Nízkodávkovaný talidomid u refrakterního a relabujícího mnohočetného myelomu
Low-dose thalidomid in refractory and relapsing multiple myeloma
Background:
Thalidomide is one of the novel agents used in the therapy of multiple myeloma. Its immunomodulatory activity and several other effects have been recently shown to be highly effective in the treatment of refractory and advanced disease. However the best way of using this drug has yet to be estimated.
Patients and methods:
We retrospectively evaluated 59 patients who were treated for multiple myeloma with Thalidomide (median dose 100 mg daily) as monotherapy or in combination with corticosteroids from 2000 to 2005. The primary goal was to compare the overall response to Thalidomide in various settings. The response to therapy was estimated according to EBMT standards.
Results:
Thalidomide was used as the second line treatment (first relapse or primary resistance to convetional chemotherapy) in 59 % of patients (35 patients), as the third line (second relapse) in 37 % of patients (22 patients). 2 patients recieved Thalidomide as the fourth line treatment. No patient recieved Thalidomide in previous therapy. In the first relapse the overall response rate (complete remissions - CR, partial remissions - PR and minimal response - MR) was reached in 64 % of patients (21 patients), 1 patient (3 %) reached CR, 12 patients PR (35 %) and 6 patients (17 %) reached MR. In the second relapse the overall response rate was 45 % with 14 % of CR (3 patients), 5 % PR (1 patient) and 23 % (5 patients) reached MR (5 patients). We observed that in the second relapse group there was higher rate of progressive disease during treatment compared to first relapse group (32 % vs. 14 %). 2 patients who recieved Thalidomide for third relapse shown either progressive disease or short stable disease with soon progression. Only 5 % of patients (3 patients) from all groups had to withdraw treatment with Thalidomide because of sevsere adverse reactions (grade III and IV neuropathy, allergic reaction, neutropenia). Follow-up of Thalidomide use was 3 - 62 months (median 10), in the 1st relapse group 3 - 60 months (median 12) and in the 2nd relapse group 3 - 57 months (median 6). No statistical differences were found in response rate and effect duration between first and second relapse group.
Conclusion:
Thalidomide is very promising agent for therapy of multiple myeloma. The higher response rate in the first relapse group also indicates, that the profit from using Thalidomide is comparable regardless the course of the disease. Lower doses of Thalidomide show similar efficiency when compared with the data from other studies using higher doses. Also less adverse reactions occur in the group of patients recieving lower doses of Thalidomide.
Key words:
thalidomide - low dose - multiple myeloma - relapsing - therapy
Authors:
J. Radocha; V. Maisnar
Authors‘ workplace:
Oddělení klinické hematologie II. interní kliniky Lékařské fakulty UK a FN, Hradec Králové, přednosta prof. MUDr. Jaroslav Malý, CSc.
Published in:
Vnitř Lék 2007; 53(2): 129-164
Category:
Original Contributions
Overview
Úvod:
Talidomid je jedním z nových léků, které jsou nově používány v terapii mnohočetného myelomu. Jeho imunomodulační aktivita a celá řada dalších účinků byla prokázána jako efektivní v léčbě pokročilého a refrakterního onemocnění. Nejvhodnější dávkovací schéma však není dosud známo a je v současnosti předmětem zkoumání řady klinických studií.
Pacienti a metody:
Retrospektivně jsme vyhodnotili výsledky léčby u 59 pacientů s mnohočetným myelomem, kteří byli na našem pracovišti léčeni talidomidem (medián dávky 100 mg) v monoterapii nebo v kombinaci s kortikosteroidy v letech 2000 až 2005. Cílem bylo stanovit procento odpovědí na léčbu u pacientů v různých fázích onemocnění. Odpověď na léčbu byla hodnocena podle standardů EBMT.
Výsledky:
Talidomid byl použit jako léčba 2. linie (1. relaps nebo primárně rezistentní onemocnění) u 59 % pacientů (35 pacientů), jako léčba 3. linie (2. relaps) u 37 % (22 pacientů). 2 pacienti dostávali talidomid jako léčbu 4. linie. Žádný z pacientů neměl talidomid jako součást předchozí léčby. V 1. relapsu dosáhl celkový počet odpovědí (CR - kompletní remise, PR - parciální remise a MR - minimální odpověď) 60 % (21 pacientů), z toho u 2 pacientů CR (6 %), u 12 nemocných PR (35 %) a dalších 6 MR (17 %). Ve 2. relapsu bylo dosaženo celkem 45 % odpovědí (10 pacientů), z toho u 3 pacientů CR (14 %), 1 pacienta PR (5 %) a 5 pacientů MR (23 %). Přestože jsme v hodnoceném souboru nemocných nezaznamenali statisticky významný rozdíl v léčebných odpovědích při použití talidomidu v 1. a ve 2. relapsu, u nemocných léčených pro 2. relaps jsme pozorovali vyšší procento progresí na léčbě (32 % vs 14 %). 2 pacienti, kteří dostávali talidomid ve 3. relapsu, uspokojivé odpovědi na léčbu nedosáhli (progrese resp. krátká stabilizace onemocnění s následnou progresí). Celkem pouze u 3 pacientů (5 %) z hodnoceného souboru bylo nutné ukončení léčby z důvodu výskytu závažných nežádoucích účinků (neuropatie, alergická reakce, leukopenie). Doba sledování užívání talidomidu v obou skupinách byla 3-62 měsíců (medián 10 měsíců), v 1. relapsu 3-60 měsíců (medián 12 měsíců) a ve 2. relapsu 3-57 měsíců (medián 6 měsíců). Nebyly pozorovány statisticky významné rozdíly mezi procentem odpovědí, ani v délce trvání účinku mezi skupinou pacientů v 1. a 2. relapsu.
Závěr:
Talidomid je v léčbě mnohočetného myelomu velmi účinným lékem. V našem sledování jsme prokázali účinnost talidomidu při jeho použití bez ohledu na pokročilost onemocnění. Námi používané nižší dávky jeví srovnatelnou účinnost s dávkami vyššími, pokud data srovnáme s výsledky jiných studií. Nespornou výhodou přitom je skutečnost, že podávání nižších dávek talidomidu vede ke snížení výskytu jeho nežádoucích účinků.
Klíčová slova:
talidomid - nízké dávky - mnohočetný myelom - léčba - relaps
Úvod
V posledních letech jsou do terapie mnohočetného myelomu zaváděny nové moderní léky. Významně se tak zvyšují naděje nemocných na dlouhý a kvalitní život. Ačkoli metodou 1. volby v léčbě mnohočetného myelomu zatím zůstává autologní transplantace a prognóza pacientů od jejího zavedení se podstatně zlepšila [1-4], stále se setkáváme s pacienty, kteří nejsou pro tento léčebný postup indikováni, a dalšími, kteří mají chorobu refrakterní ke konvenční chemoterapii. Bohužel ani autologní transplantace nevede k trvalému vyléčení a v různém odstupu od jejího provedení dochází u nemocných k progresi resp. relapsu onemocnění. Do popředí pozornosti se proto dnes dostávají především léky ze skupiny tzv. imunomodulačních látek, mezi které patří právě talidomid, a některé jeho novější obdoby, jako např. lenalidomid [5]. Další unikátní lék s velikým biologickým potenciálem, který se v poslední době výrazně prosazuje v léčbě nemocných s mnohočetným myelomem, je bortezomib působící jako inhibitor proteazomu [6].
Talidomid je používán v léčbě mnohočetného myelomu již několik let. První informace o jeho účinnosti u nemocných s mnohočetným myelomem se v odborném tisku objevily v roce 1999 [7]. Mezi jeho nejčastěji zmiňované účinky patří imunomodulační a antiangiogenní efekty [8]. Nicméně celá řada těchto účinků není doposud důkladně probádána a řada studií například zmiňované antiangiogenní účinky zpochybňuje [9]. Efekt talidomidu při jeho použití v léčbě mnohočetného myelomu je však nesporný. Celá řada prací ukazuje jeho vysokou efektivitu při léčbě refrakterního a pokročilého onemocnění, tedy v rámci léčby druhé a dalších linií [10,11], výsledky některých studií z poslední doby prokazují jeho vysokou účinnost i při použití v rámci 1. léčebné linie u nemocných staršího věku [12]. Podstatnou výhodou talidomidu je především jeho perorální forma podávání, která činí léčbu pro pacienta velmi pohodlnou, probíhající většinou v ambulantním režimu. Na druhou stranu je tento lék zatížen relativně vysokou toxicitou [13]. Zejména neurotoxicita s možným rozvojem periferní neuropatie může být komplikujícím faktorem, často vedoucím až k přerušení léčby. Mezi další obávané komplikace patří tromboembolická nemoc, riziko jejího vzniku dále zvyšuje současné podávání kortikoidů [14]. Z předchozích studií je zřejmé, že toxicita talidomidu je do značné míry závislá na celkové kumulativní dávce [15]. Z literatury vyplývá, že nejnižší účinná dávka se může pohybovat až kolem 50 mg podávaných obden [16]. I v současnosti nadále pokračují snahy o nalezení optimálního dávkovacího schématu, které by umožnilo podávat účinnou dávku léku s minimální průvodní toxicitou po co nejdelší dobu. Dosud používaná schémata využívala obvykle dávkování od 200 do 800 mg talidomidu denně v jedné večerní dávce (výhoda spojení se sedativním účinkem, pro který byl lék původně vyvinut). Naše pracoviště od začátku používá nižší dávky talidomidu, obvykle 100 mg denně v monoterapii, nebo 50-100 mg denně v rámci kombinace s kortikoidy. Důvodem tohoto dávkování byla kromě snahy o co nejnižší toxicitu částečně i špatná dostupnost talidomidu na trhu v České republice. Cílem této práce bylo zmapovat procento odpovědí na léčbu a výskytu jejích komplikací léčby při použití nižších dávek talidomidu.
Pacienti a metody
Do hodnoceného souboru jsme zařadili všechny pacienty, u kterých bylo 50-100 mg talidomidu denně použito jako monoterapie nebo v rámci kombinace s kortikoidy pro relaps resp. progresi onemocnění, a dále i nemocné refrakterní ke konvenční chemoterapii. Základní podmínkou pro jejich zařazení bylo, že nesměli být léčeni talidomidem v předchozím průběhu nemoci. Celkem jsme hodnotili výsledky léčby a výskyt nežádoucích účinků u 59 pacientů s mnohočetným myelomem ve věku od 35 do 85 let (medián 67 let), kteří byli léčeni na našem pracovišti v letech 2000 až 2005 (tab. 1).

Do hodnocení byli zařazeni jen ti nemocní, u kterých bylo možné stanovit léčebnou odpověď, tzn. doba jejich sledování nebyla kratší než 6 týdnů. Léčebná odpověď byla vyhodnocena podle standardů EBMT (European Bone Marrow Transplant) a případné nežádoucí účinky dle WHO klasifikace [17]. Zjednodušená verze kritérií pro odpověď na léčbu běžného sekrečního mnohočetného myelomu je uvedena v tab. 2. Pro netypické formy myelomu se kritéria mohou lišit v závislosti na jejich typu.

Pacienti byli rozděleni do celkem 3 skupin podle toho, ve které linii léčby byl talidomid použit. Do skupiny nemocných léčených talidomidem v rámci 2. linie byli zařazeni i pacienti s primárně rezistentní nemocí při použití konvenční chemoterapie. Podávání talidomidu bylo ukončeno při výskytu nežádoucích účinků stupně 3 nebo 4 dle WHO klasifikace.
Ke srovnání procenta odpovědí a délky trvání odpovědi byl použit Fisherův test. Ke srovnání délky trvání odpovědi byla použita metoda dle Kaplan-Meiera.
Výsledky
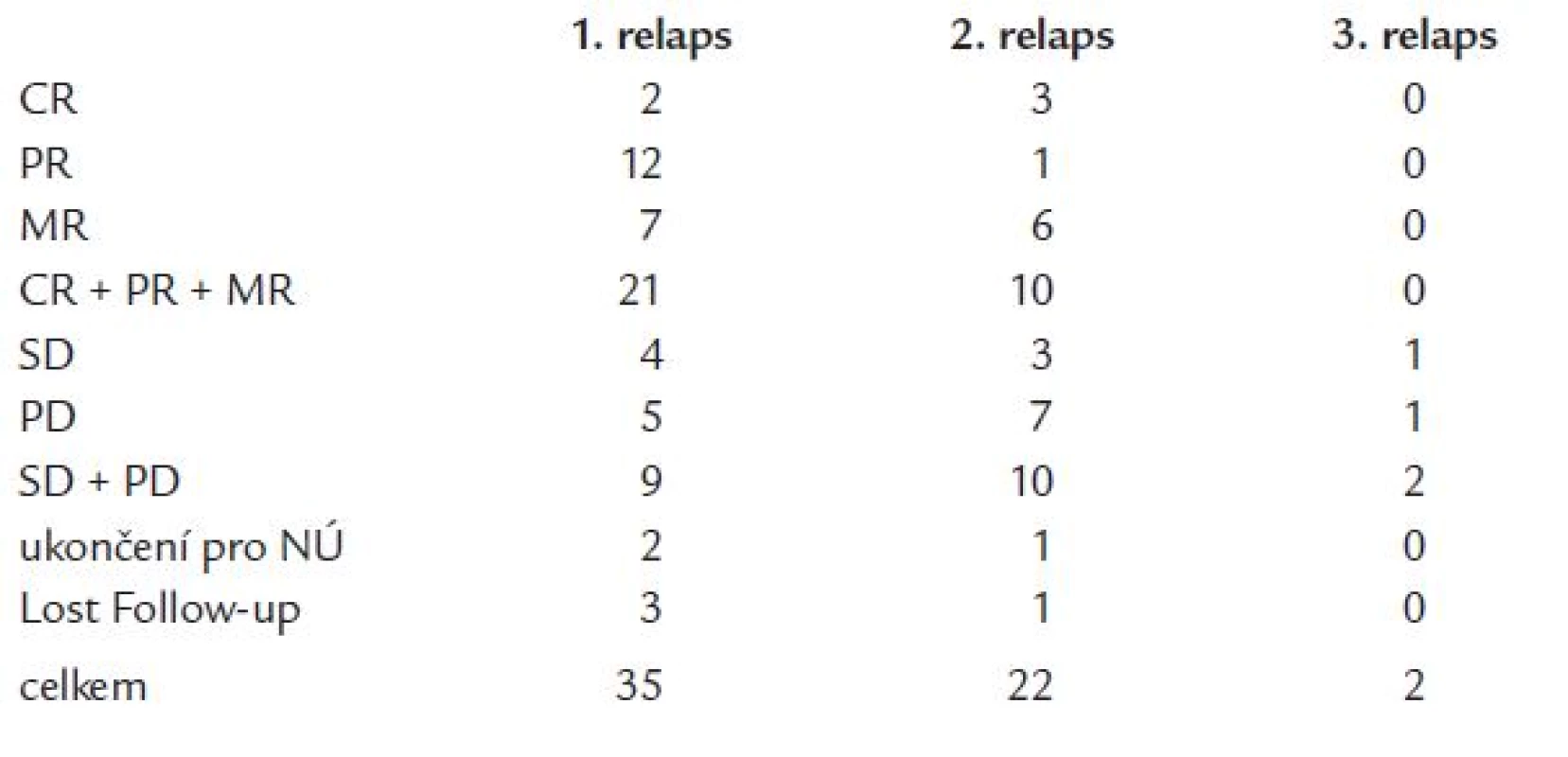
V rámci námi hodnoceného souboru 59 nemocných s MM byl talidomid použit jako léčba 2. linie (1. relaps nebo primárně rezistentní onemocnění) u 35 pacientů (59 %), jako léčba 3. linie (2. relaps) u 20 pacientů (37 %) (tab. 1). Dva pacienti dostávali talidomid jako léčbu 4. linie. V 1. relapsu dosáhla celková odpověď na léčbu 60 % (CR + PR + MR) (CR - kompletní remise, PR - parciální remise a MR - minimální odpověď), z čehož 2 pacienti dosáhli CR (6 %), 12 pacientů PR (35 %) a 6 pacientů MR (17 %). Ve 2. relapsu bylo dosaženo již pouze 45 % odpovědí (10 pacientů), 3 pacienti byli v CR (14 %), 1 pacient v PR (5 %) a 5 pacientů dosáhlo MR (23 %). Pozorovali jsme vyšší procento progresí při léčbě u skupiny nemocných ve 2. relapsu (32 % vs 14 % progresí u nemocných léčených v rámci 2. linie). 2 pacienti, kteří dostávali talidomid ve 3. relapsu, uspokojivé odpovědi na léčbu nedosáhli (progrese resp. krátká stabilizace onemocnění s následnou progresí). Celkem 3 pacienti ze sledovaného souboru (5 %) museli ukončit léčbu kvůli výskytu závažných nežádoucích účinků stupně 3 nebo 4 dle WHO klasifikace (1krát neuropatie, 1krát toxoalergická reakce, 1krát dlouhodobá leukopenie) (tab. 3 a graf 1). Délka podávání talidomidu v celém sledovaném souboru nemocných se pohybovala v rozmezí 3 až 62 měsíců (medián 10 měsíců). Ve skupině nemocných léčených talidomidem v rámci 2. linie léčby se doba trvání léčebné odpovědi pohybovala v rozmezí od 3 do 60 měsíců (medián 12 měsíců), u nemocných léčených v rámci 3. linie pak od 3 do 57 měsíců (medián 6 měsíců). V tomto souboru nemocných jsme nezaznamenali statisticky významný rozdíl v léčebných odpovědích při použití talidomidu v rámci 2. a 3. léčebné linie, a to jak při posouzení počtu dosažených léčebných odpovědí (p = 0,23), tak ani v délce jejich trvání (p = 0,64) (graf 2).


Diskuse a závěry
Místo talidomidu v terapii myelomu není zatím jasně definováno. V tomto roce byly uveřejněny dvě důležité studie, které hledaly odpověď na tuto otázku. Barlogie et al [18] uveřejnili studii na 668 pacientech, kteří byli randomizováni do 2 ramen studie. Pacienti v 1. rameni dostávali talidomid spolu se standardním režimem a následně podstoupili autologní transplantaci kostní dřeně, pacienti ve 2. rameni talidomidem léčeni nebyli. Ze studie vyplynul fakt, že talidomid nedokázal prodloužit celkovou dobu přežití pacientů a dokonce, že doba od relapsu do úmrtí ve skupině s talidomidem byla výrazně kratší než ve 2. skupině. Tyto výsledky znamenají, že talidomid zřejmě nebude do budoucna využit v rámci primoterapie mladších nemocných směřujících k vysokodávkové léčbě. Tento fakt podporuje i další nedávno publikovaná studie, ve které Attal et al [19] použili talidomid jako udržovací léčbu. Do studie bylo zařazeno celkem 597 pacientů rozdělených do 3 léčebných ramen, kde jedni dostali talidomid s pamidronátem, 2. rameno pouze pamidronát a 3. rameno žádnou udržovací léčbu. Udržovací rameno s talidomidem vyšlo z tohoto srovnání jednoznačně lépe, a to v obou hlavních sledovaných parametrech (doba do relapsu a výskyt nových kostních ložisek). Studie měla velmi zajímavé i vedlejší výsledky sledování. Například přítomnost delece chromozomu 13 byla spjata s významně nižší účinností talidomidu. Stejně tak i dobré výsledky primoléčby (dosažení alespoň VGPR) byly spjaty s horším výsledkem při podávání talidomidu. Na základě závěrů této studie lze tedy předpokládat, že udržovací léčba talidomidem bude vhodná zejména u pacientů bez přítomnosti delece 13. chromozomu a zároveň pro ty nemocné, kteří po iniciální léčbě nedosáhli VGPR a lepší léčebné odpovědi.
Naše výsledky podporují hypotézu, že nižší dávky talidomidu mají účinnost srovnatelnou s jinými schématy využívajícími vyšších dávek tohoto léku (tab. 4). Zároveň je dávka 100 mg denně provázena významně nižší toxicitou ve srovnání s dávkami 400 či dokonce 800 mg denně. Proto by i tento fakt sám o sobě mohl přispět k celkově delšímu přežívání nemocných nebo alespoň ke zlepšení jejich kvality života, neboť obecně se zatím talidomid podává tak dlouho, jak je tolerován, či do relapsu/progrese nemoci. Zajímavé je zjištění, že léčebný účinek dosažený u nemocných, u nichž byl talidomid podáván v rámci 2. resp. 3. léčebné linie, se statisticky významně nelišil. Opakovaně jsme využili výborného efektu talidomidu i u nemocných, kteří byli rezistentní na úvodní klasickou chemoterapii. Jen díky talidomidu někteří žijí dnes již několik let s velmi dobrou kvalitou života. Nelze opomenout ani poměrně nízké náklady na léčbu, která při dobré toleranci může probíhat zcela v ambulantním režimu.
![Přehled dosud publikovaných studií a procenta odpovědí na léčbu [7,16,20–25].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/ff484f46dcddc1e411fe49cdbec63391.jpg)
Stále však zůstává řada otázek stran nejvhodnějšího použití nových léků u mnohočetného myelomu nezodpovězených. Do budoucna se můžeme dočkat diferenciace nemocných s mnohočetným myelomem do různých skupin, které budou léčeny rozdílnou jak úvodní, tak i udržovací léčbou. Talidomid se zatím zdá být vhodným lékem pro progresi/relaps onemocnění ev. pro dlouhodobou udržovací léčbu nemocných, kteří nedosáhnou po úvodní léčbě minimálně VGPR, zatímco potenciál bortezomibu bude naopak díky bleskovému nástupu jeho účinku a relativně nízké toxicitě do budoucna pravděpodobně využit zejména v rámci iniciální léčby. Ve fázi klinického testování se nachází další nové léky jako např. derivát talidomidu lenalidomid, od kterého se očekává nižší toxicita a zároveň srovnatelná účinnost. Zda budou tato očekávání naplněna, se prozatím neví. S velkou nedočkavostí je očekáván příchod monoklonálních protilátek do léčby mnohočetného myelomu, na jejichž použití jsme si tak rychle zvykli v léčbě lymfomů. Do fáze klinického výzkumu již vstoupila protilátka proti interleukinu-6, připravuje se protilátka proti jeho receptoru, a nezbývá než doufat, že výsledkem bude další zlepšení výsledků léčby tohoto zatím nevyléčitelného onemocnění.
Nadějné léčebné výsledky při použití talidomidu u nemocných s MM, které jsme ověřili na našem souboru nemocných, poněkud komplikuje zatím špatná dostupnost léku na našem trhu. Jeho použití je v době vzniku tohoto článku vázáno přísnými pravidly pro preskripci, do června roku 2006 byl dostupný pouze v rámci specifického léčebného programu, nyní nově v rámci mimořádného dovozu po schválení revizním lékařem. Přitom je jeho použití součástí standardních léčebných doporučení připravených Českou myelomovou skupinou a schválených Českou hematologickou společností JEP.
Podpořeno výzkumným záměrem MZO 00179906.
Poděkování patří Mgr. V Bláhovi za vynikající pomoc při zpracování statistiky.
MUDr. Jakub Radocha
www.fnhk.cz
e-mail: jakub.radocha@centrum.cz
Doručeno do redakce: 12. 10. 2006
Přijato po recenzi: 13. 11. 2006
Sources
1. Barlogie B, Tricot GJ, van Rhee F et al. Long-term outcome results of the first tandem autotransplant trial for multiple myeloma. Br J Haematol 2006; 135 : 158-164.
2. Attal M, Harousseau JL, Stoppa AM et al. A prospective, randomized trial of autologous bone marrow transplantation and chemotherapy in multiple myeloma. N Engl J Med 1996; 335 : 91-97.
3. Krejčí M, Adam Z, Mayer J et al. Autologní transplantace periferních kmenových buněk v terapii relapsu mnohočetného myelomu Vnitř Lék 1998; 44 : 698-701.
4. Ráčil Z, Adam Z, Hájek R et al. Vysokodávkovaná chemoterapie s podporou autologních hemopoetických buněk v terapii mnohočetného myelomu - přehled současných možností. Vnitř Lék 2001; 47 : 92-98.
5. Richardson PG, Blood E, Mitsiades CS et al. A randomized phase 2 study of lenalidomide therapy for patients with relapsed or relapsed and refractory multiple myeloma. Blood 2006; 18: in print
6. San-Miguel J, Blade J. Perspective on the current use of bortezomib in multiple myeloma. Haematologica 2006; 91 : 871-872.
7. Singhal S, Mehta J, Desikan R et al. Antitumor activity of thalidomide in refractory multiple myeloma. N Engl J Med 1999; 341 : 1565-1571.
8. Hájek R, Maisnar V, Krejčí M. Thalidomid. Klin Farm 2005; 19 : 43-46.
9. Strupp C, Germing U, Scherer A et al. Thalidomide for the treatment of idiopathic myelofibrosis. Eur J Haematol 2004; 72 : 52-57.
10. Palumbo A, Falco P, Ambrosini MT et al. Thalidomide plus dexamethasone is an effective salvage regimen for myeloma patients relapsing after autologous transplant. Eur J Haematol 2005; 75 : 391-395.
11. Neuwirtová R, Špička L, Karban J et al. Naše zkušenosti s léčbou myelomu thalidomidem. Transfuze dnes 2002; 8 : 13-19.
12. Palumbo A, Bringhen S, Caravita T et al. Oral melphalan and prednisone chemotherapy plus thalidomide compared with melphalan and prednisone alone in elderly patients with multiple myeloma: randomised controlled trial. Lancet 2006; 367 : 825-831.
13. Foldyna D, Kamelander J, Krejčí M et al. Žádoucí a nežádoucí účinky thalidomidu u pacientů s mnohočetným myelomem. Vnitř Lék 2003; 49 : 859-868.
14. Grover JK, Uppal G, Raina V. The adverse effects of thalidomide in relapsed and refractory patients of multiple myeloma. Ann Oncol 2002; 13 : 1636-1640.
15. Palumbo A, Rus C, Zeldis JB et al. Enoxaparin or aspirin for the prevention of recurrent thromboembolism in newly diagnosed myeloma patients treated with melphalan and prednisone plus thalidomide or lenalidomide. J Thromb Haemost 2006; 4 : 1842-1845.
16. Durie BGM, Stepan DE. Low Dose Thalidomide Alone and in Combination: Long Term Follow-Up. Blood 2001; 98(Suppl 1): 163a.
17. Blade J, Samson D, Reece D et al. Criteria for evaluating disease response and progression in patients with multiple myeloma treated by high-dose therapy and haemopoietic stem cell transplantation. Myeloma Subcommittee of the EBMT. Br J Haematol 1998; 102 : 1115-1123.
18. Barlogie B, Tricot G, Anaissie E et al. Thalidomide and hematopoietic-cell transplantation for multiple myeloma. N Engl J Med 2006; 354 : 1021-1030.
19. Attal M, Harousseau JL, Leyvraz S et al. Maintenance therapy with thalidomide improves survival in multiple myeloma patients. Blood 2006; 108 : 3289-3294.
20. Barlogie B, Desikan R, Eddlemon P et al. Extended survival in advanced and refractory multiple myeloma after single-agent thalidomide: identification of prognostic factors in a phase 2 study of 169 patients. Blood 2001; 98 : 492-494.
21. Juliusson G, Celsing F, Turesson I et al. Frequent good partial remissions from thalidomide including best response ever in patients with advanced refractory and relapsed myeloma. Br J Haematol 2000; 109 : 89-96.
22. Rajkumar SV, Dispenzieri A, Fonseca R et al. Thalidomide for previously untreated indolent or smoldering multiple myeloma. Leukemia 2001; 15 : 1271-1276.
23. Oakervee HE, Gupta V, Smith ML et al. Response to thalidomide can be predicted by paraprotein quantitation 14 days after initiating therapy. Br J Haematol 2001; 113(Suppl 1): 40.
24. Grosbois B, Bellissant E, Moreau P et al. Thalidomide (Thal) in the Treatment of Advanced Multiple Myeloma (MM). A Prospective Study of 120 Patients. Blood 2001; 98(Suppl 1): 163a.
25. Weber DM, Rankin K, Delasalle K et al. Thalidomide Alone and in Combination for Previously Untreated Myeloma. VIIIth International Myeloma Workshop, Banff, Alberta, Canada 2001.
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Internal Medicine

2007 Issue 2
-
All articles in this issue
- Paradoxní embolizace při foramen ovale patens u potápěčů: možnosti screeningu
- Klinicky manifestní gastrointestinální krvácení u koronarografovaných nemocných
- Dlouhodobá účinnost chirurgické kryoablace chronické fibrilace síní provedené při operaci pro závažnou mitrální regurgitaci
- Dysfunkce transjugulární intrahepatální portosystémové spojky (TIPS) a její řešení
- Enkapsulující peritoneální skleróza
- Teplota nejasné etiologie: příčiny a diagnostický postup
- Doporučení pro diagnostiku a léčbu dyslipidemií v dospělosti, vypracované výborem České společnosti pro aterosklerózu
- Reziduální echokardiografické nálezy a NT-proBNP u asymptomatických dospělých pacientů po radikální korekci Fallotovy tetralogie
- Vliv sekundárního zavedení ePTFE potahovaného stentu na udržení průchodnosti TIPS
- Nízkodávkovaný talidomid u refrakterního a relabujícího mnohočetného myelomu
- Pankreatikopleurální píštěle
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue
- Teplota nejasné etiologie: příčiny a diagnostický postup
- Doporučení pro diagnostiku a léčbu dyslipidemií v dospělosti, vypracované výborem České společnosti pro aterosklerózu
- Enkapsulující peritoneální skleróza
- Dlouhodobá účinnost chirurgické kryoablace chronické fibrilace síní provedené při operaci pro závažnou mitrální regurgitaci
