Genetika dyslipidemií včera, dnes a zítra
Genetics of dyslipidemia – yesterday, today, and tomorrow
The great majority of plasmatic lipid and lipoprotein metabolism disorders are genetically determined diseases (primary dyslipidemias). Only a minority of prevailingly severe dyslipidemias is monogenic, and a greater part of them is inherited as a polygenic trait. Analyses of the genetic background of dyslipidemia are made difficult by the complexity of lipoprotein metabolism and also by gene-gene, gene-gender and gene-environment interactions. Association studies, animal models, whole genome scans and gene expression analyses are used in the study of the genetic background of primary dyslipidemias. There are several genetically well characterized dyslipidemias (e.g. familiar hypercholesterolemia, sitosterolemia), but in most of the disorders the exact genetic cause remains unknown. The knowledge of the gene variants responsible for a particular phenotype will be essential for correct diagnosing and treatment, as well as for further development of gene therapy which brings hope for patients with severe homozygous forms of monogenic dyslipidemias.
Key words:
dyslipidemia – polymorphism – mutation – gene therapy – cardiovascular disease
Authors:
J. A. Hubáček 1; M. Vráblík 2
Authors‘ workplace:
Pracoviště experimentální medicíny, Laboratoř molekulární genetiky IKEM Praha, vedoucí doc. MUDr. Luděk Červenka, CSc.
1; III. interní klinika 1. lékařské fakulty UK a VFN Praha, přednosta prof. MUDr. Štěpán Svačina, DrSc., MBA
2
Published in:
Vnitř Lék 2007; 53(4): 371-376
Category:
Reviews
Overview
Poruchy metabolizmu plazmatických lipidů a lipoproteinů jsou ve velké většině geneticky podmíněná onemocnění (primární dyslipidemie). Menší část většinou závažných dyslipidemií je monogenní, většinou se však jedná o polygenně determinované odchylky. Analýza genetického základu dyslipidemie je ztížená komplexností metabolické přeměny lipoproteinů a interakcemi gen-gen, gen-pohlaví a gen-prostředí. Při zjišťování genetické podstaty dyslipidemie se uplatňují asociační studie, zvířecí modely, metodika celogenomových scanů i sledování genové exprese. Existuje řada geneticky prozkoumaných dyslipidemií (familiární hypercholesterolemie, sitosterolemie), ale u většiny dyslipidemií přesný a kompletní genetický základ zatím znám není. Znalost genových variant zodpovědných za sledovaný fenotyp bude v budoucnu nezbytná pro správnou diagnózu, léčbu, ale i rozvoj genové terapie, která je nadějí pro nemocné z těžkými homozygotními formami monogenních dyslipidemií.
Klíčová slova:
dyslipidemie - polymorfizmus - mutace - genová léčba - kardiovaskulární onemocnění
Úvod
První asociační studie analyzující vztah mezi genetickou variantou a lipidovými parametry se objevily před více než 20 lety. Po počátečním nadšení, kdy se očekávalo, že genetika vyřeší řadu do té doby neobjasněných otázek, se v současné době nacházíme ve stadiu, kdy naopak je velká většina genetických studií přijímána s nedůvěrou a komentářem „že z toho nakonec stejně nic nebude“ a na publikování genetických studií ve vysoce impaktovaných časopisech jsou často kladeny mnohem vyšší nároky (počty analyzovaných jedinců, nutnost konfirmačních studií) než na studie klinické.
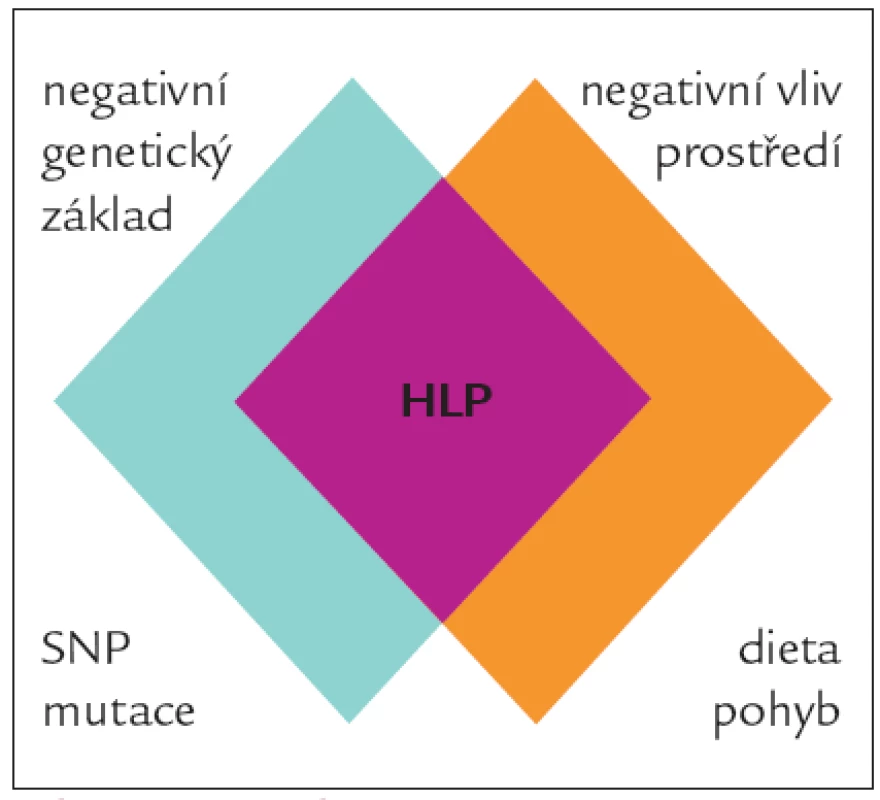
Primární dyslipidemie jsou geneticky podmíněná onemocnění metabolizmu plazmatických lipidů a lipoproteinů, která se projevují abnormálním počtem či složením lipoproteinových částic v cirkulaci. Lze je rozdělit na monogenní způsobené defektem jednoho genu (např. familiární hypercholesterolemie - geny pro LDL-receptor, apolipoprotein B a PCSK9, sitosterolemie - geny pro ABCG5 a ABCG8 transportéry) a polygenní (např. familiární kombinovaná hyperlipidemie, dysbetalipoproteinemie), v jejichž patogenezi se uplatňuje současné působení variant více genů (např. geny pro apolipoproteiny A1, A5, C3, E, LDL-receptor, CYP7A1 a další) [1]. Ve všech případech ovlivňuje vznik dyslipidemie zevní prostředí a předpokládá se, že podíl genetické predispozice na vzniku poruchy metabolizmu krevních lipidů je okolo 50 %. Tento podíl bude pochopitelně vyšší u mladších osob a nižší u starších osob (u nichž se může negativně projevit delší expozice negativním vnějším faktorům) s polygenně děděnou dyslipidemií. U osob s monogenně podmíněnými poruchami může genetický podíl onemocnění být až 100 % [2]. Kromě faktorů zevních (mezi které zařazujeme především dietní zvyklosti, pohybový režim, kuřácký statut atd) k manifestaci dyslipidemie přispívá interakce mezi různými geny, interakce mezi geny a pohlavím a nakonec i interakce mezi geny a vnějším prostředím, které znesnadňují zjištění přesné příčiny poruchy lipidového metabolizmu [3].
Existuje několik desítek genů, jejichž varianty jsou spojeny s různými odchylkami lipidového metabolizmu. V řadě případů se jedná o varianty, jejichž vztah k lipidovým parametrům byl mnohokrát potvrzen (např. vztah alel genu pro apolipoprotein E k celkovému a LDL-cholesterolu či vztah varianty v regulační části genu pro hepatickou lipázu k HDL-cholesterolu), v jiných případech se jedná o nálezy jedinečné (např. vztah repetitivního polymorfizmu v genu pro HMGCoA-reduktázu k celkovému cholesterolu), u kterých však není vždy jasné, zda vztah nikdo další neanalyzoval, nebo zda negativní výsledky byly sice získány, ale nebyly nikde publikovány. Důvodem může být i fakt, že publikace negativních výsledků v oblasti asociačních genetických studií je v naprosté většině časopisů velice obtížná a autoři po několika zamítavých odpovědích výsledky buď nepublikují vůbec, nebo v časopisech neindexovaných ve veřejných databázích, a výsledky tak zůstanou relativně utajeny.
S ohledem na komplexní vztahy genetické informace a výsledného fenotypového projevu je posouzení příčinné souvislosti určité genetické varianty a dyslipidemie obtížné.
Asociační studie
Nejvhodnějším přístupem ke studiu dědičné podstaty dyslipidemie jsou asociační studie. Cílem asociačních studií je posoudit výskyt sledovaného genetického znaku u nemocných s určitou chorobou a porovnat je s frekvencemi zjištěnými ve zdravé populaci, nebo zjistit, zda jedinci s určitým genetickým markerem nemají nějakou odchylku v lipidovém metabolizmu, např. zvýšený celkový cholesterol, nadprodukci triglyceridů apod. Důležité jsou dostatečné počty nemocných i kontrol a jejich správná charakteristika (síla studií je snížena faktem, že někteří asymptomatičtí jedinci z kontrolní skupiny mohou dané onemocnění vyvinout později) [4].
Asociační studie obvykle pracují s tzv. kandidátními geny, což jsou geny přímo kódující proteiny, které se uplatňují v metabolizmu sérových lipidů a lipoproteinů. V případě dyslipidemií se mezi kandidátní geny nejčastěji zařazují geny pro receptory, apolipoproteiny a enzymy (v přehledu jsou nejdůležitější kandidátní geny uvedeny v tab. 1). U polygenních onemocnění, jakými většina dyslipidemií je, je třeba si uvědomit, že stejný fenotypový obraz může způsobit různá konstelace genetických variant, a naopak u různě postižených lze nalézt stejný genetický základ, který je modifikován odlišným vnějším prostředím. Toto je základní limitací reprodukovatelnosti asociačních studií, která se projeví zejména v nejběžnějším retrospektivním uspořádání. Tato limitace se často mylně vysvětluje jako „falešně negativní výsledek“. V řadě případů ale stojí za obtížnou reprodukovatelností zcela jiné důvody (viz dále).
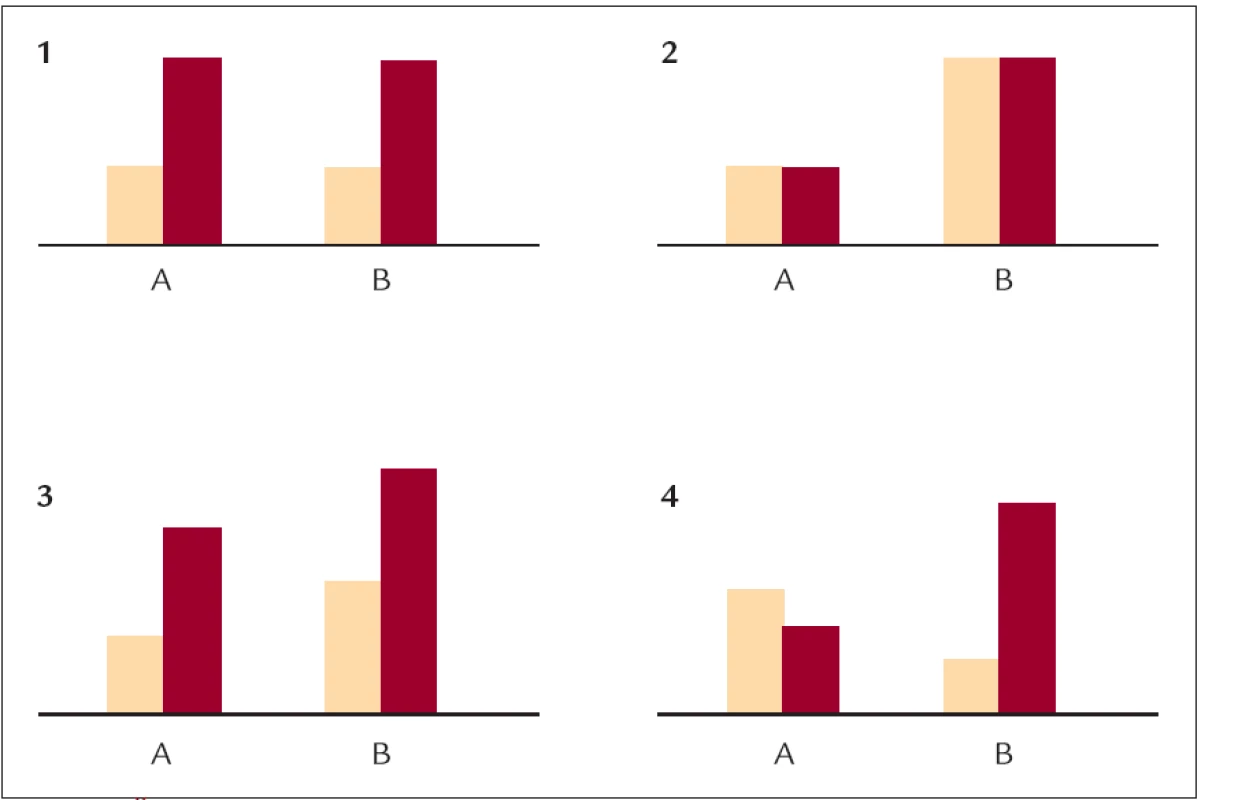
První publikace asociačních studií týkající se genetické determinace lipidemie analyzovaly na relativně nepočetných skupinách jednotlivé varianty kandidátních genů. Nicméně, hladina lipidů je určena multifaktoriálně a je výsledkem predispozic genetických (desítek až stovek variant v desítkách genů) a vlivů vnějšího prostředí (především složením diety, pohybovou aktivitou a kouření). PJ Talmud ve svém excelentním přehledu shrnula 4 základní, modelové možnosti vzájemného působení genů a prostředí (obr. 1) [5]. V jednodušších (ne příliš častých) případech můžeme pozorovat izolovaně buď vliv vnějšího prostředí, anebo vliv genetické varianty. Na hladiny lipidů má tak vnější prostředí vliv identický u různých jedinců bez ohledu na přítomné genetické varianty, či naopak, genetická varianta může mít stejný efekt bez ohledu na vnější prostředí. Další možností je, že se projeví vlivy vnějšího prostředí i genetických variant. V tomto případě nemusí docházet k interakcím - přítomnost jedné alely je spojena s nižší hladinou lipidů než přítomnost druhé alely, při zvýšeném příjmu tuků vzroste hladina lipidů o stejné absolutní číslo. Patrně nejčastějším případem je situace, v níž spolu geny a vnější prostředí interagují. Nositelé jedné alely tak např. reagují na změnu diety podstatně výrazněji než nositelé alely druhé. Interakce pak mohou být (vztaženo k velikostem změn) aditivní nebo multiplikační. Vysoká hladina lipidů se u jedince projeví tehdy, když je negativní genetická predispozice doprovázena nevýhodným složením diety/nedostatkem pohybu (obr. 2). Samotná jedna, nebo druhá podmínka je dostačující pouze v extrémních případech.
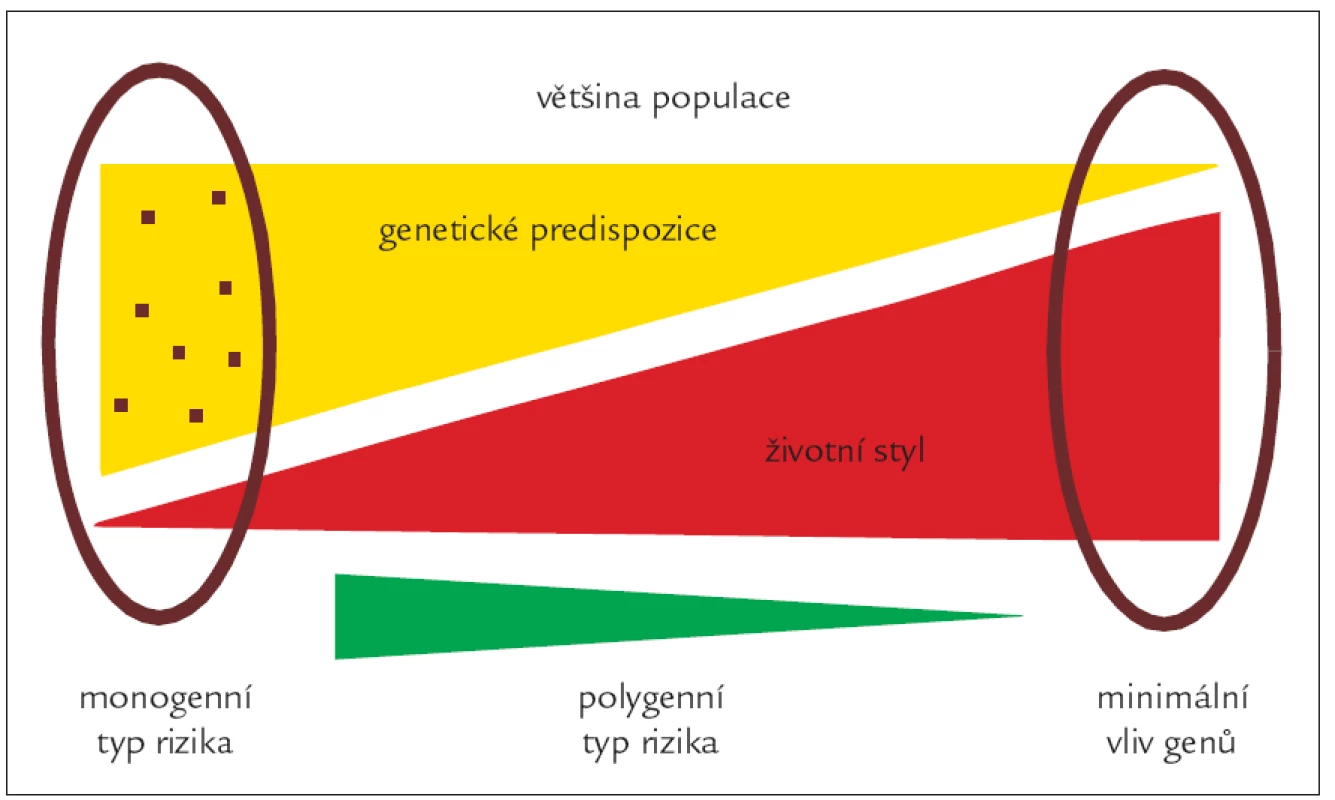
Vztahy mezi genetickými variantami a vnějším prostředím si lze představit i velice zjednodušeně, jak je schematicky znázorněno na obr. 3. V populaci bude určité množství jedinců, kteří jsou geneticky (často monogenní fatální poruchou) predisponováni k velmi vysokým hladinám plazmatických lipidů. Pochopitelně budou v populaci existovat i opačné extrémy, tedy geneticky podmíněné velmi nízké hladiny cholesterolu a triglyceridů. U obou těchto extrémů je genetická dispozice tak silná, že je víceméně jedno, jakou dietu budou tito jedinci konzumovat. V případě silné genetické dispozice k vysokým hladinám plazmatických lipidů bude nezbytná farmakologická intervence. Většina lidí se pohybuje někde mezi těmito extrémy. Jejich genetická informace je predisponuje k vyšší či nižší hladině plazmatických lipidů a oni sami mohou tuto hladinu do jisté míry (která je u každého individuální) ovlivňovat. Podle toho, zda se geny účastní spíše celkového nastavení našeho metabolizmu či jeho schopnosti vyrovnat se s působením vnějších faktorů, můžeme geny dle jejich funkce rozdělit do dvou základních skupin, na „levels“ geny a „variability“ geny (obr. 4) [6].
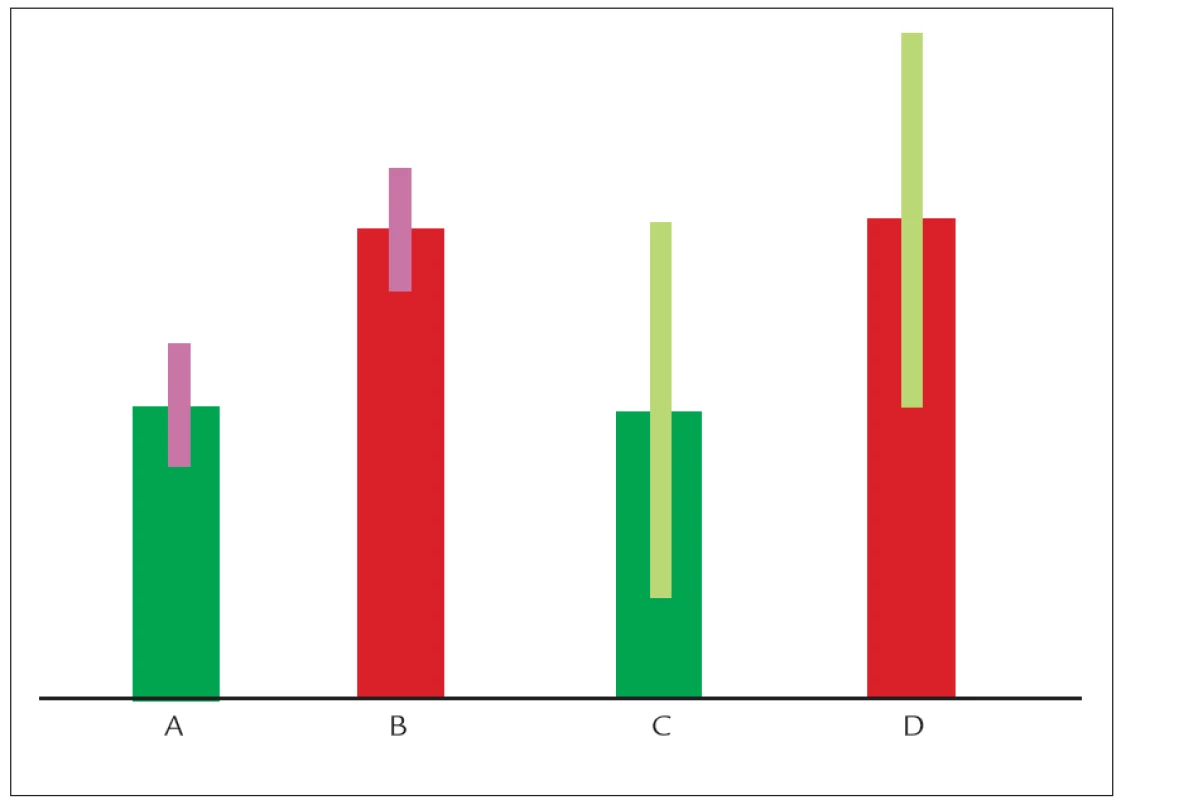
Charakterizovat jednotlivé geny jako „levels“ či „variability“ a detekovat kdy a za jakých vnějších (a v součinnosti s jakou další genetickou variantou stejného či jiného genu) podmínek sledovaná genetická varianta ovlivní hladiny plazmatických lipidů, je v současnosti patrně ta nejsprávnější cesta, kterou by se genetický aplikovaný výzkum měl ubírat. S tím musí jít ruku v ruce i správné použití statistických analýz. Řada asociačních studií jednotlivé analýzy koriguje, adjustuje na nějaký faktor (nejčastěji věk, tělesnou hmotnost, kouření atd). Tato korekce však může být zavádějící. Pokud se např. v analyzované populaci vliv některé alely objeví jen u kuřáků či jen u diabetiků, adjustací na tyto faktory se vztah nemusí vůbec nalézt. Vhodnější cestou k detekci genetické asociace je analyzovat vztahy v jednotlivých kategoriích (ať už třeba věkových či v podskupinách s různým BMI).
S otázkou gen-gen a gen-prostředí interakcí úzce souvisí i otázka tzv. falešně pozitivních výsledků. Fakt, že výsledky získané ve studii jedné nejsou potvrzeny ve studii následující, mohou jednoduše odrážet skutečnost, že protokoly studií nejsou (a ani nemohou) být identické, protože:
- vliv genu může být etnicky či pohlavně specifický
- genetické pozadí analyzovaných skupin bude odlišné i v případě stejného etnika
- ve studii nejsou věkově srovnatelní jedinci
- v populaci je jiné složení konzumované diety
- v populaci je jiná úroveň fyzické aktivity
- v populaci je jiná frekvence kuřáků atd
V řadě případů se tedy nemusí jednat o nereprodukovatelné výsledky získané chybnou analýzou či chybným protokolem, ale rozdíly mohou jednoduše odrážet neanalyzované odlišnosti sledovaných populací [7]. Je zajímavé, že se minimálně zmiňuje nebezpečí falešně negativních výsledků, které by, čistě statisticky vzato, mělo být stejně vysoké.
Analýza genetických predispozic k vysokým hladinám lipidů může v budoucnu získávat na významu z několika důvodů. Především, v populaci se pomalu, ale jistě snižuje rizikové chování obyvatelstva - zlepšuje se skladba konzumované stravy, alespoň v některých skupinách se zvyšuje fyzická aktivita. Následkem toho může vzrůstat důležitost genetických dispozic. Dále, analyzovat genetické varianty je v současnosti velice jednoduché a relativně levné, vnitřní i vnější kontrola správnosti výsledků je snadná, výsledek se omezuje na „varianta přítomna je“ versus „varianta přítomna není“. Výsledky biologických analýz je nutné v určitých časových intervalech opakovat, naproti tomu výsledek genetického vyšetření je platný po celý život. Je nepochybné, že vysoké hladiny lipidů zjištěné v nízkém a středním věku je nutné snížit. Do jaké míry je to však nutné u seniorů, u nichž se zvyšující se hladinou celkového cholesterolu dramaticky klesá riziko úmrtí na infekční onemocnění, nevíme.
Informace o rizikových faktorech vnějšího prostředí jsou často získávány pomocí nestandardizovaných dotazníků a informace získané od dotazovaného nelze validně ověřit, což s sebou přináší značné riziko chyb. Počet vykouřených cigaret, množství spotřebovaného tuku či jednotky zkonzumovaného alkoholu jsou nejčastěji podhodnocovanými údaji. Nadhodnocována bývá často naopak fyzická aktivita. Bohužel pro tato nutná data nemáme vhodné markery, které bychom mohli standardně a jednoduše laboratorně analyzovat.
Analýza genové exprese
Varianta genu se může fenotypově projevit pouze tehdy, jestli je gen přepsán do mRNA a dále do proteinu. Analýza množství mRNA je tak často diskutovanou otázkou na odborných fórech. Úloha těchto analýz je nepochybná v experimentálních modelech. V humánním výzkumu či klinické praxi však patrně tato stránka genetiky nebude nikdy příliš rozšířena. Obtížné je v první řadě získání vhodného vzorku - pro analýzu exprese většiny genů, které hrají roli v lipidovém metabolizmu, by byla nutná jaterní biopsie. Vlastní zpracování je (v porovnání s klasickou biochemickou a genetickou analýzou) relativně složité a finančně náročné. Získané množství materiálu by nestačilo pro rozsáhlé analýzy a hlavně zcela chybí informace o referenčních hodnotách, které bude velice obtížné získat. V porovnání s biochemickými parametry mohou hladiny mRNA kolísat podstatně více a v mnohem kratším časovém rozpětí. Analyzovat míru exprese některých genů by patrně mohlo být v budoucnu vhodné a možné u určitých monogenních poruch, ku nichž by tato informace mohla pomoci vybrat správnou léčbu, ale aplikace v populačním měřítku se v dohledné budoucnosti nezdá reálná.
Epigenetika a genový imprinting
Epigenetika a genový imprinting představují jev, který s velkou pravděpodobností nebude mít na metabolizmus lipidů výrazný vliv. Protože jeho případnou důležitost nelze v současné době zcela vyloučit, alespoň okrajově se o něm zmíníme.
DNA je v jádře uložena spolu s histony, a jak DNA, tak histony jsou částečně reverzibilně modifikovány, DNA metylací a histony acetylací. Míra acetylace či metylace pomáhá regulovat genovou expresi, v extrémním případě dokonce tak, že se výlučně exprimuje pouze alela získaná od jednoho z rodičů, zatímco druhá je zcela potlačena a nefunkční. V takovém případě dochází k tvorbě proteinu pouze z genu získaného buď od otce nebo od matky a de facto dochází k odchylkám od mendelovské dědičnosti. Při studiu genetického základu metabolické přeměny plazmatických lipidů nebyly zatím tyto fenomény popsány.
Genová terapie
Monogenní poruchy mající za následek extrémní případy hyperlipidemií (např. homozygoti FH) jsou běžným způsobem velice obtížně léčitelné. Genetická manipulace takto postižených jedinců tak může být jedinou opravdu účinnou možností léčby. Principiálně se jedná o přenos kompletního funkčního genu pomocí vhodného vektoru do postiženého organizmu. Přenesený gen navodí expresi funkčního proteinu, jehož aktivita znormalizuje lipidový metabolizmus [8]. Vektorem jsou většinou upravené rekombinantní virové částice, které nejen gen přenášejí, ale zajistí jeho inkorporaci do genomu nového hostitele. Hlavními problémy genové terapie v případě KVO jsou především účinnost přenosu genu, jeho relativně nízká aktivita a krátká doba jeho funkčnosti v novém organizmu. Zcela vyřešena není ani otázka nebezpečných vedlejších účinků, cytotoxicita a potenciální kancerogeneze indukovaná přenosovým virem. Genová terapie je tak v současné době především otázkou experimentální.
Celogenomové scany
Se znalostí struktury lidského genomu a s dostupností moderních a rychlých postupů molekulární biologie začaly být používány i metodiky, které umožňují identifikaci úseků DNA nepatřící mezi známé kandidátní geny (které odvozujeme ze znalosti patologií prozkoumaných biochemických drah), a přesto mohou rozhodujícím způsobem ovlivnit výsledný fenotypový obraz [9]. Takové změny mohou být umístěny např. v genech kódujících regulační proteiny ovlivňující transkripci či translaci řady genů, a tím lze vysvětlit jejich dramatický efekt na fenotyp (např. hladiny sérových lipidů), ačkoli nedochází ke změně aminokyselinového složení žádného předpokládaného kauzálního proteinu. Zjištění úseků DNA zodpovědných za manifestaci onemocnění se provádí nejsnáze pomocí sledování přenosu specifických genetických markerů (např. opakující se repetitivní sekvence) s následnou detekcí takového markeru u postižených v rozsáhlých rodokmenech obsahujících informace od nemocných i zdravých členů rodiny.
Relativní nevýhodou tohoto přístupu je finanční náročnost, vysoké nároky na rozsáhlost a kvalitu analyzovaných rodin a fakt, že přístup funguje dobře u onemocnění způsobených malým počtem genů, ale je dosti nepřesný při studiu komplexních poruch, jakými dyslipidemie jsou. Omezující je rovněž počet genetických markerů a jejich hustota na analyzovaném genomu - v případě, že hledané genové varianty nejsou součástí určitého většího bloku haplotypů, je jejich nalezení velice obtížné.
Zvířecí modely
Využití zvířecích modelů je v současnosti jedním z důležitých nástrojů pro pochopení podstaty a etiologie některých typů dyslipidemií.
Jsou pěstovány inbrední kmeny, kde se vychází ze sourozeneckého páru a trpělivým křížením a šlechtěním se po mnoha generacích získá jedinec unikátních vlastností. Z jednotlivých generací se vybírají pro další křížení zvířata s požadovaným fenotypovým projevem, dokud se nezíská fenotypově stabilní inbrední kmen. Ten lze s výhodou použít pro řadu studií, např. sledovat navozování hyperlipidemie různými typy diet. Problémem takto vyšlechtěných kmenů je, že znalosti o skutečných genetických příčinách sledovaného fenotypu jsou při uměle vytvořeném genotypu často neúplné (pokud vůbec nějaké).
Je rovněž možné připravit taková zvířata, kde je jeden z genů upraven tak, aby nefungoval (tzv. knock-out kmeny), a naopak zvířata nesoucí jiný většinou lidský gen „navíc“ (tzv. transgenní kmeny). Analýza geneticky modifikovaných zvířat za přesně stanovených parametrů zevního prostředí (strava, pohyb, hmotnost atd) poskytuje jedinečnou informaci o vlivu studovaných genů a jejich změn na fenotyp pokusného zvířete [10]. Při studiu poruch metabolizmu lipidů jsou např. hojně využívány modely apoE knock-out a LDL-receptor knock-out myší s významnou dyslipidemií a akcelerovanou aterosklerózou.
I tyto modely však mají své nevýhody. Laboratorní zvířata většinou vyvíjejí aterosklerózu obtížně a nastavené laboratorní podmínky jsou obvykle zcela extrémní (např. obvyklá dávka 2 % cholesterolu v laboratorní dietě potkana představuje na absolutní množství asi stejnou dávku cholesterolu, jaký je doporučený denní příjem v dietě člověka, nicméně při zhruba 250krát nižší tělesné hmotnosti).
U transgenních zvířat není zcela jasné, zda vnesený funkční gen bude fungovat tak, jak předpokládáme. Zvířata mají v naprosté většině svůj vlastní adekvátní gen. Je nutné sledovat, zda se přenesený gen opravdu exprimuje do mRNA, zda se vytváří odpovídající funkční protein. Například se ukázalo, že myši transgenní a knock-out pro monocytární CD14 receptor reagovali přesně opačně, než se (dle znalostí o lidském CD14 receptoru) předpokládalo [12].
Zvířecí modely lze tedy použít velice dobře pro prvotní cílené studie, které však musí být nezbytně potvrzeny v humánním experimentu (např. použitím tkáňových kultur).
Analýzy více genů a polygenní dyslipidemie
Současné molekulárně genetické metody, které jsou automatizované a dovolují analýzu velkého množství znaků a vzorků najednou, umožňují nový přístup k hledání podstaty polygenně determinovaných dyslipidemií. Vztahy mezi jednotlivými geny a prostředím jsou velmi komplikované a počty nositelů konkrétní genetické odchylky v jednom sledovaném znaku jsou i při studiu velkých souborů nemocných nevelké. Proto je perspektivní směr zkoumání několika set genových variant v řádově desítkách genů pomocí technologií tzv. genových chipů. S minimálním množstvím DNA aplikované na genetický chip je možné v krátkém čase provést až několik set tisíc analýz. Tak je možné posoudit i kombinace genových variant, které se u nemocných s polygenními dyslipidemiemi vyskytují častěji a jsou v příčinné souvislosti s jejich manifestací [12]. Zásadní překážkou rozšíření těchto metodik a jejich širšího využití je zatím vysoká cena.
Závěr
Genetický výzkum poruch metabolizmu plazmatických lipidů a lipoproteinů probíhá již více než 3 desetiletí, a přesto jsou naše znalosti stále neúplné a stále čekáme na objevení hlavních genetických variant zodpovědných za manifestaci familiární kombinované hyperlipidemie, chylomikronemie nezpůsobené defektem genu pro lipoproteinovou lipázu nebo polygenní hypercholesterolemie. Na druhé straně známe genetickou podstatu řady dyslipidemií (familiární hypercholesterolemie, sitosterolemie aj). Genetický výzkum dyslipidemií je komplikován nejen složitostí interakce plazmatických lipidů a lipoproteinů, ale zejména interakcemi mezi jednotlivými geny a mezi geny a prostředím. Význam genetické analýzy není jen v tom, že genetická diagnóza je nejpřesnější, časná a neměnná, ale především v tom, že pouze přesná znalost genetické varianty zodpovědné za manifestaci onemocnění nám v budoucnu (po lepším zvládnutí metod genového přenosu) umožní kauzální léčbu dyslipidemií, léčbu genovou.
Poděkování:
Podpořeno grantem IGA MZ ČR NR/9411-3.
Ing. Jaroslav A. Hubáček, CSc.
www.ikem.cz
e-mail: jaroslav.hubacek@medicon.cz
Doručeno do redakce: 29. 3. 2007
Sources
1. Freiberger T, Vrablík M. Genetika hyperlipoproteinémií. Familiární hypercholesterolémie. Postgraduální medicína 2007; 9 : 907-911.
2. Vrablík M, Češka R, Hořínek A. Major apolipoprotein B-100 mutations in lipoprotein metabolism and atherosclerosis. Physiol Res 2001; 50 : 337-343.
3. Hubáček JA, Bobková D. Molekulární genetika, lipidy a ateroskleróza. In: Česka R et al. Cholesterol a ateroskleróza, léčba dyslipidémií. Praha: Triton 2005 : 75-92.
4. Hirschhorn JN. Genetic approaches to studying common diseases and complex traits. Pediatr Res 2005; 57 : 74R-77R.
5. Talmud PJ. How to identify gene-environment interactions in a multifactorial disease: CHD as an example. Proc Nutr Soc 2004; 63 : 5-10.
6. Berg K. Gene-enviromental interaction: variability gene concept. In: Goldbourt U, de Faire U, Berg K (eds.): Genetic factors in Coronary Heart Disease. Kluwer Academic Publishers: 1994 : 373-383.
7. Talmud PJ, Humphries SE. Gene: environment interactions and coronary heart disease risk. World Rev Nutr Diet 2004; 93 : 29-40.
8. Rader DJ. Gene therapy for familial hypercholesterolemia. Nutr Metab Cardiovasc Dis 2001; 11 (Suppl 5): 40-44.
9. Topol EJ, Smith J, Plow EF et al. Genetic susceptibility to myocardial infarction and coronary artery disease. Hum Mol Genet 2006; 15: R117-R123.
10. Bobkova D, Honsova E, Kovar J et al. Effect of diets on lipoprotein concentrations in heterozygous apolipoprotein E-deficient mice. Physiol Res 2004; 53 : 635-643.
11. Vogel SN, Perera PY, Detore GR et al. CD14 dependent and independent signaling pathways in murine macrophages from normal and CD14 “knockout” (CD14KO) mice stimulated with LPS or taxol. Prog Clin Biol Res 1998; 397 : 137-146.
12. Tuomisto TT, Binder BR, Yla-Herttuala S. Genetics, genomics and proteomics in atherosclerosis research. Ann Med 2005; 37 : 323-332.
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Internal Medicine

2007 Issue 4
-
All articles in this issue
- Prevalencia abdominálnej obezity na Slovensku. Štúdia IDEA Slovakia
- Dlouhodobé zkušenosti s infuzní léčbou treprostinilem u nemocných s plicní arteriální hypertenzí v České republice
- Vliv léčby fenofibrátem na rizikový profil nemocných s metabolickým syndromem a smíšenou dyslipidemií léčených ambulantně
- Molekulární genetika infarktu myokardu
- Lipoprotein (a)
- Chronická pankreatitida - etiologická klasifikace a diagnostická kritéria
- Adiponektin a ateroskleróza
- Představuje inhibitor reninu aliskiren nové výhledové možnosti v léčbě kardiovaskulárních onemocnění?
- Genetika dyslipidemií včera, dnes a zítra
- Smykové napětí v karotickém povodí a jeho role v rozvoji aterosklerózy
- Tyreopatie, dyslipidemie a kardiovaskulární rizika
- Jak ovlivňují kortikoidy, růstový hormon a estrogeny lipidy a aterosklerózu
- CRP - marker proinflamačního stavu a kardiovaskulárního rizika
- Sekundární dyslipidemie a jejich léčba
- Může být snížení klidové srdeční frekvence pro pacienty přínosné?
- Pravidelná aerobní pohybová aktivita zlepšuje lipidový profil u osob s vyšší než normální tělesnou hmotností
- Vedlejší účinky farmakoterapie na hladinu lipidů
- Intravenózní léčba akutního srdečního selhání
- Duální inhibice cholesterolu prostřednictvím přípravku ezetimib/simavastatin (Inegy®) - nejsnadnější cesta k dosažení cílových hodnot LDL-cholesterolu?
- Diagnostické a terapeutické postupy u feochromocytomu: současné trendy
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue
- Lipoprotein (a)
- Jak ovlivňují kortikoidy, růstový hormon a estrogeny lipidy a aterosklerózu
- Vedlejší účinky farmakoterapie na hladinu lipidů
- Může být snížení klidové srdeční frekvence pro pacienty přínosné?

