Leukemogeneza a léčba akutní promyelocytární leukemie: cesta od nejhoršího k nejpříznivějšímu typu akutní myeloidní leukemie
Leukemogenesis and therapy of acute promyelocytic leukemia: from the worse to the most favorable subtype of acute myeloid leukemia
The evolution of therapy of acute promyelocytic leukemia (APL) from 1964 to present is reviewed. The paper is focused on the main findings and key studies which formed current and almost standard therapeutic approach to APL. The first important development was the use of anthracyclines for the initial therapy of APL in 1967. Starting 1972, heparin was introduced into a treatment of coagulopathy and the intensity of substitutional transfusion therapy was remarkably enhanced. The main breakthrough was the initiation of differentiation therapy using all-trans retinoic acid (ATRA). The first clinical study which brought information about the effect of ATRA in APL started in China in 1986. A number of the most important subsequent studies focused on pathogenesis and therapy of APL are analyzed and reviewed. The additional considerable finding was the discovery of arsenic trioxide (ATO) therapeutic efficacy in APL and ATO is now in particular used for a therapy of relapsed APL. The publication gives also a recent insight into a leukemogenesis of APL and development of a resistance to ATRA. At the conclusion, the authors emphasize the need of early diagnosis as a one of the main conditions for successful treatment of APL.
Key words:
history – therapy – acute promyelocytic leukemia – induction of differentiation – retinoids – ATRA – arsenic trioxide
Authors:
Z. Kořístek; J. Mayer
Authors‘ workplace:
Interní hematoonkologická klinika Lékařské fakulty MU a FN Brno, pracoviště Bohunice, přednosta prof. MUDr. Jiří Vorlíček, CSc.
Published in:
Vnitř Lék 2008; 54(7-8): 701-727
Category:
Review
Overview
Autoři podávají přehled vývoje v oblasti terapie akutní promyelocytární leukemie (APL) od roku 1964 do současnosti. Práce je zaměřena na hlavní objevy a klíčové studie, které formovaly současný a téměř standardní léčebný přístup k APL. Prvním významným počinem bylo v roce 1967 použití antracyklinů v úvodní léčbě APL. Po roce 1972 se začal používat v léčbě koagulopatie heparin a významně se zvýšila intenzita substituční transfuzní léčby. Největším objevem a přínosem však zůstává diferenciační terapie pomocí kyseliny all‑trans retinové (ATRA). První klinická studie, která přinesla informace o použití ATRA v indukční léčbě APL, byla přitom zahájena v Číně v roce 1986. Následovala řada prací zaměřených na patogenezu a léčbu APL, nejdůležitější jsou analyzovány a citovány. Dalším důležitým objevem bylo zjištění efektivity oxidu arzenitého (ATO) v léčbě APL, jehož místo je nyní především v léčbě relapsu APL. Součástí přehledu je rovněž současný pohled na leukemogenezu APL a analýza vzniku rezistence k ATRA. Na závěr autoři upozorňují na důležitost včasné diagnostiky APL, která je základní podmínkou úspěšné léčby této nemoci.
Klíčová slova:
historie – léčba – akutní promyelocytární leukemie – indukce diferenciace – retinoidy – ATRA – oxid arzenitý
Leukemogeneza APL
Cílem této části článku je pokud možno srozumitelně seznámit zájemce s leukemogenezou APL. Zmíníme zde samozřejmě řadu základních prací, aby si čtenář mohl informace lépe zařadit do historického kontextu, podrobněji se však historii poznání u APL věnuje na jiném místě velmi čtivou formou MUDr. Jiří Schwarz.
Standardně se uvádí, že první morfologický a klinický popis APL pochází z 50. let 20. století od Leifa Hillestada [1]. Až na obvykle rychlý a fatální průběh s průvodní závažnou koagulopatií se APL dlouho výrazněji neodlišovala od jiných akutních leukemií (AML). Tato situace trvala až do roku 1976, kdy se objevila zpráva o parciální deleci dlouhého raménka 17. chro-mozomu u dvou pacientů s APL [2], a zanedlouho, v roce 1977, stejný tým okolo Rowleyové a Golomba upřesnil, že jde o balancovanou translokaci dlouhých ramének chromozomů 15 a 17 [3]. Jistě stojí za zmínku, že po objevu t(9;22) u CML šlo o druhý důkaz genetického původu malignity u člověka. V roce 1984 Larson et al [4] konstatovali, že translokaci 15/17 má každý pacient s APL, a s rozvojem molekulárně genetických metod se postupně podařilo přesně charakterizovat i příslušné geny, které fúzují při této translokaci. V roce 1988 byl na band q21 chromozomu 17 namapován receptor typu RARα [5] a o 2 roky později se už vědělo, že výsledkem t(15;17) je fúzní gen vytvořený z genu myl, nyní zvaného PML, a genu RARα [6]. V roce 1990 Borrow et al prokázali, že v případě RARα nastává zlom konstantně v oblasti 2. intronu RARα lokusu chromozomu 17q21, výsledný chimerický protein tedy neobsahuje prvních 30 aminokyselin [7]. Stejný autorský kolektiv pak charakterizoval i partnerský gen na chromozomu 15q22 a zjistil, že výsledný PML protein obsahuje motiv zinkového prstu a exprese PML není omezena na hematopoetickou tkáň, ale je přítomná např. i v mozku, plicích, placentě, svalech střevě atd. Možná zlomová místa u PML jsou navíc minimálně dvě [8]. Časem se však objevili i pacienti, u kterých se typická translokace 15/17 nepodařila prokázat ani na cytogenetické, ani na molekulárně biologické úrovni.
Abychom si uvědomili, jaké změny přináší t(15;17) a proč dochází k blokádě diferenciace s následnou leukemizací, je potřeba poněkud podrobněji nahlédnout do funkce zainteresovaných proteinů. Nukleární receptor RARα má 6 domén, A–F, které jsou evolučně výrazně konzervované, nejvíce pak doména C, která obsahuje dva zinkové prsty. Díky této doméně se RARα váže na RARE (retinoid acid response elements), které se nacházejí v oblasti promotorů řady genů, společně s příslušným retinoid X receptorem (RXR) jako heterodimer [9]. Heterodimerizace obou proteinů je zajištěna jak vazbou RARα díky doméně C na DNA (na RARE), tak vazbou pomocí domény E na RXR [10]. Modulace transkripce je zajištěna interakcí s kofaktory. V nepřítomnosti retinoidů se prostřednictvím domény E na komplex tvořený RARα, RXR a RARE (tedy příslušnou oblastí promotoru daného genu) vážou korepresory N-CoR, SMRT [11] a Sin3A [10]. Korepresory N-CoR a SMRT jsou přitom součástí multiproteinového komplexu, který zahrnuje také histon-deacetylázu (HDAC). Deacetylace histonů mění konfirmaci chromatinu a výsledkem je, že daný úsek DNA není dostupný pro transkripční mechanizmy [12]. Pokud je přítomen ligand – tedy retinoid, pak doména E mění svou konfirmaci, což má za následek uvolnění komplexu korepresorů a HDAC, a naopak navázání koaktivačních molekul, mezi které patří např. Src‑1, ACTR, CBP, TIFI atd. Přitom především CBP a ACTR kofaktory mají histon-acetylázovou aktivitu [13,14] a výsledkem jejich vazby na komplex RARα – RXR – RARE je acetylace chromatinu, která ve svém důsledku umožňuje transkripci daného genu [10].
Jinými slovy, retinoidy významně ovlivňují diferenciaci, protože umožňují řízení transkripce příslušných genů díky svému působení na komplex tvořený RARα, RXR, RARE (jako příslušná oblast promotoru daného genu) a několika kofaktory. Za nepřítomnosti retinoidu (ligandu RARα) se na komplex vážou kofaktory s represorickou funkcí a znemožňují transkripci deacetylací histonů. Po vazbě retinoidu jsou korepresory nahrazeny koaktivátory a následná acetylace histonů a změna struktury chromatinu umožňuje transkripci genetické informace [10].
Pro vznik APL je charakteristický vznik fúzních proteinů, kde jedním z partnerů je retinoidový receptor RARα a druhým obvykle (v nejméně 98 %) PML. Kromě PML bylo dosud identifikováno ještě 5 partnerských genů RARα: PLZF (11q23) [15], NuMA (11q13) [16], NPM (5q35) [17], STAT5b (17q21) [18] a v loňském roce PRKAR1A (17q24) [19]. Přes rozdílné funkce a charakteristiky fúzních partnerů RARα (dále jako X) je jejich společnou vlastností, že obsahují multimerizační doménu, díky které mohou vytvářet X‑RARα homodimery a multimery. Tyto homodimery a multimery typu X‑RARα mají schopnost inter-agovat s původními proteiny X, které se nadále vytvářejí díky funkční alele na druhém, nepostiženém chromozomu. V případě overexprese X‑RARα dochází tedy ke tvorbě X‑RARα homodimerů a multimerů, které obsazují RARE a pomocí korepresorických molekul blokují transkripci pro diferenciaci důležitých genů [20].
Jak již bylo uvedeno, u drtivé většiny pacientů s APL nacházíme fúzní gen PML‑RARα, který je výsledkem balancované translokace (15q22;17q21). PML je běžně exprimovaný protein, vysoká exprese je přítomná při zánětlivých onemocněních, v buňkách uzlin při Hodgkinově lymfomu, v zánětlivých lézích při GVHD apod [21]. PML protein je součástí nukleárních tělísek (NB – nuclear bodies), která jsou vázána na nukleární matrix. Protein PML má několik domén, z nichž nejdůležitější je pravděpodobně oblast bohatá na cystein, kde se nachází 3 struktury typu zinkových prstů. První struktura je zvaná RING (really interesting new gene) a je zodpovědná za lokalizaci PML proteinu do nukleárních tělísek. Další region PML, zaujímající šroubovitou konfirmaci (helical coiled-coil region), je zodpovědný za multimerizaci PML a heterodimerizaci s PML‑RARα a rovněž hraje roli v NB lokalizaci PML. Právě v oblastech NB dochází v jádře k regulaci, resp. útlumu transkripce. Množství a velikost NB v jádře jsou tak přímo úměrné míře syntézy bílkovin a nepřímo úměrné diferenciaci [22]. V tomto ohledu je důležité zmínit, že i další proteiny kódované možnými partnerskými geny RARα u APL jsou úzce spojené se strukturou nukleárních tělísek. PML a PLZF interagují s korepresory histon-deacetylázy, a tlumí tak transkripci. NPM a především NuMA velmi úzce souvisejí se strukturou nukleárních tělísek a PLZF je rovněž součástí NB, stejně jako PML. Na podkladě těchto zjištění se předpokládalo, že základní patogeneze APL spočívá v narušení funkce NB a jaderné matrix [10]. PML je přitom považován za tumor supresorický protein a PML–/ – myši vykazovaly významně vyšší incidenci výskytu různých typů tumorů [23]. PML protein rovněž hraje velmi významnou roli v procesech apoptózy a vysoká míra exprese PML indukuje apoptózu i bez zapojení kaspáz, kdežto fyziologický výskyt PML se zdá být nezbytný pro jejich normální aktivaci [24]. Jak již bylo uvedeno, v případě vzniku fúzního proteinu PML‑RARα je narušena normální funkce RARα a nedochází k odblokování transkripce genů klíčových pro myeloidní diferenciaci. Zvýšená koncentrace PML‑RARα a schopnost dimerizace PML‑RARα s PML má za následek sekvestraci PML, vymizení nukleárních tělísek z jádra, potlačení normální funkce PML jako tumor supresorického proteinu a narušení apoptotických mechanizmů, na kterých se PML významně podílí.
Přesto nelze s jistotou uzavřít, že tyto děje mají bezvýhradně za následek vznik akutní promyelocytární leukemie. Práce publikované v posledních letech naznačují, že za patogenezí APL stojí pravděpodobně ještě další faktor. Při pokusech na transgenních myších exprimujících PML‑RARα zaznamenali Grisolano et al, že penetrace vzniku leukemie je malá a myší leukemie odpovídající APL se rozvine pouze u 20–30 % těchto myší [25]. Na druhé straně je potřeba uvést, že exprese PML‑RARα byla při těchto pokusech poměrně nízká. Penetrace APL se však dramaticky zvýšila ve chvíli, kdy byly tyto transgenní myši buď ozářeny, nebo se podařilo v mladých myeloidních buňkách koexprimovat RARα-PML. V obou případech se zjistilo, že naprostá většina takto vzniklých APL vykazovala velkou intersticiální deleci na chromozomu 2, která vždy zahrnovala gen PU.1, který byl v roce 1990 původně identifikován jako onkogen Spi‑1 [26]. Expresí PU.1 u lidí i u myší se zabývala řada prací a bylo jasně prokázáno, že je omezena na krvetvorbu, dominantně na linii makrofágů, granulocytů a B-lymfocytů. Další práce přinesly poznatek, že PU.1 moduluje transkripci řady dalších genů, které jsou zásadní zejména pro myeloidní diferenciaci, tedy receptorů růstových faktorů (G-CSF, GM-CSF, CSF‑1, M-CSF, IL-6), různých adhezivních molekul (CD11b, CD18) a enzymů (myeloperoxidázy, proteinázy‑1, elastázy) asociovaných s myeloidními buňkami, resp. granulocyty. Při mutaci typu PU.1–/ – dochází k blokádě myeloidní diferenciace a akumulaci nezralých monocytoidních a granulocytárních progenitorů [27,28].
Metcalf et al na myším modelu ukázali, že při nepřítomnosti funkčního PU.1 genu došlo postupně u všech zvířat k rozvoji akutní myeloidní leukemie. Typicky se rozvinula leukopenie s neutropenií, která byla dokonce i relativní. Cytologická analýza ukázala, že přibližně 50 % buněk přítomných v kostní dřeni a zvětšené slezině byly blasty a 20–25 % promyelocyty, což je obraz nápadně podobný lidské APL [29]. Jinými slovy, primární ztráta funkce PU.1 způsobila poruchu regulace transkripce při myeloidní diferenciaci a následkem byl diferenciační blok a progresivní hromadění do určité míry abnormálních prekurzorů granulocytů [30].
U pacientů s PML/RARα pozitivní APL nebyla mutace PU‑1 dosud zjištěna, což vedlo k teorii, že právě fúzní protein PML‑RARα může negativně ovlivňovat expresi PU.1. Aby ověřili tuto myšlenku, provedli Walter et al transfekci kultury U937 (primitivních myelomonocytárních buněk) plazmidy nesoucími PML/RARα, PML a RARα. Transfekce PML/RARα měla už po 8 hod za následek 77% snížení exprese PU.1 v porovnání s kontrolami. Vzhledem k tomu, že poločas PU.1 mRNA u buněk U937 je 7,3 hod, bylo jasné, že PML‑RARα blokuje expresi PU.1 mimořádně rychle a účinně [31].
Dalším logickým krokem bylo ověření hypotézy, zda také u buněk lidské APL způsobuje PML‑RARα blokádu PU.1. Pokud ano, pak by podávání ATRA mělo vést k odstranění tohoto bloku. Muellerová et al [32] provedli několik typů pokusů, aby tyto otázky zodpověděli. Nejprve znovu ověřili, že v lidské myeloidní buněčné linii U837-PR9, vyznačující se na zinku závislou expresí PML‑RARα, dochází po indukci zinkem k výraznému útlumu exprese PU.1. Dále ověřili, že buněčná linie HT93A, odvozená z buněk pacienta s PML/RARα pozitivní APL, výrazně méně exprimuje PU.1 než původní buněčná linie U937 (neexprimující PML‑RARα). Následovaly další testy, které ukázaly, že 18 hod po expozici ATRA došlo k 8násobnému nárůstu množství PU.1 mRNA v buňkách linie HT93A. Podle očekávání vymizel po 24 hod z buněk HT93A fúzní protein PML‑RARα, ale navíc se ukázalo, že během této doby rovnoměrně s clearance PML‑RARα narůstalo množství PU.1 proteinu stejně jako produktu jednoho z jeho cílových genů – v tomto případě M-CSF receptoru. Při stejných testech na linii APL buněk typu NB4-R1, která se vyznačuje ATRA rezistencí, zvýšení exprese PU.1 nezaznamenali.
Aby ověřili platnost výsledků, tes-tovali pomocí real-time PCR expresi PU.1 v blastech získaných od 18 pacientů s APL a v selektovaných CD34+ buňkách a granulocytech získaných od zdravých dobrovolníků. Zdravé zralé neutrofily vykazovaly 16krát vyšší expresi PU.1 než CD34+ buňky. Při porovnání množství RNA, a tedy exprese PU.1 a PML‑RARα u pacientů s APL byla zjištěna jednoznačná a vysoce statisticky signifikantní korelace typu nepřímé úměry mezi množstvím PML‑RARα a PU.1 (r = –0,912). Podobně jako PU.1 se přitom chovala koncentrace mRNA OCT‑1 a faktorů CEBP, což jsou proteiny vážící se na promotor PU.1. Posledním krokem bylo ověřit, zda se popsaná genová exprese chová stejně in vivo při léčbě pacienta s APL pomocí ATRA. Autoři proto měřili kinetiku exprese RNA pro PML‑RARα, PU.1, OCT‑1 a rodinu CEBP den po dni u pacienta s nově diagnostikovanou APL a léčeného pouze ATRA v klasickém dávkování (45 mg/m2/den). Také v tomto případě zjistili přibližně 8násobné zvýšení exprese RNA PU.1 po 24 hod od zahájení podávání ATRA. Dalšímu zvýšení exprese PU.1 předcházelo výrazné zvýšení exprese CEBPA, CEBPB a OCT‑1 v den 2 terapie a ex-prese PU.1 potom rychle narostla dokonce na 65násobek původních hodnot v den 3. Léčba APL pomocí ATRA tedy nejprve vede především k indukci transkripce CEBPA, CEBPB a OCT‑1, které převádí efekt ATRA na expresi PU.1. Poslední pokusy byly zaměřeny na ověření tohoto faktu, a proto byly buňky HT93A před ATRA transfekovány siRNA proti OCT‑1 a CEBPA, CEBPB a CEBPE. Podle očekávání byla oproti netransfekovaným buňkám exprese PU.1 výrazně snížená, u buněk transfekovaných siRNA proti OCT‑1 dokonce 13krát. Transfekce pomocí siRNA proti CEBPA a CEBPE se projevila jen malým snížením exprese PU.1 [32]. Závěr se zdá být jednoznačný – ATRA aktivuje expresi PU.1 cestou aktivace exprese CEBPB a OCT‑1 a exprese PU.1 je esenciální pro přechod ze stadia promyelocytů k další diferenciaci (obr. 1).
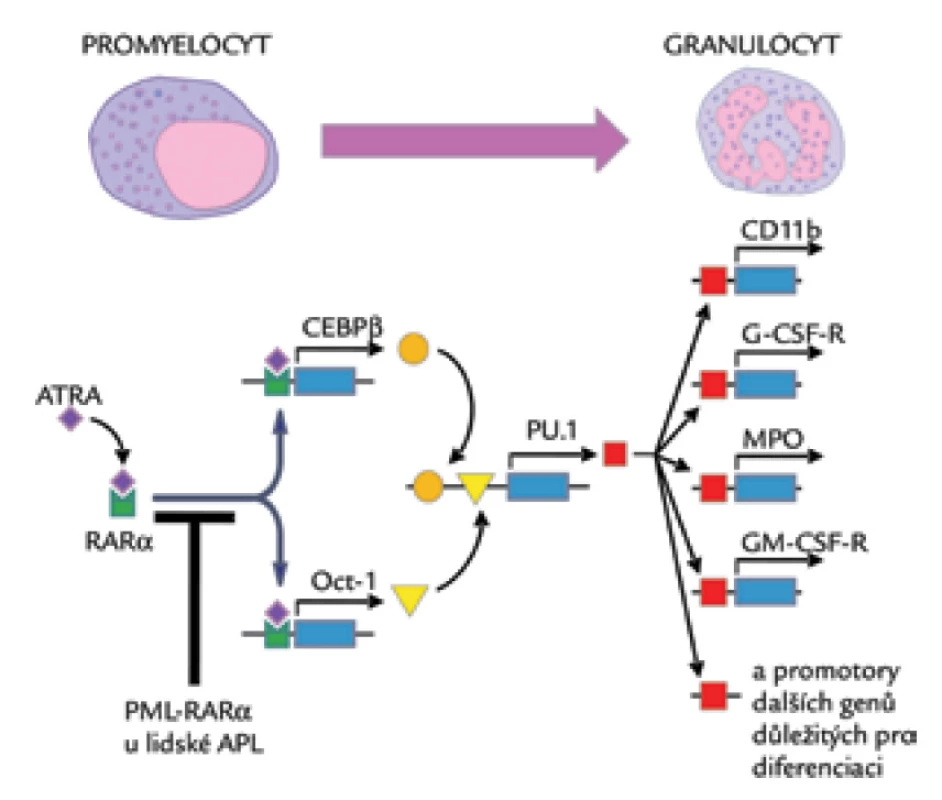
Z uvedeného vyplývá, že pro rozvoj APL je s největší pravděpodobností zásadní blok jednoho jediného genu kódujícího protein PU.1. A bez vlivu PU.1 zůstává zablokována transkripce genů esenciálních pro diferenciaci granulocytárních progenitorů, aniž by došlo k zablokování proliferace, což ve svém důsledku vede k obrazu APL tak, jak jej známe.
Léčba APL před objevem diferenciační terapie pomocí kyseliny all-trans retinové (ATRA)
Diagnóza APL znamenala kdysi ex-trémně špatnou prognózu a tato situace trvala až do zavedení daunorubicinu do klinické praxe. Pravidlem byla závažná koagulopatie s hypofibrinogenemií a rychlým rozvojem krvácivé diatézy, více než 1/2 pacientů umírala na intrakraniální krvácení a jiné komplikace ještě před zahájením léčby, dosažení kompletní remise (CR) bylo výjimečné. Za této situace ani na nejlepších světových pracovištích pacienti nepřežívali déle než 1/2 roku. Výsledky byly tristní, a tak není divu, že z této doby pochází jen málo prací, které se věnují léčbě APL – nebylo se čím chlubit. Např. Didisheim et al [33] publikovali v roce 1964 výsledky léčby APL u 57 pacientů, z nichž pouze 5 pacientů přežívalo déle než 4 měsíce. Hlavním důvodem úmrtí bylo fatální krvácení, kterému nemocní podlehli obvykle ještě před zahájením terapie nebo během prvních 2 týdnů léčby. Vzhledem k tomu, že 3 pacienti léčení 6-merkaptopurinem (6-MP) dosáhli remise trvající 7–18 měsíců, se zdálo, že 6-MP dává určitou naději na lepší výsledky.
Jak ve svém vynikajícím historickém přehledu zmiňuje MUDr. Schwarz, v pařížském Hôpital Saint-Louis se léčbě APL intenzivně věnoval prof. Jean Bernard, který popsal téměř identické zkušenosti. Ve své práci publikované v časopise Blood v roce 1973 uvádí, že v období 1963–1967 s kolegy diagnostikovali APL u 36 pacientů, z nichž 6 zemřelo do pěti dnů od stanovení diagnózy a u 30 byla zahájena léčba různými kombinacemi 6-merkaptopurinu, metotrexátu a prednisonu. Celkem 23 pacientů zemřelo po zahájení chemoterapie na krvácivé komplikace a kompletní remise se nakonec podařilo dosáhnout pouze u 4 pacientů, kteří však bez výjimky zrelabovali a zemřeli do 4 měsíců.
Zlom nastal až v roce 1967, kdy se stal dostupným daunorubicin. Prof. Bernard uvádí, že v letech 1967–1971 bylo daunorubicinem (4 × 60 mg/m2) léčeno celkem 39 pacientů s APL, 5 pacientů sice opět zemřelo před zahájením léčby, ale ostatní výsledky se výrazně zlepšily: kompletní remise bylo dosaženo u 19 pacientů (55 % léčených), medián přežití byl 26 měsíců, žádný pacient nezrelaboval dříve než za 5 měsíců a 4 pacienti byli v remisi déle než 4 roky [34]. Daunorubicin tak zásadně změnil prognózu pacientů s APL a stal se rychle základním lékem v indukční i konsolidační terapii APL.
Po roce 1972 se navíc k potlačení projevů konsumpční koagulopatie začal běžně používat heparin, což zároveň s agresivní transfuzní léčbou (plazma a trombokoncentráty) snížilo incidenci fatálních krvácení pod 25 %, a remise tak dosahovalo už 60 % pacientů – to byli téměř všichni, kteří přežili indukční terapii. Prodloužila se také doba remisí a medián trvání CR přesáhl 2 roky. Vývoj terapeutického přístupu k APL během dekády 1974–1984 je velmi přehledně zmapován v retrospektivní práci z Memorial Sloan-Kettering Cancer Center v New Yorku publikované Isabelou Cunningham et al v roce 1989 [35]. Pacienti byli zpočátku léčeni kombinací daunorubicin, cytosar a 6-thioguanin. Později byly dávky daunorubicinu navýšeny a po roce 1980 byl daunorubicin u některých pacientů nahrazen amsakrinem. Na krvácivé komplikace zemřelo 14 % pacientů a mortalita indukční terapie byla 21 %. Kompletní remise dosáhlo už 75 % pacientů a přes 20 % pacientů zůstávalo v remisi 5–13 let po léčbě, což vynikne při srovnání s ostatními typy AML, u kterých při stejné léčbě přežívalo po 5 letech asi 5 % pacientů. Tyto výsledky byly opravdu vynikající – je potřeba si navíc uvědomit, že vstupní hyperleukocytózu měla přitom celá 1/3 pacientů. Už tehdy se totiž ukázalo, že nejsilnějším negativním prognostickým faktorem je vstupní počet leukocytů nad 10 × 109/l, který ovlivňuje zásadně nejenom mortalitu při indukci, ale také délku remisí a tendenci k relapsu.
V letech 1972–1986 publikovaly své léčebné výsledky u 280 pacientů s APL další skupiny [36–42], které indukční terapii postavily na daunorubicinu a k léčbě koagulopatie používaly heparin; kompletních remisí bylo dosaženo u 53–73 % pacientů. Na pracovištích, kde heparin používán nebyl [43–45], byly výsledky horší a kompletních remisí dosahovalo pouze 12–56 % pacientů – především z důvodu vysokého výskytu fatálních krvácení, a tedy kvůli vysoké mortalitě během indukční terapie. Jedině v Bostonu používali místo heparinu intenzivní podpůrnou transfuzní terapii plazmou a trombocyty a dosahovali podobných výsledků jako skupiny používající heparin, tedy 74 % kompletních remisí [46].
Diferenciační efekt retinoidů a jejich vstup do léčby APL
Výzkum účinků jednotlivých vitaminů byl prováděn již před 80 lety a při studiu navozených hypovitaminóz bylo mimo jiné zjištěno, že retinoidy hrají důležitou úlohu při buněčné diferenciaci. U krys chovaných za podmínek absence přísunu vitaminu A v potravě byla pozorována vysoká incidence tumorů žaludku [47], hlodavci vyvíjeli dysplastické a premaligní epidermální léze, které mizely po přidání retinoidů do potravy [48] a u morčat se objevovaly nádory epiteliálních tkání laryngu, trachey, plic, slinných žláz a žaludku [49]. S rozvojem cytostatické léčby malignit ustoupilo studium diferenciace v onkologii na čas do pozadí. Retinoidy se přitom pro navození diferenciace začaly s úspěchem používat od 40. let 20. století v dermatologii pro léčbu akné a později také abnormální keratinizace či psoriázy. V roce 1955 byla syntetizována kyselina 13-cis retinová neboli isotretinoin, v roce 1973 následoval aromatický retinoid zvaný etretinát. V dermatologii postupně doznaly retinoidy velkého rozšíření a díky tomu byly také dobře známé jejich nežádoucí účinky a únosné dávkování.
V 70. letech 20. století se opět někteří autoři začali věnovat studiu diferenciační léčby v onkologii a byl zkoumán efekt různých retinoidů s cílem inhibice karcinogeneze nebo maligní transformace zejména u epidermálních tumorů a karcinomů [50,51]. Mimo jiné byl objeven stimulační vliv retinoidů na granulopoezu [52].
Ve stejném období Collins et al [53] vyvinuli dodnes používanou buněčnou linii lidské akutní myeloidní leukemie HL-60, o které se domnívali, že pochází od pacienta s APL (podrobněji se o tom zde zmiňuje MUDr. Schwarz ve svém historickém přehledu). Na této buněčné linii začali testovat diferenciační efekt dimetylsulfoxidu a dalších polárních sloučenin, což byly s výjimkou kyseliny máselné organická rozpouštědla typu piperidonu, trietylenglykolu, acetamidu atd. Ve všech případech zaznamenali navození určité diferenciace leukemických buněk [54]. Mechanizmus, kterým tyto látky diferenciaci aktivovaly, však zůstával naprosto nejasný, i když jednou z hypotéz bylo, že dochází k ovlivnění konfirmace chromatinu způsobem, který umožňuje zahájení transkripce genů důležitých pro další diferenciaci buněk. Zjištění, že blok diferenciace lze za určitých okolností překonat, byl bez pochyby nejdůležitějším výsledkem těchto prvních výzkumů. Vzhledem ke známému diferenciačnímu efektu retinoidů navázal tento tým z National Cancer Institute v Bethesdě na své předchozí výsledky a začal testovat, zda retinoidy také ovlivní diferenciaci v linii HL-60. Nejlepších a přibližně stejných výsledků dosahovali s použitím 13-cis retinové kyseliny a all-trans retinové kyseliny (ATRA) v koncentraci 1 μmol/l, kdy byla v buněčné kultuře promyelocytů po 5 dnech patrná 90% terminální diferenciace [55].
Tyto výsledky nezůstaly dlouho bez povšimnutí, protože zejména terapie relapsu APL byla stále svízelná a často neúspěšná. Navíc isotretinoin, tedy kyselina 13-cis retinová, byl od roku 1976 poměrně běžně užíván pro léčbu kožních afekcí, byl tedy dostupný jako humánní lék a neměl velkou toxicitu [56]. Poprvé se pro experimentální postup s použitím isotretinoinu rozhodli Flynn et al z Minneapolis, kde byl na podzim roku 1981 hospitalizován 22letý muž s relapsem APL. Léčebná odpověď na indukční chemoterapii byla u tohoto pacienta nulová a přetrvávala téměř 100% infiltrace kostní dřeně základním onemocněním s těžkou periferní leukopenií a neutropenií. Flynn začal tomuto pacientovi podávat isotretinoin (kyselinu 13-cis retinovou) v dávce 100 mg/m2/den. Léčba byla tolerována dobře, koncentrace leukocytů včetně dozrávajících granulocytů v krvi stoupala. Bohužel, pacient po 13 dnech této experimentální terapie zemřel na diseminovanou kandidózu, ale první krok byl učiněn [57]. Nilsson [58] v roce 1984 informoval o dosažení kompletní remise u 30leté ženy s relabovanou APL podáváním isotretinoinu v dávce 1 mg/kg. Fontana, Rogers a Durham [59] také použili isotretinoin v monoterapii u těžce předléčeného pacienta s APL a překvapivě dosáhli kompletní remise, která se udržela po celý rok. Daenen et al [60] publikovali kazuistiku pacienta s APL a současně aspergilovou pneumonií. Intenzivní chemoterapie nebyla možná, a proto byl tento pacient léčen isotretinoinem v monoterapii. Po 7 týdnech perorální léčby se podařilo navodit kompletní remisi a rovněž došlo k rychlé úpravě koagulopatie. Sampi et al [61] použili u jednoho pacienta jiný retinoid, etretinát, jehož účinnost nejprve úspěšně otestovali na promyelocytech pacienta in vitro. Léčba etretinátem však zůstala zcela bez efektu a pacient po 2 týdnech zemřel.
Důvodem, proč se nakonec isotretinoin v terapii APL neprosadil, byla ve srovnání s ATRA jeho menší efektivita při nižší koncentraci jak in vitro, tak in vivo. Tým okolo Christine Chomienne v Hôpital Saint-Louis (připomínám, že jde stále o pracoviště prof. Jeana Bernarda) studoval v letech 1986–1988 diferenciační efekt 13-cis a all-trans retinové kyseliny na buněčné kultury získané od pacientů s APL. Mimo jiné hodnotili vliv koncentrace obou izomerů na výsledný diferenciační efekt a zjistili, že při koncentraci retinoidů 10–7 mol/l ATRA výborně indukovala buněčnou diferenciaci, zatímco isotretinoin navodil diferenciaci jen v některých vzorcích. Při koncentraci retinoidů 10–6 mol/l se tento rozdíl sice stíral, ale z výsledků vyplynulo, že ATRA by mohla být účinnějším lékem a že na případný léčebný efekt bude mít vliv nejen typ použitého retinoidu, ale i jeho dávkování [62]. Do té doby dosažené léčebné výsledky tyto závěry potvrzovaly: etretinát čili etyl-ester byl bez efektu a isotretinoin byl dostatečně efektivní jen v dávkách 45–100 mg/m2, nižší dávkování bývalo neúčinné [57–61,63].
K hlavním překážkám na cestě zavedení ATRA do klinické praxe patřila její problematická dostupnost, možná vyšší toxicita v porovnání s ostatními retinoidy [64] a zřejmě i nedostatek odvahy vyzkoušet látku neschválenou pro humánní použití. Přitom se již od roku 1985 vědělo, že ATRA patří mezi přirozené retinoidy a za normálních okolností se v organizmu vyskytuje [65]. Zřejmě právě z těchto důvodů došlo k tomu, že první klinické pokusy a studie s použitím ATRA v terapii APL proběhly pod záštitou Shanghai a Harbin University v Číně, kde sociální a právní prostředí jistě nevyvíjelo takový tlak na klinické výzkumy jako v Evropě, USA a dalších rozvinutých zemích. Personálie a okolnosti, které nakonec vedly k zavedení ATRA do klinické praxe v léčbě APL, popisuje ve svém příspěvku velmi zevrubně a zajímavě MUDr. Jiří Schwarz. Zde pro lepší přehlednost uvedu pouze poměrně strohá fakta.
Huang Meng-er et al z Shanghai Institute of Hematology využili dostupných teoretických a klinických údajů a od začátku roku 1986 začali podávali ATRA pacientům s APL. Dávka ATRA se pohybovala od 45 do 100 mg/m2/den. Do studie bylo nakonec zařazeno 16 pacientů s nově diagnostikovanou APL a 8 pacientů s rezistentní nebo relabovanou APL. Vedle sledování léčebné odpovědi souběžně in vitro testovali efekt ATRA na vzorcích kostní dřeně 15 pacientů.
Po nasazení ATRA začala koncentrace leukocytů stoupat a vrcholu dosáhla za 7–14 dní. Pak se začal krevní obraz upravovat a po 3 týdnech se začala normalizovat i koncentrace trombocytů. Dřeň přitom zůstávala hypercelulární. Do měsíce dosáhli 3 pacienti kompletní a 15 pacientů parciální remise a po 2 měsících bylo v kompletní remisi již 21 z 24 pacientů. Dva pacienti dosáhli CR až po 68, resp. 119 dnech podávání ATRA. Pouze u jednoho pacienta, u kterého ani kultura in vitro nereagovala na ATRA, nebyla zaznamenána léčebná odpověď na monoterapii ATRA. Terapie byla proto rozšířena o 10 mg cytosinarabinosidu každých 12 hod a nakonec po 98 dnech dosáhl i tento pacient kompletní remise. Tyto výsledky byly až šokující, protože mortalita při tomto typu indukce byla nulová a kompletní remise dosáhlo všech 24 pacientů, resp. 23 pacientů jen při monoterapii preparátem necytostatické povahy. Problémem však byla vysoká a poměrně časná incidence relapsů, a to i přes udržovací terapii. Dva ze šesti pacientů, kterým byla jako udržovací terapie podávána pouze ATRA, zrelabovali za 2, resp. 4 měsíce. Tři ze 4 pacientů s udržovací terapií ATRA plus nízkými dávkami alternujícího cytosinarabinosidu a harringtoninu zrelabovali během 4–5 měsíců. Ostatní pacienti měli jako udržovací terapii různě dávkovaný cytosinarabinosid, cyklofosfamid, meto-trexát a 6-merkaptopurin a 3 z těchto 14 pacientů rovněž zrelabovali. Doba sledování byla přitom velmi krátká, od 1 do 8 měsíců od dosažení CR [66].
Další čínská studie byla vedena v letech 1988–1990 v Jiangsu Institute of Hematology a bylo do ní zařazeno 50 pacientů, 47 s nově diagnostikovanou a 3 s relabovanou APL. Opět byla podávána ATRA v indukci a jako konsolidace režim HOAP (homoharringtonin, vinkristin, cytosinarabinosid a prednison). Jako udržovací terapie byla zvolena kombinace cytosinarabinosidu s 6-thioguaninem a intratekální podávání metotrexátu. U 8 pacientů byla v rámci udržovací léčby podávána navíc ATRA v redukované dávce (30–40 mg/den).
Tři pacienti zemřeli do 5 dnů pro krvácení, všech ostatních 47 pacientů dosáhlo CR v průměru po 39 dnech podávání ATRA (od 25 do 90 dnů). Relaps nadále zůstával největším problémem jinak velmi úspěšné léčby, zrelabovalo 19 pacientů a průměrná doba CR byla necelých 15 měsíců. Zajímavé bylo, že do 26 měsíců zrelabovalo všech 8 pacientů, kteří jako součást udržovací terapie dostávali ATRA.
Hlavní závěry vyplývající z této studie byly následující: monoterapie ATRA navodí remisi prakticky u všech pacientů s APL, po nasazení ATRA dochází k velmi rychlé úpravě koagulopatie (autoři dokonce uvádějí, že pacienti nebyli během indukce hospitalizováni), ale přes navození remise a nasazení udržovací terapie relabuje přibližně 40 % pacientů [67]. Z dnešního pohledu byla konsolidační terapie málo intenzivní, a pokud byla do udržovací terapie přidána ATRA, bylo dávkování nízké a podávání nebylo intermitentní, což rychle vedlo k rezistenci k ATRA dané změnami metabolizmu.
Studie s ATRA mimo Čínu
První klinické testy mimo Čínu byly zahájeny ve Francii už v říjnu roku 1988 díky úzké spolupráci s univerzitou v Šanghaji, která poskytla kyselinu all-trans retinovou týmu Laurenta Degose. Od července roku 1989 už výrobu a distribuci ATRA zajistila firma Hoffman LaRoche, která již dříve dodávala ATRA pro preklinické testy. Na základě výsledků těchto preklinických výzkumů, které jsou popsány výše [62], a první čínské klinické studie [66] byla ATRA podána 22 pacientům jako indukční terapie prvního (11 pacientů), druhého (4 pacienti), a dokonce třetího relapsu APL (1 pacient). Další 2 pacienti dostali ATRA pro APL rezistentní k chemoterapii, 1 pacientka pro odmítnutí chemoterapie a konečně 3 pacienti pro vysoký věk (81 a 78 let) a závažnou komorbiditu (72 let a plicní silikóza) bránící zahájení konvenční intenzivní indukční chemoterapie. Dávkování ATRA bylo stejné jako dnes, tedy 45 mg/m2/den.
Kompletní remise dosáhlo 14 pacientů. První odpovědí na ATRA bylo odeznění koagulopatie, koncentrace fibrinogenu se normalizovala do 9 dnů. Tři pacienti zemřeli do 2 týdnů za symptomů, které dnes známe jako ATRA syndrom, resp. leukostázu při leukocytóze vyvolané vyplavením vlivem ATRA maturujících myeloidních buněk, které ve vysoké míře exprimují adhezivní molekuly. ATRA měla jen přechodný a neúplný efekt u tří pacientů ve 2. a jed-noho v 1. relapsu. Úplné selhání ATRA a nulová odpověď na terapii byla zaznamenána pouze u jediného pacienta léčeného pro 3. relaps APL, u kterého se neobjevily žádné známky diferenciace v granulocytární řadě krvetvorby. 9 ze 14 pacientů, kteří dosáhli kompletní remise, zrelabovalo přes nasazení udržovací terapie [68]. Horší výsledky oproti čínské studii byly pravděpodobně dány především charakteristikou léčených pacientů, kteří byli více předléčení, měli vyšší věk (nejstarší pacient léčený v Šanghaji měl 69 let, v Paříži 81 let), měli rezistentní nebo opakovaně relabující chorobu. Práce však přinesla velmi důležité informace a vyvstala řada otázek. Bylo vysoce pravděpodobné, že historie léčby APL má zásadní význam pro úspěšnost terapie, u 11 pacientů léčených v 1. relapsu bylo dosaženo 10 kompletních remisí, z 5 pacientů léčených pro 2. či 3. relaps dosáhl remise pouze jeden. ATRA by proto měla být nasazena co nejdříve bez čekání na nepříznivý průběh nemoci. Dále byla zaznamenána tendence k leukocytóze po nasazení ATRA a u 4 pacientů koncentrace leukocytů překročila 30 × 109/l, což bylo u 3 z nich příčinou fatální leukostázy, nyní známé spíše jako ATRA syndrom. Autoři proto doporučili, aby u pacientů se vstupní leukocytózou byla ATRA nasazována s velkou opatrností a za jejich intenzivního sledování. Vzhledem ke krátkému trvání remisí a vysokému počtu relapsů bylo jasné, že je potřebná intenzivní konsolidace a že udržovací terapie sama o sobě nestačí.
Tyto závěry byly bezodkladně zohledněny v designu další studie, kterou inicioval stejný tým v roce 1989. Jednalo se o pilotní studii s použitím ATRA v indukci s navazující intenzivní chemoterapií [69]. Francouzská skupina okolo Pierra Fenauxe a Laurenta Degose vycházela při designu studie jak ze svých výsledků [62,68], tak už i ze zkušeností jiných týmů [66,70].
Do studie bylo v letech 1989–1991 zařazeno 26 pacientů s nově diagnostikovanou APL a vstupní koncentrací leukocytů menší než 10 × 109/l. Její de-sign byl dosti intenzivní: indukce ATRA 45 mg/m2/den do CR (nebo dne 90), konsolidace jedním cyklem 4+7 (daunorubicin 60 mg/m2/den, den 1–4, a cytosinarabinosid 100 mg/m2/ den, den 1–7) a dále 3 cykly 2+5 (daunorubicin 50 mg/m2/den, den 1–2, a cytosina-rabinosid 200 mg/m2/den, den 1–5), udržovací terapie po 2,5 roku trvalým podáváním 6-merkaptopurinu (90 mg/m2/den) a metotrexátu (12 mg/m2/týden) s vložením cyklofosfamidu a metyl-gagu (obojí 400 mg/m2/den 1 a 8) každé 3 měsíce. Pokud došlo při terapii ATRA k leukocytóze, pak byl okamžitě vložen cyklus 4+7 z obavy před vznikem leukostázy, resp. ATRA syndromu, a tím pádem už nebyl podán v rámci konsolidace. Heparin či antifibrinolytika podávány nebyly, pouze byly prováděna transfuze trombocytů při jejich poklesu pod 30 × 109/l.
Všichni pacienti až na jednoho dosáhli CR (96 %), ale jen 14 pouze po ATRA. U 8 pacientů byla vložena chemoterapie 4+7 pro leukocytózu. U jednoho pacienta byla chemoterapie podána den 16 pro nulovou odpověď při ATRA. Jediný pacient, který nedosáhl CR, zemřel den 6 na krvácení do mozku při leukocytóze. Tři pacienti byli alogenně transplantováni před zahájením udržovací terapie a léčba dalších pacientů se lišila jen v detailech.
Úspěch studie nespočíval ve vysoké míře dosahování kompletních remisí, protože tento výsledek se nelišil od do té doby známých prací [66,67] a byl celkem očekávaný. Nejdůležitějším zjištěním byla nízká incidence relapsů, protože zrelabovali pouze 3 z celkem 25 pacientů a po 18 měsících bylo přežití bez známek choroby 87 %. Tento fakt vynikne rovněž při srovnání s předchozími výsledky léčby APL chemoterapií, kdy do 18 měsíců relabovaly přibližně 2/3 pacientů.
Na uvedenou pilotní studii navazovala v roce 1991 první velká muticentrická evropská studie nazvaná APL 91, opět pod vedením Pierra Fenauxe a Laurenta Degose [71].
Základním cílem studie bylo zjistit, jak zařazení ATRA do indukční terapie ovlivní léčebné výsledky u tentokrát neselektované skupiny pacientů, zařazeni byli tedy i pacienti se vstupní leukocytózou nad 10 × 109/l. Intenzita indukční a konsolidační chemoterapie byla snížena a design studie byl následující: v rameni chemoterapie byli pacienti léčeni indukcí typu 3+7 (CHT 1 – daunorubicin 60 mg/m2/den, den 1–3, a cytosin-ara-binosid 200 mg/m2/den, den 1–7) a následně konsolidací, nejprve opět režimem 3+7 (CHT 2) ve stejném složení jako indukce a následně režimem HAD (CHT 3 – cytosinarabinosid 1 000 mg/m2 každých 12 hod den 1–4 a daunorubicin 45 mg/m2/den, den 1–3).
V rameni ATRA bylo schéma chemoterapie stejné, pouze před první chemoterapií (CHT 1) byla podávána ATRA v dávce 45 mg/m2/den do dne 90 nebo do navození CR (podle toho, co nastalo dříve). Vzhledem ke známému riziku rozvoje ATRA syndromu z pilotní studie [69] byla v rameni ATRA nasazena chemoterapie 3+7 u pacientů se vstupní koncentrací leukocytů nad 5 × 109/l už ode dne 1 a dále při vzestupu leukocytů nad 6 × 109/l v den 5, nad 10 × 109/l v den 10 nebo nad 15 × 109/l v den 15 (bez vysazení ATRA).
U pacientů s poklesem ejekční frakce levé komory byl daunorubicin v konsolidaci nahrazen amsakrinem. Léčba koagulopatie byla založena na intenzivní substituci trombocytů s hranicí pro transfuzi 50 × 109/l v rameni chemoterapie a 30 × 109/l v rameni ATRA. Ostatní opatření (heparin, antifibrinolytika, plazma) nebyla pevně dána.
Původní plán bylo zařadit do studie 215 pacientů během necelých dvou a půl let. První předběžná analýza výsledků byla provedena v prosinci roku 1992 a dosažené výsledky tak přesvědčivě favorizovaly použití ATRA v indukci, že se ukázalo neetické ve studii dále pokračovat, a nábor pacientů byl předčasně ukončen. Nakonec tedy bylo do studie APL 91 zařazeno jen 101 pacientů s nově diagnostikovanou APL. V rameni ATRA dosáhlo remise 91 % pacientů oproti 81 % v rameni chemoterapie. Hlavní rozdíl mezi oběma skupinami spočíval v incidenci relapsů: bezpříznakové přežití (EFS) ve skupině ATRA bylo 91 % v 6 měsících a 79 % ve 12 měsících oproti skupině léčené pouze chemoterapií, kde EFS bylo v 6 měsících 76 % a ve 12 měsících 50 % (p = 0,001) (obr. 2).
![Rozdíl v přežití bez události (EFS) ve studii APL 91 podle Fenauxe [71].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/8ce33890ca618e902efdd33b988d9253.jpg)
Trend favorizující ATRA měl pravděpodobně kořeny především ve skutečnosti, že ve skupině léčené chemoterapií mělo 11 % pacientů rezistentní leukemii, kdežto v ATRA skupině se všichni pacienti dostali do remise. Na druhé straně se ukázalo, že samotná ATRA nesnížila časnou mortalitu, která se v obou skupinách shodně blížila 10 %. Přesto byla časná mortalita sama o sobě velmi nízká s ohledem na do té doby dosahované výsledky, což bylo pravděpodobně dáno politikou intenzivní substituce trombocytů.
Ze studie vyplynul jednoznačný závěr, že zařazení ATRA do úvodní terapie APL spolu s intenzivní konsolidační léčbou založenou na antracyklinech a cytosinarabinosidu znamenalo zásadní přínos pro pacienty díky prakticky neexi-stující rezistenci k terapii a výraznému snížení četnosti relapsů.
Vzápětí po ukončení studie APL 91 zahájila stejná skupina (European APL Group) další prospektivní randomizovanou studii nazvanou APL 93 [72]. Jejím cílem bylo zjistit, zda je výhodnější podávat ATRA současně s chemoterapií, nebo před chemoterapií. Dalším cílem bylo ověřit význam udržovací terapie. Indukční terapie byla tentokrát stratifikována podle věku a vstupní koncentrace leukocytů. Ve studii probíhající v letech 1993–1996 byl hodnocen léčebný efekt a přežití u 413 pacientů léčených pro APL v celkem 97 evropských centrech. Léčebné schéma určovalo léčbu pro seniory a pacienty s hyperleukocytózou a zahrnovalo 2 randomizace ostatních pacientů.
Pacienti ve věku ≤ 65 let se vstupní koncentrací leukocytů ≤ 5 × 109/l byli randomizováni do dvou skupin, ATRA → CHT a ATRA + CHT. Skupina ATRA → CHT dostávala ATRA 45 mg/m2/den do dne 90 nebo do navození CR (podle toho, co nastalo dříve) a v rámci indukce ještě následoval intenzivnější typ režimu 3+7 (daunorubicin 60 mg/m2/den, den 1–3, a cytosinarabinosid 200 mg/m2/den, den 1–7). Vzhledem k riziku rozvoje ATRA syndromu při vzestupu leukocytů byla chemoterapie podána i v případě, kdy došlo k vzestupu leukocytů nad 6 × 109/l v den 5, případně nad 10 × 109/l v den 10 nebo nad 15 × 109/l v den 15. Skupina ATRA + CHT dostávala ATRA ve stejném dávkování a režim 3+7 byl podán ode dne 3, kdy hlavním cílem dvoudenního podávání ATRA před chemoterapií byla korekce koagulopatie.
Pacienti se vstupní koncentrací leukocytů ≥ 5 × 109/l a rovněž pacienti ve věku nad 66 let randomizováni nebyli a dostávali stejnou terapii jako skupina ATRA + CHT. Pro léčbu koagulopatie byla používána substituce trombocytů s cílem držet jejich koncentraci v době koagulopatie ≥ 50 × 109/l, ostatní opatření (heparin, antifibrinolytika, plazma) nebyla pevně určena.
Všichni pacienti, kteří dosáhli CR, byli následně léčeni 2 cykly chemoterapie, nejprve režimem 3+7 a následovně režimem HAD (cytosinarabinosid 1 000 mg/m2 každých 12 hod den 1–4 a daunorubicin 45 mg/m2/den, den 1–3). Pacienti starší 66 let dostali pouze jednu konsolidační chemoterapii typu 3+7. Pacienti, kteří zůstávali po konsolidaci v CR, byli opět randomizováni, tentokrát do 4 skupin: pouze sledování bez udržovací terapie, udržovací chemoterapie (metotrexát a 6-merkaptopurin), intermitentní podávání ATRA a konečně intermitentně ATRA + chemoterapie.
Celkově bylo ve studii APL 93 do-saženo velmi dobrých výsledků, 92 % pacientů dosáhlo kompletní hematologické remise, bylo zaznamenáno 31 časných úmrtí a z toho pouze 10 pacientů zemřelo na intrakraniální krvácení – tedy výrazný pokrok oproti dřívějším výsledkům při klasické intenzivní léčbě chemoterapií. ATRA syndrom byl příčinou úmrtí u 5 pacientů, opět pravděpodobně díky dobrému designu studie, kdy reakcí na narůstající koncentraci leukocytů byla aplikace chemoterapie.
Typ indukční terapie neměl zásadní vliv na dosažení kompletní remise, které ve skupině ATRA → CHT dosáhlo 94 % a ve skupině ATRA + CHT 95 % pacientů. Rozdíl však byl v incidenci relapsů, která dosáhla ve 2 letech od diagnózy 6 % ve skupině ATRA + CHT oproti 16 % ve skupině ATRA → CHT (p = 0,04).
Studie APL 93 přinesla následující závěry: CR bylo s výjimkou 1 pacienta dosaženo u všech pacientů, kteří přežili indukční terapii. CR lze tedy dosáhnout u více než 90 % pacientů s APL, pokud je v indukci použita kombinace ATRA a chemoterapie. Zařazení chemoterapie do indukce v případech, kdy je přítomná nebo se objeví leukocytóza, snižuje časnou mortalitu v důsledku krvácení a ATRA syndromu. Pokud by se podařilo časnou mortalitu dále snížit, výsledky indukční léčby by byly ještě lepší. Byl potvrzen význam udržovací terapie, zdaleka nejlepší výsledky byly dosaženy ve skupině kombinované udržovací terapie (kontinuální chemoterapie plus intermitentní ATRA), kde do 2 let zrelabovalo pouze 6 ze 74 pacientů. Nejvíce profitovala z kombinované udržovací terapie skupina pacientů s leukocytózou (tedy indukce ATRA + CHT), kdy s touto udržovací terapií zrelabovali jen 3 pacienti (10 %), kdežto bez udržovací terapie zrelabovalo 54 %, s ATRA 37 % a s CHT 24 % pacientů.
ATRA syndrom byl zaznamenán u 15 % pacientů a na rozdíl od jiných autorů [73] nebyl nalezen jasný prediktivní faktor pro jeho rozvoj (včetně leukocytózy).
O dosažených výsledcích ve studii APL 93 autoři referovali ještě na sjezdu Americké hematologické společnosti (ASH – American Society of Hematology) v roce 2003. Celkem bylo do studie zařazeno 576 pacientů a 533 (92,5 %) dosáhlo CR. Zrelabovalo 134 pacientů (23,3 %) v rozmezí od 5 do 98 měsíců. Rovněž tato pozdní analýza ukázala, že časná kombinace ATRA s chemoterapií (skupina ATRA + CHT) signifikantně snižuje počet relapsů v 5 letech (12 % oproti 19 % ve skupině ATRA → CHT, p = 0,04), vliv na celkové přežití se neprokázal (84 vs 77 %, p = 0,29). Celkové výsledky jsou však při vysoké míře dosahování CR ovlivněny spíše udržovací terapií, přičemž výskyt relapsů během 5 let po dosažení CR byl 39 %, 29 %, 24 % a 13 % (nic, ATRA, CHT, ATRA + CHT). Zajímavým zjištěním bylo také to, že udržovací terapie (zejména typu ATRA + CHT, viz výše) sice zredukovala výskyt relapsů v 18 měsících, ale nijak nezměnila incidenci pozdních relapsů. Pozornost ještě zasluhuje fakt, že vzhledem k výskytům pneumocystové pneumonie v době udržovací terapie autoři doporučovali profylaxi pneumocystové infekce i v době udržovací terapie [74].
ATRA se samozřejmě testovala i ve Spojených státech amerických. Frankel et al [75] z Memorial Sloan-Kettering Cancer Center v New Yorku publikovali výsledky dosažené při použití ATRA jako indukční terapie v letech 1990–1992. ATRA v monoterapii po-dali 56 pacientům, z nichž bylo nakonec 5 vyřazeno pro nepotvrzení t(15;17) a diagnózu jiné AML. Hodnoceno nakonec bylo 30 pacientů s relapsem APL po předchozí chemoterapii a 21 nemocných s nově diagnostikovanou APL. Koagulopatie byla korigována plazmou a trombocyty, heparin používán nebyl. Největším problémem byl rozvoj ATRA syndromu, který se rozvinul u 41 % (!) pacientů, z toho u 13 pacientů (23 %) byla naplněna všechna arbitrární kritéria (horečka, dušnost, intersticiální plicní infiltráty, pleurální výpotek a nárůst hmotnosti) a u 10 pacientů byl rozvoj ATRA syndromu hodnocen jako nejistý. Nicméně 8 pacientů vyžadovalo léčbu na jednotce intenzivní péče včetně intubace a řízené ventilace a ATRA syndrom byl příčinou úmrtí 5 pacientů. Leukocytóza se ukázala být dobrým prediktivním znakem rozvoje ATRA syndromu, i když ne jednoznačným – 3 pacienti s jistým ATRA syndromem neměli leukocytózu před zahájením terapie a ani v jejím průběhu. Přesto byl u pacientů s rozvojem leukocytózy nasazen cytosinarabinosid (5 pacientů) nebo byly prováděny leukaferézy (5 pacientů) a při prvních známkách dušnosti byl nasazen dexametazon.
Kompletní remise dosáhlo 86 % pacientů. U nově diagnostikovaných pacientů byly následně podány konsolidační terapie založené na kombinaci cytosinarabinosidu a idarubicinu nebo daunorubicinu. Medián doby do relapsu přesáhl 28 měsíců a přes krátkou dobu sledování šlo o lepší výsledky než u historické kontroly (80 pacientů léčených na stejném pracovišti pouze chemoterapií v uplynulých 15 letech, střední doba do relapsu 22 měsíců a medián přežití 17 měsíců). Na druhé straně byla u 13 pacientů ATRA po-užita bez konsolidace jako udržovací terapie po dosažení kompletní remise a až na 1 pacientku všichni zrelabovali do 10 měsíců od zahájení terapie. Šlo o další důkaz, že ATRA v monoterapii není schopna u drtivé většiny pacientů udržet dlouhodobě remisi APL.
Vzápětí byla pod záštitou ECOG zahájena velká multicentrická prospektivní randomizovaná studie North American Intergroup APL Trial 1992 pod vedením Martina Tallmana z Chicaga. Tato studie si kladla za cíl především srovnat frekvenci kompletních remisí, celkové přežití a přežití bez známek choroby u pacientů léčených ATRA a konvenční chemoterapií. Dalším cílem bylo posoudit význam udržovací terapie [76].
Pacienti byli randomizováni do ramene ATRA a ramene chemoterapie (CHT). Jako indukční terapie byla v 1. skupině použita pouze ATRA v obvyklé dávce 45 mg/m2/den, ve 2. skupině byl zvolen indukční režim 3+7 v nižších dávkách (daunorubicin 45 mg/m2/den, den 1–3, cytosinarabinosid 100 mg/m2/den, den 1–7). U pacientů randomizovaných do ramene ATRA se vstupní leukocytózou nad 10 × 109/l byla nejprve podávána hydroxyurea jako cytoredukce. Při dosažení CR byly podány 2 cykly konsolidační chemoterapie (3+7 ve stejném dávkování jako při indukci a HAD, tedy cytosinarabinosid 2 g/m2 každých 12 hod den 1–4 a daunorubicin 45 mg/m2/den, den 1–2). Pacienti, u kterých po ukončení konsolidační terapie trvala kompletní remise, byli opět randomizováni: buď do ramene udržovací terapie ATRA denně po dobu 1 roku, nebo do ramene sledování bez terapie. Studie nedávala žádná závazná doporučení stran léčby koagulopatie. Pokud se při indukci v rameni ATRA objevila v průběhu léčby hyperleukocytóza nad 30 × 109/l, byla nasazena hydroxyurea a podávání ATRA bylo přerušeno do doby poklesu leukocytů pod 10 × 109/l.
Nábor do studie probíhal v letech 1992–1995 a celkem byly vyhodnoceny léčebné výsledky u 346 pacientů. 15 pacientů ze skupiny ATRA bylo nakonec léčeno chemoterapií, buď pro ATRA toxicitu včetně ATRA syndromu, nebo pro rezistentní chorobu. ATRA syndrom byl pozorován u 8 pacientů (4,6 %), 2 pacienti tuto komplikaci nepřežili. U 4 pacientů byla choroba hodnocena jako ATRA rezistentní, z toho u 3 pacientů nebyla prokázána typická aberace t(15;17). Jeden pacient s ATRA rezistentní APL měl t(11;17), z dnešního pohledu tedy šlo pravděpodobně o variantu s fúzním genem PLZF/RARα, která je ATRA rezistentní.
Časná mortalita (do dne 28) se v obou skupinách statisticky nelišila (12,4 %, tedy 43 pacientů) stejně jako incidence závažného krvácení, pouze bylo více závažných infekčních komplikací ve skupině léčené chemoterapií (52 vs 25 %). Hyperleukocytóza nad 30 × 109/l byla zaznamenána u celkem 59 pacientů (34 %) léčených ATRA a 45 pacientů (26 %) rozvinulo ATRA syndrom, který byl nakonec u 2 pacientů fatální. Plnou konsolidační terapii dokončilo 229 pacientů a 199 pacientů bylo randomizováno pro udržovací terapii (94 pacientů) nebo pro sledování (105 pacientů).
V rameni ATRA dosáhlo CR 72 % a v ra-meni CHT 69 % pacientů (p = 0,56). Přežití bez známek choroby už ale bylo významně lepší v ATRA skupině, kdy zrelabovalo pouze 36 pacientů oproti 70 relapsům ve skupině léčené chemoterapií (p < 0,001, medián sledování 30 měsíců). Převedeno do jiného pohledu, po indukci s ATRA bylo 3leté přežití bez známek choroby 67 % oproti 32 % v rameni chemoterapie. Podobné výsledky přineslo hodnocení efektu udržovací terapie: bez ohledu na typ indukce bylo 3leté přežití bez známek choroby od zahájení udržovací terapie ve skupině ATRA 65 % oproti 40 % ve skupině bez terapie (p < 0,001).
Při analýze kombinace indukce a udržovací terapie vyplynulo, že do 3 let zrelabovalo pouze 22 % pacientů, kteří dostali ATRA jak v indukci, tak v udržovací terapii, kdežto ve skupině léčené pouze chemoterapií zrelabovalo více než 76 % pacientů.
Při celkovém vyhodnocení studie bylo evidentní, že význam ATRA v terapii APL spočívá především ve snížení incidence relapsů, a tato výhoda je ještě výraznější při zařazení ATRA do udržovací terapie. Výsledky léčby samotnou chemoterapií bez udržovací terapie byly až překvapivě špatné, celkové přežití ve 3 letech od diagnózy bylo pouze 18 %.
Tallman et al informovali ještě jednou o dosažených výsledcích ve studii North American Intergroup APL Trial 1992 v roce 2002, tentokrát z po-hledu dlouhodobého sledování [77]. Vý-sledky nadále jednoznačně hovořily pro zařazení ATRA do indukce i udržovací terapie. Přežití bez známek nemoci bylo v 5 letech od diagnózy následující: chemoterapie a sledování 16 %, chemoterapie a udržovací terapie ATRA 47 %, ATRA a sledování 55 % a konečně ATRA v indukci i udržovací terapii 74 %. Celkové přežití a bezpříznakové přežití v 5 letech od diagnózy bez ohledu na udržovací terapii také vyznělo ve prospěch ramene s ATRA a dosáhlo 69 % a 69 % oproti 29, resp. 45 % v ramenu chemoterapie.
Na začátku 90. let 20. století byla testována ATRA v léčbě APL i v Japonsku. Pod záštitou JALSG (Japan Adult Leukemia Study Group) proběhla v letech 1992–1993 multicentrická studie AML-92. Schéma bylo poměrně jednoduché – jako základní indukční léčba byla zvolena monoterapie ATRA, pokud však měli pacienti při diagnóze koncentraci leukocytů vyšší než 3 × 109/l, ATRA byla v úvodu doplněna chemoterapií typu 3+5 (daunorubicin 40 mg/m2/den po 3 dny a cytosinarabinosid 200 mg/m2/den po 5 dní). Stejná chemoterapie byla podána i v průběhu indukce, pokud došlo při podávání ATRA k vzestupu koncentrace promyelocytů a blastů v periferní krvi nad 1 × 109/l. Monoterapii ATRA v indukci nakonec dostalo pouze 26 % z celkem 110 pacientů zařazených do studie. Přestože dávky antracyklinu byly dosti nízké, 89 % pacientů dosáhlo kompletní remise a ve skupině pacientů pod 40 let věku to bylo dokonce 98 %. Mezi ATRA a ATRA + chemoterapie nebyl shledán ve frekvenci dosahování remisí rozdíl. ATRA syndrom se v této studii, pravděpodobně díky včasnému nasazení chemoterapie, objevil pouze u 7 pacientů (6 %) a jen 1 pacient v důsledku ATRA syndromu a hyperleukocytózy zemřel. Při srovnání s předchozí studií AML-89, která byla zaměřena na léčbu APL kombinovanou chemoterapií (daunorubicin, cytosinarabinosid, 6-merkaptopurin a prenisolon) bez použití ATRA, výsledky jasně a signifikantně favorizovaly použití ATRA v indukci APL, protože ve studii AML-89 dosáhlo remise 71 % pacientů a do dne 28 zemřelo 21 % pacientů [78].
Italská cesta k indukční terapii AIDA
Italové zvolili poněkud odlišnou cestu. Od roku 1967 bylo jasné, že APL je velmi citlivá na terapii antracykliny. Již dříve citovaná práce Bernarda et al [2] popisovala velmi dobré výsledky při použití monoterapie daunorubicinem v poměrně vysokých dávkách (4 × 60 mg/m2) při indukci u APL s dosažením 55 % kompletních remisí, které trvaly i více než 4 roky. Význam antracyklinů a jejich dávky byl posléze potvrzen při analýze výsledků dosažených při léčbě pacientů s AML v rámci SWOG v letech 1982 až 1986 a 1986–1991 [79]. Autoři zjistili, že při léčbě APL v rámci SWOG bylo v letech 1982–1986 dosahováno významně lepších výsledků než v letech 1986–1991: kompletních remisí bylo v letech 1982–1986 dosaženo u 71 % pacientů s APL oproti 54 % u ne-APL pacientů, kdežto v letech 1986–1991 to bylo pouze 47 % oproti 55 % u ne-APL pacientů. Při vzájemném srovnání lé-čebných výsledků u obou skupin pa-cientů s APL (tedy léčených v letech 1982–1986 a 1986–1991) autoři konstatovali, že u dříve léčených pacientů bylo dosaženo nejen signifikantně vyššího počtu kompletních remisí, ale i delšího celkového přežití a přežití bez známek choroby. Hlubší analýza ukázala, že hlavními faktory ovlivňujícími dosažení CR a přežití jsou vstupní koncentrace trombocytů, vstupní koncentrace leukocytů a především celková dávka daunorubicinu použitá v indukci. Při dávce daunorubicinu 180–210 mg/m2 dosáhlo po jednom cyklu chemoterapie CR 57 % pacientů, ale jen 30 % pacientů po dávce 40 až 135 mg/m2. Vyšší dávka daunorubicinu dokonce pozitivně ovlivnila i mortalitu pacientů, kteří po první indukci nedosáhli remise: při vyšším dávkování daunorubinu zemřelo před reindukcí 14 % těchto pacientů, kdežto při nižších dávkách daunorubicinu to bylo již 31 % pacientů. Celkové i bezpříznakové přežití také významně narůstalo s vyšší dávkou daunorubicinu (p = 0,001). Dávkování cytosinarabinosidu v indukci přitom léčebné výsledky neovlivnilo, naopak, vysoké dávky cytosinarabinosidu při konsolidaci měli na přežití spíše negativní vliv (p = 0,061 pro celkové přežití, p = 0,026 pro přežití bez známek nemoci). Dávkování daunorubicinu použité v konsolidační terapii nemělo na přežití vliv [79].
Italská skupina GIMEMA (Gruppo Italiano Malattie Ematologiche dell’Adulto) se vzhledem k významné akutní i chronické kardiotoxicitě daunorubicinu rozhodla použít u APL idarubicin, a to v monoterapii. Vzhledem k deklarované menší kardiotoxicitě idarubicinu zvolili dosti vysokou dávku, a 27 pacientů tak dostávalo 12 mg/m2/den po 6 dní. Na rozdíl od v té době zavedené praxe nebyl podáván heparin, ale pacienti dostávali prvních 7 dní terapie kontinuálně antifibrinolytikum – kyselinu tranexamovou. Toxicita vysokých dávek idarubicinu byla únosná a účinnost vysoká: 22 pacientů (81 %) dosáhlo kompletní remise, pouze u 1 pacienta bylo onemocnění hodnoceno jako rezistentní a 3 pacienti (15 %) zemřeli pro komplikace během indukce [80].
Tyto výsledky byly tak dobré, že v roce 1989 skupina GIMEMA iniciovala multicentickou studii LAP 0389, která si kladla za cíl porovnat efektivitu indukční terapie u APL s použitím idarubicinu v monoterapii a v kombinaci s cytosinarabinosidem. Dalším cílem bylo posoudit význam udržovací terapie, a pacienti byli tedy randomizováni 2krát. Věk pacientů byl omezen na rozpětí 12–62 let a do studie byli zařazeni pouze pacienti s APL standardního typu M3, pacienti s mikrogranulární variantou do ní zařazováni nebyli.
První randomizace byla pro indukční terapii, pacienti v ramenu A byli léčeni idarubicinem v dávce 60 mg/m2 (tedy 10 mg/m2/den, den 1–6), pacienti v ramenu B idarubicinem 48 mg/m2 (12 mg/m2/den, den 1–4) v kombinaci s cytosinarabinosidem (200 mg/m2/den, den 1–7). Konsolidační léčba byla v obou ramenech shodná a byla dosti intenzivní: 3 cykly kombinované léčby, tedy idarubicin + cytosinarabinosid, mitoxantron + etoposid, idarubicin + cytosinarabinosid + 6-thioguanin. Následovala 2. randomizace na skupinu bez udržovací terapie a skupinu, kde pacienti užívali po 2 roky me-to-trexát a 6-merkaptopurin.
Vyhodnocení studie zahrnovalo 257 pacientů registrovaných v letech 1989–1993. Mezi skupinou A (idarubicin) a skupinou B (idarubicin + cytosinarabinosid) nebyly zjištěny statisticky významné rozdíly v dosažení kompletní remise (76,3 vs 66,6 %), rezistenci k terapii (8,4 vs 11,9 %) a ani v časné mortalitě (15,3 vs 21,4 %). Ve skupině B bylo signifikantně více fatálních krvácení (16 vs 7, p < 0,05), výskyt ostatních nežádoucích účinků byl v obou skupinách přibližně stejný. Celkem 38 pacientů nedokončilo intenzivní konsolidační chemoterapii, obvykle z důvodu toxicity, a před udržovací terapií bylo nakonec randomizováno pouze 116 pacientů. Na rozdíl od jiných studií nepřinesla udržovací terapie zlepšení v přežívání pacientů a rovněž nebyly zjištěny statisticky významné rozdíly v přežití mezi skupinami pacientů randomizovaných do udržovací terapie a sledování. Ačkoli nebyl zjištěn signifikantní rozdíl v celkovém přežití mezi pacienty v obou ramenech indukční terapie, bezpříznakové přežití (EFS – event-free survival) vyznělo ve prospěch monoterapie idarubicinem v indukci hypergranulární APL a EFS v 8 letech po diagnóze v rameni idarubicinu bylo 35 % oproti 23 % v rameni idarubicin + cytosinarabinosid (p < 0,05) [81].
Studie LAP 0389 poskytla 2 velmi důležité závěry:
- Idarubicin je velmi účinný v terapii APL a jeho kardiotoxicita je ve srovnání s daunorubicinem nižší. Tento závěr později potvrdila analýza léčby dětí ve studii 0493 [82], v níž se symptomatická, antracykliny způsobená kardiotoxicita nerozvinula u žádného ze 101 dlouhodobě přežívajících dětí.
- Kombinace idarubicinu s cytosinarabinosidem nepřinesla přídavný efekt ve zlepšení léčebných výsledků. Naopak, v rameni kombinované chemoterapie bylo signifikantně více fatálních krvácení.
Této studii však lze jistě vytknout její design, protože srovnání idarubicin vs idarubicin + cytosinarabinosid nebylo zcela čisté kvůli dávce idarubicinu v monoterapii vyšší o 25 % než v rameni indukce kombinovanou chemoterapií. Studie LAP 0389 nicméně poskytla vodítka pro návrh nové indukční terapie pro léčbu APL postavené na kombinaci ATRA s idarubicinem.
Tato nová indukční terapie, dnes známá pod líbivou a poetickou zkratkou AIDA (ATRA + IDArubicin), začala být podávána u nově diagnostikovaných pacientů již v březnu roku 1993, tedy ještě v době, kdy byla studie LAP 0389 aktivní. Design této pilotní studie [83], provedené na 20 pacientech, zahrnoval ještě opět 3 cykly poměrně intenzivní konsolidační léčby, která již cytosinarabinosid zahrnovala, protože v té době bylo nemyslitelné úplné vypuštění tohoto základního léku z terapie akutní myeloidní leukemie. Dávky cytosinarabinosidu byly navíc v konsolidaci nemalé, první cyklus 4 dny vždy 1 g/m2 + idarubicin a 3. cyklus 5 dní vždy 450 mg/m2. Druhý cyklus kombinoval mitoxantron a etoposid. Při prvních známkách ATRA syndromu, který se nakonec objevil u 2 pacientů (10 %), byla ATRA přerušena a byl podáván dexametazon. Důraz na substituci trombocytů nebyl tak velký jako v předchozích studiích, udržovaly se nad 20 × 109/l nebo byly podávány při krvácivých projevech a léčba koagulopatie spočívala především v kontinuálním podávání antifibrinolytik (kyselina tranexamová 100 mg/kg/den u 70 % pacientů) bez použití heparinu.
Výsledky této pilotní studie byly velmi dobré, přestože ATRA nebyla součástí ani konsolidační, ani udržovací terapie. Osmnáct pacientů (90 %) dosáhlo kompletní hematologické remise, 1 pacient zemřel na aspergilovou myokarditidu a 1 na masivní hemoptýzu. Po ukončení konsolidační terapie zrelabovali celkem 4 pacienti, u 3 bylo dosaženo 2. remise a pouze 1 zemřel v relapsu. Tato studie také poprvé zavedla monitorování kvality remisí pomocí RT-PCR analýzy pozitivity PML/RARα v kostní dřeni. Data získaná PCR analýzami bylo možné zhodnotit u 16 pacientů. Ze 4 pacientů, kteří zrelabovali, předcházela PML/RARα pozitivita hematologickému relapsu přibližně o 2–3 měsíce. Celkové pře-žití souboru všech 20 pacientů při sledování od 24 do 31 měsíců (medián 27) bylo 85 % a bezpříznakové přežití 69 %, 17 pacientů bylo tedy stále naživu a v molekulární remisi nemoci. Studie dále konstatovala, že dosažení molekulární remise po dokončení kon-solidační léčby je pravděpodobně podmínkou dlouhodobé kompletní remise [83].
Léčebné výsledky dosažené ve studii LAP 0389 a úspěch kombinované AIDA indukce byly dobrým základem pro zahájení velké studie, která měla být prospektivní, multicentrická a bez omezení věku. GIMEMA se proto spojila s italskou skupinou pediatrické hematologie a onkologie, AIEOP (Associazione Italiana di Ematologia ed Oncologia Pediatrica), a v roce 1993 tak odstartovala studie AIDA 0493.
Cílem studie bylo potvrdit výsledky LAP 0389 a zjistit, jak ovlivňuje do-sažení negativity PML/RARα po ukončení konsolidační léčby celkové přežití a výskyt relapsů. Schéma léčby bylo téměř stejné jako v předchozí pilotní studii, indukce typu AIDA, u pacientů mladších 20 let byla ATRA redukovaná pro obavu ze syndromu benigní nitrolební hypertenze (pseudotumor cerebri) na 25 mg/m2/den, 3 konsolidace stejně jako v LAP 0389. Pacienti v molekulární remisi po 3. konsolidaci byli randomizováni do čtyř ramen udržovací terapie: ATRA, chemoterapie (6-MP a MTX), alternující ATRA a chemoterapie, sledování bez udržovací léčby. Pacienti, kteří po konsolidaci zůstávali PML/RARα pozitivní, byli směřovaní do alogenní transplantace.
Velká pozornost byla v této studii věnována ATRA syndromu, který byl definován dle Frankela et al [75], a při jeho prvních známkách bylo přerušeno podávání ATRA a nasazen dexametazon.
První hodnocení dosažených vý-sledků studie AIDA 0493 bylo publikováno v roce 1997 [84]. Vzhledem ke krátké době sledování však nemohl být zatím hodnocen význam udržovací terapie pro přežívání pacientů a výskyt relapsů. Léčbu podle protokolu AIDA 0493 v letech 1993 až 1996 zahájilo 240 pacientů ve věku od 2 do 74 let, mikrogranulární variantu APL mělo 12,6 % pacientů. Indukci dle protokolu dokončilo 95 % pacientů a všichni dosáhli kompletní hematologické remise, rezistentní leukemie nebyla zaznamenána, 11 pacientů (5 %) zemřelo během indukce, z toho 8 na intrakraniální krvácení. Další 3 pacienti zemřeli na intrakraniální krvácení ještě před zahájením terapie. Rozvoj ATRA syndromu byl považován za jistý u 6 pacientů (2,5 %), pouze 1 pacient v důsledku ATRA syndromu zemřel, dalších 11 pacientů mělo neúplnou symptomatologii a ATRA syndrom se s jistotou nerozvinul u 93 % pacientů. Molekulární remise dosáhlo po indukci 61,5 % z hodnocených pacientů, ze zbývajících 55 pacientů (39,5 %) s PCR pozitivitou dosáhlo molekulární remise po dokončení konsolidační léčby 52 pacientů, pouze 3 nemocní byli nadále PCR pozitivní a byli alogenně transplantováni. Zrelabovalo pouze 17 pacientů (od 5 do 20 měsíců po dosažení hematologické remise) a celkové přežití v 1 roce dosáhlo 90 % a ve 2 letech 87 %. Bezpříznakové přežití se mezi skupinou pacientů, kteří po indukci dosáhli a nedosáhli PCR negativity, statisticky nelišilo a v celém souboru dosáhlo v 1 roce od dosažení remise 83 %, ve 2 letech pak 79 %.
Z těchto prvních výsledků jasně vyplývalo, že indukční terapie typu AIDA, tedy kombinace ATRA a současné cytotoxické léčby v podobě idarubicinu v monoterapii, je vysoce účinná. Indukce typu AIDA navíc přináší další výhody, protože ATRA rychle potlačuje koagulopatii, a její podávání tak snižuje incidenci fatální intrakraniální hemoragie a časné podání idarubicinu zase snižuje pravděpodobnost rozvoje ATRA syndromu. Rozvoj ATRA syndromu byl kromě prvních čínských studií největším problémem podávání ATRA v indukci, kdy jeho incidence dosahovala 25 % a byl spojen s vysokou mortalitou. Navíc se dexametazon ukázal být velmi cenným lékem a také díky jeho okamžitému nasazení při prvních známkách ATRA syndromu byla tato komplikace ve studii AIDA 0493 příčinou smrti pouze u 1 pacienta. Význam dosažení molekulární remise se nepodařilo objasnit ze 3 důvodů:
- Kromě 3 pacientů dosáhli všichni nemocní, kteří dokončili konsolidační léčbu, PCR negativity PML/RARα při senzitivitě PCR metody 10–4, a nedošlo tedy k potřebné stratifikaci sou-boru na PCR pozitivní a negativní.
- Všichni 3 pacienti, kteří nedosáhli po konsolidacích PCR negativity, byli alogenně odtransplantováni.
- Všech 17 pacientů, kteří zrelabovali, bylo původně po konsolidacích PCR negativních.
Avvisati et al informovali [85] o výsledcích studie LAP 0493 znovu v roce 2003. Kompletní remise dosáhlo po indukci typu AIDA 761 z celkem 807 dospělých pacientů (94,3 %), 44 pacientů zemřelo během indukční terapie (5,45 %) a pouze 2 pacienti měli rezistentní leukemii (0,25 %). Na krvácivé komplikace během in-dukce zemřelo 17 pacientů, pouze u 3 pacientů byl příčinou úmrtí tromboembolizmus – což je v určitém rozporu s některými názory, podle kterých je trombóza u APL významnou morbiditou a je také důležitou příčinou mortality [86,87]. Ze 664 pacientů testovaných na PML/RARα dosáhlo 646 (97,3 %) po konsolidacích negativity, pouze u 18 pacientů (2,7 %) přetrvávala pozitivita PML/RARα. Od ledna roku 1998 byli oproti původnímu záměru pacienti, kteří po konsolidacích dosáhli negativity PML/RARα (268 pacientů), randomizováni pouze do 2 ramen udržovací terapie, ATRA nebo chemoterapie + ATRA. Nejzajímavější je pravděpodobně fakt, že se v této studii nepodařilo prokázat rozdíl v trvání molekulární remise mezi pacienty, kteří dosáhli po konsolidacích molekulární remise a byli randomizováni pro udržovací terapii jak do ledna roku 1998, tak po lednu roku 1998. Jinými slovy, z výsledků studie LAP 0493 vyplývá, že pro pacienty, kteří po konsolidacích dosáhli molekulární remise choroby, je udržovací terapie zbytečná a nepřináší dodatečný pozitivní efekt.
Jak již bylo uvedeno výše, italský protokol nebyl použit pouze u dospělých pacientů. Z celkem 983 pacientů léčených protokolem LAP 0493 v letech 1993–2000 bylo 124 pacientů mladších 18 let. U těchto pacientů bylo dávkování ATRA redukováno na 25 mg/m2/den. Ze 107 pacientů, kteří nakonec absolvovali indukci typu AIDA, dosáhlo 96 % kompletní remise a pouze 4 děti zemřeli na komplikace. ATRA syndrom měli 2 pacienti, ostatní výrazné nežádoucí účinky ATRA včetně pseudotumor cerebri se objevily u 10 dětí. Dlouhodobé výsledky jsou také vynikající, celkové přežití v 10 letech je 89 % a ve skupině dětí s nízkým rizikem dle Sanze (leukocyty < 10 × 109/l a trombocyty > 40 × 109/l v době stanovení diagnózy) bylo přežití v 10 letech 100 % [82,88].
V roce 1993 odstartovala také britská studie MRC, která si kladla za cíl zjistit, zda 5denní podávání ATRA před zahájením indukční chemoterapie sníží výskyt hemoragických komplikací vyplývajících z koagulopatie doprovázející APL a zda cytoredukce vyplývající z chemoterapie podávané současně s ATRA na začátku indukce sníží výskyt ATRA syndromu [89]. Pacienti byli proto randomizováni do 2 ramen. V rameni „dočasná ATRA“ dostávali ATRA 45 mg/m2/kg 5 dní před zahájením chemoterapie, pokud však koncentrace leukocytů dosáhla 25 ×109/l, byla chemoterapie podána ihned. V rameni „dlouhodobá ATRA“ byla ATRA ve stejné dávce podávána od 1. dne indukce současně s chemoterapií do dosažení remise nebo do dne 60, podle toho, co nastane dříve. Typy indukční chemoterapie se lišily podle věku pacientů a odpovídali protokolům MRC AML 10, MRC AML 11 a MRC AML 12, které jsou popsány jinde [89]. Pro jejich složitější schéma je zde nebudeme uvádět, ale byly opět založeny na kombinaci daunorubicinu nebo mitoxantronu s cytosinarabinosidem (DAT, ADE, MAE, MAC). Výsledky studie tentokrát vycházely z analýzy na bázi intent-to-treat.
Celkem bylo do studie v letech 1993–1997 zařazeno 239 pacientů a medián sledování byl 41 měsíců. V rameni „dočasná ATRA“ byla u 36 % pacientů podána chemoterapie dříve než 5. den a v rameni „dlouhodobá ATRA“ bylo u 12 % pacientů zahájeno podávání ATRA 1–3 dny před chemoterapií. Studie jednoznačně potvrdila význam podávání ATRA po celou dobu indukce. V rameni s dlouhodobým podáváním ATRA bylo méně rezistentních leukemií (2 % oproti 7 %, p = 0,03), menší mortalita během indukce (12 % oproti 23 %, p = 0,02) a 87 % pacientů dosáhlo kompletní remise oproti 70 % pacientů v rameni s krátkodobým podáváním ATRA (p < 0,001). Statistická analýza potvrdila, že tyto rozdíly nebyly ovlivněny typem indukční chemoterapie.
Největší dopad na prognózu pacientů měla vstupní koncentrace leukocytů a překročení hodnoty 10 × 109/l znamenalo jednoznačně horší prognózu. Kompletní remise dosáhlo 85 % pacientů s leukocyty pod 10 × 109/l a pouze 62 % pacientů s leukocyty nad 10 × 109/l a v rameni dlouhodobého podávání ATRA dokonce 94 % pacientů s leukocyty pod 10 × 109/l a pouze 76 % pacientů s leukocyty nad 10 × 109/l (p < 0,001). Mortalita v době indukce byla signifikantně menší v rameni „dlouhodobá ATRA“, kde bylo zaznamenáno 14 úmrtí oproti 27 ve 2. rameni (p < 0,02), a rovněž výskyt ATRA syndromu byl v této skupině pacientů menší a byl příčinou smrti pouze u 1 pacienta oproti 4 pacientům v rameni „dočasná ATRA“. Další hodnocení léčebné odpovědi vždy favorizovaly rameno „dlouhodobá ATRA“ a skupinu pacientů se vstupní koncentrací leukocytů menší než 10 × 109/l: celkové přežití ve 4 letech od diagnózy 71 % vs 52 % (všichni) a 80 % vs 57 % (leu < 10 × 109/l), riziko relapsu 20 % vs 36 % (všichni) a 13 % vs 35 % (leu < 10 × 109/l), přežití bez známek nemoci 4 roky od remise 72 % vs 59 % (všichni) a 77 % vs 59 % (leu < 10 × 109/l). Výsledky celé studie byly bohužel do určité míry zkresleny, protože vstupním kritériem byla morfologická diagnóza APL a dle molekulárně genetických vyšetření téměř 10 % pacientů (21 z 239) nemělo diagnózu APL, ale jiné typy AML.
Zajímavé, ale z větší části očekávané výsledky přinesla také studie německé skupiny (German AML Cooperative Group) pod vedením Edmunda Lengfeldera [90]. V této prospektivní studii bylo mimo jiné cílem ověřit, zda intenzifikovaná úvodní léčba zahrnující vysokodávkovaný cytosinarabinosid a ATRA bude mít vliv na rychlost dosažení molekulární remise. Do studie bylo v letech 1994–1999 zařazeno celkem 51 pacientů, z nichž 92 % dosáhlo CR, časná mortalita dosáhla 8 %. Již po indukční léčbě bylo dosaženo 91 % molekulárních remisí (z 32 vyhodnotitelných pacientů) a incidence relapsů ve 2 letech byla menší než 10 %.
Španělské zkušenosti a konsolidace dle rizika
V roce 1996 zahájila španělská skupina PETHEMA (Programa de Estudio y Tratamiento de las Hemapatías Malignas) novou klinickou studii nazvanou LPA96, jejíž protokol vycházel z velké části z italských zkušeností. Předchozí klinické studie jednoznačně nepotvrdily pozitivní efekt cytosinarabinosidu ani etoposidu, a tato cytostatika proto nebyla zařazena do léčebného schématu. Základním vstupním kritériem byla diagnóza PML/RARα pozitivní APL. Jako indukční terapie byla zvolena AIDA, tedy ATRA a idarubicin. Pacienti, kteří dosáhli hematologické remise onemocnění, byli následně léčeni 3 cykly konsolidační chemoterapie bez ATRA: idarubicin 5 mg/m2 po 4 dny jako 1. cyklus, mitoxantron 10 mg/m2 po 5 dní jako 2. cyklus a idarubicin 12 mg/m2 1 den jako 3. cyklus. U pacientů, kteří po 3 cyklech konsolidace dosáhli molekulární remise, byla po 2 roky podávána udržovací terapie v nyní už klasickém schématu, tedy ATRA 15 dní každé 3 měsíce + kontinuální 6-merkaptopurin a metotrexát.
V letech 1996–1999 bylo do této studie zařazeno celkem 123 vyhodnotitelných pacientů, z nichž 89 % dosáhlo kompletní remise choroby. Ze 14 pacientů, kteří remise po indukci nedosáhli, celkem 12 zemřelo pro komplikace a pouze u 2 pacientů šlo o rezistentní chorobu. ATRA syndrom byl hodnocen jako jistý u 7 pacientů (6 %) a 1 pacient pro tuto komplikaci zemřel. Sanz et al v roce 1999 uvedli, že molekulární odpověď byla do té doby vyhodnocena u celkem 88 pacientů, z nichž 93 % dosáhlo negativity PML/RARα. Tři ze 6 PCR pozitivních pacientů po konsolidacích dosáhli molekulární remise během udržovací léčby. Do 1. vyhodnocení protokolu byl zachycen hematologický relaps u 5 pacientů od 4 do 15 měsíců po dosažení hematologické remise. U dalších 3 pacientů došlo po konsolidaci ke konverzi z PCR negativity do PCR pozitivity PML/RARα. Dvouleté celkové přežití dosáhlo 82 % a bezpříznakové přežití 79 %. Z pacientů, kteří dosáhli kompletní hematologické remise, dosáhlo dvouleté přežití bez známek choroby 92 % [91].
Stejný tým v roce 1999 navázal na tyto velmi dobré výsledky novým protokolem a studií s označením LPA99 [92]. Indukční terapie byla ponechána beze změny, konsolidační léčba však byla nově přizpůsobena vstupnímu riziku, které bylo hodnoceno na základě koncentrace leukocytů a trombocytů v periferní krvi při diagnóze choroby. Jednotlivé rizikové skupiny byly následující: nízké riziko – leukocyty méně než 10 × 109/l a trombocyty více než 40 × 109/l, střední riziko – leukocyty méně než 10 × 109/l a trombocyty méně než 40 × 109/l, vysoké riziko – leukocyty více než 10 × 109/l. Pacienti v nízkém riziku byli léčeni stejně jako v LPA96, kdežto u pacientů ve středním a vysokém riziku byla při každé konsolidační léčbě podávána po 2 týdny ATRA a dávka idarubicinu byla v 1. a 3. konsolidační chemoterapii zvýšena o 40, resp. 50 %. Udržovací terapie byla stejná jako ve studii LPA96. Od tohoto přístupu, tedy stratifikace léčby podle rizika, si autoři slibovali snížení incidence relapsů především ve skupině s vysokým rizikem. Do studie LPA99 bylo zařazeno do roku 2002 celkem 251 vyhodnotitelných pacientů a dosažené výsledky byly opět velmi dobré. Během indukce zemřelo pouze 24 pacientů (10 %), obvykle v důsledku krvácení, pouze 1 pacient zemřel v důsledku ATRA syndromu. Všichni zbývající pacienti (90 %) dosáhli kompletní remise, nebyla zaznamenána rezistentní leukemie. Přibližně u 25 % pacientů se objevily známky ATRA syndromu, ale pouze u 10 pacientů (4 %) byl ATRA syndrom hodnocen jako jistý. Z 227 pacientů testovaných po ukončení konsolidační terapie na PML/RARα byli pozitivní pouze 2 pacienti (tedy méně než 1 %). Při vyloučení pacientů s nízkým rizikem pro posouzení efektu stratifikace konsolidace dle rizika dosáhla kumulativní incidence relapsů ve 3 letech ve studii LPA99 necelých 9 % oproti 20 % ve studii LPA96 (p = 0,004). To znamenalo, že se podařilo dosáhnout základního cíle, tedy zlepšit prognózu více rizikových pacientů. Ve skupině s vysokým rizikem (vstupní leukocytóza nad 10 × 109/l) však stále dosahovala 21 %, což ale bylo stále méně než ve studii LPA96 (34 %). Z obou studií tedy vyplynulo, že souběžné podávání ATRA a chemoterapie má u PML/RARα akutní promyelocytární leukemie velmi vysoký antileukemický efekt. Při dobré podpůrné terapii, která zahrnovala mimo jiné především substituci trombocytů a ve studii LPA99 kontinuální podávání vysokých dávek antifibrinolytik (kyseliny tranexamové) do normalizace koagulopatie, přežilo indukční terapii přibližně 90 % pacientů. Ze 386 pacientů zařazených v obou studiích dosáhlo kompletní hematologické remise po 1 sérii indukční terapie typu AIDA 384 pacientů, pouze 2 pacienti (0,5 %) ve studii LPA96 měli rezistentní chorobu. Intenzifikace konsolidační terapie dle rizika měla jednoznačně pozitivní dopad na léčebné výsledky u pacientů s vyšším rizikem [91,92].
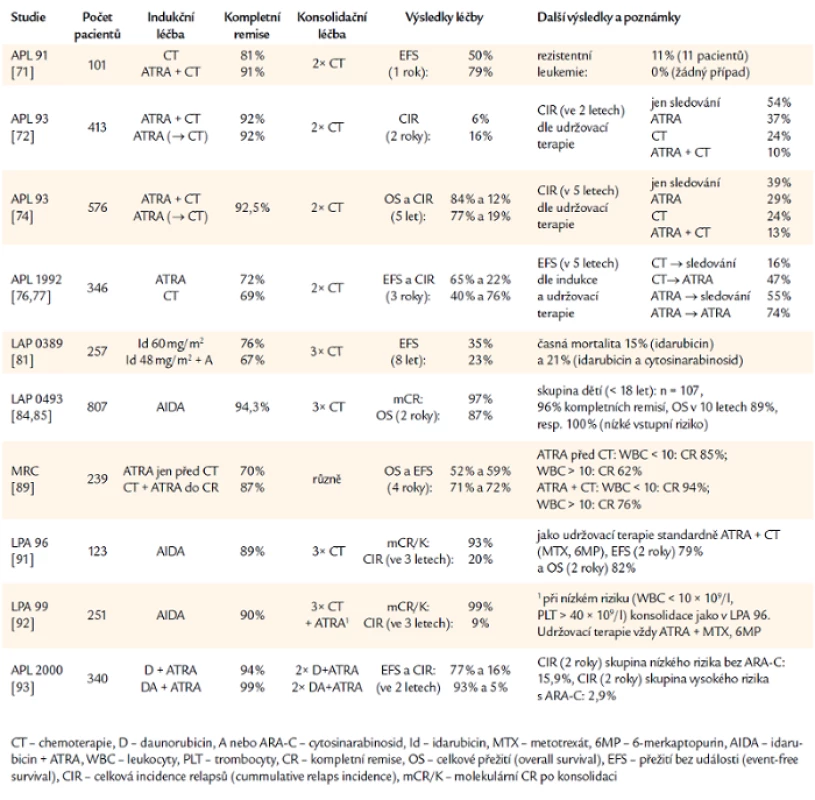
Základní přehled léčby a výsledků dosažených ve velkých studiích u APL podává tab. 1.
Role cytosinarabinosidu v moderní léčbě APL
Jak už bylo uvedeno, výše citované velké studie jednoznačně nezjistily přínos a pozitivní efekt cytosinarabinosidu (ARAC) v léčbě APL. Skupina PETHEMA z obavy před zvýšenou toxicitou dokonce ARAC z léčba vypustila, aniž by došlo ke zhoršení výsledků ve srovnání s jinými studiemi. Efektivita nebo zbytečnost ARAC v terapii APL však stále nebyla potvrzena v randomizované studii. V roce 2000 proto francouzská skupina iniciovala studii APL 2000, která měla za cíl porovnat léčebné výsledky s použitím ARAC v indukční a konsolidační terapii a bez něj [93]. V letech 2000–2004 bylo do studie zařazeno 356 pacientů s nově diagnostikovanou PML/RARα pozitivní APL, vyhodnotitelných bylo nakonec 340 pacientů. V rameni ARAC byl cytosinarabinosid součástí indukce a 2 konsolidací vždy v dávce 200 mg/m2 po 7 dní, tito pacienti navíc dostávali ARAC intrathekálně v rámci profylaxe CNS postižení. Jinak se léčba nelišila (indukce 3krát daunorubicin 60 mg/m2 + ATRA, 1. konsolidace 3krát daunorubicin 60 mg/m2 a 2. konsolidace 3krát daunorubicin 45 mg/m2; ARAC nedostávali pacienti nad 60 let věku a s leukocyty pod 10 × 109/l). Po 2. konsolidaci následovala obvyklá udržovací léčba (ATRA, 6-MP, MTX). Při mediánu sledování 35 měsíců dosáhlo CR 99 % ve skupině ARAC a 94 % ve skupině bez ARAC (p = 0,12), ve 2. skupině byly zaznamenány 2 případy rezistentní APL. Celkem během indukce zemřelo 5 pacientů, z toho 4 ve skupině bez ARAC. Přestože šlo o klinickou studii, a tedy do jisté míry selektovanou skupinu pacientů, vynikají tato data zejména ve srovnání s výsledky léčby v České republice, které jsou zhodnocené v tomto čísle časopisu Vnitřní lékařství na jiném místě. V tomto ohledu není bez zajímavosti, že za mimořádně nízkou časnou mortalitou mohl stát požadavek protokolu studie APL 2000, který předepisoval udržování koncentrace trombocytů nad 50 × 109/l. Výsledky studie byly opět velmi dobré: molekulární remise po ukončení konsolidace byla dosažena u 90 % a 82 % pacientů (ARAC vs ne-ARAC, p = 0,18) a ve skupině s ARAC byla nižší 2letá incidence relapsů (4,7 % vs 15,9 %; p = 0,11). Statisticky významně se ve prospěch skupiny léčené ARAC lišilo EFS ve 2 letech (93,3 % vs 77,2 %; p = 0,0021) stejně jako 2leté celkové přežití (97,9 % vs 89,6 %; p = 0,0066). Vzhledem k tomu, že ve skupině neléčené ARAC bylo více časných úmrtí, analyzovali autoři celkové přežití u pacientů, kteří dosáhli CR. Rovněž výsledek této analýzy preferoval skupinu léčenou ARAC (p = 0,026). Pokud tyto výsledky srovnáme se studií LPA 99 skupiny PETHEMA, pak vynikne zejména výrazně nižší incidence relapsů ve skupině vysokého rizika (leukocyty > 10 × 109/l), která byla ve španělské studii ve 3 letech 21 % a v rameni ARAC studie APL 2000 ve 2 letech 2,9 %. Naproti tomu ve studii LPA 99 byla ve 3 letech výrazně nižší incidence relapsů ve skupině nízkého rizika (3 %) ve srovnání se stejnou skupinou pacientů léčených bez ARAC ve studii APL 2000 (15,9 % ve 2 letech) [92,93].
Lepší výsledky studie LPA 99 ve skupině nízkého rizika oproti studii APL 2000 v rameni bez ARAC lze vysvětlit o 50 % vyšší kumulativní dávkou antracyklinů při léčbě dle španělského protokolu, případně tím, že idarubicin a mitoxantron mohou mít vyšší a specifičtější účinnost při léčbě APL. Na druhé straně studie APL 2000 prokázala, že mladší pacienti (< 60 let) významně profitují z přidání ARAC k indukční a konsolidační terapii. Lze se také domnívat, že svou roli sehrála i profylaxe CNS postižení, což je lokalizace, kde relaps APL zaznamenáváme relativně často. Celkově lze uzavřít, že studie APL 2000 Evropské skupiny pro APL (European Acute Promyelocytic Leukemia Group) do jisté míry restaurovala význam cytosinarabinosidu v terapii APL.
Design nové a stále probíhající nerandomizované studie LPA 2000 španělské skupiny PETHEMA už význam ARAC při léčbě APL zohledňuje. Tato studie, které se účastní i některá česká pracoviště, zařadila ARAC do konsolidačních terapií ve skupině vysokého rizika dle Sanze (vstupní leukocyty > 10 × 109/l) a nyní nezbývá než vyčkat vyhodnocení dosažených výsledků.
ATRA rezistence
Důvody pro ATRA rezistenci jsou v zásadě dva. První typ rezistence je dán farmakokinetikou ATRA, druhý typ rezistence vyplývá z mutace RARα. Z prvních prací, kdy byla ATRA u APL používána v monoterapii, vyplynulo, že ATRA navodí remisi u APL téměř u všech pacientů, ale tato remise při monoterapii ATRA není trvalá a poměrně rychle, během 3–7 měsíců, dochází k relapsům onemocnění, které jsou velmi rezistentní na jakoukoli terapii [67,75,94]. Zda je relaps APL provázený ATRA rezistencí, je odvislé především od doby, která uplynula od posledního podávání ATRA. Gallagher uvádí, že 100 % pacientů bylo ATRA rezistentních při relapsu v době podávání ATRA, 76 % pacientů při relapsu do 1 roku a 34 % pacientů při relapsu po více než 1 roce od posledního podání ATRA [95]. Zpočátku se zdálo paradoxní, že u leukemických buněk od pacientů se získanou ATRA rezistencí byla v testech in vitro senzitivita na ATRA normální [96], ale další výzkum odhalil, že je to vlastně logické.
Do buněčného jádra může z cytoplazmy pronikat pouze volná ATRA, která se zde váže na jaderné retinoidové receptory, a ovlivňuje tak transkripční mechanizmy. V cytoplazmě buněk však většinu ATRA vyvazují buněčné nosiče retinoidů, v případě myeloidních buněk se jedná dominantně o CRABP-II. Takto vyvázaná ATRA je postupně dále metabolizovaná pomocí oxidačních enzymů na inaktivní metabolity [94,97]. Cornicová et al [98] prokázali, že u pacientů léčených ATRA pro APL dochází k indukci tvorby CRABP v mononukleárních buňkách kostní dřeně. Pro indukci zvýšení tvorby CRABP je však nezbytné, aby léčba ATRA trvala nejméně 30 dní – ve vzorcích od pacientů léčených kratší dobu se tento efekt nepodařilo prokázat. Delva et al [99] sledovali dynamiku koncentrace CRABP-II v leukemických buňkách pacientů s APL. Před zahájením terapie pomocí ATRA byla koncentrace CRABP-II v leukemických buňkách pod hranicí detekce. U čtyř pacientů měli později možnost stanovit intracelulární koncentraci CRABP-II v leukemických buňkách v době relapsu a zjistili, že byla nápadně vysoká. Prostřednictvím CRABP-II je ATRA transportována do endoplazmatického retikula, kde podléhá degradaci v sy-stému cytochromu P450 [94]. Existuje i alternativní cesta degradace ATRA, kterou představuje postupná oxidace ATRA v systému lipidových hydroperoxydáz, které jsou rovněž indukovány dlouhodobě zvýšenou hladinou ATRA a současnou diferenciací buněk [100]. Na vzniku rezistence k ATRA se tedy podílí nejméně 3 vzájemně se kombinující mechanizmy, které samozřejmě nejsou omezeny pouze na leukemické buňky, ale objevují se v celém organizmu:
- indukce produkce proteinů typu CRABP, které vyvazují intracelulární ATRA,
- zvýšení aktivity systému cytochromu P450,
- zvýšení aktivity lipidových hydroperoxydáz.
Z metabolizmu ATRA tedy můžeme odvodit několik možných přístupů, které mohou alespoň částečně potlačit vznik získané ATRA rezistence. První přístup je pro svou jednoduchost téměř standardní a spočívá v intermitentním podávání ATRA v rámci konsolidační a udržovací terapie. Tento přístup používá např. španělská skupina PETHEMA a je zainkorporován např. v nejnovější studii LPA 2005, kdy je ATRA v rámci konsolidace a udržovací terapie podávána vždy maximálně 15 dní přibližně každý měsíc, resp. každé 3 měsíce. Intermitentní podávání ATRA má oporu především ve dvou pracích. Muindiová et al [101] měřili AUC (area under the plasma concentration time curve) ATRA v krvi při kontinuálním podávání a zjistili, že již ve 2 týdnech klesla AUC na sotva polovinu původní hodnoty a tento trend se nezměnil ani po zdvojnásobení dávkování. Adamson et al [102] prokázali, že cytoplazmatická koncentrace CRABP se 1 týden po vysazení ATRA začala rychle vracet k výchozímu stavu. Teoreticky by mělo být rovněž výhodné využít inhibice systému cytochromů P450, např. podáváním azolových antimykotik typu ketokonazolu, ale v praxi se tyto postupy nepoužívají.
Další možností je podávat ATRA intravenózně. Plazmatická hladina je výrazně vyšší než po perorálním podávání a obejde se efekt prvního průchodu játry. ATRA proniká do buněk pasivní difuzí po koncentračním spádu, intracelulární koncentrace ATRA bude tedy také výrazně vyšší a buňky nedokážou tak efektivně ATRA metabolizovat. Do jádra se tak dostane podstatně více volné ATRA a to by ve svém důsledku mělo znamenat nejenom oddálení nebo zamezení vzniku rezistence, ale rovněž lepší léčebný efekt. Problematiku lipozomální ATRA (L-ATRA) rozpracovali v M.D. Anderson Cancer Center. První pokusy se datují do roku 1993 [103] a od té doby bylo provedeno celkem 5 studií, 3 studie byly fáze II [104]. Podle dostupných informací byla dosud L-ATRA podána asi 250 pacientům a v současné době by měla být L-ATRA registrována v USA pro podání v rámci klinického výzkumu jako preparát ATRA-IV (Antigenics, New York, USA). Maximální tolerovaná dávka byla ve studii fáze I stanovena na 140 mg/m2/den, ve studiích fáze II bylo použito dávkování 90 mg/m2/den a při intravenózní aplikaci L-ATRA bylo dosahováno přibližně 15krát vyšší plazmatické koncentrace ATRA než při perorálním podávání ATRA. Celkem bylo do studií zařazeno 69 pacientů s nově diagnostikovanou i relabovanou APL včetně studie 004, kde byla L-ATRA podávána pacientům, u kterých zůstalo podávání ATRA perorálně bez léčebné odpovědi. Podávání L-ATRA u 32 nově diagnostikovaných pacientů bylo spojeno s vysokou mortalitou, 9 pacientů zemřelo před podáním 4. dávky L-ATRA. Na druhé straně všichni pacienti, kteří přežili déle než 27 dní, dosáhli kompletní remise. U pacientů s relapsem APL nebo ATRA rezistencí bylo dosaženo podstatně horších výsledků, CR dosáhlo 71 % pacientů, kteří alespoň rok nedostávali ATRA, ale pouze 23 % z těch, kteří zrelabovali do 1 roku od posledního podávání ATRA [104]. Významnou výhodou L-ATRA ve srovnání s ATRA je dosahování molekulárních remisí, které po monoterapii ATRA nebyly nikdy pozorovány [105]. Poslední publikovaná práce z M.D. Anderson Cancer Center zhodnotila léčbu L-ATRA u nově diagnostikovaných pacientů. Rozdíl mezi monoterapií ATRA a L-ATRA nespočívá v dosahování kompletních remisí, ale především v dlouhodobém efektu. Celkem byla L-ATRA (90 mg/m2/den, ob den) podána 34 pacientům s nově diagnostikovanou APL. Bylo dosaženo 79 % kompletních remisí, 2 pacienti byli rezistentní na tento typ terapie. ATRA syndrom se objevil u 30 % pacientů. U 10 pacientů, kteří měli v době diagnózy leukocyty méně než 10 × 109/l, přetrvává kompletní remise více než 6 let (medián), přičemž žádný z těchto pacientů nedostal kromě L‑ATRA žádnou další léčbu (např. idarubicin). Celkové přežití v 5 letech od diagnózy bylo 76 % a na rozdíl od monoterapie ATRA, kdy se nikdy nepodařilo dosáhnout molekulární remise, při použití L-ATRA dosáhlo molekulární CR 25 z 27 pacientů. K molekulárnímu relapsu došlo u 8 pacientů, kteří nakonec dostali idarubicin, hematologický relaps se objevil pouze u 2 pacientů [106]. Celkový význam L-ATRA není příliš velký, při kombinované terapii se v současnosti neuplatňuje a její účinnost při léčbě relapsu APL je ve srovnání s ATO malá. Největší uplatnění by patrně našla např. při léčbě svědků Jehovových a starých jedinců, protože při použití L-ATRA v monoterapii nedochází k útlumu krvetvorby. Otázkou zůstává, zda se L-ATRA prosadí při léčbě APL u dětí, kdy použití chemoterapie, a zejména antracyklinů není nejvhodnější, neboť je spojeno s kardiotoxicitou a zvýšeným rizikem sekundárních malignit.
Kromě farmakokinetických a metabolických změn, které jsou příčinou ATRA rezistence, existují samozřejmě primárně rezistentní PML‑RARα pozitivní APL. Ve většině velkých studií se objevilo několik pacientů s t(15;17), kteří byli v rámci indukční léčby APL primárně rezistentní na terapii ATRA. U buněk získaných od těchto pacientů byla nejčastěji zjištěna mutace v LBD (ligand binding domaine) oblasti RARα. Při této mutaci, známé jako R276W, dochází k nahrazení argininu na pozici 276 tryptofanem. Arginin v pozici 276 má velmi důležitou funkci ve struktuře RARα a celá struktura LBD je charakteristická a konzervovaná v celé rodině nukleárních receptorů steroidního typu. Arginin je jako hydrofilní molekula s pozitivním nábojem součástí sítě vodíkových můstků a dalších vazeb receptoru, které interagují zejména s karboxylovou skupinou ligandu. Pozitivní náboj argininu se pravděpodobně podílí na vytváření elektrostatického pole, které navádí příslušnou část ligandu do vazebného místa receptoru. Při mutaci způsobené náhradě argininu tryptofanem se naruší celá terciální struktura vazebného místa receptoru, protože tryptofan je nepolární a hydrofobní [95]. Další dosud popsané mutace u pacientů s PML/RARα pozitivní APL a spontánní rezistencí k ATRA jsou Lys 207 Asn, Arg 272 Gln, Arg 276 Gln, Gly 289 Arg, Leu 290 Val, Arg 294 Trp, Met 297 Leu, Arg 394 Trp, Pro 407 Ser, Met 413 Thr [107–112] a u buněčných linií APL rezistentních k ATRA a exprimujících PML/RARα dále Phe 286 delece, Leu 398 Pro, Pro 407 Leu, Ile 410 Thr, Gln 411-stop codon [112–117].
Arzen v terapii APL
Lékaři, alchymisté a traviči používali nerosty obsahující arzen od pradávna, obvykle šlo o bílý arzenik (tedy oxid arzenitý, As2O3, dále ATO) nebo o červený či žlutý arzenik (tedy různé formy sulfidu arzenu, As2S3). Pro svou vysokou toxicitu však byly lektvary použitelné jen lokálně. Hippokrates je doporučoval k výplachům abscesů, Galén pro léčbu některých kožních nemocí a od 15. století se v Evropě pomocí arzenu léčila hlavně syfilis. V tradiční čínské medicíně je bílý arzenik uváděn již v Rukověti lékové nauky sepsané Li Shi-Zhenem v 16. století a arzeniková pasta se používala např. k devitalizacím zubů při onemocnění zubní dřeně [118]. V Evropě se léčba arzenem rozšířila po roce 1786, kdy Thomas Fowler popsal a začal používat 1% roztok KH2AsO4 (Fowlerův roztok), který byl více než 150 let předepisován jako lék proti nejrůznějším chorobám. Nakonec se uplatnil i v hematologii, když ho v roce 1865 začal Lissauer podávat pacientům s chronickou myeloidní leukemií, čímž dosahoval klinických remisí [119,120]. Tyto výsledky potvrdili v roce 1878 lékaři Bostonské městské nemocnice, kteří pomocí Fowlerova roztoku dosáhli u pacienta s „leukocytemií“ rychlého snížení počtu leukocytů. Arzen ve Fowlerově roztoku se tak nakonec stal na dlouhou dobu lékem volby u leukemií [121]. Po roce 1909 až do objevu penicilinu byla díky práci Paula Ehrlicha používána sloučenina arzenu (dioxy-diamino-arzeno--benzen-dihydrochlorid, pod obchodním jménem Salvarsan) v léčbě syfilis. S nástupem radioterapie bylo sice od používání arzenu v onkologii částečně upuštěno, ale po roce 1931 se začal opět podávat u chronické myeloidní leukemie poté, co Forkner a Scott referovali o úspěšné léčbě CML arzenem u 9 z 10 pacientů [122]. O použití arzenu v léčbě chloromů se v tomto čísle časopisu Vnitřní lékařství zmiňuje také MUDr. Schwarz ve svém článku věnovaném historii poznání APL. Zavedení cytostatik a antibiotik však v medicíně znamenalo na dlouhou dobu konec používání arzenu.
Na začátku 70. let minulého století se na půdě čínské Harbin Medical University začaly u různých typů nádorů poměrně seriózně testovat metody tradiční čínské medicíny. Intravenózní podávání roztoku Ailing‑1, tedy 1% ATO se stopovým množstvím chloridu rtuťnatého, dokázalo během 28–60 dnů navodit kompletní remisi u 65–84 % pacientů s akutní promyelocytární leukemií. Ještě po 10 letech přežívalo devět z původního souboru 32 pacientů (28,2 %), kteří tuto léčbu podstoupili [123]. Léčba As2O3 v dávce 10 mg/den přitom nebyla spojená s dřeňovým útlumem a nebyly zaznamenány výraznější nežádoucí účinky [124]. Od roku 1996 byla publikována řada sdě-lení, která uvádějí dosažení kompletní remise pomocí As2O3 (ATO) u 85–90 % pacientů s APL, ať už jde o primární terapii, nebo léčbu relapsu po předchozí terapii ATRA a cytostatiky. Stručný přehled léčebných výsledků s použitím ATO v publikovaných stu-diích je uveden v tab. 2.
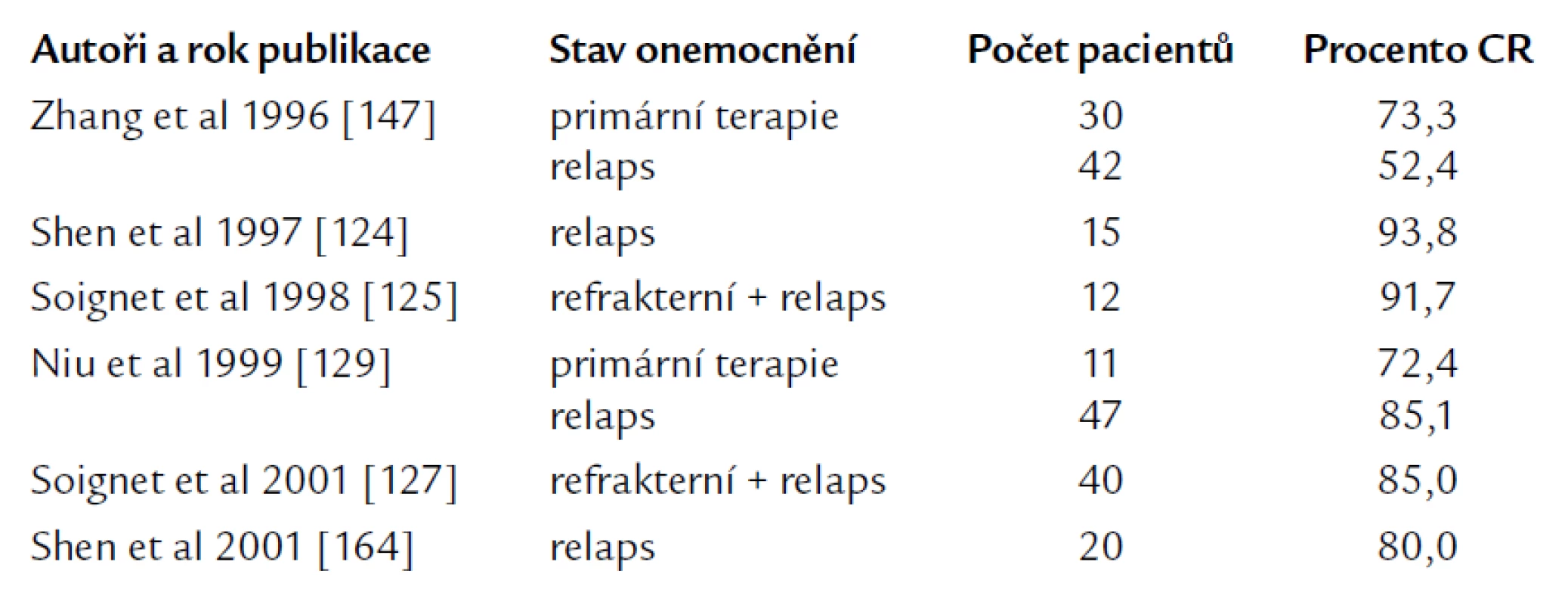
První klinická studie s ATO mimo Čínu byla vedená v Memorial Sloan-Kettering Cancer Center a byla publikována v roce 1998 [125]. Do studie bylo zahrnuto 12 pacientů v době 1.–3. relapsu APL, 2 pacienti s relapsem po alogenní transplantaci. Po léčbě ATO v dávce 10–15 mg/den (u dětí 0,15 mg/kg/den) dosáhlo 11 pacientů kompletní remise, jeden pacient zakrvácel do mozku během 1. dne léčby a po 5 dnech zemřel. Indukční terapie ATO trvala v průměru 33 dní, kumulativní dávka ATO byla v průměru 360 mg (160–515 mg) a všechna kritéria kompletní remise byla splněna v průměru po 47 dnech (24–83). ATO byl podáván i jako konsolidace a už po 1. konsolidačním cyklu ATO dosáhlo 8 pacientů molekulární remise. Zbylí 3 pacienti zrelabovali během 2. cyklu ATO. Toxicita terapie byla nízká a 4 pacienti byli léčeni pouze ambulantně. U 2 pacientů se rozvinula obdoba ATRA syndromu (tedy ATO syndrom), ale po nasazení dexametazonu symptomy postupně vymizely. Výraznější jaterní toxicita se neobjevila, dominovala únavnost a slabost, muskuloskeletální bolesti a hyperglykemie. Na rozdíl od ATRA nevykazovaly leukemické buňky během prvních nejméně 10 dní žádné morfologické změny a až po této době začalo docházet k jejich rychlému úbytku. Na tuto pilotní studii navázaly ve Spojených státech další multicentrické studie, tentokrát už s použitím purifikovaného ATO (preparát Trisenox, výrobce původně Cell Therapeutics, nyní Cephalon). Celkem bylo v rámci pilotní a navazujících studií léčeno 52 pacientů s relapsem APL, 87 % nemocných pak dosáhlo kompletní a 78 % molekulární remise nemoci. Při mediánu sledování 18 měsíců přežívalo 69 % pacientů. V úvodu léčby ATO docházelo obvykle k leukocytóze a u 23 % pacientů se rozvinul ATO syndrom, který velmi dobře reagoval na léčbu dexametazonem. Asi u poloviny pacientů bylo zaznamenáno asymptomatické prodloužení QT intervalu. V souladu s čínskými pracemi nebyl zaznamenán dřeňový útlum nebo alopecie. Na podkladě těchto výsledků byl Trisenox v roce 2000 schválen v USA (Food and Drug Administration) a o 2 roky později i v Evropě (European Agency for the Evaluation of Medical Products) pro terapii relapsu APL [126–128].
Postavení ATO v úvodní léčbě APL není dosud zcela jasné. Jeho velkou výhodou by ale přitom mohlo být to, že při použití ATO nedochází postupně k rozvoji rezistence a že samotný ATO dokáže (na rozdíl od ATRA) navodit u PML/RARα pozitivní APL molekulární remisi [125]. Niu et al [129] informovali o závažné jaterní toxicitě u 7 z 11 pacientů s nově diagnostikovanou APL léčených ATO v Číně letech 1996–1998. Jaterní toxicita byla nakonec u 2 pacientek příčinou úmrtí. Roztok ATO byl však připravován lékárnou tradiční čínské medicíny a s vysokou pravděpodobností nešlo o roztok s vysokou čistotou. Příčinou závažné jaterní toxicity tedy mohla být příměs kadmia, která bývala v původních čínských přípravcích obsahujících ATO častá. Informace o jaterní toxicitě ATO v primoléčbě APL znamenala na dlouhou dobu odklon od podávání ATO jako úvodní léčby APL. Na druhé straně, pokud by byl roztok ATO připraven z vysoce čisté suroviny, pak by mohl být pro svou nízkou toxicitu (především neindukuje dřeňový útlum) a nízké náklady na léčbu s výhodou používán v zemích, kde je ekonomicky problematické zajistit plnou zdravotní péči. Mathews et al vyčíslili náklady na léčbu APL v indických podmínkách na 15–20 tisíc amerických dolarů při použití standardního režimu založeného na ATRA v kombinaci s chemoterapií, kdežto jedna denní dávka roztoku ATO indické provenience (INTAS Pharmaceuticals, Indie) stojí přibližně 10 dolarů. Tito autoři léčili pomocí ATO celkem 72 pacientů s nově diagnostikovanou APL a dosáhli 86,1 % kompletních remisí a při mediánu sledování 25 měsíců bylo odhadované 3leté přežití bez známek choroby 87,2 % a ve skupině pacientů se vstupní koncentrací leukocytů méně než 5 × 109/l a trombocytů více než 20 × 109/l bylo dosaženo 100 % remisí a rovněž 100 % přežití bez známek nemoci. Závažnější hepatotoxicita byla pozorována u necelých 7 % pacientů, ale vždy odezněla po přerušení léčby [130].
Bezpečnost originálního Trisenoxu (registrovaného rovněž v České republice) byla zhodnocena v roce 2003 v rámci práce publikované na sjezdu Americké hematologické asociace (ASH) v roce 2003 [131]. Trisenox byl v době této publikace podáván celkem 2 896 pacientům, z toho bylo 696 pacientů s APL. Závažné prodloužení QT intervalu bylo zaznamenáno u 15 pacientů a nikdy nevedlo k maligní arytmii. Tento fakt pravděpodobně souvisí s vysokou čistotou přípravku. Také jaterní toxicita zmiňovaná v čínské [129] a indické [130] práci se při léčbě Trisenoxem neobjevovala.
V současnosti bylo publikováno několik sdělení, kdy autoři použili v indukční léčbě kombinaci ATRA + ATO, případně ještě tuto kombinaci doplnili o chemoterapii. Estey et al [132] použili v indukci APL u 44 pacientů ATRA ode dne 1 s přidáním ATO ode dne 10. Stejná terapie byla použita i pro konsolidaci. U 15 pacientů s vysokým rizikem (leukocyty při stanovení diagnózy nad 10 × 109/l) byl navíc den 1 indukce podán gentuzumab ozo-gamycin v dávce 9 mg/m2 a u dalších 3 pacientů byla indukce doplněna také o idarubicin. Po dosažení remise byli pacienti konsolidováni kombinovanou léčbou ATRA a ATO dalších 28 týdnů. ATO syndrom se vyskytl u 6 pacientů a nebyl fatální. Čtyři pacienti zemřeli během prvních 3 dnů na krvácivé komplikace, 1 pacient zemřel na cévní mozkovou příhodu po 2 týdnech léčby. Všech 39 ostatních pacientů dosáhlo kompletní a postupně rovněž molekulární remise. Při mediánu sledování 16 měsíců došlo k relapsu u 3 pacientů se vstupně vysokým rizikem, vždy předcházela molekulární pozitivita PML/RARα. Tyto výsledky jsou velmi nadějné a podobný léčebný protokol by mohl představovat především alternativu pro starší nemocné, u kterých má klasická léčba kombinací ATRA a chemoterapie poměrně vysokou mortalitu. Sanz totiž uvádí u pacientů starších 70 let mortalitu v remisi 24 % [133] a Adès ve skupině pacientů nad 60 let mortalitu 19 % [134] v důsledku komplikací vyplývajících z dřeňového útlumu během konsolidační léčby.
Výsledky zatím poslední velké studie s použitím ATO v úvodní léčbě APL byly publikovány v roce 2007 na sjezdu Americké společnosti pro klinickou onkologii (ASCO). Do severoamerické randomizované studie fáze III bylo zařazeno 481 dospělých a 57 dětí s nově diagnostikovanou APL. Pokud byla indukční léčbou (ATRA, daunorubicin, cytosinarabinosid) dosažena remise, pak v ramenu ATO byly před 2 cykly konsolidační léčby (ATRA + daunorubicin) podány pacientům navíc 2 cykly ATO (0,15 mg/m2/den, 5krát týdně, celkem 5 týdnů). Po konsolidační terapii byli pacienti v kompletní remisi dále randomizováni pro jednoletou udržovací terapii (ATRA nebo ATRA + 6-MP + MTX). Do ramene ATO byly zařazeny pouze 2 děti. Kompletní remise bylo dosaženo u 89 % pacientů (skupina dětí se nelišila). Při mediánu sledování 29 měsíců byl EFS 77 % v rameni ATO a 59 % v rameni bez ATO (p = 0,0013) a podobně vyznělo celkové přežití: 86 % a 77 % (ATO, bez ATO; p = 0,029). Z výsledků tedy vyplynulo, že doplnění standardní konsolidační léčby o 2 cykly ATO signifikantně zlepšuje přežití pacientů a APL [135]. Bohužel tato studie (North American Intergroup Protocol C9710) použila jiné léčebné schéma, než je obvyklé v Evropě, a např. výsledky studie skupiny PETHEMA LPA99 jsou plně srovnatelné s výsledky dosaženými v rameni s ATO. Bylo by tedy žádoucí srovnat v současnosti asi nejlepší léčebné schéma (LPA99, resp. LPA2005) s podobnou nebo identickou léčbou, která by byla rozšířena o zařazení ATO do konsolidační terapie.
Podstata léčebného efektu arzenu na molekulární úrovni
ATO působí na buňky APL duálním efektem, který je do jisté míry závislý na dosažené koncentraci. Ve vyšších koncentracích (tedy 0,5–2,0 μmol/l) je spíše induktorem apoptózy, v nižších koncentracích (0,1–0,5 μmol/l) a při dlouhodobém podávání indukuje spíše diferenciaci [136]. U mitochon-drií dochází vlivem ATO ke snížení transmembránového potenciálu a otevření mitochondriálních membránových pórů čili PTPC (permeability transition pore complex). Ovlivnění PTPC indukuje přímo i nepřímo apoptózu, protože PTPC interagují s rodinou Bcl-2/BAX apoptózu regulujících proteinů, a navíc se při otevření PTPC do cytosolu uvolňuje cytochrom C a proapoptotické faktory aktivující např. kaspázu 3, 8 a 9 [118]. Na mechanizmu poškození mitochondrií se přitom zřejmě podílí i změna intracelulárního pH, kdy ATO zvyšuje aktivitu Anion exchangeru 2 (AE2), což vede k intracelulární acidifikaci [137]. Je také známo, že arzen interferuje s procesy fosforylace-defosforylace, protože v nich nahrazuje fosfát [138]. Arzen má silnou afinitu k sulfohydrylovým skupinám proteinů a touto vazbou ovlivňuje řadu důležitých enzymů bohatých na tyto SH-skupiny [139]. Vazba arzenu na SH-skupiny mitochondriálních enzymů vede k narušení metabolizmu peroxidů a blokuje jejich degradaci. To vede obvykle k terminálnímu poškození mitochondrií, což má pro buňku fatální následky [140]. Tento proapoptotický efekt ATO je závislý na koncentraci glutathionu (GSH) a buňky obsahující vysoké koncentrace GSH vykazují ATO rezistenci. GSH vytváří s ATO komplexy, vznikají molekuly typu As(GS)3 a dochází k inaktivaci ATO jako generátoru volných radikálů. Tento mechanizmus navíc umožňuje snadnější exkreci ATO z buňky prostřednictvím membránových pump. Buňky APL však obsahují významně méně GSH než jiné buňky [141]. Kromě výše popsaných efektů je cytotoxický efekt ATO způsoben také aktivací JNK (c-Jun NH2-terminal kinases) a AP‑1 (aktivační protein-1). Arzen přitom významně indukuje fosforylaci a aktivitu JNK [142].
Proces buněčné diferenciace je kladen spíše do souvislosti s degradací PML/RARα proteinu a restitucí nukleár-ních tělísek (NB), která se významně projevuje již po několika hodinách po podání ATO. ATO ovlivňuje intranukleární distribuci PML, která se z difuzní stává rychle koncentrovaná do NB. ATO indukuje modifikaci PML, resp. PML/RARα kovalentním navázáním SUMO (polypeptid podobný ubiquitinu). Sumoylace PML, resp. PML/RARα, vyvolává interakci dalších proteinů (Daxx, Sp100 a také proteazomového S11 komplexu) a vytváří se velká NB, ve kterých dochází k rychlé degradaci PML, resp. PML/RARα [143,144]. U normálních buněk se SUMO‑1 polymodifikované formy PML vyskytují pouze v nukleárních tělíscích (NB) a z toho lze usoudit, že ATO významně přispívá k obnovení NB v APL buňkách. Jak bylo uvedeno výše, restituce a normální funkce NB souvisí s buněčnou diferenciací.
Celý komplex mechanizmů, kterými ATO indukuje diferenciace APL buněk, není zatím uspokojivě objasněn. Ně-které studie navíc dokládají spíše synergické působení ATO a ATRA, některé naopak uvádějí spíše antagonizmus, který by mohl např. vycházet z faktu, že ATO prostřednictvím JNK indukuje fosforylaci RXRα, což by mělo vést ke snížení transaktivace nukleárních receptorů. Současné podávání ATRA a ATO, které uvádí někteří autoři jako možný model necytostatické terapie APL, by tedy nemuselo být výhodné a mohlo by být méně efektivní než sekvenční aplikace [145]. Kromě přímého ovlivnění buněk APL má ATO také antiangiogenní efekt [146,147]. Důležité je, že ATO neovlivňuje přežívání neleukemických buněk, u kterých pouze dochází ke snížení počtu nu-kleárních tělísek [139].
Přídavné chromozomální aberace a mutace FLT3 u APL
Standardní indukční terapie založená na antracyklinu a ATRA by rozhodně neměla být jakkoli měněna v souvislosti s případným výskytem faktorů, u kterých se předpokládá, že by mohly negativně ovlivňovat prognózu. Jedná se zejména o přídavné chromozomální aberace, expresi CD56, krátkou izoformu PML/RARα. Při analýzách rozsáhlých souborů pacientů léčených moderními režimy založenými na kombinaci ATRA a chemoterapie se nepodařilo prokázat, že by přítomnost přídavných chromozomálních aberací negativně ovlivnila léčebné výsledky [148–150].
FLT3 (FMS‑like tyroxin-kináza 3) patří do rodiny receptorů s tyroxiN-kinázovou aktivitou třídy III [151], které po aktivaci ligandem (FL) zvyšují proliferaci a přežívání hematopoetických progenitorů [151–153]. Mutace FLT3 mají za následek konstitutivní tyrosinkinázovou aktivitu FLT3 [154], což ve svém důsledku přináší leukemickým buňkám na cytokinech nezávislou proliferaci, a tedy proliferační výhodu [155].
Mutace FLT3, ať už typu ITD (internal tandem duplication), nebo v oblasti aktivační kličky, jsou u APL poměrně časté. Při stanovení diagnózy je nacházíme u 30–40 % pacientů [149,154–156] a u mikrogranulární varianty (M3v) dokonce u 60–75 % pacientů, kdy jsou nápadně přítomny zároveň s leukocytózou [149,156,157]. Mutace FLT3 nejsou dominantní a samy o sobě nezpůsobují leukemii. Dosud není ani jasné, zda nezávisle zvyšují riziko relapsu. Naopak bylo opakovaně publikováno, že pozitivita mutace FLT3 při diagnóze nebyla následně zjištěna při relapsu choroby [160,161].
Gale et al [162] studovali vliv mutací FLT3 u 203 pacientů s APL. Mutace FLT3 byla přítomná u 88 pacientů, u 65 pacientů šlo o mutaci typu ITD. Autoři uvádějí signifikantně vyšší výskyt úmrtí během indukce u pacientů s mutacemi FLT3. Analýza po rozdělení pacientů do skupin podle vstupní koncentrace leukocytů (nad a pod 10 × 109/l) však nepotvrdila nezávislou prediktivní hodnotu přítomnosti mutace FLT3 pro dosažení CR nebo výskyt relapsu. Podobně to neprokázaly ani jiné studie, ale téměř vždy konstatují určitý trend k nižšímu přežití a vyšší incidenci relapsů [158,160,162].
Stále také není zcela jasné, zda vyšší výskyt fatálního krvácení a relapsů u pacientů s leukocytózou vyplývá pouze z leukocytózy, anebo se na nich nějakým způsobem podílí i mutace FLT3 aktivací dalších signálních drah typu STAT5, Ras nebo Src.
Závěr
Přístup k léčbě akutní promyelocytární leukemie přirozeně zaznamenal během posledních 30–40 let významné změny. Za hlavní milníky lze označit použití antracyklinů v indukční a postremisní terapii APL, intenzivní léčbu koagulopatie s důrazem na agresivní substituci trombocytů, zavedení ATRA do indukční léčby a standardizaci indukční léčby kombinací ATRA a antracyklinů. ATO zatím, spíše bohužel, nenalezl své pevné postavení v úvodní léčbě APL, i když je jeho použití při léčbě relapsů v současnosti standardem.
Na tomto místě je vhodné zmínit, že tento přehled si nečinil nárok na vyčerpávající informaci o všech trendech a studiích, které probíhaly či probíhají na poli léčby APL. Cílem bylo chronologicky a s určitou logikou zrekapitulovat nejdůležitější práce, a usnadnit tak čtenáři získání odpovědí na různé otázky související s léčbou APL. Určitá shrnutí současných a všeobecně přijatých doporučení pro úvodní léčbu APL jsou uvedena v tab. 3 a 4.
![Současné doporučení léčby pacientů s APL mimo klinické studie. Podle [165].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/421cab8fd3f3297cc3c1adad028a8c6e.png)
![Současné doporučení léčby pacientů s APL mimo klinické studie. Podle [166].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/017b68c1ba39c82581bc281b3b44d9ec.png)
Na závěr ještě několik vět, které nemusejí vyznít úplně pozitivně. Víme, že incidence APL není rozhodně zanedbatelná, a víme, že v naprosté většině případů jde o vyléčitelné onemocnění. Případy rezistentní leukemie jsou v případě APL zcela raritní, na rozdíl od jiných typů akutní myeloidní leukemie. Pozorný čtenář si nemohl nepovšimnout, že největší problém u APL nespočívá v rozhodování, zda použít v indukci daunorubicin nebo idarubicin nebo zda doplnit léčbu o cytosinarabinosid. Pro přežití pacientů je nejdůležitější včasná diagnostika a rychlé zahájení léčby, pokud možno tam, kde jsou veškeré podmínky pro komplexní terapii APL. Hlavní problém v České republice spočívá ve faktu, že se stále řada pacientů do hematologického centra dostává pozdě, a tedy často ve špatném stavu, který je podmíněn především leukocytózou a rozvinutou koagulopatií. Jak ve svém článku píše kolega Schwarz, léčba APL je jednoznačnou hematologickou emergencí a každá prodleva v zahájení léčby zvyšuje riziko možné fatální komplikace. V jednotlivých centrech specializované hematologické péče je stanovení diagnózy APL včetně molekulárně biologické diagnostiky záležitostí řádově několika hodin a komplexní léčba bývá zahájena už při podezření na možnou APL. Největším problémem tak bohužel zůstává často nepochopitelně dlouhá doba, která nezřídka uplyne od prvního kontaktu pacienta a lékaře. APL přitom postihuje obvykle lidi v produktivním věku, kteří nemají důvod pro banální problémy vyhledávat lékaře. Je přinejmenším zarážející, že se stále setkáváme s tím, že při nezvyklých krvácivých projevech není ordinováno ani tak základní vyšetření, jako je krevní obraz, závažná leukopenie je bagatelizována s doporučením kontroly za měsíc, u pacienta přicházejícího pro horečky není vzata do úvahy doprovodná symptomatologie anémie a přítomnost krvácivých projevů. Abychom tuto situaci ilustrovali, zařadili jsme do tohoto čísla časopisu Vnitřní lékařství i několik kazuistik. Nezbývá než doufat, že tato tematická publikace rozšíří povědomí o akutní promyelocytární leukemii i v řadách nehematologické odborné veřejnosti a že přispěje k tomu, aby se na toto onemocnění více myslelo a nemoc byla diagnostikována a léčena dříve, a tedy s větší nadějí na méně komplikací a vyléčení. Pak se nám jistě společně podaří dosáhnout lepších výsledků, vyléčit více pacientů a přiblížit se těm nejlepším.
Doručeno do redakce: 9. 6. 2008
MUDr. Zdeněk Kořístek
www.fnbrno.cz
e-mail: Zdenek.Koristek@seznam.cz
Sources
1. Hillestad LK. Acute promyelocytic leukemia. Acta Med Scand 1957; 159 : 189–194.
2. Golomb HM, Rowley JD, Vardiman J et al. Partial deletion of long arm of chromosome 17: a specific abnormity in acute promyelocytic leukemia? Arch Intern Med 1976; 136 : 825–828.
3. Rowley JD, Golomb HM, Dougherty C. 15/17 Translocation: a consistent chromosomal change in acute promyelocytic leukemia. Lancet 1977; 1 : 549–550.
4. Larson RA, Kondo K, Vardiman JW et al. Evidence for a 15;17 translocation in every patient with acute promyelocytic leukemia. Am J Med 1984; 76 : 827–841.
5. Mattei MG, Petkovich M, Mattei JF et al. Mapping of the human retinoic acid receptor to the q21 band of chromosome 17. Hum Genet 1988; 80 : 186–188.
6. de The H, Chomienne C, Lanotte M et al. The t(15;17) translocation of acute promyelocytic leukaemia fuses the retinoic acid receptor alpha gene to a novel transcribed locus. Nature 1990; 347 : 558–561.
7. Borrow J, Goddard AD, Sheer D et al. Molecular analysis of acute promyelocytic leukemia breakpoint cluster region on chromosome 17. Science 1990; 249 : 1577–1580.
8. Goddard AD, Borrow J, Freemont P et al. Characterization of a zinc finger gene disrupted by the t(15;17) in acute promyelocytic leukemia. Science 1991; 254 : 1371–1374.
9. Umesono K, Murakami KK, Thompson CC et al. Direct repeats as selective response elements for the thyroid hormone, retinoic acid, and vitamin D3 receptors. Cell 1991; 65 : 1255–1266.
10. Melnick A, Licht JD. Deconstructing a disease: RARα, its fusion partners, and their roles in the pathogenesis of acute promyelocytic leukemia. Blood 1999; 93 : 3167–3215.
11. Chen JD, Evans RM. A transcriptional co-repressor that interacts with nuclear hormone receptors. Nature 1995; 377 : 454–457.
12. Pazin MJ, Kadonaga JT. What’s up and down with histone deacetylation and transcription? Cell 1997; 89 : 325–328.
13. Bannister AJ, Kouzarides T. The CBP co-activator is a histone acetyltransferase. Nature 1996; 348 : 641–643.
14. Chen H, Lin RJ, Schiltz RL et al. Nuclear receptor coactivator ACTR is a novel histone acetyltransferase and forms a multimeric activation complex with P/CAF and CBP/p300. Cell 1997; 90 : 569–580.
15. Chen Z, Brand NJ, Chen A et al. Fusion between a novel Krüppel‑like zinc finger gene and the retinoic acid receptor-α locus due to a variant t(11;17) translocation associated with acute promyelocytic leukaemia. EMBO J 1993; 12 : 1161–1167.
16. Wells RA, Kamel-Reid S. NuMA-RARA, a new gene fusion in acute promyelocytic leukaemia. Blood 1996; 88 : 365a.
17. Redner RL, Rush EA, Faas S et al. The t(5;17) variant of acute promyelocytic leukemia expresses a nucleophosmin – retinoic acid receptor fusion. Blood 1996; 87 : 882–886.
18. Arnould C, Philippe C, Bourdon V et al. The signal transducer and activator of transcription STAT5b gene is a new partner of retinoic acid receptor α in acute promyelocytic‑like leukemia. Hum Mol Genet 1999; 8 : 1741–1749.
19. Catalano A, Dawson MA, Somana K et al. The PRKAR1A gene is fused to RARA in a new variant acute promyelocytic leukemia. Blood 2007; 110 : 4073–4076.
20. Guidez F, Ivins S, Zhu J et al. Reduced retinoic acid-sensitivities of nuclear receptor corepressor binding to PML ‑ and PLZF-RARα underlie molecular pathogenesis and treatment of acute promyelocytic leukemia. Blood 1998; 91 : 2634–2642.
21. Gambacorta M, Flenghi L, Fagioli M et al. Heterogeneous nuclear expression of the promyelocytic leukemia (PML) protein in normal and neoplastic human tissues. Am J Pathol 1996; 149 : 2023–2035.
22. Lam YW, Ammerlaan W, O WS et al. Cell type - and differentiation stage-dependent expression of PML domains in rat, detected by monoclonal antibody HIS55. Exp Cell Res 1995; 221 : 344–356.
23. Wang ZG, Delva L, Gaboli M et al. Role of PML in cell growth and the retinoic acid pathway. Science 1998; 279 : 1547–1551.
24. Salomoni P, Pandolfi PP. The role of PML in tumor suppression. Cell 2002; 108 : 165–170.
25. Grisolano JL, Wesselschmidt RL, Pelicci PG et al. Altered myeloid development and acute leukemia in transgenic mice expressing PML‑RAR alpha under control of cathepsin G regulatory sequences. Blood 1997; 89 : 376–387.
26. Klemsz MJ, McKercher SJ, Celada A et al. The macrophage and B cell-specific transcription factor PU.1 is related to the ets oncogene. Cell 1990; 61 : 113–124.
27. Fisher RC, Scott EW. Role of PU.1 in hematopoiesis. Stem Cells 1998; 16 : 25–37.
28. Lekstrom-Himes JA. The role of C/EBPε in the terminal stages of granulocyte differentiation. Stem Cells 2001; 19 : 125–133.
29. Metcalf D, Dakic A, Mifsud S et al. Inactivation of PU.1 in adult mice leads to the development of myeloid leukemia. Proc Natl Acad Sci USA 2006; 103 : 1486–1491.
30. Dakic A, Metcalf D, Di Rago L et al. PU.1 regulates the commitment of adult hematopoietic progenitors and restricts granulopoiesis. J Exp Med 2005; 201 : 1487–1502.
31. Walter MJ, Park JS, Ries RE et al. Reduced PU.1 expression causes myeloid progenitor expansion and increased leukemia penetrance in mice expressing PML‑RARα. Proc Natl Acad Sci USA 2005; 102 : 12513–12518.
32. Mueller BU, Pabst T, Fos J et al. ATRA resolves the differentiation block in t(15;17) acute myeloid leukemia by restoring PU.1 expression. Blood 2006; 107 : 3330–3338.
33. Didisheim P, Trombold JS, Vandervoort RLE et al. Acute promyelocytic leukemia with fibrinogen and factor V deficiencies. Blood 1964; 23 : 717–728.
34. Bernard J, Weil M, Boiron M et al. Acute promyelocytic leukemia: results of treatment by daunorubicin. Blood 1973; 41 : 489–496.
35. Cunningham I, Gee TS, Reich LM et al. Acute promyelocytic leukemia: treatment results during a decade at Memorial Hospital. Blood 1989; 73 : 1116–1122.
36. Cordonnier C, Vernant JP, Brun B et al. Acute promyelocytic leukemia in 58 previously untreated patients. Cancer 1985; 55 : 18–25.
37. Daly PA, Schiffer CA, Wiernik PH. Acute promyelocytic leukemia – Clinical management of 15 patients. Am J Hematol 1980; 8 : 347–359.
38. Collins AJ, Bloomfield CD, Peterson BS et al. Acute promyelocytic leukemia. Management of the coagulopathy during daunorubicine-prednisone remission induction. Arch Intern Med 1978; 138 : 1677–1680.
39. Bennett JM, Begg CB. Eastern Cooperative Oncology Group study of the cytochemistry of adult acute myeloid leukemia by correlation of subtypes with response and survival. Cancer Res 1981; 41 : 4833–4837.
40. Hurd DD, Vukelich M, Artur DC et al. 15;17 translocation in acute promyelocytic leukemia. Cancer Genet Cytogenet 1982; 6 : 331–337.
41. Cassileth PA, Begg CB, Bennett JM et al. A randomized study of the efficacy of consolidation therapy in adult nonlymphocytic leukemia. Blood 1984; 63 : 843–847.
42. Kantarjian HM, Keating MJ, McCredie G et al. Acute promyelocytic leukemia: The M.D. Anderson Hospital experience. Am J Med 1986; 80 : 789–797.
43. Ruggero D, Baccarani M, Guarini A et al. Acute promyelocytic leukemia: Results of therapy and analysis of 13 cases. Acta Haematol 1977; 58 : 108–119.
44. Rai KR, Holland JF, Glidewell OJ et al. Treatment of acute myelocytic leukemia: A study by cancer and leukemia group B. Blood 1981; 58 : 1203–1212.
45. Weinstein HJ, Mayer RJ, Rosenthal DS et al. Chemotherapy for acute myelogenous leukemia in children and adults: VAPA update. Blood 1983; 62 : 315–319.
46. Goldberg MA, Ginsburg D, Mayer RJ et al. Is heparin administration necessary during induction chemotherapy for patients with acute promyelocytic leukemia? Blood 1987; 69 : 187–191.
47. Fujimaki Y. Formation of carcinoma in albino rats fed on deficient diets. J Cancer Res 1926; 10 : 469–477.
48. Wolbach SB, Howe PR. Tissue changes following deprivation of fat soluble A vitamin. J Exp Med 1925; 42 : 753–777.
49. Wolbach SB, Howe PR. Vitamin A deficiency in guinea pig. Arch Pathol Lab Med 1928; 5 : 239–253.
50. Bollag W. Prophylaxis of chemically induced benign and malignant epithelial tumors by vitamin A acid (retinoid acid). Eur J Cancer 1972; 8 : 689–693.
51. Sporn MB, Square RA, Brown CC et al. 13-cis‑retinoic acid: inhibition of bladder carcinogenesis in the rat. Science 1977; 195 : 487–489.
52. Hodges R, Sauberlich H, Canham J et al. Hematopoietic studies in Vitamin A deficienty. Am J Clin Nutr 1978; 31 : 876–885.
53. Collins SJ, Gallo RC, Gallagher RE. Continuous growth and differentiation of human myeloid leukaemic cells in suspension culture. Nature 1977; 270 : 347–349.
54. Collins SJ, Ruscetti FW, Gallagher RE et al. Terminal differentiation of human promyelocytic leukemia cells induced by dimethyl sulfoxide and other polar compounds. Proc Natl Acad Sci USA 1978; 75 : 2458–2462.
55. Breitman TR, Selonick SE, Collins SJ. Induction of differentiation of the human promyelocytic leukemia cell line (HL‑60) by retinoid acid. Proc Natl Acad Sci USA 1980; 77 : 2936–2940.
56. Heller EH, Shiffman NJ. Syntetic retinoids in dermatology. Can Med Assoc J 1985; 132 : 1129–1136.
57. Flynn PJ, Miller WJ, Weisdorf DJ et al. Retinoic acid treatment of acute promyelocytic leukemia: in vitro and in vivo observation. Blood 1983; 62 : 1211–1217.
58. Nilsson B. Probable in vivo induction of differentiation by retinoid acid of promyelocytes in acute promyelocytic leukemia. Br J Haematol 1984; 57 : 365–371.
59. Fontana JA, Rogers JS, Durham JP. The role of 13-cis‑retinoic acid in the remission induction of a patient with acute promyelocytic leukemia. Cancer 1986; 57 : 209–217.
60. Daenen S, Vellenga E, van Dobbenburgh OA et al. Retinoic acid as antileukemic therapy in a patient with acute promyelocytic leukemia and Aspergillus pneumonia. Blood 1986; 67 : 559–561.
61. Sampi K, Honma Y, Hozumi M et al. Discrepancy between in-vitro and in-vivo inductions of differentiation by retinoids of human acute promyelocytic leukemia cells in relapse. Leuk Res 1985; 9 : 1475–1478.
62. Chomienne C, Ballerini P, Balitrand N et al. All-trans retinoic acid in acute promyelocytic leukemias: II. In vitro studies: structure-function relationship. Blood 1990; 76 : 1710–1717.
63. Chomienne C, Ballerini P, Balitrand N et al. Retinoic acid therapy for promyelocytic leukaemia. Lancet 1989; 2 : 746–747.
64. Windhorst DB, Nigra T. General clinical toxicity of oral retinoids. J Am Acad Dermatol 1982; 6 : 675–682.
65. Cullum ME, Zile MH. Metabolism of all‑trans‑retinoic acid and all‑trans‑retinyl acetate. Demonstration of common physiological metabolites in rat small intestinal mucosa and circulation. J Biol Chem 1985; 260 : 10590–10596.
66. Huang ME, Ye YC, Chen SR et al. Use of all‑trans retinoic acid in the treatment of acute promyelocytic leukemia. Blood 1988; 72 : 567–572.
67. Chen ZX, Xue YQ, Zhang R et al. A clinical and experimental study on all‑trans retinoic acid-treated acute promyelocytic leukemia patients. Blood 1991; 78 : 1413–1419.
68. Castaigne S, Chomienne C, Daniel MT et al. All-trans retinoic acid as a dif-ferentiation therapy to acute promyelocytic leukemia. I. Clinical Results. Blood 1990; 76 : 1704–1709.
69. Fenaux P, Castaigne S, Dombret H et al. All-transretinoic acid followed by intensive chemotherapy gives a high complete remission rate and may prolong remission in newly diagnosed acute promyelocytic leukemia: a pilot study on 26 cases. Blood 1992; 80 : 2176–2181.
70. Warrell RP Jr, Frankel R, Miller WH Jr et al. Differentiation therapy of acute promyelocytic leukemia with tretinoin (all trans retinoic acid). N Engl J Med 1991; 324 : 1385–1393.
71. Fenaux P, Le Deley MC, Castaigne S et al. Effect of all transretinoic acid in newly diagnosed acute promyelocytic leukemia. Results of a multicenter randomized trial. European APL 91 Group. Blood 1993; 82 : 3241–3249.
72. Fenaux P, Chastang C, Chevret S et al. A randomized comparison of all trans-retinoic acid (ATRA) followed by chemotherapy and ATRA plus chemotherapy and the role of maintenance therapy in newly diagnosed acute promyelocytic leukemia. Blood 1999; 94 : 1192–1200.
73. Vahdat L, Maslak P, Miller WH et al. Early mortality and the retinoic acid syndrome in acute promyelocytic leukemias: Impact of leukocytosis, low-dose chemotherapy, PMN/RARAα isoform, and CD13 expression in patients treated with all‑trans retinoic acid. Blood 1994; 84 : 3843–3849.
74. Bourgeois E, Chevret S, Sanz M et al. Long term follow up of APL treated with ATRA and chemotherapy (CT) including incidence of late relapses and overall toxicity. Blood 2003; 102 : 140a, (Abstract 483).
75. Frankel SR, Eardley A, Heller G et al. All-trans retinoic acid for acute promyelocytic leukemia. Results of the New York study. Ann Intern Med 1994; 120 : 278–286.
76. Tallman MS, Andersen JW, Schiffer CA et al. All-trans‑retinoic acid in acute promyelocytic leukemia. N Engl J Med 1997; 337 : 1021–1028.
77. Tallman MS, Andersen JW, Schiffer CA et al. All-trans retinoic acid in acute promyelocytic leukemia: long-term outcome and prognostic factor analysis from the North American Intergroup protocol. Blood 2002; 100 : 4298–4302.
78. Kanamaru A, Takemoto Y, Tanimoto M et al. All-trans retinoic acid for the treatment of newly diagnosed acute promyelocytic leukemia. Japan Adult Leukemia Study Group Blood 1995; 85 : 1202–1206.
79. Head D, Kopecky KJ, Weick J et al. Effect of agressive daunorubicine therapy on survival in acute promyelocytic leukemia. Blood 1995; 86 : 1717–1728.
80. Avvisati G, Mandelli F, Petti MC et al. Idarubicin (4-demethoxydaunorubicin) as single agent for remission induction of previously untreated acute promyelocytic leukemia: a pilot study of the Italian cooperative group GIMEMA. Eur J Haematol 1990; 44 : 257–260.
81. Avvisati G, Petti MC, Lo Coco F et al. Induction therapy with idarubicin alone significantly influences event-free survival duration in patients with newly diagnosed hypergranular acute promyelocytic leukemia: Final results of the GIMEMA randomized study LAP 0389 with 7 years of minimal follow‑up. Blood 2002; 100 : 3141–3146.
82. Testi AM, Biondi A, Lo Coco F et al. GIMEMA-AIEOP AIDA protocol for the treatment of newly diagnosed acute promyelocytic leukemia (APL) in children. Blood 2005; 106 : 447–453.
83. Avvisati G, Lo Coco F, Diverio D et al. AIDA (all‑trans retinoic acid+idarubicin) in newly diagnosed acute promyelocytic leukemia: A Gruppo Italiano Malattie Ematologiche dell’Adulto (GIMEMA) pilot study. Blood 1996; 88 : 1390–1398.
84. Mandelli F, Diverio D, Avvisati G et al. Molecular remission in PML/RARα-positive acute promyelocytic leukemia by combined all‑trans retinoic acid and idarubicin (AIDA) therapy. Blood 1997; 90 : 1014–1021.
85. Avvisati G, Petti MC, Lo Coco F et al. AIDA: The Italian way of treating acute promyelocytic leukemia (APL). Final act. Blood 2003; 102 : 104a (Abstract 487).
86. Schwarz J, Lemež P, Lukášová M et al. High incidence of thromboembolic events in leukemic patients with acute promyelocytic leukemia (APL). Blood 1996; 88 : 169b (Abstract 3404).
87. Baker WG, Bang NU, Nachman RL et al. Hypofibrinogenemic hemorrhage in acute myelogenous leukemia treated with heparin. With autopsy findings of widespread intravascular clotting. Ann Intern Med 1964; 61 : 116–123.
88. Testi AM, Lo Coco F, Biondi A et al. GIMEMA-AIEOP AIDA protocol for the treatment of newly diagnosed acute promyelocytic leukemia (APL) in children. Blood 2003; 102 : 141a (Abstract 485).
89. Burnett AK, Grimwade D, Solomon E et al. Presenting white blood cell count and kinetics of molecular remission predict prognosis in acute promyelocytic leukemia treated with all‑trans retinoic acid: result of randomized MRC trial. Blood 1999; 93 : 4131–4143.
90. Lengfelder E, Reichert A, Schoch C et al. Double induction strategy including high dose cytarabine in combination with all‑trans retinoic acid: effects in patients with newly diagnosed acute promyelocytic leukemia. German AML Cooperative Group. Leukemia 2000; 14 : 1362–1370.
91. Sanz MA, Martín G, Rayón C et al. A modified AIDA protocol with anthracycline‑based consolidation results in high antileukemic eficacy and reduced toxicity in newly diagnosed PML/RARα-positive acute promyelocytic leukemia. Blood 1999; 94 : 3015–3021.
92. Sanz MA, Martín G, Gonzáles M et al. Risk-adapted treatment of acute promyelocytic leukemia with all‑trans‑retinoic acid and anthracycline monochemotherapy: a multicenter study by the PETHEMA group. Blood 2004; 103 : 1237–1243.
93. Adés L, Chevret S, Raffoux E et al. Is cytarabine useful in the treatment of acute promyelocytic leukemia? Results of a randomized trial from the European Acute Promyelocytic Leukemia Group. J Clin Oncol 2006; 24 : 5703–5710.
94. Warrell RP Jr. Retinoid resistance in acute promyelocytic leukemia: new mechanisms, strategies, and implications. Blood 1993; 82 : 1949–1953.
95. Gallagher RE. Retinoic acid resistance in acute promyelocytic leukemia. Leukemia 2002; 16 : 1940–1958.
96. Zhou DC, Hallam SJ, Lee SJ et al. Constitutive expression of cellular retinoic acid binding protein II and lack of correlation with sensitivity to all‑trans retinoic acid in acute promyelocytic leukemia cells. Cancer Res 1998; 58 : 5770–5776.
97. Fiorella PD, Napoli JL. Expression of cellular retinoic acid binding protein (CRABP) in Escherichia coli. Characterization and evidence that holo-CRABP is a substrate in retinoic acid metabolism. J Biol Chem 1991; 266 : 16572–16579.
98. Cornic M, Delva L, Guidez F et al. Induction of retinoic acid-binding protein in normal and malignant human myeloid cells by retinoic acid in acute promyelocytic leukemia patients. Cancer Res 1992; 52 : 3329–3334.
99. Delva L, Cornic M, Balitrand N et al. Resistance to all‑trans retinoic acid (ATRA) therapy in relapsing acute promyelocytic leukemia: study of in vitro ATRA sensitivity and cellular retinoic acid binding protein levels in leukemic cells. Blood 1993; 82 : 2175–2181.
100. Muindi JF, Young CW. Lipid hydroperoxides greatly increase the rate of oxidative catabolism of all‑trans‑retinoic acid by human cell culture microsomes genetically enriched in specified cytochrome P-450 isoforms. Cancer Res 1993; 53 : 1226–1229.
101. Muindi J, Frankel SR, Miller WH Jr et al. Continuous treatment with all‑trans retinoic acid causes a progressive reduction in plasma drug concentrations: implications for relapse and retinoid “resistance” in patients with acute promyelocytic leukemia. Blood 1992; 79 : 299–303.
102. Adamson PC, Boylan JF, Balis FM et al. Time course of induction of metabolism of all‑trans‑retinoic acid and the up-regulation of cellular retinoic acid-binding protein. Cancer Res 1993; 53 : 472–476.
103. Drach J, Lopez-Berestein G, McQueen G et al. Induction of differentiation in myeloid leukemia cell lines and acute pomyelocytic leukemia cells by liposomal all‑trans‑retinoic acid. Cancer Res 1993; 53 : 2100–2104.
104. Douer D, Estey E, Santillana S et al. Treatment of newly diagnosed and relapsed acute promyelocytic leukemia with intravenous liposomal all‑trans retinoic acid. Blood 2001; 97 : 73–80.
105. Estey EH, Giles FJ, Kantarjian H et al. Molecular remissions induced by liposomal-encapsulated all‑trans retinoic acid in newly diagnosed acute promyelocytic leukemia. Blood 1999; 94 : 2230–2235.
106. Tsimberidou AM, Tirado-Go-mez M, Andreeff M et al. Single-agent liposomal all‑trans retinoic acid can cure some patients with untreated acute promyelocytic leukemia: an update of The University of Texas M.D. Anderson Cancer Center Series. Leuk Lymphoma 2006; 47 : 1062–1068.
107. Zhou DC, Kim SH, Ding W et al. Frequent mutations in the ligand-binding domain of PML‑RARα after multiple relapses of acute promyelocytic leukemia: analysis for functional relationship to response to all‑trans retinoic acid and histone deacetylase inhibitors in vitro and in vivo. Blood 2002; 99 : 1356–1363.
108. Marasca R, Zucchini P, Galimberti S et al. Missense mutations in the PML/RARα ligand binding domain in ATRA-resistant As(2)O(3) sensitive relapsed acute promyelocytic leukemia. Haematologica 1999; 84 : 963–968.
109. Marasca R, Zucchini P, Iannitelli P et al. PML/RAR alpha mutations in relapsed acute promyelocytic leukemia. Joint International Congress on APL and Differentiation therapy 2001 (Abstract 34).
110. Ding W, Li YP, Nobile LM et al. Leukemic cellular retinoic acid resistance and missense mutations in the PML‑RARα fusion gene after relapse of acute promyelocytic leukemia from treatment with all‑trans retinoid acid and intensive chemotherapy. Blood 1998; 92 : 1172–1183.
111. Imaizumi M, Suzuki H, Yoshinari M et al. Mutations in the E-domain of RARα portion of the PML/RARα chimeric gene may confer clinical resistance to all‑trans retinoic acid in acute promyelocytic leukemia. Blood 1998; 92 : 374–382.
112. Côté S, Rosenauer A, Bianchini A et al. Response to histone deacetylase inhibition of novel PML/RARα mutants detected in retinoic acid-resistant APL cells. Blood 2002; 100 : 2586–2596.
113. Takayama N, Kizaki M, Hida T et al. Novel mutation in the PML/RARα chimeric gene exhibits dramatically decreased ligand-binding activity and confers aquired resistence to retinoic acid in acute promyelocytic leukemia. Exp Hematol 2001; 29 : 864–872.
114. Nason-Burchenal K, Allopenna J, Begue A et al. Targeting of PML/RARα is lethal to retinoic acid-resistant promyelocytic leukemia cells. Blood 1998; 92 : 1758–1767.
115. Shao W, Benedetti L, Lamph WW et al. A retinoid-resistant acute promyelocytic leukemia subclone expresses a dominant negative PML‑RAR alpha mutation. Blood 1997; 89 : 4282–4289.
116. Kitamura K, Kiyoi H, Yoshida H et al. Mutant AF-2 domain of PML‑RARα in retinoic acid-resistant NB4 cells: differentiation induced by RA is triggered directly through PML‑RARα and its down-regulation in acute promyelocytic leukemia. Leukemia 1997; 11 : 1950–1956.
117. Dupres E, Benoit G, Flexor M et al. A mutated PML/RARA found in the retinoid maturation resistant NB4 subclone, NB4-R2, blocks RARA and wild-type PML/RARA transcriptional activities. Leukemia 2000; 14 : 255–261.
118. Zhang TD, Chen GQ, Wang ZG et al. Arsenic trioxide, a therapeutic agent for APL. Oncogene 2001; 20 : 7146–7153.
119. Lissauer H. Zwei Fälle von Leukämie. Berl Klin Wochenschr 1865; 2 : 403–404.
120. Conrad ME. Treatment of acute promyelocytic leukemia with arsenic trioxide. N Engl J Med 1999; 340 : 1044–1045.
121. Kwong YL, Todd D. Delicious Poison: Arsenic trioxide for the treatment of leukemia. Blood 1997; 89 : 3487–3487.
122. Forkner CE, Scott TFM. Arsenic as a therapeutic agent in chronic myelogenous leukemia. JAMA 1931; 97 : 3–5.
123. Zhou GB, Zhao WL, Wang ZY et al. Retinoic acid and arsenic for treating acute promyelocytic leukemia. PLoS Med 2005; 2: e12.
124. Shen ZX, Chen GQ, Ni JH et al. Use of arsenic trioxide (As2O3) in the treatment of acute promyelocytic leukemia (APL): II. Clinical efficacy and pharmacokinetics in relapsed patients. Blood 1997; 89 : 3354–3360.
125. Soignet SL, Maslak P, Wang ZG et al. Complete remission after treatment of acute promyelocytic leukemia with arsenic trioxide. N Engl J Med 1998; 339 : 1341–1348.
126. Soignet SL. Clinical experience of arsenic trioxide in relapsed acute promyelocytic leukemia. Oncologist 2001; 6 : 11–16.
127. Soignet SL, Frankel SR, Douer D et al. United States multicenter study of arsenic trioxide in relapsed acute promyelocytic leukemia. J Clin Oncol 2001; 19 : 3852–3860.
128. Douer D, Hu W, Giralt S et al. Arsenic trioxide (trisenox) therapy for acute promyelocytic leukemia in the setting of hematopoietic stem cell transplantation. Oncologist 2003; 8 : 132–140.
129. Niu C, Yan H, Yu T et al. Studies on treatment of acute promyelocytic leukemia with arsenic trioxide: remission induction, follow‑up, and molecular monitoring in 11 newly diagnosed and 47 relapsed acute promyelocytic leukemia patients. Blood 1999; 94 : 3315–3324.
130. Mathews V, George B, Lakshmi KM et al. Single-agent arsenic trioxide in the treatment of newly diagnosed acute promyelocytic leukemia: durable remissions with minimal toxicity. Blood 2006; 107 : 2627–2632.
131. Singer JW, Kirkhart B, Frank K et al. Safety with Trisenox (arsenic trioxide). Blood 2003; 102 : 11. Abstract 5767.
132. Estey E, Garcia-Manero G, Ferra-joli A et al. Use of all‑trans retinoic acid plus arsenic trioxide as an alternative to chemotherapy in untreated acute promyelocytic leukemia. Blood 2006; 107 : 3469–3473.
133. Sanz MA, Vellenga E, Rayón C et al. All-trans retinoic acid and anthracycline monochemotherapy for the treatment of elderly patients with acute promyelocytic leukemia. Blood 2004; 104 : 3490–3493.
134. Ades L, Chevret S, De Botton S et al. Outcome of acute promyelocytic leukemia treated with all trans retinoic acid and chemotherapy in elderly patients: the European group experience. Leukemia 2005; 19 : 230–233.
135. Powell BL. Effect of consolidation with arsenic trioxide (As2O3) on event-free survival (EFS) and overall survival (OS) among patients with newly diagnosed acute promyelocytic leukemia (APL): North American Intergroup Protocol C9710. J Clin Oncol 2007; 25 : 5143–5150.
136. Chen GQ, Shi XG, Tang W et al. Use of arsenic trioxide (As2O3 ) in the treatment of acute promyelocytic leukemia (APL): I. As2O3 exerts dose-dependent dual effects on APL cells. Blood 1997; 89 : 3345–3353.
137. Pan XY, Chen GQ, Cai L et al. Anion exchanger 2 mediates the action of arsenic trioxide. Br J Haematol 2006; 134 : 491–499.
138. Jennette KW. The role of metals in carcinogenesis: biochemistry and metabolism. Environ Health Perspect 1981; 40 : 233–252.
139. Chen GQ, Zhu J, Shi XG et al. In vitro studies on cellular and molecular mechanisms of arsenic trioxide (As2O3) in the treatment of acute promyelocytic leukemia: As2O3 induces NB4 cell apoptosis with downregulation of Bcl-2 expression and modulation of PML‑RAR alpha/PML proteins. Blood 1996; 88 : 1052–1061.
140. Chen Z, Chen GQ, Shen ZX et al. Treatment of acute promyelocytic leukemia with arsenic compounds: in vitro and in vivo studies. Semin Hematol 2001; 38 : 26–36.
141. Davison K, Mann KK, Miller WH Jr. Arsenic trioxide: Mechanisms of action. Semin Hematol 2002; 39 : 3–7.
142. Huang C, Ma W, Li J et al. Arsenic induces apoptosis through a c-Jun NH2-terminal kinase-dependent, p53-in-dependent pathway. Cancer Res 1999; 59 : 3053–3058.
143. De Thé H, Chelbi-Alix MK. APL, a model disease for cancer therapies? Oncogene 2001; 20 : 7136–7139.
144. Lallemand-Breitenbach V, Zhu J, Puvion F et al. Role of promyelocytic leukemia (PML) sumolation in nuclear body formation, 11S proteasome recruitment, and As2O3‑induced PML or PML/retinoic acid receptor alpha degradation. J Exp Med 2001; 193 : 1361–1371.
145. Mann KK, Padovani AMS, Guo Q et al. Arsenic trioxide inhibits nuclear receptor function via SEK1/JNK–mediated RXRα phosphorylation. J Clin Invest 2005; 115 : 2924–2933.
146. Jing Y, Wang L, Xia L et al. Combined effect of all‑trans retinoic acid and arsenic trioxide in acute promyelocytic leukemia cells in vitro and in vivo. Blood 2001; 97 : 264–269.
147. Zhang P, Wang SY, Hu XH et al. Arsenic trioxide-treated 72 cases of acute promyelocytic leukemia. Chin J Hematol 1996; 17 : 170–171.
148. De Botton S, Chevret S, Sanz M et al. Additional chromosomal abnor--malities have no effect on the clinical outcome of patients with acute promyelocytic leu-kemia. Br J Haematol 2000; 111 : 801–806.
149. Cervera J, Martín G, Hernández JM et al. Additional chromosome abnormalities have no prognostic value in acute promyelocytic leukemia patiens treated with simultaneous ATRA and anthracycline‑based chemotherapy: an update of the LPA96 and LPA99 PETHEMA protocols. Blood 2004; 104 : 2019.
150. Hernández JM, Martín G, Gutiérrez NC et al. Additional cytogenetic changes do not influence the outcome of patients with newly diagnose acute promyelocytic leukemia treated with an ATRA plus an-thracyclin based protocol. A report of the Spanish group PETHEMA. Haematologica 2001; 86 : 807–813.
151. Gilliland DG, Griffin JD. The roles of FLT3 in hematopoiesis and leukemia. Blood 2002; 100 : 1532–1542.
152. Molineaux G, McCrea C, Yan XQ et al. Flt-3 ligand synergizes with granulocyty colony-stimulating factor to increase neutrophil numbers and to mobilize peripheral blood stem cells with long–term repopulating potential. Blood 1997; 89 : 3998–4004.
153. Yamamoto Y, Kioyoi H, Nakano Y et al. Activating mutation of D835 within the activation loop of FLT3 in human hematological malignancies. Blood 2001; 97 : 2434–2439.
154. Kiyoi H, Towatari M, Kokota S et al. Internal tandem duplication of the FLT3 gene is a novel modality of elongation mutation which causes constitutive activation of the product. Leukemia 1998; 12 : 1333–1337.
155. Rombouts WJC, Blokland I, Löwenberg B et al. Biological characteristics and prognosis of adult acute myeloid leukemia with internal tandem duplications in the FLT3 gene. Leukemia 2000; 14 : 675–683.
156. Schnittger S, Schoch C, Dugas M et al. Analysis of FLT3 length mutations in 1003 patients with acute myeloid leukemia: correlation to cytogenetics, FAB subtype, and prognosis in the AMLCG study and usefulness as a marker for the detection of minimal residual disease. Blood 2002; 100 : 59–66.
157. Thiede C, Steudel C, Mohr B et al. Analysis of FLT3-activationg mutations in 979 patients with acute myelogenous leukemia: association with FAB subtypes and identification of subgroups with poor prognosis. Blood 2002; 99 : 4326–4335.
158. Callens C, Chevret S, Cayuela JM et al. Prognostic implication of FLT3 and Ras gene mutations in patients with acute promyelocytic leukemia (APL): a retrospective study from the European APL Group. Leukemia 2005; 19 : 1153–1160.
159. Kiyoi H, Naoe T, Yokota S et al. Internal tandem duplication of FLT3 associated with leukocytosis in acute promyelocytic leukemia: Leukemia Study Group of the Ministry of Health and Welfare (Kohseisho). Leukemia 1997; 11 : 1447–1452.
160. Au WY, Fung A, Chim CS et al. FLT-3 aberrations in acute promyelocytic leukemia: clinicopathological associations and prognostic impact. Br J Haematol 2004; 125 : 463–469.
161. Kottaridis PD, Gale RE, Langabeer SE et al. Studies of FLT3 mutations in paired presentation and relapse samples from patients with acute myeloid leukemia: implications for the role of FLT3 mutations in leukemogenesis, minimal residual disease detection, and possible therapy with FLT3 inhibitors. Blood 2002; 100 : 2393–2398.
162. Gale RE, Hilus R, Pizzey AR et al. Relationship between FLT3 mutation status, biologic characteristics, and response to targeted therapy in acute promyelocytic leukemia. Blood 2005; 106 : 3768–3776.
163. Noguera NI, Breccia M, Divona M et al. Alterations of the FLT3 gene in acute promyelocytic leukemia: association with diagnostic characteristics and analysis of clinical outcome in patients treated with the Italian AIDA protocol. Leukemia 2002; 16 : 2185–2189.
164. Shen Y, Shen ZX, Yan H et al. Studies on the clinical efficacy and pharmacokinetics of low-dose arsenic trioxide in the treatment of relapsed acute promyelocytic leukemia: A comparison with conventional dosage. Leukemia 2001; 15 : 735–741.
165. Tallman MS, Nabhan C, Feusner JH et al. Acute promyelocytic leukemia: evolving therapeutic strategies. Blood 2002; 99 : 759–767.
166. Sanz MA, Tallman MS, Lo-Coco F. Tricks of the trade for the appropriate management of newly diagnosed acute promyelocytic leukemia. Blood 2005; 105 : 3019–3025.
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Internal Medicine

2008 Issue 7-8
-
All articles in this issue
- Relaps akutní promyelocytární leukemie a role transplantace krvetvorných kmenových buněk v terapii APL
- Léčba akutní promyelocytární leukemie v Česku: výsledky a analýza prognostických faktorů
- Stručné kazuistiky ilustrující úvodní průběh u akutní promyelocytární leukemie
- Jak léčíme nemocné s esenci ální trombocytemi í a dalšími myeloproliferacemi provázenými trombocytemi í a co může být prediktivní známko u rizika trombózy u těchto nemocných – zpráva z registru paci entů léčených Thromboreductinem®
- Od chloromu k akutní promyelocytární leukemii – pohledy do historie
- Leukemogeneza a léčba akutní promyelocytární leukemie: cesta od nejhoršího k nejpříznivějšímu typu akutní myeloidní leukemie
- Urgentní stav v hematologii: akutní promyelocytární leukemie – principy diagnostiky
- Koagulopatie a diferenciační syndrom: hlavní komplikace úvodní léčby akutní promyelocytární leukemie
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue
- Urgentní stav v hematologii: akutní promyelocytární leukemie – principy diagnostiky
- Koagulopatie a diferenciační syndrom: hlavní komplikace úvodní léčby akutní promyelocytární leukemie
- Stručné kazuistiky ilustrující úvodní průběh u akutní promyelocytární leukemie
- Léčba akutní promyelocytární leukemie v Česku: výsledky a analýza prognostických faktorů
