Léčba akutní promyelocytární leukemie v Česku: výsledky a analýza prognostických faktorů
Therapy of acute promyelocytic leukemia in Czechia: results and analysis of prognostic factors
We have retrospectively evaluated a cohort of 144 patients (including 17 pediatric ones) with de novo acute promyelocytic leukemia registered in databases of institutions cooperating within the CELL group (The Czech Leukemia Study Group for Life). The patients were diagnosed according to WHO criteria from 1989 until 2006. The aim was to check how well fared the patients, the majority of whom was not included into clinical trials, in real life. Of 140 evaluable patients, 97 (69.3%) attained complete remission (CR). The projected overall survival (OS) 4 years after diagnosis was 58.9%, and 55.3% at 6 years. In 8 patients (6.0%), no antileukemic therapy at all was given (either they died shortly after admission to the ward or therapy was not feasible due to their clinical status). Of 125 patients with documented commencement of some kind of therapy, 96 (76.8%) achieved CR. Of 102 patients with induction treatment with a combination of anthracycline and tretino in (ATRA), 84 individuals (82.4 %) attained CR (typically, this cohort might have been subjected to clinical trials). This result was better than that of patients treated by chemotherapy only (n = 15; CR 46.7%; P = 0.003) or by ATRA monotherapy (n = 13; CR 62.5%; P = 0.17). Another parameter with a significant impact on attaining CR was the leukocyte (WBC) count at diagnosis: its median values in patients achieving and not achieving CR were 2.1 and 24.0 × 109/ l, respectively (P < 0.0001). The WBC counts affected OS as well (P = 0.0001). However, when only patients after attaining CR were evaluated, the initial WBC counts no longer affected OS (P = 0.18). Achieving CR was also influenced by the performance status (PS) 0– 1 (P = 0.005), which was in turn closely correlated to WBC counts (P = 0.0006). Additional factors (most likely connected with leukocytosis) influenced attaining CR with borderline statistical significance: e. g. FAB M3v morphology, LDH serum level, fibrinogen level, presence of internal tandem duplicati on (ITD) of the FLT3 gene (which was strongly associated with leukocytosis and also with the short PML/ RARα transcript resulting from the bcr3 bre ak in the PML gene). It may be speculated that FLT3‑ ITD is just one of the possible factors that lead to leukocytosis. The platelet counts at diagnosis had no impact on entering CR. Thus, we have not validated the current PETHEMA risk stratificati on in distinguishing intertermediate and low risk patients. Our study points to a significant difference of the results obtained in real life and of the results that could be achieved in patients who were fit to enter clinical trials. Among the prognostic factors, the most important one was the WBC co unt, the PS (which is highly affected by the WBC count), and feasibility of administration of the most potent induction therapy with anthracyclines and ATRA.
Key words:
acute promyelocytic leukemia – therapy – chemotherapy – tretino in (ATRA) – prognostic factors – PML/ RARα fusion gene – FLT3 gene – performance status
Authors:
J. Schwarz 1; Z. Kořístek 2; J. Starý 3; P. Žák 4; T. Kozák 5; J. Marková 1; K. Michalová 6,7; D. Dvořáková 8; J. Mayer 2; P. Cetkovský 1
Authors‘ workplace:
Klinický úsek Ústavu hematologie a krevní transfuze Praha, přednosta doc. MUDr. Petr Cetkovský, Ph. D.
1; Interní hematoonkologická klinika Lékařské fakulty MU a FN Brno, pracoviště Bohunice, přednosta prof. MUDr. Jiří Vorlíček, CSc.
2; Klinika dětské hematologie a onkologie 2. lékařské fakulty UK a FN Motol Praha, přednosta prof. MUDr. Jan Starý, DrSc.
3; Oddělení klinické hematologie II. interní kliniky Lékařské fakulty UK a FN Hradec Králové, přednosta prof. MUDr. Jaroslav Malý, CSc.
4; Oddělení klinické hematologie FN Královské Vinohrady Praha, přednosta doc. MUDr. Tomáš Kozák, Ph. D., MBA
5; Centrum nádorové cytogenetiky 1. lékařské fakulty UK a VFN Praha, přednosta prof. MUDr. Tomáš Zima, DrSc., MBA
6; Výzkumný úsek Ústavu hematologie a krevní transfuze Praha, vedoucí prof. Ing. Jan E. Dyr, DrSc.
7; Centrum molekulární biologie a genové terapie Interní hematoonkologické kliniky Lékařské fakulty MU a FN Brno, pracoviště Bohunice, přednosta prof. MUDr. Jiří Vorlíček, CSc.
8
Published in:
Vnitř Lék 2008; 54(7-8): 757-770
Category:
Original Contributions
Overview
Byl retrospektivně hodnocen soubor 144 pacientů (včetně 17 pediatrických) s de novo akutní promyelocytární leukemií z databází institucí spolupracujících v rámci skupiny CELL (The Czech Leukemia Study Group for Life), diagnostikovaných podle WHO kritérií v letech 1989–2006. Cílem bylo ověřit, jak se dařilo v reálném životě všem pacientům, z nichž naprostá většina nebyla zařazena do klinických studií. Ze 140 hodnotitelných pacientů dosáhlo kompletní remise (CR) 97 (69,3 %). Projekce celkového přežití (OS) po 4 letech od doby diagnózy byla 58,9 %, po 6 letech 55,3 %. U 8 nemocných (6,0 %) nebyla podána žádná antileukemická léčba (buď zemřeli krátce po příchodu na oddělení, anebo klinicky nebyli ve stavu únosném pro léčbu). Ze 125 pacientů, u kterých bylo dokumentováno zahájení některé formy léčby, dosáhlo CR 96 (76,8 %). Ze 102 nemocných, v indukci léčených kombinací antracyklinu a tretinoinu (ATRA), dosáhlo CR 84 jedinců (82,4 %; jde o skupinu pacientů, kteří by mohli být zařazeni do klinických studií). Tento výsledek byl lepší než u pacientů léčených pouze chemoterapií (n = 15; CR 46,7 %; P = 0,003), anebo samotnou ATRA (n = 13; CR 62,5 %; P = 0,17). Dalším parametrem s vysoce signifikantním vlivem na dosažení CR byl počet leukocytů v době diagnózy: jejich medián u pacientů, kteří dosáhli, resp. nedosáhli CR, byl 2,1 a 24,0 × 109/l (P < 0,0001), počet leukocytů ovlivnil i OS (P = 0,0001). Po dosažení CR se však původní počet leukocytů při diagnóze nepromítl do OS (P = 0,18). Dosažení CR dále ovlivnil performance status (PS) 0–1 (P = 0,005), který významně koreloval s počty leukocytů (P = 0,0006). Další faktory, spjaté patrně s leukocytózou, ovlivňovaly dosažení CR na hranici statistické významnosti: např. morfologie FAB M3v, hladina LDH v krvi, hladina fibrinogenu, přítomnost interní tandemové duplikace (ITD) genu FLT3 (ta byla silně asociována s vyšším počtem leukocytů a také se zlomem bcr3 v genu PML při tvorbě fúze PML/RARα). Lze usuzovat, že FLT3‑ITD je jedním z možných faktorů podmiňujících leukocytózu. Počty trombocytů v době diagnózy neměly vliv na indukci CR – nepotvrdili jsme tedy oprávněnost současné klasifikace rizik (ve smyslu odlišení středního a nízkého rizika) podle skupiny PETHEMA. Naše studie ukazuje na významný rozdíl mezi výsledky v reálném životě a výsledky dosahovanými u pacientů s možností vstoupit do klinických studií. Nejvýznamnějšími prognostickými faktory jsou počet leukocytů a od něj odvozený PS a možnost podání indukční terapie s antracykliny a ATRA.
Klíčová slova:
akutní promyelocytární leukemie – terapie – chemoterapie – tretinoin (ATRA) – prognostické faktory – FLT3 gen – performance status
Úvod
Akutní promyelocytární leukemie (APL) je hematologickou urgencí se značným rizikem časné smrti následkem koagulopatie (krvácivé diatézy, ev. trombózy). Na druhou stranu pokroky v léčbě, především zavedení tretinoinu (kyseliny transretinové, all‑trans retinoic acid – ATRA) do indukční a následně i udržovací a konsolidační léčby, přinesly výrazný zvrat v osudu nemocných s APL – z nejmalignějšího subtypu akutní myeloidní leukemie (AML) se stalo poměrně dobře léčitelné onemocnění, ovšem za předpokladu, že je zavčas zachyceno [1–5] (viz také další články v tomto čísle časopisu Vnitřní lékařství). Léčbou antimetabolity a antifoliky se dosahovalo kompletních remisí (CR) jen sporadicky: ve studii Bernarda et al to bylo pouze u 1 pacienta ze 20 [1]. Kombinací antracyklinu a cytarabinu v indukční léčbě se ve studiích s více než 50 pacienty dosahovalo CR u 50–74 % nemocných, avšak cytarabin patrně již nezvyšuje účinek antracyklinu, je‑li tento podán v dostatečně vysoké kumulativní dávce [2,6]. Kombinací účinku antracyklinu s tretinoinem (ATRA) se v klinických studiích dosahuje 89–95 % CR [7,8].
Vzhledem k relativní vzácnosti onemocnění je nutné výsledky terapie tohoto onemocnění posuzovat v rámci meziústavní spolupráce. Tato studie představuje úsilí nedávno založené skupiny CELL zhodnotit výsledky terapie APL na několika českých pracovištích. Cílem našeho hodnocení bylo především zjištění situace v reálném životě; naprostá většina pacientů nebyla zařazena do žádné klinické studie. Do hodnocení jsme zařadili naprosto všechny pacienty – tedy i ty, kteří zemřeli dříve, než mohla být zahájena léčba (takoví pacienti jistě nebývají běžně zařazováni do klinických studií). Dalším dílčím cílem naší studie bylo identifikovat rizikové faktory pro dosažení kompletní remise, což je nejdůležitější mezník vedoucí u většiny nemocných k vyléčení. Řada prognostických ukazatelů je již známa a dobře popsána: zdaleka nejdůležitější je počet leukocytů v době diagnózy. Na něm závisí nejen míra dosažení CR, ale podle některých autorů i pravděpodobnost relapsu [2,9–15]. Některé další faktory jsou spojeny s vyššími počty leukocytů v době diagnózy a je otázkou, zda jde o nezávislé prognostické faktory: jde např. o variantní M3v morfologii, o přítomnost interních tandemových duplikací genu FLT3 (FLT3‑ITD) [12,14–17], přítomnost hemoragické diatézy („purpury“) v době diagnózy [9]. Jako prognostický faktor je také uváděn věk, v některých studiích je záporným prognostickým faktorem i mužské pohlaví [15]. Dalším prognostickým faktorem je podle některých autorů počet trombocytů – hranice 40 × 109/l je používána španělskou skupinou PETHEMA k odlišení pacientů s < 10 × 109/l leukocyty s nízkým a středním rizikem [11]. Stále ještě však existuje řada sporných otázek, např. zda významně ovlivňuje prognózu typ transkriptu fúzního genu PML/RARα. Výsledky naší studie ukazují, nakolik jsou tyto prognostické faktory relevantní v reálné praxi mimo klinické studie, a poukazují na rozdíl mezi osudem průměrného pacienta a osudem pacienta, který by mohl být zařazen do klinické studie.
Pacienti, materiály a metody
Pacienti
Byla získána data o 144 pacientech s de novo APL z českých institucí (Ústav hematologie a krevní transfuze Praha – 56; Interní hematoonkologická klinika FN Brno – 44; Klinika dětské hematologie a onkologie Praha-Motol – 17; Oddělení klinické hematologie II. interní kliniky FN Hradec Králové – 12; Oddělení klinické hematologie FN Královské Vinohrady – 9; další – 6). APL byla diagnostikována podle WHO kritérií [18]. U 143 nemocných byla prokázána cytogeneticky t(15;17) a/nebo molekulárně fúzní gen PML/RARα, 1 nemocný měl t(11;17) s fúzním genem PLZF/RARα. Průměr a medián věku byl 43,1 a 45,7 let, rozsah 4,8–79,2 let. Poměr mužů a žen byl 64 : 80 (44 : 56 %). Průměry hodnot počtu leukocytů (× 109/l), hemoglobinu ( g/l) a počtů trombocytů (× 109/l) v době diagnózy byly následující: 17,9 – 9,2 – 35,7, mediány uvedených hodnot byly 3,2 – 9,6 – 27,0. Jiné maligní onemocnění měli v anamnéze čtyři nemocní. Žádný pacient neměl v době diagnózy extramedulární postižení. Celkový stav (performance status – PS) v době diagnózy byl hodnocen podle kritérií Eastern Cooperative Oncology Group (ECOG) [19].
Riziková stratifikace pacientů podle kritérií PETHEMA
Skupina s vysokým rizikem dle těchto kritérií je definována pouze počtem leukocytů (WBC) > 10 × 109/l v době diagnózy, nehledě na počet trombocytů. Pacienti s WBC < 10 × 109/l byli rozděleni na středně‑ a nízkorizikové podle toho, zda jejich počet trombocytů v době diagnózy byl > 40 × 109/l, anebo dosahoval hodnoty ≤ 40 × 109/l [11].
Podaná indukční terapie
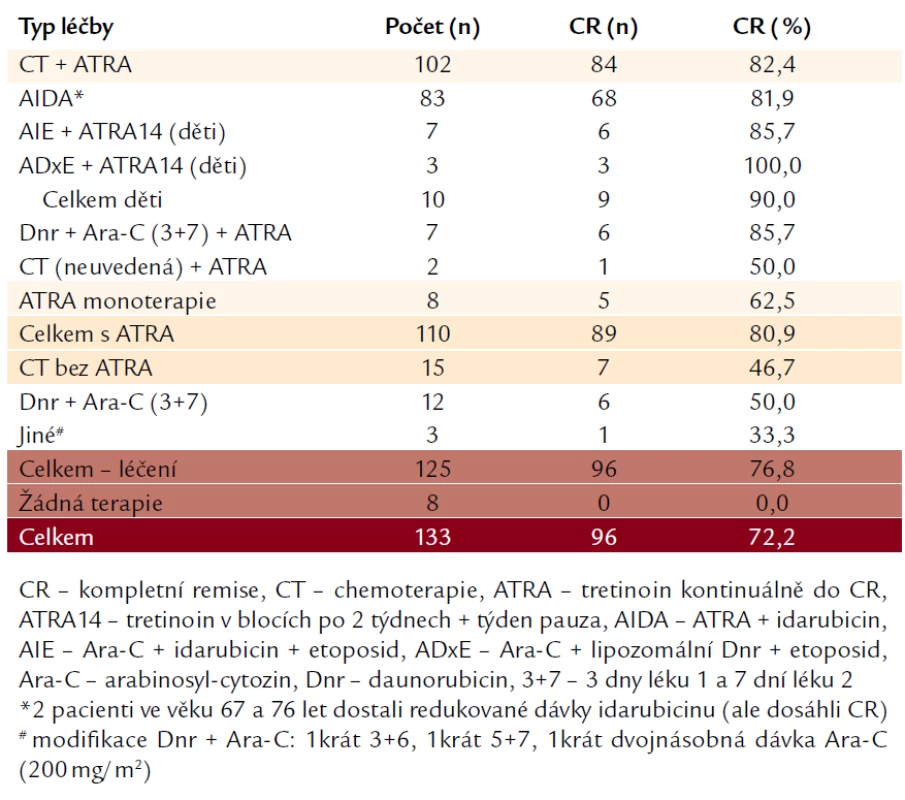
Celkem jsme měli údaje o indukční léčbě u 133 pacientů (tab. 2). Nejvíce (n = 83) bylo léčeno indukcí podle protokolu AIDA [7], tj. kombinací idarubicinu 12 mg/m2 × 4 dny + ATRA 45 mg/m2 do dosažení CR. Tato indukce byla stejná jak v protokolu AIDA skupin GIMEMA a EORTC, tak v různých verzích protokolů PETHEMA LPA. Pediatričtí pacienti (n = 10) byli léčeni podle protokolů Berlin-Frankfurt-Münster (BFM) a byli randomizováni buďto do větve s indukcí AIE [Arabinosyl-cytozin (Ara‑C) + Idarubicin + Etoposid], anebo do větve ADxE [Ara‑C + Daunorubicin (Dnr) v lipozomální formě + Etoposid], v obou větvích byla podávána ATRA v 14denních pulzech s týdenní přestávkou mezi nimi. Někteří pacienti (n = 19) byli léčeni kombinací Dnr + Ara‑C: 7 z nich dostalo zároveň ATRA, 12 ji nedostalo. Jiní nemocní (n = 8) dostali ATRA v monoterapii. Celkem 8 pacientů nedostalo žádnou léčbu – buďto zemřeli bezprostředně po příchodu na oddělení, anebo měli natolik závažné komplikace (na které posléze zemřeli), že léčba nebyla únosná. Podrobné výsledky jsou uvedeny v tab. 2. Pacienti, kteří dosáhli CR, dostali (až na některé výjimky) 3 konsolidační chemoterapie (bez ATRA) a dále absolvovali 2 roky udržovací terapie, v naprosté většině s ATRA, podávanou v 15denních cyklech jednou za 3 měsíce, menšina z nich dostávala po tuto dobu navíc denně 6‑merkaptopurin a 1krát týdně metotrexát.
Morfologie
Odlišení mezi typickým a variantním subtypem APL (tj. mezi akutní myeloidní leukemií M3 a M3v) bylo provedeno dle francouzsko-americko-britské (FAB) skupiny [20] analýzou pa-nopticky obarvených preparátů kostní dřeně a periferní krve. Atypické morfologické nálezy inkompatibilní s oběma kategoriemi byly přiřazeny ke kategorii M3v.
Analýza karyotypu
Vzorky kostní dřeně byly zpracovány po 24hodinové kultivaci v médiu RPMI doplněném 10 % fetálního bovinního séra, bez použití mitogenu, podle standardních cytogenetických postupů. Bylo hodnoceno nejméně 20 mitóz, obarvených dle Wrighta na získání G-pruhů na chromozomech, pokud byly na preparátech přítomny. Kromě t(15;17) byly konvenční cytogenetikou zjišťovány případné další aberace v karyotypu.
Záchyt fúzního genu PML/RARα pomocí fluorescenční in situ hybridizace (FISH)
Pomocí sondy DNA LSI PML/RARA Dual color a v pozdějších letech sondou LSI PML/RARA Dual Color Dual Fusion (Abbott-Vysis, Downers Grove, IL, USA) byla vyšetřena přítomnost fúzního genu v mitózách i v nedělících se jádrech metodou FISH. Při každém vyšetření bylo hodnoceno nejméně 20 mitóz, resp. 200 interfázických jader. Hranice pozitivity („cut-off“) pro vyšetření touto sondou byla stanovena na 5 %.
Záchyt fúzního genu PML/RARα pomocí polymerázové řetězové reakce po reverzní transkripci (RT‑PCR) a stanovení bodu zlomu (bcr) genu PML
Mononukleární buňky z periferní krve nebo kostní dřeně byly separovány gradientovou centrifugací v prostředí Histopaque-1077 (Sigma-Aldrich, St. Louis, MO, USA). Separované buňky byly 2krát promyty v PBS (fyziologickém roztoku pufrovaném fosfátem). V případě přítomnosti většího počtu erytrocytů byla suspenze buněk lyzována (roztokem 155 mmol NH4Cl, 10 mmol NH4HCO3, 0,1 mmol EDTA) k odstranění erytrocytů. Alikvoty po 5 × 106 buňkách byly dále lyzovány TRIzol Reagentem (Invitrogen, Carlsbad, CA, USA) a podle návodu výrobce byla izolována RNA (a jako vedlejší produkt navíc DNA a protein).
Reverzní transkripce: 1 μg izolované RNA byl inkubován s 25 pmol náhodných hexamerů (Invitrogen) 10 min při 65 °C a poté zchlazen na 4 °C. Byl přidán master mix obsahující: 200 μmol dNTP, 10 mmol dithiothreitolu, 1krát First Strand Buffer, 100 U reverzní transkriptázy Superscript II (Invitrogen), 10 U RNasinu® (Promega, Madison, WI, USA) a sterilní vodu do konečného objemu 10 μl. Reakční směs byla inkubována při 42 °C 60 min s následným zahřátím na 95 °C po dobu 2 min. Alternativně (na brněnském pracovišti) byl k reverzní transkripci použit RNA PCR Core Kit (Applied Biosy-stems, Foster City, CA, USA).
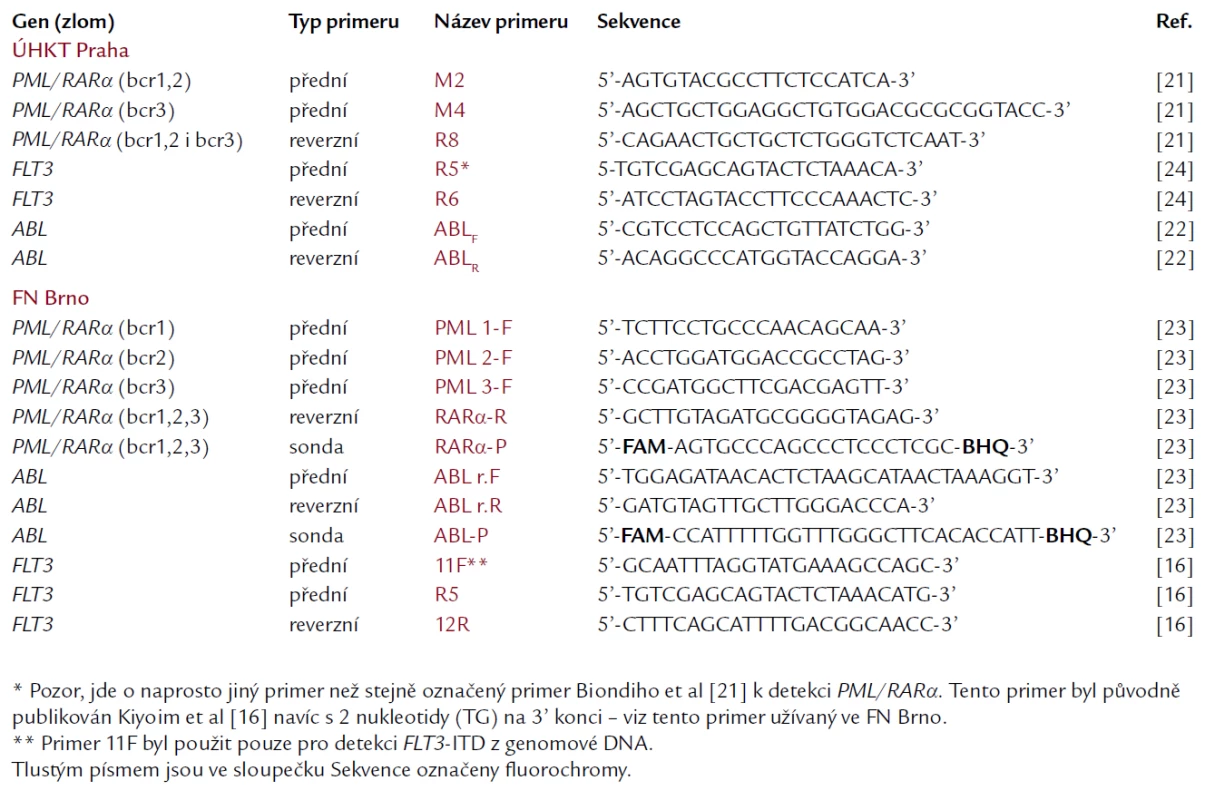
K detekci PML/RARα bylo užito 2 souběžných PCR amplifikací. Každá PCR probíhala v celkovém objemu 25 μl v obou master mixech. Při detekci PML/RARα se zlomy v PML genu bcr1 a bcr2 obsahoval master mix přední primer M2, druhý master mix, určený pro detekci zlomu bcr3, obsahoval přední primer M4. Reverzní primer byl pro obě reakce stejný, a sice R8. Tyto primery byly původně publikovány Biondim et al [21], v ÚHKT byly mírně modifikovány. Sekvence užitých primerů jsou uvedeny v tab. 1. Jako kontrola pro ověření kvality RNA a průběhu reverzní transkripce byl v souběžné PCR amplifikován i kontrolní gen ABL, při použití primerů dle Crosse et al [22]. Master mixy byly pro všechny 3 reakce shodné (s výjimkou primerů). Obsahovaly: 10 pmol každého z dvojice primerů (Invitrogen), 200 μmol dNTP, 1krát PCR reaction buffer, 1 mmol MgCl2, 0,5 U Platinum Taq DNA polymerázy (Invitrogen), 1 μl cDNA a sterilní vodu do celkového objemu 25 μl. Použitý PCR program byl shodný jak pro amplifikaci PML/RARα, tak i kontrolního genu ABL: po úvodní 5minutové denaturaci při 95 °C následovalo 40 cyklů s profilem: denaturace po dobu 15 s při 95 °C, annealing 30 s při 58 °C a polymerace 30 s při 72 °C. PCR produkty byly analyzovány pod UV světlem pomocí elektroforézy ve 2% agarózovém gelu, obarveném ethidium bromidem. Jako pozitivní kontroly byly použity plazmidy se zaklonovaným PCR produktem pacientů s dlouhým (L) transkriptem (se zlomem bcr1 v genu PML) a s krátkým (S) transkriptem (se zlomem bcr3). Nesouhlasila‑li délka PCR produktu pacienta při amplifikaci PML/RARα s bcr1,2 s délkou kontrolního amplifikátu transkriptu s bcr1, podezírali jsme u pacienta přítomnost variabilního (V) transkriptu se zlomem bcr2, což jsme následně ověřovali sekvenací produktu po jeho purifikaci z agarózového gelu. Byly tak vyloučeny případné nespecifické amplifikace (falešné pozitivity). Negativními kontrolami byly amplifikace master-mixů bez přidání pacientovy cDNA. Alternativní metodou záchytu fúzního genu PML/RARα, užívanou na brněnském pracovišti, byla RT‑PCR v reálném čase. Šlo o 3 souběžné amplifikace pro každý typ transkriptu (L-, V- a S-formu) zvlášť, přičemž reverzní primer a TaqMan sonda byly společné pro všechny reakce, zatímco přední primer se lišil podle zlomového místa v genu PML (tab. 1). Jako referenční gen byl stejnou metodou amplifikován gen ABL [23].
Záchyt FLT3‑ITD pomocí RT‑PCR
Krok izolace RNA a přepis do cDNA byl totožný s postupem při detekci fúze PML/RARα. Při vlastní PCR byly amplifikovány exony 11 a 12 genu FLT3. Master mix měl následující složení: 100 pmol obou primerů R5 a R6 [24] (jejich sekvence je uvedena v tab. 1), 200 μmol dNTPs, 1krát PCR reaction buffer, 2 mmol MgCl2, 0,5 U Platinum Taq DNA polymerázy (Invitrogen), 1 μl cDNA a sterilní voda do celkového objemu 25 μl. Použitý PCR program měl tyto charakteristiky: úvodní denaturace 94 °C 5 min, potom 10 cyklů s profilem: denaturace 94 °C 15 s, annealing 56 °C 30 s, polymerace 72 °C 45 s a dále 30 cyklů s profilem: denaturace 94 °C 15 s, annealing 52 °C 30 s, polymerace 72 °C 45 s. Výsledné PCR produkty byly analyzovány po separaci elektroforézou ve 2,5% agarózovém gelu, který byl obarven ethidium bromidem a hodnocen pod UV světlem. Pacienti pozitivní na délkovou mutaci (ITD) měli kromě produktu odpovídajícího wild‑type genu navíc druhý, delší PCR produkt. Každý ze zachycených delších produktů (s ITD) byl po purifikaci z gelu sekvenován. Na brněnském pracovišti bylo užito velmi podobné RT‑PCR metodiky, ale s jinými primery (R5 a 12R), konstruovanými podle původní publikace [16] (tab. 1). V některých případech byl však gen FLT3 amplifikován z genomové DNA pomocí primerů 11F a 12R dle stejné publikace.
Statistické analýzy
Vztahy mezi naměřenými parametry v kontingenční tabulce byly analyzovány pomocí χ2 testu. Pro hodnocení kvantitativních dat ve 2 skupinách byly zjištěny mediány naměřených hodnot a statistická analýza byla provedena pomocí neparametrického dvoustranného Mann‑Whitneyho testu. Pro hodnocení celkového přežití bylo užito Kaplanovy-Mayerovy regresní metody hodnocení křivek přežití, odlišnost křivek byla hodnocena pomocí log-rank testu Mantela-Haenschelové. Pro analýzu přežití ve věkových skupinách jsme použili log-rank test na trend. Všechny statistické testy byly provedeny na úrovni 95% intervalu spolehlivosti a příslušné hodnoty P (odpovídající možnosti chybného odmítnutí nulové hypotézy) byly nalezeny pomocí softwaru GraphPad Prism verze 3.03 (GraphPad Software, San Diego, CA, USA).
Výsledky
Indukce CR celkem a celkové přežití
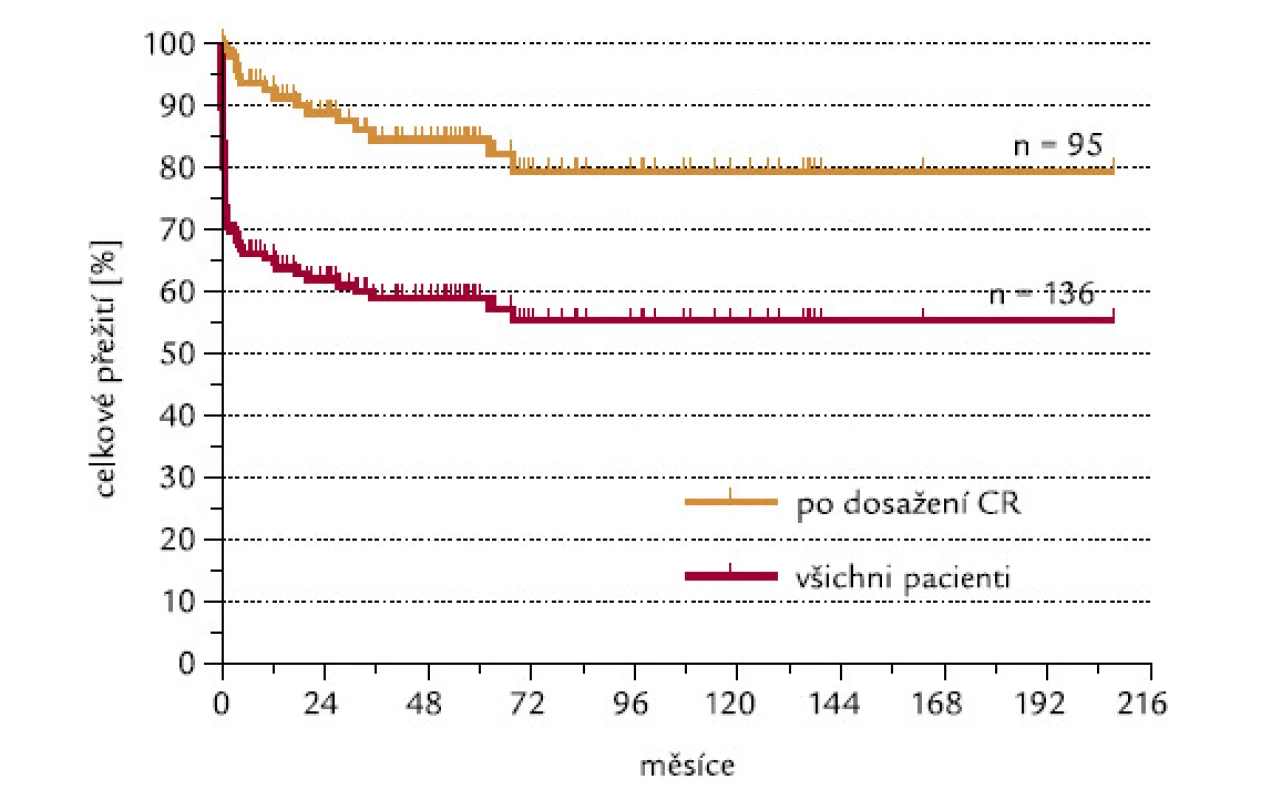
Ze 140 hodnotitelných pacientů dosáhlo CR 97 (69,3 %). Projekce celkového přežití po 4 letech od doby diagnózy je 58,9 %, po 6 letech 55,3 %. Pacienti, kteří dosáhli CR, mají pravděpodobnost přežití po 4 a 6 letech 84,5 %, resp. 79,3 % (obr. 1). K úmrtí pacientů došlo nejpozději do 4 let od doby diagnózy.
Indukce CR v závislosti na podané terapii
Ze 133 pacientů, u kterých byly dodány záznamy o terapii, dostalo 125 nějakou indukční léčbu. Naopak 8 pacientů (6,0 %) léčbu z různých důvodů nedostalo (úmrtí před zahájením léčby anebo celkový klinický stav nedovolující léčbu). Ze všech 125 léčených pacientů dosáhlo CR 96 (76,8 %). Z 15 pacientů léčených pouze chemoterapií dosáhlo CR 7 (46,7 %). Celkem 110 pacientů dostalo v indukci ATRA (ať již v kombinaci s chemoterapií, nebo bez ní), CR dosáhlo 89 (80,9 %), což je signifikantně lepší výsledek oproti pacientům, kteří absolvovali pouze chemoterapii bez ATRA (P = 0,003). Ze 102 pacientů, kteří dostali kombinaci chemoterapie a ATRA, dosáhlo CR 84 (82,4 %), což je podstatný rozdíl ve srovnání s pacienty, kteří absolvovali samotnou chemoterapii (P = 0,002). Mezi pacienty léčenými monoterapií ATRA dosáhlo CR 5 z 8 (62,5 %), což je nesignifikantně horší výsledek než u zmíněných pacientů s léčbou kombinací chemoterapie a ATRA (P = 0,17). Z pediatrických pacientů dosáhlo CR kombinací chemoterapie a pulzů ATRA 9 z 10 nemocných (90,0 %).
Indukce CR a celkové přežití v závislosti na počtu leukocytů
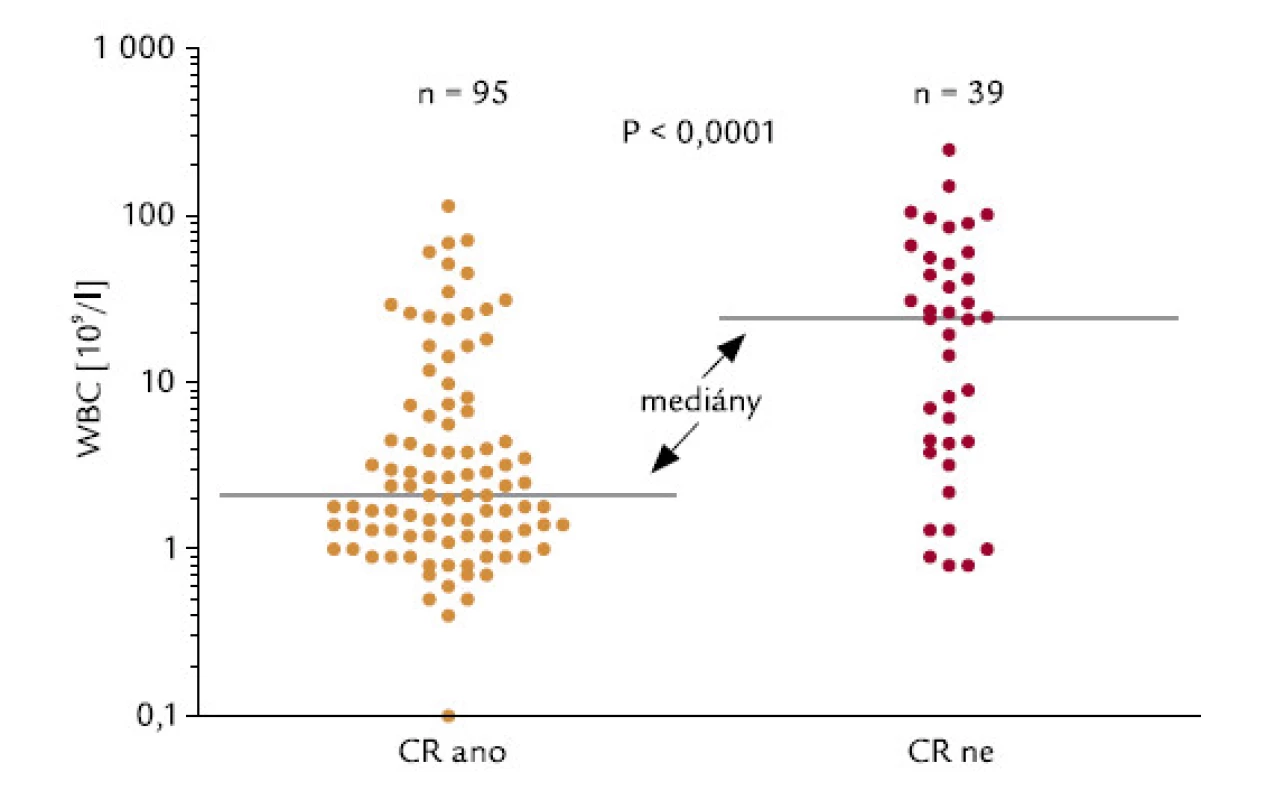
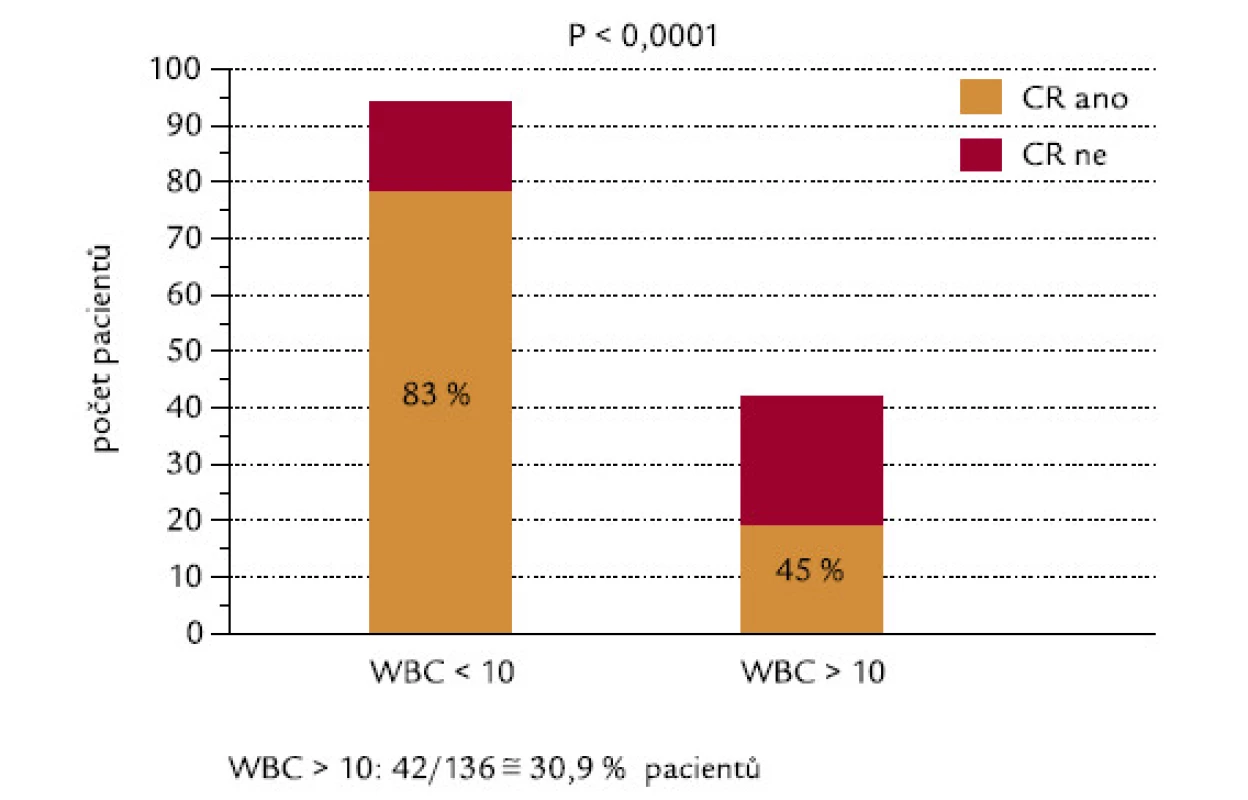
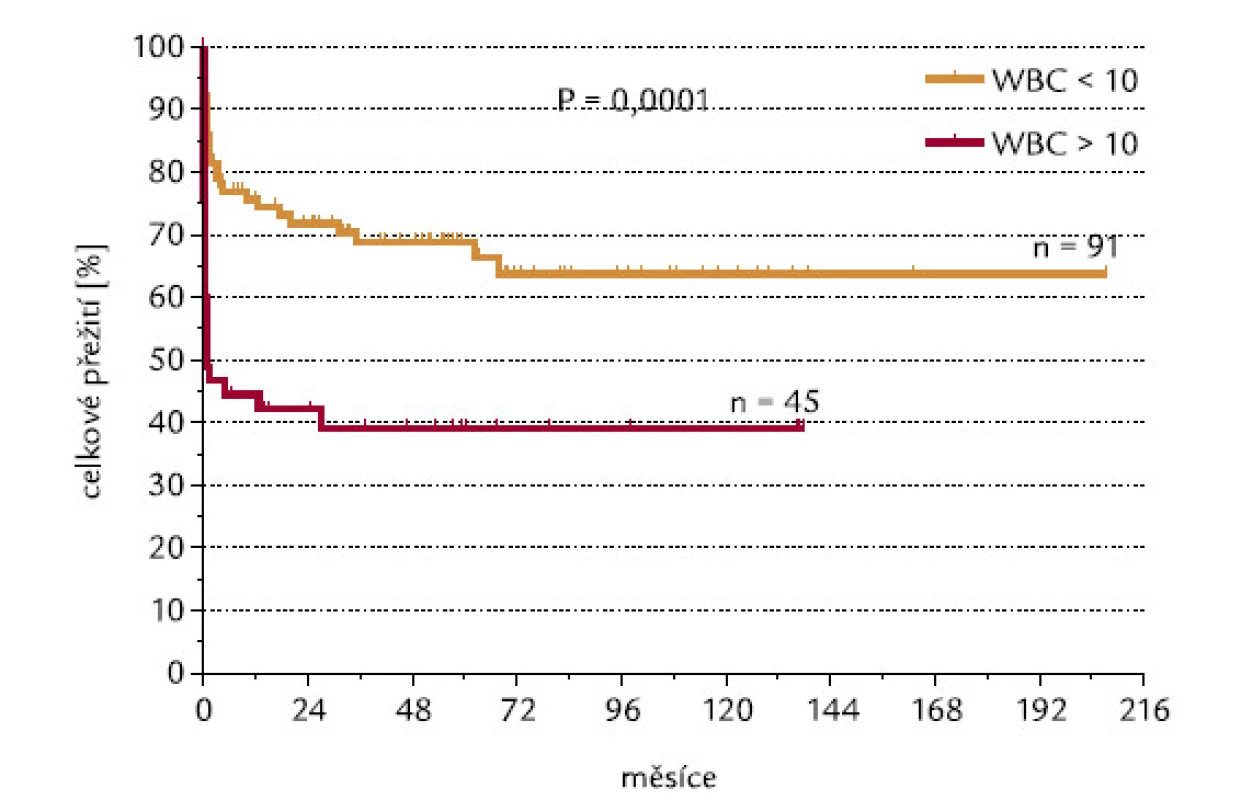
U pacientů, kteří dosáhli, resp. nedosáhli CR, byly signifikantně rozdílné počty leukocytů v době diagnózy: hodnoty mediánu byly u těchto 2 skupin 2,1 a 24,0 × 109/l leukocytů (P < 0,0001; obr. 2). 42 ze 136 hodnotitelných pacientů (30,9 %) mělo v době diagnózy počet leukocytů > 10 × 109/l (skupina označená WBC > 10). Tito pacienti dosahovali CR signifikantně hůře než pacienti s počtem leukocytů < 10 × 109/l (45 % oproti 83 %; P < 0,0001; obr. 3). Velice podobný výsledek se stejnou statistickou signifikancí byl získán, když jsme analyzovali pacienty s použitím meze v počtu leukocytů 5 × 109/l: celkem 53 ze 136 (39,0 %) nemocných mělo počet leukocytů > 5 × 109/l (WBC > 5). CR dosáhlo 49 % z těchto pacientů, ve skupině s leukocyty < 5 × 109/l dosáhlo CR 86 % pacientů (P < 0,0001). Pacienti s WBC > 10 měli signifikantně horší celkové přežití než pacienti s WBC < 10 (P = 0,0001): medián přežití ve skupině s WBC > 10 byl 0,83 měsíců, zatímco ve skupině s WBC < 10 mediánu nebylo dosaženo (obr. 4). Podobné byly i výsledky analýzy celkového přežití při srovnání skupin WBC > 5 a WBC < 5 (P = 0,0008). Medián přežití ve skupině s WBC > 5 byl 8,7 měsíců, zatímco ve skupině s WBC < 5 mediánu nebylo dosaženo. Dále jsme zjišťovali, zda počty leukocytů v době diagnózy mohou ovlivnit OS u pacientů, kteří již dosáhli CR. Nebyl zjištěn statisticky významný rozdíl v OS mezi 76 pacienty s počtem WBC < 10 a 19 pacienty, kteří dosáhli CR při počátečním počtu WBC > 10 (P = 0,18). Naopak projekce OS po 6 letech od diagnózy byla lepší pro druhou skupinu nemocných (76,3 % vs 92,8 %).
Indukce CR a celkové přežití v závislosti na počtu trombocytů, resp. rizikové skupiny definované skupinou PETHEMA
Obr. 5 ukazuje rozdíly v procentech indukce CR (89 % – 81 % – 45 %) v jednotlivých rizikových skupinách (s nízkým, středním, resp. vysokým rizikem), definovaných skupinou PETHEMA [11] (P < 0,0001). Nebyl však zjištěn rozdíl v indukci CR mezi skupinou s nízkým a středním rizikem (P = 0,34). Horší celkové přežití pacientů s vysokým rizikem (definovaným WBC > 10 dle PETHEMA) oproti pacientům s nízkým a středním rizikem (s WBC < 10) je zachyceno na obr. 4 (viz předchozí odstavec). Obr. 6 ukazuje, že nebyl zjištěn rozdíl v celkovém přežití ve skupinách s nízkým a středním rizikem, křivky přežití se prolínají (P = 0,76).
![Rizikové skupiny definované dle PETHEMA [11] a indukce CR.](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/c583725158aa0d3f62342133c21db30d.jpg)
![Skupiny s nízkým a středním rizikem dle PETHEMA [11] a OS.](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/8355758317dc92b9d69883a91065284c.jpg)
Indukce CR a hladina fibrinogenu
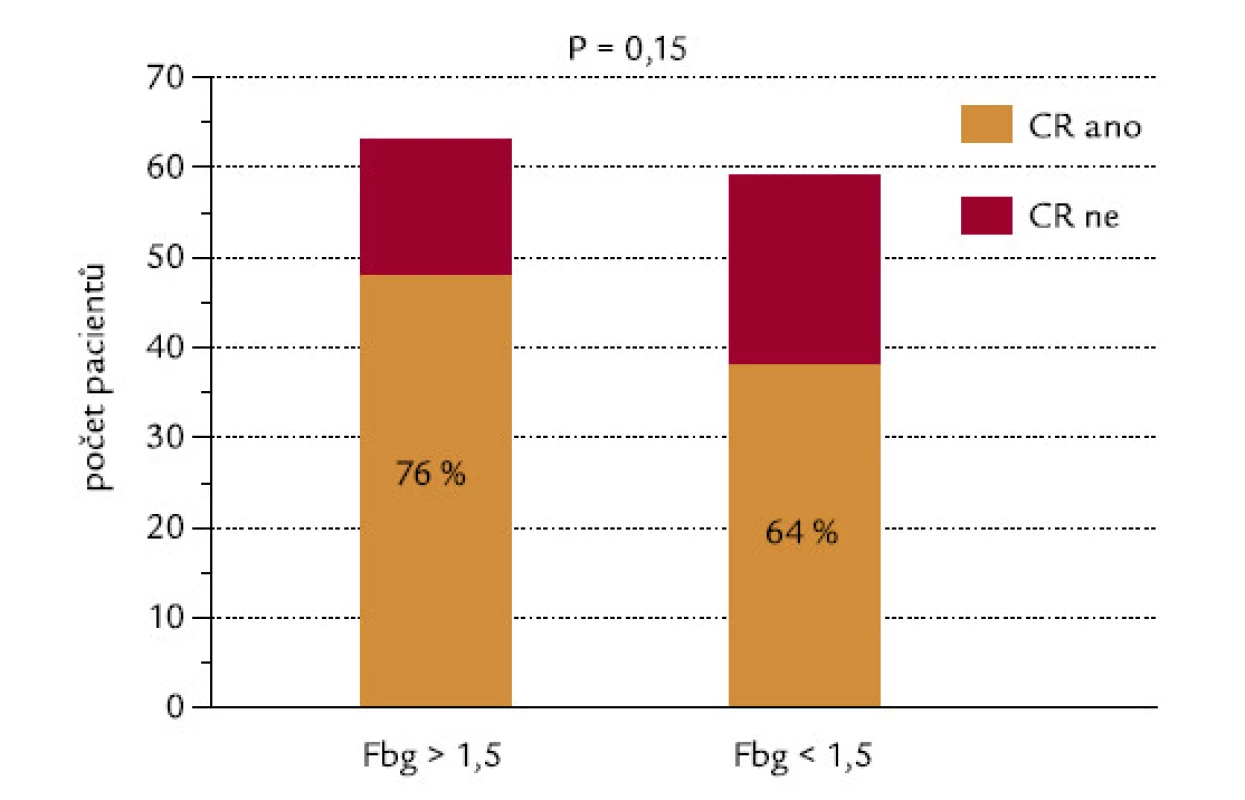
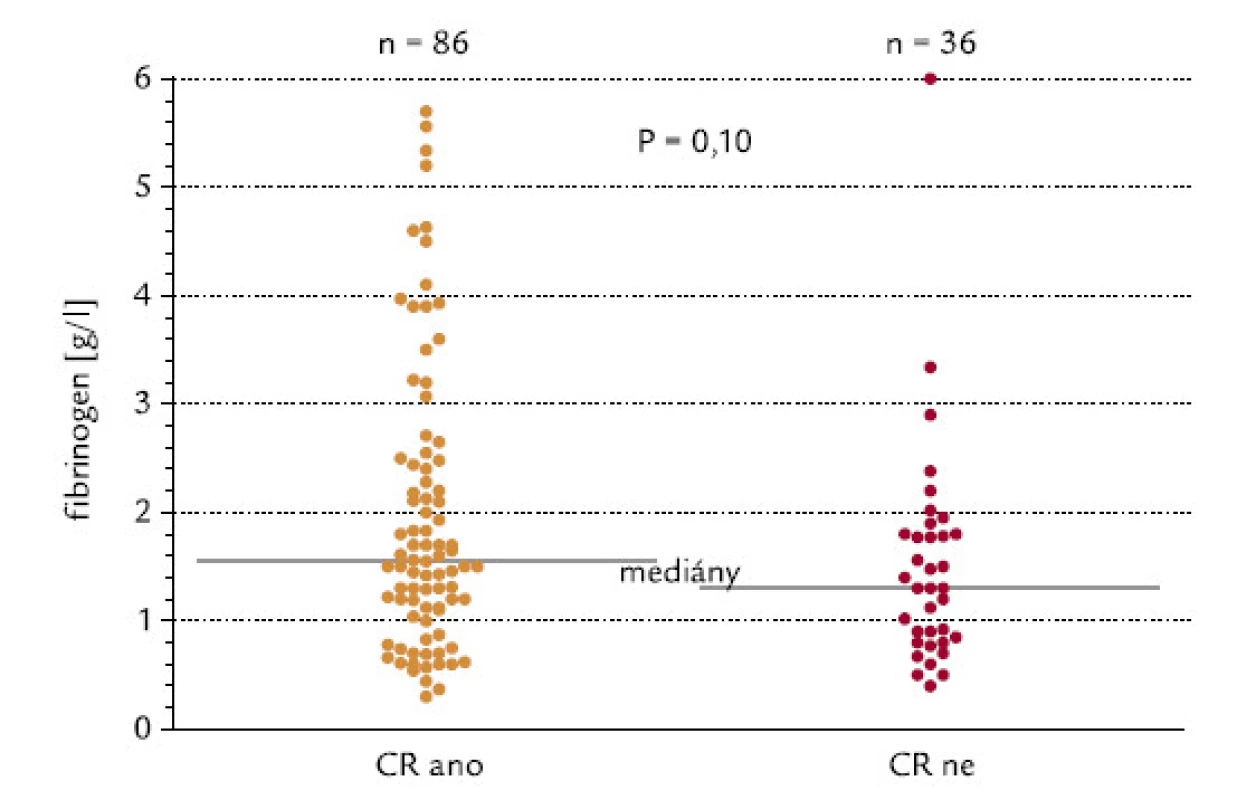
Pacienti byli rozděleni do 2 skupin podle hladiny fibrinogenu, mez byla na hladině 1,5 g/l. Z pacientů s hodnotou pod touto hladinou dosáhlo CR 64 %, z pacientů s fibrinogenem > 1,5 g/l dosáhlo CR 76 % (P = 0,15, χ2 test o dvoustranné alternativě; obr. 7). Kdybychom testovali hypotézu, zda pacienti s hladinou fibrinogenu < 1,5 g/l dosahují méně často remisi, výsledné P při užití jednostranného testu by mělo hodnotu 0,075, což by se dalo hodnotit jako statistický trend. Tento trend je také zřejmý při hodnocení konkrétních hladin fibrinogenu ve skupinách nemocných, kteří dosáhli, resp. nedosáhli kompletní remisi (P = 0,10, dvoustranný Mann‑Whitneyho test; obr. 8). Při testování hypotézy, zda pacienti, kteří nedosáhnou CR, mají nižší hladinu fibrinogenu, by výsledné P při užití jednostranného testu mělo hodnotu 0,05, což by se rovnalo hraniční statistické signifikanci.
Indukce CR a celkové přežití v závislosti na morfologii APL buněk
U 115 pacientů byla zhodnocena morfologie buněk podle FAB klasifikace [20], u 92 z nich (80 %) byl zjištěn klasický subtyp M3. U 22 pacientů byl morfologický závěr M3v. U zbývající pacientky (s datem diagnózy 14. 6. 1994) ukazoval závěr morfologické analýzy na AML M2. Až vzhledem k pozdějšímu průkazu PML/RARα u této pacientky byl morfologický nález přehodnocen na M3v, takže celkový počet pacientů s tímto subtypem byl 23 (20 %). Z pacientů s M3 subtypem dosáhlo CR 65 jedinců (70,7 %), se subtypem M3v 13 nemocných (56,5 %; P = 0,19; obr. 9). Kdybychom testovali hypotézu, zda pacienti s M3v morfologií dosahují méně často remisi, výsledné P by při užití jednostranného testu mělo hodnotu 0,097, což by se dalo hodnotit jako statistický trend. Rozdíl v morfologii buněk (M3 vs M3v subtyp) se nepromítnul do celkového přežití pacientů (P = 0,62; obr. 10).
![Morfologie APL dle FAB [20] a indukce CR.](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/24049510872f9bfcaddc69c9a38e0130.jpg)
![Morfologie APL dle FAB [20] a OS.](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/1de2b15facadeaf1f8678c204d24ce0b.jpg)
Indukce CR a celkové přežití v závislosti na hladině LDH v krvi
U relativně malého počtu nemocných jsme měli k dispozici údaje o hladině LDH v době diagnózy. Rozdělili jsme je podle arbitrární meze 15 μkat/l (norma pro LDH užívaná v ÚHKT bývala do 7,7 μkat/l; od roku 2005, kdy byla norma změněna, již nejsou hodnoty do analýzy zahrnuty). Zvolená mezní hladina LDH může jen velmi zhruba odlišit pacienty, kteří dosáhnou, resp. nedosáhnou CR (P = 0,11). Kdybychom postulovali hypotézu, že pacienti s LDH nad 15 μkat/l dosahují méně často remisi, výsledné P by při užití jednostranného testu mělo hodnotu 0,065, což by se dalo hodnotit jako statistický trend. Hladina LDH v době diagnózy nikterak neovlivnila celkové přežití pacientů (P = 0,35).
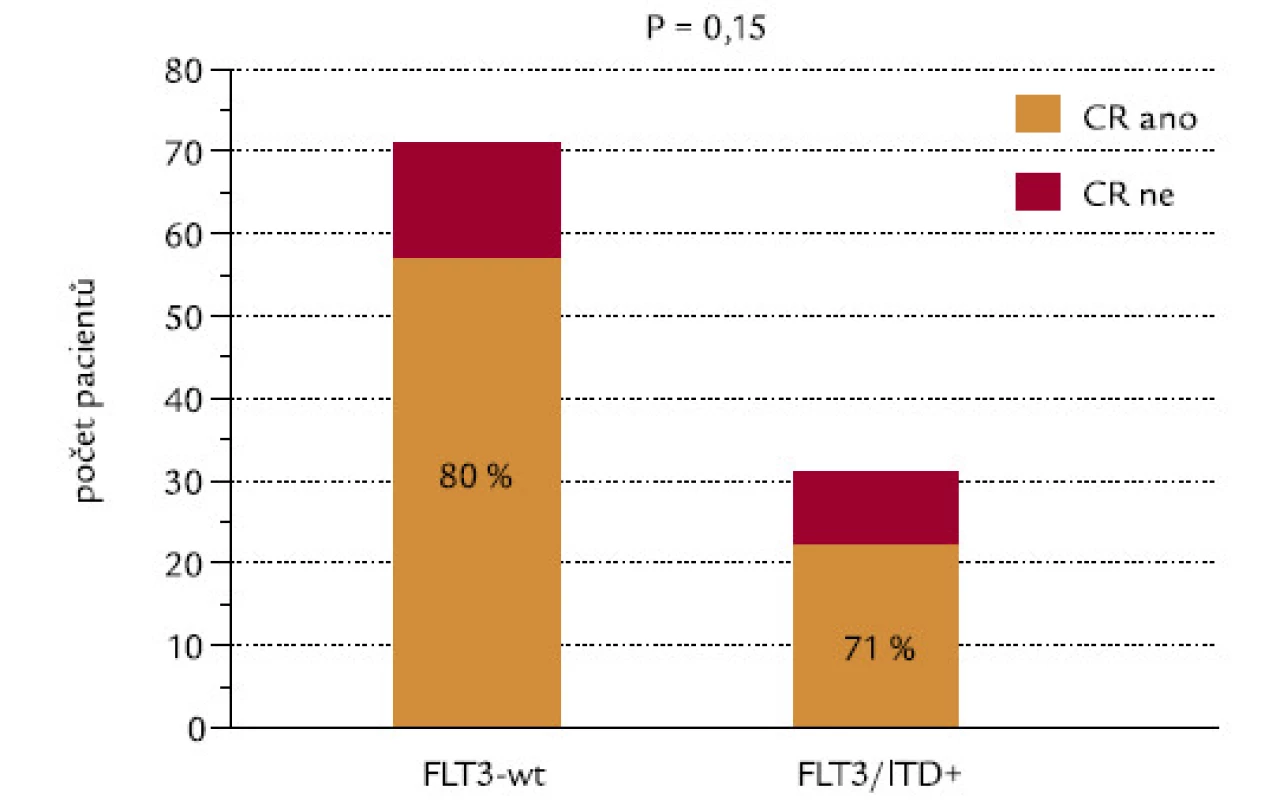
Indukce CR a celkové přežití v závislosti na přítomnosti FLT3‑ITD
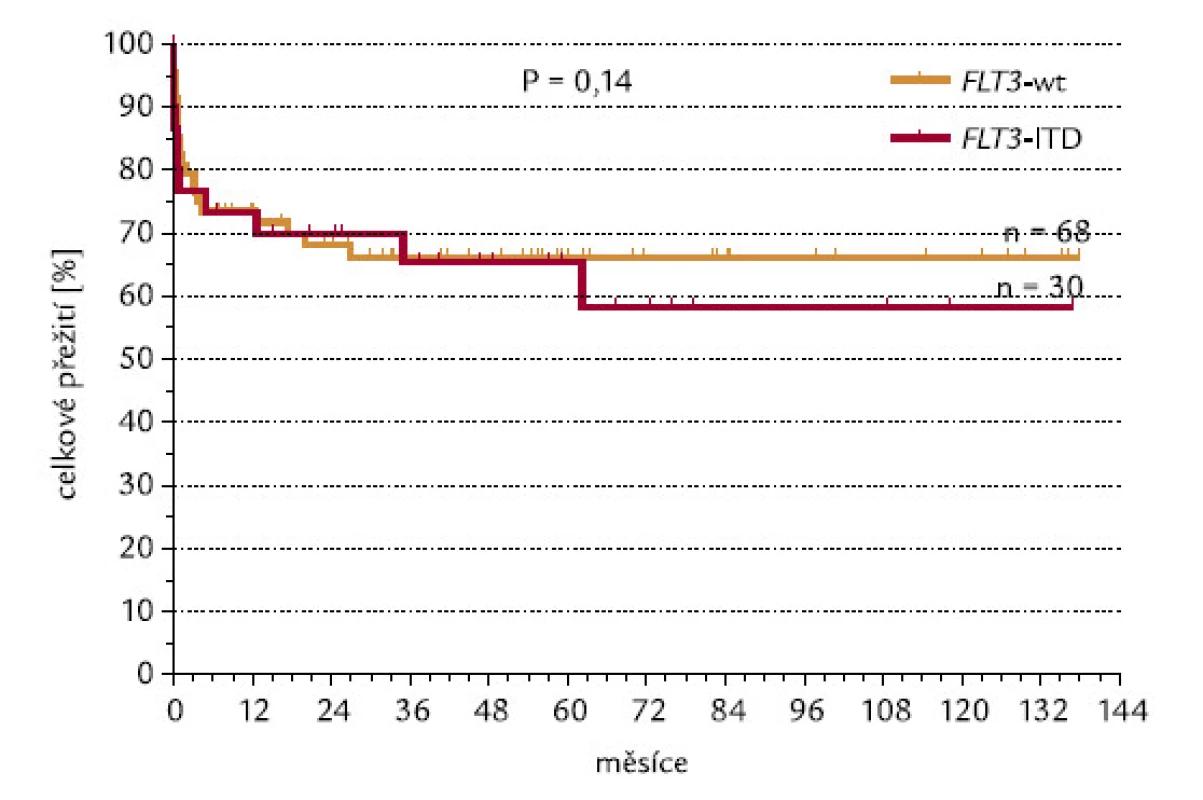
CR se podařilo dosáhnout u 80 % nemocných s nemutovaným (wild‑type – wt) genem a u 71 % pacientů s FLT3‑ITD (P = 0,15, χ2 test o dvoustranné alternativě; obr. 11). Kdybychom testovali hypotézu, zda pacienti s FLT3‑ITD dosahují méně často remisi, výsledné P při užití jednostranného testu by mělo hodnotu 0,075, což by se dalo hodnotit jako statistický trend. Při hodnocení celkového přežití nebyl zjištěn významný rozdíl mezi pacienty s wt konfigurací a s ITD genu FLT3 (P = 0,14; obr. 12).
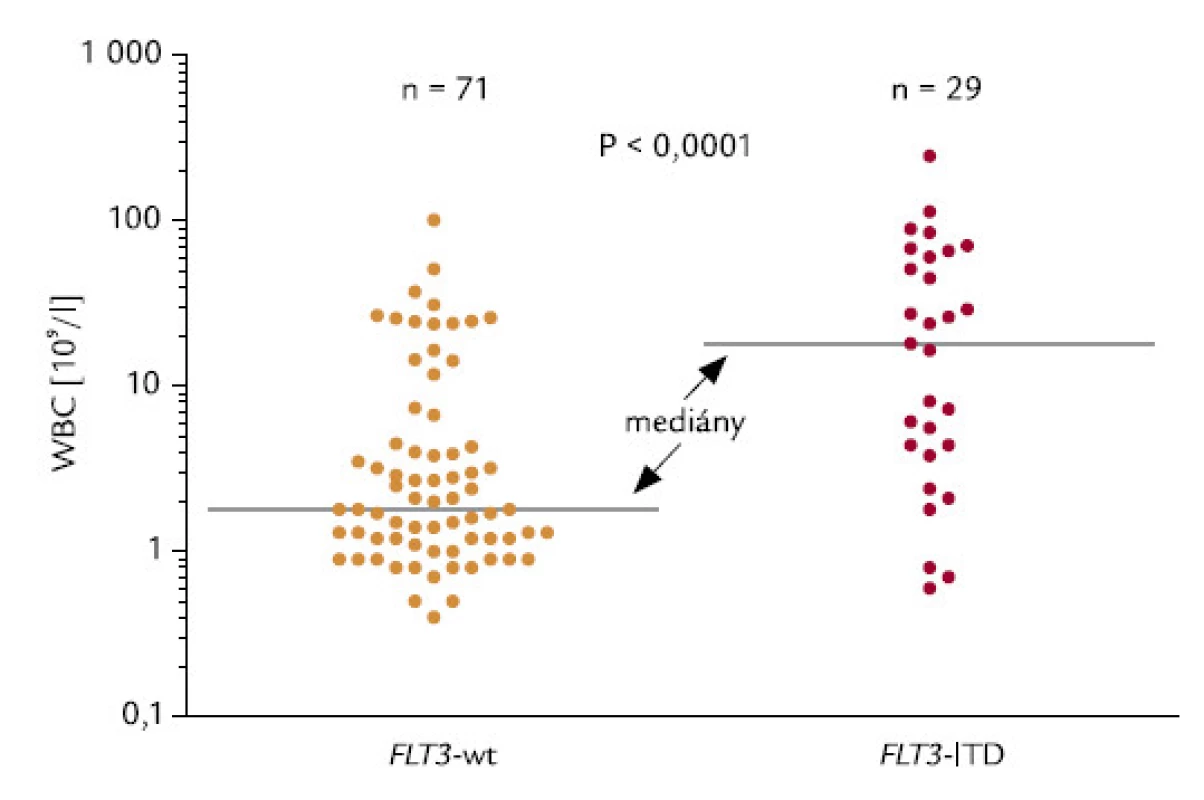
Spojitost mezi přítomností FLT3‑ITD a počtem leukocytů
Zachycuje ji obr. 13. Hodnoty me-diánů počtu leukocytů u pacientů s wt-FLT3 a s FLT3‑ITD byly 1,80 a 18,1 × 109/l. Asociace byla statisticky vysoce významná (P < 0,0001).
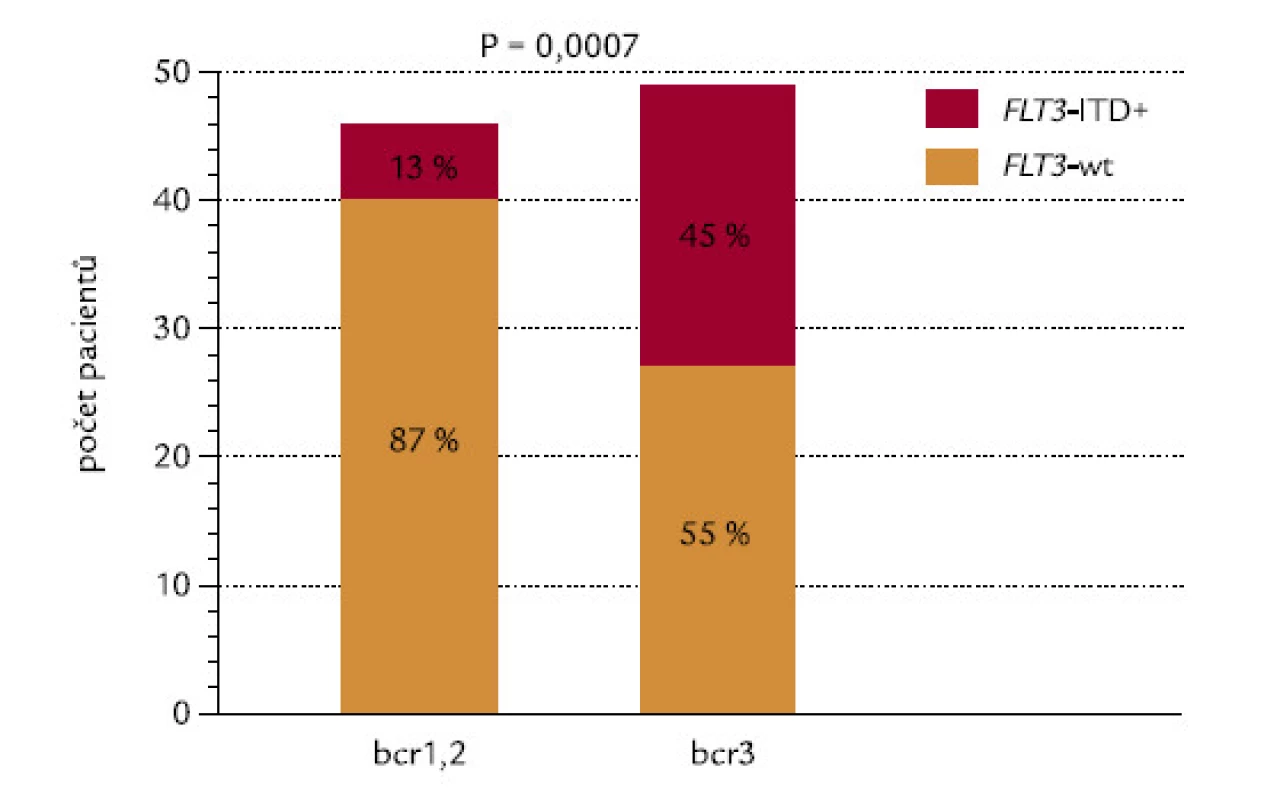
Spojitost mezi přítomností FLT3‑ITD a typem zlomu v genu PML
Pacienti se zlomy v genu PML typu bcr1, bcr2 a bcr3 měli zároveň FLT3‑ITD ve 13 %, 12 % a 45 % (P = 0,003). Vzhledem k téměř totožnému výsledku mezi bcr1 a bcr2 byli srovnáni pacienti s bcr1,2 proti pacientům s bcr3: pacienti se zlomem bcr3 měli vysoce signifikantně častěji FLT3‑ITD (P = 0,0007; obr. 14).
Indukce CR a celkové přežití v závislosti na typu zlomu v genu PML
Mezi 107 pacienty s hodnotitelným ty-pem zlomu v genu PML byly zlomy bcr1, bcr2 a bcr3 zachyceny u 45 (42,1 %), 8 (7,5 %), resp. 54 (50,4 %) jedinců. Pacienti s uvedenými typy zlomů dosáhli CR v 84,4 % – 62,5 % – 77,8 % (P = 0,43). Analýza křivek přežití neukázala žádný rozdíl ve skupinách nemocných definovaných podle typu zlomu (P = 0,10).
Indukce CR a celkové přežití v závislosti na věku
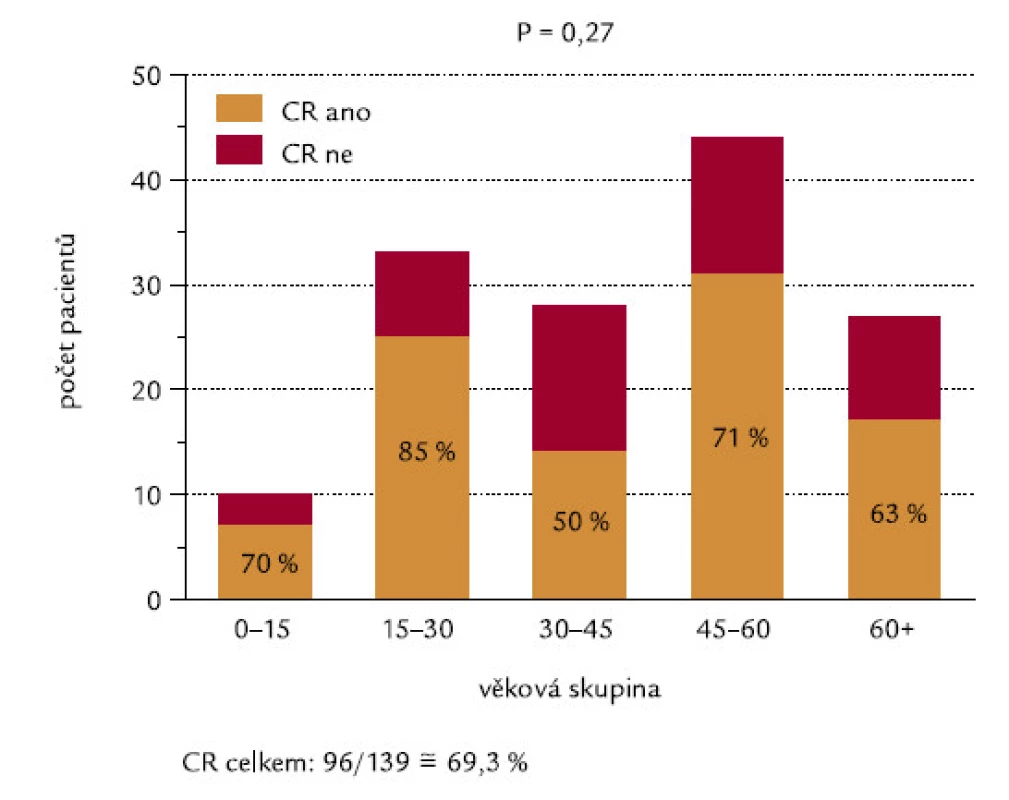
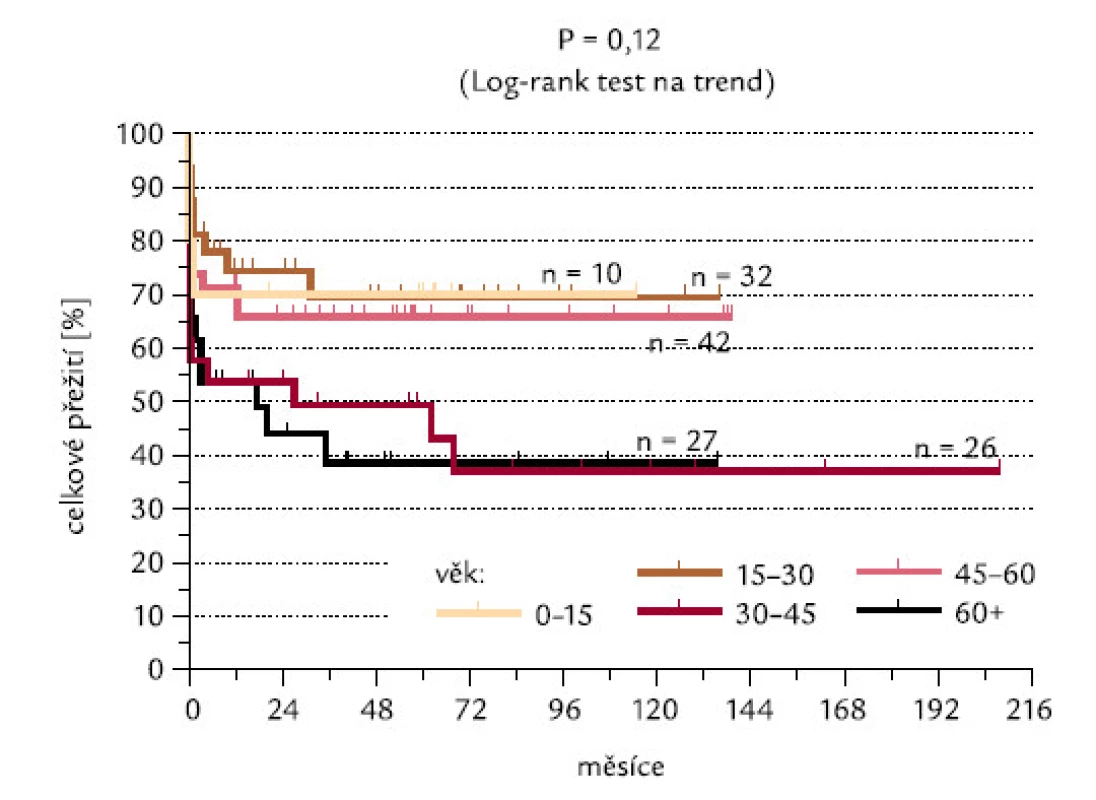
Obr. 15 ukazuje procenta indukce CR v jednotlivých věkových skupinách, odlišených v intervalech po 15 letech. Nebyl mezi nimi zjištěn žádný signifikantní rozdíl (P = 0,27), překvapivě nebyl zaznamenán ani výraznější rozdíl mezi nejmladší věkovou skupinou (0–15 let) a nejstaršími pacienty (60 a více let). Obr. 16 ukazuje celkové přežití pacientů jednotlivých věkových skupin. Nebyl zjištěn významný rozdíl, ani když jsme užili log-rank testu na trend (P = 0,12).
Indukce CR, celkové přežití a celkový stav (performance status – PS)
Nemocní, kteří měli v době diagnózy PS 0, 1, 2 a 3–4, dosáhli CR v 84,6 % – 84,2 % – 60,0 % – 44,4 % (P = 0,04). Když jsme srovnali navození CR u nemocných s PS 0–1 proti nemocným s PS 2–4, byl výsledek signifikantní (P = 0,005; obr. 17). Dále bylo porovnáno celkové přežití u (poměrně malého počtu) pacientů se známým PS, kteří dosáhli CR. Křivka přežití pacientů s původním PS 0–1 byla příznivější než u pacientů s PS 2–4 (P = 0,08; obr. 18).
![Performance status (PS) dle ECOG [19] a indukce CR.](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/5156bec7e8bd0da7bdc5be84b5d8b2ac.jpg)
![Performance status (PS) dle ECOG [19] v době diagnózy a OS u pacientů po dosažení CR.](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/4f107a622429f102500e1d2ce010aa8b.jpg)
Performance status a počet bílých krvinek v době diagnózy
Na obr. 19 je znázorněna souvislost mezi horším PS 2–4 a vysokými počty leukocytů. Mediány počtů leukocytů ve skupinách s PS 0–1 a s PS 2–4 byly 1,8 a 16,5 × 109/l (P = 0,0006).
![Performance status (PS) dle ECOG [19] a počty leukocytů.](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/3e3dafde364b87c5c4c2b57fe582817a.jpg)
Indukce CR a celkové přežití v závislosti na době od příznaků onemocnění do diagnózy
Pacienti, kteří dosáhli, resp. nedosáhli CR, měli totožnou dobu od objevení se prvních příznaků onemocnění do okamžiku diagnózy. U nemocných s dosažením kompletní remise (n = 53) i u pacientů, kteří remise nedosáhli (n = 29), byl medián doby do okamžiku diagnózy shodně 21 dní (P = 0,47). Podobně se nelišilo celkové přežití pacientů, u kterých byla doba od příznaků do okamžiku stanovení diagnózy kratší (n = 60), resp. delší (n = 22) než 28 dní (P = 0,50).
Celkové přežití v závislosti na roku diagnózy
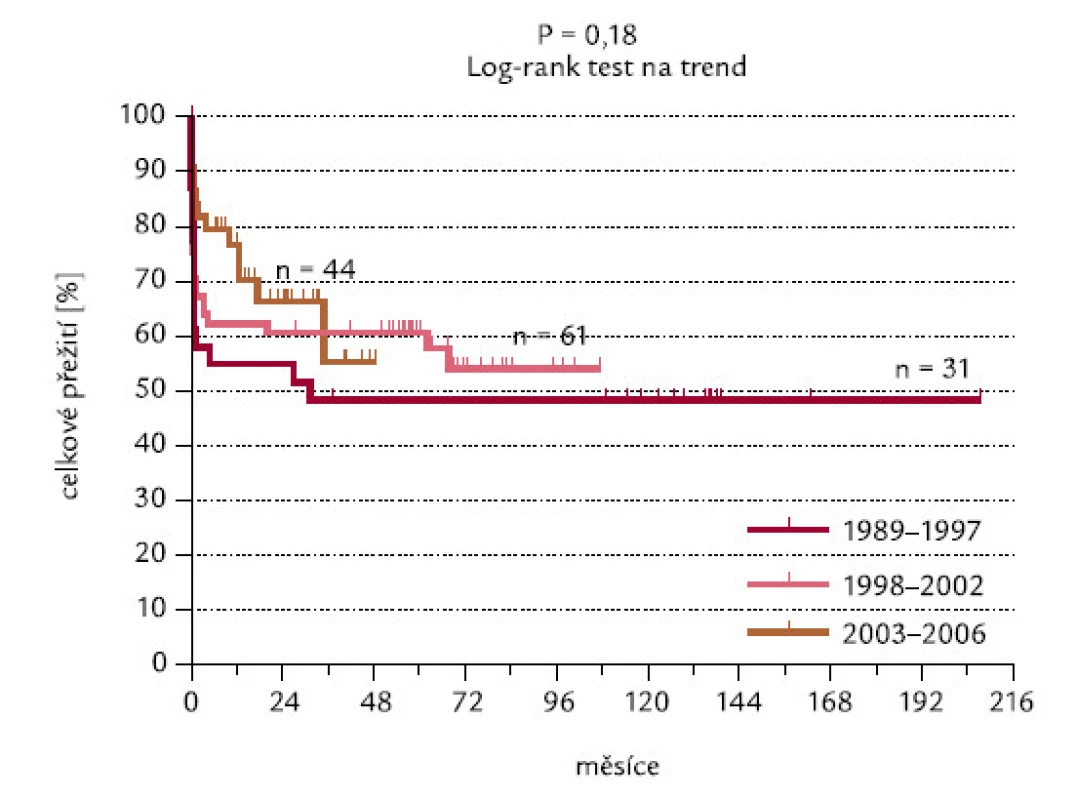
Toto přežití se nikterak nelišilo ve skupinách pacientů diagnostikova-ných v letech 1989–1997, 1998–2002 a 2003–2006. Pacienti diagnostikovaní v posledním časovém rozmezí měli tendenci k lepšímu OS po 12 měsících sledování (v uvedených skupinách v této době přežívalo 58,1 % – 67,1 % a 84,1 % pacientů), avšak později došlo k vyrovnání křivek přežití a rozdíly mezi nimi nejsou signifikantní (P = 0,18; obr. 20).
Rozbor relapsů
Alespoň k jednomu relapsu došlo celkem u 17 z 97 nemocných (17,5 %), kteří předtím dosáhli CR. Celkové přežití pacientů, kteří dosáhli CR, je znázorněno na obr. 1. Projekce přežití po 6 letech od doby diagnózy v této skupině je 79,3 %. Ze 17 pacientů s relapsem 7 (41,2 %) dlouhodobě přežívá v 2. CR. Při srovnání skupiny pacientů, u nichž došlo k relapsu, a skupiny bez relapsu jsme nenalezli rozdíl v počtu leukocytů v době diagnózy (průměry: 13,0, resp. 12,5 × 109/l) ani jsme nezjistili rozdíl v nálezu FLT3‑ITD v době diagnózy. Mělo ji 23/82 (28,0 %) pacientů bez relapsu a 5/7 (71,4 %) hodnotitelných pacientů s relapsem (P = 0,34). Mezi skupinami pacientů s relapsem a bez něj nebylo rozdílné zastoupení typů zlomu v genu PML.
Relaps se projevil často u pacientů, kteří byli nedostatečně léčeni. 3 pa-cienti neměli ATRA v indukci i konsolidaci, 2 měli redukci dávek chemoterapie v indukci vzhledem k věku, 3 nemocní dostali méně než 3 konsolidační cykly a 1 pacient měl genetickou aberaci se špatnou prognózou – PLZF/RARα. K relapsu došlo také u 2 ze 17 dětí v souboru. Ze 7 žijících pacientů po relapsu jsou v 2. kompletní remisi 4 pacienti po transplantaci krvetvorných kmenových buněk (3 po alogenní a 1 po autologní transplantaci po předchozí vysokodávkové chemoterapii) a 3 nemocní po standardní kombinaci ATRA + chemoterapie (z toho 1 pacientka, u které došlo k relapsu po konsolidační terapii s autologní transplantací, předtím nebyla léčena pomocí ATRA, a 2 další pacientky dostaly při terapii 1. linie snížené kumulativní dávky chemoterapie).
Diskuze
Uvedené výsledky ukazují reálnou situaci pacientů s APL tak, jak postupně přicházeli na naše oddělení. Někteří (n = 8; 6 % z pacientů s vyplněným údajem o terapii) ani nemohli dostat žádnou léčbu, neboť zemřeli dříve než za 24 hod po příchodu na oddělení, anebo měli tak špatný celkový stav (PS), že léčba nebyla v tu chvíli únosná. Ze všech hodnotitelných nemocných (n = 140) dosáhlo kompletní remise pouze 97 jedinců (69,3 %). Tento výsledek je výrazně horší než výsledky kterékoli studie za posledních 20 let v éře ATRA (ev. arzeniku), kdy se míra dosažení CR běžně pohybuje mezi 80 a 95 % [2,4–7,10,13,25–27]. Jsou‑li naše léčebné možnosti srovnatelné s pracovišti publikujícími uvedené výsledky (a věříme, že v zásadě jsou), pak náš výsledek ukazuje na rozdíl reality klinických studií a reality běžného medicínského života. Studie jsou totiž založeny na značné výběrovosti vstupních kritérií – např. nelze do nich vstoupit ve špatném celkovém klinickém stavu (PS > 2), některé dokonce vylučují z hodnocení pacienty s časným úmrtím (a takových je ještě stále při diagnóze APL dost). Sám fakt zahájení terapie je již výběrem per se – podíváme‑li se na vlastní výsledky, tak ze 125 pacientů, u kterých byla zahájena některá forma léčby, dosáhlo CR 96 (76,8 %). To je již lépe znějící číslo, přihlédneme‑li i ke skutečnosti, že řada z těchto pacientů nedostala ani léčbu ATRA (bylo jich 15 ze 125). Jistým překvapením naší studie je skutečnost, že pacienti léčení ATRA (v kombinaci s chemoterapií anebo v monoterapii) dosáhli vysoce signifikantně častěji CR než nemocní léčení pouze chemoterapií. V randomizovaných multicentrických studiích z počátku 90. let 20. století se sice ukázalo, že pacienti, kteří dostanou ATRA, přežívají lépe, avšak výhoda užívání ATRA se v těchto klinických pokusech projevila až na OS, zatímco procenta dosažení CR nebyla signifikantně lepší [28,29]. Tento rozdíl v našich výsledcích je patrně dán velmi slabým výsledkem dosažení CR (46,7 %) u pacientů, kteří nedostali ATRA a byli léčeni pouze chemoterapií. Ve světě se v pre-ATRA éře chemoterapií běžně dosahovalo v 50–74 % CR [2,6]. Je však třeba vzít v úvahu velmi malý počet pacientů, kteří byli v naší studii léčeni pouze chemoterapií. Nicméně většina z našich pacientů (n = 102) byla léčena moderní kombinací antracyklinu a ATRA. Výsledky u těchto pacientů jsou pak téměř srovnatelné s výsledky klinických pokusů italské skupiny GIMEMA a španělské PETHEMA – CR dosáhlo na našich pracovištích 84 (82,4 %) nemocných, zatímco ve zmíněných zahraničních studiích 89–95 % [7,8]. Z malého počtu pediatrických pacientů, léčených podobnou kombinací, dosáhlo remisi 9/10 (90 %) dětí. Shrneme‑li výsledky komentované v tomto odstavci, je jasné, že jedním z nejdůležitějších prognostických faktorů pro osud pacientů je typ podané léčby – evidentně lépe se dařilo pacientům léčeným ATRA, nejlépe v kombinaci s chemoterapií antracykliny. Je jisté, že celkový klinický stav (udávaný jako PS) musel hrát roli v tom, komu byla nasazena terapie (PS – viz níže).
Z prognostických faktorů byl jediný, který dosáhl vysoké signifikance, a to počet leukocytů v době diagnózy. Ten nejpodstatněji ovlivnil jak indukci CR, tak OS. Výsledky byly podobné, ať jsme jako hraniční počet leukocytů použili hodnotu WBC 5 × 109/l, nebo 10 × 109/l (v literatuře již bylo zmíněno, že jakékoli rozhraní mezi 2 a 10 × 109/l leukocytů může mít prognostický dopad [13]). Je pochopitelné, že řada dalších faktorů může být spojena s vysokými počty leukocytů – avšak pouze jediný z nich, a to PS, sám o sobě statisticky ještě signifikantně ovlivnil jak indukci CR, tak OS. Poněkud překvapivé však je, že PS v době diagnózy si zachoval mírný prognostický dopad na OS i mezi pacienty, kteří dosáhli CR. U ostatních zkoumaných parametrů, které mohou být spojeny s vysokým počtem leukocytů, jsme obvykle zaznamenali pouze určitý prognostický trend – týká se to např. FLT3‑ITD, morfologického typu M3v, hladiny fibrinogenu, hladiny LDH v krvi. Zatímco většina těchto parametrů se zdá být buď přímým důsledkem, nebo paralelou (druhou stranou mince) vyššího počtu leukocytů, první z nich (FLT3‑ITD) by logicky mohl být příčinou vedoucí k leukocytóze: jde přece o konstituční aktivaci receptorové tyrozinové kinázy, která dává buňkám s maturačním blokem navíc proliferační impuls. Je proto pochopitelné, že existuje vysoce signifikantní vztah mezi počty leukocytů a nálezem FLT3‑ITD. Nicméně statistická signifikance FLT3‑ITD s ohledem na (ne)dosažení CR není zdaleka tak výrazná jako u počtu leukocytů. Ani v původní japonské práci o významu FLT3‑ITD u APL, ani v další podobné studii z Hongkongu nebyl prokázán dopad duplikace na indukci CR, ačkoli byla také zjištěna asociace s vysokými počty leukocytů [15,16]. Z tohoto důvodu lze spekulovat, že FLT3‑ITD je pouze jedním z možných faktorů, které vedou k leukocytóze. Dalším faktorem, který by mohl indukovat leukocytózu, je např. infekční onemocnění v době diagnózy. Infekce může také zhoršovat celkový klinický stav (PS). Naše výsledky nepotvrzují, že by typ zlomu v genu PML byl důležitý z hlediska navození CR. Na druhou stranu však je zřejmé, že zlom bcr3 je signifikantně spojen s FLT3‑ITD. Zdá se tedy, že tento zlom predisponuje k duplikaci genu FLT3. Nedokážeme však interpretovat, jakým mechanizmem k tomu dochází.
Z faktorů zjišťovaných v době diagnózy měl signifikantní dopad na OS pouze počet leukocytů (a hraničně také PS). Nicméně další analýza ukázala, že se do OS musel významně promítnout rozdíl v dosažení CR: při srovnání OS pacientů s WBC nad a pod 10 × 109/l, kteří již dosáhli CR, nebyl zjištěn žádný signifikantní rozdíl (naopak, po dosažení CR zdánlivě lépe přežívali nemocní s WBC > 10; P = 0,18). Horší OS ve skupině s WBC > 10 tedy není výsledkem větší incidence relapsů, nýbrž pouze horší šance na navození CR. To je dosti v rozporu se závěry metaanalýzy dat španělské skupiny PETHEMA a italské skupiny GIMEMA, publikované Sanzem et al [11]. Leukocytóza byla v této metaanalýze jediným důležitým rizikovým faktorem i pro relaps (a proto ve své současné studii LPA 2005 zintenzivnila konsolidační léčbu u pacientů s leukocytózou). Dalším bodem rizikové stratifikace skupiny PETHEMA, který nebyl podpořen našimi výsledky, je odlišení pacientů se střední a dobrou prognózou na základě počtu trombocytů při diagnóze. Sanz et al totiž také došli k závěru, že počet trombocytů v době diagnózy (s hranicí 40 × 109/l) může ovlivnit incidenci relapsů [11]. Proto se skupina PETHEMA rozhodla ve své další studii LPA99 přidat ATRA v konsolidačních kúrách u pacientů se středním (tj. s WBC < 10 a Plt ≥ 40) a vysokým rizikem (WBC ≥ 10), což pomohlo významně redukovat počet relapsů v těchto skupinách [30]. Důvod, proč naše výsledky nepodporují některé prognostické vývody ze studií PETHEMA, není zcela zřejmý. Lze spekulovat, že ve studiích PETHEMA bylo více pacientů než v našem souboru a že tito pacienti byli (na rozdíl od našich) zcela homogenně léčeni dle jediného protokolu (byť se 3 větvemi podle rizikové stratifikace). Naše výsledky ale na druhou stranu naznačují, že výše uvedené španělské výsledky nejsou natolik robustní, aby mohly být aplikovány v našem reálném prostředí při podávání nejednotné léčby, a nemají patrně z hlediska jednotlivce s APL zásadní význam. Koneckonců i ve zmíněné metaanalýze dat Sanze et al [11] neměl počet destiček z hlediska predikce relapsu příliš velký význam – jednalo se pouze o trend. Jiné skupiny v současnosti rovněž nerozlišují skupinu se středním rizikem a užívají prosté rozdělení na vysoko-a nízkorizikové nemocné podle počtu leukocytů.
Závěr
Lze uzavřít, že naše studie je první, která ukazuje výsledky nemocných v reálném životě mimo klinické studie, a že výsledky těch pacientů, které by bylo možné zařadit do studií, zhruba odpovídají výsledkům ze studií zahraničních. Co se týče prognostických faktorů, potvrzujeme kruciální úlohu počtu leukocytů při diagnóze (a proto jsou legitimní snahy skupiny CELL upozorňovat na někdy příliš pomalou diagnostiku APL v Česku [3], neboť leukocytóza je pouze známkou pokročilosti onemocnění). Dalším klíčovým faktorem pro přežití pacientů je typ podávané terapie (jednoznačně nejlépe si vedou pacienti s indukcí ATRA + chemoterapie). Není proto překvapením, že velmi významným faktorem v době diagnózy je celkový stav (PS), který jistě ovlivňuje rozhodnutí kliniků podat tu či onu léčbu. Dopad dalších prognostických faktorů je výrazně nižší. Různé nuance léčby je však nutno hodnotit v klinických studiích; zde bychom mohli doporučit v dalších studiích nerozlišovat střední a nízkorizikovou skupinu dle definice PETHEMA [11].
Poděkování
Poděkování patří všem ošetřujícím lékařům, sestrám a personálu laboratoří, kteří vyšetřovali a ošetřovali naše pacienty s APL – bez jejich práce bychom neměli co hodnotit. Práce byla podpořena Výzkumným záměrem Ministerstva zdravotnictví ČR 00237360001.
Doručeno do redakce: 9. 6. 2008
MUDr. Jiří Schwarz, CSc.
www.uhkt.cz
e‑mail: jiri.schwarz@uhkt.cz
Sources
1. Bernard J, Mathé G, Boulay J et al. La leucose aiguë à promyélocytes. Etude portant sur vingt observations. Schweiz Med Wochenschr 1959; 89: 604–608.
2. Frankel SR. Acute promyelocytic leukemia. New insights into diagnosis and therapy. Hematol Oncol Clin North Am 1993; 7: 109–138.
3. Lemež P, Schwarz J, Jelínek J et al. Pozdní a pomalá diagnostika akutních promyelocytárních leukemií – hlavní příčina časných smrtí. Vnitř Lék 1994; 40: 654–659.
4. Tallman MS, Nabhan C, Feusner JH et al. Acute promyelocytic leukemia: evolving therapeutic strategies. Blood 2002; 99: 759–767.
5. Wang ZY, Chen Z. Acute promyelocytic leukemia: from highly fatal to highly curable. Blood 2008; 111: 2505–2515.
6. Fenaux P. Management of acute promyelocytic leukemia. Eur J Haematol 1993; 50: 65–73.
7. Mandelli F, Diverio D, Avvisati G et al. Molecular remission in PML/RARα‑positive acute promyelocytic leukemia by combined all‑trans retinoic acid and idarubicin (AIDA) therapy. Blood 1997; 90: 1014–1021.
8. Sanz MA, Martín G, Rayón C et al. A modified AIDA protocol with anthracycline‑based consolidation results in high antileukemic efficacy and reduced toxicity in newly diagnosed PML/RARα‑positive acute promyelocytic leukemia. Blood 1999; 94: 3015–3021.
9. Asou N, Adachi K, Tamura J et al. Analysis of prognostic factors in newly diagnosed acute promyelocytic leukemia treated with all‑trans retinoic acid and chemotherapy. Japan Adult Leukemia Study Group. J Clin Oncol 1998; 16: 78–85.
10. Burnett AK, Grimwade D, Solomon E et al. Presenting white blood cell count and kinetics of molecular remission predict prognosis in acute promyelocytic leukemia treated with all‑trans retinoic acid: result of the randomized MRC trial. Blood 1999; 93: 4131–4143.
11. Sanz MA, Lo Coco F, Martín G et al. Definition of relapse risk and role of nonanthracycline drugs for consolidation in patients with acute promyelocytic leukemia: a joint study of the PETHEMA and GIMEMA cooperative groups. Blood 2000; 96: 1247–1253.
12. Schwarz J, Peková S, Protivánková M et al. FLT3 gene internal tandem duplications in APL: correlation with leukocytosis and outcome. In: Joint International Congress on APL and Differentiation Therapy; 2001. Rome 2001.
13. Mistry AR, Pedersen EW, Solomon E et al. The molecular pathogenesis of acute promyelocytic leukaemia: implications for the clinical management of the disease. Blood Rev 2003; 17: 71–97.
14. Schwarz J, Peková S, Cermák J et al. Prognosis in AML and APL: the role of FLT3 gene internal tandem duplications (ITDs) and other prognostic markers. Leuk Lymphoma 2003; 44 (Suppl): S64.
15. Au WY, Fung A, Chim CS et al. FLT-3 aberrations in acute promyelocytic leukaemia: clinicopathological associations and prognostic impact. Br J Haematol 2004; 125: 463–469.
16. Kiyoi H, Naoe T, Yokota S et al. In-ternal tandem duplication of FLT3 associated with leukocytosis in acute promyelocytic leukemia. Leukemia 1997; 11: 1447–1452.
17. Noguera NI, Breccia M, Divona M et al. Alterations of the FLT3 gene in acute promyelocytic leukemia: association with diagnostic characteristics and analysis of clinical outcome in patients treated with the Italian AIDA protocol. Leukemia 2002; 16: 2185–2189.
18. Brunning RD, Bennett J, Matutes E et al. Acute myeloid leukaemia with recurrent genetic abnormalities. In: Jaffe ES, Harris NL, Stein H et al. World Health Organization classification of tumours. Pathology and genetics. Tumours of haematopoietic and lymphoid tissues. Lyon: IARC 2001: 81–87.
19. Oken MM, Creech RH, Tormey DC et al. Toxicity and response criteria of the Eastern Cooperative Oncology Group. Am J Clin Oncol 1982; 5: 649–655.
20. Bennett JM, Catovsky D, Daniel MT et al. A variant form of hypergranular promyelocytic leukaemia (M3). Br J Haematol 1980; 44: 169–170.
21. Biondi A, Rambaldi A, Pandolfi PP et al. Molecular monitoring of the myl/retinoic acid receptor-alpha fusion gene in acute promyelocytic leukemia by polymerase chain reaction. Blood 1992; 80: 492–497.
22. Cross NC, Melo JV, Feng L et al. An optimized multiplex polymerase chain reaction (PCR) for detection of BCR-ABL fusion mRNAs in haematological disorders. Leukemia 1994; 8: 186–189.
23. Gabert J, Beillard E, van der Velden VHJ et al. Standardization and quality control studies of ‚real-time‘ quantitative reverse transcriptase polymerase chain reaction of fusion gene transcripts for residual disease detection in leukemia – a Europe Against Cancer program. Leukemia 2003; 17: 2318–2357.
24. Xu F, Taki T, Yang HW et al. Tandem duplication of the FLT3 gene is found in acute lymphoblastic leukaemia as well as acute myeloid leukaemia but not in myelodysplastic syndrome or juvenile chronic myelogenous leukaemia in children. Br J Haematol 1999; 105: 155–162.
25. Chen SJ, Zhu YJ, Tong JH et al. Rearrangements in the second intron of the RARA gene are present in a large majority of patients with acute promyelocytic leukemia and are used as molecular marker for retinoic acid‑induced leukemic cell differentiation. Blood 1991; 78: 2696–2701.
26. Warrell RP Jr, Frankel SR, Miller WH Jr et al. Differentiation therapy of acute promyelocytic leukemia with tretinoin (all‑trans‑retinoic acid). N Engl J Med 1991; 324: 1385–1393.
27. Lo Coco F, Nervi C, Avvisati G et al. Acute promyelocytic leukemia: a curable disease. Leukemia 1998; 12: 1866–1880.
28. Fenaux P, Le Deley MC, Castaigne S et al. Effect of all transretinoic acid in newly diagnosed acute promyelocytic leukemia. Results of a multicenter randomized trial. Blood 1993; 82: 3241–3249.
29. Tallman MS, Andersen JW, Schiffer CA et al. All‑trans‑retinoic acid in acute promyelocytic leukemia. N Engl J Med 1997; 337: 1021–1028.
30. Sanz MA, Martín G, González M et al. Risk-adapted treatment of acute promyelocytic leukemia with all‑trans‑retinoic acid and anthracycline monochemotherapy: a multicenter study by the PETHEMA group. Blood 2004; 103: 1237–1243.
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Internal Medicine

2008 Issue 7-8
Most read in this issue
- Urgentní stav v hematologii: akutní promyelocytární leukemie – principy diagnostiky
- Koagulopatie a diferenciační syndrom: hlavní komplikace úvodní léčby akutní promyelocytární leukemie
- Stručné kazuistiky ilustrující úvodní průběh u akutní promyelocytární leukemie
- Leukemogeneza a léčba akutní promyelocytární leukemie: cesta od nejhoršího k nejpříznivějšímu typu akutní myeloidní leukemie
