BNP a echokardiografické parametre u pacientov s chronickými chorobami obličiek a dialyzovaných chorých
BNP and echocardiographic parameters in patients with chronic kidney disease and dialyzed patients
We assessed the relation between BNP levels and some echocardiographic parameters of systolic and diastolic function of the left ventricle in 49 patients (mean age 69.39 ± 8.47 years) with chronic kidney disease in different stages of chronic renal failure according to K/ DOQI and in 45 subjects (mean age 52.6 ± 14.85 years) on dialysis. Median for BNP in the group of patients with chronic renal failure was 132 pg/ ml, and in dialysis subjects 320 pg/ ml. None of our patients had clinical signs of heart failure during the last six months. Using a method of correlation matrix we found the left ventricular mass and its indexed value as a common indicator of increased BNP level in both groups of patients (dialysis patients, p = 0.0003, and p = 0.0005, respectively; patients with chronic renal failure, p = 0.03, and p = 0.04, respectively). Further analysis proved that in the group of dialysis patients the main determinants of increased BNP level were volumes of the left heart side: left ventricular enddiastolic volume (p = 0.004), endsystolic volume (p = 0.01), and left atrial volumes (maximal, minimal, and total atrial stroke volume; p = 0.004, p = 0.009 a p = 0.04, respectively). In the group of patients with chronic renal failure the major contributors to increased BNP level were echocardiographic parameters of diastolic filling assessed from transmitral and pulmonary venous flow: E wave (p = 0.001), A wave (p = 0.01), E/ A (p < 0.001), IVRT (p = 0.004), E/ EDT (p < 0.0001), S wave (p = 0.01), D wave (p = 0.0003), S/ D (p = 0.001), Ar duration (p = 0.02), and E/ Vp (p = 0.003). No significant relation to left ventricular ejection fraction was found in both groups of patients. Our results suggest that the main determinant of increased BNP level in patients with different stages of chronic renal failure is diastolic dysfunction, whereas in dialysis patients high left heart volumes due to volume overload. The common denominator of high BNP level in both groups of patients is especially the left ventricular mass.
Key words:
chronic renal disease – chronic renal failure – systolic and diastolic dysfunction – cardiac biomarkers – BNP
Authors:
I. Valočiková 1; G. Valočik 2; B. Krištofová 1; Ľ. Družbacká 2; R. Roland 3; P. Mitro 2
Authors‘ workplace:
I. interná klinika Lekárskej fakulty UPJŠ a FN L. Pasteura Košice, Slovenská republika, prednostka prof. MU Dr. Ivica Lazúrová, CSc.
1; III. interná klinika Lekárskej fakulty UPJŠ a FN L. Pasteura Košice, Slovenská republika, prednosta doc. MU Dr. Peter Mitro, Ph. D.
2; FRESENIUS, Nefrologické a dialyzačné centrum Košice, Slovenská republika, prednosta prim. MU Dr. Robert Roland
3
Published in:
Vnitř Lék 2009; 55(10): 934-939
Category:
Original Contributions
Overview
Hodnotili sme vzťah medzi hladinami BNP a niektorými echokardiografickými parametrami systolickej a diastolickej funkcie ľavej komory u 49 pacientov (priemerný vek 69,39 ± 8,47 rokov) s chronickou renálnou insuficienciou v rozličných štádiách podľa K/ DOQI a u 45 dialyzovaných chorých (priemerný vek 52,6 ± 14,85 rokov). Medián pre BNP v skupine chorých s chronickou obličkovou nedostatočnosťou bol 132 pg/ ml a v skupine dialyzovaných osôb 320 pg/ ml. Ani jeden z pacientov zaradených do štúdie nemal posledný polrok klinické prejavy kardiálnej dekompenzácie. Pri hodnotení echokardiografických parametrov metódou korelačnej matrix sme zistili, že spoločným vysoko signifikantným ukazovateľom zvýšenej hodnoty BNP v oboch vyšetrovaných skupinách bola masa ľavej komory, resp. jej index (dialyzovaní pacienti, p = 0,0003, resp. p = 0,0005; pacienti s chronickou renálnou insuficienciou, p = 0,03, resp. p = 0,04). Ďalšou analýzou bolo potvrdené, že na vyššej hodnote BNP u dialyzovaných osôb sa podieľajú predovšetkým zvýšené objemy ľavých oddielov srdca: enddiastolický objem ľavej komory (p = 0,004), endsystolický objem ľavej komory (p = 0,01) a objemy ľavej predsiene (maximálny, minimálny a celkový vývrhový objem ľavej predsiene; p = 0,004, p = 0,009 a p = 0,04). V skupine pacientov s chronickou obličkovou nedostatočnosťou sa na zvýšenej hladine BNP podieľali najmä echokardiografické parametre diastolického plnenia ľavej komory hodnotené z transmitrálneho toku a toku pľúcnymi žilami: E vlna (p = 0,001), A vlna (p = 0,01), E/ A (p < 0,001), IVRT (p = 0,004), E/ EDT (p < 0,0001), S vlna (p = 0,01), D vlna (p = 0,0003), S/ D (p = 0,001), trvanie Ar (p = 0,02) a E/ Vp (p = 0,003). Ani v jednej skupine nebol identifikovaný významný vzťah k ejekčnej frakcii ľavej komory. Naše predbežné výsledky dokazujú, že hlavnou kardiovaskulárnou determinantou vyšších hladín BNP u chorých v rozličnom štádiu obličkovej nedostatočnosti je diastolická dysfunkcia, kým u dialyzovaných osôb sú to najmä zvýšené objemy ľavých oddielov srdca v dôsledku ich objemového preťaženia. Spoločným menovateľom vysokej hladiny BNP v oboch skupinách pacientov je hlavne masa ľavej komory.
Kľúčové slová:
chronické choroby obličiek – chronická obličková nedostatočnosť – systolická a diastolická dysfunkcia ľavej komory – kardiálne biomarkery – BNP
Úvod
Kardiovaskulárne ochorenia sú hlavnou príčinou morbidity a mortality pacientov s chronickými chorobami obličiek. Včasná identifikácia asymptomatických jedincov s chronickými chorobami obličiek je preto veľmi dôležitá. Ďalšia prognóza týchto pacientov závisí najmä od včasnej detekcie a následnej liečby kardiovaskulárnych ochorení. V posledných rokoch sa v klinickej praxi začali používať tzv. „kardiálne biomarkery“, ktoré dokážu u asymptomatických jedincov s chronickými chorobami obličiek (v rozličnom štádiu redukcie obličkových funkcií) predvídať riziko vzniku rozličných kardiovaskulárnych komplikácií. Jedným z takýchto biomarkerov je aj B-typ natriuretického peptidu (BNP). BNP je produkovaný kardiomyocytmi, metabolizovaný receptormi natriuretických peptidov v pečeni, obličkách, v cievnom endoteli [1]. BNP je rozštiepený na aktívny C terminálny koniec BNP 32 a inaktívny N terminálny koniec pro BNP. Hladiny oboch foriem BNP významne ovplyvňujú obličkové funkcie, zvyšujú sa pri postupnej progresii chronických chorôb obličiek [2].
Je známe, že pacienti s redukovanými obličkovými funkciami majú zvýšené hodnoty BNP. Jedným z vysvetlení by mohla byť retencia BNP obličkami, avšak proti tomu svedčí dôkaz zvýšených hladín BNP v moči u chorých s redukovanými obličkovými funkciami. Medzi obličkovými funkciami a hodnotami BNP existuje teda inverzná korelácia [3]. Zvýšená hodnota BNP v tejto skupine chorých je potom výsledkom tak retencie obličkami, ale aj kontraregulačnej odpovede srdca na zmeny v hemodynamike a vodnej homeostáze [4].
Chronické choroby obličiek s postupným poklesom glomerulovej filtrácie (GF) významne zvyšujú riziko rozvoja kardiovaskulárnych ochorení (KVO), urýchľujú priebeh už prítomného KVO a celkovo zhoršujú prognózu takýchto pacientov. Dokázali to viaceré práce u pacientov bez dokázaného KVO, u chorých s prítomnými kardiovaskulárnymi rizikovými faktormi, ako aj u osôb s prekonanými kardiovaskulárnymi príhodami [5–7]. U jedincov v terminálnom štádiu zlyhania obličiek (End Stage Renal Disease – ESRD) je mortalita 20–50krát vyššia v porovnaní s ostatnou populáciou. Viac ako polovica úmrtí je spôsobená práve KVO [8].
BNP je senzitívnym markerom porušenej funkcie ľavej komory u chorých s chronickými chorobami obličiek a jeho hodnoty u týchto chorých sú zvýšené. Nie je však jasné, čo sa podieľa na zvýšení hodnôt BNP, systolická, resp. diastolická dysfunkcia.
Cieľom našej práce bolo zistiť vzťah medzi hladinami BNP a niektorými echokardiografickými parametrami systolickej a diastolickej funkcie ľavej komory u pacientov s rozličnými štádiami chronickej renálnej insuficiencie (CHRI) podľa K/DOQI, resp. u dialyzovaných chorých.
Pacienti a metódy
Vyšetrili sme 49 pacientov s chronickými chorobami obličiek v rozličnom štádiu CHRI podľa K/DOQI, priemerný vek pacientov bol 69,39 ±± 8,47 rokov, priemerné hodnoty urey boli 9,68 ± 4,59 mmol/l, kreatinínu 170,29 ± 120,66 μmol/l a priemerné hodnoty glomerulovej filtrácie (GF) boli 0,71 ± 0,25ml/s. Okrem týchto parametrov sme zisťovali aj hodnoty C-reaktívneho proteínu (CRP) a fibrinogénu. Priemerné hodnoty fibrinogénu boli 3,25 ± 0,92g/l a medián pre CRP bol 3,77 (v širokom rozpätí od 0,29 do 32,35mg/l). Medián pre BNP bol 132 pg/ml, v širokom rozpätí od 0,1 do 1 820 pg/ml.
Podobne sme vyšetrili 45 dialyzovaných pacientov, ich priemerný vek bol 52,6 ± 14,85 rokov, priemerné hodnoty urey boli 20,27 ± 4,95 mmol/l, kreatinínu 729,1 ± 238,19 μmol/l, priemerné hodnoty fibrinogénu boli 4,27 ± 1,3g/l. Medián pre CRP bol 7,71 (v rozpätí od 0,38 do 318) a medián pre BNP bol 310 pg/ml (opäť v širokom rozpätí od 5 do 11 430 pg/ml). Základnú charakteristiku súboru našich pacientov uvádzame v tab. 1.
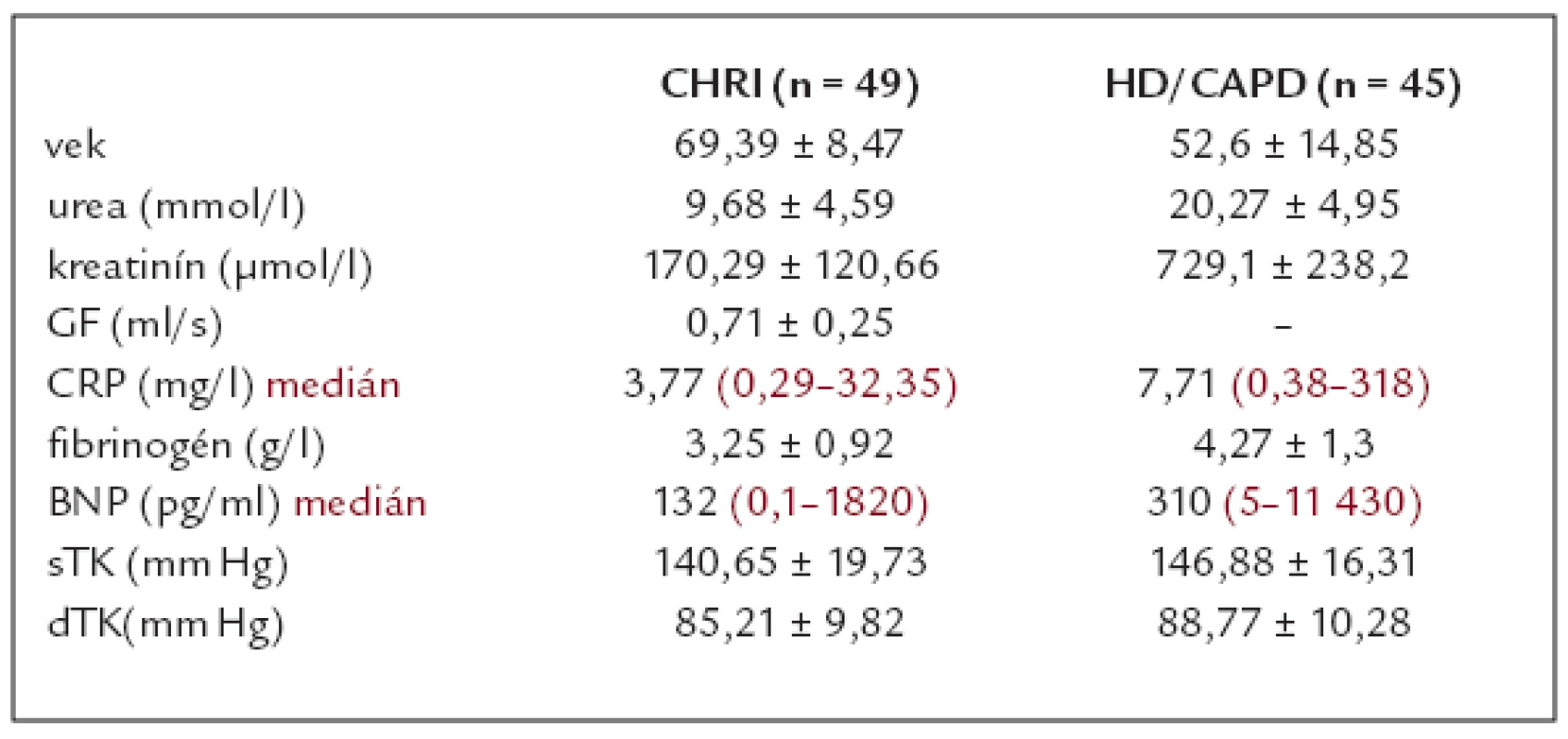
Príčinou CHRI v skupine nedialyzovaných chorých bola diabetická nefropatia (DN) u 17 pacientov, chronická tubulointersticiálna nefritída (TIN) u 23 chorých, glomerulonefritída (GN) u 3 jedincov, nefroskleróza u 5 osôb a ANCA vaskulitída u 1 pacienta. V skupine dialyzovaných pacientov (HD 33 pacientov, resp. 12 chorých na CAPD) bola najviac zastúpená chronická GN – u 15 pacientov, TIN 14 chorých, DN a polycystické obličky malo po 7 chorých a 2 pacienti mali myelómovú, resp. dnavú nefropatiu.
Celkovo v skupine chorých s CHRI (n = 49) malo hypertenziu 40 pacientov a diabetes mellitus 17 jedincov. V skupine dialyzovaných osôb (n = 45) 43 z nich malo hypertenziu a 7 boli diabetici.
Pri rozdelení pacientov s CHRI podľa štádií K/DOQI boli 4 pacienti v 2. štádiu, 35 chorých v 3. štádiu a 10 pacientov bolo v 4. štádiu K/DOQI. Ani jeden zo zaradených pacientov nemal za posledný polrok klinické prejavy kardiálnej dekompenzácie.
U každého pacienta bola realizovaná transtorakálna dvojrozmerná echokardiografia a dopplerovské vyšetrenie na prístroji Siemens Sequoia (Siemens Medical Solutions) 2,25–3,75 MHz sondou. Off line bola podrobne analyzovaná systolická a diastolická funkcia ľavej komory. Ejekčná frakcia (EF), enddiastolický a endsystolický objem (EDV, ESV) ľavej komory boli hodnotené na základe modifikovanej biplanárnej metódy podľa Simpsona. Masa ľavej komory (LVM) a index masy (LVMI) boli merané metódou podľa Devereuxa et al [9]. Z transmitrálneho toku boli pulzným dopplerovským vyšetrením hodnotené nasledovné parametre: vrcholová rýchlosť v čase rýchlej fázy plnenia komôr (E vlna) a systoly predsiení (A vlna), trvanie A vlny (A dur), deceleračný čas E vlny (E DT), izovolumetrický relaxačný čas (IVRT), pomer E/A a E/E DT. Pulzným dopplerovským vyšetrením boli hodnotené aj toky v pľúcnych žilách (ľavej hornej pľúcnej žile): vrcholová rýchlosť systolickej, diastolickej vlny a atriálneho reverzného toku (S, D, Ar), vrátane trvania Ar (Ar dur), pomeru S/D a rozdielu A dur – Ar dur. Z farebného dopplerovského vyšetrenia v jednorozmernom zobrazení bola hodnotená propagačná rýchlosť transmitrálneho toku (Vp). Pulznou tkanivovou dopplerovskou echokardiografiou sa hodnotila myokardiálna rýchlosť bazálneho segmentu interventrikulárneho septa v systole (Sm) a diastole (Em, Am). Nová zobrazovacia metodika – Vector Velocity Imaging (VVI) umožnila podrobné hodnotenie funkcie ľavej predsiene (ĽP) a deformácie ĽK. Funkcia ĽP bola hodnotená z časovo-objemových kriviek určením nasledovných parametrov: EF ĽP, maximálny a minimálny objem ĽP (Vmax, Vmin) a celkový vývrhový objem ľavej predsiene (Total Atrial Stroke Volume – TASV).
Echokardiografické vyšetrenie sme realizovali v deň odberu krvi na BNP. Údaje sú uvedené v tab. 2.
Štatistická analýza
Štatisticky boli hodnotené priemery ± smerodajné odchýlky. Pri zisťovaní vzťahu BNP k echokardiografickým parametrom sme použili metódu korelačnej matrix. Za signifikantnú sa považovala hodnota p < 0,05. Fischerov exaktný χ2 test sme použili pri analýze liečby v oboch skupinách pacientov.
Výsledky
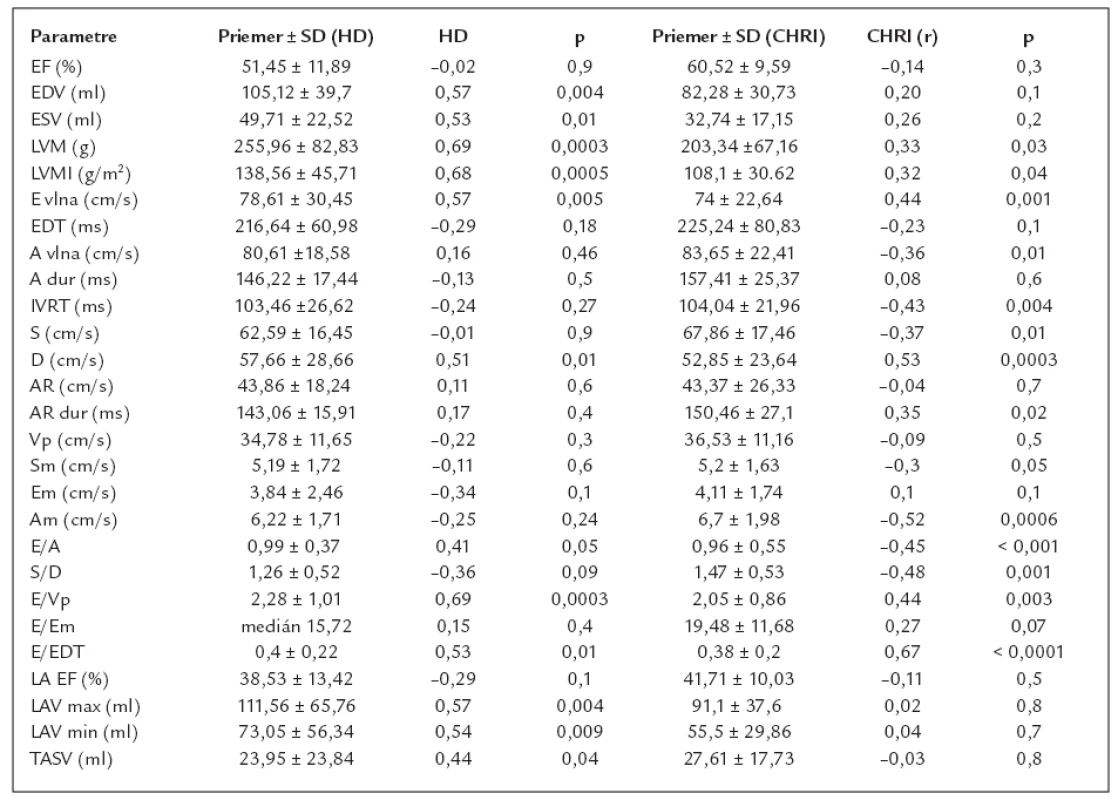
V oboch skupinách sledovaných pacientov sme dokázali zvýšenú hodnotu BNP (medián 132 pg/ml v skupine s CHRI, resp. medián 320 pg/ml v skupine dialyzovaných chorých, p = 0,001). Spoločným vysoko signifikantným ukazovateľom zvýšenej hodnoty BNP u chorých s CHRI, resp. dialyzovaných pacientov je masa ľavej komory a index masy ľavej komory (v skupine CHRI LVM p = 0,03, u dialyzovaných osôb p = 0,0003, resp. LVMI p = 0,04 v skupine CHRI a p = 0,0005 u dialyzovaných osôb).
V skupine pacientov s chronickou obličkovou nedostatočnosťou sa na zvýšenej hladine BNP podieľali najmä echokardiografické parametre diastolického plnenia ľavej komory hodnotené z transmitrálneho toku a toku pľúcnymi žilami: E vlna (p = 0,001), A vlna (p = 0,01), E/A (p < 0,001), IVRT (p = 0,004), E/E DT (p < 0,0001), S vlna (p = 0,01), D vlna (p = 0,0003), S/D (p = 0,001), trvanie Ar (p = 0,02) a E/Vp (p = 0,003). Z parametrov tkanivového dopplerovského vyšetrenia bol signifikantný vzťah BNP len k Am (p = 0,0006).
U dialyzovaných chorých sa na zvýšenej hodnote BNP podieľali najmä zvýšené objemy ľavej komory, ľavej predsiene a len niektoré parametre diastolického plnenia ľavej komory: EDV ľavej komory (p = 0,004), ESV ľavej komory (p = 0,01) a objemy ľavej predsiene (maximálny, minimálny a celkový vývrhový objem ľavej predsiene; p = 0,004, p = 0,009 a p = 0,04). Z indexov diastolického plnenia ľavej komory bol významný vzťah BNP len k E vlne (p = 0,005), D vlne (p = 0,01), pomeru E/Vp (p = 0,0003) a E/E DT (p = 0,01).
Ani v jednej skupine nebol identifikovaný významný vzťah k systolickej funkcii ľavej komory (EF, Sm), hoci je potrebné poznamenať, že v oboch skupinách boli pacienti s primeranou systolickou funkciou (priemerná EF v skupine hemodialyzovaných pacientov bola 51,45 ± 11,89% a v skupine s chronickou renálnou insuficienciou bola priemerná EF 60,52 ± 9,59%).
Výsledky korelačnej matrix sú uvedené v tab. 2.
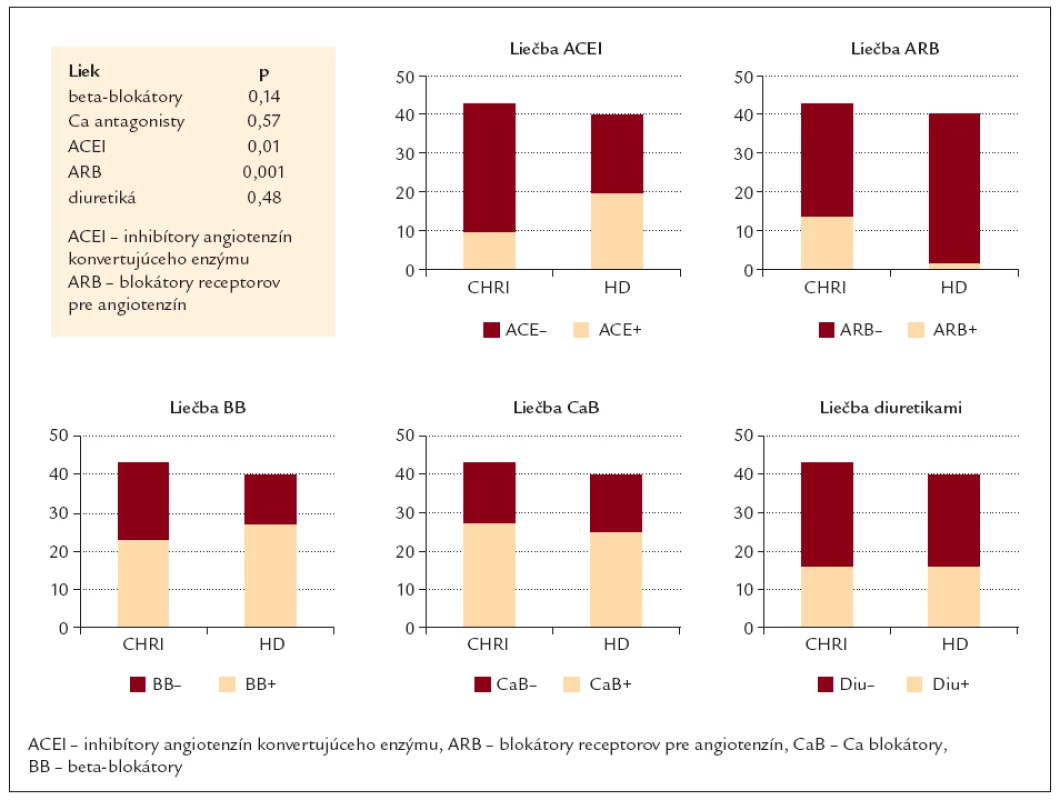
Analýzou liečby oboch vyšetrovaných skupín sme zistili, že chorí v rozličných štádiách CHRI významne menej často užívali inhibítory angiotenzín konvertujúceho enzýmu (ACEI) v porovnaní s dialyzovanými pacientmi (p = 0,01). Naopak, blokátory receptorov pre angiotenzín II významne častejšie užívali pacienti v dialyzačnom programe (p = 0,001). Významný rozdiel v užívaní ďalších liekov (beta blokátory, Ca antagonisty, diuretiká) sme nezistili (tab. 3).
Diskusia
Je známe, že jedinci s chronickými chorobami obličiek majú výrazne zvýšené kardiovaskulárne riziko. Viac ako 50% úmrtí v 4. a 5. štádiu CHRI pripadá práve na kardiovaskulárne ochorenia a mortalita z kardiovaskulárnych príčin je 10–20krát vyššia v populácii osôb s chronickými chorobami obličiek oproti jedincom bez postihnutia obličiek [10–12].
Aj menej závažné postihnutie obličiek môže byť spojené s významným kardiovaskulárnym rizikom. Viaceré štúdie dokázali inverzný vzťah medzi obličkovými funkciami a kardiovaskulárnymi výsledkami [13–15]. Veľké štúdie SOLVD (Studies of Left Ventricular Dysfunction), TRACE (Trandolapril Cardiac Evaluation), SAVE (Survival And Ventricular Enlargement) a VALIANT (Valsartan in Acute Myocardial Infarction) potvrdili významnú asociáciu redukovaných obličkových funkcií so signifikantne vyššou kardiovaskulárnou morbiditou aj mortalitou [16].
Pacienti s chronickými chorobami obličiek a postihnutím kardiovaskulárneho systému tvoria 4. typ kardiorenálneho syndrómu – tzv. renokardiálny syndróm. Tento typ kardiorenálneho syndrómu je charakterizovaný prítomnosťou primárnej chronickej choroby obličiek prispievajúcej k postihnutiu srdca, napr. k hypertrofii ľavej komory, diastolickej dysfunkcii a/alebo k zvýšenému riziku kardiovaskulárnych príhod [16].
Nepriaznivé kardiovaskulárne výsledky u pacientov s chorobami obličiek sú spojené so zvýšenými hodnotami špecifických kardiálnych biomarkerov [2,17]. Troponín, natriuretické peptidy, asymetrický dimethyl arginín (ADMA) a C-reaktívny proteín (CRP) sú biomarkery, ktorých hladiny korelujú s kardiovaskulárnymi výsledkami u pacientov s chronickými chorobami obličiek [18,19].
Tieto pozorovania poskytujú dôkaz o istom prepojení medzi chronickým zápalom, subklinickými infekciami, akcelerovanou aterosklerózou, interakciami srdce – obličky a negatívnymi kardiovaskulárnymi, resp. obličkovými výsledkami [20].
V našom súbore pacientov sme zistili vyššie hodnoty BNP tak v skupine CHRI (132 pg/ml), ako aj u dialyzovaných chorých (320 pg/ml). Spoločným vysoko signifikantným ukazovateľom zvýšenej hodnoty BNP v oboch skupinách bola masa ľavej komory. V skupine chorých s CHRI najsilnejšími prediktormi zvýšenej hodnoty BNP boli najmä echokardiografické parametre diastolického plnenia ľavej komory. Diastolickú dysfunkciu u pacientov s CHRI v rozličnom štádiu K/DOQI potvrdil Agarwal [21], pričom diastolická dysfunkcia sa vyskytovala skôr ako systolická dysfunkcia ľavej komory. Portugalskí autori Almeida et al [22] dokázali, že diastolická dysfunkcia sa vyskytuje prakticky vo všetkých štádiách K/DOQI u chorých s autozomálne dominantnou polycystickou chorobou obličiek. Tento nález bol nezávislý od veku a krvného tlaku. Miyazato [23] zasa dokázal diastolickú dysfunkciu ľavej komory u pacientov s diabetickou nefropatiou v rozličnom štádiu CHRI, a to nezávisle od hypertrofie ľavej komory. Aj v práci Hayashiho et al [24] u 40 pacientov s rozličným stupňom CHRI tkanivový doppler odhalil výraznejšiu diastolickú dysfunkciu spojenú so zvýšeným systolickým krvným tlakom ako aj zvýšené hladiny parathormónu (PTH).
U hemodialyzovaných osôb v našej skupine pacientov sa na vysokej hladine BNP podieľali najmä objemy ľavej komory a predsiene a len niektoré parametre diastolickej dysfunkcie, ale opäť najsilnejším prediktorom bola masa ľavej komory.
Tak systolickú ako aj diastolickú dysfunkciu potvrdili poľskí autori v skupine 59 dialyzovaných pacientov, spolu s hypertrofiou ľavej komory. Navyše autori potvrdili aj koreláciu medzi koncentráciami PTH a hypertrofiou ľavej komory [25]. V nami prezentovanej štúdii sme nenašli významný vzťah medzi hladinou BNP a systolickou funkciou ľavej komory (EF, Sm). Je však potrebné poznamenať, že v oboch skupinách boli zastúpení pacienti s primeranou systolickou funkciou.
Českí autori sledovali hladiny NT-proBNP a big endotelínu (prekurzor endotelínu) u chorých zaradených do dlhodobého dialyzačného programu. Dokázali tak isto významný výskyt diastolickej dysfunkcie u týchto pacientov a zároveň aj vysoké hodnoty oboch neurohumorálnych pôsobkov, síce 2násobok normy u big endotelínu a až 7násobok normálnej hodnoty pro BNP. Naviac, hodnoty oboch pôsobkov korelovali s kardiotorakálnym indexom [26].
Tí istí autori sledovali hodnoty NT-proBNP a big endotelínu u pacientov v dlhodobom dialyzačnom programe v časovom období hneď po HD a v čase medzi 2 dialýzami. V súbore 22 pacientov dokázali, že hodnoty tak NT-proBNP ako aj hladiny plazmatického big endotelínu sa v sledovaných časových obdobiach prakticky nemenili a ostávali zvýšené [27].
Celkový počet pacientov s chronickými chorobami obličiek užívajúcich vhodnú liečbu redukujúcu kardiovaskulárne riziko je menší ako v bežnej populácii. Tento tzv. „terapeutický nihilizmus“ vyplýva zo zhoršovania obličkových funkcií a dôsledkom toho je, že menej ako 50% pacientov s chronickými chorobami obličiek je liečených kombináciou aspirín, beta blokátory, ACEI a statíny [16].
Berger et al dokázali vo veľkej štúdii pacientov po prekonanom IM, že skupina týchto chorých s chronickými chorobami obličiek bola významne menej často liečená aspirínom, ACEI alebo beta blokátorom [28]. Možnými príčinami takýchto „subterapeutických“ postupov je pozorované zhoršovanie obličkových funkcií, resp. vznik vedľajších účinkov liekov spôsobených redukovanými obličkovými funkciami [29].
V našich skupinách pacientov sme analyzovaním liečby zistili, že chorí s CHRI v porovnaní s dialyzovanými pacientmi boli významne menej často liečení ACE inhibítormi (p = 0,01). Naopak, sartany menej často užívali chorí zaradení do dialyzačného programu (p = 0,001). V používaní ďalších druhov hypotenzív sme nenašli významné rozdiely: beta blokátory (p = 0,14), Ca antagonisty (p = 0,57) a diuretiká (p = 0,48).
Záver
Záverom možno povedať, že posledné roky sa nesú v znamení rastúceho významu tzv. kardiálnych biomarkerov a následného vytipovania osôb s chronickými chorobami obličiek a vysokým kardiovaskulárnym rizikom. V našej skupine pacientov s CHRI boli hlavnou príčinou vyššej hodnoty BNP parametre diastolickej dysfunkcie ľavej komory, kým v skupine dialyzovaných chorých sa na vyššej hodnote BNP podieľali najmä parametre objemového preťaženia. Spoločným a najvýznamnejším determinantom bola však v oboch skupinách pacientov masa ľavej komory. Analýzou liečby najmä pacientov s CHRI sme zistili nedostatočnú vyťaženosť hlavne preparátmi ACEI. Optimálnym by bolo ich častejšie používanie najmä kvôli nefroprotekcii, resp. kardioprotekcii, ako aj ich vplyvu na diastolickú dysfunkciu.
doc. MUDr. Ivana Valočiková, PhD.
www.ujps.sk
e mail: irosochova@hotmail.com
Sources
1. Joffy L, Rosner MH. Natriuretic peptides in ESRD. Am J Kidney Dis 2005; 46 : 1 – 10.
2. Roberts MA, Hare DL, Ratnaike S et al. Cardiovascular Biomarkers in CKD: Pathophysiology and Implication for Clinical Management of Cardiac Disease. Am J Kidney Dis 2006; 48 : 341 – 360.
3. Totsune K, Takahashi K, Satoh F et al. Urinary immunoreactive brain natriuretic peptide in patients with renal disease. Regul Pept 1996; 63 : 141 – 147.
4. Vasavada N, Agarwal R. Role of excess volume in the pathopsysiology of hypertension in chronic kidney disease. Kidney Int 2003; 64 : 1772 – 1779.
5. Go AS, Chertow GM, Fan D et al. Chronic kidney disease and the risk of death, cardiovascular events, and hospitalization. N Engl J Med 2004; 351 : 1296 – 1305.
6. Shlipak MG, Heidenreich PA, Noguchi H et al. Association of renal insufficiency with treatment and outcomes after myocardial infarction in elderly patients. Ann Intern Med 2002; 137 : 555 – 562.
7. Anavekar NS, McMurray JJ, Velazquez EJ et al. Relation between renal dysfunction and cardiovascular outcomes after myocardial infarction. N Engl J Med 2004; 351 : 1285 – 1295.
8. Longenecker JC, Coresh J, Powe NR et al. Traditional cardiovascular disease risk factors in dialysis patients compared with the general population: the CHOICE Study. J Am Soc Nephrol 2000; 13 : 1918 – 1927.
9. Devereux RB, Reichek N. Echocardiographic determination of left ventricular mass in man. Anatomic validation of the method. Circulation 1977; 55 : 613 – 618.
10. Herzog CA. Dismal long‑term survival of dialysis patients after acute myocardial infarction: can we alter the outcome? Nephrol Dial Transplant 2002; 17 : 7 – 10.
11. Johnson DW, Craven AM, Isbel NM. Modification of cardiovascular risk in haemodialysis patients: an evidence‑based review. Hemodial Int 2007; 11 : 1 – 14.
12. Logar CM, Herzog CA, Beddhu S. Diagnosis and therapy of coronary artery disease in renal failure, end‑stage renal disease, and renal transplant population. Am J Med Sci 2003; 325 : 214 – 227.
13. Garg AX, Clark WF, Haynes RB et al. Moderate renal insufficiency and the risk of cardiovascular mortality: Results from the NHANES I. Kidney Int 2002; 61 : 1486 – 1494.
14. Keith DS, Nichols GA, Gullion CM et al. Longitudinal follow‑up and outcomes among a population with chronic kidney disease in a large managed care organisation. Arch Intern Med 2004; 164 : 659 – 663.
15. Sarnak MJ, Coronado BE, Greene T et al. Cardiovascular disease risk factors in chronic renal insufficiency. Clin Nephrol 2002; 57 : 327 – 335.
16. Ronco C, Haapio M, House AA et al. Cardiorenal syndrome. J Am Coll Cardiol 2008; 52 : 1527 – 1539.
17. Cameron SJ, Green GB. Cardiac biomarkers in renal disease: the fog is slowly lifting. Clinical Chem 2004; 50 : 2233 – 2235.
18. Zoccali C. Biomarkers in chronic kidney disease: utility and issues towards better understanding. Curr Opin Nephrol Hypertens 2005; 14 : 532 – 537.
19. Mallamaci F, Tripepi G, Cutrupi S et al. Prognostic value of combined use of biomarkers of inflammation, endothelial dysfunction, and myocardiopathy in patients with ESRD. Kidney Int 2005; 67 : 2330 – 2337.
20. Cazzovillan S, Ratanarat R, Segala C et al. Inflammation and subclinical infection in chronic kidney disease: a molecular approach. Blood Purif 2007; 25 : 69 – 76.
21. Agarwal S, Dangri P, Kalra OP et al. Echocardiographic assessment of cardiac dysfunction in patients of chronic renal failure. JIAM 2003; 4 : 296 – 303.
22. de Almeida EA, de Oliveira EI, Lopés JA et al. Diastolic function in several stages of chronic kidney disease in patients with autosomal dominant polycystic kidney disease: a tissue doppler imaging study. Kidney Blood Press Res 2007; 30 : 234 – 239.
23. Miyazato J, Horio T, Takiuchi S et al. Left ventricular diastolic dysfuction in patients with chronic renal failure: impact of diabetes mellitus. Diabet Med 2005; 22 : 730 – 736.
24. Hayashi SY, Rohani M, Lindholm B. Left ventricular function in patients with chronic kidney disaese evaluated by colour tissue Doppler velocity imaging. Nephrol Dial Transplant 2006; 21 : 125 – 132.
25. Wanic - Kossowska M, Lehmann P, Czekalski S. Left ventricular systolic and diastolic dysfunction in patients with chronic renal failure treated with hemodialysis. Pol Arch Med Wewn 2003; 109 : 365 – 373.
26. Ludka O, Špinar J, Vítovcová L et al. Význam stanovení NT - proBNP a big endotelinu pro diagnostiku chronického srdečního selhání u nemocných v pravidelném hemodialyzačním programu. Vniř Lék 2007; 53 : 38 – 45.
27. Ludka O, Špinar J, Vítovcová L et al. Variabilita plazmatických hladin big endotelinu a NT - proBNP u nemocných se srdečním selháním v chronickém hemodialyzačním programu. Vniř Lék 2007; 53 : 1177 – 1181.
28. Berger AK, Duval S, Krumholz HM. Aspirin, beta‑blocker and angiotensin‑converting enzyme inhibitor therapy in patients with end‑stage renal disease and an acute myocardial infarction. J Am Coll Cardiol 2003; 42 : 201 – 208.
29. French WJ, Wright RS. Renal insufficiency and worsened prognosis with STEMI: a call for action. J Am Coll Cardiol 2003; 42 : 1544 – 1546.
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Internal Medicine

2009 Issue 10
-
All articles in this issue
- Charakteristika ulceráci í na nohách u diabetikov
- Plazmatické hladiny neuropeptidu Y, ghrelinu a leptinu u pacientek s anorexia nervosa a jejich změny po šestitýdenní realimentaci
- Sekundární dyslipidemie navozená současnými perorálními kontraceptivy
- BNP a echokardiografické parametre u pacientov s chronickými chorobami obličiek a dialyzovaných chorých
- Vztah mezi kvalito u života a BODE indexem u bývalých kuřáků ve stabilní fázi chronické obstrukční plicní nemoci
- 24letý muž s horečkami, multiorgánovou dysfunkcí a rychle progredujícím ARDS
- Léčba refluxní choroby jícnu – současný stav
- Polohový test – víme o něm opravdu všechno?
- Neuroendokrinní nádory žaludku
- Refluxní choroba jícnu. Standardy České gastroenterologické společnosti – aktualizace 2009
- Nežádo ucí účinky amiodaronu na kůži
- IgA pemfigus provázející mnohočetný myelom vymizel při léčbě bortezomibem (Velcade), cyklofosfamidem a dexametazonem. Popis případu a přehled literatury
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue
- Refluxní choroba jícnu. Standardy České gastroenterologické společnosti – aktualizace 2009
- Léčba refluxní choroby jícnu – současný stav
- Polohový test – víme o něm opravdu všechno?
- Neuroendokrinní nádory žaludku
