Karcinoid appendixu s pohárkovými buňkami
Goblet cell carcinoid of the appendix
Appendiceal goblet cell carcinoids are mixed tumors including neuroendocrine cells and intestinal type of goblet cells. Compared to typical carcinoids, goblet cell carcinoids are malignant tumors with degree of malignity differing from case to case. Carcinoid syndrom is not present. There is poor prognosis in larger tumors. Appendectomy is a sufficient therapeutical approach in small tumors, hemicolectomy should be performed in larger ones. There is limited experience with chemotherapy in metastasizing tumors and sporadic with somatostatin analogues.
Key words:
appendectomy – goblet cell carcinoid – chemotherapy – somatostatin receptor scintigraphy – somatostatin analogues
Authors:
O. Louthan
Authors‘ workplace:
Ambulance pro neuroendokrinní nádory IV. interní kliniky 1. lékařské fakulty UK a VFN Praha, přednosta prof. MU Dr. Aleš Žák, DrSc.
Published in:
Vnitř Lék 2009; 55(11): 1056-1059
Category:
Reviews
Overview
Karcinoid s pohárkovými buňkami appendixu (goblet cell carcinoid) je smíšený nádor z neuroendokrinních buněk a pohárkových buněk intestinálního typu. V porovnání s typickými karcinoidy appendixu jde o maligní tumor lišící se případ od případu stupněm malignity. Jeho incidence je 10krát nižší nežli incidence typického karcinoidu. Neprojevuje se karcinoidovým syndromem. Větší nádory mají horší prognózu. U malých nádorů postačuje appendektomie, u větších je nutná hemikolektomie. U metastazujících nádorů jsou omezené zkušenosti s chemoterapií a zcela minimální se somatostatinovými analogy.
Klíčová slova:
appendektomie – goblet cell carcinoid – chemoterapie – karcinoid s pohárkovými buňkami – somatostatinová analoga – somatostatinová receptorová scintigrafie
Úvod
Klasifikace
Podle základní klasifikace [1] se neuroendokrinní tumory (karcinoidy) appendixu dělí na:
- dobře diferencované tumory s benigním nebo nejistým chováním
- dobře diferencované neuroendokrinní karcinomy
- karcinoidy s pohárkovými buňkami (goblet cell carcinoid)
Poslední uvedená skupina je předmětem tohoto sdělení. Goblet cell karcinoidy (GCK), jinak karcinoidy s pohárkovými buňkami (M-8243/3) či karcinoidy z pohárkových buněk (synonymy jsou též adenokarcinoid, mucinózní adenokarcinoidy), jsou odlišnou patologickou i klinickou entitou od typického karcinoidu appendixu. V klasifikaci podle WHO jsou označeny jako exokrinně endokrinní karcinomy. Tento poměrně vzácný nádor má smíšený fenotyp s částečnou neuroendokrinní diferenciací a intestinálním typem pohárkových buněk. I když GCK se může vyskytovat i mimo appendix, je appendikální forma nejčastější a nejtypičtější. Maligní potenciál tohoto nádoru je nesporný, ale stupeň malignity se liší případ od případu. GCK bývají hormonálně nefunkční. Tumor vzniká z pluripotentní buňky [2]. Vyznačuje se agresivnějšími vlastnostmi, takže si vyžaduje odlišné diagnostické a terapeutické přístupy v porovnání s appendikálním karcinoidem.
Incidence
Podle údajů SEER (Surveillance Epidemiology and End Results) z let 1973 až 2001 je incidence 0,5 GCK na 1 mil. obyvatel. Odhaduje se, že incidence GCK je v poměru k incidenci karcinoidu appendixu asi 1 : 10. Medián věku pacientů je 5. dekáda, druhý vrchol se vyskytuje kolem 70. roku věku, což je o 20–40 let později než klasické karcinoidy appendixu. U obou pohlaví se vyskytuje se stejnou četností.
Patologie
Podle poslední verze WHO klasifikace jsou karcinoidy s pohárkovými buňkami klasifikovány jako smíšený exokrinně endokrinní karcinom, jde o low-grade maligní tumor. Goblet cell karcinoidy bývají většinou menší nežli karcinoidy appendixu.
Karcinoidy s pohárkovými buňkami se šíří v subkumóze, infiltrují doširokaperiappendikální tuk a šíří se perineurálně. Je typické, že mukóza je nádorem ušetřena. Tumor většinou ne-vytváří solidní masy. Nádorový parenchym se skládá z malých kruhových buněčných hnízd z buněk podobajících se střevním pohárkovým buňkám. Buňky vykazují pozitivitu na mucikarmín, jodistou kyselinu – Schiffovu bázi, alciánovou modř, na cytokeratin a karcinoembryonální antigen. Část buněk se vyznačuje i pozitivitou imunohistochemického vyšetření na chromogranin a synaptofyzin. Je zvýšená exprese buněčných proliferačních markerů a markerů buněčného cyklu. Prognostický význam proliferačních markerů, mitotického indexu a Ki67, je s ohledem na nedostatek příslušných studií zatím nejasný. Podobně je nejasný prognostický význam β-cateninu, P53, E-cadherinu či catestatinu A prováděných v rámci imunohistochemických vyšetření [3–5].
Podle mikroskopického charakteru rozeznáváme tři podtypy GCK:
- typický GCK neboli podtyp A, histologická charakteristika je zmíněna výše
- podtyp 2. je tzv. adenokarcinom ex GCK neboli podtyp B, též typ nádoru z prstenčitých buněk (signet ring cell type). U tohoto podtypu se v terénu pohárkových nádorových buněk objevují ostrůvky buněk s odlišným charakterem. Z morfologického hlediska jsou tyto buňky uspořádané neorganizovaně, převažují prsténčité buňky s desmoplastickou stromální reakcí [6].
- typ 3 – adenokarcinom ex GCC, málo diferencovaný typ (podtyp C) je vzácný
Klinika
U většiny pacientů se karcinoid s prstenčitými buňkami manifestuje jako akutní appendicita nebo jako chronická bolest v pravém dolním kvadrantu břicha. Někdy se může manifestovat formou obecně onkologických příznaků při růstu nádorové masy. Oproti karcinoidům, které se nacházejí na špičce appendixu, a proto většinou nezpůsobují samy o sobě appendicitidu, je GCK lokalizován ve střední třetině appendixu, a může proto způsobit jeho obstrukci s následným akutním zánětem. Vzdálené metastázy se popisují u 10% nemocných. Většina metastáz se objevuje v ovariích, na peritoneu a konečně je známa i extraabdominální lokalizace. Vzácný není ani synchronní nebo metachronní výskyt dalších malignit, zejména kolorektálního karcinomu.
Diagnostika
GCK jsou diagnostikovány většinou histologicky po appendektomii provedené pro klinicky zřejmou appendicitidu. V první fázi tedy přichází ke slovu histologie a další vyšetření přicházejí v úvahu až po operačním výkonu v rámci stagingu. V přípravě je TNM klasifikace [7] v návrhu ENETS (European Neuroendocrine Tumors Society). Všechny obvyklé zobrazovací techniky vykazují u tohoto nádoru dosti vysokou senzitivitu. CT a MRI jsou poněkud validnější nežli ultrazvukové vyšetření. Somatostatinová receptorová scintigrafie (SRS) (octreoscan) je součástí stagingu, má význam v detekci reziduální nemoci a v průkazu nitrobřišních metastáz, pokud exprimují somatostatinové receptory [8]. Studie Chitiho et al (1998) [9] ukázala, že u jaterních metastáz byla senzitivita SRS 90%, ultrazvuku 88% a u CT 78%. Dalšími možnostmi jsou CT-SPECT (kontrastní multifázické CT kombinované se somatostatinovou receptorovou scintigrafií-SPECT) anebo CT-PET se somatostatinovým analogem značeným 68Gadoliniem, pokudjsou tato vyšetření k dispozici. Tato nová zobrazovací vyšetření jsou u GCK senzitivnější nežli konvenční zobrazovací metody. Všichni pacienti by měli být vyšetřeni kolonoskopicky nebo pomocí CT kolonografie s cílem vyloučit synchronní nebo metachronní tumory [10,11].
Pro GCK neexistují žádné vhodné specifické sérové markery, a to ani sérový chromogranin, který je jinak dobrým specifickým a senzitivním markerem u neuroendokrinních tumorů. U metastatické nemoci se doporučuje sledovat CEA, CA19-9 a CA125.
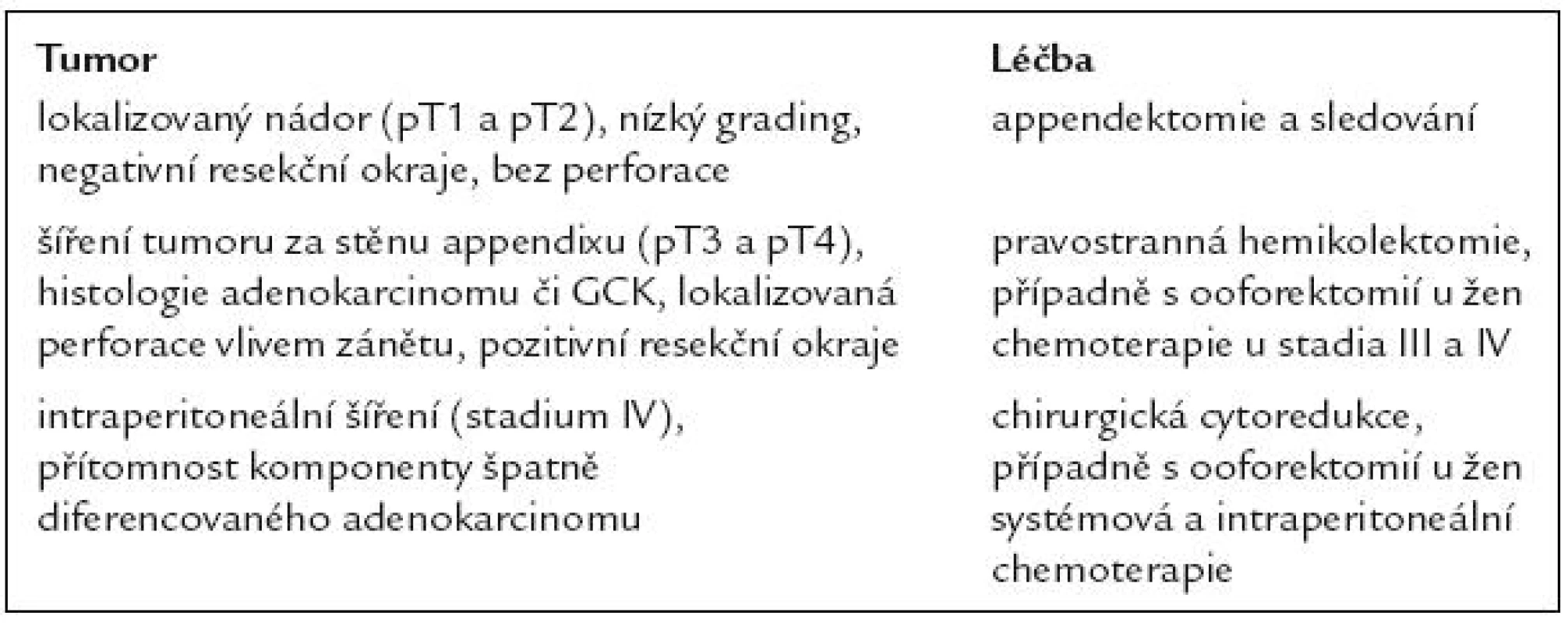
Léčba
Radikální léčba
U většiny GCK je indikována pravostranná hemikolektomie jako radikální výkon [11,12]. Může být provedena do 3 měsíců jako second-look operace po appendektomii. U GCK appendixu u žen se doporučuje i provedení oboustranné salpingo-ooforektomie. Podle některých autorů lze malé, lokalizované tumory < 1cm, s nízkým proliferačním indexem, bez invaze do serózy, bez invaze do mesoappendixu či céka ošetřit jen appendektomií, neboť riziko recidivy či metastazování je za těchto okolností nízké [13–15].
Paliativní léčba
U peritoneální diseminace GCS se doporučuje chirurgická cytoredukce s následnou intraperitoneální chemoterapií, která může prodloužit přežití. Podle omezených zkušeností může pacient s karcinózou peritonea profitovat z velké resekce či mnohočetné resekce postiženého peritonea a intraperitoneální chemoterapie (Sugarbakerova metoda). Léčba jaterních metastáz se provádí podle obvyklých procedur pro léčbu malignit (embolizace, chemoembolizace, radiofrekvenční ablace, resekce solitárních metastáz apod.), ale zkušenosti s léčbou v této indikaci jsou zatím spíše kazuistické [16,17].
Pokud jde o chemoterapii a bioterapii, jako zkušenosti jsou omezené, paliativně se doporučuje podávání chemoterapeutických režimů s 5-fluorouracilem, tedy v podstatě režimy používané v léčbě kolorektálního karcinomu. Adjuvantní terapie s 5-fluorouracilem a leukovorinem neskýtá žádný benefit a nedoporučuje se. Existují kazuistické zkušenosti s dlouhodobou kompletní remisí u nemocného s disseminovanou formou GCF léčeného režimem FOLFOX IV. Vzhledem k nízké incidenci nádoru není žádná zkušenost s léčbou interferonem α, analogy somatostatinu ani s cílenou aktinoterapií. Patologické i molekulárně biologické vlastnosti nádoru sice jejich použití nepodporují, ale v případě exprese somatostatinových receptorů podle pozitivity octreoscanu je třeba uvážit možnost terapie analogy somatostatinu.
Prognóza
Karcinoidy s pohárkovými buňkami mají jasně horší prognózu nežli klasický karcinoid appendixu, a to i po adjustaci na známé prognostické faktory, jakými jsou velikost a stadium onemocnění [18]. Nicméně průběh onemocnění se liší případ od případu. Pokročilé, generalizované formy GCK mají v podstatě stejný maligní potenciál jako adenokarcinomy tlustého střeva. Mají špatnou prognózu jako jiné jasně maligní tumory appendixu, adenokarcinomy z prsténčitých buněk. Vysloveně maligní formou je i smíšený karcinoid s pohárkovými buňkami + adenokarcinom (M–8244/3).
Přežití je v úzkém vztahu se stagingem onemocnění. S přežitím koreluje i velikost nádoru. Hraniční velikosti nádoru pro prognózu jsou < 1cm, 1–2cm a > 2cm.
Dalšími prognostickými faktory jsou postižení serózy, invaze do mesoappendixu nebo extenze do peritonea či okolních orgánů (tab. 2 a 3). Na rozdíl od karcinoidů appendixu má prorůstání GCS do serózy určitou prognostickou hodnotu. Navíc postižení serózy má spolu s mesoappendikální invazí větší prognostickou hodnotu nežli postižení lymfatických uzlin.

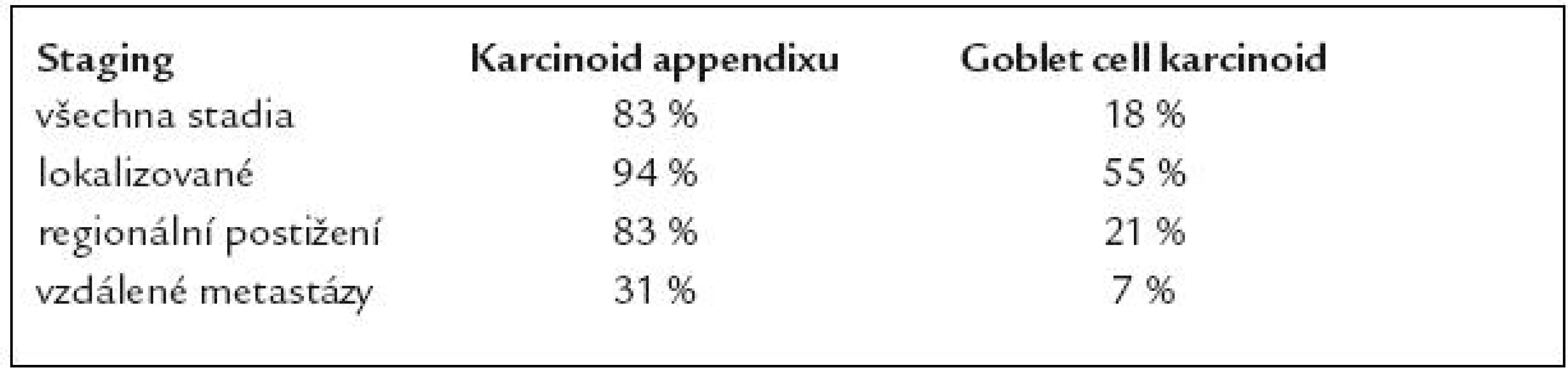
Klinickopatologická klasifikace GCK je teprve rozpracovávána. Vychází z poněkud odlišných hledisek nežli u low-grade maligní smíšené exokrinně endokrinní karcinomy. Klinickopatologická klasifikace má zahrnovat velikost nádoru v rozpětích < 1cm, 1–2cm a > 2cm, vzhledem k odlišnému riziku pro vznik regionálních a vzdálených metastáz. Plánovaná TNM klasifikace proto diferencuje T1 na T1a (< 1cm) a T1b (1–2cm). 5leté přežití vzhledem ke stagingu pro lokalizované onemocnění je 64%, regionální postižení 24% a u vzdálených metastáz 12%. U poloviny případů se zjistí nádorové postižení mesoappendixu.
Kontroly a sledování
U radikálně operovaných pacientů mají být prováděny kontroly každých 3–6 měsíců s klinickým, biochemickým a zobrazovacím vyšetřením, později 1krát za rok, podobně jako u kolorektálního karcinomu. Není shoda v délce trvání kontrol. Je vyšší koincidence (7–48% dle různých zdrojů) s dalšími gastrointestinálními tumory, proto se doporučují i endoskopické kontroly. Pro onkologa je důležité získat od chirurga a patologa dobrý popis lokalizace, velikosti nádoru, histochemický nález.
Závěr
Karcinom appendixu s pohárkovými buňkami je oproti karcinoidům appendixu, které jsou benigními nebo hraničně maligními neoplaziemi, jasně maligní neoplastický proces se špatně předvídatelným maligním potenciálem. Hemikolektomie je standardní chirurgická léčba, u žen doplněná o bilaterální salpingo-ooforektomií. Šetrnější výkon, tedy appendektomie, musí být individuálně uvážena u zřetelně příznivých forem nádoru z hlediska velikosti atd. Léčba jaterních metastáz se provádí podle zvyklých postupů jako u jiných malignit.
Podpořeno výzkumným záměrem MSMT 00216200808.
MUDr. Oldřich Louthan
www.vfn.cz
e mail: louthan@post.cz
Sources
1. Solcia E, Klöppel G, Sobin LH. Histological Typing of Endocrine Tumours. 2nd ed. WHO. International Histological Classification of Tumours. Berlin, New York: Springer 2000.
2. Burke A, Sobin L. The histogenesis of appendiceal carcinoid tumours. Histopathology 1992; 21 : 600 – 601.
3. Kanthan R, Saxena A, Kanthan SC. Goblet cell carcinoids of the appendix: immunophenotype and ultrastructural study. Arch Pathol Lab Med 2001; 125 : 386 – 390.
4. Tang L, Shia J, Wong WD. Pathological classification and clinical behavior of a spectrum of goblet cell carcinoid tumors of the appendix. Am J Surg Pathol 2008; 32 : 1429 – 1443.
5. Burke AP, Sobin LH, Federspiel BH et al. Goblet cell carcinoids and related tumors of vermiform appendix. Am J Clin Pathol 1990; 94 : 27 – 35.
6. Kabbani W, Houlihan PS, Luthra R et al. Mucinous and nonmucinous appendiceal adenocarcinomas: different clinicopathological features but similar genetic alterations. Mod Pathol 2002; 15 : 599 – 605.
7. Rindi G, Klöppel G, Couvelard A et al. TNM staging of midgut and hindgut (neuro)endocrine tumors: a consensus proposal including a grading system. Virchows Arch 2007; 451 : 757 – 762.
8. Modlin IM, Kidd M, Latich I et al. Current status of gastrointestinal carcinoids. Gastroenterology 2005; 128 : 1717 – 1751.
9. Chiti A, Fanti S, Savelli G et al. Comparison of somatostatin receptor imaging, computed tomography and ultrasound in the clinical management of neuroendocrine gastroenteropancreatic tumors. Eur J Nucl Med 1998; 25 : 1396 – 1403.
10. Caplin ME, Buscombe JR, Hilson AJ et al. Carcinoid tumour. Lancet 1998; 352 : 799 – 805.
11. Butler JA, Houshiar A, Lin F et al. Goblet cell carcinoid of the appendix. Am J Surg 1994; 168 : 685 – 687.
12. Safioleas MC, Moulakakis KG, Kontzoglou K et al. Carcinoid tumors of the appendix. Prognostic factors and evaluation for indications for right hemicolectomy. Hepatogastroenterology 2005; 52 : 123 – 127.
13. Varisco B, McAlvin B, Dias J et al. Adenocarcinoid of the appendix: is right hemicolectomy necessary? A meta‑analysis of retrospective chart reviews. Am Surg 2004; 70 : 593 – 599.
14. Bucher P, Gervaz P, Ris F et al. Surgical treatment of appendiceal adenocarcinoid (goblet cell carcinoid). World J Surg 2005; 29 : 1436 – 1439.
15. Goede AC, Caplin ME, Winslet MC. Carcinoid tumour of the appendix. Br J Surg 2003; 90 : 1317 – 1322.
16. Plöckinger U, Couvelard A, Falconi M et al. Consensus Guidelines for the Management of Patients with Digestive Neuroendocrine Tumours: Well‑differentiated Tumour/ Carcinoma of the Appendix and Goblet Cell Carcinoma. Neuroendocrinology, ENETS Consensus Guidelines for the Diagnosis and Treatment of Neuroendocrine Gastrointestinal Tumors. Part – 2 Midgut and Hindgut Tumors. Neuroendocrinology 2008; 87 : 20 – 30.
17. Tang LH, Klimstra DS. Carcinoid Tumors of the Appendix. In: Modlin IM, Öberg K(eds). A Century of Advance in Neuroendocrine Tumor Biology and Treatment. Hannover: Felsenstein CCP 2008 : 112 – 123.
18. Moertel CG, Weiland LH, Nagorney DM et al. Carcinoid tumor of the appendix: treatment and prognosis. N Engl J Med 1987; 317 : 1699 – 1701.
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Internal Medicine

2009 Issue 11
-
All articles in this issue
- Dlouhodobé sledování pacientů s diabetes mellitus 1. typu léčených inzulinem glargin
- Idiopatické střevní záněty – familiární a sporadická forma
- Sociální, ekonomické a psychické vlivy jako rizikové faktory kardiovaskulárních chorob
- Porovnání struktury a funkce nazální a bronchiální sliznice u nemocných s CHOPN (pilotní projekt ciliární studie)
- Endoskopická diagnostika a léčba pankreatobiliárních onemocnění u pacientů po resekci žaludku podle Billrotha II
- Neuroendokrinní tumory appendixu
- Karcinoid appendixu s pohárkovými buňkami
- Současné ochlazovací metody pro indukci mírné hypotermie po srdeční zástavě
- Môže tromboelastografia ovplyvniť manažment pacientov v kardiológii a kardiochirurgii?
- High‑sensitivity metody stanovení srdečních troponinů 2009: klinický potenciál, současná praxe a přínos, perspektiva
- Výsledky studie RE- LY slibují účinnější, bezpečnější a jednodušší prevenci embolických komplikací u nemocných s nevalvulární fibrilací síní
- Vymizení nefrotického syndromu a zlepšení funkce ledvin u nemocné s light chain deposition disease po vysokodávkované chemoterapii s autologní transplantací kmenových krvetvorných buněk. Popis případu a přehled literatury
- Rekurentní nesetrvalá komorová tachykardie v těhotenství
- Opakovaná lokální trombolýza u poranění a trombózy axilární a podklíčkové žíly
- Výsledky léčby nemocných s esenciální trombocytemií a dalšími myeloproliferacemi provázenými trombocytemií – zpráva z registru pacientů léčených Thromboreductinem®
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue
- Neuroendokrinní tumory appendixu
- Rekurentní nesetrvalá komorová tachykardie v těhotenství
- Endoskopická diagnostika a léčba pankreatobiliárních onemocnění u pacientů po resekci žaludku podle Billrotha II
- Opakovaná lokální trombolýza u poranění a trombózy axilární a podklíčkové žíly
