Transplantace jater a perioperační změny renálních funkcí
Liver transplantation and peri - operative changes to renal function
The aim of the study:
Was to analyze in detail perioperative changes of renal function during orthotopic liver transplantation (OLT) and to identify risk factors, that were associated with the need of renal replacement therapy (RRT) during the first week after liver transplantation. Methods: Prospective study of 50 consecutive patients undergoing OLT was performed. Selected laboratory and clinical parameters were monitored prior to the procedure, after reperfusion, at the end of the procedure, and at 12 hours after the procedure. In the first post‑transplant week, necessity to use RRT in the presence of acute kidney injury was monitored and the analysis of risk factors for the need for RRT was performed. Patient survival, graft function, need for dialysis and selected laboratory parameters were assessed at one year post‑transplant. Results: During OLT, there was an increase in Scr and Surea, which persisted as late as 12 hours post‑transplant. There was a decrease in Ucr and Uurea and an increase in SNa and SK. During the procedure any increase in Scyst were observed, increase the values were recorded 12 hours after surgery. Sbili level decreased. There was a rise in the urinary levels of total protein, albumin and β2-microglobulin. Uprot/ Ucr increased significantly after reperfusion, with a peak after the procedure. At 12 hours after the procedure, there was a decrease in Uprot/ Ucr, but the values were still many times higher than those seen preoperatively. RRT was necessary in 14% cases. Risk factors for acute kidney injury requiring RRT included a higher APACHE score, higher BMI, higher preoperative Scr and Surea, hepatorenal syndrome pretransplant, blood loss and intraoperative hemodynamic instability, postoperative complications and dysfunction of the liver graft. One year after OLT, there was no difference in followed laboratory values between patients requiring postoperative RRT and others; no patient was treated with dialysis. Conclusion: OLT has a major impact on glomerular and tubular renal functions. Our data suggest that patients surviving acute renal injury treated with RRT in the early postoperative period have a high chance of restoring renal function. A sensitive marker of renal injury during OLT seems to be perioperative proteinuria.
Key words:
liver transplantation – acute kidney injury – renal replacement therapy
Authors:
E. Kieslichová 1
; O. Schück 2; I. Smrčková 3; J. Granátová 5; J. Skibová 1; D. Merta 1; P. Trunečka 4
Authors‘ workplace:
Klinika anesteziologie, resuscitace a intenzivní péče IKEM Praha, přednostka MU Dr. Eva Kieslichová
1; Klinika nefrologie IKEM Praha, přednosta prof. MU Dr. Ondřej Viklický, CSc.
2; Oddělení klinické biochemie IKEM Praha, přednosta prof. MU Dr. Antonín Jabor, CSc.
3; Transplantcentrum IKEM Praha, přednosta prim. MU Dr. Pavel Trunečka, CSc.
4; Oddělení klinické biochemie Fakultní Thomayerovy nemocnice Praha, prim. MU Dr. Zora Hamrlová
5
Published in:
Vnitř Lék 2009; 55(12): 1126-1134
Category:
Original Contributions
Overview
Cílem studie byla analýza perioperačních změn renálních funkcí při ortotopické transplantaci jater (OTJ) a identifikace rizikových faktorů pro potřebu náhrady funkce ledvin (RRT) v 1. týdnu po OTJ. Metodika: Do prospektivní studie bylo zařazeno 50 konsekutivních pacientů, kteří podstoupili OTJ. Před operací, po reperfuzi, na konci operace a 12 hod po ní byly sledovány vybrané laboratorní a klinické parametry. První týden po OTJ byla sledována četnost zavedení RRT pro akutní poškození ledvin a analyzovány rizikové faktory pro potřebu RRT. Jeden rok po OTJ bylo hodnoceno přežívání pacientů, funkce štěpu, potřeba dialyzační léčby a vybrané laboratorní parametry. Výsledky: Během OTJ došlo ke zvýšení Skr a Surea a vzestup hodnot byl patrný ještě 12 hod po operaci. Byl zaznamenán pokles Ukr a Uurea a nárůst SNa a SK. Hodnoty Scyst se během operace významně neměnily, zvýšení hodnot bylo zaznamenáno 12 hod po OTJ. Hodnoty Sbili poklesly. Došlo k vzestupu močové koncentrace celkové bílkoviny, albuminu a β2 - mikroglobulinu. Hodnoty Uprot Ukr se zvýšily po reperfuzi s maximem po výkonu. Po 12 hod po OTJ došlo k poklesu Uprot/ Ukr, ale na hodnoty vyšší než předoperační. RRT byla zavedena u 14 % pacientů. Rizikovými faktory pro akutní poškození ledvin s potřebou RRT byly: vyšší APACHE skóre, vyšší BMI, vyšší předoperační hodnoty Skr a Surea, hepatorenální syndrom v anamnéze, krevní ztráty a hemodynamická nestabilita během operace, pooperační komplikace a dysfunkce jaterního štěpu. Jeden rok po OTJ nebyl zaznamenán rozdíl ve sledovaných laboratorních hodnotách mezi pacienty, u nichž bylo časně po výkonu indikováno zavedení RRT a ostatními, žádný z pacientů nebyl rok po transplantaci léčen dialýzou. Závěr: OTJ významně ovlivňuje glomerulární a tubulární funkce ledvin. Na základě získaných dat je možno usuzovat, že pacienti, kteří přežijí akutní poškození ledvin s RRT v časném pooperačním období, mají vysokou pravděpodobnost obnovení funkce ledvin. Citlivým markerem poškození funkce ledvin během OTJ by mohlo být perioperační sledování proteinurie.
Klíčová slova:
transplantace jater – akutní poškození ledvin – náhrada funkce ledvin
Úvod
Ortotopická transplantace jater (OTJ) je v současné době standardní metodou terapie selhání jater u pacientů v konečném stadiu jaterního onemocnění. Při podrobnějších analýzách faktorů, které ovlivňují dlouhodobé přežívání a dobrou funkci transplantovaných jater bylo opakovaně zjištěno, že významnou roli z tohoto hlediska hraje úroveň funkce ledvin [1,2]. Řada onemocnění postihuje současně játra a ledviny, některá primární onemocnění jater jsou spojena se sekundárním postižením ledvin [3,4]. Onemocnění ledvin se mohou vyvinout v průběhu jaterního postižení různé etiologie, např. u virových hepatitid, deficience α1-antitrypsinu a autoimunitní hepatitidy. Podíl na renální dysfunkci mohou mít i některá metabolická a strukturální onemocnění jako tyrozinemie a polycystóza. Patofyziologickým důsledkem jaterní dysfunkce je intrarenální vazokonstrikce, která může vést k ischemickému selhání ledvin. Hepatorenální syndrom (HRS) je definován jako funkční selhání ledvin, které doprovází jaterní onemocnění s portální hypertenzí, organické poškození ledvin přitom není přítomno [5]. U pacientů před OTJ bývá HRS často přítomen, po úspěšné transplantaci odeznívá [6]. Závažnost postižení ledvin při pokročilých jaterních onemocněních je v některých případech důvodem k provedení současné transplantace jater a ledviny. Zásadní význam má odlišení pacientů s funkční renální poruchou od nemocných s pokročilým ireverzibilním renálním onemocněním. Častou komplikací po OTJ je rozvoj akutního poškození ledvin (AKI – Acute Kidney Injury) v časném pooperačním období a chronické onemocnění ledvin v dlouhodobém průběhu po OTJ [7]. AKI postihuje 12–64% pacientů po OTJ [8,9], přičemž řada studií ukazuje souvislost AKI se zvýšenou potransplantační mortalitou [10]. Údaje o incidenci AKI se liší v různých transplantačních centrech, což souvisí s problémem konsenzuální definice a s výběrem pacientů. Do budoucna by měla být v tomto směru přínosná kritéria RIFLE (Risk – Injury – Failure – Loss – End stage kidneydisease), zveřejněná v roce 2004 a založená na změnách sérové koncentrace kreatininu a výdeji moče, která umožňují standardizovanou klasifikaci renální dysfunkce [11]. V literatuře je výskyt renální dysfunkce po OTJ často zmiňován, pouze výjimečně je však věnována pozornost změnám renálních funkcí v perioperačním období, většina studií je retrospektivních.
Cílem prospektivní studie bylo sledování perioperačních změn renálních funkcí v souboru 50 pacientů, kterým byla provedena OTJ, identifikace rizikových faktorů pro potřebu náhrady funkce ledvin (RRT – Renal Replacement Therapy) časně po OTJ a hodnocení renálních funkcí po jednom roce po transplantaci.
Soubor a metodika
Do prospektivní studie bylo zařazeno 50 konsekutivních pacientů, kteří podstoupili v Institutu klinické a experimentální medicíny v Praze OTJ standardní technikou bez veno venózního bypassu. Do souboru nebyli zařazeni pacienti, kterým byla provedena kombinovaná transplantace jater a ledviny, pacienti, kteří zemřeli bezprostředně po OTJ a pacienti mladší než 15 let. Při reperfuzi byl všem pacientům podán bolus metylprednisolonu, imunosupresivní protokol po výkonu sestával z kombinace kalcineurinového inhibitoru (takrolimus nebo cyklosporin), kortikoidu a antimetabolitu (mykofenolát mofetil). Plazmatické koncentrace kalcineurinových inhibitorů byly v prvních pěti dnech po OTJ kontrolovány denně. Parametry zaznamenané před OTJ byly: pohlaví, věk, body mass index (BMI), doba na čekací listině (WL), indikace k transplantaci jater, pokročilost jaterního onemocnění dle Child-Pugh klasifikace a CTP skóre (Child-Turcotte-Pugh), hypertenze, diabetes mellitus a onemocnění ledvin v anamnéze. Peroperačně byla sledována délka anestezie, délka anhepatické fáze (AHF), čas studené ischemie (CIT – Cold Ischemic Time), velikost krevní ztráty, počet podaných jednotek čerstvě zmrazené plazmy (FFP), počet podaných erytrocytárních koncentrátů (EK) peroperační komplikace (hemodynamická nestabilita s podáváním inotropik) a objem odsáté ascitické tekutiny. Pooperačně sledované parametry zahrnovaly počet dnů na resuscitačním oddělení (LOS – Length Of Stay), délku umělé plicní ventilace (UPV) a APACHE skóre (Acute Physiology and Chronic Health Evaluation). V prvním týdnu po OTJ byly sledovány pooperační komplikace (krvácení s podáváním krevních derivátů, event. s nutností operační revize, oběhová nestabilita), funkce štěpu jater, zvýšená plazmatická koncentrace kalcineurinového inhibitoru a výskyt akutního poškození ledvin stupně F dle kritérií RIFLE se zavedením RRT. Byly porovnány vybrané klinické a laboratorní parametry ve skupině s RRT a bez RRT. Jeden rok po OTJ bylo hodnoceno přežívání pacientů, potřeba dialyzační léčby, funkce štěpu jater a vybrané laboratorní hodnoty (Skr, Surea, SNa, SK, Sbili, Ukreat a Uprot).
Popis sledování a biochemické metody
Biochemická vyšetření vzorků plazmy a moče byla provedena těsně před chirurgickým výkonem (čas T1), po reperfuzi štěpu (čas T2), bezprostředně po operaci (čas T3) a 12 hod po ukončení výkonu (čas T4). Moč byla sbírána katétrem zavedeným do močového měchýře. Ve vzorcích plazmy a moče byla stanovena koncentrace kreatininu enzymatickou metodou „Crea plus“ (Roche). Ve vzorcích plazmy byla stanovena koncentrace bilirubinu DPD metodou (s diazočinidlem za tvorby azobilirubinu). Koncentrace močoviny, sodíku a draslíku byla stanovena pomocí autoanalyzátoru (Hitachi 912). Močová koncentrace albuminu byla stanovena imunoturbimetricky (Roche, Modular). Koncentrace β2-mikroglobulinu byla stanovena na podkladě chemiluminiscence (kity BioVendor, Immulite 1000). Celková močová bílkovina byla vyšetřována turbidimetricky s benzethonium chloridem (Roche, Modular). Koncentrace cystatinu byla vyšetřena imunonefelometricky (N Latex Cystatin C, Behring).
Statistické hodnocení
Sledované veličiny byly vyjádřeny v průměrech ± směrodatná odchylka a v mediánech, s udáním minimální a maximální hodnoty. Porovnání změn vybraných laboratorních hodnot v čase a srovnání předoperačních laboratorních parametrů s parametry při jednoroční kontrole bylo provedeno pomocí Wilcoxonova párového testu. Porovnávání sledovaných kvantitativních a kvalitativních parametrů mezi skupinami s RRT a bez RRT bylo provedeno pomocí Mann Whitneyova testu a χ2 testu. Byl užit výpočet Pearsonova nebo Spearmanova korelačního koeficientu (r), výpočet AUC (Area Under Curve) – plochy pod křivkou. K porovnání diurézy mezi skupinou s RRT a bez RRT byl užit Mann Whitneyův test a analýza rozptylu (analysis of variance – ANOVA). Logistické krokové regrese bylo užito k hodnocení rizikových faktorů pro zavedení RRT. Za statisticky významnou byla považována hodnota p < 0,05.
Výsledky
Klinické charakteristiky
Soubor pacientů tvořilo 28 mužů (56%) a 22 žen (44%), v tab. 1 a grafu 1 jsou znázorněny předoperační parametry a indikace k OTJ, 2 pacienti v souboru podstupovali retransplantaci jater. Anamnestické údaje jsou zobrazeny v grafu 2, pozitivní nefrologická anamnéza byla zaznamenána u 17 pacientů, u 11 z nich byl diagnostikován HRS, v 10 případech se jednalo o HRS typu II a v jednom případě o HRS typu I při akutním selhání jater. Dále šlo o recidivující infekci močových cest (n = 1), pyelonefritidu (n = 1), nefrolitiázu (n = 2), cystu ledviny (n = 1), diabetickou nefropatii (n = 2), glomerulonefritidu při hepatitidě typu B (n = 1) a chronické onemocnění ledvin při kalcineurinové nefrotoxicitě u pacienta indikovaného k retransplantaci jater (n = 1). Podle pokročilosti jaterního onemocnění byli pacienti zařazeni dle klasifikace Child-Pugh, do skupiny A (n = 6), B (n = 17) a C (n = 27).
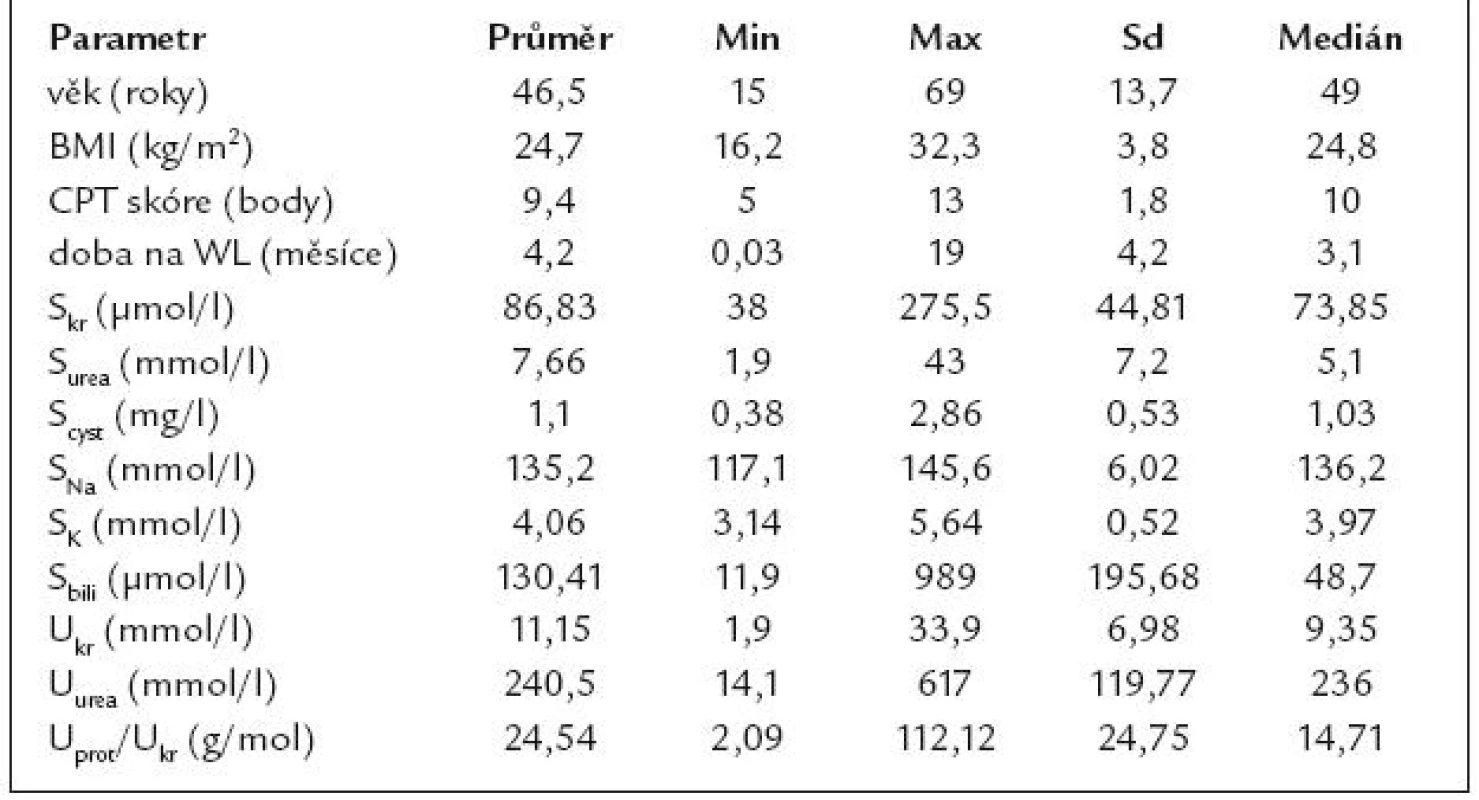


Intraoperačně a pooperačně sledované parametry jsou uvedeny v přehledu v tab. 2 a 3. Peroperační oběhová nestabilita s podáváním inotropik byla zaznamenána u 18 pacientů (36 %). U 43 pacientů (86%) došlo v 1. týdnu po OTJ k časnému rozvoji funkce štěpu, opožděný rozvoj funkce štěpu byl zaznamenán u 6 pacientů, a těžká dysfunkce štěpu u 1 pacienta. Takrolimus byl podáván 42 pacientům (84%), cyklosporin 8 pacientům (16%). Zvýšená plazmatická koncentrace kalcineurinového inhibitoru byla v 1. pooperačním týdnu zachycena u 23 pacientů (46%). Pooperační komplikace se vyskytly u 29 pacientů (58%). RRT byla zavedena u 7 pacientů (14%), jednalo se o metodu kontinuální s regionální antikoagulací. Indikací k zavedení RRT bylo těžké tekutinové přetížení při digonurii. RRT byla ukončena při reparaci renálních funkcí, napojení trvalo v průměru 4,8 dne (min. 2, max. 13, medián dva dny).
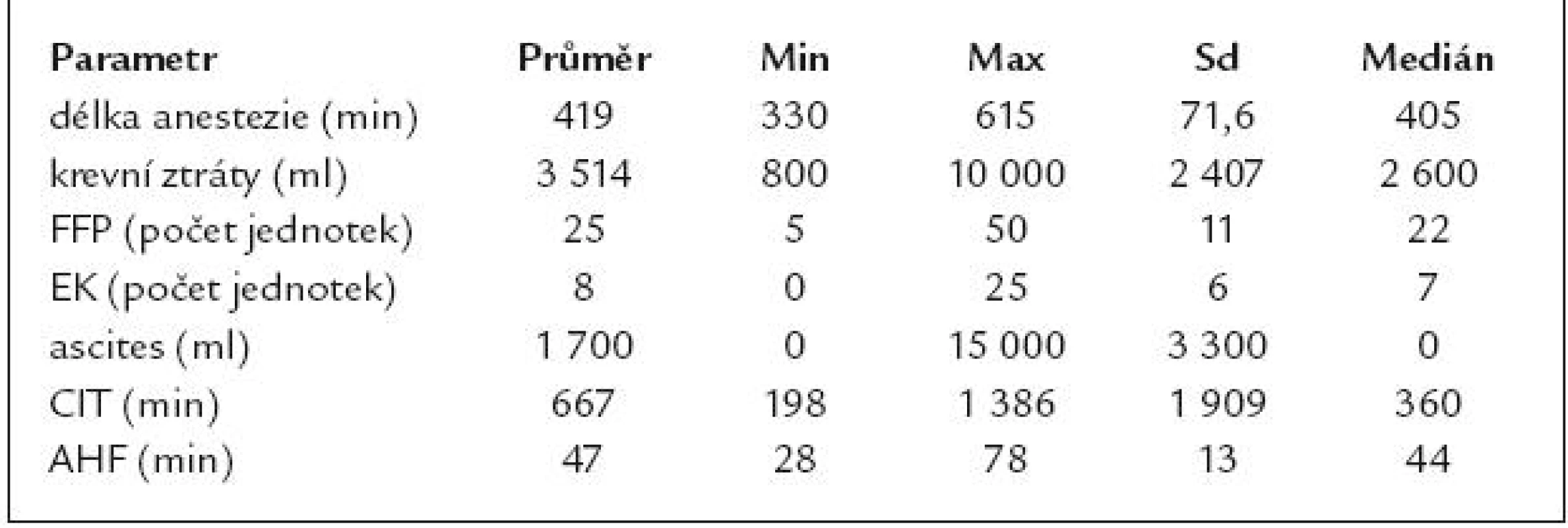

Klinické charakteristiky po jednom roce po OTJ
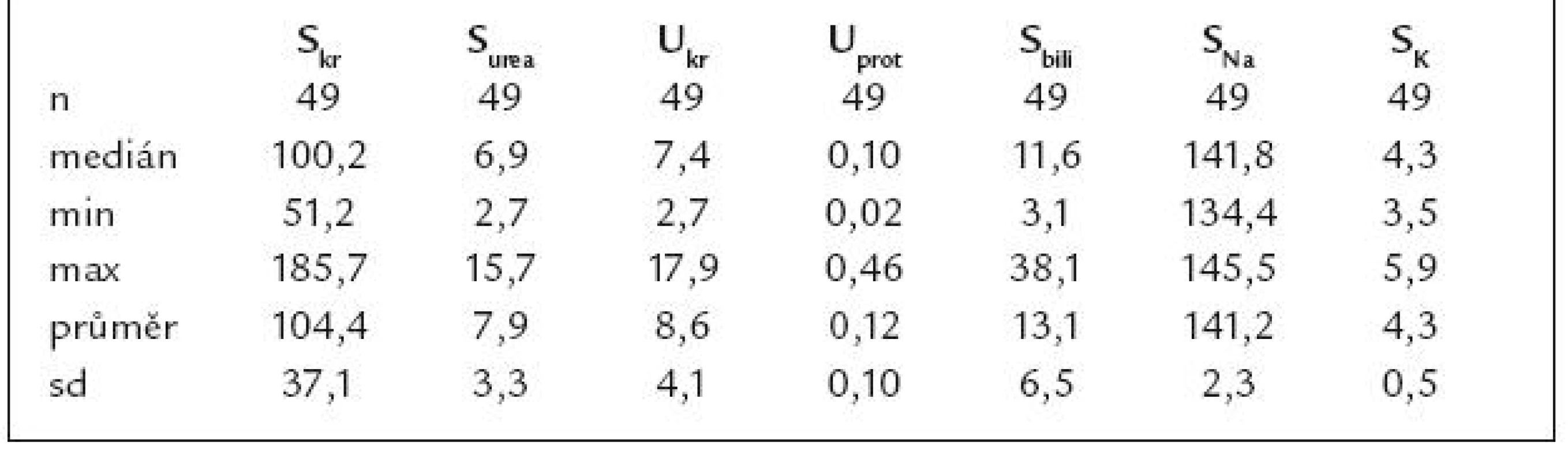
Roční kontrola byla provedena u 49 pa-cientů, 1 pacientka, transplantovanápro akutní selhání jater na podkladě Wilsonovy choroby, zemřela v důsledku multiorgánové dysfunkce. V průběhu jednoho roku po OTJ podstoupili 2 pacienti ze souboru retransplantaci jater, 1 pacient byl pro dysfunkci štěpu indikován k retransplantaci. Žádný pacient při roční kontrole nevyžadoval dialyzační léčbu.
Laboratorní parametry
Ve sledovaném souboru vzrostly během OTJ hodnoty Skr (graf 3) a Surea (graf 4) a vzestup bylo možno zaznamenat ještě 12 hod po operaci. V časovém intervalu T1–T4 došlo k nárůstu hodnot Skr a Surea (obojí p < 0,001). Hodnoty Scyst (graf 5) se v čase T1–T3 nezvyšovaly, nárůst Scyst byl zaznamenán po 12 hod po operaci. V intervalu T1–T4 vzrostly hodnoty SNa (p < 0,001) a SK (p < 0,01). Hodnoty SNa, posuzovány z hlediska průměru i mediánu, se před OTJ nejčastěji pohybovaly při dolní hranici normy. Předoperační hodnota SNa ≤ 135 mmol/l byla zjištěna u 24 pacientů, SNa ≤ 130 mmol/l u 8 pacientů. Předoperačně byl přítomen velký rozptyl hodnot Sbili, průměrné hodnoty Sbili v čase T1–T4 poklesly (p < 0,05). Během OTJ klesly hodnoty Ukr (graf 6) a Uurea (graf 7), po 12 hod po operaci se oba parametry zvýšily, ale na hodnoty nižší než předoperační. V intervalu T1–T4 byl zaznamenán pokles hodnot Ukr i Uurea (p < 0,001). Během OTJ došlo k vzestupu močové koncentrace celkové bílkoviny, albuminu a β2-mikroglobulinu. Hodnoty poměru Uprot/Ukr (graf 8) se zvýšily po reperfuzi a dosáhly maxima po operaci. Po 12 hod po výkonu došlo sice k poklesu Uprot/Ukr, nicméně na hodnoty mnohonásobně převyšující hodnoty předoperační, nárůst hodnot byl zaznamenán v intervalu T1–T4 (p < 0,001). Hodnoty poměru Ualb/Ukr (graf 9) se rovněž zvýšily, maximální nárůst byl zaznamenán po reperfuzi. Hodnoty Ub2m/Ukr (graf 10) se významně zvýšily s maximálním nárůstem na konci operace. Diuréza v čase T3 zvýšená oproti T2 (p < 0,001), v čase T4 poklesla (p < 0,001). Vybrané laboratorní parametry po jednom roce po OTJ jsou znázorněny v tab. 4. Neprokázala se souvislost mezi hodnotami laboratorních parametrů při jednoroční kontrole s hodnotami vstupních laboratorních parametrů.








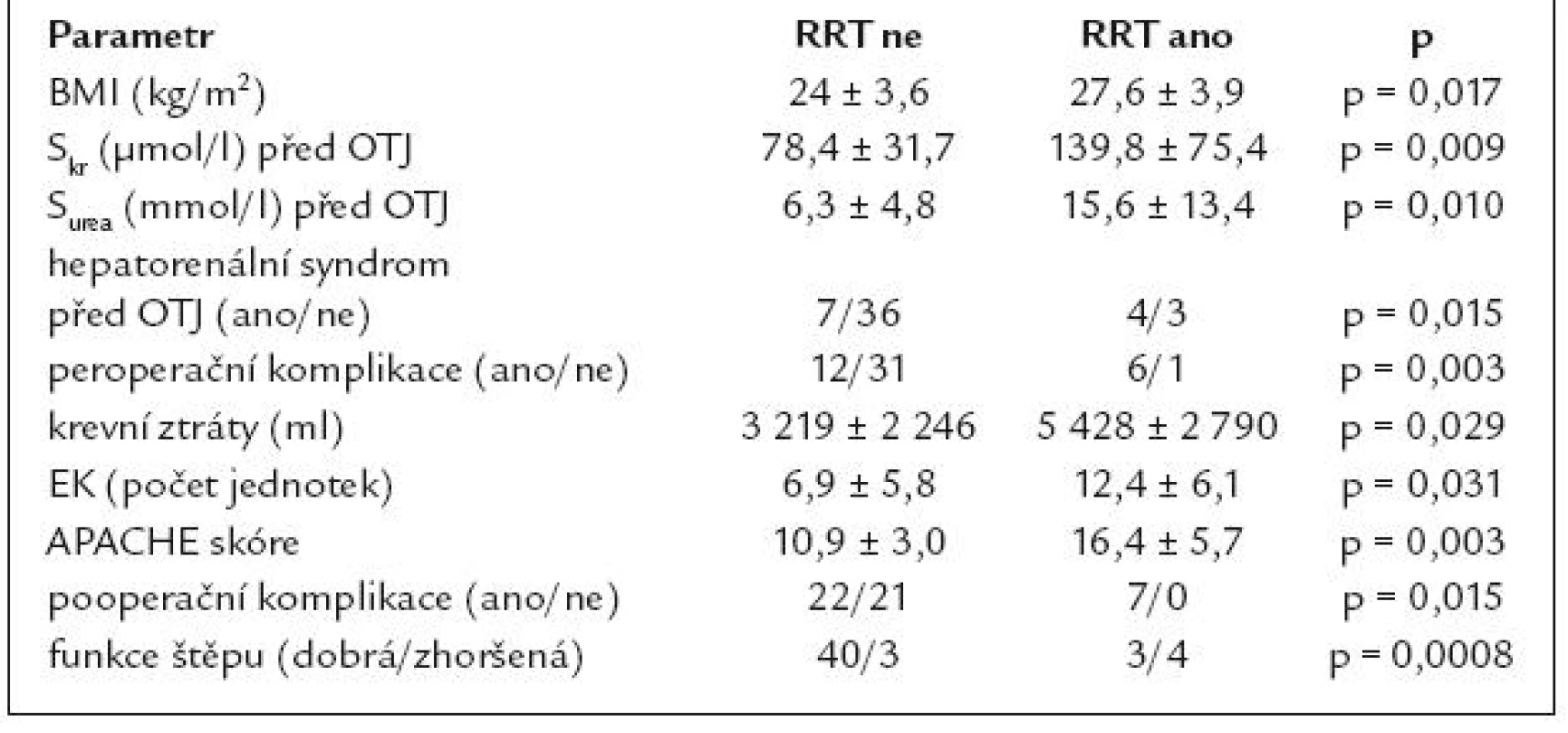
Statisticky významné rozdíly mezi skupinou pacientů s RRT a bez RRT byly nalezeny v následujících parametrech: APACHE skóre, BMI, předtransplantační hodnoty Skr a Surea, hepatorenální syndrom před OTJ, peroperační komplikace, krevní ztráty, počet podaných EK, pooperační komplikace a funkce jaterního štěpu (tab. 5). Ve skupině pacientů, u nichž bylo indikováno zavedení RRT, byla produkce moče nižší oproti skupině bez RRT, statisticky významný rozdíl v diuréze mezi oběma skupinami prokázán nebyl. Do modelu logistické krokové regrese jsme zařadili následující rizikové faktory pro potřebu RRT: APACHE skóre, komplikace na operačním sále, pooperační komplikace a funkce štěpu. Byl nalezen statisticky významný regresní koeficient pro velikost APACHE skóre (koeficient 0,647; OR 1,91; 95% CI 1,17–3,13). Při jednoroční kontrole nebyly mezi skupinami s RRT a bez RRT prokázány rozdíly v hodnotách vybraných laboratorních parametrů.
Nebyla prokázána souvislost mezi velikostí proteinurie v časovém intervalu T1–T4 (AUC) a vstupními parametry včetně hodnot laboratorních. Nebyla prokázána souvislost mezi velikostí proteinurie v časovém intervalu T1–T4 (AUC) a počtem peroperačně podaných jednotek FFP (r = –0,0703). Velikost proteinurie v časovém intervalu T1–T4 (AUC) nesouvisela s laboratorními parametry po jednom roce po OTJ.
Diskuze
Etiologie AKI po OTJ je multifaktoriální. Pacienti podstupující OTJ se v řadě aspektů podobají pacientům, u nichž je prováděn velký břišní výkon, v některých aspektech se však zásadně liší. Onemocnění jater má souvislost s poškozením renálních funkcí, rozvoj HRS významně ovlivňuje přežití pacientů v konečném stadiu onemocnění jater. Kromě faktorů působících na ledviny v průběhu intraabdominálního výkonu [12] se v průběhu OTJ uplatňuje omezení průtoku krve v ledvinách v průběhu anhepatické fáze operace. Po OTJ jsou navíc pacienti standardně vystaveni nefrotoxickému působení kalcineurinových inhibitorů. OTJ prováděná standardní technikou je spojena s významnými hemodynamickými změnami v ledvinách. Během anhepatické fáze při naložení svorky na dolní dutou žílu a portální žílu je omezen průtok krve ve splanchnické oblasti a zvýšen venózní tlak. Za účelem snížení hemodynamické nestability během anhepatické fáze byly zavedeny modifikace chirurgické techniky, a to veno venózní bypass (VVB), který odvádí krev z povodí portální a dolní duté žíly do horní duté žíly a technika piggy-back, při níž je provedena hepatektomie u příjemce s ponecháním dolní duté žíly. Porovnáním renálních funkcí pacientů, kterým byl při OTJ zaveden VVB a pacientů, u nichž tato technika použita nebyla, se zabývá práce, která hodnotí úroveň glomerulární filtrace, proteinurii a některé tubulární funkce v perioperačním období [13]. Tato studie zaznamenala menší pokles glomerulární filtrace během OTJ v anhepatické fázi u jedinců s VVB než u jedinců, u kterých bypass použit nebyl, avšak úroveň renální funkce 7. den po chirurgickém zákroku nejevila prokazatelný rozdíl. Předpokládaný protektivní účinek VVB na renální funkce nebyl prokázán a jeho systematické používání není v současné době doporučováno [13–15]. Podle některých autorů je užití techniky piggy-back spojeno s nižší incidencí pooperačního akutního selhání ledvin [16], tento nález však nebyl bez výhrad potvrzen [17]. Vzhledem ke značné variabilitě chirurgické techniky OTJ je hodnocení vlivu určitého typu užité techniky na pooperační renální dysfunkci nesnadné. Souvislost mezi typem chirurgické techniky a pooperační renální dysfunkcí nebyla jednoznačně prokázána [17,18].
Změny sérových koncentrací perioperačně sledovaných parametrů je třeba interpretovat velmi zdrženlivě, protože v průběhu OTJ dochází k velkým změnám vnitřního prostředí a výměně tekutin a iontů. Koncentrace Skr nemusí být citlivým indikátorem změn renálních funkcí, protože může být ovlivněna relativně velkým objemem podávaných tekutin, které neobsahují kreatinin. Přesto byl v našem sledování zaznamenán významný nárůst Skr a Surea. Enyzmatická metoda stanovení kreatininu byla zvolena pro vyloučení interference s bilirubinem při stanovení Skr kinetickou Jaffé reakcí s alkalickým pikrátem [19]. Změny Scyst v průběhu OTJ budou vyžadovat další analýzu. V souladu s řadou nálezů o metabolizmu sodíku u pacientů s jaterní cirhózou byl v předoperačním období patrný sklon k hyponatremii [4]. Nárůst SNa a SK nepochybně souvisí s podáváním infuzních roztoků a s metabolickými změnami po reperfuzi jaterního štěpu [20].
Domníváme se, že důležité nálezy byly získány při sledování změn renálního vylučování bílkovin během OTJ. Je zřejmé, že omezení cirkulace krve v ledvinách bylo spojeno se zvýšením proteinurie (Uprot/Ukr). Bližší analýza této proteinurie ukazuje, že na jejím rozvoji se podílí albumin a β2-mikroglobulin. Zvýšení poměru Ualb/Ukr by bylo možno vysvětlit poškozením permeability glomerulárních kapilár v souvislosti se zvýšením intraglomerulárního tlaku a hypoxií při omezené renální cirkulaci. S ohledem na současné znalosti renálního vylučování β2-mikroglobulinu lze soudit, že jeho zvýšené vylučování během OTJ je projevem postižení tubulárních buněk s následným snížením jeho tubulární resorpce. Tento nález je v souladu se zjištěním Grande et al [13]. Pokles Ukr a Uurea nasvědčuje tomu, že v průběhu OTJ dochází k významnému snížení tubulární resorpce vody. Na této změně se může uplatňovat expanze extracelulární tekutiny během OTJ. Neprokázali jsme statisticky významný rozdíl v diuréze mezi skupinou s RRT a bez RRT. Produkce moče je citlivým markerem renální dysfunkce, avšak senzitivita a specificita tohoto údaje klesá při snížené diuréze a při užití diuretik. Naproti tomu závažné poškození ledvin může být přítomno i při zachované diuréze [11].
Zavedení RRT v prvním týdnu po OTJ bylo indikováno u 14% pacientů. Neprokázali jsme souvislost potřeby RRT s vyšší hladinou kalcineurinových inhibitorů v prvním týdnu po OTJ přes jejich prokázanou nefrotoxicitu [21]. Jejich dávkování vycházelo z denní monitorace sérových koncentrací a bylo redukováno dle aktuálních hodnot a při známkách poruchy funkce ledvin. Rovněž nebyla prokázána souvislost RRT s délkou anhepatické fáze operace. Oproti některým literárním zdrojům jsme neprokázali souvislost mezi potřebou RRT a špatnou prognózou [26–28].
V literatuře je zavedení RRT udáváno u 8–19% pacientů [22–28]. Rozdíly v publikovaných údajích jsou dány absencí jednotných kritérií a kontraindikací k zavedení RRT a souvisí s nejednotným časovým intervalem, který je považován za časné potransplantační období. Práce týkající se této problematiky jsou většinou retrospektivní někdy vycházejí z databází propuštěných pacientů podle diagnóz [23], ve studiích jsou hodnoceny metody intermitentní i kontinuální. Srovnávání incidence RRT je proto problematické, stejně tak i rozbor rizikových faktorů. Jako rizikové faktory pro potřebu RRT jsou uváděny např. Skr, Surea, délka hospitalizace na JIP nad tři dny, MELD skóre nad 21 při potřebě RRT u 12% pacientů [24] nebo Skr, Surea a výdej moče při zavedení RRT u 11% pacientů [15]. V jiné studii bylo pozorováno akutní selhání ledvin po OTJ s potřebou RRT u 13% pacientů, byla prokázána souvislost s předoperační hodnotou Skr, počtem podaných EK a intraoperační diurézou, korelace s MELD skóre prokázána nebyla [25]. V retrospektivní studii z roku 2007 s využitím RIFLE kritérií pro akutní poškození ledvin je udáváno zavedení RRT u 19% pacientů, akutní selhání ledvin souviselo s předoperační hodnotou Skr, užitím inotropik a aminoglykosidů [26].
Provedená prospektivní studie poukazuje na dramatické změny vybraných parametrů v průběhu OTJ a hodnotí rizikové faktory závažné dysfunkce ledvin v časném potransplantačním období. Limitace studie spočívá v malém souboru pacientů, který je nehomogenní z hlediska vstupních parametrů, včetně úrovně předoperačního postižení ledvin.
Závěr
Na základě námi dosažených výsledků lze soudit, že transplantace jater významně ovlivňuje glomerulární a tubulární funkce ledvin. Rizikovými faktory pro potřebu RRT v časném potransplantačním období byly: vyšší APACHE skóre, vyšší předoperační hodnoty Skr a Surea, hepatorenální syndrom před OTJ, vyšší BMI, krevní ztráty a hemodynamická nestabilita během operace, pooperační komplikace a dysfunkce jaterního štěpu. Na základě skutečnosti, že mezi skupinou pacientů se zavedením RRT a skupinou bez RRT nebyl po jednom roce po OTJ zaznamenán statisticky významný rozdíl ve sledovaných laboratorních parametrech a že žádný z pacientů při jednoroční kontrole nevyžadoval terapii dialýzou, lze usuzovat, že pacienti, kteří přežijí AKI se zavedením RRT v časném potransplantačním období, mají šanci na obnovení funkce ledvin.
MUDr. Eva Kieslichová
www.ikem.cz
e mail: evki@ikem.cz
Sources
1. Pham PT, Pham PC, Wilkinson AH. The kidney in liver transplantation. Clin Liver Dis 2000; 4 : 576 – 590.
2. Neau - Cransac M, Morel D, Merville P et al. Renal failure after liver transplantation: outcome after calcineurin inhibitor withdrawal. Clin Transplant 2002; 16 : 368 – 373.
3. Davis CL, Gonwa TA, Wilkinson AH. Pathophysiology of renal disease associated with liver disorders: Implications for liver transplantation. Part I. Liver Transpl 2002; 8 : 91 – 109.
4. Gines P, Arroyo V, Rodes J. Renal fuction in cirrhosis: pathophysiology and clinical features. In: Zakim D, Boyer TD (eds). Hepatology: a textbook of liver disease. 4th ed. Philadelphia: Elsevier 2003 : 497 – 516.
5. Ginès P, Guevara M, Arroyo V. Hepatorenal syndrome. Lancet 2003; 362 : 1819 – 1827.
6. Marik PE, Wood K, Starzl T. The course of type 1 hepato - renal syndrome post liver transplantation. Nephrol Dial Transpl 2006; 21 : 478 – 482.
7. Yalavarthy R, Edelstein CL, Teitelbaum I. Acute renal failure and chronic kidney disease following liver transplantation. Hemodial Int 2007; 11 (Suppl 3): 7 – 12.
8. Chuang FR, Lin CC, Wang PH et al. Acute renal failure after cadaveric related liver transplantation. Transplant Proc 2004; 36 : 2328 – 2330.
9. Junge G, Schewior LV, Kohler S et al. Acute renal failure after liver transplantation: incidence, etiology, therapy, and outcome. Transplant Proc 2006; 38 : 723 – 724.
10. Gainza FJ, Valdivieso A, Quintanilla N et al. Evaluation of acute renal failure in the liver transplantation period. Incidence and impact. Transplant Proc 2002; 34 : 250 – 251.
11. Bellomo R, Ronco C, Kellum JA et al. Acute Dialysis Quality Initiative Workgroup. Acute renal failure – definition, outcome, measures, animal models, fluid therapy and information technology needs: the second international consensus conference of the Acute Dialysis Quality Initiative Group. Crit Care 2004; 8: R204 – R212.
12. Reddy VG. Prevention of postoperative acute renal failure. J Postgrad Med 2002; 48 : 64 – 70.
13. Grande L, Rimola A, Cugat E et al. Effect of venovenous bypass on perioperative renal function in liver transplantation: result of a randomized, controlled trial. Hepatology 1996; 23 : 1418 – 1428.
14. Reddy K, Mallet S, Peachey T. Venovenous bypass in orthotopic liver transplantation: time for rethink? Liver Transplant 2005; 11 : 741 – 749.
15. Contreras G, Garces G, Quartin AA et al. An epidemiologic study of early renal replacement therapy after orthotopic liver transplantation. J Am Soc Nephrol 2002; 13 : 228 – 233.
16. Cabezuelo JB, Ramirez P, Acosta F et al. Does the surgical technique used (standard vs Piggy Back) have an effect on development of early acute renal failure after orthotopic liver transplantation? Transplant Proc 2003; 35 : 1913 – 1914.
17. Cabezuelo JB, Ramírez P, Ríos A et al. Risk factors of acute renal failure after liver transplantation. Kidney Int 2006; 69 : 1073 – 1080.
18. Lima EQ, Zanetta DM, Castro I et al. Risk factors for development of acute renal failure after liver transplantation. Ren Fail 2003; 25 : 553 – 560.
19. Mazzachi BC, Peake MJ, Ehrhardt V. Reference range and method comparison studies for enzymatic and Jaffé creatinine assays in plasma and serum and early morning urine. Clin Lab 2000; 46 : 53 – 55.
20. Schroeder RA, Collins BH, Tuttle - Newhall E et al. Intraoperative fluid management during orthotopic liver transplantation. J Cardiothoracic Vasc Anesth 2004; 18 : 438 – 441.
21. Nankivell BJ, Borrows RJ, Fung CL et al. Calcineurin inhibitor nephrotoxicity: Longitudinal assessment by protocol histology. Transplantation 2004; 78 : 557 – 565.
22. Gonwa TA, Mai ML, Melton LB et al. Renal replacement therapy and orthotopic liver transplantation: the role of continuous veno‑venous hemodialysis. Transplantation 2001; 71 : 1424 – 1428.
23. Wyatt CM, Arons RR. The burden of acute renal failure in nonrenal solid organ transplantation. Transplantation 2004; 78 : 1351 – 1355.
24. Sanchez EQ, Gonwa TA, Levy MF et al. Preoperative and perioperative predictors of the need for renal replacement therapy after orthotopic liver transplantation. Transplantation 2004; 78 : 1048 – 1054.
25. Faenza S, Bernardi E, Cimatti M et al. Acute renal failure after liver transplantation in MELD era. Transplant Proc 2007; 39 : 1945 – 1946.
26. O’Riordan A, Wong W, McQuillan R et al. Acute renal disease, as defined by the RIFLE criteria, post – liver transplantation. Am J Transplant 2007; 7 : 168 – 176.
27. Pawarode A, Fine DM, Thuluvath PJ. Independent risk factors and natural history of renal dysfunction in liver transplant recipients. Liver Transpl 2003; 9 : 741 – 747.
28. Faenza S, Santoro A, Mancini E et al. Acute renal failure requiring renal replacement therapy after orthotopic liver transplantation. Transplant Proc 2006; 38 : 1141 – 1142.
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Internal Medicine

2009 Issue 12
-
All articles in this issue
- Program řízené ambulantní rehabilitace u pacientů po operaci chlopenních srdečních vad
- Transplantace jater a perioperační změny renálních funkcí
- Onemocnění pandemickým chřipkovým virem H1N1 2009 vyžadující intenzivní péči: soubor nemocných z jednoho centra v Austrálii
- Komplexita interakcií nádorového procesu
- Komplexita interakcií nádorového procesu
- Preeklampsie z hlediska mezioborové spolupráce
- Rozdiely medzi pohlaviami vo farmakoterapii chronického srdcového zlyhávania
- Diabetes insipidus, následovaný po 4 letech dysartrií a lehkou pravostrannou hemiparézou – první klinické příznaky Erdheimovy‑ Chesterovy nemoci. Popis a zobrazení případu s přehledem informací o této nemoci
- Obojstranná flebotrombóza dolných končatín zapríčinená vrodenou malformáciou dolnej dutej žily
- Polymorfizmy v genech pro nukleární receptory a riziko restenózy a klinických příhod po koronárním stentingu
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue
- Preeklampsie z hlediska mezioborové spolupráce
- Program řízené ambulantní rehabilitace u pacientů po operaci chlopenních srdečních vad
- Komplexita interakcií nádorového procesu
- Obojstranná flebotrombóza dolných končatín zapríčinená vrodenou malformáciou dolnej dutej žily
