Význam struktury inzulinových přípravků pro klinickou praxi
Importance of the Structure of Insulin Preparations for Clinical Practice
Since the first application of insulin in the 1920s, many clinically necessary changes in the insulin action, effect reduction and extension, hypoglycemia risk reduction and positive weight development have been achieved by way of technological changes of insulin preparations. Such results have been achieved, in particular, by replacing insulin with insulin analogues. The impact on diabetes compensation and on the prevention of complications is not achieved by individual preparations but, in particular, by the quality of treatment and cooperation from the patient. The doctor should know, in particular, the clinical impacts of changes in the structure of insulin preparations as they are indicated in their respective SPCs. The necessary effect extension is achieved by similar technological changes, also with so-called incretin mimetics.
Key words:
insulin – protamine insulin – lente insulins – insulin analogues – incretin mimetics – hypoglycemia – weight – diabetes compensation
Authors:
Š. Svačina
Authors‘ workplace:
III. interní klinika 1. lékařské fakulty UK a VFN Praha, přednosta prof. MUDr. Štěpán Svačina, DrSc., MBA
Published in:
Vnitř Lék 2009; 55(4): 409-411
Category:
Overview
Od prvního využití inzulinu ve 20. letech minulého století bylo technologickými změnami inzulinových přípravků dosaženo mnoha klinicky potřebných změn v působení inzulinu, zkrácení účinku, prodloužení účinku, snížení rizika hypoglykemií, příznivého vývoje hmotnosti. Tyto efekty byly dosaženy zejména záměnou inzulinu za inzulinová analoga. Vliv na kompenzaci diabetu a prevenci komplikací není dosahován jednotlivými přípravky, ale především kvalitou vedení léčby a spoluprací pacienta. Lékař by měl znát především klinické dopady změn struktury inzulinových přípravků tak, jak jsou uvedeny v jejich SPC. Potřebné prodloužení účinku je podobnými technologickými změnami dosahováno i u tzv. inkretinových mimetik.
Klíčová slova:
inzulin – protamin inzulin – lente inzuliny – inzulinová analoga – inkretinová mimetika – hypoglykemie – hmotnost – kompenzace diabetu
Úvod
Od prvního léčebného využití inzulinu v léčebné praxi v roce 1921 uběhlo již téměř 90 let. Od té doby proběhla dlouhá evoluce výrobních technologií od využití zvířecích inzulinů až po inzulinová analoga. Tuto dlouhou cestu (tab. 1) lze na jedné straně charakterizovat jako snahu o úpravy molekuly inzulinu a na druhé straně jako snahu o změnu vazby molekuly v přípravku tak, aby mohlo dojít ke změně disociace inzulinu či inzulinového analoga, a tím ke změně jeho uvolnění a následně farmakodynamiky. Při úpravě molekuly šlo nejprve o vývoj co nejčistšího, tedy méně imunogenního (humánního) inzulinu a následně pak rovněž o změnu farmakodynamiky, jak tomu bylo při vývoji nových molekul, tedy inzulinových analog.
Disociace inzulinu po subkutánní aplikaci
Molekuly inzulinu jsou asociovány po subkutánní aplikaci krátkodobě účinkujícího (regular) inzulinu v hexamerech (podobně jako v pankreatu) a postupně se za ztráty zinku mění na monomery, které pronikají do oběhu. Molární koncentrace inzulinu se tak v podkoží mění o 5 řádů (obr. 1) [1]. Rychle působící inzulinová analoga (lispro, aspart a glulisin) mají v řetězci inzulinu zaměněny některé aminokyseliny, resp. sled aminokyselin. To vede ke změněné disociační křivce inzulinu a rychlejšímu uvolnění a působení. U inhalačního inzulinu bylo změněné rychlosti účinku dosaženo nikoli změnou disociace, ale místem podání. Nejrychlejší účinek mají subkutánně podaná krátkodobá inzulinová analoga, pak následuje inhalační inzulin a ještě pomalejší je účinek subkutánně podaného regular humánního inzulinu. Klinické využití inhalačního inzulinu Exubera bylo na podzim roku 2007 zastaveno, běží však další studie s inhalačním inzulinem i studie s bukálně podávaným roztokem i experimenty s tabletovým a transdermálním inzulinem [3].
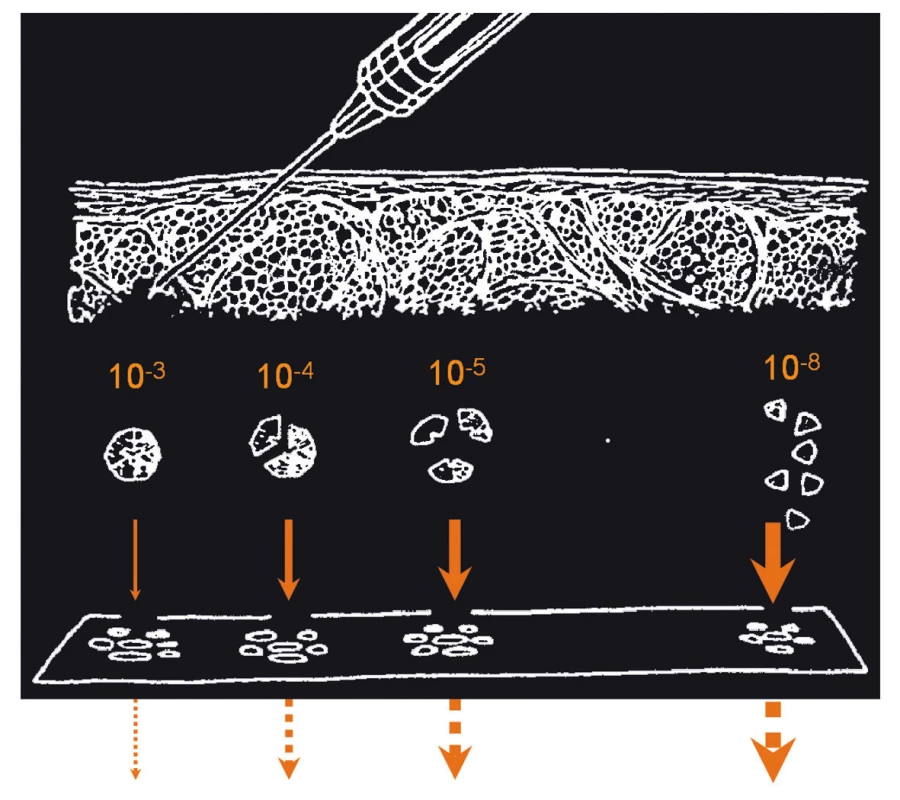
Z klinického hlediska existují rozdíly v podání krátkodobého humánního inzulinu a krátkodobých analog. Krátkodobá analoga je možno podávat až těsně před jídlem či během jídla. Krátký efekt na jedné straně nenutí diabetika k časnému podání příštího jídla, na druhé straně však po 4 hod nemusí být jaterní suprese produkce glukózy dostatečná a může dojít k hyperglykemii [1]. Efekt krátkodobých analog a inzulinů, např. při využití v inzulinové pumpě, je srovnatelný jak v kompenzaci, tak ve výskytu hypoglykemií [4]. Hlavní výhoda je tedy v možnosti snadnějšího časování injekce a jídla – tedy ve změně kvality života. U diabetiků 2. typu je u krátkodobých analog popsán významnější vliv na postprandiální glykemii [5]. Je to logické, neboť u diabetiků 2. typu trpí právě rychlá postprandiální sekrece inzulinu.
Dlouhodobě působící inzuliny
Prodloužení efektu inzulinu bylo významným úspěchem farmakoterapie diabetu v první polovině minulého století. Hlavním cílem bylo tehdy zjednodušení života diabetiků s možností aplikovat inzulin jen 1–2krát denně. Dnes víme, že optimální léčbou je tzv. intenzifikovaná terapie. Dlouhodobě působící inzuliny si podržely svůj význam a jsou využívány jako bazální inzuliny v intenzifikované léčbě či jako součást tzv. premixovaných inzulinů.
V prodloužení účinku inzulinu jsou užívány dva principy [1]. Přidání buď protaminu, nebo zinku vede k změně precipitace inzulinu a inzulin ze vzniklé amorfní substance se pomaleji vstřebává. Solubilita těchto přípravků klesne výrazně právě při fyziologickém tkáňovém pH. Při tomto neutrálním pH převažují na molekule inzulinu negativní náboje a snadno se asociuje s bazickým proteinem protaminem. Název NPH pochází z upřesněné technologie výroby v Hegedronových laboratořích (Neutral Protamin Hagedorn). Synonymem tohoto inzulinu je i název isophane. Doba účinku těchto inzulinů je 12–15 hod.
Potřebného 24hodinového působení bylo dosaženo jiným principem. Tzv. lente inzuliny obsahují více než 10krát více iontů zinku než inzuliny regular či NPH. Působení může být 12–36 hod a je dále ještě ovlivňováno skutečností, zda inzulin je amorfní (semílejte – kratší působení) nebo krystalický (ultralente – působení až 36 hod). Podle konkrétní výrobní technologie se délka působení jednotlivých inzulinů dále může lišit a vzájemně se ovlivňují i složky tzv. premixovaných inzulinů.
Dlouhodobě působící inzulinová analoga
Prodloužení účinku inzulinových analog vzniká na jedné straně podobnými principy jako u klasických inzulinů, ale využity jsou i principy nové.
U inzulinu glargine je využita klasická technologie. Přítomen je mírný nadbytek iontů zinku a zároveň změny v aminokyselinovém řetězci mají za následek dobrou rozpustnost při kyselém pH 4 v ampulce a precipitaci při fyziologickém pH v podkoží. Tento princip vyvolává velmi pomalé uvolňování a vlastnost potřebnou pro bazální inzulin – trvale stejnou hladinu prakticky bez peaku.
U inzulinu detemir jsou využity dva jiné principy. Na jedné straně je to acylace řetězce inzulinu mastnou kyselinou o 14 uhlících – kyselinou myristovou. Přítomnost lipidové složky zpomaluje adsorpci inzulinu. Lipidové části hexamerů detemiru adherují k sobě a vytvářejí se dihexamery, a dokonce řetězce hexamerů. Druhým principem je vazba detemiru na albumin. Dochází k ní jak lokálně v tkáni, tak v oběhu a týká se monomerů, dimerů i hexamerů.
U detemiru je známá závislost délky působení na dávce [6]. Při malé dávce je působení kratší. Klinicky nejsou mezi oběma dlouhodobě působícími inzulinovými analogy rozdíly. Oba léky výrazně snižují riziko hypoglykemií a zvyšují kvalitu života. Údaje o vlivu na zlepšení kompenzace oproti klasickým inzulinům jsou podle přehledných článků nepřesvědčivé [7]. Informace o pozitivním vlivu na hmotnost (mírný vzestup hmotnosti u diabetu 2. typu a pokles u diabetu 1. typu) byla u detemiru prokázána již v prvních studiích a je uvedena v SPC. U glarginu prokázal příznivý vliv na hmotnost až postmarketingové sledování [8]. U nedávno provedené head to head study [9] byl po 52 týdnech u diabetiků 2. typu signifikantně vyšší hmotnostní vzestup po glarginu (3,8 kg) než po detemiru (2,8 kg).
Krátkodobá i dlouhodobá analoga inzulinu mají dnes v léčbě diabetu 1. i 2. typu významné místo.
Perspektivy změny struktury inzulinových přípravků
Další technologické úpravy molekul inzulinu i inzulinových analog povedou v budoucnu jistě k možnosti léčit i jinak než subkutánními injekcemi, např. orálně nebo transdermálně [3].
Principy použité při výzkumu a pozdější výrobě inzulinových přípravků se do značné míry uplatňují i u inkretinových mimetik. Liraglutid působí protrahovaně s možností aplikace injekce jen 1krát denně, což je výhodou oproti prvnímu léku této skupiny exenatidu, díky podobnému lipidovému řetězci, jaký je použit u molekuly detemiru. U nového inkretinového analoga albiglutidu [10] se bude po zavedení do praxe uplatňovat v prodloužení účinku podobná vazba na albumin jako u detemiru.
V tzv. exenatidu LAR, který bude aplikován místo 2krát denně jen 1krát týdně [11], je použita technologie LAR (long‑acting repeatable), kterou neznáme z inzulinoterapie, je však více než 10 let užívána v docílení protrahovaného účinku u jiných hormonů, např. u octreotidu [12].
Již dnes je známo, že jednotlivé typy inzulinů a inzulinových analog se významně liší v poměru hypoglykemizujícího a mitogenního efektu inzulinu [13]. Mitogenní efekt je potenciálně nebezpečný s pronádorovými efekty. Klinicky význam tohoto jevu nebyl nikdy prokázán ve vztahu k žádnému typu inzulinu či inzulinového analoga. Tyto efekty je však třeba v budoucnu dále sledovat u každého nově vyvíjeného přípravku.
Závěr
Úprava podávaného inzulinu i inzulinových analog se dnes týká na jedné straně strukturálních změn v molekule, na druhé straně pak technologických změn složení roztoku v jednotlivých léčivých přípravcích. Dopad těchto změn na injekční léčbu je značný a vede k rozdílné délce působení, rozdílnému riziku hypoglykemií i k rozdílné kvalitě života pacientů.
Změny struktury inzulinových přípravků mohou znamenat:
- změny v délce působení přípravku
- snížení rizika hypoglykemií
- vliv na hmotnost
- vliv na kvalitu života
- změny postprandiální glykemie
K pochopení klinického významu těchto technologických změn nemusí lékař detaily znát. Měl by však dobře znát SPC jednotlivých přípravků, kde jsou klinicky významné efekty dobře popsány, a je tak jednoznačně na podkladě studií prokázáno, jakou změnu u konkrétního pacienta lze po převedení na jiný přípravek očekávat.
Vliv na kompenzaci diabetu a prevenci komplikací není dnes dosahován jednotlivými přípravky, ale především kvalitou vedení léčby a spoluprací pacienta.
Doručeno do redakce: 5. 1. 2009
prof. MUDr. Štěpán Svačina, DrSc., MBA
www.vfn.cz
e‑mail: svacinas@lf1.cuni.cz
Sources
1. Pickup JC, Williams G. Textbook of diabetes. Oxford: Blackwell Science 1991.
2. SPC přípravku Exubera. Pfizer 2006.
3. Svačina Š. Nové formy inzulinoterapie. Trendy v diabetologii 10. Praha: Galén 2005 : 211–220.
4. Bode B, Weinstein R, Bell D et al. Comparison of insulin aspart with buffered regular insulin and insulin lispro in continuous subcutaneous insulin infusion: a randomized study in type 1 diabetes. Diabetes Care 2002; 25 : 439–444.
5. Giugliano D, Ceriello A, Razzoli E et al. Defining the role of insulin lispro in the management of postprandial hyperglycaemia in patients with type 2 diabetes mellitus. Clin Drug Investig 2008; 28 : 199–210.
6. Plank J, Bodenlenz M, Sinner F et al. A double-blind, randomized, dose‑response study investigating the pharmacodynamic and pharmacokinetic properties of the long‑acting insulin analog detemir. Diabetes Care 2005; 28 : 1107–1112.
7. Hartman I. Insulin analogs: impact on treatment success, satisfaction, quality of life, and adherence. Clin Med Res 2008; 6 : 54–67.
8. Schreiber SA, Haak T. Insulin glargine benefits patients with type 2 diabetes inadequately controlled on oral antidiabetic treatment: an observational study of everyday practice in 12,216 patients. Diabetes Obes Metab 2007; 9 : 31–38.
9. Hollander P, Cooper J, Bregnhøj J et al. A 52‑week, multinational, open-label, parallel-group, noninferiority, treat-to-target trial comparing insulin detemir with insulin glargine in a basal-bolus regimen with mealtime insulin aspart in patients with type 2 diabetes. Clin Ther 2008; 30 : 1976–1987.
10. Green BD, Flatt PR. Incretin hormone mimetics and analogues in diabetes therapeutics. Best Pract Clin Endocrinol Metab 2007; 21 : 497–516.
11. Kim D, MacConell L, Zhuang D et al. Effects of once‑weekly dosing of a long‑acting release formulation of exenatide on glucose control and body weight in subjects with type 2 diabetes. Diabetes Care 2007; 30 : 1487–1493.
12. Gillis JC, Noble S, Goa KL. Octreotide long‑acting release (LAR). A review of its pharmacological properties and therapeutic use in the management of acromegaly. Drugs 1997; 53 : 681–699.
13. Kurtzhals P, Schäffer L, Sørensen A et al. Correlations of receptor binding and metabolic and mitogenic potencies of insulin analogs designed for clinical use. Diabetes 2000; 49 : 999–1005.
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Internal Medicine

2009 Issue 4
-
All articles in this issue
- Farmakoekonomika léčby diabetu – trendy u nás
- Potenciální nová antidiabetika pro příští desetiletí
- Význam struktury inzulinových přípravků pro klinickou praxi
- Funkční potraviny a diabetes – důkazy a mýty
- Rostlinné látky ovlivňující metabolizmus diabetu 2. typu
- Nová a starší farmaka ovlivňující inzulinovou sekreci
- Inzulin senzitizující léky
- Náklady na diabetes 2. typu v podmínkách zdravotního systému České republiky
- Klinické hodnocení léčiv a jeho význam pro diabetologii
- Klinické studie, které ovlivnily léčbu diabetu
- Enterální a parenterální výživa u diabetu
- Hypolipidemika a diabetes mellitus
- Cílové hodnoty krevního tlaku u pacientů s diabetes mellitus
- Léky ovlivňující kostní metabolizmus diabetiků
- Substituce hypotyreózy a nadledvinové nedostatečnosti u diabetiků
- Možnosti hormonální antikoncepce a substituce u diabetiček
- Farmaceutická péče u pacienta s diabetes mellitus a vztah ke klinické farmacii
- Zlepšení kontroly krevního tlaku jako výsledek spolupráce lékaře a farmaceuta
- Lékové interakce vybraných léků užívaných pacienty s diabetes mellitus
- Liekové interakcie u diabetikov na oddelení klinickej farmakológie
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue
- Cílové hodnoty krevního tlaku u pacientů s diabetes mellitus
- Lékové interakce vybraných léků užívaných pacienty s diabetes mellitus
- Možnosti hormonální antikoncepce a substituce u diabetiček
- Inzulin senzitizující léky

