Současné možnosti léčby osteoporózy
Current options for the treatment of osteoporosis
The primary aim of osteoporosis treatment is prevention of osteoporotic fractures. The main factors in the development of these fractures are mechanic resistance of the bone and the bone quality. The importance of risk factor identification increases and it is important to consider the structural analysis of the hip-bone when evaluating and deciding whether to prescribe antiresorptive or osteoanabolic drugs or whether to just modify calcium and vitamin D intake. Various options are currently available for the pharmacological treatment of osteoporosis: calcium and vitamin D supplementation together with aminobisphosphonates, or osteoanabolic treatment with parathormone derivatives; monoclonal antibody to RANKL denosumab will also soon become available.
Key words:
osteoporosis – BMD – risk of fractures – FRAX – DXA – HAS software – calcium – vitamin D – alendronate – risedronate – ibandronate – zoledronate – calcitonin – strontium ranelate – parathormone derivatives – denosumab
Authors:
doc. MUDr. Václav Vyskočil, Ph.D.
Authors‘ workplace:
Osteocentrum FN Plzeň, II. interní kliniky LF UK a FN Plzeň, přednosta prof. MUDr. Jan Filipovský, CSc., a Traumacentra Kliniky ortopedie a traumatologie pohybového ústrojí, přednosta prof. MUDr. Karel Koudela, CSc.
Published in:
Vnitř Lék 2010; 56(7): 749-758
Category:
80th Birthday - Jaroslava Blahoše, MD, DrSc.
Overview
Zásadním cílem léčby osteoporózy je zábrana vzniku osteoporotických zlomenin. Jedním z hlavních faktorů při vzniku těchto zlomenin je mechanická odolnost a kvalita kosti. Při hodnocení a rozhodování, zda léčit antiresorpčními či osteoanabolickými léky, nebo pouze upravit příjem vápníku a vitaminu D, se zvyšuje význam stanovení rizikových faktorů a z hlediska mechanické odolnosti přihlédnutí ke strukturální analýze kyčle. Farmakologická léčba osteoporózy v současnosti zahrnuje několik možností: suplementace vápníku a vitaminu D spolu s aminobisfosfonáty nebo osteoanabolickou léčbu deriváty parathormonu, nově bude k dispozici protilátka proti RANKL denosumabem.
Klíčová slova:
osteoporóza – BMD – riziko zlomenin – FRAX – DXA – HSA software – vápník – vitamin D – alendronát – risedronát – ibandronát – zoledronát – kalcitonin – stroncium ranelát – deriváty parathormonu – denosumab
Osteoporóza je systémové metabolické onemocnění skeletu, charakterizované poruchou mechanické odolnosti kosti doprovázenou zvýšeným rizikem zlomenin. Mechanická odolnost kosti je podmíněna množstvím a kvalitou kostního minerálu, organické matrix, mikroarchitekturou a makroarchitekturou kosti a dalšími aspekty kvality kosti.
Navzdory značnému množství pozornosti, které bylo v minulosti i přítomnosti věnováno měření hustoty kostního minerálu (BMD – Bone Mineral Density) a rovněž biochemickým ukazatelům kostního obratu, které se staly zástupnými markery pro posuzování a monitorování léčby osteoporózy, není cílem léčby zvýšení BMD, ale zábrana vzniku osteoporotických zlomenin. Vznik osteoporotické zlomeniny je mimo řadu dalších faktorů závislý na mechanické odolnosti kosti. Zachování mechanické odolnosti kosti předpokládá udržet množství i kvalitu kostní hmoty. Obojí se se zvyšujícím věkem snižuje. Rozhodující pro časový horizont pozdní manifestace osteoporózy je především dosažení maximálního množství kostní hmoty, kterou má každý jedinec determinován geneticky a jíž dosáhne během dospívání.
Kromě genetických faktorů, které zatím neumíme ovlivnit, lze k dosažení optimální kostní hmoty přispět dostatečným pohybem, optimálním hormonálním stavem jedince a adekvátní výživou, čímž myslíme nejen minerály, vitamin D, ale i dostatečné množství bílkovin. Významným způsobem může negativně ovlivnit dosažení vrcholu kostní hmoty snížení pohybu a zároveň medikamentózní léčba působící na snížení formace, event. resorpce kostní tkáně. Typickým příkladem jsou astmatici či pacienti s CHOPN, u kterých chronické onemocnění limituje pohyb a sportovní aktivitu a glukokortikoidy, ať již inhalační či perorální, negativně zasahují do kostního metabolizmu rostoucích jedinců.
Kostní tkáň a biomechanické projevy osteoporózy, které oslabují kost, byly revidovány Seemanem. Adaptace kosti je možná jen díky koordinaci mnoha buněk, mezi nimiž hrají hlavní roli dříve opomíjené osteocyty, které jsou schopny spolu s dalšími rozpoznat orientaci a velikost zátěže, i její frekvenci, a v této souvislosti přestavět strukturu kosti ve prospěch více zatěžovaných míst, respektive kostních trámců na úkor trámců méně zatěžovaných. Tento proces je mimořádně efektivní v době růstu. Vůbec největší je bioplasticita kosti ihned po narození, což lze demonstrovat na léčbě vrozené dysplazie kyčelních kloubů novorozenců. Ale i v pozdějším věku je schopnost kosti adaptovat se a přestavovat podle typu zátěže v pozitivním i negativním smyslu, jak můžeme pozorovat u cvičení gymnastů nebo vzpěračů. Po ukončení růstu dochází nejprve ke snížení kostní novotvorby, protože organizmus již nemá potřebu vytvářet novou hmotu. 90 % kostní hmoty je u dívek dosaženo v 18 letech u chlapců ve 20 letech. Konečného maxima kostní hmoty je u žen dosaženo během 20. roku života, u mužů kolem 24., tedy poněkud později. Množství kostní hmoty je zodpovědné za 75–90 % mechanické odolnosti kosti a zároveň vytváří tzv. „startovní čáru“, protože po dosažení kostní hmoty začíná každý dospělý jedinec ročně ztrácet 0,5–0,75 % kostní hmoty, což považujeme za fyziologickou ztrátu v důsledku stárnutí organizmu. Během následujícího života klesá BMD ve všech oblastech, zpočátku u obou pohlaví rovnoměrně, ale u žen v přechodu dochází k mírnému útlumu kostní formace a silnému zvýšení kostní resorpce, a tato nerovnováha vede ke zrychlené ztrátě kosti ve všech oblastech. Z těchto důvodů, od dosažení vrcholu kostní hmoty do konce života, dojde k poklesu BMD v oblasti proximálního femuru u žen k 58% ztrátě, kdežto u mužů je tato ztráta pouze 39 %.
Rozdíl ve ztrátě BMD je způsoben především poklesem sekrece ženských pohlavním hormonů po menopauze při setrvalé sekreci kortikosteroidů (pokles pouze o 10 %). U mužů je snížení hladiny testosteronu zodpovědné pouze za 15–20 % výskytu osteoporózy, v téměř v 70 % případů jsou příčiny sekundární nebo se nezjistí. Hladiny androgenu sice začínají klesat již po 35. roce života a od 60 let věku již nemá vysoké procento mužů (kolem 60 %) optimální sekreci androgenů, přesto osteoporóza vzniká u mužů zhruba ve 20 % případů. U mužů je obecně vyšší úmrtnost v důsledku zlomeniny kyčelního kloubu již v průběhu hospitalizace, a to 8 % oproti 3 % u žen a v průběhu prvního pooperačního roku 36 % ve srovnání 24 % u ženské populace. Podobně nižší je i délka přežití po prodělaných symptomatických zlomeninách obratlových těl – 0,72 % vs 0,84 % u žen. Každá prodělaná zlomenina pak zvyšuje riziko další zlomeniny.
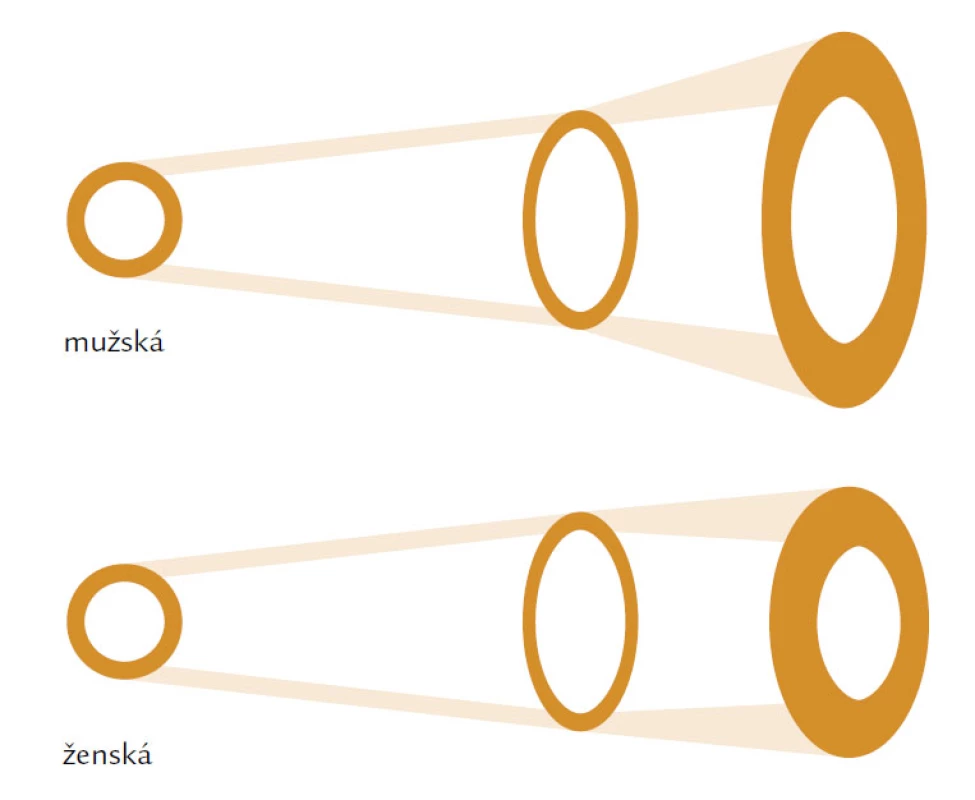
Hlavním rizikovým faktorem je věk. Věkově podmíněné změny ovlivňují složení kosti a její makroskopickou a mikroskopickou strukturu. V první řadě je to nerovnováha mezi kostní formací, tzn. novotvorbou a kostní resorpcí čili odbouráváním kosti. U žen dochází především ke zvýšenému odbourávání kosti, u mužů dominuje spíše snížená kostní formace. Nerovnováha, resp. negativní bilance v kostní remodelační jednotce (BRU – Bone Remodeling Unit) spolu s vysokým obratem a změnou vlastností kolagenu narušují strukturu a fyzikální vlastnosti kosti. Jak kortikální, tak trabekulární kost je tenčí a poróznější a přerušení kostních trámců, které je typické především pro postmenopauzální osteoporózu nebo ztenčení kostních trámců typické pro mužskou či glukokortikoidy indukovanou osteoporózu, vede ke snížení mechanické odolnosti a absorpční schopnosti kosti odolat působení síly. Kost se snaží kompenzovat tento negativní efekt především zvýšením vnitřního průměru kosti, jehož zvětšení se projeví na její odolnosti vůči tlaku i ohybu při stejné hodnotě areálního BMD (obr. 1). V průběhu života se vnitřní průměr u mužů zvětšuje mnohem více než u žen a může být jedním z faktorů, které ovlivňují odlišné riziko zlomenin v závislosti na pohlaví (obr. 2).
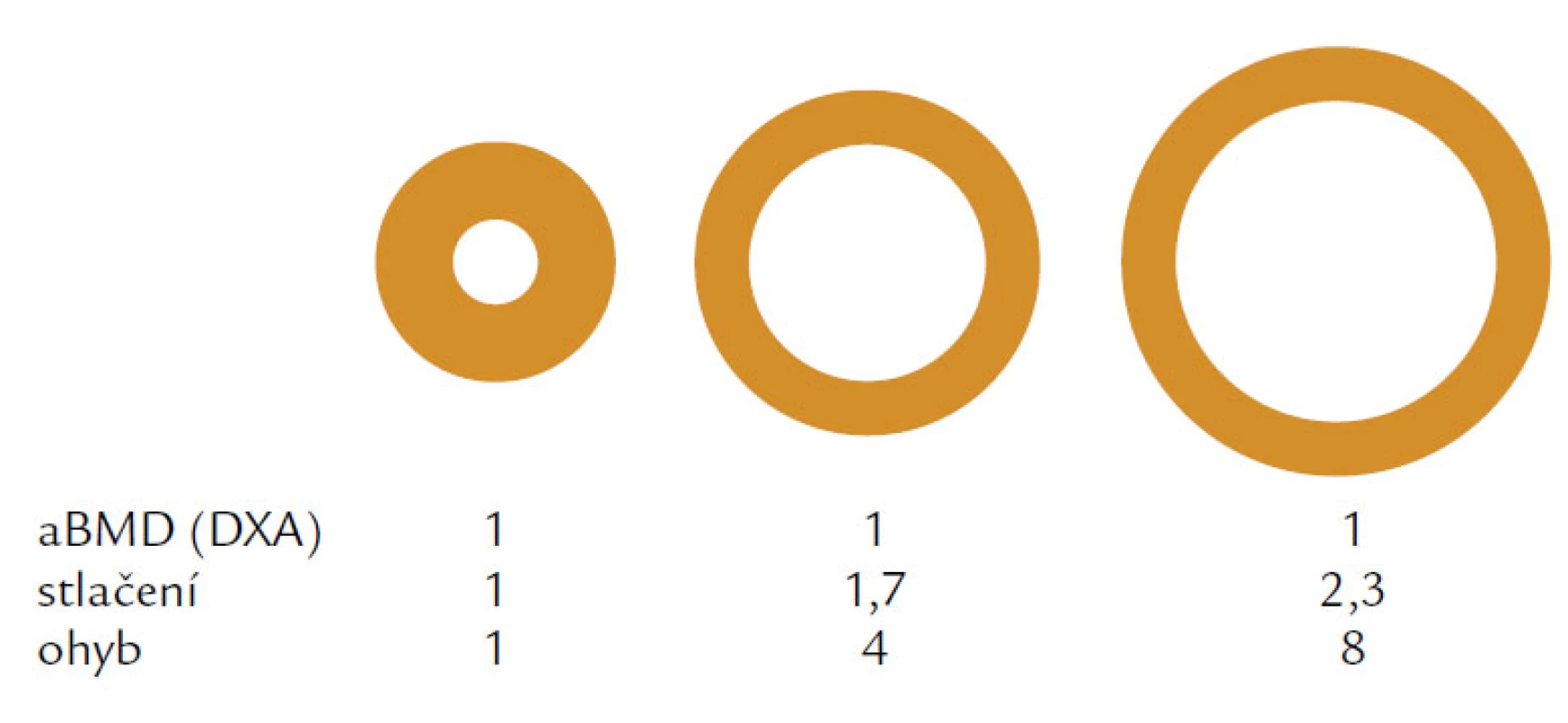
Dalšími faktory, které přispívají k fragilitě kostí v souvislosti s věkem, je kumulace mikroskopických únavových poškození, hypermineralizace a změna vlastností kolagenních vláken včetně zvýšeného počtu aktivních a ne zcela vyplněných resorpčních lagun na povrchu kosti. K dalším rizikovým činitelům patří i kouření, nízké BMI a hypogonadizmus, které jsou spojeny rovněž se sníženou konektivitou trabekulární sítě, která vede ke snížené odolnosti kosti vůči ohybu a tlaku. Všechny tyto skutečnosti byly prokázány na trabekulární architektuře v biopsiích odebraných z lopaty kosti kyčelní, i když není zcela jisté, zda tato architektura kosti, která je mimo axiální zátěž, tzn. mimo zátěž v ose, které je vystavena páteř a končetiny, nám poskytuje zcela objektivní obrázek o biomechanických změnách v průběhu času či nasazené léčby.
V poslední době se stále větší význam přikládá jednak ke stanovení rizikových faktorů a především strukturální analýze kyčle, která se používá jako nadstavbová analýza pro stanovení strukturálních hodnot při skenování kyčelního kloubu na DXA. Již v minulosti Duan et al analyzovali DXA snímky za použití strukturální analýzy a zjistili, že velikost krčku femuru je klíčovým determinantem jeho odolnosti, protože větší krček rozkládá zatížení a tlak na větší plochu a snižuje velikost síly ohybu.
Krček femuru se zvětšuje během života periostální apozicí nové kosti, částečně jako adaptační odpověď na ztrátu kosti na endostálním povrchu. Duan et al zjistili, že při porovnání kontrolní skupiny jedinců se skupinou žen se zlomeninou proximálního femuru měly tyto ženy větší krček femuru, ale zároveň tenčí kortikalis zejména v oblasti Adamsova oblouku, takže byly méně odolné vůči zátěži. Naproti tomu muži se zlomeninou proximálního femuru měli menší femorální krčky s narušenou periostální apozicí a tenčí kortikalis ve srovnání s kontrolní skupinou. Tyto nálezy, naznačující významný rozdíl v patogenezi fragility krčku mezi oběma pohlavími, vedou k hypotéze, že i léčba, resp. prevence těchto zlomenin nejen s ohledem na biomechanickou rozdílnost, ale i míru narušení kostní formace, by měla být rozdílná.
Analýza Epos Study však ukazuje, že rozdíly v riziku zlomenin končetin v populaci jsou silně závislé na míře pádů u žen i mužů. Především u zlomenin horní končetiny je míra pádu více riziková pro vznik zlomeniny než vlastní BMD. Tuto skutečnost potvrdila i nizozemská skupina (Pluijm et al), která prokázala, že u žen a mužů nad 65 let jsou rizikovými faktory funkční omezení, svalová slabost, snížení BMI, vysoká spotřeba alkoholu (míněno více než 15 skleniček týdně) a v neposlední řadě i anamnéza předchozích pádů. U jedinců s těmito faktory byla pravděpodobnost pádů extrémně vysoká. Pokud šlo o pacienty s přítomností všech uvedených rizikových faktorů, pak bylo riziko pádů v následujících 3 letech téměř stoprocentní. Použití zavedených rizikových faktorů pro pády k identifikaci jedinců s vysokým rizikem pádu je bohužel zatím přehlížena a není obsažena ani v kritériích FRAX pro identifikaci rizika osteoporotických zlomenin obecně a rizika zlomeniny proximálního femuru.
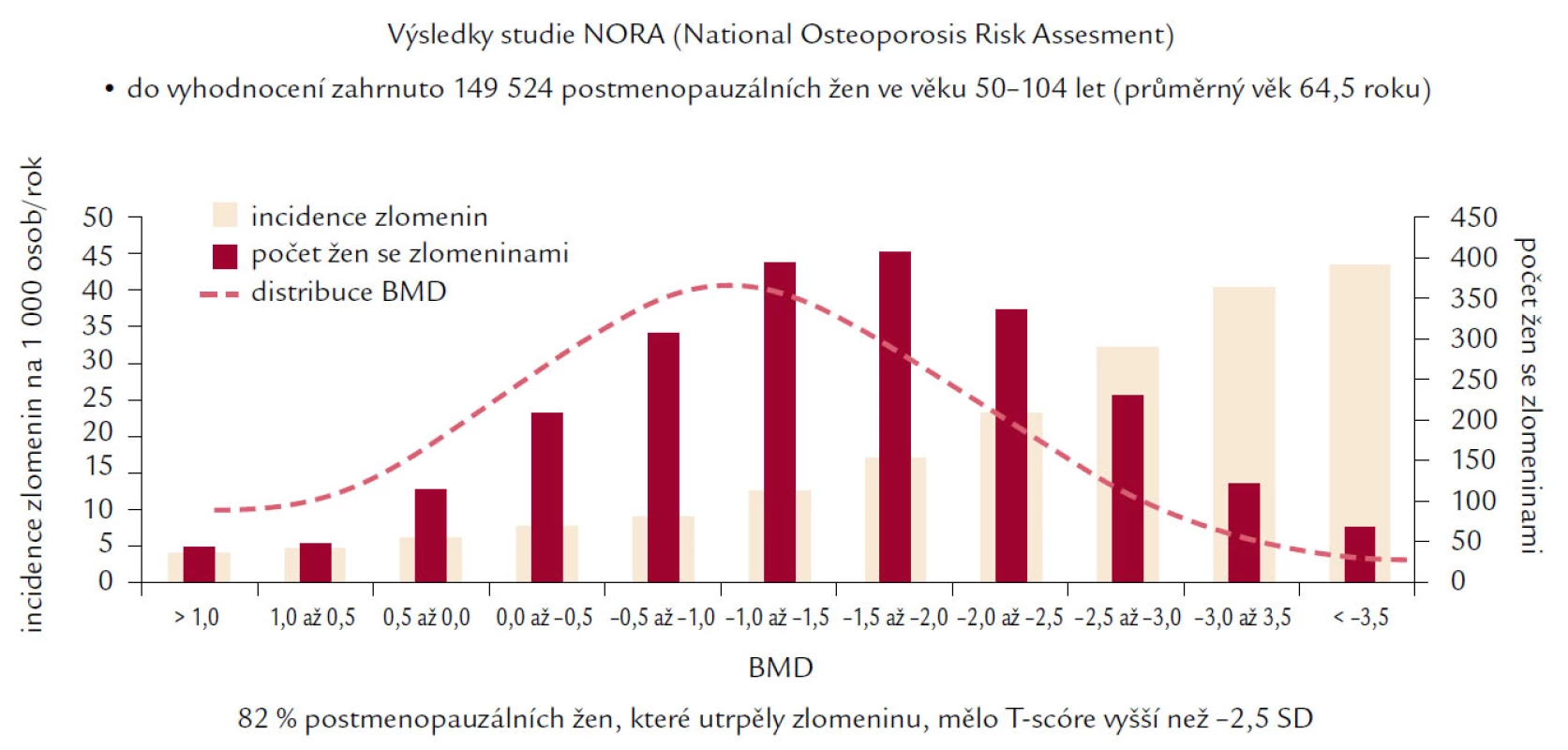
I když hodnota BMD vysvětluje mezi 75 a 90 % variability mechanické odolnosti kosti a snížení BMD o jednu SD znamená přibližně 2,2krát vyšší riziko následné zlomeniny, existuje rozdílný práh BMD, při němž vzniká zlomenina u žen a mužů (u mužů je tento práh nižší, ale zcela exaktně definován nebyl). Navíc ve studii NORA, Siris prokázala, že mnohem vyšší procento zlomenin vzniká ve skupině s osteopenií než ve skupině pacientů s osteoporózou podle současné klasifikace WHO (obr. 3). Tyto skutečnosti zřejmě odrážejí fakt vyššího počtu pacientů s existující osteopenií, ale především rozdílnost rizikových faktorů v obou sledovaných skupinách, kde BMD představuje pouze jeden z mnoha faktorů vedoucích ke zlomenině. WHO doporučuje hodnocení absolutního rizika hlavních osteoporotických zlomenin nebo pouze proximálního femuru v následujících 10 letech pomocí nástroje FRAX, který má být pomůckou, nikoli doporučeným postupem, v rozhodování lékaře pro nasazení léčby u jednotlivého pacienta. FRAX si klade za cíl na základě zhodnocení 10leté pravděpodobnosti kvantifikovat riziko zlomeniny kyčle nebo závažné osteoporotické zlomeniny v dané zemi za předpokladu příznivé životní prognózy pacienta v následujících letech. V tomto výpočtu je zapotřebí zohlednit následující rizikové faktory:
- věk
- pohlaví
- hmotnost a výšku (stimulace osteoblastů je u pacienta s větší tělesnou hmotností vyšší)
- předchozí zlomeninu (identifikuje pacienty, kteří již mají klinické příznaky OP)
Nezohledňuje počet prodělaných zlomenin, konstatuje pouze přítomnost nebo absenci předchozí zlomeniny či zlomenin:
- zlomeninu kyčle v rodinné anamnéze
- aktuální kouření – nepočítá se vliv ani délka předchozího kouření či počet vykouřených cigaret ani interval od přerušení kouření
- glukokortikoidy – nepočítá, zda jde o prvé 3 měsíce podávání, nerozlišuje délku podávání ani kumulativní dávku
- sekundární osteoporóza (způsobenou např. nedostatkem vitaminu D, hyperparatyreózu)
Nerozlišuje typ sekundární osteoporózy, její tíži či etiologii:
- alkohol (> 3 nápoje denně) – jde o orientační posouzení bez vztahu např. k jaterním funkcím
- revmatoidní artritidu – jde o údaj, zda pacient trpí RA, bez kvantifikace tíže a délky trvání choroby
Důležité je, že FRAX není závislý jen na výsledku vyšetření hustoty kostního minerálu. Při používání výpočtu on‑line je možné zadat výsledky BMD v krčku stehenní kosti. Nejsou‑li však tyto informace k dispozici, lze riziko zlomeniny kyčle vypočítat na základě BMI a přítomnosti klinických rizikových faktorů. Dalším přínosem FRAX je možnost kvantifikovat riziko zlomenin ve skupinách, o kterých jsme doposud neměli dostatečné informace, a to zejména u mužů a premenopauzálních žen.
FRAX prozatím není součástí diagnostických guidelines, jde však o užitečný nástroj, který lze využít, pokud není přístup k vyšetření DXA pro identifikaci jedinců vhodných k vyšetření, nikoliv k nasazení terapie. Naopak u lékařů pracujících s dvoufotonovým celotělovým denzitometrem (DXA) přístrojem či výsledkem vyšetření představuje FRAX další nástroj k rozhodnutí o nasazení terapie. Nevýhodou je, že nezohledňuje některá rizika popsaná výše, např. mnohočetné zlomeniny, kumulativní dávku glukokortikoidů, nebo že poskytne nepřesné výsledky v důsledku zadání chybné informace do výpočetního algoritmu. Zároveň samotný systém hodnocení využívající hodnocení typu ano/ne vnáší do výsledku určitou subjektivitu a může být zkreslen snahou lékaře prospět pacientovi předčasným nasazením antiosteoporotické léčby.
Farmakologická léčba osteoporózy
Vápník a vitamin D
Vápník je bezesporu základním kamenem terapeutických a preventivních strategií a žádná účinnější antiresorpční léčba se bez suplementace vápníkem a vitaminem D neobejde. Vliv vápníku na redukci zlomenin byl zkoumán v monoterapii i v kombinaci s vitaminem D. V monoterapii nebyl přímý vliv vápníku na redukci zlomenin jednoznačně potvrzen, např. Recker [4] prokázal po 4 letech léčby vápníkem pokles relativního rizika (RR) zlomeniny obratle, ale jen u pacientů s předchozí prodělanou zlomeninou, a neprokázal vliv na nevertebrální zlomeniny. Stejně tak vitamin D v monoterapii neměl podle Lipse [22], který jeho účinek zkoumal 3,5 roku na souboru 2 578 pacientů starších 70 let, žádný signifikantní vliv na redukci zlomenin. Naproti tomu nejznámější práce Chapuyho [21] z roku 1992 v 3letém sledování 3 270 seniorů léčených vitaminem D3 v dávce 800 IU a 1 200 mg vápníku prokázala pokles RR zlomeniny o 27 %.
Z hlediska dávkování vitaminu D se podle posledního doporučení ASBMR za horní hranici denní dávky považuje 2 000 IU vitaminu D. V běžné praxi se používají dávky mezi 800 a 1 200 IU D3 podle výchozího stavu hladiny 25 OHD v séru, protože snížená hladina vitaminu D může být kontraindikací nasazení léčby bisfosfonáty, resp. je limitací bezpečnosti u této léčby. U nemocných s průkazem snížené aktivity 1α-hydroxylázy v ledvinách nebo pacientů starších 65 let, kde lze mít podezření na deficit aktivity tohoto enzymu, lze vitamin D nahradit aktivním metabolitem vitaminu D α-kalcidiolem či kalcitriolem. Sledování odpadů vápníku v moči před zahájením této léčby a v jejím průběhu je samozřejmostí.
Hormonální substituční léčba
Pod pojmem hormonální substituční léčba (HRT), resp. estrogenní substituční léčba, si představujeme substituci deficitu estrogenu u žen po menopauze, protože estrogeny upravují zvýšený kostní obrat po menopauze do oblasti premenopauzálních hodnot a účinně zamezují ztrátě kostní hmoty ve všech oblastech skeletu včetně snížení vstřebávání vápníku ve střevě. WHI studie (Women’s Health Iniciative), která jako první přinesla Evidence Based Medicine (EBM) data na snížení obratlových i neobratlových zlomenin, znamenala pro výskyt vedlejších účinků a především zvýšený výskyt rakoviny prsu a tromboembolické choroby vyřazení těchto léků z první linie volby prevence a léčby osteoporózy. Důvodem byla především neadekvátní výběr pacientů pro tuto studii, nicméně v současné době se používá hormonální substituce pouze k léčbě klimakterických příznaků.
Selektivní modulátory estrogenních receptorů (SERM)
Mechanizmus účinku SERM je realizován prostřednictvím její vysoké afinity k estrogenním receptorům ER-α a ER-β. ER-α se vyskytují v reprodukčních tkáních a ER-β mimo reprodukční tkáň. U nás dostupný raloxifen funguje jako agonista estrogenu v kosti, resp. agonista estradiolu na osteoblastech a osteocytech, ale jako antagonista v děloze a prsní tkáni. Mechanizmus účinku inhibice kostní resorpce je pravděpodobně stejný jako u estrogenu, tzn. blokování produkce cytokinů, které produkují diferenciaci osteoklastů, ale také stimulaci TGF‑β3, který potlačuje aktivaci osteoklastů. Studie MORE (Mutiple Outcome of Raloxifen Evaluation) prokázala účinnost raloxifenu v prevenci zlomenin obratlů a snížení rizika mnohočetných kompresí, ale ve studii CORE ani po 8 letech podávání nebyl potvrzen vliv raloxifenu na snížení nonvertebrálních zlomenin. V této studii bylo zjištěno signifikantní snížení rizika zlomenin periferního skeletu u žen s prevalentní zlomeninou.
V současné době by mohl tuto nevýhodu překonat bazedoxifen, který v dávce 20–40 mg denně v 3leté studii u postmenopauzálních žen prokázal ve srovnání s klinicky užívanou dávnou raloxifenu 60 mg denně a placebem, významné snížení rizika nových zlomenin obratlových těl a v post‑hoc analýze u pacientů s T-skóre ≤ –3 SD nebo přítomnou prevalentní zlomeninou obratle prokázal 50% snížení relativního rizika nevertebrálních zlomenin. V ČR nejsou zatím s tímto preparátem kromě výsledků ze studií žádné klinické zkušenosti.
Aminobisfosfonáty
Aminobisfosfonáty jsou syntetické látky strukturálně příbuzné pyrofosfátům, které jsou rezistentní vůči chemické a enzymatické hydrolýze a inhibují adherenci osteoklastů na povrch kosti a současně navozují apoptózu osteoklastů. Z těchto důvodů poskytují delší čas na tzv. sekundární mineralizaci v rámci remodelačního cyklu, ale zkracují čas potřebný na formaci nové kosti. Různé typy bisfosfonátů se liší jak v míře afinity k hydroxiapatitu, tak v míře inhibice farnesyldifosfátsyntetázy.
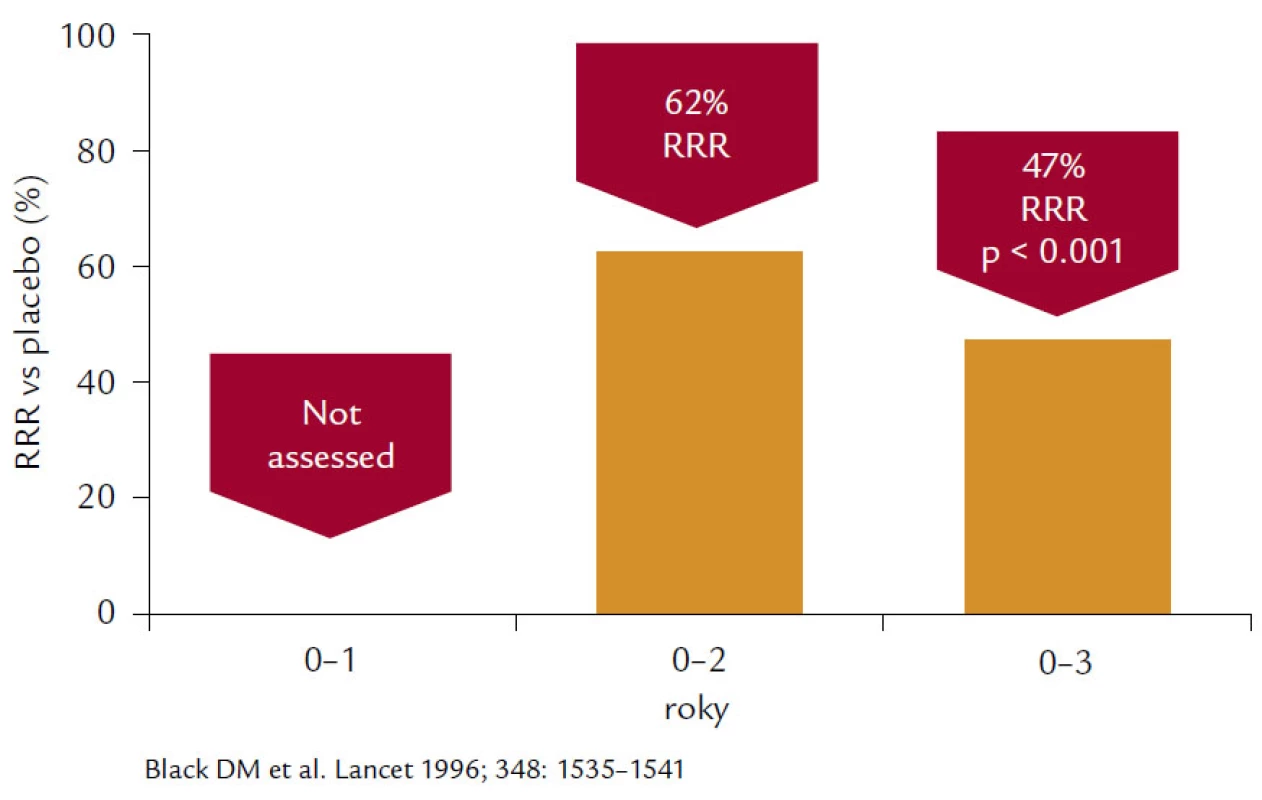
Alendronát prokázal ve studii FIT (Fracture Interevention Trial) u skupiny postmenopauzálních žen s prevalentní zlomeninou, resp. VDS (Vertebral deformity study), redukci incidence no-vých deformit obratlových těl o 44 % a kumulativní incidenci obratlových zlomenin v prvním roce 40 %, v druhém 90 % a ve třetím 99 %. V průběhu 3letého sledování byla dosažena 32% redukce. Druhá podstudie Clinical fracture study (CFS) prokázala 36% pokles zlomenin u pacientek v krčku femuru, nikoliv u těch, u nichž BMD bylo nižší než 2,5 T-skóre, a rovněž bylo dosaženo 44% poklesu v radiologicky potvrzených zlomeninách u všech skupin sledovaných žen. Post‑hoc analýzou dat byla prokázána relativní redukce nevertebrálních zlomenin o 56 %, ale pouze u pacientek, jejichž BMD v krčku byla nižší než –2,5 SD. V 3leté studii VDS došlo k 47% redukci vzniku nových zlomenin obratlových těl, 55% redukci klinicky symptomatických zlomenin obratlů a 90% redukci rizika mnohočetných zlomenin páteře (obr. 4). Prokázána byla přibližně 50% redukce zlomenin krčku femuru a 48% redukce zlomenin předloktí. Prodloužením studií FIT o dalších 5 let se pouze prokázalo, že u pacientů, kteří vysadili antiresorpční léčbu, došlo k mírnému poklesu BMD a zvýšila se incidence klinických zlomenin, ale incidence nonvertebrálních zlomenin se nelišila od pacientek léčených alendronátem po celou dobu studie.
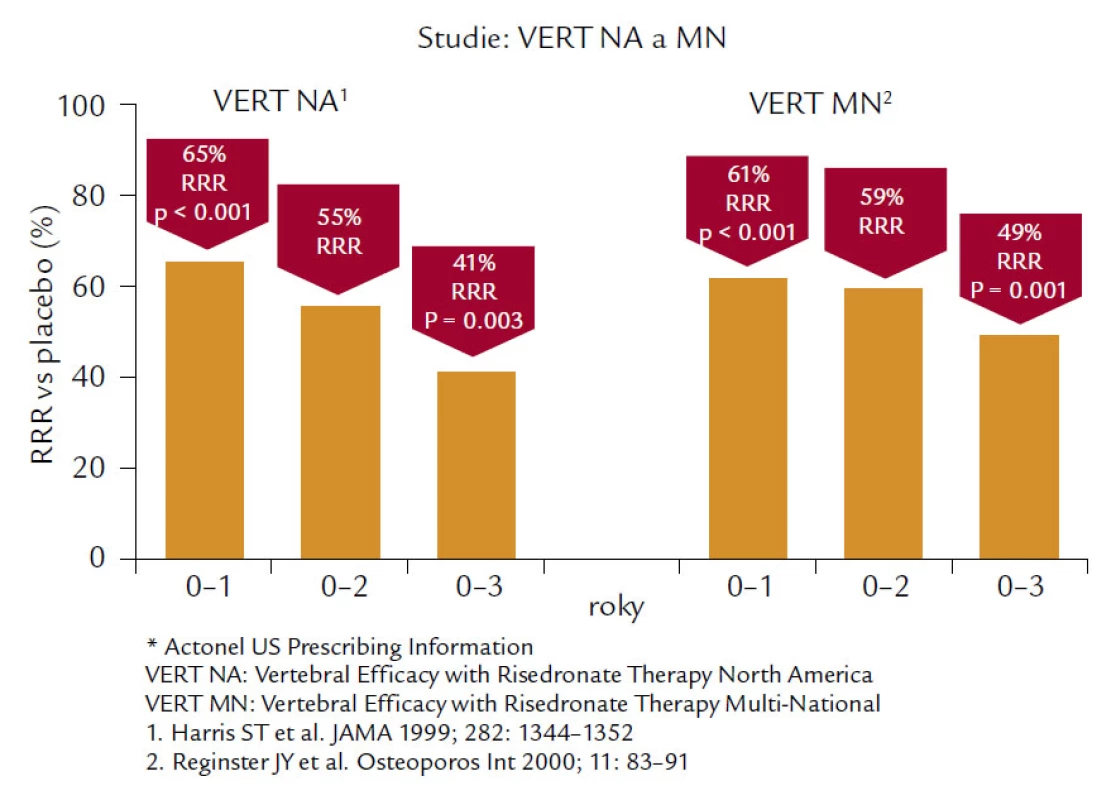
Risedronát je bisfosfonát 3. generace, který byl testován v řadě velkých klinických studií a ve studii VERT (Vertebral Efficacy with Risendronate Therapy) u žen s prevalentní zlomeninou obratle snížil výskyt nových zlomenin obratlů o 41 % ve skupině léčené 5 mg risendronátu ve srovnání s placebem v severoamerické (NA) větvi a 49 % v mnohonárodní (MN) větvi (obr. 5). Kumulativní incidence nevertebrálních zlomenin byla v léčené skupině nižší o 39 % (VERT-NA) a o 33 % ve VERT-MN. Ve studii HIP, jejímž primárním cílem bylo sledovat účinek risendronátu na zlomeniny kyčle, bylo z původně 22 708 screenovaných žen vzhledem k výjimečným selekčním kritériím vybráno pouze 9 331 žen, ze kterých bylo 5 445 randomizováno, tzn. přibližně 25 % původního počtu. Tato skupina zahrnovala ženy ve věku 70–79 let, které prodělaly nejméně 2 vertebrální zlomeniny a u nichž bylo T-skóre nižší než –4,0 SD nebo –3,0 SD a byl současně přítomen nejméně jeden neskeletální rizikový faktor pro zlomeniny kyčelního kloubu typu poruchy chůze nebo sklonu k pádům. Druhou skupinu tvořila skupina 3 886 žen starších 80 let, kde byl přítomen nejméně jeden rizikový faktor nebo nízká BMD v krčku femuru nižší než –4,0 SD nebo nižší než –3,0 SD se současnou délkou krčku větší než 11 cm (samostatný rizikový faktor). U 1 683 žen, které měly již předem prokázanou zlomeninu obratle, se riziko snížilo u 68 %, ale u skupiny bez předchozí zlomeniny nebylo snížení rizika zlomenin signifikantní. Rovněž nebyl prokázán žádný efekt léčby u žen vybraných podle rizikových faktorů a nebylo dosaženo signifikantního snížení na výskyt zlomeniny proximálního femuru u žen starších 80 let. Signifikantního snížení bylo dosaženo paradoxně u dávky 2,5 mg denně, nikoliv 5 mg denně, která je dávkou terapeutickou. Přes extrémně zvýšené rizikové faktory vstupu při této studii:
- vyšší než 70 let
- T-skóre v krčku nižší –3,0 SD, event. –4,0 SD
- další neskeletální faktor pro vznik zlomenin
- délka krčku delší než 11 cm
bylo dosaženo signifikantního 40% snížení rizika až po sloučení dat obou terapeutických skupin 2,5 mg a 5 mg risendronátu denně. U nás je dostupná pouze týdenní generická forma, nikoli týdenní či měsíční originál.
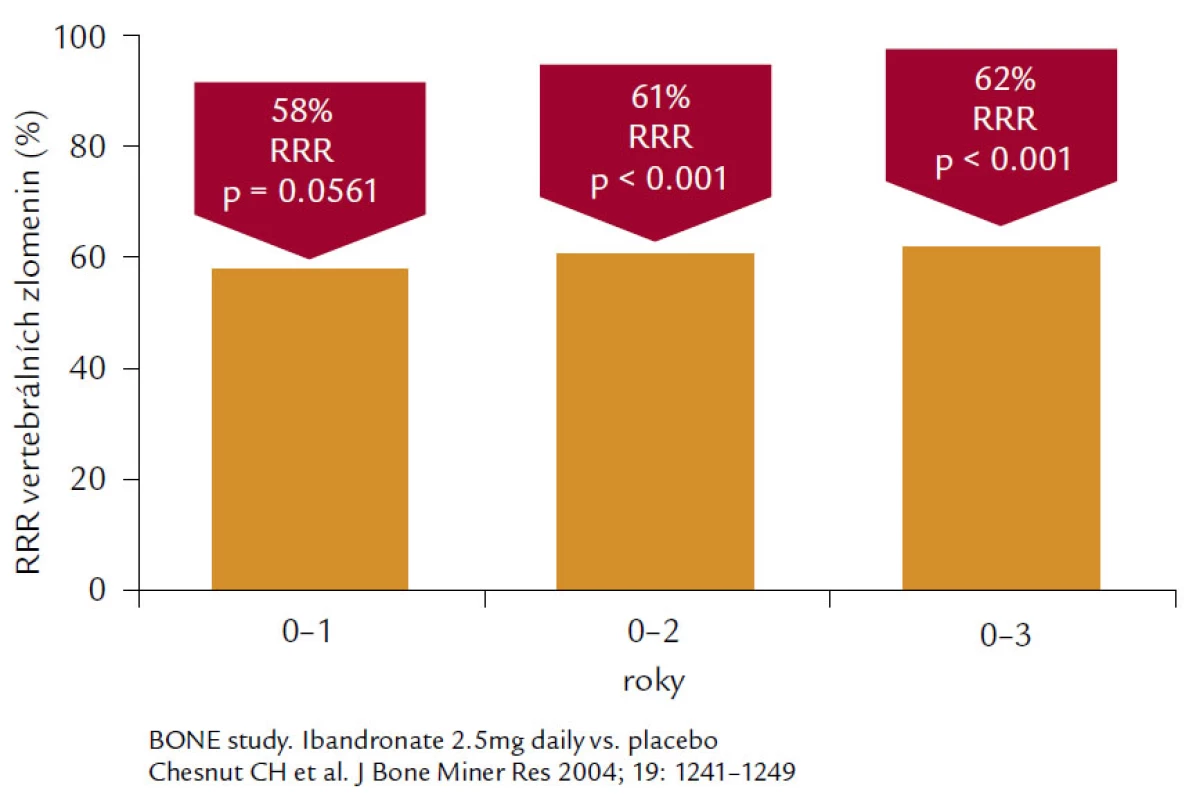
Ibandronát. Jde o aminobisfosfonát 3. generace s vysokým antiresorpčním preparátem a relativně střední afinitou k hydroxyapatitu. Ibandronát je aplikován v dávce 150 mg měsíčně per os nebo 3 mg 1krát za 3 měsíce intravenózně u postmenopauzálních žen s osteoporózou především k prevenci nově vzniklých zlomenin obratlových těl. Ve studii BONE bylo prokázáno snížení relativního rizika pro nové obratlové zlomeniny o 62 % při denním podávání, což představuje největší relativní snížení ze všech perorálních bisfosfonátů používaných k léčbě osteoporózy (obr. 6).
Studie MOBILE (Monthly ibandronate in ladies) zkoumala účinnost léčby dávkou 100 mg (50 mg podaných ve 2 po sobě následujících dnech v měsíci nebo 10 mg podaných jednou měsíčně v jednom dni) a dávkou 150 mg (podaných v jednom dni), kdy primární cíl nárůstu BMD splnily všechny 3 zkoumané dávkovací režimy a dávka 150 mg měsíčně ve srovnání s denní formou 2,5 mg denně vykázala signifikantně vyšší nárůst BMD v oblasti bederní páteře (4,9 % vs 3,9 %) na hladině významnosti p < 0,001.
V oblasti kyčle byl zaznamenán nárůst 3,1 % vs 2,0 %, v krčku stehenní kosti 2,2 % vs 1,7 % a 2,0 % vs 3,1 % v oblasti proximálního femuru. V trochanterické krajině, kde se dosahuje zpravidla nejlepších výsledků při léčbě BF, byl nárůst 4,6 % vs 3,2 %. Z hlediska odpovědi na léčbu, která byla sledována pomocí předem definovaného snížení sérového CTx (C‑terminální telopeptid kolagenu typu I) –50 % a –70 %, odpovídal na léčbu měsíční formou IBA signifikantně vyšší podíl pacientů (p < 0,05 a p < 0,001) ve srovnání s denním podáváním. Při sledování účinku terapie na kostní izofotu ALP došlo k poklesu o 35 % při denním podávání, zatímco při léčbě dávkou podanou jednou měsíčně došlo k poklesu o 50 % (p < 0,005). Všechny dávkovací režimy měly bezpečnostní profil srovnatelný s placebem a zúčastněné ženy vykazovaly vyšší adherenci v závislosti na délce intervalu podávání.
Studie DIVA (Dosing IntraVenous Administration) hodnotila vliv intermitentní intravenózní aplikace IBA a BMD a markery kostní remodelace. Celkový počet 1 395 žen s postmenopauzální osteoporózou byl rozdělen do 3 skupin: 2 mg IBA i.v. každé 2 měsíce (n = 377), 3 mg IBA i.v. každé 3 měsíce (n = 365) a 2,5 mg IBA p.o. denně (n = 377). Po jednoletém podávání bylo intravenózní léčbou IBA dosaženo významně vyššího nárůstu BMD v bederní páteři ve srovnání s denní dávkou (o 5,1 % ve skupině 2 mg/2 měsíce, o 4,8 % ve skupině 3 mg/3 měsíce a od 3,8 % při denní p.o. léčbě). Vzestupy BMD v proximálním femuru byly též vyšší v případě obou intravenózních režimů. Všechny režimy vedly ke srovnatelnému snížení sérového CTx o 60 % po roční léčbě.
Studie MOBILE a DIVA prokázaly větší účinnost intermitentních vyšších režimů dávkování ibandronátu na BMD ve srovnání s denním podáváním.
Nespornou výhodou ibandronátu je jeho renální bezpečnost, která umožňuje podávat tento preparát bez předchozího vyšetření glomerulární filtrace a ostatních parametrů renálních funkcí.
Kyselina zoledronátová patří mezi bisfosfonáty 3. generace s nejsilnějším účinkem, jak na enzymatickou složku, tzn. farnesyldifosfátsyntetázu, tak nejvyšší afinitu ke kostnímu minerálu. Jeho účinnost byla prokázána nejdříve v léčbě hyperkalcemie, prevence i léčbě metastatického onemocnění skeletu a Pagetovy choroby. Nově byla prokázána jeho účinnost v 3letých studiích u postmenopauzální osteoporózy a probíhají studie u osteoporózy u mužské populace.
Studie HORIZONT PFT sledovala celkem 7 765 pacientek průměrného věku 73 let. V průběhu 3letého podávání snížil zoledronát v jednoročním intervalu podávání riziko obratlových zlomenin o 70 % ve srovnání s placebem a o 41 % snížil riziko zlomenin kyčle ve srovnání s placebovou skupinou. Z hlediska nežádoucích účinků bylo zaznamenáno signifikantní zvýšení sérového kreatininu mezi 9. a 11. dnem po podání: u 1,3 % pacientů léčených ZOL byl sérový kreatinin vyšší než 0,5 mg/dl ve srovnání s 0,4 % u placebové skupiny. Tyto změny byly transientní a do 30 dnů se hladiny normalizovaly u 85 % pacientů, u 15 % zvýšení přetrvávalo. Ve 3. roce ale nebyly zaznamenány signifikantní rozdíly mezi oběma skupinami. Nepodstatné byly rovněž vedlejší příznaky jako nauzea, bolesti zad, kostí a kloubů. Akutní fáze reakce na bisfosfonáty je způsobena zvýšením TNF‑α a IL‑6 a INF - γ.
Signifikantně vyšší výskyt arytmií byl v zoledronátové skupině 2,6 % vs 5,3 % (p = 0,003) a vážné síňové arytmie se vyskytly u 1,3 % u léčených zoledronátem ve srovnání s 0,5 % léčených placebem (p = 0,001). Nebyl pozorován vyšší výskyt mozkových příhod ani úmrtí na CMP. Shodně byly nalezeny 2 případy osteonekrózy čelisti, jeden v léčené a druhý v placebové skupině. Nebyly zaznamenány nepříznivé účinky na hojení zlomenin.
Kalcitonin
Kalcitonin (KT) je fylogeneticky velice starý hormon, který hraje významnou roli v udržování homeostázy vápníku. Mnozí autoři přičítají kalcitoninu spíše normokalcemizující než hypokalcemizující účinek, protože zvýšená hladina tohoto hormonu není doprovázena žádnou poruchou v metabolizmu vápníku a fosfátu. Stejně tak dosud nebyl popsán syndrom doprovázený sníženou hladinou kalcitoninu. Kalcitonin antagonizuje inhibici PTH na pyrofosfatázu a tím podporuje mineralizaci kostí. Inhibuje resorpci vápníku a velmi rychle zvyšuje osteoblastickou aktivitu a proteosyntézu, urychluje mineralizaci osteoidu a reguluje aktivitu osteocytů, a proto se uvažuje spíše o jeho vlivu na osteoformaci.
Studie PROOF (Preven Recurrence Of Osteoporotic Fractures) zahrnovala 1 255 postmenopauzálních žen, z nichž v době zahájení studie mělo 975 alespoň jednu kompresivní zlomeninu obratle podle RTG vyšetření páteře a T-skóre ≤ –2,0 SD. Po 5 letech studie zůstalo méně než 50 % žen. Ve skupině žen, která užívala 200 IU lososího kalcitoninu denně, bylo prokázáno snížení rizika obratlových zlomenin o 36 %, zatímco ve skupinách užívajících 100 nebo 400 IU KT denně riziko nové zlomeniny sníženo nebylo. Rovněž tak nebyl prokázán efekt na nevertebrální zlomeniny ani zlomeniny v oblasti kyčelního kloubu. Z výsledků studie PROOF lze odvodit, že léčba lososím kalcitoninem podávaná kontinuálně 3 roky u 100 pacientek dokáže zabránit u 9 z nich kompresivní zlomenině obratle. V současné době je lék užívám především k léčbě Sudeckova algoneurosystrofického syndromu, jinak nazývaného též komplexní regionální bolestivý syndrom.
Stroncium ranelát
Stroncium ranelát (SR) zabraňuje úbytku kosti, ale především vede k nárůstu trámčité kosti. Jde o tzv. uncoupling fenomén. Většina preparátů, která snižuje akcelerovanou kostní resorpci, zároveň potlačuje i kostní formaci, ale u SR jsou právě tyto dva procesy rozpojeny. Stroncium ranelát je přípravek, který vykazuje duální účinek na kostní remodelaci, tzn. že současně snižuje kostní resorpci a zvyšuje formaci.
Studie STRATOS prokázala nárůst BMD při podávání 2 g stroncium ranelátu o 7,3 % v bederní páteři (p < 0,01) a 3,1 % v krčku stehenní kosti ve srovnání s 1 g SR, kde došlo k nárůstu 4,5 % a 4,1 % ve stejné lokalizaci. Ve studii SOTI došlo po 3leté léčbě u skupiny léčených stroncium ranelátem k poklesu rizika zlomeniny obratlového těla o 49 % a ke snížení rizika nové vertebrální zlomeniny o 41 % ve srovnání s placebem léčenou skupinou žen (RR 0,59; 95% CI 0,46–0,73; p < 0,001). Novou zlomeninu obratle mělo 28,4 % pacientek v placebové skupině a 17,7 % v léčené SR (p < 0,001). Ve skupině léčené SR byl zaznamenán nárůst kostního minerálu ve srovnání s placebem o 14,4 % v oblasti bederní páteře; ve skutečnosti o 8,1 % po odpočtu nárůstu BMD způsobeného vlastním obsahem stroncia v měřené oblasti; nárůst 8,3 % byl zaznamenán v oblasti krčku femuru a 9,8 % v oblasti kyčle (p < 0,001). U léčených pacientek bylo již po 3 měsících léčby zaznamenáno signifikantní zvýšení hladiny kostní izoformy ALP a snížení hladin C-telopeptidu vůči placebem léčené skupině žen. Histomorfometrické vyšetření neprokázalo poruchy mineralizace. Kromě zvýšené peristaltiky u léčené skupiny byl SR velmi dobře tolerován.
Studie TROPOS byla rovněž multicentrická, randomizovaná, dvojitě zaslepená a placebem kontrolovaná stu-die, která proběhla v 75 centrech ve 12 zemích s celkovým počtem 5 091 post-menopauzálních žen. Po 4leté léčbě se signifikantně snížil počet nových zlomenin obratlů o 33 % v pokračování studie SOTI ve skupině léčené SR (n = 719) ve srovnání s placebovou skupinou (n = 723; RR 0,67; 95% CI 0,55–0,81; p < 0,001). Po 5leté léčbě ve studii TROPOS došlo k redukci zlomenin obratlů o 24 % (RR 0,76; 95% CI 0,65–0,87; p < 0,001) a o 15 % k redukci neobratlových zlomenin (RR 0,85; 95% CI 0,77–0,99; p < 0,03). Tato data potvrzují přetrvávající účinek dlouhodobé léčby SR.
V současné době jsou k dispozici 8letá data.
Parathormon
Teriparatid (1–34 PTH) se naváže na
receptory osteoblastů (typu G-proteinů), a tím je aktivuje, podporuje
jejich diferenciaci a oddaluje apoptózu. Usnadňuje transdukci signální
cesty prostřednictvím aktivace Cbfa-1, Wnt a IGF‑1 a 2 a PPAR‑γ  (peroxisome proliferator‑activated receptor).
(peroxisome proliferator‑activated receptor).
Zatímco dosavadní medikamenty limitovaly jen odbourávání kostí, nový preparát má podpůrné růstové schopnosti, jeho „restaurační“ účinek je však vázán na málo obvyklý způsob aplikace. Preparát teriparatid představuje fragment PTH připravený genovou manipulací bakterie Escherichia coli. V současné době jsou známy 2 formy PTH – fragment 1–34 a 1–84. Větší zkušenosti jsou s 1–34 N‑terminální sekvencí AMK (teriparatid), která se aplikuje pomocí 3ml pera obsahujícího 20 μg účinné látky pro jednotlivou aplikaci. Pero obsahuje léčivo na dobu 28 dnů.
Vlastní studie s 1–34 N‑terminálním (teriparatidem) PTH byla provedena u 1 637 postmenopauzálních žen s předchozí zlomeninou obratle, které byly randomizovány do 3 skupin, z nichž 2 dostávaly denně 20 nebo 40 μg 1–34 PTH nebo placebo.
Nejdůležitějším výstupem studie byla redukce jedné a více obratlových zlomenin o 65 % a 69 % podle dávky 20 anebo 40 μg 1–34 PTH. Průkaz poklesu o 35 % a 40 % u nevertebrálních zlomenin byl rovněž podán u dávky 20 a 40 μg ve srovnání s placebem. Incidence zlomenin kyčle nebyla zpracována, protože vzhledem k frekvenci jejich výskytu neměla studie statickou sílu prokázat jejich pokles.
Parathormon 1–84 má jen limitované množství studií, např. ve II. fázi bylo podáváno buď placebo, nebo 50, 75 či 100 μg 1–84 PTH po dobu 12 měsíců. Byl prokázán nárůst BMD v bederní páteři v závislosti na délce podávání a dávce, přičemž dávce 100 μg 1–84 PTH, kde průměrný počet zlomenin byl více než 2, jejich incidence ve III. fázi při dávce 100 μg 1–84 PTH činila pouze 19 %. Přes tuto skutečnost 1–84 PTH snížil incidenci nových vertebrálních zlomenin o 69 % a 63 %.
První randomizovanou, placebem kontrolovanou studii s PTH u mužů provedl Kurland [34] na 23 mužích s idiopatickou osteoporózou, léčených 400 IU teriparatidu (ekvivalent 40 μg) denně nebo placebem. U mužů léčených 40 μg teriparatidu denně se BMD v bederní páteři zvýšila o 13,5 %. V kyčli bylo dosaženo signifikantního, ale mnohem menšího a pomalejšího nárůstu BMD ve srovnání s bederní páteří.
Podobně multicentrická, randomizo-vaná, dvojitě zaslepená studie TOP (Treatment of Osteoporosis with Para-thyroid Hormone) zahrnuje 2 532 post-menopauzálních žen s osteoporózou, které byly léčeny buď dávkou 100 μg 1–84 PTH, nebo placebem, doložila signifikantní redukci vertebrálních zlomenin (primární cíl studie) u všech pacientek. Ze získaných dat není průkazná redukce nevertebrálních zlomenin ani redukce zlomenin v oblasti kyčle.
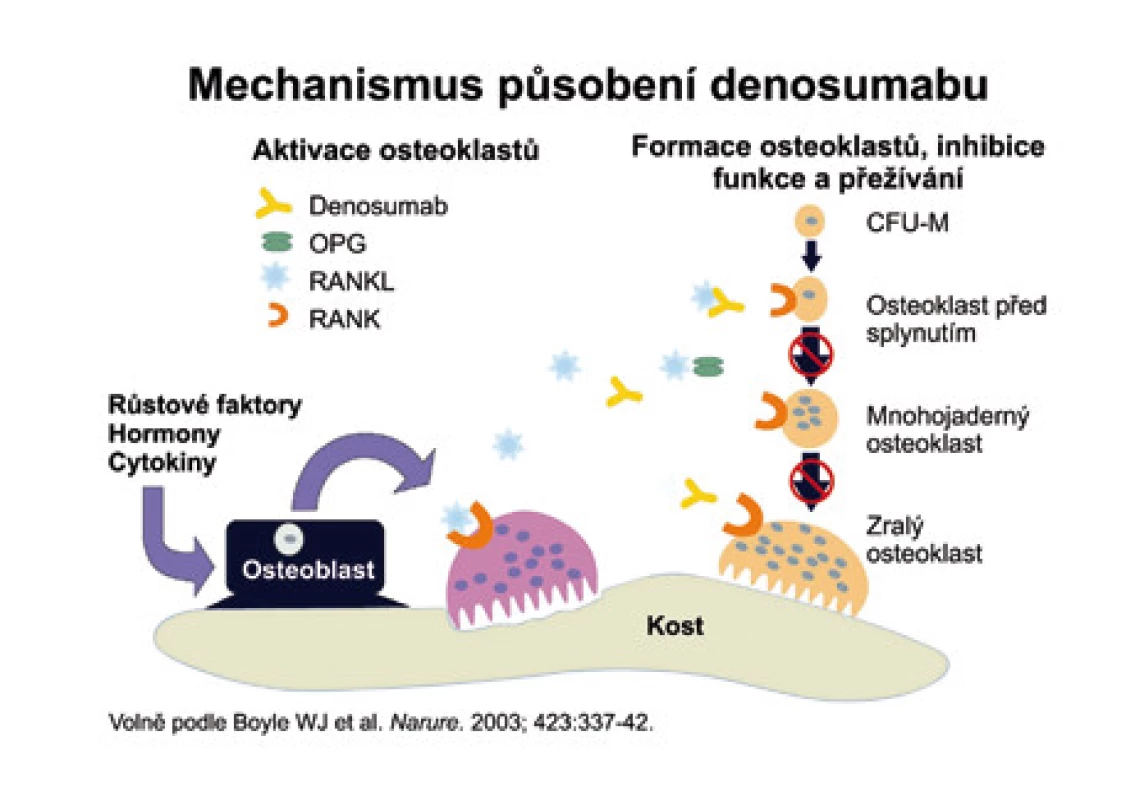
Denosumab
Denosumab (AMG 162) je protilátka RANKL, která se váže na RANKL obdobným způsobem jako OPG. Oproti OPG má však AMG 162 delší biologický poločas. Mechanizmus účinku ukazuje obr. 7.
V mezinárodní randomizované klinické studii byl denosumab podáván 412 postmenopauzálním ženám v 3měsíčních intervalech v dávkách 6, 14 nebo 30 mg nebo v 6měsíčních intervalech v dávkách 14, 60 nebo 100 mg subkutánně po dobu 12 měsíců. Byl prokázán její signifikantní vliv na snížení kostní resorpce a zvýšení denzity kostního minerálu.
Snížení rizika osteoporotických zlomenin bylo ověřeno ve velké randomizované klinické studii placebem kontrolované na zvané FREEDOM, která sledovala 7 868 žen ve věku 60–90 let s průměrnou BMD v bederní páteři nebo v proximálním femuru nižší než –2,5 T-skóre, ale ne nižší než –4,0 T-skóre. Po 3 letech byla incidence nových radiograficky zjištěných zlomenin obratlů u žen léčených denosumabem 2,3 % a v kontrolní skupině 7,2 %. Léčba tedy snižovala relativní riziko zlomeniny obratle o 68 % (RR 0,32; 95% CI 0,26–0,41; p < 0,001). Kumulativní incidence zlomenin v oblasti kyčle byla 0,7 % v léčené skupině a 1,2 % u kontrol (40% snížení relativního rizika zlomeniny; p < 0,04). Kumulativní incidence neobratlových zlomenin byla 6,5 % v léčené skupině a 8,0 % u kontrol (20% snížení relativního rizika zlomeniny; p < 0,01). Mezi léčenou a kontrolní skupinou nebyly zaznamenány významné rozdíly v incidenci nežádoucích účinků, závažných nežádoucích účinků, v přerušení léčby pro nežádoucí účinky, riziku nádorového onemocnění, infekcí, kardiovaskulárních komplikací, v době hojení zlomenin ani ve výskytu hypokalcemie. Studie byla následně prodloužena na 5 let, kde obě skupiny byly léčeny 60 mg denosumabu a pro velmi slibné výsledky i s ohledem na dlouhodobou bezpečnost byla tato studie prodloužena na 10 let a stále probíhá.
Dále byla provedena komparativní otevřená studie se 70 mg ALN podávanými 1krát týdně. U AMG 162 bylo prokázáno zvýšení kostního minerálu v páteři od 3,0 % do 6,7 % ve srovnání se 4,6 % u ALN a ztrátou 0,8 % u placeba, v kyčli došlo k nárůstu od 1,9 % do 3,6 % ve srovnání s 2,1 % u ALN a 0,6 % u placeba.
Důležité bylo zjištění, že AMG 162 dokáže signifikantně zvýšit kostní denzitu i v místech s převahou kortikální kosti. Vliv dlouhodobého podávání AMG 162 na BMD a na riziko zlomenin je v současné době prověřován klinickými studiemi u postmenopauzálních pacientek i pacientek s onkologickým onemocněním nebo revmatoidní artritidou.
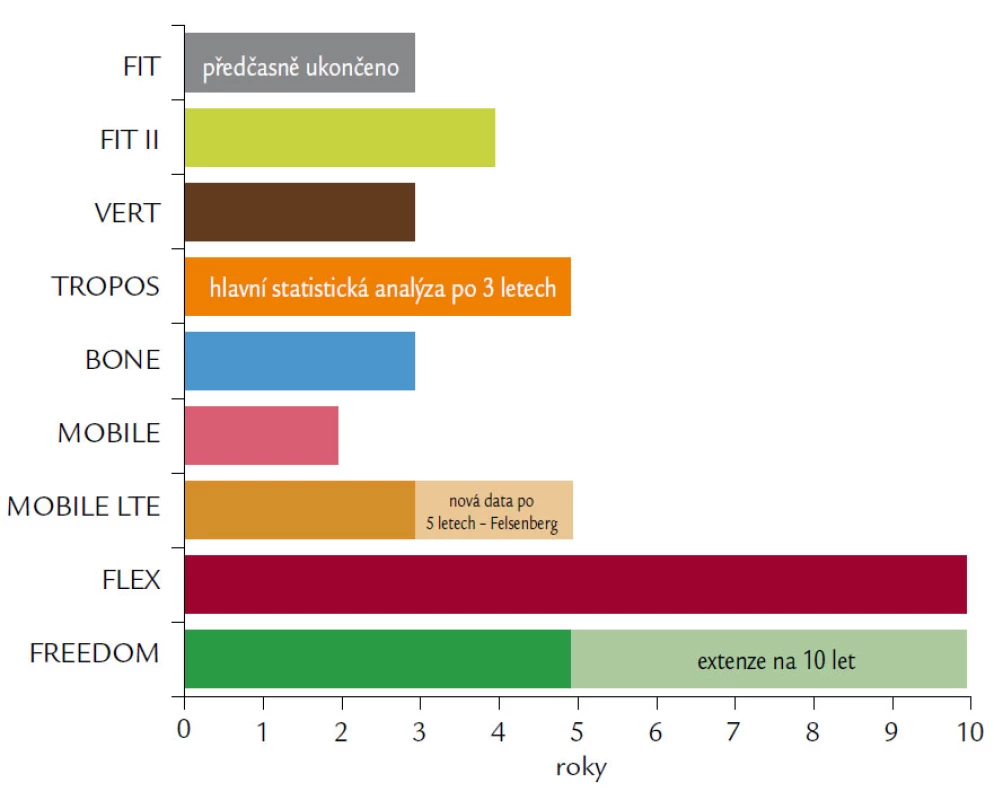
Přehled délky prováděných studií ukazuje obr. 8.
Závěr
V současné době máme k dispozici dvě zcela odlišné skupiny léků lišících se mechanizmem účinku, a to léky antiresorpční, které zvyšují mineralizaci skeletu bez výraznějšího zvýšení objemu vyšetřované kosti, a léky osteoanabolické, které dokážou nejen zvýšit objem měřené kosti, ale zlepšit konektivitu již přerušených kostních trámců. Nezbytnou součástí každé léčby je vápník a vitamin D, který na rozdíl od osteoanabolické léčby i léčby antiresorpční je nejen indikován od časného narození do pozdního stáří, ale ve všech těchto životních periodách vykazuje pozitivní efekt na lidský skelet.
Doručeno do redakce: 3. 6. 2010
MUDr. Václav Vyskočil, Ph.D.
www.fnplzen.cz
e‑mail: vyskocil@fnplzen.cz
Sources
1. NIH Consensus Development Panel on Osteoporosis Prevention, Diagnosis and Therapy. Osteoporosis prevention, diagnosis and therapy. JAMA 2001; 285 : 785–795.
2. Black D, Nguyen ND, Milch VE et al. Mortality risk associated with low-trauma osteoporotic fracture and subsequent fracture in men and women. JAMA 2009; 301 : 513–521.
3. Kanis JA, McCloskey EV, Johansson H et al. National Osteoporosis Guideline Group. Case finding for the management of osteoporosis with FRAX – assessment and intervention thresholds for the UK. Osteoporos Int 2008; 19 : 1395–1408.
4. Recker R, Hinders S, Davies KM et al. Correcting calcium nutritional deficiency prevents spine fractures in elderly women. J Bone Miner Res 1996; 11 : 1961–1966.
5. Fait T, Vokrouhlická J, Vrablík M et al. Současné postavení hormonální substituční terapie. Čas Lék Čes 2004; 143 : 447–452.
6. Black DM, Thompson DE, Bauer DC et al. Fracture Intervention Trial. Fracture risk reduction with alendronate in women with osteoporosis: the Fracture Intervention Trial. FIT Research Group. J Clin Endocrinol Metab 2000; 85 : 4118–4124.
7. Harris ST, Watts NB, Genant HK et al. Effects of risendronate treatment on vertebral and nonvertebral fractures in women with postmenopausal osteoporosis: a randomized controlled trial. Vertebral Efficacy With Risendronate Therapy (VERT) Study Group. JAMA 1999; 282 : 1344–1352.
8. McClung MR, Geusens P, Miller PD et al. Hip Intervention Program Study Group. Effect of risendronate on the risk of hip fracture in elderly women. Hip Intervention Program Study Group. N Engl J Med 2001; 344 : 333–340.
9. Eriksen EF, Hodgson SF, Eastell R et al. Cancellous bone remodeling in type I (postmenopausal osteoporosis: quantitative assessment of rates of formation, resorption, ad bone loss t tissue and cellular levels. J Bone Miner Res 1990; 5 : 311–319.
10. Arlot ME, Delmas PD, Chappard D et al. Trabecular and endocortical bone remodeling in postmenopausal osteoporosis: comparison with normal postmenopausal women. Osteoporos Int 1990; 1 : 41–49.
11. Seeman E, Hopper JL, Bach LA et al. Reduced bone mass in the daughters of women with osteoporosis. N Engl J Med 1989; 320 : 554–558.
12. Duan Y, Turner CH, Kim BT et al. Sexual dimorphism in vertebral fragility is more the result of gender differences in age‑related bone gain than bone loss. J Bone Miner Res 2001; 16 : 2267–2275.
13. Miller PD, Christiansen C, Hoeck HC et al. Efficacy of bazedoxifene for prevention of osteoporosis: results of a 2‑year, phase III, placebo and active controlled study. J Bone Miner Res 2007; 22 (Suppl 1): S559.
14. Russell RG, Watts NB, Ebetino FH et al. Mechanism of action of bisphosphonates: similarities and differences and their potential influence on clinical efficacy. Osteoporos Int 2008; 19 : 733–759.
15. Black DM, Delmas PD, Eastell R et al. HORIZON Pivotal Fracture Trial. Once‑yearly zolendronic acid for treatment of postmenopausal osteoporosis. N Eng J Med 2007; 356 : 1809–1822.
16. Bone HG, Hosking D, Devogelaer JP et al. Ten years’ experience with alendronate for osteoporosis in postmenopausal women. N Eng J Med 2004; 350 : 189–1199.
17. Zikán V. Nové možnosti farmakologické léčby osteoporózy na obzoru. Postgrad Med 2008; 10 (Suppl): 52–58.
18. Mehta N, Ray V, Stern B et al. Clinical development of recombinant oral calcitonin. Osteoporos Int 2009; 20 (Suppl 1): 103.
19. Dobnig H, Turner RT. Evidence that intermittent treatment with parathyroid hormone increases bone formation in adult rats by activation of bone lining cells. Endokrinology 1995; 136 : 3632–3638.
20. Palička V, Živný P, Pavlíková L. Léčba postmenopauzální osteoporózy – novinky v principech i postupech. Medicína po promoci 2009; 10 : 81–87.
21. Chapuy MC, Arlot ME, Duboeuf F et al. Vitamin D3 and calcium to prevent hip fractures in the elderly women. N Eng J Med 1992; 327 : 1637–1642.
22. Lips P, Graafmans WC, Ooms ME et al. Vitamin D supplementation and fracture incidence in elderly persons. A randomized, placebo-controlled clinical trial. Ann Intern Med 1996; 124 : 400–406.
23. Barrett-Connor E, Cauley JA, Kulkarni PM et al. Risk‑benefit profile for raloxifene: 4‑year data from the Multiple Outcomes of Raloxifen Evaluation (MORE) randomized trial. J Bone Miner Res 2004; 19 : 1270–1275.
24. Barrett-Connor E, Grady D, Sashegyi A et al. Raloxifene and cardiovascular events in osteoporotic postmenopausal women. Four‑year results from the MORE randomized trial. JAMA 2002; 287 : 847–857.
25. Fink HA, Ensrud KE, Nelson DB et al. Disability after clinical fracture in postmenopausal women with low bone density: the fracture intervention trial (FIT). Osteoporos Int 2003; 14 : 69–76.
26. Delmas PD, Recker RR, Chesnut CH 3rd et al. Daily and intermittent oral ibandronate normalize bone turnover and provide significant reduction in vertebral fracture risk: results from the BONE study. Osteoporos Int 2004; 15 : 792–798.
27. Miller PD, McClung MR, Macovei L et al. Monthly oral ibandronate therapy in postmenopausal osteoporosis: 1‑year results from the MOBILE study. J Bone Miner Res 2005; 20 : 1315–1322.
28. Reginster JY, Adami S, Lakatos P et al. Efficacy and tolerability of once-monthly oral ibandronate in postmenopausal osteoporosis: 2 year results from the MOBILE study. Ann Rheum Dis 2006; 65 : 654–661.
29. Vyskočil V. Stroncium ranelát v léčbě osteoporózy. Farmakoterapie 2005; 5 : 425–457.
30. Vyskočil V. Osteoporóza a ostatní nejčastější metabolická onemocnění skeletu. Praha: Galén 2009.
31. Michalská D. Nové poznatky o léčbě osteoporózy. Interní Med 2009; 11 : 498–501.
32. Pluijm SMF, Smit JH, Tromp AM et al. Identifying community-dwelling elderly at high risk for recurrent falling. Results of a three year prospective study. In: Pluijm SMF. Predictors and Consequences of Falls and Fractures in the Elderly (PhD Thesis). Enschede: Ipskamp, 2001 : 91–108.
33. Siris ES, Chen YT, Abbott TA et al. Bone mineral density thresholds for pharmacological intervention to prevent fractures. Arch Intern Med 2004; 164 : 1108–1112.
34. Kurland ES, Cosman F, McMahon DJ at al. Parathyroid hormone as a therapy for idiopathic Osteoporosis in men: effects on bone mineral density and bone markers. J Clin Endocrinol Metab 2000; 85 : 3069–3076.
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Internal Medicine

2010 Issue 7
-
All articles in this issue
- Hyperlipoproteinemie a dyslipoproteinemie II. Terapie: Nefarmakologická a farmakologická léčba
- Chronická pankreatitida a skelet
- Nezbytnost soustavného rozvoje rozsáhlého systému péče o zdraví
- Elektrokardiografické markery u pacientov s hypertrofickou kardiomyopatiou
- Mezinárodní kurz NATO pro nácvik a výuku řešení situací s hromadným výskytem raněných
- 12 rokov kontinuálneho medicínskeho vzdelávania na Slovensku
- Hypofyzární adenomy – kam směřuje léčba na počátku 21. století?
- Kyselina oxalová – významný uremický toxín
- Vplyv testosterónu na kardiovaskulárne ochorenia u mužov
- Současné možnosti a principy patomorfologické diagnostiky nádorů
- Nátriuretické peptidy pri aortovej stenóze
- Kardiovaskulárne ochorenia u reumatoidnej artritídy
- Zásady péče o pacienty s intermitentními klaudikacemi
- Trnitá cesta metabolického syndromu prosadit se v praxi
- Diabetická osteopatie: onemocnění kdysi sporné a pravděpodobně významné
- Dočkáme se protinádorových vakcín?
- Současné možnosti léčby osteoporózy
- Laboratorní diagnostika a endokrinologie
- Infekcia parvovírusom B19 – príčina závažnej anémie po transplantácii obličky
- Přežití a kvalita života u popálenin
- Technika zaťažovania skeletu so spätnou väzbou v rehabilitácií osteoporotického pacienta (Biomechanická analýza)
- Index pevnosti femuru versus hustota kostného minerálu: nové poznatky (Slovenská epidemiologická štúdia)
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue
- Laboratorní diagnostika a endokrinologie
- Vplyv testosterónu na kardiovaskulárne ochorenia u mužov
- Infekcia parvovírusom B19 – príčina závažnej anémie po transplantácii obličky
- Chronická pankreatitida a skelet
