Použití kladribinu v první linii léčby multifokální anebo multiorgánové formy histiocytózy z Langerhansových buněk u dospělých osob
Cladribine as the first line treatment in multifocal or multiorgan Langerhans cell histiocytosis in adult patients
Introduction:
Vinblastin and prednisone are the traditional treatment choices in Langerhans cell histiocytosis (LCH). Cladribine has also been shown to be highly effective. It was originally used as the second and higher lines treatment and achieved high treatment response. The first report on excellent results achieved with cladribine as the first line treatment was published in 2003. Based on this report and our own experience with high efficacy of cladribine when administered as the second and higher line treatment, we use cladribine since 2003 not only for adult patients with relapsing multifocal or multiorgan form of LCH but also as part of the first line treatment of multifocal and multisystemic forms of LCH.
Patients and methodology:
Ten patients (9 men and 1 woman) have been treated with cladribine since 2001. Median age at diagnosis was 31.5 (5–45) years. The disease involved multiple organs in 8 patients and had an aggressive multifocal bone-involving form in 2 patients. Cladribine was administered in the dose of 5 mg/m2/day s.c. for 5 consecutive days in 28-day intervals. In 2 patients in whom the treatment was insufficient, the 3rd cycle of cladribine monotherapy was followed by a combination treatment with cladribine 5 mg/m2/day, cyclophosphamide 300 mg/day and dexamethasone 20 mg/day, all 1st–5th day. We planned a maximum of 6 cycles. Median of administered cladribine cycles was 5 (4–6).
Results:
In 2 patients, the disease had an aggressive character at the diagnosis, and thus a collection of haematopoietic stem cells from peripheral blood was performed before cladribine administration. In total, 9 patients have now completed their treatment and, of these, 8 (88%) are in complete remission. The treatment was ineffective in one patient only – it relapsed within 60 days from treatment completion. This patient received three cycles of the CHOEP regimen (cyclophosphamide, adriamycin, vincristine, etoposide and prednisone) and the treatment was completed with high-dose BEAM chemotherapy (carmustine, cytarabine, etoposide, melphalan). The patient has now been in complete remission for 5 months from the completion of the high-dose therapy. Treatment response was observed in all 3 patients with CNS involvement, in 2 patients with LHC focus in pituitary infundibulum and in 1 patient with LCH focus in temporal lobe.
Conclusion:
Cladribine is a suitable treatment modality for multiorgan and multifocal forms of LCH. Complete remission was achieved in 88% of the 9 evaluable patients. Treatment response was achieved in all three patients with CNS lesions. Addition of cyclophosphamide and dexamethasone after the 4th cycle improved treatment response in 2 patients, although this response was sustained on longer term basis in one patient only. Ascertaining the usefulness of adding cyclophosphamide and dexamethasone to cladribine in patients with LCH will require evaluation of this treatment on a larger sample of patients.
Key words:
cladribine – 2-chlorodeoxyadenosine – Langerhans cell histiocytosis – diabetes insipidus
Authors:
Z. Adam 1; P. Szturz 1; J. Ďuraš 2; Z. Řehák 3; R. Koukalová 3; L. Pour 1; M. Krejčí 1; M. Navrátil 1; Z. Adamová 4; R. Hájek 1; J. Mayer 1
Authors‘ workplace:
Interní hematoonkologická klinika Lékařské fakulty MU a FN Brno, pracoviště Bohunice, přednosta prof. MUDr. Jiří Mayer, CSc.
1; Oddělení klinické hematologie FN Ostrava, přednosta prim. MUDr. Jaroslav Gumulec, Ph. D.
2; Oddělení nukleární medicíny a pozitronové emisní tomografie Masarykova onkologického ústavu Brno, přednosta prim. MUDr. Karol Bolčák
3; Chirurgické oddělení Nemocnice Vsetín, přednosta prim. MUDr. Jaroslav Sankot
4
Published in:
Vnitř Lék 2010; 56(Supplementum 2): 141-151
Category:
Langerhans cell histiocytosis and some other Hematology rare diseases
Overview
Úvod:
Klasickými léky pro léčbu histiocytózy z Langerhansových buněk (LCH) je vinblastin a prednison. Velmi účinným lékem pro LCH je také kladribin. Zprvu byl používán v rámci léčby druhé a vyšší linie a dosahoval vysokého počtu léčebných odpovědí. Již v roce 2003 byla zveřejněna první zpráva o vynikajících výsledcích aplikace kladribinu v první léčebné linii. Na základě těchto zpráv a vlastních zkušeností s vysokou účinností kladribinu při jeho podání v druhé či vyšší léčebné linii používáme od roku 2003 kladribin nejen pro dospělé nemocné s relabující multifokální či multiorgánovou formou LCH, ale také v rámci léčby první linie multifokální a multisystémové formy LCH.
Pacienti a metodika:
Od roku 2001 jsme léčili kladribinem celkem 10 dospělých (9 mužů a 1 žena). Medián věku stanovení diagnózy je 31,5 (5–45) let. Choroba měla u 8 pacientů formu multiorgánového postižení a u 2 pacientů formu multifokální kostní formy s agresivním průběhem. Kladribin jsme podávali v dávce 5 mg/m2/den s.c. 5 dní po sobě ve 28denních intervalech. V případě nedostatečné účinnosti jsme u 2 nemocných po 3. cyklu kladribinu v monoterapii přešli na kombinovanou léčbu kladribin 5 mg/m2/den, cyklofosfamid 300 mg/den a dexametazon 20 mg/den, vše 1.–5. den. Maximálně jsme plánovali 6 cyklů. Medián podaných cyklů kladribinu byl 5 (4–6).
Výsledky:
Nemoc v době stanovení diagnózy jevila u 2 osob agresivní chování, a proto byl před podáním kladribinu proveden sběr kmenových krvetvorných buněk z periferní krve. Celkem 9 pacientů již ukončilo léčbu a z nich 8 (88 %) je v kompletní remisi. Pouze u jednoho pacienta byla léčba neúspěšná – nemoc progredovala do 60 dnů od ukončení léčby. U tohoto pacienta byly podány 3 cykly režimu CHOEP (cyklofosfamid, adriamycin, vinkristin, etoposid a prednison) a léčba byla zakončena vysokodávkovanou chemoterapií BEAM (carmustin, cytosinarabinosid, etoposid, melfalan). Pacient je 5 měsíců od vysokodávkované léčby v kompletní remisi. Léčebnou odpověď jsme pozorovali u všech 3 pacientů s postižením CNS, u 2 pacientů s ložiskem LCH v infundibulu hypofýzy a u 1 nemocné s ložiskem LCH v temporálním laloku.
Závěr:
Kladribin je vhodným lékem pro multiorgánové a multifokální formy LCH. V našem kolektivu 9 hodnotitelných nemocných dosáhla léčba kladribinem 88 % kompletních remisí. Tři pacienti měli postižení CNS a u všech 3 bylo dosaženo léčebné odpovědi. Přidání cyklofosfamidu a dexametazonu po 4. cyklu zlepšilo u 2 pacientů léčebnou odpověď, ale pouze u jednoho z nich byla dosažena dlouhodobá léčebná odpověď. Vyhodnocení přidání cyklofosfosfamidu a dexametazonu ke kladribinu u pacientů s LCH bude vyžadovat hodnocení této léčby ve větší skupině nemocných.
Klíčová slova:
kladribin – 2-chlorodeoxyadenosin – histiocytóza z Langerhansových buněk – diabetes insipidus
Úvod
Histiocytóza z Langerhansových buněk má velmi široké spektrum projevů, od jednoho osteolytického ložiska až po generalizovanou formu nemoci, postihující více orgánů. A stejně tak pestrý je průběh choroby, na jedné straně jsou případy se spontánními remisemi, na druhé straně případy s postupnou progresí nemoci, vedoucí ke smrti [1]. Ale i opakované relapsy, které neohrožují život nemocného, výrazně zhoršují jeho kvalitu [2].
U dětí jsou jasně definovány takzvané rizikové orgány, při jejichž postižení je prognóza nemoci nepříznivá a nemoc je často rezistentní na léčbu. Těmito rizikovými orgány u dětí jsou játra, slezina, plíce a kostní dřeň. U dětí dále platí, že při postižení obratlů, kostí tváře nebo kostí přední a střední jámy lební je zvýšené riziko postižení CNS, a to jak hypotalamu a hypofýzy, tak ostatního mozkového parenchymu [3].
U dospělých nemocných nebyly jednoznačně definovány orgány, při jejichž postižení by nemoc měla nepříznivý průběh. Prognostické ukazatele, ověřené v pediatrických kolektivech, nebyly u dospělých nemocných ověřeny pro vzácnost LCH s multiorgánovým postižením u osob starších 18 let. Nicméně i u dospělých osob s LCH platí, že multiorgánové postižení signalizuje méně příznivý průběh, než je obvyklý při postižení pouze jednoho orgánu či tkáně. Časná recidiva po léčbě signalizuje agresivní průběh choroby jak u dětí, tak u dospělých pacientů [1].
Léčebné postupy u dospělých se odvozují od zkušeností s léčbou dětských pacientů. Prvním úspěšným cytostatikem pro léčbu LCH byl vinblastin a své postavení „zlatého standardu“ pro léčbu LCH si stále ponechává. V rámci léčby první linie se kombinuje s prednisonem a případně s merkaptopurinem. Dlouhodobá léčba vinblastinem však přináší u dospělých určitá rizika. Limitujícím nežádoucím účinkem vinkristinu a vinblastinu je neuropatie. Neuropatie způsobuje nejen parestezie, ale může oblenit i peristaltiku, způsobit obstipaci a ta v případě divertikulózy sigmatu může způsobit další komplikace. Extrémní formou neuropatie, ke které může dojít při přehlédnutí varovných příznaků, je paralytický ileus. Dalším problémem při dlouhodobé léčbě vinblastinem a vinkristinem je vznik nekrózy při nechtěném úniku léčiva mimo žílu do podkoží (paravazace). Třetí nevýhodou léčby vinblastinem dle pediatrických protokolů je dlouhá doba léčby. Prednison, který se standardně podává v kombinaci s vinblastinem, může způsobit manifestaci diabetes mellitus.
Pro léčbu rezistentních či relabujících forem se od počátku 90. let minulého století používá kladribin. Vzhledem k velmi dobré toleranci a velmi vysoké účinnosti jej někteří autoři začali používat jako lék prvé volby pro multifokální či multiorgánové formy nemoci. Publikované zprávy, popisující velmi dobrý účinek při minimu nežádoucích účinků, nás vedly k tomu, že u dospělých nemocných tento lék používáme pro léčbu multifokální a multiorgánové formy LCH jak v rámci iniciální léčby, tak v rámci léčby relapsu. V následujícím textu shrnujeme naše zkušenosti s touto léčbou.
Soubor pacientů a léčba
Soubor pacientů
Léčbu kladribinem absolvovalo celkem 10 pacientů (9 mužů a 1 žena). Pouze u jednoho nemocného byla diagnóza LCH stanovena v dětství, v 5 letech, u ostatních byla diagnóza LCH stanovena v dospělosti.
Medián věku stanovení diagnózy celého souboru je 31,5 (5–45 let) let. Medián věku stanovení diagnózy u 9 pacientů, u nichž byla choroba diagnostikována v dospělém věku, je 34 (21–45) let.
U 2 z 10 pacientů byl postižen pouze skelet, u ostatních 8 pacientů bylo postiženo více orgánů či tkání (multiorgánová forma LCH).
U 1. pacienta s multifokální kostní formou nemoci byl ihned při stanovení diagnózy zřetelný agresivní průběh. Masy LCH expandovaly z okcipitální kosti intrakraniálně a komprimovaly okcipitální lalok, což vedlo k výpadům zrakového pole. U tohoto pacienta byl postižen masivně femur, obratle a také měl mnohočetné postižení kostí obličejové i mozkové části kalvy. U 2. pacienta s multifokální kostní formou LCH se také jednalo o mnohočetné postižení skeletu i s postižením obratlů, žeber a kalvy. Rozsah nemoci při zahájení léčby kladribinem ukazuje tab. 1. Z hlediska frekvence orgánové lokalizace bylo přítomno:
- postižení kostí u 7 (70 %),
- postižení plic u 6 (60 %),
- postižení kůže u 4 (40 %), z toho u 3 pacientů se jednalo o postižení kůže v oblasti anogenitální a 2 v oblasti zapářkových lokalizací, axilly, třísla, pod prsy,
- postižení hypotalamo-hypofyzární osy s diabetes insipidus u 4 (40 %) pacientů,
- infiltrace v oblasti zevního ucha (otitis externa) u 3 (30 %) pacientů, ve 2 případech s destrukcí kostních struktur spánkové kosti,
- infiltrát LCH v mozku mimo hypotalamu-hypofyzární osu u 1 (10 %) pacienta,
- intrakraniální expanze z kostního ložiska s neurologickými příznaky u 1 (10 %) pacienta,
- infiltrace jater u 1 (10 %) pacienta,
- mnohočetné postižení lymfatických uzlin u 1 (10 %) pacienta.
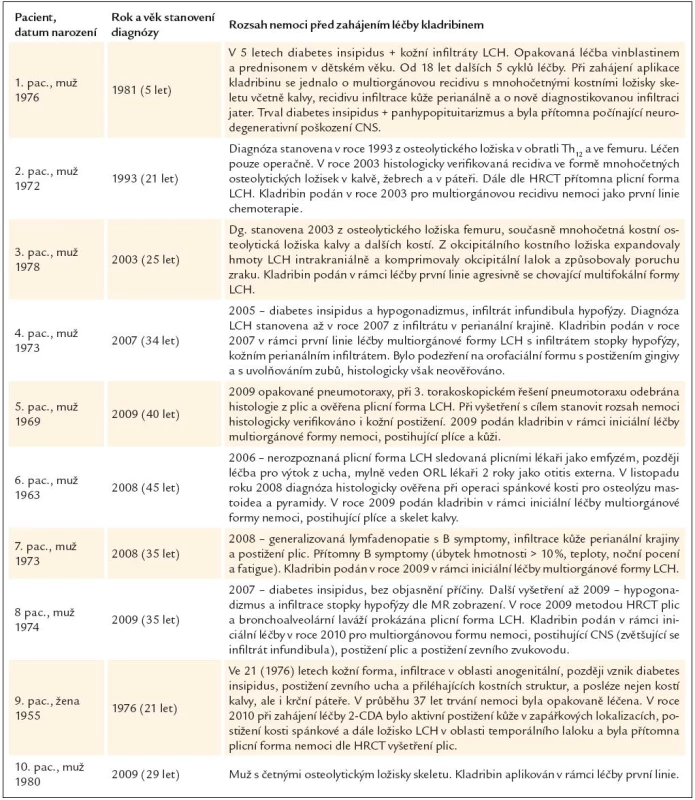
U 8 z 10 pacientů byl kladribin použit jako chemoterapie první linie. U 2 pacientů předcházel léčbě kladribinem několik desetiletí trvající průběh nemoci s opakovanými atakami nemoci, které byly léčeny chemoterapií (vinblastin a prednison a také etoposid) a radioterapií.
Léčba
Všichni uvedení pacienti byli léčeni 2-chlorodeoxyadenosinem (kladribinem) v dávce 5 mg/m2/den, 5 dní po sobě. První pacient dostal tuto léčbu ve formě nitrožilních infuzí, ostatní nemocní pak ve formě podkožních injekcí. Tyto cykly se opakovaly v měsíčních intervalech, maximálně 6krát. Medián počtu aplikovaných cyklů chemoterapie byl 5 (4–6). Vyhodnocení účinnosti léčby jsme prováděli po 2. a 3. cyklu.
Ve 2 případech, kdy nemoc měla známky rychlého a velmi agresivního průběhu, jsme před aplikací kladribinu provedli sběr kmenových krvetvorných buněk a jejich zamražení pro pozdější případné použití. Vzhledem k tomu, že pro dospělé pacienty nebyly definovány prognostické ukazatele, záviselo rozhodnutí o provedení sběru PBSC od posouzení agresivity nemoci ošetřujícím lékařem. Přihlíželi jsme k rychlosti nástupu příznaků, masivnosti postižení, k případné extramedulární propagaci původně na kost limitované nemoci, k rozsahu multiorgánového postižení a k přítomnosti B symptomů (úbytek hmotnosti větší než 10 % za 6 měsíců, subfebrilie či febrilie, noční pocení).
Před sběrem kmenových buněk krvetvorby z periferní krve jsme podávali stimulační režim (cyklofosfamid 2 g/m2 den 1 s aplikací mesny, etoposid 200 mg/m2 den 1.–3.) a leukocytární růstový faktor G-CSF (filgrastim) v dávce 10 µg/kg/den, rozdělené do 2 denních dávek od 3. dne po ukončení chemoterapie až do ukončení sběru kmenových krvetvorných buněk.
Pro vysokodávkovanou chemoterapii jsme použili režim BEAM v následujících dávkách: carmustin, čili BCNU 300 mg/m2 i.v. infuzi den –7, cytosinarabinosid 200 mg/m2/den rozdělený do 2 denních dávek podávaných v 3hodinové i.v. infuzi, etoposid 200 mg/m2/den –6 až –3, melfalan 140 mg/m2 podávaný den –2. V den označený jako 0 se podává transplantát krvetvorných buněk.
Ve 2 případech jsme ke kladribinu při nedostatečném efektu prvních 3 cyklů léčby přidali dexametazon 20 mg/den a cyklofosfamid 300 mg/den, vše po dobu 3–5 dnů.
Výsledky léčby
Léčebný efekt jsme u všech pacientů hodnotili na základě výsledků PET a později PET-CT vyšetření. Prováděli jsme i další zobrazovací vyšetření (RTG snímky skeletu, scintigrafii skeletu, funkční plicní testy a endokrinologické testy), ale základem pro hodnocení efektu léčby byla pozitronová emisní tomografie.
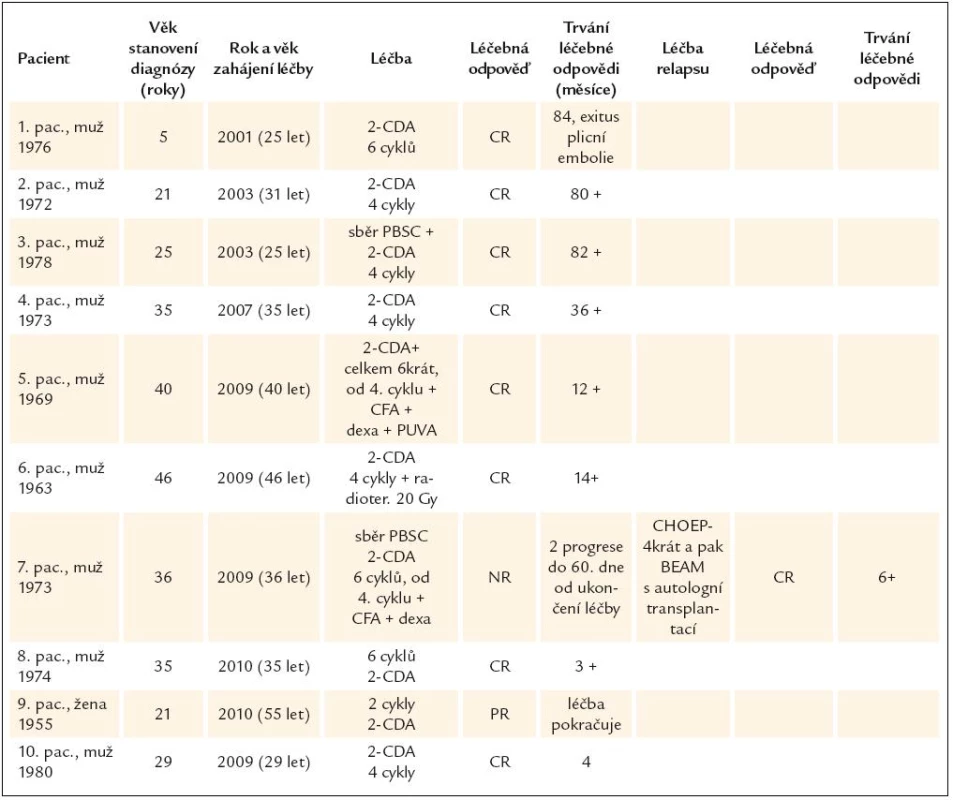
Z popisovaného souboru 10 nemocných zemřel pouze 1 pacient 84 měsíců od ukončení léčby kladribinem. U pacienta sice progredovaly pozdní neurodegenerativní změny CNS, které jej invalidizovaly tak, že nebyl schopen chůze, ale při kontrolních vyšetřeních jsme neprokázali recidivu nemoci. Pacient zemřel na plicní embolii bez prokazatelné recidivy nemoci. Ostatních 9 pacientů žije s mediánem sledování 14 měsíců (4–82).
Toho času léčbu dokončilo 9 pacientů. Ihned po ukončení léčby kladribinem jsme dosáhli u všech pacientů vymizení symptomů nemoci, nicméně u 1 pacienta nemoc relabovala již po 8 týdnech od ukončení chemoterapie, takže jsme nedosáhli klinicky relevantní odpovědi. Klinicky relevantní léčebnou odpověď hodnocenou jako CR, ověřenou PET-CT vyšetřením, dosáhlo 8 ze 9 pacientů, kteří již dokončili léčbu (88 %).
Za klinicky relevantní léčebnou odpověď typu kompletní remise považujeme naprosté vymizení symptomů aktivy nemoci, potvrzené negativitou PET-CT vyšetření, trvající nejméně 60 dní. Časové kritérium trvání léčebné odpovědi (trvání nejméně 60 dní od ukončení léčby) bylo nedávno zavedeno pro hodnocení léčebné odpovědi u mnohočetného myelomu a my je aplikujeme i na LCH.
U jedné nemocné, která má za sebou pouze 3 cykly chemoterapie, zatím můžeme dosaženou léčebnou odpověď definitivně vyhodnotit. Po 2. cyklu kladribinu bylo u této nemocné provedeno kontrolní PET-CT vyšetření. V ložisku LCH v temporálním laloku poklesla akumulace fluorodeoxyglukózy o více než o50 % (SUV pokleslo z 12,53 na 5,71), takže dosaženou léčebnou odpověď hodnotíme jako parciální remisi.
Pouze u 1 nemocného nebylo dosaženo klinicky relevantní léčebné odpovědi kladribinem, ke kterému byl od 4. cyklu přidán cyklofosfamid a dexametazon. Nemoc do 8 týdnů od ukončení 6. cyklu chemoterapie prudce relabovala, a to ve všech původních lokalizacích: lymfatických uzlinách, plicích, perianální kůži. Navíc přibylo postižení kostí, které předtím nebylo detekováno. Obnovily se B symptomy.
Tento pacient dostal 4 cykly CHOEP režimu (cyklofosfamid, adriamycin, vinkristin, etoposid a prednison), léčebná odpověď byla potvrzena po 2. cyklu kontrolním PET-CT vyšetřením. V březnu roku 2010 byla provedena vysokodávkovaná chemoterapie BEAM (carmustin, cytosinarabinosid, etoposid, melfalan) s autologní transplantací. Kontrolní PET-CT vyšetření bylo provedeno v červenci roku 2010. V CT obraze byla popsána částečná regrese změn v plicním parenchymu. Vymizely minule popisované prstenčité opacity, ubylo miliárních modularit a v kostních defektech byla v CT obraze zřetelná rekalcinace čili proces hojení. V PET zobrazení nebyla žádná patologická akumulace fluorodeoxyglukózy. Efekt léčby hodnotíme také jako kompletní remisi.
Hodnocení přechodu z monoterapie kladribinem na kombinaci kladribinu, cyklofosfamidu a dexametazonu
Pouze u 2 pacientů jsme přešli po 3 cyklech kladribinu v monoterapii na kombinaci kladribinu (5 mg/m2/den s.c. 3–5 dní po sobě) s cyklofosfamidem (300 mg celková dávka/den 3–5 dní po sobě) a dexametazonem (20 mg/den 3–5 dní po sobě). U prvního z nich (pacient č. 5, plicní forma a kožní forma) se kožní projevy po prvních 3 cyklech jen částečně zmenšily, ale nevymizely, proto jsme od 4. cyklu přidali cyklofosfamid a dexametazon a aplikovali další 3 cykly této trojkombinace. Po 5. cyklu jsme začali léčit kožní projevy metodou PUVA, protože po 2 cyklech uvedené trojkombinace stále byly drobné kožní morfy patrné. Po ukončení chemoterapie a léčby PUVA kožní projevy vymizely.
U druhého z nich (pacienta č. 7, uzlinová forma B příznaky + kožní forma+ plicní forma) jsme pozorovali po počáteční léčebné odpovědi stabilní stav bez prohlubování léčebné odpovědi po 2. a 3. cyklu kladribinu v monoterapii. Proto jsme od 4. cyklu podali kladribin ve výše uvedené kombinaci. Po této změně došlo k výraznému zmenšení uzlin, takže v době ukončení posledního cyklu dle klinického i sonografického vyšetření bychom mohli odpověď hodnotit jako kompletní remisi. Nicméně již 8. týden od ukončení chemoterapie PET-CT kontrola i klinický stav signalizoval progresi nemoci, takže výsledek léčby hodnotíme tak, že nebylo dosaženo klinicky relevantní léčebné odpovědi.
Tolerance léčby a nežádoucí účinky
Kladribin má výrazný imunosupresivní účinek. Přesto jsme v celém souboru v průběhu léčby zaznamenali pouze jednu infekční komplikaci (pneumonii v terénu plíce postižené LCH) vyžadující hospitalizaci a 2 infekce horních dýchacích cest, které byly zvládnuty ambulantní antibiotickou léčbou.
Tolerance kladribinu podávaného v monoterapii byla velmi dobrá. Lokální aplikace kladribinu byla tolerována bez nežádoucích účinků a žádný z pacientů, kteří byli léčeni pouze kladribinem, neměl neutropenii či trombocytopenii III. nebo IV. stupně dle WHO klasifikace nežádoucích účinků.
V případě použití kombinace kladribinu s cyklofosfamidem a dexametazonem jsme při kontrole krevního obrazu 14 dní od ukončení léčby zaznamenali neutropenii III. stupně, která však byla dočasná a nevedla ke změně léčebného plánu.
Výsledky léčby shrnuje tab. 2.
Diskuze
Základní farmakologické informace o 2-chlorodeoxyadenosinu (kladribinu)
Kladribin (synonymem 2-chlorodeoxy-adenosin) se dostal do klinické praxe počátkem 90. let minulého století. Kladribin je derivát adenosinu, u něhož na druhém uhlíku purinového kruhu byl vodík substituován chlórem. Tato změna je dostatečná, aby zabránila deaminaci 2-chlorodeoxyadenosinu. Kladribin je v buňce metabolizován a fosforylován až na 2-chlorodeoxyadenosintrifosfát, který je vlastní účinnou formou léku. Akumulace chlorodeoxyadenosintrifosfátu je největší v buňkách, jejichž aktivační (fosforylační) enzym, deoxycytidinkináza, má největší aktivitu, zatímco inaktivační (defosforylační) enzym, cytoplazmatická 5-nukleotidáza, má nejmenší aktivitu. Velmi příznivý poměr uvedených dvou enzymů pro účinnost kladribinu je v klidových a proliferujících lymfocytech, monocytech, v histiocytech a také v Langerhansových buňkách. V nich dosahují nitrobuněčné koncentrace 2-chlorodeoxyadenosintrifosfátů několiksetkrát vyšší hladiny, než je jeho plazmatická koncentrace [4,5]. Díky této vlastnosti je kladribin vysoce selektivním cytostatikem, má intenzivní cytotoxický účinek na pomalu progredující maligní lymfatické a histiocytární (tedy i Langerhansovy) buňky. V buňkách ostatních tkání je akumulace 2-chlorodeoxyadenosintrifosfátu malá, takže na ně cytotoxicky nepůsobí. Kladribin proniká v účinné dávce do CNS, intratekální koncentrace kladribinu dosahuje 25 % plazmatické koncentrace, což je dostačující hladina pro tumoricidní efekt na granulomy tvořené Langerhansovými buňkami, protože, jak výše uvedeno, tumoricidní účinek se odvíjí od nitrobuněčné koncentrace 2-chlorodeoxyadenosintrifosfátu a ta závisí hlavně na poměru aktivujícího a deaktivujícího enzymu. A u Langerhansových buněk je tento poměr vysoký, takže koncentrace kladribinu, dosahovaná v mozkomíšním moku po i. v. či s. c. podání, je účinná na mozkové formy LCH [5]. Biologická dostupnost podkožní aplikace je 100%, takže je možné jak nitrožilní, tak podkožní podání. Farmakologické vlastnosti kladribinu (100% resorpce z podkoží, několikasetnásobná akumulace v cílových senzitivních buňkách a 15–30hodinový intracelulární poločas) umožňují aplikaci formou podkožních injekcí. Na 2 pracovištích bylo prokázáno, že plochy pod křivkou průběhu plazmatické koncentrace v čase (AUC-area under curve) jsou shodné při aplikaci formou kontinuální infuze či podkožní injekce, liší se však průběh křivky v čase [6–8].
Kladribin má své standardní místo v léčbě vlasatobuněčné leukemie a Waldenströmovy makroglobulinemie. Používá se také pro léčbu chronické lymfatické leukemie, protože jeho účinek je shodný s fludarabinem, byť více klinických studií testovalo v této indikaci fludarabin [9]. Od roku 1993 je známo, že je účinným lékem i pro LCH.
Publikované zkušenosti s kladribinem u LCH
U dětí byla léčba LCH ověřena klinickými studiemi a z nich jsou odvozena také léčebná doporučení pro dospělé, jejich přehled uvádí [3,10]. Klasické pediatrické léčebné protokoly jsou založeny na vinblastinu, prednisonu, merkaptopurinu. Dalšími účinnými medikamenty pro léčbu LCH jsou etoposid a metotrexát, oba však mají intenzivnější nežádoucí účinky než vinblastin, a proto vinblastinové režimy zůstávají zlatým standardem pro léčbu LCH.
Léčba dle těchto pediatrických protokolů trvá dlouho, může trvat až rok. Při jejich použití u dospělých bývá často závažným problémem neurotoxicita vinblastinu, v případě aplikace mimo žílu komplikace způsobené paravazací. Nepřehlédnutelným problémem jsou komplikace způsobené dlouhodobým podáváním kortikoidů (diabetes mellitus, trombózy apod.).
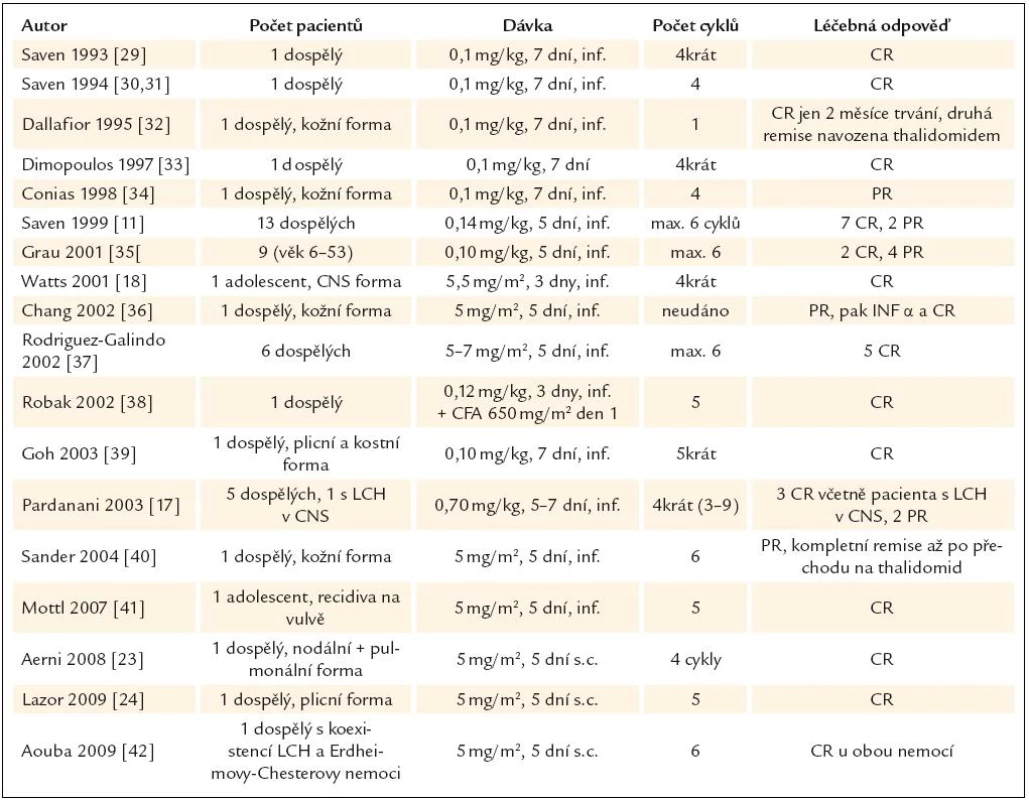
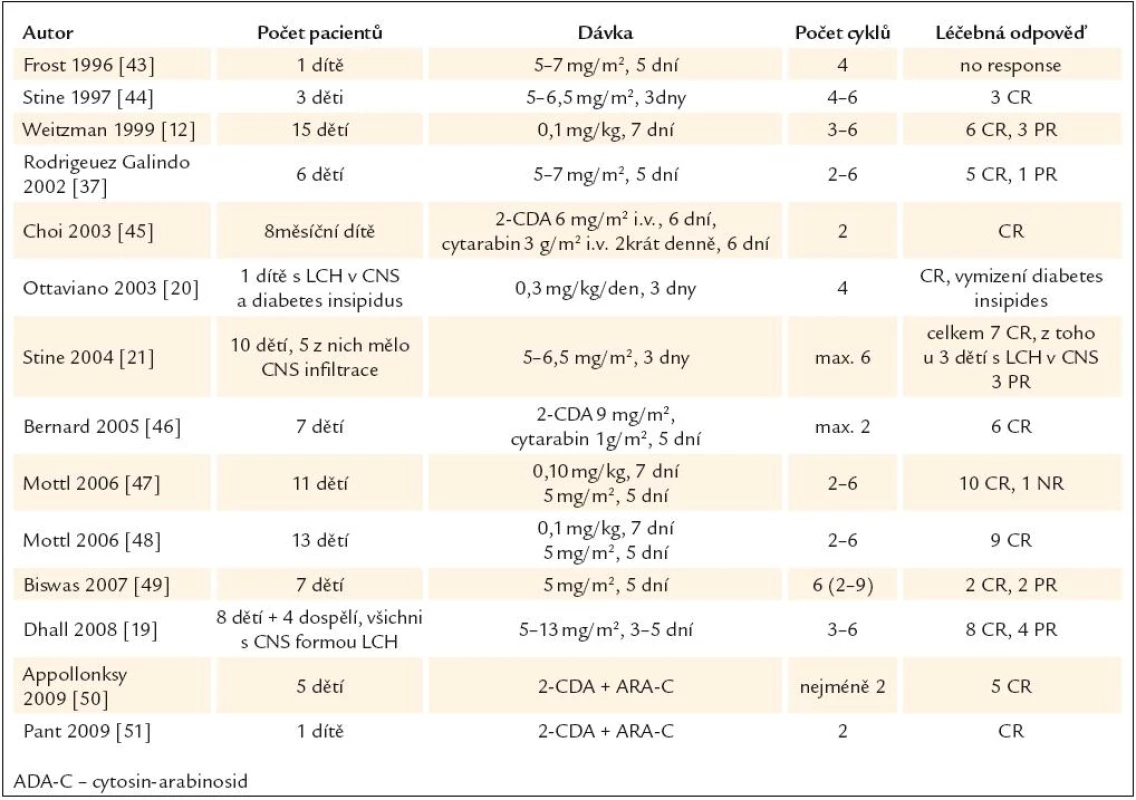
Od roku 1993 se objevují četné zprávy o výborné účinnosti kladribinu u LCH, obvykle ve formě popisu případu. V prvních publikovaných případech byl kladribin použit v rámci léčby druhé či vyšší linie. Přehled publikovaných zkušeností s kladribinem u pacientů s LCH uvádíme v tab. 3 a 4. V literatuře jsme našli pouze 4 publikace, které popisují zkušenosti s kladribinem u nejméně 10 pacientů, a z nich jsme vybrali nejdůležitější fakta.
Zkušenosti ze Scripps Clinic v USA
První prací s počtem pacientů nad 10 jsou zkušenosti ze Scripps Clinic. Tato práce hodnotí léčbu celkem 13 dospělých pacientů s LCH pomocí kladribinu, podávaného v dávce 0,14 mg/kg ve 2hodinových infuzích po dobu 5 dnů ve 4týdenních intervalech. Medián počtu aplikovaných cyklů pro dosažení CR byl 3 (1–6). U 7 (58 %) z 12 hodnotitelných nemocných bylo dosaženo kompletní remise a 2 (17 %) pacienti dosáhli parciální remise při nezávažných nežádoucích účincích [11].
Shrnutí publikovaných zkušeností Scheilou Weitzman
V roce 1999 shrnula Sheila Weitzman v kritickém přehledu publikované zkušenosti. V té době měla k dispozici zprávy od 23 pacientů léčených kladribinem a od 4 pacientů léčených 2-deoxycoformycinem. Věk těchto pacientů se pohyboval od 2 měsíců do 49 let. Konstatovala, že nejčastěji byla použita dávka 0,1 mg/kg v infuzi po dobu 5–7 dnů. Maximální použitá dávka byla 13 mg/m2/den 5 dní po sobě, počet aplikovaných cyklů se pohyboval mezi 1 a 6. Dosaženo bylo 13 kompletních remisí u 23 pacientů léčených kladribinem. U 4 pacientů léčených deoxycoformicinem bylo dosaženo 2 kompletních a 2 parciálních remisí. Nežádoucí účinky byly zanedbatelné, a tak v závěru svého přehledu doporučuje tuto léčbu [12].
Japonská retrospektivní studie
Podobné retrospektivní shrnutí zkušeností z Japonska se objevilo až v roce 2010. Autoři shrnuli zprávy od 17 dětí, které byly léčeny kladribinem v dávce 4–9 mg/m2/den, 2–5 dní po sobě. U 9 dětí byla nemoc hodnocena jako riziková (postižení alespoň jednoho rizikového orgánu) a z těchto 9 dětí byla léčebná odpověď dosažena u 5. Celkem 8 dětí mělo multisystémovou formu LCH, ale bez postižení rizikových orgánů. V této podskupině bylo zaznamenáno 5 léčebných odpovědí [13].
Prospektivní studie Mezinárodní společností pro studium histiocytárních chorob
Aplikaci 2-CDA (5 mg/m2 2 hod infuze) u pacientů s LCH hodnotí pouze jedna prospektivní multicentrická studie, organizovaná Mezinárodní společností pro studium histiocytárních chorob (Hystiocyte Society), do níž bylo zařazeno 92 dětí s rezistentní či relabující formou LCH. V rámci hodnocení léčebné odpovědi byly děti rozděleny do skupiny s vysokým a s nízkým rizikem. Ve skupině s vysokým rizikem bylo přítomno postižení alespoň jednoho rizikového orgánu, mezi něž u dětí patří plíce, játra, slezina a hematopoietický systém. Ve skupině s nízkým rizikem nebyl postižen žádný rizikový orgán.
U nízce rizikové skupiny bylo popsáno 62 % léčebných odpovědí. Ve vysoce rizikové skupině byla léčebná odpověď zaznamenána pouze u 22 % léčených [14].
Z těchto větších souborů a z menších studií lze usoudit, že kladribin je pro nemocné s LCH velmi účinným lékem, zvláště pro méně agresivní formy.
Ostatní purinová analoga
Zcela ojedinělé jsou zprávy popisující účinek clofarabinu [15] a 2-deoxycoformycinu [16].
Kladribin podávaný v rámci první linie léčby
U dospělých pacientů s LCH nelze léčbu odvozovat od randomizovaných klinických studií, protože u dospělých nebyla ani jedna studie dokončena. Studie, která měla za cíl ověřit účinek vinblastinu u dospělých, nebyla uskutečněna, snad pro problémy s nežádoucími účinky tohoto léku. Proto se léčba dospělých odvíjí od zkušeností získaných v pediatrických studiích a dále od publikovaných popisů jednotlivých případů či menších souborů nemocných.
Vysoce pozitivní zkušenosti s kladribinem a známé nežádoucí účinky vinblastinu vedly lékaře na Mayo Clinic USA k jeho použití v rámci léčby první linie. Jejich publikace z roku 2003 jako první popisuje účinnost kladribinu aplikovaného u dospělých pacientů s LCH v rámci léčby první linie [17].
Na základě excelentních publikovaných zkušeností s kladribinem použitým pro léčbu prvé linie anebo pro léčbu recidivy LCH jsme přikročili k léčbě kladribinem v rámci iniciální léčby multiorgánové či multifokální formy LCH.
V našem souboru 10 pacientů je zatím pouze 9 hodnotitelných, z nichž u 8 (88 %) byla dosažena kompletní remise nemoci, pouze u 1 pacienta, u něhož byl kladribin použit v rámci první linie, byla nemoc na tuto léčbu rezistentní.
Zkušenosti s aplikací kladribinu při mozkové formě LCH
Kladribin je považován za nejvhodnější lék při postižení mozku LCH. Z léků, které působí na tuto nemoc, dosahuje nejvyšších intratekálních koncentrací, proto je pro tuto podskupinu nemocných považován za optimální lék. Jeho účinnost potvrzují i četné popisy případů, u nichž léčba vedla k vymizení LCH ložiska v mozku [17–21]. Ottaviano v roce 2003 dokonce popsal reverzibilitu diabetes insipidus při časně zahájené léčbě infiltrátu v oblasti hypotalamo-hypofyzární [20]. Velmi dobrý efekt kladribinu byl popsán i u dalšího histiocytárního onemocnění postihujícího CNS, u juvenilní xantogranulomatózy v CNS [22].
V našem souboru jsme postižení mozku některou z forem LCH pozorovali celkem 4krát, v jednom případě šlo o diabetes insipidus diagnostikovaný již v dětství, zde jsme již v dospělosti oblast hypofýzy a hypotalamu nevyšetřovali. U 3 našich pacientů byl v dospělosti diagnostikován diabetes insipidus s infiltrací stopky hypotalamu. U jednoho z nich došlo k úplnému vymizení infiltrátu a vymizení tohoto infiltrátu trvá na kontrolním MR zobrazení i po 3 letech. U druhého z nich došlo k výrazné regresi velikosti infiltrátu na reziduální zastínění již po 4. cyklu kladribinu v monoterapii.
U 9. pacientky, která zatím dokončila pouze 3. cyklus chemoterapie, byla na kontrolním PET-CT vyšetření, provedeném po 2. cyklu chemoterapie, snížena akumulace fluorodeoxyglukózy o více než o 50 %, což svědčí pro dobrou léčebnou odpověď. Takže naše zkušenosti potvrzují účinek kladribinu na mozkovou formu LCH.
Zkušenosti s aplikací kladribinu u pacientů s plicní formou LCH
Izolovaná plicní forma LCH se obvykle vyskytuje pouze u kuřáků a její průběh, pokud se podaří překonat závislost na cigaretách a ukončit kouření, bývá příznivý. V případě, že plicní postižení je součástí multiorgánového poškození, je spontánní vymizení aktivity nemoci po ukončení kouření málo pravděpodobné. Klasicky se používají kortikoidy, případně vinblastin. V literatuře však byla na více případech dokumentována účinnost kladribinu u pacientů s plicní formou postižení [23,24]. Také u našich pacientů s plicním postižením při multiorgánové formě LCH jsme pozorovali léčebnou odpověď, dokumentovanou PET-CT a HRCT vyšetřením.
Kombinace kladribinu s dalšími léky při léčbě LCH
Počet informací o potenciaci kladribinu kombinací s jiným lékem je malý. Pilotní studie (10 dětí) testovala léčebný protokol pro děti, který obsahoval 9 mg/m2/den kladribinu 5 dní po sobě a 1 000 mg/m2/den cytosinarabinosidu 5 dní po sobě. Medián věku v době stanovení diagnózy byl 0,5 roku. U 7 nemocných, kteří dostali alespoň 2 cykly této léčby, poklesla aktivita nemoci. Tento léčebný protokol je zatížený závažnou neutropenií, takže není divu, že 2 děti zemřely na septický šok. Zda kombinace kladribinu s cytosinarabinosidem bude úspěšná a jaké dávky budou optimální, to ukážou teprve další studie.
Účinek adenozinových analog je potencován alkylačními cytostatiky, alkylační cytostatika poškozují nukleovou kyselinu a adenozinová analoga blokují opravu těchto poškození. Proto u nízce agresivních lymfoproliferativních onemocnění dosáhla kombinace adenozinového analoga a alkylačního cytostatika vyšší počet léčebných odpovědí než adenozinové analogum v monoterapii. Proto Robak et al použil tuto léčbu také u dospělé pacientky s velmi agresivní formou LCH, postihující játra, slezinu a břišní lymfatické uzliny. Onemocnění bylo refrakterní na vinblastin a uvedenou kombinací bylo dosaženo kompletní remise [25].
Kombinace purinových analog a alkylačních cytostatik má však své limity, v závislosti na dávce byl po této léčbě u nízce agresivních lymfoproliferací popsán vyšší výskyt myelodysplastického syndromu a akutních leukemií [26–28].
V našem souboru jsme vždy po ukončení 3 cyklů léčby vyhodnotili dosažený efekt a při malé léčebné odpovědi jsme přidali cyklofosfamid a dexametazon. V 1. případě po přidání cyklofosfamidu došlo k dalšímu výraznému ústupu kožních změn, nicméně úplné vymizení bylo dosaženo až po zapojení PUVA terapie do léčebného postupu. V 2. případě se po přidání cyklofosfamidu výrazně zmenšila lymfadenopatie, nicméně do 8 týdnů od poslední léčby došlo k recidivě. Naše zkušenosti jsou tedy velmi limitované, omezené počtem 2 pacientů. Je možné, že kombinace s kortikoidy a dexametazonem zvýší počet léčebných odpovědí, zřejmě díky dexametazonu, obsaženém v protokolu, je léčebná odpověď zřetelnější, ale neprokázali jsme, že by přidání cyklofosfamidu a dexametazonu k monoterapii kladribinem zásadním způsobem změnilo průběh léčby. Zde jen připomeneme zkušenosti u lymfoproliferativních chorob, u nichž zvýšení počtu léčebných odpovědí nemusí vždy přinést odpovídající prodloužení celkového přežití [52–57].
A co když je nemoc na kladribin rezistentní
Kladribin je excelentní lék, ale jak z výše uvedeného přehledu vyplývá, tak počet léčebných odpovědí je podstatně lepší ve skupině s nižším rizikem než u pacientů s vysokým rizikem. V našem souboru jsme se v 1 případě velmi agresivní formy LCH (vysoký proliferační index) setkali s rezistencí na kladribin i na kladribin kombinovaný s cyklofosfamidem a dexametazonem. Za 2 měsíce po ukončení léčby nemoc u tohoto muže recidivovala. Zvolili jsme proto etoposid obsahující režim (CHOEP). Na tento režim nemoc dle průběžného PET-CT hodnocení velmi dobře reagovala. Léčbu jsme zakončili vysokodávkovanou chemoterapií BEAM. Tento pacient je 6 měsíců od ukončení léčby v kompletní remisi dle PET-CT vyšetření.
V odborné literatuře je popsán případ 53letého pacienta se sarkomem z Langerhansových buněk, který progredoval při léčbě CHOP (cyklofosfamid adriamycin, vinkristin a prednison) a který dosáhl léčebnou odpověď při změně na režim ESHAP (etoposid, carboplatina, cytosin-arabinosid, metylprednisolon) [28]. Domníváme se, že v případech rezistentních na kladribin je vhodné vyzkoušet některý z intenzivních chemoterapeutických režimů pro maligní lymfomy, obsahující etoposid, např. režim CHOEP nebo režim ESHAP.
Protože kladribin je při dlouhodobějším podávání myelosupresivní, je žádoucí se již v průběhu léčby kladribinem přesvědčit, zda nemoc na tuto léčbu reaguje, a v případě, že po 2–3 cyklech není žádná léčebná odpověď a neobjeví se ani po 4. cyklu, tak již další kladribin nepodávat a včas změnit léčbu.
Závěry pro praxi
- Klasickým lékem pro multifokální formu a multiorgánovou formu LCH je vinblastin a prednison [58]. Alternativu představuje kladribin v monoterapii, aplikovaný maximálně v 6 cyklech. V dávce 5 mg/m2/den s.c. 5 dní po sobě v měsíčních intervalech je tato léčba velmi dobře tolerována.
- Cyklofosfamid a dexametazon potencují účinek kladribinu při léčbě nízce agresivních lymfoproliferativních onemocnění, zdá se, že to platí i pro léčbu LCH u dospělých. Tato léčba je však zatím u dospělých velmi málo prozkoumána. Zkušenosti získané u lymfoproliferativních onemocnění však hovoří o podstatně vyšším počtu pozdních nežádoucích účinků typu sekundárního MDS.
- V případě neúspěchu kladribinu se nám osvědčily léčebné postupy obvyklé při léčbě maligních lymfomů obsahující etoposid, zakončené případně vysokodávkovanou chemoterapií s autologní transplantací.
Tato publikace byla připravena v rámci projeku MUNI/A/1012/2009 s názvem „Optimalizace diagnostiky a terapie maligních chorob a komplikací, které tyto maligní nemoci provázejí, s využitím nových molekulárně biologických metod“, a také je součástí aktivit v rámci grantů IGA MZ: NR9225, NS10387 a NS10406.
prof. MUDr. Zdeněk Adam, CSc.
www.fnbrno.cz
e-mail: z.adam@fnbrno.cz
Doručeno do redakce: 9. 9. 2010
Sources
1. Aricò M, Girschikofsky M, Généreau T et al. Langerhans cell histiocytosis in adults. Report from the International Registry of the Histiocyte Society. Eur J Cancer 2003; 39 : 2341–2348.
2. Haupt R, Nanduri V, Calevo MG et al. Permanent consequences in Langerhans cell histiocytosis patients: a pilot study from the Histiocyte Society-Late Effect Study Group. Pediatr Blood Cancer 2004; 42 : 438–444.
3. Allen CE, McClain KL. Langerhans cell histiocytosis: a review of past, current and future therapies. Drugs Today (Barc) 2007; 43 : 627–643.
4. Carrera CJ, Terai C, Piro LD et al. Potent toxicity of 2-chlorodeoxyadenosine toward human monocytes in vitro and in vivo. A novel approach to immunosuppressive therapy. J Clin Invest 1996; 86 : 1480–1488.
5. Liliemark J. The clinical pharmacokinetics of cladribine. Clin Pharmacokinet 1997; 32 : 120–131.
6. Bryson MH, Sorkin EM. Cladribine: a review of its pharmacodynamic and pharmacokinetic properties and therapeutic potential in haematological malignancies. Drugs 1993; 46 : 872–894.
7. Liliemark J, Albertoni F, Hassan M et al. On the bioavailability of oral and subcutaneous 2-chloro-2’-deoxadenosine in humans: alternative routes of administration. J Clin Oncol 1992; 10 : 1514–1518.
8. Robak T, Lech-Maranda E, Korycka A et al. Purine nucleoside analogs as immunosuppressive and antineoplastic agents: mechanism of action and clinical activity. Curr Med Chem 2006; 13 : 3165–3189.
9. Adam Z. Hematologické choroby nízkého stupně malignity. Standardní léčebné postupy a zhodnocení účinnosti 2-chlorodeoxyadenosinu. Brno: Lékařská fakulta MU 1998.
10. McClain KL. Drug therapy for the treatment of Langerhans cell histiocytosis. Expert Opin Pharmacother 2005; 6 : 2435–2441.
11. Saven A, Burian C. Cladribine activity in adult Langerhans-cell histiocytosis. Blood 1999; 93 : 4125–4130.
12. Weitzman S, Wayne AS, Arceci R at al. Nucleoside analogues in the therapy of Langerhans cell histiocytosis: a survey of members of the histiocyte society and review of the literature. Med Pediatr Oncol 1999; 33 : 476–481.
13. Imamura T, Sato T, Shiota Y et al. Outcome of pediatric patients with Langerhans cell histiocytosis treated with 2 chlorodeoxyadenosine: a nationwide survey in Japan. Int J Hematol 2010; 91 : 646–651.
14. Weitzman S, Braier J, Donadieu J et al. 2’-Chlorodeoxyadenosine (2-CDA) as salvage therapy for Langerhans cell histiocytosis (LCH). Results of the LCH-S-98 protocol of the Histiocyte Society. Pediatr Blood Cancer 2009; 53 : 1271–1276.
15. Rodriguez-Galindo C, Jeng M, Khuu P et al. Clofarabine in refractory Langerhans cell histiocytosis. Pediatr Blood Cancer 2008; 51 : 703–716.
16. McCowage GB, Frush DP, Kurtzberg J. Successful treatment of two children with Langerhans’ cell histiocytosis with 2’-deoxycoformycin. J Pediatr Hematol Oncol 1996; 18 : 154–158.
17. Pardanani A, Phyliky RL, Li CY et al. 2-chlorodeoxyadenosine therapy for disseminated Langerhans cell histiocytosis. Mayo Clin Proc 2003; 78 : 301–306.
18. Watts J, Files B. Langerhans cell histiocytosis: central nervous system involvement treated successfully with 2-chlorodeoxyadenosine. Pediatr Hematol Oncol 2001; 18 : 199–204.
19. Dhall G, Finlay JL, Dunkel IJ et al. Analysis of outcome for patients with mass lesions of the central nervous system due to Langerhans cell histiocytosis treated with 2-chlorodeoxyadenosine. Pediatr Blood Cancer 2008; 50 : 72–79.
20. Ottaviano F, Finlay JL. Diabetes insipidus and Langerhans cell histiocytosis: a case report of reversibility with 2-chlorodeoxyadenosine. J Pediatr Hematol Oncol 2003; 25 : 575–577.
21. Stine KC, Saylors RL, Saccente S et al. Efficacy of continuous infusion 2-CDA (cladribine) in pediatric patients with Langerhans cell histiocytosis. Pediatr Blood Cancer 2004; 43 : 81–84.
22. Rajendra B, Duncan A, Parslew R et al. Successful treatment f central nervous system juvenile xanthogranulomatosis with cladribine. Pediatr Blood Cancer 2009; 52 : 413–415.
23. Aerni MR, Aubry MC, Myers JL et al. Complete remission of nodular pulmonary Langerhans cell histiocytosis lesions induced by 2-chlorodeoxyadenosine in a non-smoker. Respir Med 2008; 102 : 316–319.
24. Lazor R, Etienne-Mastroianni B, Khouatra C et al. Progressive diffuse pulmonary Langerhans cell histiocytosis improved by cladribine chemotherapy. Thorax 2009; 64 : 274–275.
25. Robak T, Kordek R, Robak E et al. Langerhans cell histiocytosis in a patient with systemic lupus erythematosus: a clonal disease responding to treatment with cladribine, and cyclophosphamide. Leuk Lymphoma 2002; 43 : 2041–2046.
26. Tam CS, Seymour JF, Prince HM et al. Treatment-related myelodysplasia following fludarabine combinations chemotherapy. Haematologica 2006; 91 : 1546–1550.
27. Bowcock SJ, Rassam SM, Lim Z et al. High incidence of therapy-related myelodysplasia and acute leukemia in general haematology clinic patients treated with fludarabine and cyclophosphamide for indolent lymphoproliferative disorders. Br J Haematol 2006; 134 : 242–243.
28. Yoshimi A, Kumano K, Motokura T et al. ESHAP therapy effective in patient with Langerhans cell sarcoma. Int J Hematol 2008; 87 : 532–537.
29. Saven A, Figueroa ML, Piro LD et al. 2-chlorodeoxyadenosine to treat refractory histiocytosis X. N Engl J Med 1993; 329 : 734–735.
30. Saven A, Piro LD. 2-chlorodeoxyadenosine: a newer purine analog active in the treatment of indolent lymphoid malignancies. Ann Intern Med 1994; 120 : 784–791.
31. Saven A, Foon KA, Piro LD. 2-chlorodeoxyadenosine-induced complete remissions in Langerhans-cell histiocytosis. Ann Intern Med 1994; 121 : 430–432.
32. Dallafior S, Pugin P, Cerny T et al. Successful treatment of a case of cutaneous Langerhans cell granulomatosis with 2-chlorodeoxyadenosine and thalidomide. Hautarzt 1995; 46 : 553–560.
33. Dimopoulos MA, Theodorakis M, Kostis E et al. Treatment of Langerhans cell histiocytosis with 2 chlorodeoxyadenosine. Leuk Lymphoma 1997; 25 : 187–189.
34. Conias S, Strutton G, Stephenson G. Adult cutaneous Langerhans cell histiocytosis. Australas J Dermatol 1998; 39 : 106–108.
35. Grau J, Ribera JM, Tormo M et al. Results of treatment with 2-chlorodeoxyadenosine in refractory or relapsed Langerhans cell histiocytosis. Study of 9 patients. Med Clin (Barc) 2001; 116 : 339–342.
36. Chang SE, Koh GJ, Choi JH et al. Widespread skin-limited adult Langerhans cell histiocytosis: long-term follow-up with good response to interferon alpha. Clin Exp Dermatol 2002; 27 : 135–137.
37. Rodriguez-Galindo C, Kelly P, Jeng M et al. Treatment of children with Langerhans cell histiocytosis with 2-chlorodeoxyadenosine. Am J Hematol 2002; 69 : 179–184.
38. Robak T, Kordek R, Robak E et al. Langerhans cell histiocytosis in a patient with systemic lupus erythematosus: a clonal disease responding to treatment with cladribine, and cyclophosphamide. Leuk Lymphoma 2002; 43 : 2041–2046.
39. Goh NS, McDonald CE, MacGregor DP et al. Successful treatment of Langerhans cell histiocytosis with 2-chlorodeoxyadenosine. Respirology 2003; 8 : 91–94.
40. Sander CS, Kaatz M, Elsner P. Successful treatment of cutaneous langerhans cell histiocytosis with thalidomide. Dermatology 2004; 208 : 149–152.
41. Mottl H, Rob L, Stary J et al. Langerhans cell histiocytosis of vulva in adolescent. Int J Gynecol Cancer 2007; 17 : 520–524.
42. Aouba A, Larousserie F, Le Guern V et al. Spumous histiocytic oligoarthritis coexisting with systemic Langerhans’ cell histiocytosis: case report and literature review. Joint Bone Spine 2009; 76 : 701–704.
43. Frost JD, Wiersma SR. Progressive Langerhans cell histiocytosis in an infant with Klinefelter syndrome successfully treated with allogeneic bone marrow transplantation. J Pediatr Hematol Oncol 1996; 18 : 396–400.
44. Stine KC, Saylors RL, Williams LL et al. 2-chlorodeoxyadenosine (2-CDA) for the treatment of refractory or recurrent Langerhans cell histiocytosis (LCH) in pediatric patients. Med Pediatr Oncol 1997; 29 : 288–292.
45. Choi SW, Bangaru BS, Wu CD et al. Gastrointestinal involvement in disseminated Langerhans cell histiocytosis (LCH) with durable complete response to 2-chlorodeoxyadenosine and high-dose cytarabine. J Pediatr Hematol Oncol 2003; 25 : 503–506.
46. Bernard F, Thomas C, Bertrand Y et al. Multi-centre pilot study of 2-chlorodeoxyadenosine and cytosine arabinoside combined chemotherapy in refractory Langerhans cell histiocytosis with haematological dysfunction. Eur J Cancer 2005; 41 : 2682–2689.
47. Mottl H, Ganevová M, Radvanská J et al. Treatment results of Langerhans cell histiocytosis with LSH II protocol. Čas Lék Čes 2005; 144 : 753–755.
48. Mottl H, Starý J, Chánová M et al. Treatment of recurrent Langerhans cell histiocytosis in children with 2-chlorodeoxyadenosine. Leuk Lymphoma 2006; 47 : 1881–1884.
49. Biswas G, Khadwal A, Arora B et al. Activity and toxicity of 2-CDA in Langerhans cell histiocytosis: a single institutional experience. Indian J Cancer 2007; 44 : 137–141.
50. Apollonsky N, Lipton JM. Treatment of refractory Langerhans cell histiocytosis (LCH) with a combination of 2-chlorodeoxyadenosine and cytosine arabinoside. J Pediatr Hematol Oncol 2009; 31 : 53–56.
51. Pant C, Madonia P, Bahna SL et al. Langerhans cell histiocytosis, a case of Letterer Siwe disease. J La State Med Soc 2009; 161 : 211–212.
52. Betticher DC, Fey MF, von Rohr A et al. High incidence of infections after 2-chlorodeoxyadenosine (2-CDA) therapy in patients with malignant lymphomas and chronic and acute leukaemias. Ann Oncol 1994; 5 : 57–64.
53. Braiteh F, Kurzrock R. CASE 1. Langerhans cell histiocytosis of the thyroid. J Clin Oncol 2006; 24 : 522–523.
54. Dewan M, Al-Ghamdi AA, Zahrani MB. Lessons to be learned – Langerhans’ cell histiocytosis. J R Soc Promot Health 2008; 128 : 41–46.
55. Nagarajan R, Neglia J, Ramsay N et al. Successful treatment of refractory Langerhans cell histiocytosis with unrelated cord blood transplantation. J Pediatr Hematol Oncol 2001; 23 : 629–632.
56. Saven A, Piro LD. 2-chlorodeoxyadenosine: a potent antimetabolite with major activity in the treatment of indolent lymphoproliferative disorders. Hematol Cell Ther 1996; 38 (Suppl 2): S93–S101.
57. Williams W, Craver RD, Correa H et al. Use of 2-chlorodeoxyadenosine to treat infantile myofibromatosis. J Pediatr Hematol Oncol 2002; 24 : 59–63.
58. Fichter J, Doberauer C, Seegenschmiedt H. Langerhans cell histiocytosis in adults: An interdisciplinary challenge. Dtsch Arztebl 2007; 104: A2347–A2353.
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Internal Medicine

2010 Issue Supplementum 2
-
All articles in this issue
- Postižení CNS histiocytózou z Langerhansových buněk a Erdheimovou-Chesterovou nemocí. Přínos PET-CT vyšetření pro diagnostiku a vyhodnocení léčebné odpovědi
- Postižení plic u pacientů s multiorgánovou formou histiocytózy z Langerhansových buněk. Popis 8 pacientů a přehled literatury
- Přínos PET-CT pro diagnostiku a sledování plicní formy histiocytózy z Langerhansových buněk
- Přehled léčby histiocytózy z Langerhansových buněk u osob dospělého věku
- Použití kladribinu v první linii léčby multifokální anebo multiorgánové formy histiocytózy z Langerhansových buněk u dospělých osob
- Radioterapie histiocytózy z Langerhansových buněk
- Hemofagocytující lymfohistiocytóza
- Erdheimova-Chesterova nemoc v obrazech
- Nekrobiotický xantogranulom – vzácná kožní komplikace u nemocného s mnohočetným myelomem
- Leukemie z dendritických buněk CD4+56+, typ DC2
- Systémová mastocytóza
- Představení histiocytárních chorob, o nichž pojednává toto supplementum časopisu Vnitřní lékařství
- Histiocytóza z Langerhansových buněkz pohledu patologa
- Diagnostická patológia non-Langerhansových histiocytóz
- Histiocytóza z Langerhansových buněk u dětí a dospívajících
- Granulomatóza z Langerhansových buněk
- Projevy histocytózy z Langerhansových buněk v ORL oblasti
- Projevy histiocytózy z Langerhansových buněk v orofaciální oblasti
- Histiocytóza z Langerhansových buněk – kožní aspekty onemocnění
- Histiocytóza z Langerhansových buněk u dospělých
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue
- Hemofagocytující lymfohistiocytóza
- Erdheimova-Chesterova nemoc v obrazech
- Systémová mastocytóza
- Histiocytóza z Langerhansových buněk u dětí a dospívajících
