Erdheimova-Chesterova nemoc v obrazech
Erdheim-Chester disease in pictures
Erdheim-Chester disease (ECD) characterized by proliferation of foamy histiocytes and their infiltration into various tissues and organs, typically the long bones of the lower extremities, is a rare disease of the non-Langerhans cell histiocytosis group. In the patients with ECD during examinations by imaging methods various pathologic changes are described, including osteosclerosis, infiltration of the hypophysis, periaortic fibrosis (coated aorta) as well as retroperitoneal fibrosis reminding of Ormond’s disease. In this work we are presenting our collection of 83 images depicting these and many other interesting findings arranged into 17 pictures. Published here are images obtained by conventional radiography (CR), computed tomography (CT), magnetic resonance imaging (MRI), traditional bone scintigraphy, single photon emission computed tomography (SPECT) and also by means of positron emission tomography (PET) or hybrid PET/CT imaging if need be. In conclusion, we underline the importance of whole-body PET/CT acquisition, including lower limbs, which depicts typical bilateral symmetric osteosclerosis of the long bones with diffusely increased radiopharmacon (fluorodeoxyglucose) uptake.
Key words:
Erdheim-Chester disease – osteosclerosis – diabetes insipidus centralis – periaortic fibrosis – retroperitoneal fibrosis – conventional radiography – CT – MR – skeletal scintigraphy – SPECT – PET/CT
Authors:
P. Szturz 1; Z. Adam 1; R. Koukalová 2; Z. Řehák 2; J. Neubauer 3; J. Prášek 4; M. Doubek 1; R. Hájek 1; J. Mayer 1
Authors‘ workplace:
Interní hematoonkologická klinika LF MU a FN Brno, pracoviště Bohunice, přednosta prof. MUDr. Jiří Mayer, CSc.
1; Oddělení nukleární medicíny, PET centrum Masarykova onkologického ústavu Brno, přednosta prim. MUDr. Karol Bolčák
2; Radiologická klinika Lékařské fakulty MU a FN Brno, pracoviště Bohunice, přednosta prof. MUDr. Vlastimil A. Válek, CSc.
3; Klinika nukleární medicíny Lékařské fakulty MU a FN Brno, pracoviště Bohunice, přednosta doc. MUDr. Jiří Prášek, CSc.
4
Published in:
Vnitř Lék 2010; 56(Supplementum 2): 170-178
Category:
Langerhans cell histiocytosis and some other Hematology rare diseases
Overview
Erdheimova-Chesterova choroba (ECD) je vzácné onemocnění ze skupiny „non-Langerhans cell“ histiocytóz charakterizované proliferací pěnitých histiocytů (foamy histiocytes) a jejich infiltrací do různých tkání a orgánů, typicky dlouhých kostí dolních končetin. U pacientů s ECD bývají při vyšetření zobrazovacími metodami popisovány různé patologické změny včetně přítomnosti osteosklerózy, infiltrace hypofýzy, periaortální fibrózy (coated aorta) či fibrózy retroperitoneální, která připomíná Ormondovu chorobu. V této práci prezentujeme naši sbírku 83 snímků těchto a mnoha dalších zajímavých nálezů uspořádaných do 17 obrazů. Jsou zde publikována zobrazení získaná konvenční radiografií (RTG), výpočetní tomografií (CT), magnetickou rezonancí (MR), klasickou scintigrafií skeletu, jednofotonovou emisní výpočetní tomografií (SPECT) i pomocí hybridního zobrazování pozitronovou emisní tomografií (PET), případně v kombinaci se současně snímanými celotělovými skeny výpočetní tomografie (CT), tzv. PET/CT vyšetření. Závěrem zdůrazňujeme význam celotělového PET/CT vyšetření, které při současném snímaní celých dolních končetin zobrazí typickou oboustrannou symetrickou osteosklerózu dlouhých kostí s difuzně zvýšenou aktivitou radiofarmaka (fluorodeoxyglukózy – FDG).
Klíčová slova:
Erdheimova-Chesterova choroba – osteoskleróza – diabetes insipidus centralis – periaortální fibróza – retroperitoneální fibróza – konvenční radiografie – CT – MR – scintigrafie skeletu – SPECT – PET/CT
Úvod
V roce 1930 popsal americký kardiolog William Chester spolu se svým vídeňským kolegou, patologem Jakobem Erdheimem, případy 2 nemocných s „lipoidní granulomatózou“ (lipoid granulomatosis) [1]. Pojem Erdheimova-Chesterova choroba (Erdheim-Chester disease – ECD) však poprvé zmiňuje až o 42 let později Henry Jeff, který publikoval zprávu o 3. a 4. případu tohoto onemocnění [2].
ECD je vzácné idiopatické onemocnění charakterizované proliferací histiocytů obsahujících tukové inkluze. Histiocyty pak mají pěnitý charakter (foamy histiocytes). Tyto patologické, pěnité histiocyty pravidelně proliferují v dlouhých kostech dolních končetin, což vede k typickému obrazu zbytnění trabekul a kortikalis v tibiích a femorech. Mohou však infiltrovat i oblasti retroperitonea, mediastina, plic, srdce, sleziny a jater, kůže či orbity a CNS se vznikem zánětlivých a fibrotických změn. Imunohistochemické vyšetření prokazuje typický imunofenotyp (CD68+, CD1a–, S100–, u minoritního počtu pacientů S-100+) [3].
Dle WHO klasifikace maligních krevních chorob patří ECD do kategorie diseminovaného juvenilního xantogranulomu, který tvoří samostatnou jednotku ve skupině histiocytárních nemocí. Maligní histiocytární nemoci tvoří nepatrný zlomek všech krevních chorob. Nejčastější z této skupiny nemocí je histiocytóza z Langerhansových buněk, ale i ta je velmi vzácná a v dospělosti se její incidence odhaduje na 1–5 nemocných na 1 milion obyvatel [4]. ECD je podstatně vzácnější, počet popsaných případů ve světě se v roce 2004 pohyboval kolem 100, v roce 2008 jich v lékařské literatuře bylo napočítáno přes 300 [5,6].
Onemocnění se vyskytuje až v dospělém věku s věkovým průměrem 54 let, má velmi variabilní příznaky, a je proto obtížně rozpoznatelné. Klinická manifestace sahá od benigních asymptomatických ložisek až po multisystémové chemorezistentní onemocnění s infaustní prognózou. Klasickým a téměř vždy přítomným projevem je osteoskleróza tibií a femorů, která může působit bolesti, ale také vést až k patologické fraktuře. Mimokostní postižení je u této nemoci popisováno v 50 % případů. Plicní fibróza s dušností a srdeční selhání jsou nejčastější příčiny úmrtí [6–8].
V této práci prezentujeme naši sbírku 83 snímků z různých zobrazovacích modalit získaných při několikaletém sledování 2 pacientů s ECD na naší klinice. Tyto snímky jsme tematicky uspořádali do 17 obrazů. Čtenáři tak mají možnost seznámit se s nálezy typickými pro ECD na konvenční radiografii (RTG), výpočetní tomografii (CT), magnetické rezonanci (MR), klasické scintigrafii skeletu, jednofotonové emisní výpočetní tomografii (SPECT) i na hybridním zobrazování pozitronovou emisní tomografií (PET), případně v kombinaci se současně snímanými celotělovými skeny výpočetní tomografií (CT), tzv. PET/CT vyšetření.
Hlava
(obr. 1–4 a 16)
V oblasti hlavy je nejčastěji popisována infiltrace orbity vedoucí k exoftalmu a dále xantogranulomatózní kožní projevy kolem očnice. Byly popsány projevy nitrolební hypertenze a přítomnost městnavé papily. Chorobným procesem však mohou být postiženy i paranazální dutiny [5,9].
Triáda příznaků diabetes insipidus, exoftalmus a kostní změny připomíná Handovu-Schüllerovu-Christianovu chorobu neboli jednu z klinických forem histiocytózy z Langerhansových buněk [4].
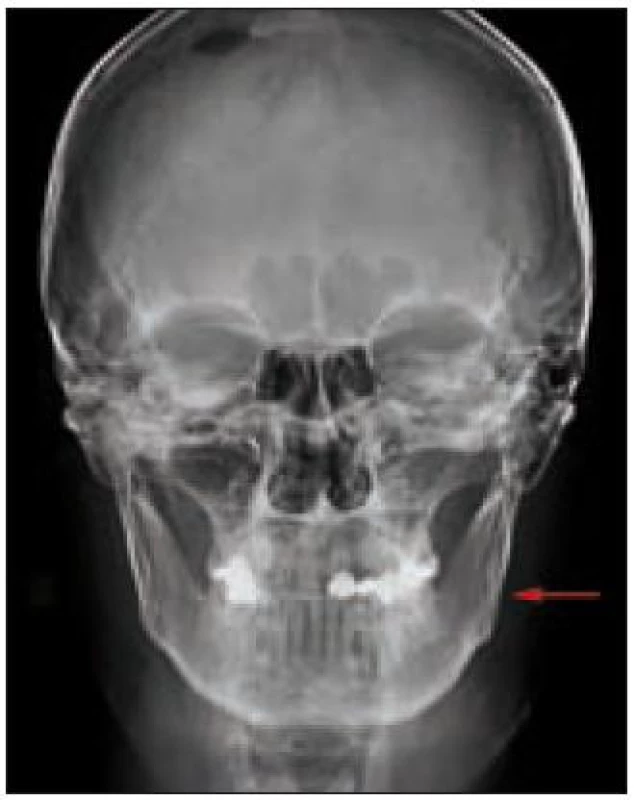
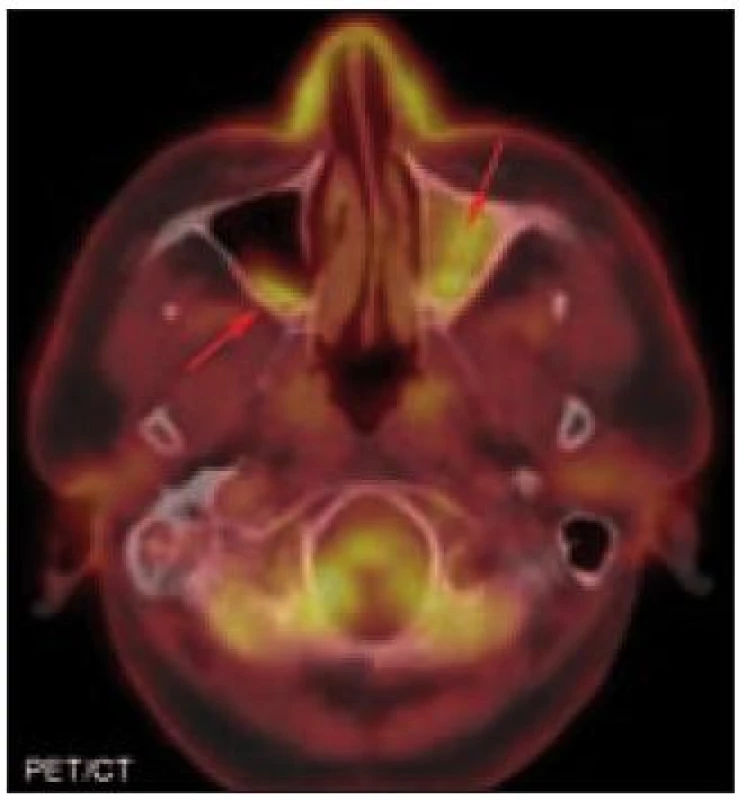
![PET/CT hlavy. Sklerotizace mediální části levé jařmové kosti. PET komponenta zachycuje difuzně zvýšenou aktivitu radiofarmaka 2-[<sup>18</sup>F]-fluoro-2-deoxy-D-glukózy (<sup>18</sup>F-FDG) v místech strukturálních změn popisovaných na CT.](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/fc93fccbe3d3cbb24441f8ae5f549352.jpeg)
Centrální nervový systém
(obr. 5, 6)
Postižení centrálního nervového systému (CNS) je možno rozdělit do 3 typů. Pro 1. typ jsou charakteristické infiltráty v oblasti kmene, mozečku a mozku. Vyskytuje se u 44 % pacientů. Druhým typem (37 %) je meningeální postižení s tumory, které tvarem odpovídají meningeomům, a s nodulárním zduřením dura mater. Třetí typ (19 %) je spojením předchozích, tedy infiltrativního a meningeálního postižení CNS. Optimálním způsobem jejich znázornění je MR. Ložiska jsou hypersignální v T2 váženém obraze a sytí se po aplikaci gadolinia v T1 váženém obraze. Byla popsána prolongovaná retence kontrastní látky.
Diabetes insipidus bývá přítomen asi u 25 % případů. Změny vedou k atrofii zadního laloku hypofýzy. Tito nemocní mívají na MR vyšetření ztrátu hyperintenzního signálu z posteriorního laloku hypofýzy a zesílení infundibula, případně infiltraci stopky hypofýzy. MR nálezy jsou však nespecifické a diagnózu může ověřit pouze histologický rozbor tohoto infiltrátu. Získat reprezentativní histologický vzorek ze stopky hypofýzy však není snadné ani bez rizika, a tak se v praxi doporučuje provést celkové vyšetření s cílem odhalit extrakraniální projevy nemoci infiltrující stopku hypofýzy [7]. Na základě našich zkušeností považujeme PET/CT vyšetření za nejvhodnější modalitu v této indikaci.
Diabetes insipidus bývá v některých případech prvním projevem nemoci a infiltrace v oblasti stopky hypofýzy může být na MR patrná až při kontrolním vyšetření po určitém čase od prvních příznaků. Někdy bývá v době stanovení diagnózy zjištěna i snížená hladina gonadotropinů a dalších hormonů [10]. Nález infiltrace v oblasti stopky hypofýzy je velký diferenciálně diagnostický problém. Je sice možné provedení biopsie tohoto infiltrátu, ale ne vždy biopsie infiltrátu vede k diagnóze. Sheu popisuje punkci infiltrátů s nálezem pseudoinflamatorní infiltrace, kdy se až sekčně potvrdila souvislost s Erdheimovou-Chesterovou nemocí [11]. V diferenciální diagnostice infiltrátů v oblasti infundibula a stopky hypofýzy připadá v úvahu neurosarkoidóza, Erdheimova-Chesterova nemoc, histiocytóza z Langerhansových buněk a lymfocytární hypofyzitida [3].
Postižení CNS způsobuje kromě diabetes insipidus také ataxii a parézy, méně často jsou přítomny bolesti hlavy, neuropsychiatrické či kognitivní poruchy, senzorické poruchy či parézy hlavových nervů, může však dojít i k úplnému výpadku hormonální aktivity hypofýzy (panhypopituitarizmus). Neurologické postižení může vést k postupnému zhoršování funkce CNS [7].
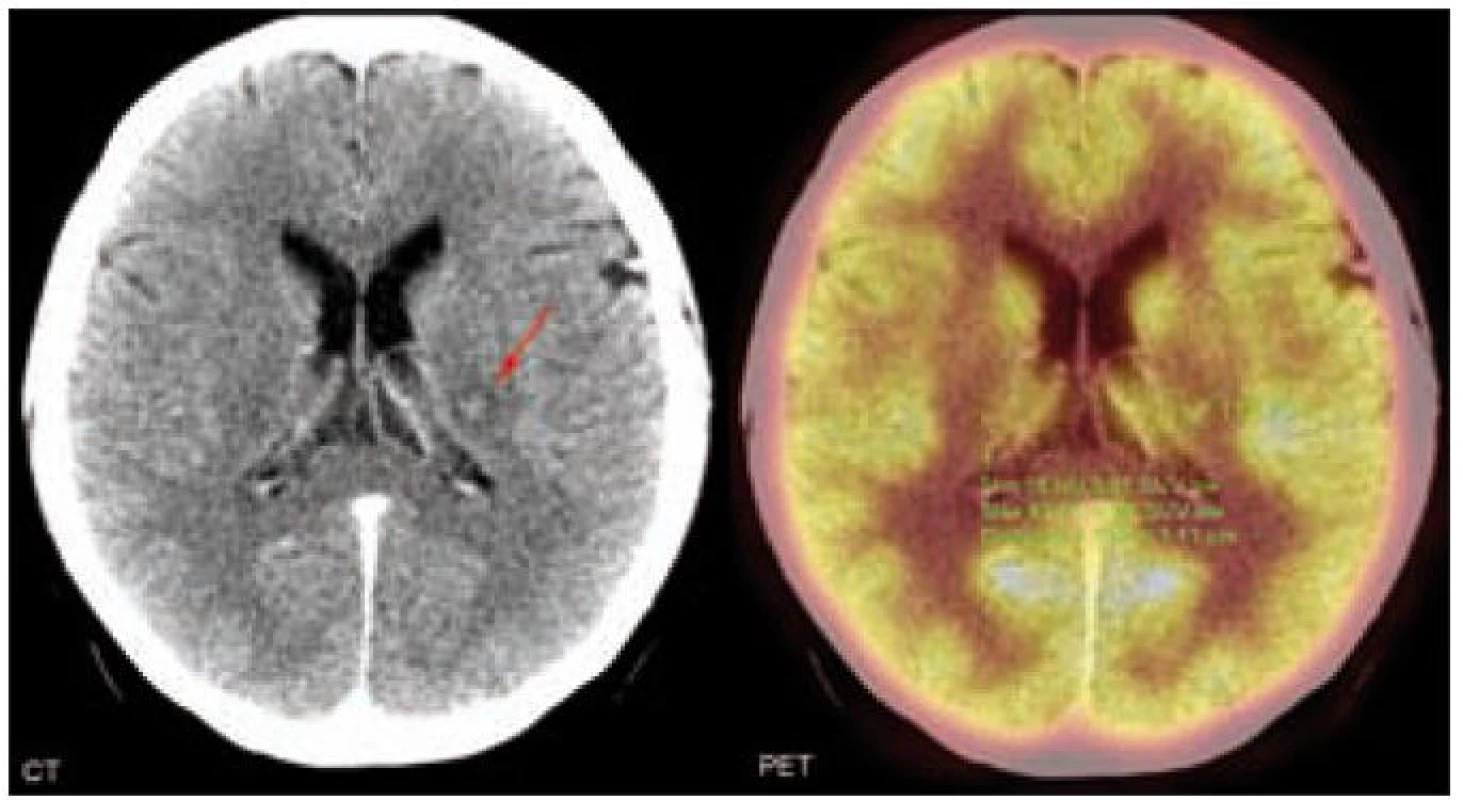
![Postižení CNS u pacienta s Erdheimovou-Chesterovou chorobou zobrazené na MR mozku v T1 vážené sekvenci po aplikaci kontrastní látky.
2006: koronární (vlevo) a sagitální (vpravo) rovina. Postkontrastně se sytící ložiskové zbytnění stopky hypofýzy na 4–5 mm u pacienta s příznaky diabetu insipidu. (Normální stopka hypofýzy se nálevkovitě zužuje, v úrovni chiasma opticum měří kolem 3 mm a při vyústění do hypofýzy jen 1– 2 mm [3].) Byla provedena endoskopická stereotakticky navigovaná parciální resekce stopky hypofýzy, dle histologického vyšetření byl však nález nespecifický a odpovídal lymfoidní zánětlivé infiltraci v oblasti hypofýzy. Absenci morfologie typické pro Erdheimovu-Chesterovu chorobu (pěnité makrofágy, mnohojaderné obrovské buňky Toutonóvy, fibroblastické pozadí) popisují i jiní autoři a její příčina není dosud objasněna. Analogii lze hledat u pacientů s neurodegenerativními projevy histiocytózy z Langerhansových buněk, u nichž byly i sekčně nalezeny pouze lymfocytární infiltráty. Bylo spekulováno, že celé neurodegenerativní poškození může mít podklad maligní chorobou indukované degenerativní změny. Je tedy možné, že infiltrace CNS pěnitými histiocyty provází natolik intenzivní zánětlivá reakce, že cílené biopsie nemusí diagnózu Erdheimovy-Chesterovy choroby odhalit, a někteří autoři proto doporučují při diferenciální diagnostice infiltrace stopky hypofýzy vždy vyšetření dolních končetin, zda nejsou přítomny znaky charakteristické pro ECD [3,11,12].
2007: transverzální roviny. Vlevo patrná nová ložiska v mesencephalu s postkontrastně se sytícím centrem a cirkulárním jemným lemem kolaterálního edému, vpravo pak tečkovité ložisko subkortikálně.
2008: transversální (vlevo) a koronární (vpravo) rovina. Nová ložiska v oblasti levého zadního raménka kapsuly interny. U pacienta se projevila nová neurologická symptomatika ve formě dysartrie středního stupně, reflexologická převaha na pravé dolní končetině a porucha alternujících pohybů levé ruky.](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/8a6e990fe4c303418e5ccaa8b1c632df.jpeg)
Břicho
(obr. 7, 8)
V oblasti břicha se nemoc nejčastěji projevuje retroperitoneálními infiltráty a fibrotizací. Tyto projevy vedou k obstrukční nefropatii. Zobrazovacími vyšetřeními je prokazatelná retroperitoneální a perirenální infiltrace a fibrotické změny. Pokud dominuje aktivita nemoci v oblasti retroperitonea, je možná záměna s Ormondovou chorobou (idiopatická retroperitoneální fibróza) [13]. Literatura popisuje případy, kdy byly provedeny biopsie této zdánlivě maligní infiltrace retroperitonea a histologické hodnocení odebraného materiálu vyznělo nespecificky – „pojivová fibrózní tkáň s fokálními známkami zánětu“ [14]. V některých případech právě retroperineální infiltrace, fibrotizace byla první známkou této nemoci, která případně způsobila hydronefrózu [15] či akutní renální selhání [16]. Zcela výjimečně je přítomna infiltrace jater a dalších parenchymatózních orgánů [17].
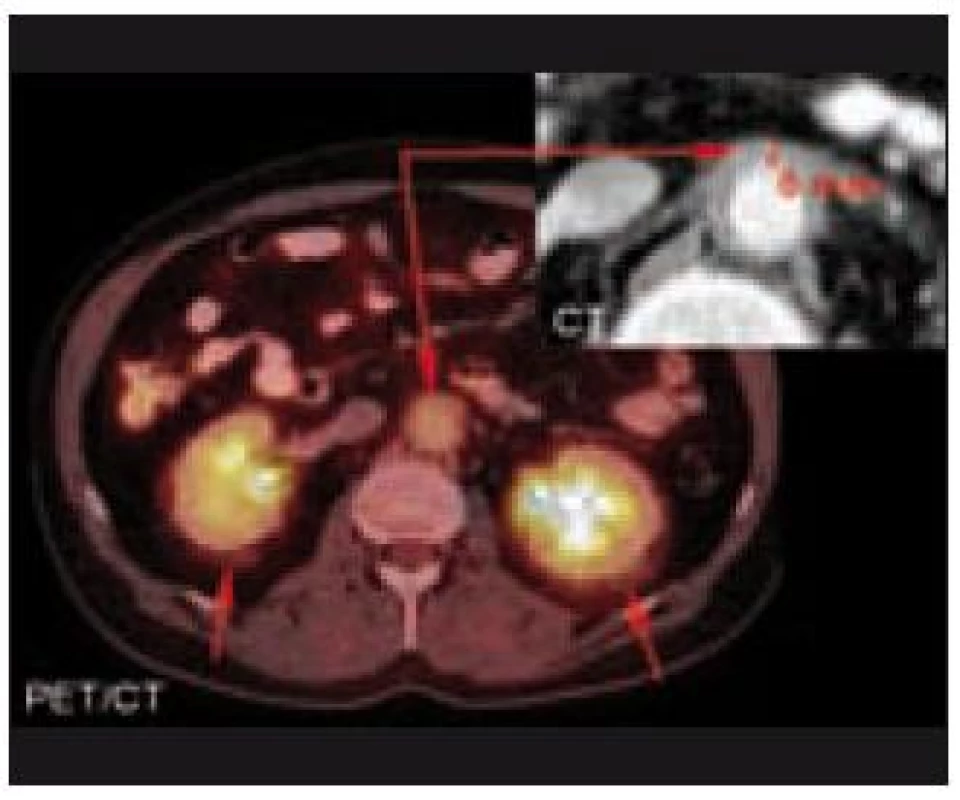
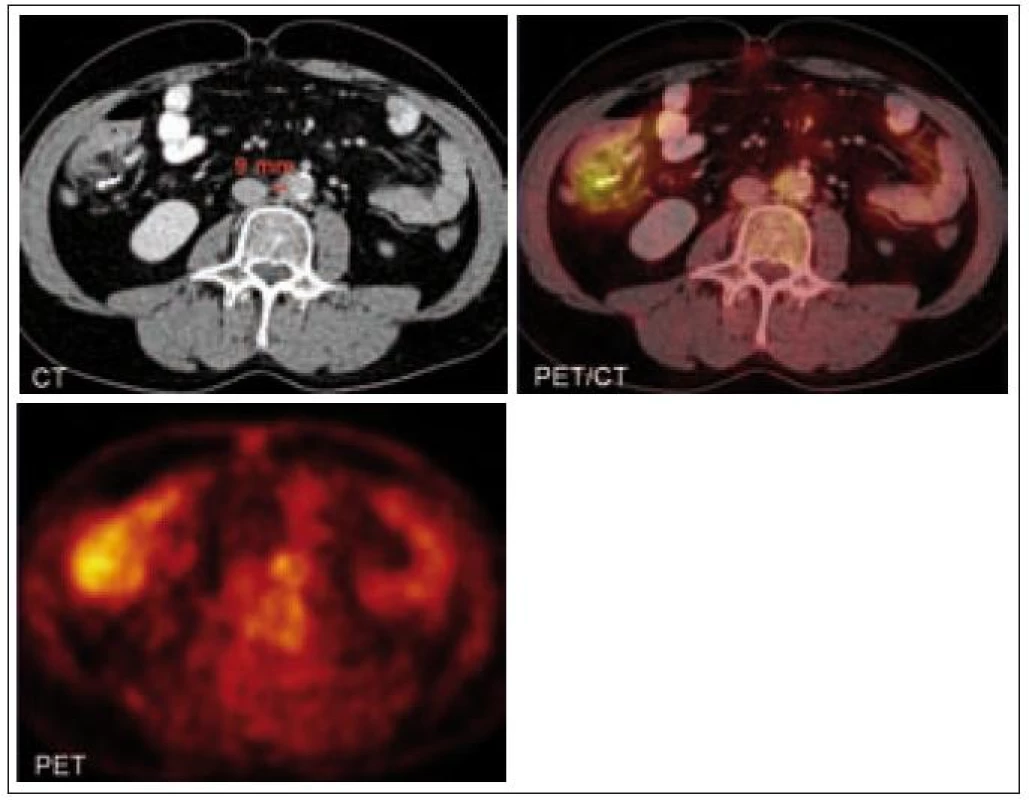
Hrudník
(obr. 9)
V oblasti hrudníku může nemoc infiltrovat plíce, vést k plicní fibróze a způsobit respirační insuficienci. Při zobrazovacích vyšetřeních jsou popisovány intersticiální infiltráty [18]. Infiltrace perikardu způsobuje perikardiální výpotek, který je nejčastějším kardiálním projevem této nemoci [19]. Dále byla popsána infiltrace myokardu, chlopní, koronárních arterií. Specifickým projevem je periaortální fibróza, takzvaná coated aorta [20]. K monitorování postižení srdce byla použita scintigrafie pomocí 67Ga [21].
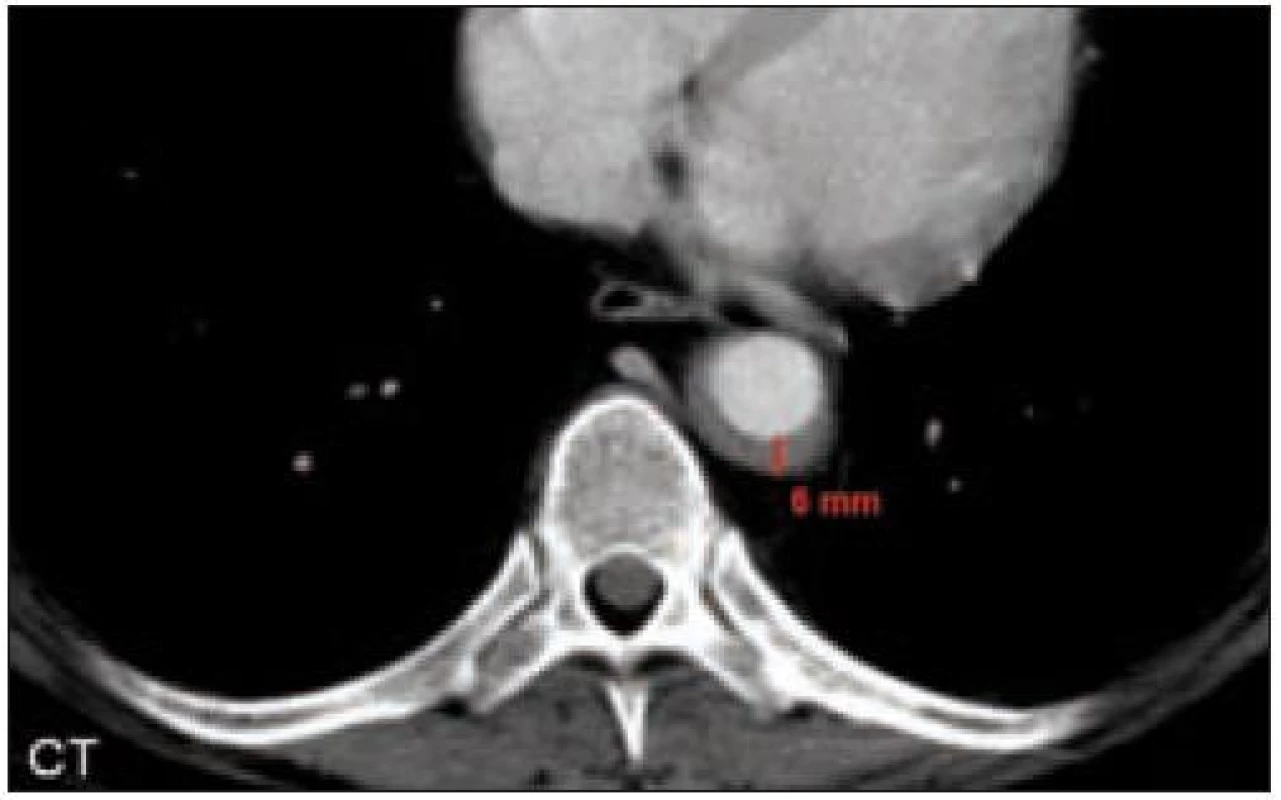
Horní a dolní končetiny
(obr. 10–17)
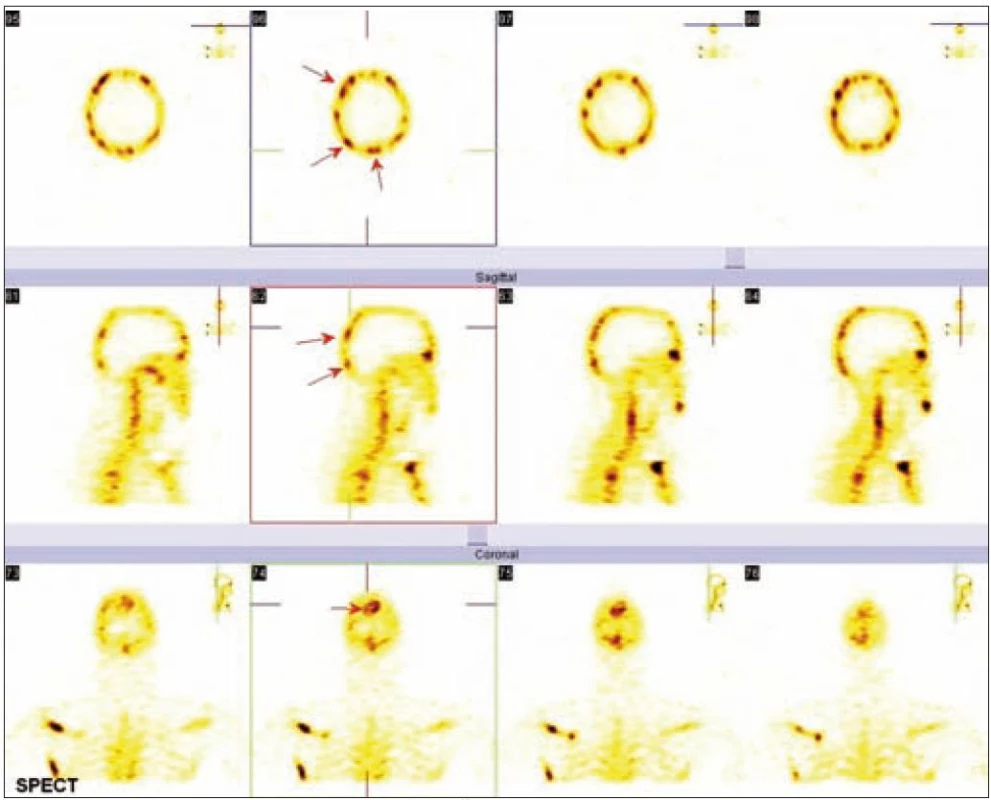
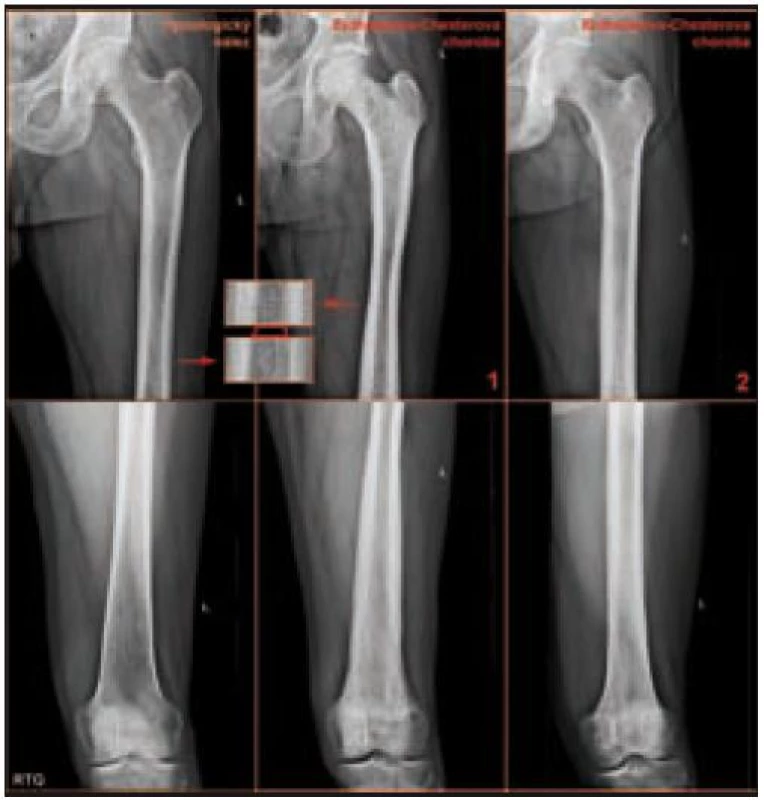
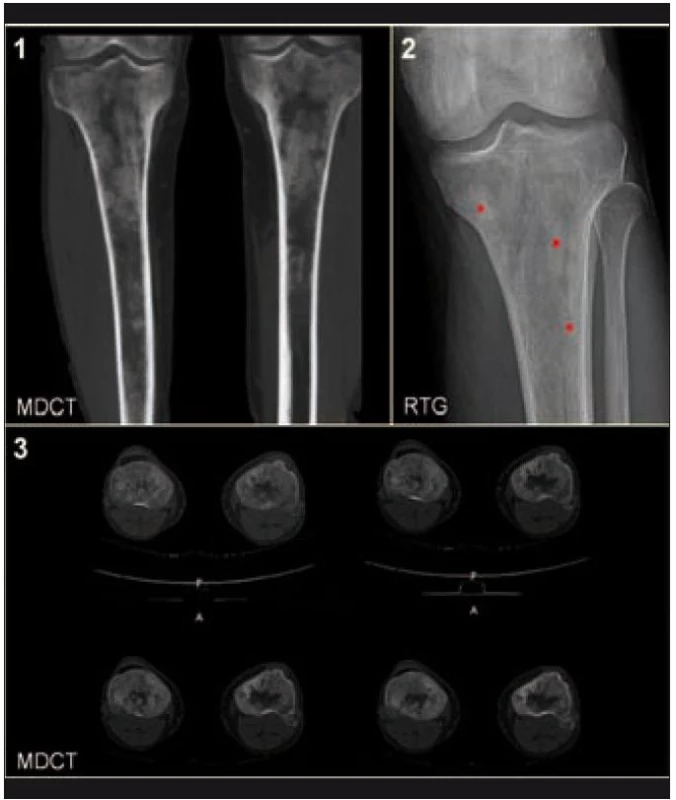
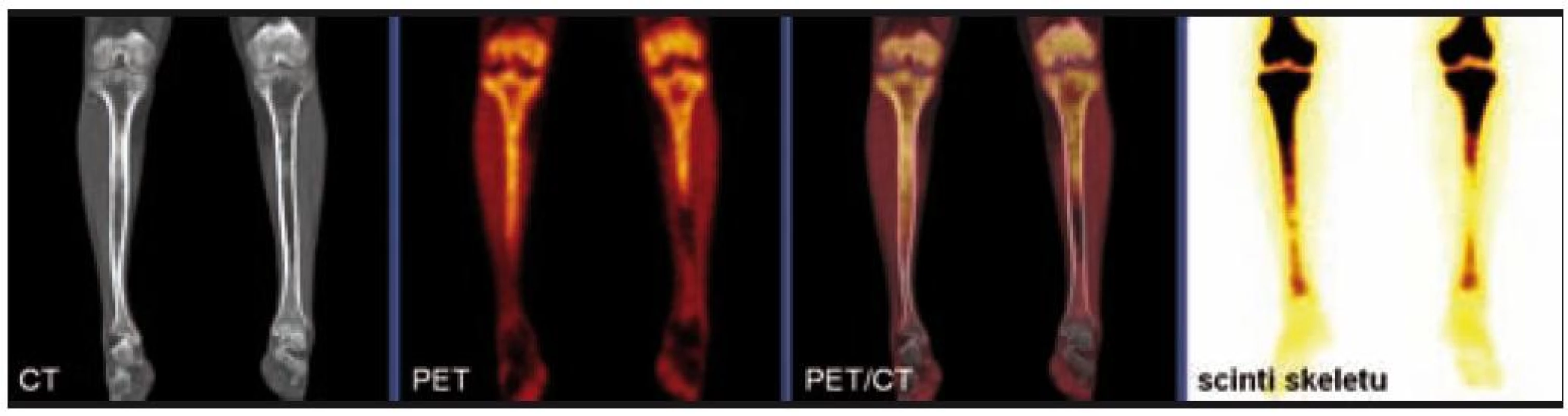
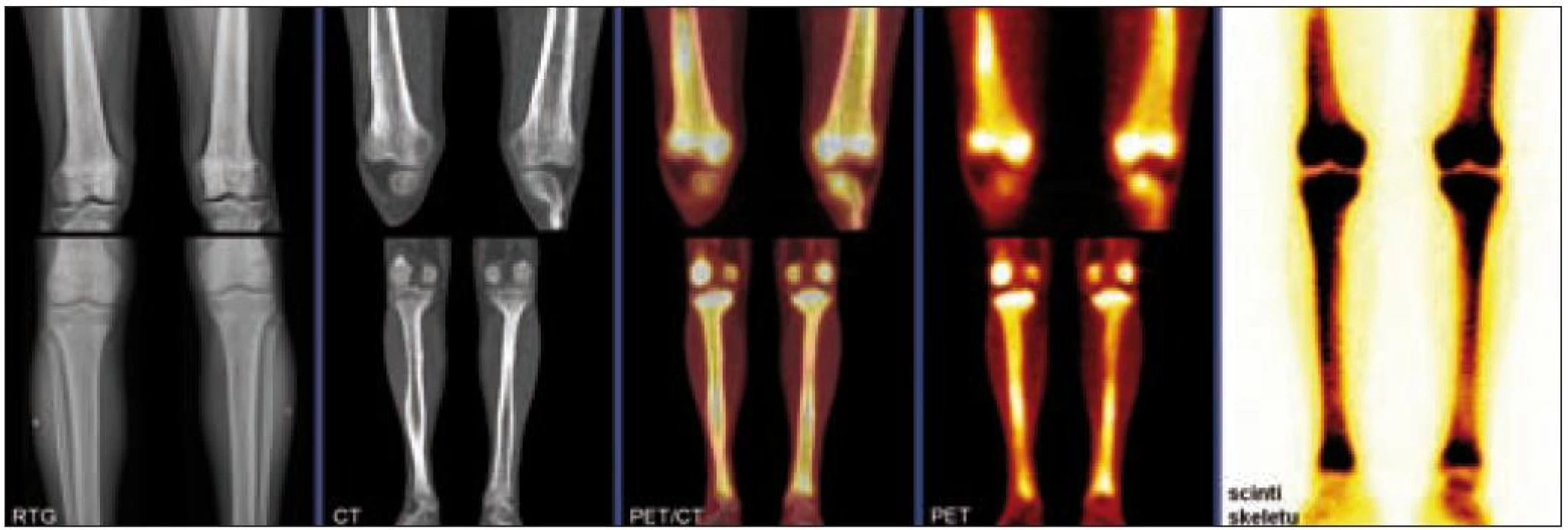
Radiografické abnormality kostí končetin jsou typické, pravidelně se vyskytují symetricky na dolních, méně často na horních končetinách. Denzita kosti je ložiskově či difuzně zvýšena, je patrné zesílení trabekul, skleróza a zesílení kortikalis. Proces postihuje hlavně diafýzy a metafýzy s minimálními změnami v epifýzách. Nejvíce patologických změn bývá patrných na kostech stehenních, a to ve formě oboustranně zvýšené opacity kostí, zesílení kompakty, která zužuje projasnění nitrodřeňové dutiny, jak je zřetelné z klasického RTG snímku a dále z CT zobrazení [22].
Odchylky metabolizmu skeletu od normálu je možné zobrazit jak pomocí klasické scintigrafie skeletu, tak pomocí PET vyšetření. Scintigrafie skeletu znázorňuje změny kostního metabolizmu intenzivněji než PET zobrazení, to však může prokázat i mimokostní patologii [5].
Bolesti kostí jsou nejčastějším příznakem ECD, bývají mírné, ale trvalé s juxtaartikulární lokalizací u kolen a kotníků [8].
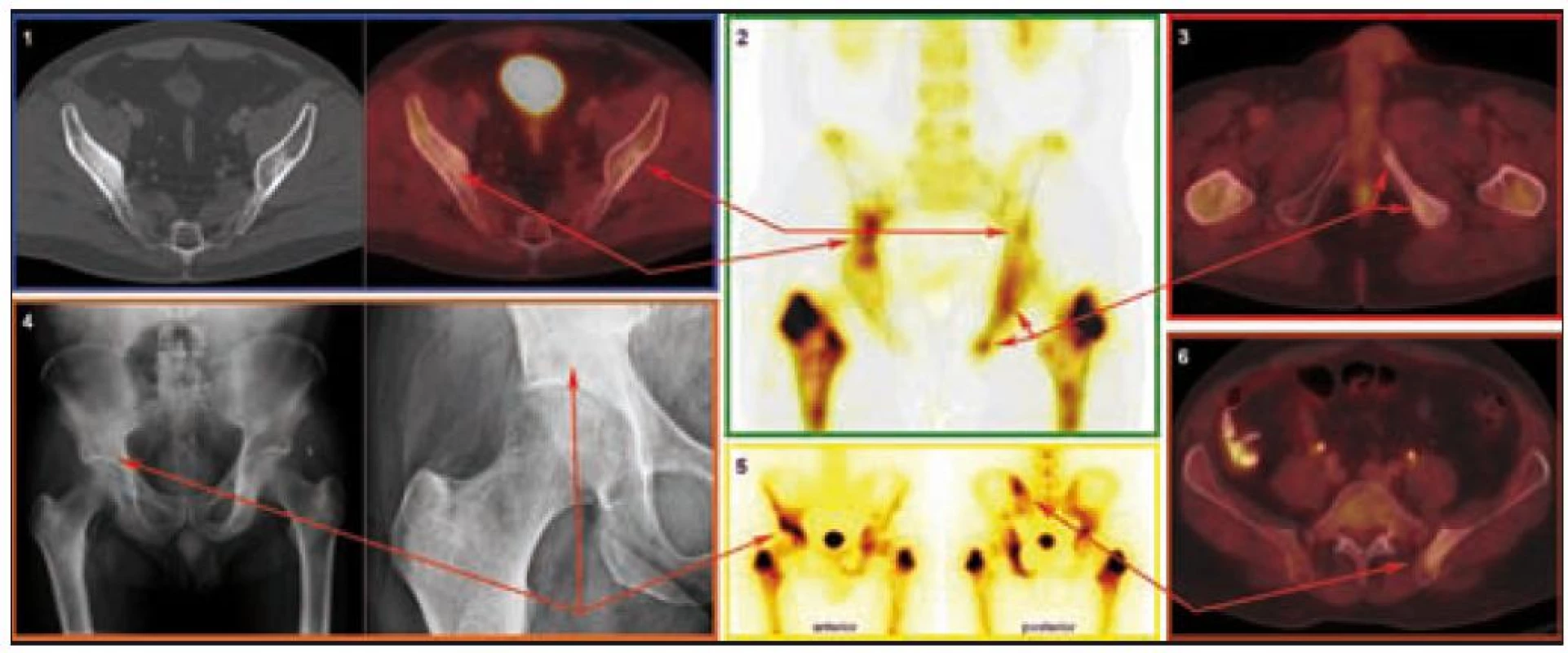
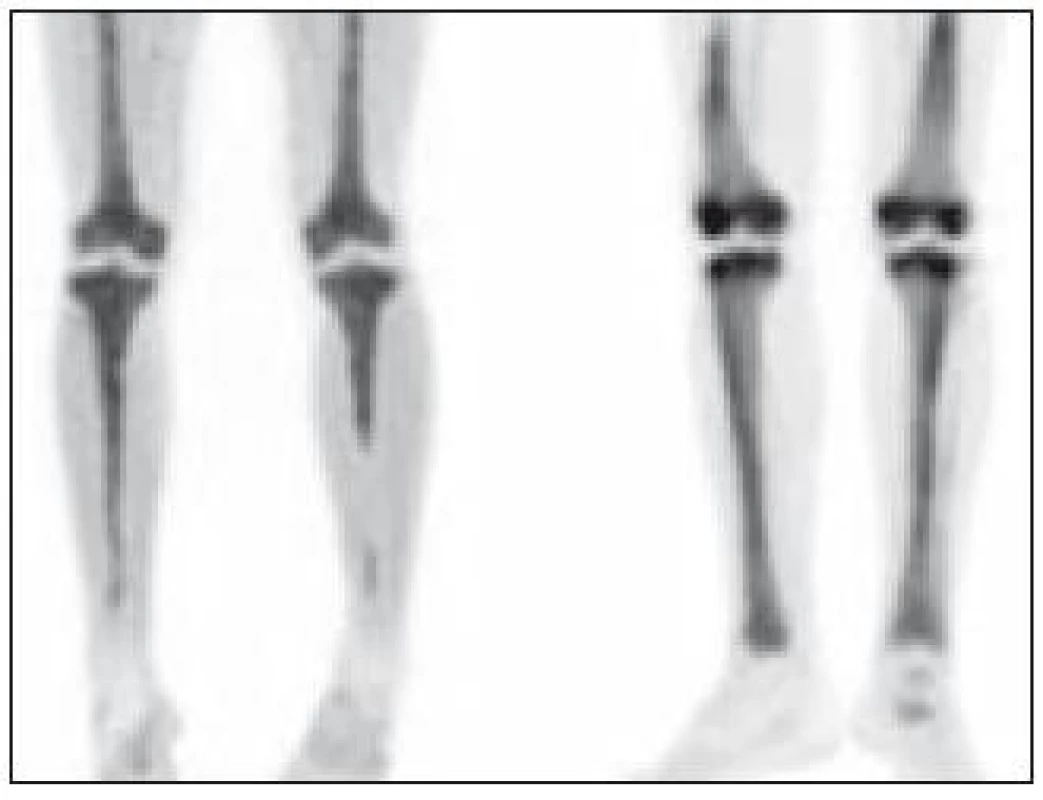
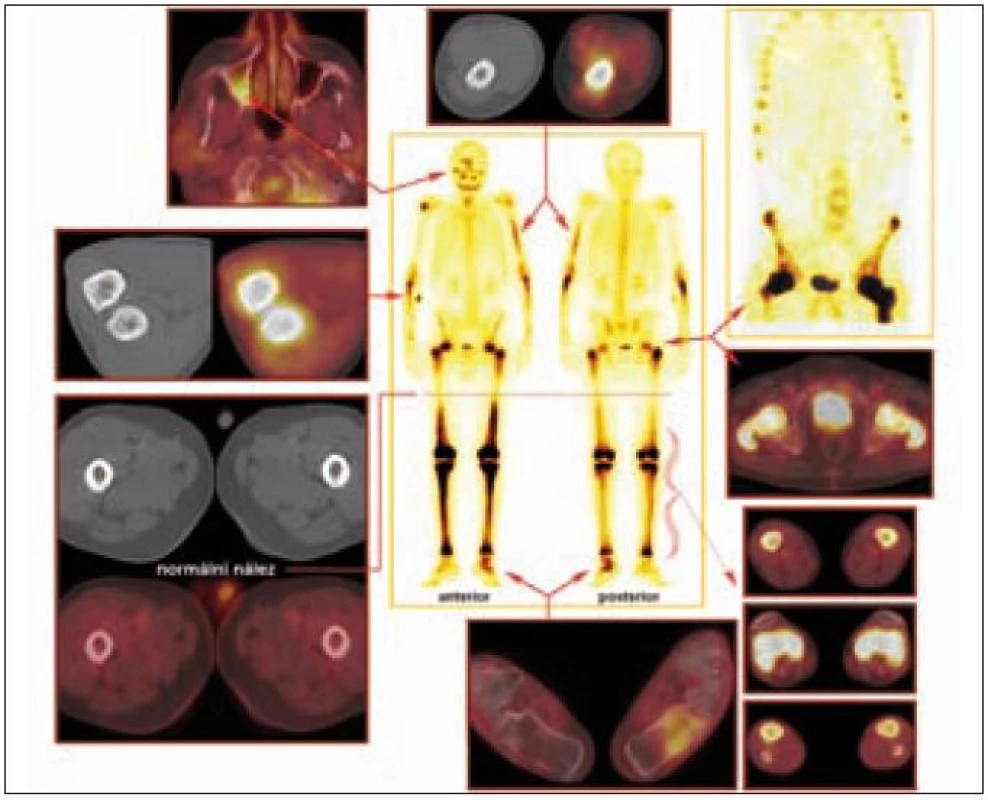
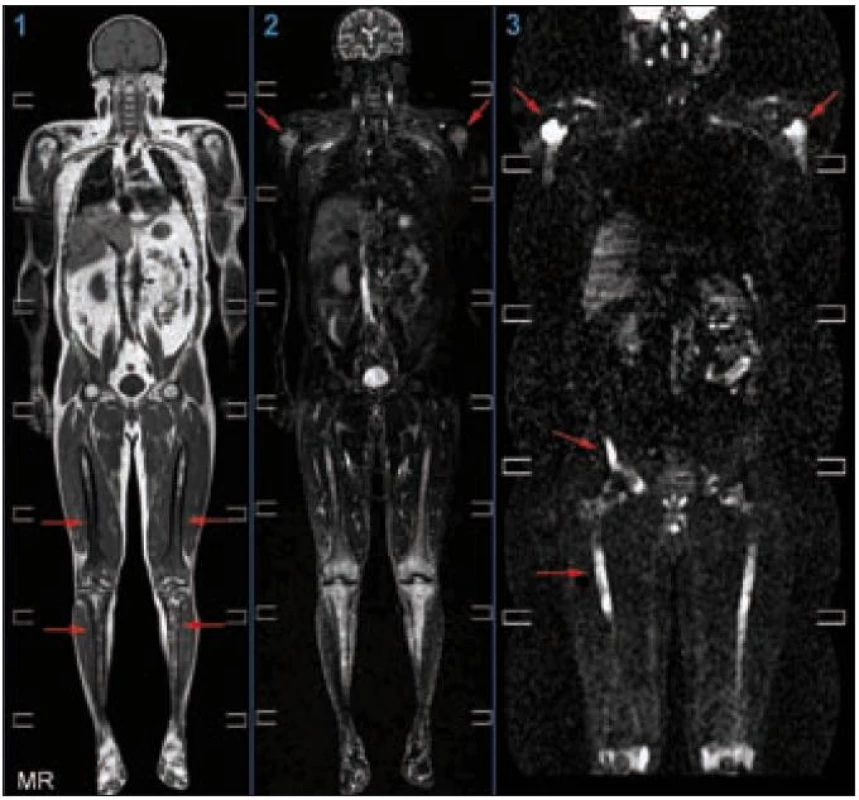
Závěr
Oboustranná symetrická osteoskleróza dlouhých kostí zobrazená při vyšetření konvenční radiografií (RTG) či výpočetní tomografií (CT) je typickou skeletální manifestací Erdheimovy-Chesterovy choroby a při jejím nálezu je nezbytné zahrnout tuto jednotku do diferenciálně diagnostické rozvahy.
Celotělové PET/CT vyšetření včetně zobrazení dolních končetin (tedy nikoliv běžné snímání od proximálních třetin stehen k bázi lební) považujeme za optimální diagnostickou modalitu při hledání extrakraniálních projevů patologické infiltrace v oblasti stopky hypofýzy.
Tato publikace byla připravena v rámci projektu MUNI/A/1012/2009 s názvem „Optimalizace diagnostiky a terapie maligních chorob a komplikací, které tyto maligní nemoci provázejí, s využitím nových molekulárně biologických metod“, a také je součástí aktivit v rámci grantů IGA MZ: NR9225, NS10387 a NS10406.
MUDr. Petr Szturz
www.fnbrno.cz
e-mail: petr.szturz@fnbrno.cz
Doručeno do redakce: 9. 9. 2010
Sources
1. Chester W. Über Lipoidgranuolmatose. Virchows Arch 1930; 279 : 561–602.
2. Jaffe HL. Metabolic, degenerative and inflammatory disease of bones and joints. Philadelphia: PA Lea and Febiger 1972 : 531–541.
3. Adam Z, Balšíková K, Pour L et al. Diabetes insipidus, následovaný po 4 letech dysartrií a lehkou pravostrannou hemiparézou – první klinické příznaky Erdheimovy-Chesterovy nemoci. Popis a zobrazení případu s přehledem informací o této nemoci. Vnitř Lék 2009; 55 : 1173–1188.
4. Adam Z, Krejčí M, Vorlíček J. Hematologie: přehled maligních hematologických nemocí. Praha: Grada Publishing 2008.
5. Arnaud L, Malek Z, Archambaud F et al. 18F-fluorodeoxyglucose-positron emission tomography scanning is more useful in follow up than in the initial assessment of patients with Erdheim-Chester disease. Arthritis Rheum 2009; 60 : 3128–3138.
6. Loeffler AG, Memoli VA. Myocardial involvement in Erdheim-Chester disease. Arch Pathol Lab Med 2004; 128 : 682–685.
7. Lachenal F, Cotton F, Desmurs-Clavel H et al. Neurological manifestations and neuroradiological presentation of Erdheim-Chester disease: report of 6 cases and systematic review of the literature. J Neurol 2006; 253 : 1267–1277.
8. Veyssier-Belot C, Cacoub P, Caparros-Lefebvre D et al. Erdheim-Chester disease. Clinical and radiologic characteristics of 59 cases. Medicine (Baltimore) 1996; 75 : 157–169.
9. Karcioglu ZA, Sharara N, Boles TL et al. Orbital xanthogranuloma: clinical and morphologic features in eight patients. Ophthal Plast Reconstr Surg 2003; 19 : 372–381.
10. Tritos NA, Weinrib S, Kaye TB. Endocrine manifestations of Erdheim-Chester disease (a distinct form of histiocytosis). J Intern Med 1998; 244 : 529–535.
11. Sheu SY, Wenzel RR, Kersting C et al. Erdheim-Chester disease: case report with multisystemic manifestations including testes, thyroid, and lymph nodes, and a review of literature. J Clin Pathol 2004; 57 : 1225–1228.
12. Sheen KC, Chang CC, Chang TC et al. Thickened pituitary stalk with central diabetes insipidus: report of three cases. J Formos Med Assoc 2001; 100 : 198–204.
13. Bangard C, Lotz J, Rosenthal H et al. Erdheim-Chester disease versus multifocal fibrosis and Ormond’s disease: a diagnostic dilemma. Clin Radiol 2004; 59 : 1136–1141.
14. Haroche J, Amoura Z, Touraine P et al. Bilateral adrenal infiltration in Erdheim-Chester disease. Report of seven cases and literature review. J Clin Endocrinol Metab 2007; 92 : 2007–2012.
15. Droupy S, Attias D, Eschwege P et al. Bilateral hydronephrosis in a patient with Erdheim-Chester disease. J Urol 1999; 162 : 2084–2085.
16. O’Rourke R, Wong DC, Fleming S et al. Erdheim-Chester disease: a rare cause of acute renal failure. Australas Radiol. 2007; 51: B48–B51.
17. Gupta A, Aman K, Al-Babtain M et al. Multisystem Erdheim-Chester disease; a unique presentation with liver and axial skeletal involvement. Br J Haematol 2007; 138 : 280.
18. Krüger S, Krop C, Wibmer T et al. Erdheim-Chester disease: a rare cause of interstitial lung disease. Med Klin (Munich) 2006; 101 : 573–576.
19. Vaglio A, Corradi D, Maestri R et al. Pericarditis heralding Erdheim-Chester disease. Circulation 2008; 118: e511–e512.
20. Serratrice J, Granel B, De Roux C et al. “Coated aorta”: a new sign of Erdheim-Chester disease. J Rheumatol 2000; 27 : 1550–1553.
21. Kudo Y, Iguchi N, Sumiyoshi T et al. Dramatic change of Ga-67 citrate uptake before and after corticosteroid therapy in a case of cardiac histiocytosis (Erdheim-Chester disease). J Nucl Cardiol 2006; 13 : 867–869.
22. Dion E, Graef C, Miquel A et al. Bone involvement in Erdheim-Chester disease: imaging findings including periostitis and partial epiphyseal involvement. Radiology 2006; 238 : 632–639.
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Internal Medicine

2010 Issue Supplementum 2
-
All articles in this issue
- Postižení CNS histiocytózou z Langerhansových buněk a Erdheimovou-Chesterovou nemocí. Přínos PET-CT vyšetření pro diagnostiku a vyhodnocení léčebné odpovědi
- Postižení plic u pacientů s multiorgánovou formou histiocytózy z Langerhansových buněk. Popis 8 pacientů a přehled literatury
- Přínos PET-CT pro diagnostiku a sledování plicní formy histiocytózy z Langerhansových buněk
- Přehled léčby histiocytózy z Langerhansových buněk u osob dospělého věku
- Použití kladribinu v první linii léčby multifokální anebo multiorgánové formy histiocytózy z Langerhansových buněk u dospělých osob
- Radioterapie histiocytózy z Langerhansových buněk
- Hemofagocytující lymfohistiocytóza
- Erdheimova-Chesterova nemoc v obrazech
- Nekrobiotický xantogranulom – vzácná kožní komplikace u nemocného s mnohočetným myelomem
- Leukemie z dendritických buněk CD4+56+, typ DC2
- Systémová mastocytóza
- Představení histiocytárních chorob, o nichž pojednává toto supplementum časopisu Vnitřní lékařství
- Histiocytóza z Langerhansových buněkz pohledu patologa
- Diagnostická patológia non-Langerhansových histiocytóz
- Histiocytóza z Langerhansových buněk u dětí a dospívajících
- Granulomatóza z Langerhansových buněk
- Projevy histocytózy z Langerhansových buněk v ORL oblasti
- Projevy histiocytózy z Langerhansových buněk v orofaciální oblasti
- Histiocytóza z Langerhansových buněk – kožní aspekty onemocnění
- Histiocytóza z Langerhansových buněk u dospělých
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue
- Hemofagocytující lymfohistiocytóza
- Erdheimova-Chesterova nemoc v obrazech
- Systémová mastocytóza
- Histiocytóza z Langerhansových buněk u dětí a dospívajících
