Diagnostika a léčba akutní plicní embolie v roce 2010
Diagnosis and treatment of acute pulmonary embolism in 2010
Diagnostic approaches in acute pulmonary embolism include evaluation of clinical likelihood, D-dimers, echocardiography and spiral CT angiography and pulmonary scintigraphy. Determination of D-dimers is only meaningful in patients with low or intermediate clinical likelihood. It is safe not to initiate anticoagulation treatment (or to discontinue such treatment) in patients with low clinical likelihood of acute pulmonary embolism and negative D-dimer test (only if methods with 99–100% sensitivity are used). Duplex sonography and pulmonary scintigraphy are only necessary at the centres with a first generation spiral CT and not those with multidetector devices. Investigations in normotensive patients should include echocardiography that should also include assessment of the right ventricular function using echocardiography and determination of biomarkers of pulmonary embolism. Right ventricular dysfunction together with elevated troponins identifies a normotensive group at an increases risk. Highly sensitive troponin T (hsTnT) appears to be particularly valuable. Echocardiography reading might the decisive factor for treatment initiation in patients with massive acute pulmonary embolism. Negative or unclear echocardiography finding warrants spiral CT angiography (CTA). Ventilation/perfusion scan or pulmonary arteriography are recommendable in patients with unclear CTA finding and patients with high clinical likelihood of pulmonary embolism and negative CTA finding. A combination of CTA and CTV also appears useful as it increases the overall sensitivity of the investigation and enables imaging of pelvic veins. Thrombolytic treatment is indicated in haemodynamically unstable patients, patients with a high risk of a massive pulmonary embolism associated with cardiogenic shock or hypotension (systolic pressure below 90 mmHg or a decrease in systolic pressure by > 40 mmHg) or symptoms of acute right-sided heart failure. Thrombolytic treatment is also indicated in pulmonary embolism not receding following heparin treatment, in recurring or expanding pulmonary embolism, in the presence of thrombi in the right heart and in patients with right-to-left shunting through patent foramen ovale. This treatment should also be considered in patients with submassive pulmonary embolism associated with a dysfunction of the right ventricle and increased troponins, and particularly in patients lacking even a relative contraindication of thrombolytic treatment. A thrombolytic of choice is alteplase. Embolectomy or catheterization should be used if thrombolytic treatment is contraindicated or ineffective. Long-term monitoring of massive and submassive acute pulmonary embolism is highly recommended. Low molecular weight heparins or unfractioned heparin or fondaparinux are used in haemodynamically stable patients.
Key words:
diagnostics in pulmonary embolism – treatment of pulmonary embolism – thrombolytic treatment of pulmonary embolism
Authors:
J. Widimský
Authors‘ workplace:
Klinika kardiologie IKEM Praha, přednosta prof. MU Dr. Jan Kautzner, CSc., FESC
Published in:
Vnitř Lék 2011; 57(1): 5-21
Category:
Celebratory Discourse
Overview
Diagnostika akutní plicní embolie se opírá o posouzení klinické pravděpodobnosti, D‑dimery, echokardiografii a spirální CT angiografii a plicní scintigrafii. Stanovení D‑dimerů má význam jen u nemocných s nízkou nebo intermediární klinickou pravděpodobností. Lze bezpečně nezahajovat antikoagulační léčbu (nebo ji přerušit) u nemocných vykazujících nízkou klinickou pravděpodobnost akutní plicní embolie v kombinaci s negativními D‑dimery, což však platí jen pro metody vykazující 99 – 100% senzitivitu. Duplexní sonografie a plicní scintigrafie jsou nutná na pracovištích se spirálním CT 1. generace, nikoliv u multidetektorových přístrojů. Součástí vyšetření by měla být echokardiografie a u normotenzních pacientů také stanovení funkce pravé komory echokardiografií a stanovení biomarkerů plicní embolie. Nález dysfunkce pravé komory spolu se zvýšenými troponiny označuje více rizikovou skupinu normotenzních nemocných. Zvláště cenné se jeví vysoce senzitivní troponin T (hsTnT). U pacientů s akutní masivní plicní embolií může pozitivní echokardiografický nález rozhodnout o zahájení léčby. V případě negativního nebo nejasného echokardiografického nálezu je třeba provést spirální CT angiografii (CTA). U nemocných, kde nález na CTA je nejasný, a také u nemocných s vysokou klinickou pravděpodobností plicní embolie a negativním CTA nálezu je vhodné použít ventilačně‑perfuzní scan nebo provést plicní arteriografii. Výhodná se také jeví kombinace CTA a CTV, protože zvyšuje senzitivitu vyšetření a umožňuje zobrazit i pánevní žíly. Trombolytická léčba je indikována u hemodynamicky nestabilních nemocných, nemocných s vysokým rizikem masivní plicní embolie, provázené kardiogenním šokem nebo hypotenzí (systolický tlak nižší než 90 mm Hg nebo pokles systolického tlaku o > 40 mm Hg) nebo projevy akutního pravostranného srdečního selhání. Trombolytická léčba je indikována dále u plicní embolie neustupující při léčbě heparinem, u recidivující a narůstající plicní embolie, v přítomnosti trombů v pravém srdci a u pacientů s foramen ovale apertum s pravolevým zkratem. U submasivní plicní embolie provázené dysfunkcí pravé komory a zvýšenými troponiny je třeba zvážit tuto léčbu, zejména u nemocných postrádajících i relativní kontraindikace trombolytické léčby. Trombolytikem volby je altepláza. Při kontraindikaci trombolytické léčby nebo její neúčinnosti je na místě embolektomie nebo katetrizační léčba. Dlouhodobé sledování akutní plicní embolie masivní a submasivní je velice vhodné. U hemodynamicky stabilních nemocných používáme nízkomolekulární hepariny nebo UFH heparin nebo fondaparinux.
Klíčová slova:
diagnostika plicní embolie – léčba plicní embolie – trombolytická léčba plicní embolie
Předneseno ve zkrácené formě jako slavnostní přednáška na zahájení XVII. kongresu České internistické společnosti České lékařské společnosti J. E. Purkyně v Brně dne 29. září 2010.
Výskyt
Výskyt plicních embolií není přesně znám. Epidemiologická data jsou jen lokální. V západní Francii podle EPI-GETBO STUDY [1] je četnost plicních embolií 60/100 000 obyvatel a žilní trombózy 124/100 000. Pokud bychom extrapolovali statistická data z lokálních evropských epidemiologických studií na 25 zemí EU, potom by každoroční zátěž rozpoznanými žilními tromboemboliemi činila 684 019 nemocných s žilní trombózou a 434 732 plicních embolií, přičemž úmrtí na tromboembolickou nemoc by představovalo 543 454 osob za rok.
Podle guidelines Evropské kardiologické společnosti z roku 2000 [2] činí roční výskyt žilní trombózy a plicní embolie 0,5–1,0 na 1 000 obyvatel. Skutečný výskyt může být podstatně vyšší, protože studie Meignana et al [3] zjistila u nemocných s hlubokou žilní trombózou, že výskyt němých plicních embolií podle perfuzního scanu činil 40–50 %.
Akutní plicní embolie představuje 3. nejčastější kardiovaskulární onemocnění, po hypertenzi a ICHS. Většina plicních embolií se vyskytuje podle klinických dat ve věkové skupině 60–70 let, podle autoptických dat pak ve věkové skupině 70–80 let.
Diagnostika
Diagnostika akutní plicní embolie patří mezi nejsvízelnější. U většiny nemocných lze bez zobrazovacích metod hovořit nejvýše o stupni pravděpodobnosti.
Klinicko-patologické studie ukazuji, že se správně rozpoznává jen 30–50 % plicních embolií [4].
Mortalita nerozpoznané a neléčené akutní plicní embolie činí 30 %, naproti tomu průměrná mortalita poznané a léčené akutní plicní embolie činí 8 %.
Správnost diagnózy klesá obecně s věkem nemocného, snižuje se u nemocných majících současně bronchopneumonii; stoupá naopak u nemocných s hlubokou žilní trombózou.
Zdrojem akutní plicní embolie (APE) jsou trombózy hlubokých žil dolních končetin u 85 % nemocných, a to nejen proximální, ale i popliteální; u dalších nemocných bývají zdrojem plicní embolie pánevní žíly, ledvinné žíly, dolní dutá žíla, pravé srdce aj.
Důležité je na možnost akutní plicní embolie myslet. Proto bychom neměli opomenout myslet na možnost APE u nemocných s predisponujícími rizikovými faktory. Predisponující faktory žilní trombózy s následnou plicní embolií zahrnují Virchowovu trias: změny koagulace, poruchy cévní stěny a zpomalení toku krve.
Rizikové faktory akutní plicní embolie
Rizikové faktory podle guidelines British Thoracic Society 2003 [5] ukazuje tab. 1.
![Rizikové faktory žilní tromboembolie podle British Thoracic Society 2003 [5].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/50ca90e0c2d2b4333fede57a1e3aacb7.jpg)
Trombofilní rizikové faktory ukazuje tab. 2 [6].
![Trombofilní rizikové faktory [6].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/590e5124353073a9a00b677439b59b56.jpg)
Pacienty, u nichž je indikováno vyšetření trombofilních faktorů, ukazuje tab. 3.

Skoro 50 % žilních trombóz vzniká u osob, u kterých nejsme schopni nalézt žádné klinické ani laboratorní rizikové faktory.
Anamnéza
Nejčastějším anamnestickým příznakem je náhle vzniklá nebo náhle zhoršená klidová dušnosti (vyskytuje se u 85–95 % pacientů) (tab. 4).

Vyšší výskyt synkopy v naší studii lze vysvětlit, že se jedná o 10leté údaje z koronární jednotky. Méně časté jsou bolesti na hrudi. Ty mohou připomínat bolest na hrudi při akutním infarktu myokardu nebo mají charakter pleurální. Oba typy bolestí na hrudi se nevyskytují častěji než u 50 % nemocných. Kašel se vyskytuje asi u 1/5 nemocných, synkopa u 14 % a hemoptýza u 7 %. Trias dušnost + bolest na hrudi + hemoptýza se vyskytuje u 5–7 % nemocných (hemoptýza se vyskytuje především u nemocných s plicním infarktem) [9].
Důležité je rozpoznání žilní trombózy, neboť indikuje zahájení léčby i při chybění známek plicní embolie. Pro diagnostiku žilní trombózy je důležitá duplexní sonografie.
Tachypnoe a tachykardie jsou nejčastější klinické známky plicní embolie. Na plicní embolii myslíme také při vzniku synkopy nebo náhle vzniklé hypotenze, často totiž značí masivní plicní embolii.
Klinický obraz a průběh
Je účelné rozeznávat následující formy akutní plicní embolie:
- masivní plicní embolii,
- submasivní plicní embolii,
- malou plicní embolii.
Tab. 5 ukazuje porovnání klasifikace akutní plicní embolie podle guidelines České kardiologické společnosti [6] a podle guidelines Evropské kardiologické společnosti [10].
![Klasifikace akutní plicní embolie podle guidelines České kardiologické společnosti [6] a podle guidelines Evropské kardiologické společnosti [10].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/6edaa210311d96345c3c22e3e4d77926.jpg)
Hlavním důvodem odlišné evropské klasifikace akutní plicní embolie je skutečnost, že radiologové při popisu CT angiografie (CTA) používají často popis plicní embolie jako masivní. Lékaři proto mohou zaměnit masivní plicní embolii určenou klinicky podle hemodynamické nestability s „masivní“ plicní embolií podle CTA u hemodynamicky stabilního pacienta.
Akutní masivní plicní embolie (plicní embolie s vysokým rizikem)
Masivní plicní embolie je klinický název, charakterizovaný hemodynamickou nestabilitou. Má závažnou prognózu a mortalita i léčené masivní plicní embolie se pohybuje kolem 20–30 %.
Akutní masivní plicní embolie může vést k náhlé smrti (nastává u asi 10 % masivních plicních embolií). Z nemocných, kteří umírají na masivní plicní embolii, umírají 2/3 do 2 hod.
Masivní plicní embolie může dále vést k rozvoji kardiogenního šoku s hypotenzí, oligurií, obluzením a chladnou, zpocenou a bledou kůží a někdy i cyanózou.
Masivní plicní embolie může vést k hypotenzi bez známek šoku. Za hypotenzi považujeme systolický tlak 90 mm Hg a nižší nebo náhlý pokles systolického tlaku o nejméně 40 mm Hg trvající ≥ 15 min, nevyvolaný náhle vzniklou arytmií nebo hypovolemií. Samotná tachykardie a tachypnoe bez hypotenze nejsou známkami nestability krevního oběhu.
Akutní masivní plicní embolie může způsobit akutní cor pulmonale, vyznačující se přítomností známek akutního selhání pravé srdeční komory, mezi něž patří vznik akutní dilatace pravé srdeční komory, tachykardie, přítomnost cvalového rytmu, systolický šelest z trikuspidální insuficience a zvýšený žilní tlak (náplň krčních žil v poloze polosedě je zvýšená) a někdy je pozitivní i hepatojugulární reflux.
Akutní submasivní plicní embolie (plicní embolie s intermediárním rizikem)
Klinický průběh je charakterizován hemodynamickou stabilitou, avšak při echokardiografickém vyšetření jsou přítomny známky dysfunkce pravé komory. Jelikož nemocní se známkami dysfunkce pravé komory vykazují zhruba 2krát vyšší mortalitu nežli stabilizovaní nemocní bez dysfunkce pravé komory; studie ICOPER 1999 [7] doporučuje zachovat tuto podskupinu nemocných.
Guidelines Evropské kardiologické společnosti [10] také zdůrazňují vyšší riziko nemocných, u nichž je dysfunkce pravé komory provázena zvýšením troponinů, a definují tuto skupinu plicních embolií jako plicní embolie s intermediárním rizikem.
Akutní malá plicní embolie (plicní embolie s malým rizikem)
Je charakterizována chyběním hypotenze nebo šoku a chyběním známek dysfunkce pravé komory, jakož i chyběním známek poškození myokardu [4].
Projeví se tachypnoí (24 dechů/min a více) a tachykardií. Ještě menší plicní embolie může být němá nebo se projeví jen malým zvýšením teploty.
Tab. 6 ukazuje hlavní markery rizika akutní plicní embolie podle evropských guidelines [10].
![Hlavní markery stratifikace rizika akutní plicní embolie [10].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/fabb85a4bab3fee063042612b4ba3d23.jpg)
Výskyt jednotlivých klinických forem akutní plicní embolie
- 13 % akutní srdeční zástava nebo kardiogenní šok
- 9 % hypotenze bez známek šoku
- 31 % hemodynamicky stabilní, ale dysfunkce PK na echokardiografii
- 47 % hemodynamicky stabilní bez dysfunkce PK na echokardiografii
Mortalita akutní plicní embolie
Mortalita akutní plicní embolie je vyšší, než bylo dosud na podkladě menších prací udáváno. Studie ICOPER [7] byla vlastně registrem akutní plicní embolie. Zahrnula 2 110 nemocných, u nichž byla diagnóza potvrzena autopsií nebo plicním scanem.
Tříměsíční mortalita akutní plicní embolie činila 17,4 %. Po vyloučení nemocných, u nichž byla plicní embolie rozpoznána až při pitvě, činila tříměsíční mortalita 15,3 %.
Registr ICOPER zjistil [7], že u 5–10 % nemocných byl přítomen kardiogenní šok při přijetí do nemocnice s mortalitou pohybující se mezi 25 a 50 %.
Diagnostika akutní plicní embolie se opírá o:
- stanovení klinické pravděpodobnosti,
- D-dimery,
- echokardiografii,
- zobrazovací metody: CT angiografii nebo ventilačně-perfuzní scintigrafii.
Stanovení klinické pravděpodobnosti
Zjednodušený klinický model pravděpodobnosti plicní embolie můžeme použít podle Wellse et al z roku 2000 [11], jak uvádějí česká i evropská doporučení [6,10] nebo revidované Geneva skóre [12] uváděné evropskými doporučeními.
Zjednodušený klinický model pravděpodobnosti plicní embolie podle Wellse et al [11] ukazuje tab. 7.
![Zjednodušený klinický model pravděpodobnosti plicní embolie podle Wellse et al [11].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/f69ee5698940dcf983a7c1bba1a28dba.jpg)
Wells et al [11] ověřovali tento model klinické pravděpodobnosti u 1 239 pacientů a vymezili skupiny s nízkou, střední a vysokou klinickou pravděpodobností plicní embolie.
Tab. 8 pak ukazuje výskyt plicní embolie podle klinické pravděpodobnosti plicní embolie.
![Pravděpodobnost plicní embolie podle skóre klinického modelu pravděpodobnosti [11].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/573338730252f5f8e69cb754a323c1cd.jpg)
Uvádíme zde revidované Geneva skóre [12], které není obsaženo v českých doporučeních (tab. 9).
![Revidované Geneva skóre [12].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/9d70c7e8f87d31686497a4fe6b7d7536.jpg)
Hodnocení klinické pravděpodobnosti podle Geneva skóre ukazuje tab. 10.

Tento algoritmus lze používat ve zjednodušené formě. Plicní embolii hodnotíme jako nepravděpodobnou, pokud dosáhneme tímto skóre jen 4 a méně bodů, a pravděpodobnou, pokud skóre čítá > 4 body.
D-dimery
D-dimery jsou konečným výsledkem působení plazminu na fibrin. Plazmin jako proteolytický enzym štěpí nejen fibrin a fibrinogen, ale i faktor V, faktor VIII a protrombin. Štěpné produkty vzniklé štěpením fibrinogenu jsou fibrinogen degradační produkty (FDP), zatímco degradací definitivního, zpevněného fibrinu plazminem vznikají D-dimery.
Stanovení D-dimerů v klinické praxi je užitečné k vyloučení diagnózy plicní embolie či žilní trombózy při ambulantním vyšetření, protože výsledek D-dimerů má vysokou negativní predikční hodnotu. Pozitivita D-dimerů však provází všechny stavy, které jsou synonymem fibrinemie, např. záněty, nekrózy, nádorová onemocnění, infekce a podobně, což je důvodem jejich nízké specificity. Specificita D-dimerů je také snížena u starších osob, u těhotných, u maligních onemocnění a u hospitalizovaných pacientů. Z těchto důvodů je diagnostická hodnota zvýšených D-dimerů omezená.
Stanovení D-dimerů se má provádět ELISA nebo LIA metodami. ELISA metody mají dobrou senzitivitu a průměrnou specificitu. Aglutinační testy z plné krve a latexové testy mají senzitivitu kolem 85 %, která neumožňuje jejich použití k vyloučení plicní embolie nebo žilní trombózy. U nás se pro stanovení D-dimerů používá mnohdy latexový test a aglutinační testy z plné krve, které mají problematickou senzitivitu, protože propouštějí až 15 % nemocných s možnou plicní embolií! Tyto testy jsou doporučeními Evropské kardiologické společnosti z roku 2000 [2] považovány za nevhodné.
Při použití citlivých metod, jako jsou rychlé ELISA testy a LIA testy, je možné s vysokou senzitivitou vyloučit plicní embolii při hodnotách D-dimerů pod 300 ng/l.
Nález negativních D-dimerů u pacientů s nízkou nebo střední klinickou pravděpodobností žilní tromboembolie značí vyloučení plicní embolie i žilní trombózy. U takových nemocných 3měsíční riziko žilní tromboembolie činí jen 0,14 %.
Pokud je klinická pravděpodobnost plicní embolie vysoká, stanovení D-dimerů neprovádíme.
Pokud je však klinická pravděpodobnost plicní embolie nízká nebo intermediární, stanovujeme D-dimery.
Srdeční biomarkery
Rozeznáváme následující biomarkery:
- a) troponiny,
- b) natriuretické peptidy a
- c) nové biomarkery.
Troponiny
Zvýšení srdečních troponinů nenalé-záme pouze u akutních koronárních syndromů, ale mohou být zvýšeny i při akutní plicní embolii. U akutní plicní embolie pomáhá zvýšení srdečních troponinů stratifikaci hemodynamicky stabilních normotenzních nemocných. Zvýšení cTnT se jeví jako diskriminující faktor rozlišující nemocné s vyšší a s nízkou mortalitou.
Negativní predikční hodnota činí 0,99, pozitivní predikční hodnota ale jen 0,34.
Zvýšení srdečních troponinů představuje marker postižení pravé komory a závažnosti akutní plicní embolie i u nemocných bez ICHS.
Zvýšení srdečních troponinů spolu s nálezem dysfunkce pravé komory označuje skupinu nemocných s podstatně vyšším rizikem.
Troponiny by se měly stanovit při přijetí nemocného a znovu za 6–7 hod, protože maximální hodnoty troponinů se objevují až za 6–12 hod pro vzniku akutní plicní embolie. Stanovení troponinů má význam jen u pacientů přijatých do 72 hod po vzniku příznaků.
Troponin T vyšší než 0,01 ng/ml má negativní prognostický význam [13].
Metaanalýza zahrnující 20 studií uveřejněných od roku 1998 a obsahující 1 985 pacientů s akutní plicní embolií, u nichž byly stanoveny troponiny, ukázala, že jakékoliv zvýšení troponinů zvyšuje 5násobně zvýšené riziko úmrtí (OR 5,24; 95 % CI 3,28–8,38), zvýšené riziko úmrtí způsobené plicní embolií (poměr šancí 9,44, 95 % CI 4,14–21,49) [14].
Nedávná metaanalýza 13 studií zahrnující jen normotenzní pacienty (n = 1 132) potvrdila, že zvýšení troponinů značí zvýšené riziko časného úmrtí – poměr šancí 7,6, zvýšené riziko komplikované hospitalizace – poměr šancí 6,8 [15].
Zvýšení troponinů samo o sobě neznačí nezbytně špatnou prognózu [15]. Hraniční hodnoty nejsou dosud známy [16].
Podle současných názorů nestačí zvýšení troponinů samo o sobě u normotenzních pacientů s akutní plicní embolií k zařazení plicní embolie do kategorie submasivní plicní embolie a není schopné samo o sobě určit pacienty vyžadující agresivní léčbu.
Natriuretické peptidy – Brain Natriuretic Peptide (BNP) a N-terminal (NT) -proBNP
Zvýšené hodnoty BNP a (NT)-proBNP provázejí dysfunkci pravé komory u nemocných s akutní plicní embolií. Vysoká hodnota natriuretických peptidů stanovená při přijetí je známkou zvýšeného rizika mortality akutní plicní embolie.
Natriuretické peptidy jsou také zvýšeny u nemocných s presorickou zátěží pravé komory z jiných příčin než plicní embolie, včetně plicní arteriální hypertenze, chronické tromboembolické plicní hypertenze a plicní hypertenze při plicních nebo srdečních onemocněních. Charakteristické je zvýšení natriuretických peptidů u srdečního selhání.
BNP 50 pg/ml se jeví jako hraniční hodnota. Nižší hodnoty značí dobrou prognózu [17]. Hraniční hodnotu pro NT-pro BNP představuje hodnota 1 000 pg/ml [18].
Hodnoty BNP vyšší než 90 pg/ml měly senzitivitu 64 % a specificitu 94 % pro detekci dysfunkce pravé komory za předpokladu chybění dysfunkce levé komory.
Současně přítomná dysfunkce levé komory důsledkem dalšího srdečního onemocnění vede sama o sobě ke zvýšení BNP a u těchto nemocných nemá stanovení BNP pro diagnostiku postižení pravé komory diagnostický význam.
Hodnoty NT-proBNP < 500 pg/ml jsou nezávislým prediktorem nekomplikovaného průběhu akutní plicní embolie. Takové hodnoty svědčí pro nepřítomnost středně těžké nebo těžké dysfunkce pravé komory. NT-proBNP je také nezávislým prediktorem špatné prognózy, zejména pokud je vzata v úvahu klinická závažnost plicní embolie a zvýšení troponinu.
Nedávná metaanalýza 13 studií zjistila u 51 % z 1 132 pacientů s plicní embolií zvýšení BNP nebo NT-pro BNP Zvýšení bylo provázeno zvýšeným rizikem časného úmrtí (OR 7,6; 95 % CI 3,4–17) a komplikovaného nemocničního průběhu (OR 6,8; 95 % CI 4,4–10) [16].
Nicméně zvýšení natriuretických peptidů samo o sobě neopravňuje zahájení invazivní léčby včetně trombolýzy.
Při opětovaném sledování průběhu léčby jsou však troponiny méně vhodné nežli natriuretické peptidy. Troponiny totiž mají příliš dlouhý poločas, takže mohou být zvýšeny i v době, kdy již došlo ke zlepšení hemodynamiky a opětnému nastolení integrity myocytů myokardu pravé komory. Jelikož BNP i NT-pro BNP mají krátký poločas (přibližně 20 min), je vhodnější je používat ke sledování zlepšení nebo zhoršení stavu nemocného.
Nové biomarkery
Mezi ně patří:
- a) Heart-type fatty acid binding protein (H-FABP) – protein vážící se na mastné kyseliny srdečního typu,
- b) Growth differentiation factor-15 (GDF-15) – faktor 15 růstové diferenciace,
- c) Highly sensitive troponin T (hsTnT) – vysoce senzitivní troponin T.
Heart type fatty acid binding protein (H-FABP) – protein vážící se na mastné kyseliny srdečního typu
Proteiny vázáné na mastné kyseliny srdečního typu (H-FABP) jsou relativně malé cytoplazmatické proteiny (12–15 kDa), které se hojně nacházejí ve tkáních s aktivním metabolizmem mastných kyselin, včetně myokardu. Ve skutečnosti jsou H-FABP jsou důležité pro myokardiální homeostázu, jelikož 50–80 % srdeční energie pochází z oxidace lipidů a H-FABP umožňuje intracelulární transport nerozpustných mastných kyselin. Při poškození myokardu difundují tyto malé proteiny daleko rychleji než troponiny intersticiálním prostorem a objevují se v krevním oběhu již za 90 min po vzniku symptomů, vrcholné koncentrace dosahují během 6 hod.
H-FABP mají vynikající negativní prognostickou hodnotu 100 % [19]. Pozitivní prognostická hodnota je vyšší než pozitivní prognostická hodnota troponinu T nebo NT-proBNP. Kombinace zvýšeného H-FABP a dysfunkce na echokardiografii dále výrazně zvyšuje pozitivní prognostickou hodnotu.
Zvýšení H-FABP při přijetí představuje mocný prediktor komplikovaného průběhu akutní plicní embolie během 30 dnů [19]. Za hraniční koncentraci H-FABP se považuje hodnota 6,0 ng/ml. Hraniční hodnota 6,0 ng/ml vykazovala senzitivitu 0,89 a specificitu 0,82. Pacienti vykazující při přijetí hodnoty H-FABP ≥ 6,0 ng/ml měli 35,6krát vyšší riziko komplikovaného 30denního průběhu a 4,5krát vyšší riziko úmrtí během dlouhodobéhosledování [19].
Growth differentiation factor-15 (GDF-15) – faktor 15 růstové diferenciace
Růstový diferenciační faktor 15 (Growth Differentiation Factor-15 – GDF-15) je cytokin, který se objevuje při ischemii nebo tlakové zátěži. Je tvořen makrofágy a dalšími buněčnými typy jako reakce na různé stresory včetně prozánětlivých cytokinů. Za normálních podmínek myokard GDF-15 netvoří. Hodnoty GDF-15 v krvi podávají nezávislou prognostickou informaci u pacientů s akutním koronárním syndromem nebo srdečním selháním. Lankeit et al [20] určovali GDF-15 u 123 pacientů s akutní plicní embolií. Za horní limit považovali autoři hodnotu vyšší než 1 200 ng/l. Pacienti se zvýšenou hodnotou byli starší, častěji byli v kardiogenním šoku nebo měli chronické srdeční selhání, měli častěji diabetes mellitus, maligní onemocnění nebo renální dysfunkci. Žádný z pacientů majících hodnoty GDF-15 nižší než 1 200 ng/l neměl větší komplikace během prvých 30 dnů. Pokud se týče prognostického významu GDF-15, určili Lankeit et al [20] hodnotu 4 600 ng/l. Tato hodnota se vyznačovala prognostickou senzitivitou 0,71, specificitou 0,90 a negativní prognostickou hodnotou 0,95. V uvedené studii nezvyšovalo GDF-15 jen kardiogenní šok a srdeční selhání, ale také extrakardální faktory jako malignita, diabetes a renální dysfunkce. Myokardiální specificita GDF-15 je proto patrně nižší nežli NT-proBNP, srdeční troponiny a H-FABF. GDF-15 může být ale výhodný v kombinaci s dysfunkcí pravé komory, protože tato kombinace dávala přesnější prognostická data nežli cTnT nebo NT-proBNP.
Highly sensitive troponin T (hsTnT) –vysoce senzitivní troponin T
Konvenční troponiny mají nízkou prognostickou senzitivitu a negativní prognostickou hodnotu.
Vysoce sensitivní troponin T byl ve studii Lankeita et al [21] stanoven kvantitativní elektrochemiluminescentní immunoassayí (Elecsyn 2010 analyser, Roche Diagnostics, Mannheim, Germany). Význam vysoce senzitivního troponinu T(hsTnT) byl porovnán s konvenčním cTnT u 156 normotenzních pacientů s akutní plicní embolií [21]. Hraniční hodnoty jsou 14 ng/ml. Hodnoty hsTnT ≥ 14 ng/l byly porovnány s hraničními hodnotami konvenčního troponinu T ≥ 0,03 a ≥ NT-proBNP pg/ml. Pacienti vykazující hodnoty hsTnT ≥ 14 ng/l vykazovali častěji tachykardii, byli starší, měli častěji synkopu, měli častěji srdeční selhání a také glomerulární filtraci < 60 ml/min/1,73 m2. Pacienti s komplikovaným průběhem vykazovali významně vyšší hodnotu hsTnT nežli pacienti bez komplikací – 71,7 (35,5–117,9) vs 26,4 (9,2–68,2 pg/ml) (p = 0,027). Pacienti s normálními hodnotami hsTnT (< 14 pg/ml) vykazovali výbornou prognózu. Autoři ukázali, že běžné troponiny nejsou na rozdíl od vysoce senzitivního troponinu T schopny diferencovat mezi zvýšeným a normálním rizikem [21].
Negativní prognostická hodnota hsTnT činí 100 % a pozitivní prediktivní hodnota také 100 %.
hsTnT se ukázal jako cenný prognostický parametr i pro dlouhodobou prognózu na rozdíl od NT-proBNP a konvenčního cTnT, které pro dlouhodobou prognózu se jevily jako bezcenné.
Dysfunkce pravé komory stanovená echokardiografií nebo CT angiografií v kombinaci se zvýšením hsTnT se jeví tč. jako optimální kombinace ke stratifikaci rizika normotenzních pacientů s akutní plicní embolií [21].
Nové biomarkery se vyznačují lepší pozitivní i negativní predikční hodnotou nežli dosavadní biomarkery, tj. troponiny a NT-proBNP. Platí to zejména pro hsTnT a H-FABP. S novými biomarkery však bude třeba získat další zkušenosti na větších studiích, které by potvrdily uvedené slibné výsledky a také prokázaly, zda je hsTnT lepším prediktorem nežli ostatní nové biomarkery.
Echokardiografie
Typický obraz významné akutní plicní embolie je charakterizován kombinací dilatace pravé komory, hypokinézy volné stěny, zvýšení poměru enddiastolického rozměru PK/LK. Dalšími známkami jsou abnormální pohyb septa – oploštění až jeho vyklenování do levé komory, dilatace pravé síně, dilatace proximálních partií plicních žil, dilatace dolní duté žíly s omezením jejího kolabování v závislosti na respiraci [6,10].
Současný nález známek plicní hypertenze (maximální rychlost trikuspidálního regurgitačního toku > 2,5 m/s) a dilatace PK (poměr velikosti pravé a levé komory > 0,5) má v diagnostice plicní embolie senzitivitu až 93 %, specificitu 81 % a negativní prediktivní hodnotu 94 %.
Dilatace pravé komory je definována jako enddiastolický rozměr PK nad 30 mm měřený z parasternální projekce na dlouhou osu nebo jako poměr enddiastolických rozměrů pravé a levé komory nad 0,5. Dilataci pravé komory můžeme také definovat jako poměr enddiastolických ploch levé a pravé komory nad 0,6 při měření z apikální 4dutinové projekce [6].
Současný nález dilatace pravé komory a poruchy kinetiky její volné stěny označujeme jako její dysfunkci, neboli akutní cor pulmonale. Vyskytuje se u 30–40 % hemodynamicky stabilních nemocných s akutní plicní embolií a dále u nemocných s oběhovou nestabilitou. V každodenní praxi je nejpřínosnější usuzovat na dysfunkci pravé komory při nálezu její dilatace.
Je však třeba zdůraznit, že normální echokardiogram plicní embolii zcela nevylučuje, protože až 20 % pacientů s akutní plicní embolií má normální nález na echokardiografii.
Echokardiografie je cenná v odlišení jiných příčin hemodynamické nestability, dušnosti, bolestí na hrudi nebo zvýšení hodnot biomarkerů. Snadno rozpozná systolickou dysfunkci levé komory srdeční při ICHS nebo dilatační kardiomyopatii, myokarditidě či chlopenní vadě, která způsobí dušnost a plicní hypertenzi. Dále odliší např. perikardiální tamponádu nebo aortální direkci jako příčinu arteriální hypotenze.
Dysfunkce pravé komory je i u hemodynamicky stabilních nemocných spojena s až 2krát vyšší hospitalizační mortalitou než nemocný bez dysfunkce pravé komory [7].
Průchozí foramen ovale (PFO) při pravo-levém zkratu je cestou, kudy může žilní trombus proniknout do systémové arteriální cirkulace (paradoxní embolie). Tromby v pravé komoře nebo pravé síni jsou přítomny až u 4 % nemocných s plicní embolií, ale při vyšetření do 24 hod až u 18 %.
U všech nemocných s plicní embolií je nutno před ukončením hospitalizace zopakovat echokardiografické vyšetření. Při přetrvávající plicní hypertenzi a/nebo dysfunkci pravé komory je zvýšeno riziko vzniku chronické tromboembolické plicní hypertenze. Tyto nemocné má pravidelně sledovat kardiolog a při přetrvávání známek plicní hypertenze a/nebo projevech selhávání pravé komory doporučit nemocného do centru pro léčbu plicní hypertenze.
Za projev dysfunkce je rovněž považováno snížení amplitudy systolického dopředního pohybu trikuspidálního anulu (TAPSE – tricuspid annular plane systolic excursion) pod 15 mm. Je však nutné dodat, že toto kritérium nebylo doposud ověřeno pro akutní plicní embolii. Podobně lze využít k posouzení dysfunkce pravé komory i tkáňovou pulzní dopplerovskou echokardiografii [22].
V literatuře není dosud jasná shoda v definici echokardiografických projevů dysfunkce pravé komory, což vede k rozdílům v její incidenci a prognostickém významu u jednotlivých autorů, a tuto heterogenitu zdůrazňuje i metaanalýza echokardiografických studií Sancheze et al [23]. Proto i aktuální doporučení pro diagnostiku a léčbu plicní embolie doporučují pro zjednodušení užívat v klinické praxi jako projev dysfunkce pravé komory pouze známky její dilatace. Sanchez et al [23] upozorňují ve své metaanalýze i na relativně nízkou celkovou specificitu (57 %) i pozitivní predikční hodnotu (58 %) echokardiografie.
Transezofageální echokardiografie umožňuje detekci plicní embolie ve kmeni plícnice nebo v pravé plícnici, někdy i v levé plícnici.
Nemocní se systolickým tlakem v plícnici > 50 mm Hg při přijetí a nemocní s přetrvávající dysfunkcí pravé komory před propuštěním z hospitalizace jsou pacienti se závažnější formou onemocnění, u kterých bude patrně v budoucnu přetrvávat plicní hypertenze a jejich kapacita pro fyzickou zátěž bude omezena. Bude vhodné tyto nemocné dále sledovat.
Echokardiografie má být v nemocnici k dispozici 24 hod denně 7 dní v týdnu.
Zobrazovací metody
V diagnostice akutní plicní embolie hrají zásadní roli zobrazovací metody. Patří mezi ně:
- výpočetní tomografie,
- ventilačně-perfuzní scan, event. perfuzní scan hodnocený spolu s RTG snímkem hrudníku,
- klasická plicní angiografie získaná srdeční katetrizací.
Magnetická rezonance se dosud nalézá ve výzkumném stadiu.
Zobrazovací metoda by měla být ideálně použita do 1 hod u akutní masivní plicní embolie a do 24 hod u akutní plicní embolie, která není masivní.
Spirální CT angiografie (CTA)
Technickým vrcholem současnosti jsou multidetektorové spirální CT přístroje, které snímají najednou až několik desítek vrstev, takže je možné ještě více urychlit posun stolu.
Nemocný v průběhu expozice zadržuje dech v inspiriu, takže by měl v případě použití sekundového přístroje tolerovat dobu apnoe 20–25 s. U zřetelně dušných nemocných tolerujeme mělké pravidelné dýchání a zkracujeme co nejvíce dobu expozice. U nejmodernějších CT přístrojů (2–64 řad detektorů) je samozřejmě potřebné přizpůsobit vyšetřovací protokol konkrétním parametrům přístroje. Obecně lze shrnout, že s nimi lze zkrátit expoziční čas (až na 5–10 s) a dosáhnout užší kolimace vrstev, což vede k dalšímu zvýšení rozlišovací schopnosti metody [24].
Nepřímá CT venografie (CTV) hlubokého žilního systému dolních končetin, pánve a retroperitonea může být doplněna ve stejném sezení s CTA. Využíváme opacifikace žilního systému v pozdní fázi po podání bolu kontrastní látky potřebné pro vyšetření plicního řečiště. S časovým odstupem 3–4 min pokrýváme další expozicí tělesný rozsah od bránic až po bérce.
Přítomnost embolie v tepně se projeví buď částečně obtékaným hypodenzním defektem v kontrastní náplni tepny, nebo její kompletní obliterací. Postižený úsek tepny může být mírně rozšířený. Relativně specifickým nálezem jsou také periferní klínovité opacity s bází přilehlou k viscerální pleuře a centrálně směřujícím otupeným hrotem.
Plicní infarkty vznikají zhruba v 10 % případů plicní embolie, a to především u kardiopulmonálně nemocných s plicní žilní hypertenzí nebo omezenou bronchiální tepennou kolateralizací. Zobrazují se jako ostře ohraničená, klínovitá, opět typicky periferně lokalizovaná ložiska, která se v průběhu několika dnů demarkují v původně rozsáhlejší hemoragické opacitě.
Diagnostická přesnost CTA. Při centrálním postižení až do úrovně segmentálních tepen přesahují ukazatelé diagnostické přesnosti 95 %. Hodnotitelnost periferního řečiště závisí na technických parametrech přístroje.
Spirální CT angiografie provedená na přístrojích 1. generace, tj. jednovrstevnatých, vykazuje nízkou senzitivitu, podle PIOPED jen 70 % [25]. Senzitivita plicní scintigrafie je větší. Proto v případech negativity CT 1. generace se doporučuje doplnit vyšetření plicní scintigrafií a/nebo ultrasonografií žilního systému dolních končetin. Již ale 4detektorové přístroje mají prakticky stejnou přesnost jako klasická plicní katetrizační angiografie.
Spirální CTA na multidetektorovým přístroji 4-, 16 - až 64vrstevnatém umožňuje lepší zobrazení segmentálních a subsegmentálních tepen. Metaanalýza 23 studií zahrnující 4 657 pacientů ukázala, že výskyt žilní tromboembolie po negativní CTA činí během 3 měsíců jen 1,4 % a fatálních plicních embolií jen 0,61 % [26].
Negativní prediktivní hodnota „zlatého standardu“ katetrizační plicní angiografie činí 96,4 % podle van Beeka et al [27] a 100 % podle Henryho et al [28] a není lepší nežli negativní prediktivní hodnota vícevrstevnaté CTA, která podle metaanalýzy Quiroze et al činí 99,1 % [29].
3měsíční výskyt žilních tromboembolií po negativní katetrizační plicní arteriografii a po negativní CTA. U 619 pacientů byla plicní embolie vyloučena katetrizační plicní arteriografií [27]. 3měsíční výskyt žilní tromboembolie u neléčených pacientů činil 1,7 %. V CHRISTOPHER studii byla plicní embolie vyloučena u 1 434 pacientů. 3měsíční výskyt žilní tromboembolie u neléčených nemocných činil 1,3 % [30]. Výskyt shodný s klasickou plicní arteriografií.
CTA umožňuje také posouzení přítomnosti dilatace pravé komory [31]. Zvětšení pravé komory na CTA je definováno diametrem PK 90 % a větším, nežli je diametr levé komory [31], což je nezávislý prediktor úmrtí i nefatálních klinických komplikací. Dilatace pravé komory stanovená poměrem PK/LK větším než 0,9 byla provázena poměrem šancí pro náhlou smrt 5,2 (p = 0,03) a celkovou 30denní mortalitou 16 % v porovnání s 8% mortalitou pacientů bez dilatace pravé komory [31].
Úloha nepřímé CT venografie. Výsledky nedávno zveřejněné studie PIOPED II [25], která využívala k provedení CTA 4 - až 16detektorových přístrojů, ukázaly, že využitím CTV lze dosáhnout zlepšení senzitivity CTA z 83 % na 90 %. Je třeba mít na paměti, že se kombinací CTA a CTV zvyšuje radiační zátěž, což je třeba zvažovat zejména u mladých nemocných.
U pacientů s vysokou klinickou pravděpodobností akutní plicní embolie, u nichž je CTA i CTV negativní, je nutné doplnit další vyšetření, a to buď opakovat vyšetření žilního systému (ultrasonografie, CT nebo i MR), ventilačně-perfuzní scan nebo plicní katetrizační angiografii.
Spirální CTA umožňuje také zobrazit patologii plic, pleurální dutiny, a tak zjistit např. nádor, pleurální výpotek, atelaktázu, pneumotorax, lymfadenopatii, emfyzém, plicní edém při srdečním selhání, plicní fibrózu, trauma, ale i o aortální disekci a další patologické stavy.
Při nedostupnosti spirálního CT nebo při nejasném výsledku CTA je vhodné provést plicní scintigrafii. Tento algoritmus platí pro multidetektorové přístroje. U CT přístrojů 1. generace má přednost plicní scintigrafie.
Radiačně hygienické aspekty provedení CTA. Efektivní dávka při CTA provedené multidetektorovým CT přístrojem dosahuje 2,2–6 mS. U dospělých žen je z hlediska radiační zátěže výhodnější provést scintigrafické vyšetření, a to jednak pro celkově nižší efektivní dávku (1,2 mS) a dále pro podstatně nižší ozáření mléčné žlázy. Naopak u těhotných je lépe, pokud je to klinicky potřebné, upřednostnit CTA, neboť ve srovnání se scintigrafií méně zatěžuje plod (0,03–0,13 mGy vs 0,28–0,50 mGy) [25].
Plicní scintigrafie
Plicní perfuzní scintigrafie detekuje distribuci nitrožilně podaných radioizotopem značených mikročástic albuminu. Ty se zachycují v cévách velikosti 200μ a jsou zdrojem radioaktivity. Neperfundované oblasti jsou bez radioaktivity.
Plicní perfuzní scan je vysoce senzitivní, ale nepříliš specifická metoda pro detekci plicní embolie. Negativní perfuzní plicní scan, provedený ve 4–6 projekcích 1. den vzniku příznaků diagnózu akutní plicní embolie spolehlivě vylučuje. Negativní prediktivní hodnota je blízká 100 %. Představuje proto ideální screeningovou metodu.
Specificitu plicní perfuzní scintigrafie lze zvýšit současně provedeným ventilačním či inhalačním scanem, který pomáhá vysvětlit chybění perfuze z jiných důvodů, než je plicní embolie. Ventilační scan umožňuje posoudit distribuci vdechovaného radioaktivního 133Xenonu nebo 81mKryptonu nebo značeného radioaerosolu v plicích. Výpad perfuze může totiž též vyvolat plicní bula, atelektáza, pneumonie, chronická obstruktivní choroba plicní a další plicní onemocnění, ale i levostranné srdeční selhání. U emfyzematózních bul, u atelektázy nebo při chronické obstruktivní chorobě plic je ventilační scan abnormální (hypoventilace bul). Při plicní embolii je ventilační scan normální.
Specificita plicní scintigrafie při SPECT vyšetření stoupá a pohybuje se kolem 91–96 %. Negativní předpovědní hodnota pak je 97–99 % [32].
Pokud existují starší nálezy perfuzní scintigrafie, neopomeneme je porovnat s nálezy aktuálními. Při nálezu výpadku plicní perfuze není též známa důležitá okolnost, kterou je právě trvání tohoto výpadku.
Specificitu plicního perfuzního scanu výrazně zvyšuje lobární nebo segmentální tvar perfuzního defektu a negativní nález ventilačního scanu.
Naproti tomu jeden nebo více perfuzních defektů jiného tvaru než klínovitého s nebo bez současných abnormalit na RTG nesvědčí pro plicní embolii podle PISA-PED [33].
Perfuzní scan bez ventilačního scanu. Pozitivní predikční hodnota samotného perfuzního scanu hodnoceného současně s výsledkem RTG plic se neliší významně od ventilačně-perfuzního scanu. Stručně řečeno, PISA-PED autoři [33] pokládají RTG snímek plic za plnohodnotnou náhradu ventilačního scanu. Za diagnostické považují jeden nebo více segmentálních defektů majících klínovitý tvar. Senzitiva perfuzního scanu byla ve studii PISA-PED 92% a specificita 87%. Poměrně dlouhou dobu zaujímal ventilačně-perfuzní scan (eventuálně u nás spíše prováděný perfuzní scan s RTG hrudníku) dominující roli. Pozitivní predikční hodnota perfuzního scanu v kombinaci s RTG hrudníku se neliší významně od perfuzně ventilačního scanu. Nález ukazující vysokou pravděpodobnost má vysokou prediktivní hodnotu jen u nemocných s vysokou klinickou pravděpodobností plicní embolie.
Plicní scintigrafie má však některé nevýhody. Časté jsou nálezy intermediární. Nejcennější je nález negativní nebo nález vykazující vysokou pravděpodobnost akutní plicní embolie, tj. přítomnost jednoho nebo více segmentálních defektů majících klínovitý tvar bez ohledu zda odpovídají, či nikoli, současné plicní patologii.
Další nevýhodou plicní scintigrafie je skutečnost, že s výjimkou několika pracovišť není metoda k dispozici 24 hod denně, 7 dní v týdnu. Používá se tak častěji k dodatečnému potvrzení diagnózy, což nepředstavuje optimální přístup.
CTA se stalo suverénní diagnostickou metodou v diagnostice akutní plicní embolie. Nicméně plicní scintigrafie si zachovává svůj význam v následujících situacích, jak ukazuje tab. 11.

![Algoritmus diagnostiky akutní masivní plicní embolie (hemodynamicky nestabilní) [6].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/af959a812055aa0bd92b3d31deef8248.jpg)
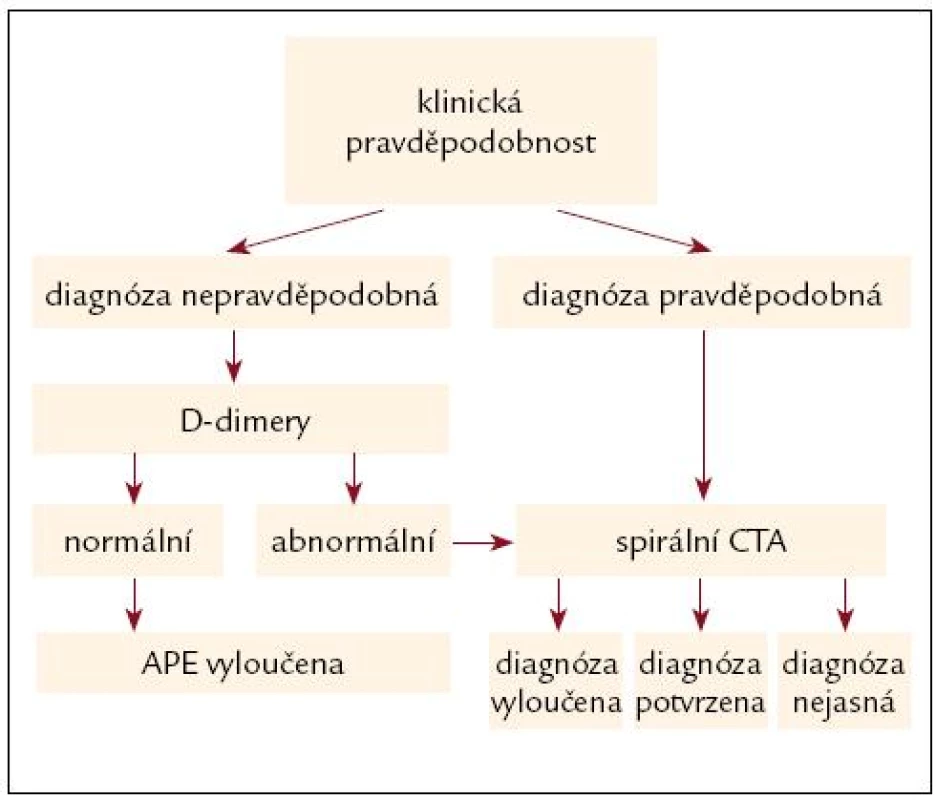
Z hlediska senzitivity je ventilačně-perfuzní scan nadřazen CTA při detekci chronické tromboembolické plicní hypertenze.
Plicní arteriografie
Plicní arteriografie zůstává zlatým diagnostickým standardem. Hlavní indikací jsou diagnostické pochybnosti u nemocného s masivní plicní embolií a relativní kontraindikací k léčbě trombolytické. Plicní angiografie může být vhodná u některých nemocných následována katetrizační a cílenou trombolytickou léčbou. Plicní arteriografie je též nutná před chirurgickou plicní embolektomií.
Relativní kontraindikace představuje významné riziko krvácení a renální insuficience. U nemocných s renální insuficiencí musí být zajištěna dostatečná hydratace před, během a po plicní arteriografii. Onemocnění jako diabetes a mnohočetný myelom mohou zvyšovat výskyt akutní renální insuficience po angiografii. Tato opatření platí všeobecně pro angiografická vyšetření.
Nejčastěji se užívá pigtail katétr nebo Grollmanův katétr. Plicní angiografie se má provádět selektivně jednostranně v předozadní a v přední šikmé projekci. Vyšetření v jedné projekci vstřikem do kmene plícnice, nebo dokonce do pravé síně se považuje za nedostatečné k vyloučení plicní embolie. Používáme nízkoosmolární neionické kontrastní látky, které jsou nemocnými dobře tolerovány.
Jisté známky plicní embolie představují defekty v kontrastní náplni plicních tepen a náhlé amputace některých větví plícnice. Známá alergie na kontrastní látku patří mezi relativní kontraindikace.
Komplikace se vyskytují u 1–2 % na pracovištích s větší zkušeností s plicními arteriografiemi. Při bloku levého Tawarova raménka je plicní arteriografie provázena vyšším rizikem (možnost vzniku asystolie) a nemocný by měl být zajištěn dočasnou stimulační elektrodou. Výrazně zvýšené riziko plicní arteriografie je u nemocných s konečným diastolickým tlakem v pravé komoře 20 mm Hg a vyšším.
Vyšetření by se měla provádět jen na pracovištích s katetrizačním provozem a vybavených příslušnou RTG technikou. Nemocnice provádějící plicní arteriografie jen ojediněle mohou mít vyšší počet komplikací tohoto výkonu.
Algoritmy diagnostiky akutní plicní embolie
Závěrem uvádíme 2 algoritmy. Prvý pro akutní masivní plicní embolii hemodynamicky nestabilní. Tento algoritmus se opírá o klinickou pravděpodobnost, a echokardiografické vyšetření. Pokud to není k dispozici nebo je technické málo přesvědčivé nebo z hlediska plicní embolie negativní, je nutné provést spirální CT.
Lze bezpečně nezahajovat antikoagulační léčbu (nebo ji přerušit) u nemocných vykazujících malou nebo střední klinickou pravděpodobnost akutní plicní embolie v kombinaci s negativními D-dimery (platí jen pro D-dimery s 98–100% senzitivitou).
Spirální CTA provedené na multide-tektorových (vícevrstvnatých přístrojích) umožňuje i zobrazení segmentálních tepen a do značné míry i subsegmentálních tepen. Důležité je, že výskyt recidiv žilních tromboembolií u pacientů, kteří nejsou léčeni antikoagulační léčbou na podkladě negativního nálezu multidetektorové CT angiografie, je velmi nízký a hlavně nepřevyšuje výskyt recidiv po klasické plicní angiografii. Spirální CT přístroje 1. generace mají nižší senzitivitu a vyžadují doplnění plicním scanem. Plicní perfuzní scan zůstává zachován pro specifické skupiny nemocných, dále pro nemocnice nemající spirální CT vícevrstevnaté, pro nemocné s vysokou klinickou pravděpodobností plicní embolie a negativním nálezem CTA a také pro nemocné s technicky nezdařenou CTA.
Algoritmus v guidelines Evropskékardiologické společností [10] je shodný s naším algoritmem, liší se jen v tom, že u nemocných, kde je možné provést okamžitě CTA, ji zařazuje do algoritmu, ale jen za předpokladu okamžitého provedení.
Diferenciální diagnóza akutní plicní embolie
Náhlý vznik dušnosti může provázet některá srdeční a plicní onemocnění. Ze srdečních onemocnění je to nejčastěji akutní srdeční selhání při akutním infarktu myokardu. Na ten nutí myslet také náhlý vznik bolesti na prsou, která nemusí mít u plicní embolie vždy pleurální charakter, ale může naopak připomínat bolest při infarktu myokardu. S náhle vzniklou dušností se ale můžeme setkat u některých plicních onemocnění – při pneumotoraxu, pneumonii a při zhoršení chronické obstrukční bronchopulmonální nemoci. Máme na paměti, že dušnost, tachypnoe, negativní nález na RTG snímku plic a hypoxemie se mohou vyskytnout u chronické obstruktivní choroby plicní nebo u bronchiálního astmatu.
Kardiologové zaměňují akutní plicní embolii nejčastěji s akutním infarktem myokardu, zejména u nemocných s ICHS, kteří již akutní infarkt myokardu prodělali. Tam se často myslí především na recidivu infarktu myokardu. Pokud jsou EKG změny akutní plicní embolie zvláště významné, takže se objevují i elevace ST úseku z pravého prekordia, svádějí někdy k mylné interpretaci EKG nálezu.
Pneumologové nejčastěji zaměňují plicní embolii s bronchopneumonií, zejména v přítomnosti plicního infarktu. Porovnání klinické diagnostiky s pitevními daty ukazuje, že diagnostika akutní plicní embolie je zvláště obtížná u akutních embolií vedoucích rychle k úmrtí.
Prognóza
Krátkodobá prognóza plicní embolie závisí na závažnosti klinického stavu a je též ovlivněna stavem funkce pravé komory srdeční. Prognóza nepoznané, a tudíž neléčené plicní embolie je podstatně horší a mortalita je 2–3krát vyšší. Tito nemocní vykazují také vysoké riziko smrtelných nebo nefatálních recidiv.
Dlouhodobá prognóza závisí na přítomnosti dalšího onemocnění, např. u nemocných s maligním onemocněním je ovlivněna především prognózou tohoto onemocnění. Mezi další faktory zhoršující dlouhodobou prognózu patří přítomnost chronického srdečního selhání, věk nad 60 let a chronické plicní onemocnění.
Dlouhodobou prognózu může také ovlivnit rozvoj chronické tromboembolické plicní hypertenze. U většiny nemocných (90 %) se funkce pravé komory po léčbě akutní plicní embolie zlepší a plicní hypertenze poklesne do 30 dnů od stanovení diagnózy. Nemocní s echokardiograficky stanovenou hodnotou systolického tlaku v plicnici > 50 mm Hg při přijetí mohou mít častěji perzistující plicní hypertenzi i po 1 roce. Nemocní se systolickým tlakem v plicnici > 50 mm Hg při přijetí a nemocní s přetrvávající dysfunkcí pravé komory před propuštěním z hospitalizace jsou ohroženi perzistencí plicní hypertenze a možností rozvoje chronické tromboembolické plicní hypertenze, která vzniká u 1–3,5 % nemocných.
Léčba
Riziko mortality a léčbu akutní plicní embolie ukazuje tab. 12.

Evropské guidelines léčby akutní plicní embolie [10] používají třídy doporučení podle „evidence based“ medicíny a stupně důkazů. Tento přístup má svá omezení, protože trombolytická léčba byla použita v asi 12 studiích zahrnujících jen asi 800 pacientů, z nichž většina byla ve stabilizovaném stavu. Randomizovaná studie porovnávající trombolýzu s heparinem u nestabilních pacientů byla přerušena po 8 pacientech – 4 léčení trombolýzou + heparinem přežili a 4 nemocní léčení pouze heparinem zemřeli [34]. Léčba submasivní plicní embolie vykazuje jen 1 studie MAPPET-3 [35] a další studie probíhá. Léčba heparinem se opírá jen o jednu placebovou studii několika desítek nemocných.
Podpůrná léčba při akutní masivní plicní embolii
U nemocných s normálním krevním tlakem a nízkým minutovým výdejem srdečním lze použít dobutamin a dopamin. Jak dopamin, tak dobutamin zvyšují minutový výdej srdeční, aniž ovlivňují tepovou frekvenci, systémový krevní tlak a tlak v plícnici. U nemocných s hypotenzí jen noradrenalin do překlenutí doby kauzální léčby, nebo dobutamin a dopamin. Vhodná je současná inhalace kyslíku nazální cestou.
Trombolytická léčba u masivní plicní embolie komplikované srdeční zástavou
Srdeční zástava, tedy náhlá smrt, je nejhorší manifestací akutní masivní plicní embolie. Z hlediska rytmu dochází obvykle k elektromechanické disociaci a/nebo k asystolii. Pokud k této příhodě dojde mimo nemocnici, mortalita se blíží ke 100 %. Naprosto klíčovou úlohu, pokud dojde k obnovení spontánní cirkulace, hraje rychlá a správná diagnóza s okamžitým zahájením trombolytické léčby. Komplexní klinické vyšetření vyloučí jiné příčiny srdeční zástavy a zároveň demonstruje dysfunkci pravé komory s přítomností plicní hypertenze, což podpoří diagnózu plicní embolie. Pouze takovýto intenzivní diagnosticko terapeutický přístup včetně následného navození mírné hypotermie může změnit špatnou prognózu nemocných.
Situace je složitější u srdečních zástav vzniklých mimo nemocnici, kdy je diagnóza onemocnění nebo komplikace, které vedly k zástavě, velmi často nemožná.
Léčebně podáme 50 mg alteplázy během 15 min a dávku můžeme poté opakovat.
V případě relativních kontraindikací této léčby použijeme alteplázu v titračním opakovaném bolusovém podání (postupné aplikace 10–50 mg podle efektu do celkové dávky 100 mg).
Trombolytická léčba u pacientů bez srdeční zástavy
Porovnání trombolytické léčby s léčbou heparinem
Wangova metaanalýza zahrnula 11 studií porovnávajících trombolytickou léčbu s heparinem u 748 pacientů [35].
Trombolýza vykazovala trend ke snížení recidiv plicní embolie – 2,7 % vs 4,3 %, OR 0,67 (95 % CI 0,35–1,37), trend ke snížení celkové mortality – 4,3 % vs 5,9 %, OR 0,70 (95 % CI 0,37–1,30), ale větší krvácení bylo častější ve skupině léčené trombolýzou – OR 1,42 (95 % CI 0,81–2,46).
V podskupině 254 pacientů s těžší plicní embolií bylo snížení mortality významnější při trombolytické léčbě: 6,2 % vs 12,7 %, OR 0,47 (95 % CI 0,20–1,10), bylo však větší krvácení častější – 21,9 % vs 11,9 %, OR 1,98 (95 % CI 1,10–3,92).
Ve studii MAPPET-3 [36], největší randomizované studii porovnávající trombolytickou léčbu alteplázou s heparinem u submasivní plicní embolie, vedla léčba tPA ke snížení nutnosti eskalace léčby téměř o polovinu, aniž zvýšila riziko krvácivých komplikací. Bylo to způsobeno tím, že autoři respektovali všechny kontraindikace trombolytické léčby, i relativní.
Před zahájením trombolytické léčby alteplázou podáme UFH v plné léčebné dávce 80 j/kg, následované infuzí UFH 18 j/kg/hod.
Indikace trombolytické léčby ukazuje tab. 13.

Česká doporučení trombolytické léčby se liší od evropských tím, že indikace trombolytické obsahují navíc následující indikace: větší plicní embolie u nemocných s omezenou kardiopulmonální rezervou, plicní embolie neustupující při léčbě heparinem, recidivující a narůstající plicní embolie, přítomnost trombů v pravém srdce a foramen ovale apertum s pravolevým zkratem [38].
Zůstává tedy otázka: mají se všichni nemocní se zvýšením troponinů a s dysfunkcí pravé komory léčit trombolýzou? Podle směrnic European Pulmonary Embolism Task Force má být trombolýza zvažována u stabilizovaných normotenzních nemocných, u nichž jsou přítomny známky dysfunkce pravé komory za předpokladu chybění zvýšeného rizika krvácivých komplikací.
Určitým kompromisem může být následující přístup: léčit všechny normotenzní nemocné heparinem včetně těch, kteří vykazují dysfunkci pravé komory a pozitivní troponiny, ale pečlivě monitorovat posledně jmenovanou podskupinu. Pokud nedochází ke klinickému zlepšení, nasadit trombolytickou léčbu.
Nejlepší se zdá být individuální přístup a u pacienta se submasivní plicní embolií zvážit rizika krvácení daná především přítomností nejen absolutních, ale i relativních kontraindikací.
Zkrácení doby podávání trombolytika nevyžaduje kontrolu hemokoagulačních parametrů.
Na rozdíl od akutního infarktu myokardu můžeme trombolytickou léčbu zahájit i později, tj. až do 14 dnů od vzniku prvých příznaků, např. při neustupujících obtížích po léčbě heparinem nebo při progresi či perzistenci kritického stavu.
t-PA
t-PA (altepláza) podáme v dávce 10 mg i.v. jako bolus během 1–2 min, dále podáváme 90 mg t-PA ve formě kontinuální i.v. infuze po dobu 2 hod.
Altepláza je v současné době trombolytikum volby, protože je provázena minimálně nežádoucími příznaky, nejsou totiž přítomny antigenní produkty, a chybějí tudíž alergické reakce. Navíc porovnání alteplázy a 2hodinové infuze streptokinázy ukázala, že altepláza rychleji uvolňuje tromboembolii v plicním řečišti, což je u nestabilních nemocných velmi žádoucí [39].
U pacientů s relativní kontraindikací trombolytické léčby je vhodné podat bolusovou dávku 0,6 mg/kg během 15 min.
V roce 2010 byla uveřejněna čínská studie Wanga et al [40], která porovnala dávku t-PA 100 mg s poloviční dávkou 50 mg. Studie zjistila stejnou účinnost, avšak méně krvácivých komplikací po dávce 50 mg tPA. Rozdíl byl zvláště vyjádřen u pacientů s tělesnou hmotností < 65 kg. Čínská populace má menší tělesnou hmotnost nežli evropská nebo severoamerická. Závěry Wangovy studie budou zatím platit především pro pacienty s nižší tělesnou hmotností. Bude je třeba potvrdit v další studii na populaci s vyšší tělesnou hmotností.
Streptokináza
V dávkování streptokinázy dáváme přednost krátkodobé léčbě plicní embolie streptokinázou, a to v dávce 1,5 mil. j. v infuzi trvající 1–2 hod. Streptokinázu nepodáváme pacientům již jednou streptokinázou léčených.
Trombolytika vyšší generace
Patří mezi ně:
- retepláza, která se podává ve 2 injekcích bolu po 10 j. po 30 min,
- tenektepláza podávaná v jednom bolu v dávce 30–50 mg během 5–10 s, dávka upravena podle tělesné hmotnosti. S tenekteplázou probíhá velká multicentrická Evropská studie porovnávající u submasivní plicní embolie léčbu trombolytickou s heparinem (tenektepláza + heparin vs heparin + placebo).
Kontraindikace trombolytické léčby
Kontraindikace trombolytické léčby podle směrnic Evropské kardiologické společnosti [10] uvádí tab. 14. Tyto kontraindikace se liší od kontraindikací uvedených v dřívějších evropských guidelines z roku 2000. Hlavním důvodem autorů byla snaha použít stejné kontraindikace jako při léčbě akutního infarktu myokardu trombolytickou léčbou. Následující kontraindikace jsou uvedeny také v českých guidelines [6].
![Kontraindikace trombolytické léčby akutní plicní embolie podle směrnic Evropské kardiologické společnosti 2008 [10].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/c1abc3a6407ba7cd02151926a9226ab7.jpg)
Uvedené kontraindikace jsou shodné s kontraindikacemi trombolytické léčby při akutním infarktu myokardu.
Evropské guidelines [10] dovolují relativizovat i absolutní kontraindikace trombolytické léčby akutní plicní embolie, pokud jde o život ohrožující plicní embolii.
Léčba pacientů, u nichž je trombolytická léčba neúčinná
Kolem 8 % pacientů nereaguje příznivě na trombolytickou léčbu. U těchto nemocných padá v úvahu embolektomie nebo další dávka trombolytika. Meneveau et al [41] porovnali v retrospektivní 10leté analýze jednoho centra oba přístupy a vhodnější se jim jevila embolektomie (trend k nižší mortalitě – 1 vs 10 úmrtí a významně nižší byl výskyt recidiv plicní embolie – fatálních a nefatálních –0 % vs 35 %, p = 0,015).
Heparinizace po trombolýze
Při léčbě t-PA podáváme heparin současně s t-PA. Po skončení trombolýzy streptokinázou bez přestávky kontinuálně heparinizujeme. Léčba heparinem i.v. musí trvat minimálně 72 hod (heparin by měl být ukončen, dosáhne-li se terapeutického prodloužení INR při současné léčbě warfarinem ve 2 po sobě jsoucích měřeních).
Místo infuzí heparinu lze podávat nízkomolekulární heparin subkutánně. Při prvé infuzi heparinu zahajujeme současně perorální antikoagulační léčbu (warfarin).
Nežádoucí účinky trombolytické léčby
Při léčbě všemi trombolytickými látkami jsou nejčastější komplikací krvácivé komplikace. Krvácení je většinou manifestací skrytého slizničního defektu nebo nerespektované kontraindikace. Mozkové krvácení se vyskytuje u 1–2 % nemocných, ale i léčba heparinem k němu vede u 0,5 % nemocných. Zvýšené riziko krvácení do mozku je u všech nemocných s intrakraniálním nebo cerebrovaskulárním onemocněním (např. v anamnéze záchvaty křečí, TIA), u nemocných po traumatu hlavy, u starších nemocných, u nemocných s hypertenzí a u osob s vyšší hmotností. Riziko krvácivých komplikací se zvyšuje s délkou trvání trombolytické léčby, proto se používají jen krátkodobá schémata trombolytické léčby v trvání maximálně do 2 hod. Nejčastější krvácení se vyskytuje v místě punkce nekomprimovatelné cévy. Léčbou krvácení při trombolýze je hemoterapie – erytrocytární masa, plazma. Není vhodné podávat fibrinogen a antifibrinolytika i.v., protože mají jen velmi omezený význam.
Plicní embolektomie
V naléhavých případech připadá v úvahu embolektomie, a to u kritických nemocných, u nemocných zhoršujících se při trombolytické léčbě nebo u nemocných s kontraindikací k trombolytické léčbě. Embolektomie s kardiopulmonálním oběhem však vyžaduje možnost brzkého zahájení. Současně se vkládá dočasně kavální filtr. Spornou indikací představují pacienti, u nichž dojde k srdeční zástavě vně nemocnice a u nichž se předoperačně nepodaří nastolit spontánní srdeční akci [42], inoperabilní maligní nádor a větší předoperační neurologický deficit. Pacienti starší 80 let nejsou považováni za vhodné kandidáty embolektomie v některých centrech, pokud u nich existují navíc některé relativní kontraindikace (např. selhání trombolytické léčby).
Operační mortalita závisí na klinickém stavu v době provádění operace.
Embolektomie je také vhodná u pacientů s trombem v pravé síni nebo u pacientů, u nichž bezprostředně hrozí paradoxní embolie nebo u nichž je třeba uzavřít foramen ovale [43].
Aklog et al [44] popsali zkušenosti s embolektomií u 29 pacientů z jednoho centra, nichž byla embolektomie provedena pro kontraindikaci trombolytické léčby, a zákrok přežilo 89 % pacientů. Je však třeba zdůraznit, že embolektomie nebyla prováděna u pacientů, u nichž došlo k zástavě srdeční vně nemocnice a resuscitace nevedla k nastolení spontánního krevního oběhu při přijetí do nemocnice. Embolektomie nebyla také prováděna u pacientů starších 80 let.
Leacche et al [42] popsala 3leté přežívání většího souboru 47 pacientů po embolektomii, které činilo 83 %.
Souhrnně řečeno optimální indikací k embolektomii jsou jednak nemocní, u nichž je trombolytická léčba kontraindikována a nemocní, u nichž trombolytická léčba selhává [45].
V ojedinělých případech lze provést i embolektomii bez mimotělního oběhu.
Mechanická léčba katétrem
V současnosti se jeví nadějná též perkutánní mechanická trombektomie (PMT) odstraňující sraženiny katétrem s či bez následné trombolýzy, která umožňuje rychlou rekanalizaci centrálních plicních arterií. Vhodnější je kombinace PMT a lokální trombolýzy, umožňující podání nižší dávky trombolytika u nemocných se zvýšeným rizikem krvácivých komplikací. Mechanickou trombektomii lze provést pouhým diagnostickým pig-tail katétrem, angioplastickým balónkovým katétrem nebo pomocí speciálních zařízení (ta však vyžadují větší erudovanosti katetrizujícího). Tyto výkony jsou ve většině případů spojeny s aspirací sraženiny. Mechanická trombektomie je vhodná u hemodynamicky nestabilních nemocných s masivní plicní embolií s kontraindikací trombolytické léčby [46,47].
Existuje řada přístrojů používaných ke katetrizační embolektomii. Neexistuje však jediná randomizovaná studie s touto léčbou a také žádný systém nezískal povolení k používání [45].
Publikovaná metaanalýza katetrové léčby masivní plicní embolie (6 prospektivních a 29 retrospektivních studií) s použitím moderních katetrových technik (nízkoprofilová zařízení ≤ 10 F, fragmentární zařízení s a bez aspirace, lokální trombolýza), prokázala klinickou úspěšnost 86,5 % z 594 pacientů [48]. Významné komplikace činily 2,1 %.
Katetrizační léčbu zvážíme jen v centrech majících s touto léčbou zkušenosti.
Další léčba
Akutní plicní embolii léčíme zásadně v nemocnici. Digoxin nepodáváme s výjimkou již digitalizovaných nemocných. Masivní uvolnění katecholaminů, ke kterému dochází při akutní masivní plicní embolii, zvyšuje srdeční kontraktilitu, takže digoxin by pouze představoval další „bič“ na myokard.
Kavální filtr
Léčba kaválním filtrem je indikována v těchto situacích:
- a) u nemocných, u nichž je antikoagulační léčba kontraindikována nebo nebezpečná (maligní onemocnění, akutní krvácení v průběhu antikoagulační léčby, stav po operaci, zvláště neurochirurgické),
- b) u nemocných, u nichž dojde k prokázané recidivě plicní embolie při dobře vedené antikoagulační léčbě,
- c) profylaktické zavedení kaválního filtru je vhodné u rizikových nemocných před operací (existují dočasné kavální filtry),
- d) suprarenální uložení kaválního filtru je indikováno především u nemocných, u nichž trombus zasahuje až k vyústění renálních žil, dále u žen, které plánují graviditu a u gravidních.
Dočasný kavální filtr představuje zajímavou, ale spornou indikaci u nemocných po těžké masivní plicní embolii s kardiogenním šokem, kde další plicní embolie by mohla být smrtelná. Kavální filtr může být úspěšně odstraněn i za 3–6 měsíců.
U pacientů s masivní plicní embolií bylo totiž zavedení kaválního filtru provázeno nižším výskytem recidiv tromboembolie [48]. Tato problematika potřebuje naléhavě větší studii.
Léčba antikoagulační
Léčba heparinem
Při podezření na akutní plicní embolii je třeba dát 5 000 j. UFH heparinu co nejdříve, tj. v době, kdy ještě probíhají diagnostická vyšetření. Nedávná studie MAYO kliniky znovu upozornila na výhodnost brzkého podání heparinu (tab. 15).

Akutní plicní embolie, která není indikována k trombolytické léčbě či embolektomii, se léčí heparinem, nízkomolekulárním heparinem nebo fondaparinuxem.
Kontrola účinnosti léčby nefrakcionovaným heparinem se provádí pomocí aktivovaného parciálního tromboplastinového testu (aPTT). aPTT se má při efektivních dávkách heparinu prodloužit na 2 - až 4násobek normální hodnoty kontrolní plazmy. Většina reagencií na aPTT je spolehlivá do hodnot aPTT do 100 s. Vyšší časy neznamenají větší účinnost, ale riziko krvácení. Léčbu UFH zahajujeme bolusovým podáním 5 000 j. UFH i.v., na které navazuje kontinuální infuze 5 000–10 000 j. UFH na 6 hod. Kontrolní aPTT by se měl provést po 6 hod od počátku léčby a podle jeho hodnoty by se dávka heparinu měla upravit. Heparin je možné podávat podle hmotnosti nemocného v počáteční dávce 80 j/kg jako bolus i.v., která je následovaná kontinuálním podáváním i.v. v dávce 18 j. heparinu/kg/hod. APTT se také provádí po 6 hod. Při nedostatečném prodloužení aPTT se podává další bolus 80 j/kg a dávka heparinu na kg/hod se zvyšuje o 2–4 jednotky (tab. 16).

Doporučená délka nitrožilní antikoagulační léčby plicní embolie pomocí UFH nemá být kratší 5 dní, zpravidla 6–10 dní.
Léčba nízkomolekulárním heparinem
Léčba nízkomolekulárním heparinem je stejně účinná v léčbě akutní hemodynamicky stabilní plicní embolie jako léčba standardním heparinem. Výhodou nízkomolekulárního heparinu je skutečnost, že není vždy třeba laboratorního monitorování léčby. Optimální je dávkování LMWH dle hmotnosti nemocného.
Průkazy účinnosti existují pro:
- dalteparin 120 antifaktor-Xa j./kg 2krát denně,
- nadroparin 400 antifaktor-Xa j./kg, rozděleno do 2 injekcí 2krát denně s.c., alternativa 1krát denně Fraxi forte,
- enoxaparin 100 antifaktor-Xa j./kg 2krát denně,
- tinzaparin 175 antifaktor-Xa j./kg 1krát denně s.c.,
- reviparin 6 300 antifaktor-Xa j. 2krát denně nebo 4 200 j. 2krát denně při hmotnosti 46–60 kg.
Laboratorní kontrola léčby LMWH
Individuálně je užitečné kontrolovat antikoagulační odpověď na léčbu LMWH laboratorními testy. K dispozici je stanovení anti-Xa aktivity nebo Hep test.
Vyšetření anti-Xa 4 hod by mělo být po podání LMWH a terapeutická šíře je zpravidla od 0,6 do 1,0 U/ml při dávkování 2krát denně a při dávkování 1krát denně 1–1,2 U/ml.
Jednoznačně je doporučeno monitorování anti-Xa u nemocných s renální insuficiencí, protože LMWH se vylučují ledvinami, dále u dětí pro rozdílné koagulační poměry, těhotných žen a obézních vzhledem k měnící se hmotnosti. Podání LMWH zpravidla neprodlužuje významně aPTT.
Poznámky k léčbě heparinem
Při léčbě heparinem je nutné kontrolovat trombocyty před léčbou a v průběhu léčby. Pokles trombocytů pod 100 × 109/l nebo pokles o více než 1/3 mohou svědčit pro imunopatologickou, heparinem indukovanou trombocytopenie (HIT). Výskyt HIT je jiný u interních a chirurgických nemocných. V ortopedie je HIT častější po UFH (5 %) a méně častá po LMWH (0,5 %), u interních nemocných je četnost po obou heparinech stejná (UFH 0,8 %, LMWH 0,8 %). U těhotných žen je se HIT vyskytuje při léčebných dávkách LMWH až u 6 %, ale při profylaktických dávkách je riziko velmi nízké.
Heparin neprochází placentární bariérou, a proto je možné jej podávat v těhotenství (ne ale u rizikového těhotenství při riziku krvácení). Heparin se též nedostává do mateřského mléka.
Kontraindikace heparinu:
- vředová gastroduodenální choroba,
- krvácení z jícnových varixů,
- alergie na heparin,
- přítomnost krvácení nebo velké předpokládané riziko krvácení u pacientů s hemofilií,
- jiné závažné riziko krvácení,
- trombocytopenie,
- těžké poškození jater a ledvin.
Při masivní plicní embolii po ortopedických a břišních operacích je nutné zvážit možné krvácivé riziko a je nutné zvážit i riziko nepodání heparinu.
Fondaparinux
Fondaparinux je syntetický pentasacharid, který inhibuje faktor Xa, a tím brání vzniku trombózy. Studie MATISSE [52] prokázala, že subkutánní fondaparinux je stejně účinný a stejně bezpečný jako enoxaparin v léčbě žilní tromboembolie.
Sekundární prevence plicní embolie kumariny
Léčbu warfarinem obvykle zahajujeme dávkou 5–10 mg denně za denních kontrol INR. Výsledná hodnota INR pro ambulantní sledování má být 2,0–3,0. Warfarin podáváme v terapeutických dávkách po dobu alespoň 6 měsíců. Warfarin nasazujeme 1. den při léčbě heparinem a heparin vysazujeme teprve poté, co hodnota INR byla po 2–3 dny v terapeutickém rozmezí.
Mechanizmus účinku warfarinu:
- inhibice vitaminu K epoxid reduktázy,
- snížení hladiny hydrochinonu (vitaminu KH2),
- limitování karboxylace inaktivních koagulačních faktorů II, VII, IX a X,
- zábrana regenerace vitaminu KH2 z epoxidu,
- zastavení karboxylace koagulačních faktorů závislých na vitaminu K,
- vznik inaktivních proteinů PIVKA (Proteins Induced by Vitamin K Absence).
Další účinky:
- ovlivnění karboxylace a aktivity inhibitorů koagulace – proteinu C a proteinu S, což se může projevit hyperkoagulací v počáteční fázi antikoagulační léčby,
- hyperkoagulace hrozí při použití vyšších dávek antikoagulancií a při současném vrozeném nebo získaném snížení hladiny faktoru C nebo S.
Kontraindikace perorální antikoagulační léčby warfarinem:
- těhotenství! (hlavně 1. a 3. trimestr),
- choroby jater a slinivky,
- vrozené či získané krvácivé stavy či přítomnost nebo hrozba čerstvého krvácení,
- chybí-li spolupráce pacienta při léčbě a kontrole,
- léčba bez možnosti laboratorních kontrol,
- abúzus alkoholu.
Je pravděpodobné, že warfarin bude v dohledné době nahrazen dabigatranem nebo rivaroxabanem.
Délka antikoagulační léčby [43]
- U pacientů s prvou epizodou plicní embolie vyvolané přechodným rizikovým faktorem trvání léčby alespoň 3 měsíce.
- U pacientů s idiopatickou plicní embolií trvání léčby alespoň 6–12 měsíců. Lze uvažovat u těchto nemocných o trvalé léčbě.
- U pacientů s maligním onemocněním nízkomolekulární heparin po prvých 3–6 měsíců dlouhodobé léčby, poté trvale warfarin nebo do doby vymizení maligního onemocnění.
- U pacientů s prvou epizodou plicní embolie, kteří mají deficit antitrombinu, proteinu C nebo proteinu S nebo mutaci faktoru V Leiden nebo mutaci genu protrombin 20210, hyperhomocysteinemii nebo vysoké hodnoty faktoru VIII (> 90. percentil) trvání léčby 6–12 měsíců. Zvážit trvalou léčbu jako u idiopatické plicní embolie.
- U nemocných se 2 nebo více epizodami objektivně prokázané plicní embolie zvážit trvalou antikoagulační léčbu.
- U pacientů s prvou epizodou plicní embolie, kteří mají antifosfolipidové protilátky (antifosfolipidový syndrom) nebo kteří mají 2 nebo více trombofilních stavů (např. kombinace faktor V Leiden + mutace genu protrombin 20210) trvání léčby 12 měsíců. U těchto nemocných zvážit trvalou antikoagulační léčbu.
Dlouhodobé sledování vybraných pacientů
Vhodné je dlouhodobé sledování pacientů následujících skupin nemocných (tab. 17).

Důraz klademe na vymizení známek dilatace pravé komory a známek plicní hypertenze. Vhodná kontrola je za 3 měsíce. Pokud dojde ke zhoršení klinického nálezu (zhoršení dušnosti) nebo zhoršení nebo přetrvávání známek dilatace pravé komory a/nebo plicní hypertenzi, je vhodný kontrolní scan. U některých pacientů může vzniknout chronická tromboembolická plicní hypertenze.
Děkuji výboru České internistické společnosti České lékařské společnosti J. E. Purkyně v čele s prof. MUDr. Richardem Češkou, CSc., a prof. MUDr. Miroslavu Součkovi, CSc., hlavnímu organizátorovi brněnského kongresu za možnost vyslovit svou přednášku. Děkuji rovněž prim. MUDr. Petru Svačinovi, vedoucímu redaktorovi časopisu Vnitřní lékařství, za pozvání k uveřejnění mé přednášky.
prof. MU Dr. Jiří Widimský, DrSc., FESC, FAHA
www.ikem.cz
e-mail: widimsky@seznam.cz
Doručeno do redakce: 11. 12. 2010
Sources
1. Noboa S, Mottier D, Oger E on behalf of EPI ‑ GETBO Study Group. Estimation of a potentially preventable fraction of venous thromboembolism: a community‑based prospective study. J Thromb Haemost 2006; 4 : 2720 – 2722.
2. Torbicki A, van Beek EJR, Charbonnier B et al. Guidelines on diagnosis and management of acute pulmonary embolism. Eur Heart J 2000; 21 : 1301 – 1336.
3. Meignan M, Rosso J, Gauthier H et al. Systematic lung scans reveal a high frequency of silent pulmonary embolism in patients with proximal deep venous thrombosis. Arch Intern Med 2000; 160 : 159 – 164.
4. Morgenthaler TI, Ryu JH. Clinical characteristics of fatal pulmonary embolism in a referral hospital. Mayo Clin Proc 1995; 70 : 417 – 424.
5. British Thoracic Society guidelines for the management of suspected acute pulmonary embolism. Thorax 2003; 58 : 470 – 483.
6. Widimský J, Malý J, Eliáš P et al. Doporučení diagnostiky, léčby a prevence plicní embolie, verze 2007. Doporučení České kardiologické společnosti. Vnitř Lék 2008; 54 (Suppl 1): 1S25 – 1S72.
7. Goldhaber SZ, Visani L, DeRosa M et al. for ICOPER. Acute pulmonary embolism: clinical outcomes in the International Cooperative Pulmonary Embolism Registry (ICOPER). Lancet 1999; 353 : 1386 – 1389.
8. Widimský J, Staněk V. Klinická diagnostika hemodynamicky významné plicní embolie. Prakt Lék 1983; 83 : 284 – 287.
9. Widimský J, Malý J et al. Akutní plicní embolie a žilní trombóza. Praha: Triton 2005, 381 s.
10. Torbicki A et al. Guidelines of the European Society of Cardiology for the Diagnosis and Management of Acute Pulmonary Embolism. Eur Heart J 2008; 29 : 2276 – 2315.
11. Wells PS, Anderson DR, Rodger M et al. Derivation of a simple clinical model to categorize patients’ probability of pulmonary embolism: increasing the model’s utility with the SimpliRED D‑dimer. Thromb Haemostat 2000; 83 : 416 – 420.
12. Le Gal G, Righini M, Roy PM et al. Prediction of pulmonary embolism in the emergency department: the revised GENEVA score. Ann Int Med 2006; 144 : 165 – 171.
13. Pruszcyk P, Bochowicz A, Torbicki A et al. Cardiac troponin T monitoring identifies high‑risk group of normotensive patients with acute pulmonary embolism. Chest 2003; 123 : 1947 – 1952.
14. Becattini C, Vedovati MC, Agnelli G. Prognostic value of troponins in acute pulmonary embolism. Circulation 2007; 116 : 427 – 433.
15. Jimenéz D, Uresandi F, Otero R et al. Troponin‑based risk stratification of patients with acute nonmassive pulmonary embolism. Systematic review and meta‑analysis. Chest 2009; 136 : 974 – 982.
16. Klok FA, Mos IC, Huisman MV. Brain‑type natriuretic peptide levels in the prediction of adverse outcome in patients with pulmonary embolism. A systematic review and meta‑analysis. Am J Respir Crit Care Med 2008; 178 : 425 – 430.
17. Kucher N, Printzen G, Goldhaber SZ. Prognostic role of brain natriuretic peptide in acute pulmonary embolism. Circulation 2005; 107 : 2545 – 2547.
18. Binder L, Pieske B, Olschewski M et al. N‑terminal pro‑brain natriuretic peptide or troponin testing followed by echocardiography for risk stratification of acute pulmonary embolism. Circulation 2005; 112 : 1573 – 1579.
19. Dellas C, Puls M, Lankeit M et al. Elevated heart‑type fatty acid‑binding protein levels on admission predict an adverse outcome in normotensive patients with acute pulmonary embolism. J Am Coll Cardiol 2010; 55 : 2150 – 2157.
20. Lankeit M, Kempf T, Dellas C et al. Growth differentiation factor ‑ 15 for prognostic assessment of patients with acute pulmonary embolism. Am J Respir Crit Care Med 2008; 177 : 1018 – 1025.
21. Lankeit M, Friesen D, Aschoff J et al. Highly sensitive troponin T assay in normotensive patients with acute pulmonary embolism. Eur Heart J 2010; 31 : 1836 – 1844.
22. Meluzin J, Spinarova L, Bakala J et al. Pulsed Doppler tissue imaging of the velocity of tricuspid annular systolic motion; a new, rapid, and non‑invasive method of evaluating right ventricular systolic function. Eur Heart J 2001; 22 : 340 – 348.
23. Sanchez O, Trinquart L, Colombet I et al. Prognostic value of right ventricular dysfunction in patients with haemodynamically stable pulmonary embolism: a systematic review. Eur Heart J 2008; 29 : 1569 – 1577.
24. Eliáš P. Úloha výpočetní tomografie v diagnostice plicní embolie. In: Widimský J, Malý J et al. Akutní plicní embolie a žilní trombóza. Praha: Triton 2005 : 111 – 126.
25. Stein PD, Goodman LR, Gottschalk A et al, for the PIOPED II Investigators. Multidetector computed tomography for acute pulmonary embolism. N Engl J Med 2006; 354 : 2317 – 2327.
26. Moores LK, Jackson jr. WL, Shorr AF et al. Meta‑analysis: outcomes in patients with suspected pulmonary embolism managed with computed tomographic pulmonary angiography. Ann Intern Med 2004; 141 : 866 – 874.
27. Van Beek EJ, Reekers JA. The value of pulmonary angiography for the differen tial diagnosis of pulmonary embolism. Eur Radiol 1999; 9 : 1310 – 1313.
28. Henry JW, Relyea B, Stein PD. Continuing risk of thromboemboli among patients with normal pulmonary angiograms. Chest 1995; 107 : 1375 – 1378.
29. Quiroz B, Kucher N, Zou KH et al. Clinical validity of a negative computed tomography scan in patients with suspected pulmonary embolism. A systematic review. JAMA 2005; 293 : 2012 – 2017.
30. Van Belle A, Buller HR, Huisman MV et al for the Christopher Study Investigators. Effectiveness of managing suspected pulmonary embolism using an algorithm combining clinical probability, D‑dimer testing, and computed tomography. JAMA 2006; 295 : 172 – 179.
31. Schoepf UJ, Kucher N, Kipfmueller F et al. Right ventricular enlargement on chest computed tomography: a predictor of early death in acute pulmonary embolism. Circulation 2004; 110 : 3276 – 3280.
32. Lang O. Plicní scintigrafie. In: Widimský J, Malý J et al. Diagnostika, léčba a prevence akutní plicní embolie. Praha: Triton Praha 2005.
33. PISA ‑ PED Investigators. Invasive and noninvasive diagnosis of pulmonary embolism. Chest 1995; 107 : 33S–38S.
34. Jerjes ‑ Sanchez C, Ramirez ‑ Rivera A, Garcia M et al. Streptokinase and heparin versus heparin alone in massive pulmonary embolism: a randomised controlled trial. J Thromb Thrombolysis 1995; 2 : 227 – 229.
35. Wan S, Quinlan DJ, Agnelli G et al. Thrombolysis compared with heparin for the Initial treatment of pulmonary embolism: a meta‑analysis of the randomized controlled trials. Circulation 2004; 110 : 744 – 749.
36. Konstantinides S, Geibel A, Heusel G et al for the MAnagement strategies And Prognosis of Pulmonary Embolism ‑ 3 Trial Investigators (MAPPET ‑ 3). N Engl J Med 2002; 347 : 1143 – 1150.
37. Widimský J. Trombolytická léčba i u normotenzních nemocných, hemodynamicky stabilních s akutní plicní embolií? Interv Akut Kardiol 2005; 4 : 66 – 68.
38. Widimský J, Malý J. Komentář k novým Doporučením o diagnostice a léčbě plicní embolie Evropské kardiologické společnosti (EKS) (Torbicki et al 2008) ve světle Doporučení diagnostiky, léčby a prevence plicní embolie České kardiologické společnosti – verze 2008. Vnitř Lék 2008; 54 : 937 – 952.
39. Meneveau N, Schiele F, Metz D et al. Comparative efficacy of a two‑hour regimen of streptokinase versus alteplase in acute pulmonary embolism: Immediate clinical and hemodynamic outcome and one‑year follow‑up. J Am Coll Cardiol 1998; 31 : 1057 – 1063.
40. Wang CH, Zhai Z, Yang Y et al for the China Venous Thromboembolism (VTE) Study Group. Half the dosage, similar efficacy, less bleeding. The new tissue plasminogen activator regimen for pulmonary embolism? Chest 2010; 136 : 254 – 264.
41. Meneveau N, Séronde MF, Blonde MC et al. Management of unsuccessful thrombolysis in acute massive pulmonary embolism. Chest 2006; 129 : 1043 – 1050.
42. Leacche M, Unic D, Goldhaber S et al. Modern surgical treatment of massive pulmonary embolism: results of 47 consecutive patients after rapid diagnosis and aggressive surgical approach. J Thor Cardiov Surg 2005; 129 : 1018 – 1023.
43. Hirsh J, Guyatt G, Albers GW et al. American College of Chest Physicians. Evidence‑based clinical practice guidelines (8th Edition). Executive summary. Chest 2008; 133: (Suppl.): 71S – 105S.
44. Aklog L, Williams ChS, Byrne JG et al. Acute pulmonary embolectomy. Contemporary approach. Circulation 2002; 105 : 1416 – 1419.
45. Carlbom DJ, Davidson BL. Pulmonary embolism in the critically ill. Chest 2007; 132 : 313 – 324.
46. Roček M. Léčba plicní embolie katétrem. In: Widimský J, Malý J et al. Akutní plicní embolie a žilní trombóza. Patogeneze, diagnostika, léčba a prevence. Praha: Triton 2005 : 241 – 252.
47. Kucher N. Catheter embolectomy for acute pulmonary embolism. Chest 2007; 132 : 657 – 663.
48. Kuo W, Gould M, Louie J et al. Catheter ‑ directed therapy for the treatment of massive pulmonary embolism: systematic review and meta‑analysis of modern techniques. J Vasc Interv Radiol 2009; 20 : 1431 – 1440.
49. Kucher N, Rossi E, De Rosa M et al. Massive pulmonary embolism. Circulation 2006; 113 : 577 – 582.
50. Smith SB, Geske JB, Jaguare SB et al. Early anticoagulation is associated with reduced mortality for acute pulmonary embolism. Chest 2010; 137 : 182 – 190
51. Malý J. Antikoagulační léčba. In: Widimský J, Malý J et al. Akutní plicní embolie a žilní trombóza. Patogeneze, diagnostika, léčba a prevence. Oraha: Triton 2005, 202 – 234.
52. Büller HR, Davidson BL, Decousus H et al for the MATISSE Investigators Subcutaneous fondaparinux versus intravenous unfractionated heparin in the initial treatment of pulmonary embolism. N Engl J Med 2003; 349 : 1695 – 1702.
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Internal Medicine

2011 Issue 1
-
All articles in this issue
- Obezita, body mass index, obvod pasu a mortalita – editorial
- Obezita, body mass index, obvod pasu a mortalita – editorial
- Akutní srdeční selhání a časný rozvoj dysfunkce levé komory u pacientů s akutním infarktem myokardu s elevacemi ST léčených primární perkutánní koronární intervencí
- Přínos celotělové magnetické rezonance v diagnostice monoklonální gamapatie nejistého významu, mnohočetného myelomu a stanovení stadia pokročilosti nemoci s pomocí systému Durie‑ Salmon Plus
- Faktory ovlivňující přítomnost varixů a varikózního krvácení u pacientů s jaterní cirhózou
- Terapeutická hypotermie po srdeční zástavě na 12 hodin: Karlovy Vary 2006– 2009
- Význam genetiky v predikci rizika osteoporózy
- Obezita, body mass index, obvod pasu a mortalita
- Prečo vzniká fibrilácia predsiení po kardiochirurgických operáciách?
- Schnitzler‑ syndrom: popis případu, zkušenosti s léčbou glukokortikoidy a preparátem anakinra (KineretTM) a sledování cytokinové odpovědi organizmu
- Opoždění diagnózy HELLP syndromu
- Prípad vlajúceho infikovaného trombu v. jugularis interna, septických pneumónií a heparínom indukovanej trombocytopénie
- Diagnostika a léčba akutní plicní embolie v roce 2010
- Terapeutická hypotermie po srdeční zástavě: proč a na jak dlouho? – editorial
- Geny a osteoporóza – editorial
- Charakteristika reziduálních tachykardií spojených s koronárním sinem během ablace dlouhodobé perzistentní fibrilace síní
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue
- Opoždění diagnózy HELLP syndromu
- Diagnostika a léčba akutní plicní embolie v roce 2010
- Obezita, body mass index, obvod pasu a mortalita
- Prípad vlajúceho infikovaného trombu v. jugularis interna, septických pneumónií a heparínom indukovanej trombocytopénie
