Schnitzler‑ syndrom: popis případu, zkušenosti s léčbou glukokortikoidy a preparátem anakinra (KineretTM) a sledování cytokinové odpovědi organizmu
Schnitzler syndrome: case report, the experience with glucocorticoid and anakinra (KineretTM) therapies and monitoring of systemic cytokine response
Schnitzler syndrome is a rare idiopathic disease characterized by chronic urtica, presence of monoclonal IgM immunoglobuline and further, less common symptoms. This case report describes another case of this disease affecting a male adult born in 1963. The first symptoms, eruptions of non‑pruritic urticarial rash, appeared in this patient at the age of 43. In addition, bone pains (mainly tibias) and joint pains (mainly knees) were present. Later on however, severe attacks of fever, chills and shaking together with bone and joint pains were added to during which new urticarial eruptions appeared. Primarily, the man was followed up without any substantial therapeutic results at a department of dermatovenerology, subsequently, due to a finding of monoclonal IgM κ immunoglobulin (serum concentration 1.9 g/ l) he was referred to our department for the reason of gammopathy being a differential diagnosis. On a CT scan hyperostosis in claviculae and pelvic bones was identified. Also on the CT, an increase in cortical thickness was described in the long bones of the lower extremities, where areas of technetium pyrophosphate accumulation were indentified on a bone scintigraphy. These areas were found in the chest and sacral regions as well. From the blood exams, the proinflammatory status of the organism was apparent (CRP 35.9 mg/ l, erythrocyte sedimentation rate 92 mm/ h, leukocytes 12.4 × 109/ l). After excluding other differential diagnoses, the patient was diagnosed with Schnitzler syndrome. As regards therapy, we made initial use of the effect of corticoids which abated the symptoms, however, these were causing serious adverse reactions in the form of iatrogenous Cushing’s syndrome. The therapy took a turn only after biologic therapy with anakinra (interleukin‑1 receptor antagonist) had started, which minimized the Schnitzler symptoms with very good drug tolerance. In the work we measured serum levels of interleukins for disease activity monitoring. The most sensitive were interleukins IL‑6 and especially IL‑18 the levels of which were the highest at the time of clinical exacerbation of the disease, whereas the levels of IL‑1β and TNF‑α (tumour necrosis factor) were during all measurements below the limit of detection. Concerning the growing numbers of the reports on successful biological therapy with anakinra and our positive experience, we propose that the therapeutic response to anakinra should be included within the diagnostic criteria of Schnitzler syndrome, which is significant above all in differential diagnosis thereof.
Key words:
Schnitzler syndrome – autoinflammatory diseases – monoclonal gammopathy – multiple myeloma – Cushing’s syndrome – interleukins
Authors:
P. Szturz 1; Z. Adam 1; M. Klabusay 1; Z. Fojtík 1; Z. Kadaňka 2; O. Stehlíková 1; J. Chovancová 3; L. Kalvodová 1; D. Čorbová 4; K. Starý 5; J. Neubauer 6; J. Prášek 7; R. Koukalová 8; Z. Řehák 8; R. Hájek 1; J. Mayer 1
Authors‘ workplace:
Interní hematoonkologická klinika Lékařské fakulty MU a FN Brno, pracoviště Bohunice, přednosta prof. MU Dr. Jiří Vorlíček, CSc.
1; Neurologická klinika Lékařské fakulty MU a FN Brno, pracoviště Bohunice, přednosta prof. MU Dr. Josef Bednařík, CSc.
2; Lékařská fakulta MU Brno, děkan prof. MU Dr. Jiří Mayer, CSc.
3; Dermatovenerologická klinika Lékařské fakulty MU a FN Brno, pracoviště Bohunice, přednostka prof. MU Dr. Alena Pospíšilová, CSc.
4; Interní hepatogastroenterologická klinika Lékařské fakulty MU a FN Brno, pracoviště Bohunice, přednosta prof. MU Dr. Jan Lata, CSc.
5; Radiologická klinika Lékařské fakulty MU a FN Brno, pracoviště Bohunice, přednosta prof. MU Dr. Vlastimil A. Válek, CSc.
6; Klinika nukleární medicíny Lékařské fakulty MU a FN Brno, pracoviště Bohunice, přednosta doc. MU Dr. Jiří Prášek, CSc.
7; Oddělení nukleární medicíny, PET Centrum Masarykova onkologického ústavu Brno, přednosta prim. MU Dr. Karol Bolčák
8
Published in:
Vnitř Lék 2011; 57(1): 97-112
Category:
Case Reports
Overview
Schnitzler ‑ syndrom je vzácné idiopatické onemocnění charakterizované chronickou kopřivkou, přítomností monoklonálního imunoglobulinu třídy IgM a dalšími, méně častými znaky. V této kazuistice přinášíme zprávu o dalším případu tohoto onemocnění, které postihlo muže narozeného v roce 1963. První příznaky, výsevy nesvědivé kopřivky, se u pacienta objevily ve 43 letech. Dále byly přítomny bolesti kostí (zejména holenních) a kloubů (zejména kolenních). Později se přidaly prudké záchvaty horečky, zimnice a třesavky s bolestmi kostí a kloubů, při kterých docházelo k výsevu nových kopřivkovitých morf. Nejprve byl muž bez větších léčebných výsledků sledován na dermatovenerologii, poté byl však pro nález monoklonálního IgM κ (sérová koncentrace 1,9 g/ l) odeslán na naše pracoviště k diferenciální diagnostice gamapatie. Na CT vyšetření se zobrazila hyperostóza klavikul a pánevních kostí. Zesílení kortikalis bylo popsáno na CT i v dlouhých kostech dolních končetin, kde byla scintigrafií skeletu prokázána zvýšená akumulace technecium pyrofosfátu nalezená rovněž v oblasti hrudního koše a os sacrum. Z krevních odběrů byl patrný prozánětlivý stav organizmu (CRP 35,9 mg/ l, sedimentace erytrocytů 92 mm/ hod, leukocyty 12,4 × 109/ l). Po vyloučení jiných diferenciálně diagnostických příčin byla u pacienta stanovena diagnóza Schnitzler ‑ syndrom. Léčebně jsme zpočátku využívali efektu kortikoidů, které sice příznaky nemoci mírnily, přinášely s sebou však závažné nežádoucí účinky v podobě iatrogenního Cushingova syndromu. Obrat v léčbě nastal až při zahájení pravidelné medikace anakinrou (antagonista IL-1 receptoru), která při velmi dobré toleranci minimalizovala příznaky Schnitzler ‑ syndromu. V této práci jsme využili měření sérových hladin interleukinů ke sledování aktivity tohoto onemocnění. Nejsenzitivnějšími ukazateli byly interleukiny IL‑6 a zejména IL‑18, jejichž hladiny byly nejvyšší v době klinické exacerbace choroby, zatímco hladiny IL‑1β a TNF‑α (tumor necrosis factor) byly při všech měřeních pod limitem detekce. S ohledem na množící se zprávy o úspěšnosti biologické léčby anakinrou a s ohledem na naši pozitivní zkušenost navrhujeme, aby byla léčebná odpověď na anakinru zařazena mezi diagnostická kritéria Schnitzler ‑ syndromu, což má význam zejména v diferenciální diagnostice tohoto onemocnění.
Klíčová slova:
Schnitzler ‑ syndrom – autoinflamatorní onemocnění – monoklonální gamapatie – mnohočetný myelom – Cushingův syndrom – interleukiny
Úvod
Schnitzler - syndrom je vzácné multisystémové onemocnění s nejasnou patogenezí, které bylo poprvé v literatuře popsáno v roce 1974 francouzskou dermatoložkou Liliane Schnitzler jako soubor příznaků, jimž dominuje chronická kopřivka spojená s kostními změnami (kombinace hyperostózy a osteolýzy), lymfadenopatií a s přítomností monoklonálního imunoglobulinu třídy IgM [1]. Další typické symptomy zahrnují teploty, bolesti kostí a kloubů a některé laboratorní a zobrazovací nálezy (tab. 1, upraveno podle Lipsker et al [2]). Dosud bylo ve světové literatuře popsáno něco málo přes 100 případů, lze však předpokládat, že skutečný výskyt této choroby je mnohem vyšší [3].
Někteří autoři pohlížejí na Schnitzler-syndrom jako na prekancerózu, a to s ohledem na jeho možný přechod do lymfoproliferativního onemocnění (nejčastěji Waldenströmova makroglobulinemie, dále mnohočetný myelom, případně lymfom marginální zóny) [3]. V poslední době se však stále častěji objevují zprávy o úloze cytokinů, solubilních proteinů a peptidů regulujících prostřednictvím receptorů různé procesy svého mikroprostředí [4], především pak interleukinu - 1, který je považován za hlavní prozánětlivý cytokin modulující produkci dalších prozánětlivých cytokinů, chemokinů a adhezivních molekul. A právě nadměrná sekrece interleukinu - 1 zřejmě odpovídá za typické příznaky Schnitzler - syndromu, což nás opravňuje k zařazení této vzácné jednotky mezi autoinflamatorní onemocnění [5].
V této kazuistice popisujeme průběh onemocnění u muže, u něhož byla diagnóza stanovena po více než 2 letech od nástupu prvních symptomů. Pacient podstoupil léčbu kortikosteroidy, která sice mitigovala příznaky nemoci, přinášela s sebou však zároveň tíživé nežádoucí účinky v podobě iatrogenního Cushingova syndromu. Po více než 1/ 2 roce kortikoterapie byla u muže zahájena pravidelná subkutánní aplikace preparátu anakinra (výrobní název KineretTM), která pak během několika dnů uvedla onemocnění do kompletní remise.
Popis případu
První příznaky onemocnění
Nyní 46letý muž sledovaný asi 8 měsíců na naší klinice s diagnózou Schnitzler - syndromu datuje počátky svého onemocnění do období prosince roku 2006, kdy poprvé pozoroval výsev nesvědivých splývajících mapovitých ložisek na trupu, horních a dolních končetinách. Tyto asymptomatické kopřivkovité morfy se zpočátku objevovaly asi v měsíčních intervalech a opět mizely. Postupně se bezpříznakové intervaly zkracovaly a výsevy byly stále častější. S těmito obtížemi byl poprvé vyšetřen na dermatologické ambulanci se závěrem: pityriasis rosea Gilbert. Při zavedené lokální léčbě se však kožní vyrážka objevovala i nadále. V této době byl pacient rovněž vyšetřen na hematologické ambulanci, kde byl sledován pro subklinickou formu idiopatické trombocytopenické purpury, a z krevních odběrů byly získány následující výsledky: C - reaktivní protein 4,7 mg/ l (v normě) a hemoglobin 140 g/ l (v normě). V předchorobí muže žádná jiná sledovaná onemocnění nebyla, trvalou medikaci pacient negoval. Nápadný byl pouze jeho náruživý nikotinizmus se spotřebou až 20 cigaret denně od 18 let života.
Asi po 3/ 4 roku od prvního výsevu kopřivky začaly u muže bolesti obou holenních kostí, jejichž intenzita vrcholila vždy navečer. Pacient uvedl, že se bolesti často objevovaly spolu s výsevem nových kopřivkových morf. Později, zhruba na přelomu let 2007 a 2008, se přidaly i bolesti předloketních kostí, dále pak kolenních kloubů, částečně i kotníků. Přítomna byla rovněž zvýšená kožní citlivost oboustranně v oblasti bérců. Všechny tyto jmenované potíže s postupem času kulminovaly v noci společně se zimnicí, pocením a třesavkou pod obrazem prudce probíhajících záchvatů. Pacient si sám tělesnou teplotu nikdy neměřil, proto na existenci horečky jako typického příznaku Schnitzler - syndromu lze z pacientovy anamnézy pouze usuzovat. Subjektivně nejhůře vnímané byly bolesti kolen, které se zpočátku vyskytovaly s četností jednou za 2 týdny, později se však obtíže stupňovaly, až bolestivé ataky nastupovaly 3krát denně a dosahovaly na vizuálně analogové škále (visual analogue scale – VAS) intenzity až 10/ 10.
Vzhledem k dominantnímu nálezu ve formě kožní vyrážky se pacient rozhodl navštívit další pracoviště s dermatologickou specializací, kde byl od června do října v roce 2008 sledován a jeho stav uzavřen jako chronická recidivující urtika. Výsledky vstupních krevních odběrů z června roku 2008 svědčily pro zánětlivé postižení (sedimentace 77 mm/ hod, CRP 35,9 mg/ l), leukocytóza nebyla (9,3 × 109/ l), zachycena však byla mírná anémie (hemoglobin 124 g/ l). V rámci sanace infekčních fokusů byl muž odeslán na extrakci několika kariézních zubů, avšak zcela bez efektu. Léčba poté do října roku 2008, kdy muž pro absenci výraznějších léčebných výsledků odmítl další péči, probíhala cestou kortikoterapie (prednizon, hydrokortizon) a lokální dermatologické léčby. Jediné, co snad, dle pacientových slov, zabíralo, byly infuze s hydrokortizonem, antihistaminika postrádala výraznějšího účinku. Po svém rozhodnutí přerušit tuto formu léčby byl pacient odkázán na dalších několik měsíců pouze na systémový účinek analgetik (Brufen, Algifen). Pokles v červené krevní řadě v té době již dále dovyšetřen nebyl.
Stanovení diagnózy
Po téměř roce od přerušení dispenzarizace na kožní klinice, v červnu roku 2009, se zastupující praktický lékař při běžné kontrole rozhodl pro podezření na revmatologické onemocnění (bolesti pohybového aparátu, kožní vyrážka) zahájit nespecificky symptomatickou léčbu glukokortikoidy a nasadil pacientovi metylprednizolon per os v dávce 3krát 16 mg denně. S obdobnou indikací, tedy se záměrem prokázat případné revmatologické onemocnění, byly zároveň provedeny krevní odběry. Zjištěna byla pozitivní imunofixace v séru prokazující přítomnost paraproteinu IgM κ a pacient byl odeslán v červenci roku 2009 na naši hematoonkologickou kliniku pro podezření nikoliv na revmatologickou chorobu, ale na mnohočetný myelom. Další laboratorní výsledky ukázaly zvýšenou sedimentaci (92 mm za 1 hod a 110 mm za 2 hod), leukocytózu (12,4 × 109/ l) s neutrofilií (10,76 × 109/ l) a hypochromní mikrocytární anémii (hemoglobin 115 g/ l, střední objem erytrocytů 77,4 fl, střední množství hemoglobinu v erytrocytech 25,2 pg).
Pro stanovení diagnózy Schnitzler-syndromu jsme využili diagnostická kritéria (tab. 1) dle pracovní skupiny Lipsker et al [2]. Tato kritéria jsme, jak bude dále v textu vysvětleno, doplnili o jedno malé kritérium zohledňující dosud publikovanou bezchybnou účinnost biologické léčby anakinrou a dále o rozšíření zánětlivých ukazatelů o elevaci C - reaktivního proteinu.
Na základě anamnestického a klinického vyšetření byla naplněna 2 malá kritéria (zvýšená tělesná teplota, artralgie a bolest kostí) a 1 velké kritérium (kopřivkový exantém). Denzitometrické měření elektroforézy séra ukázalo přítomnost monoklonálního IgM κ v koncentraci 1,9 g/ l (druhé velké kritérium), nález v moči byl negativní. V období, kdy na naší klinice byly odebrány vstupní odběry, užíval pacient již více než měsíc vysoké dávky kortikoidů (48 mg metylprednizolonu denně), proto zvýšená hladina leukocytů (13,4 × 109/ l) a fyziologické hodnoty sedimentace (7 mm/ hod), CRP (4,2 mg/ l), stejně tak jako hemoglobinemie (139 g/ l) či fibrinogenemie (3,5 g/ l) byly touto léčbou jistě zkresleny. Opírat se však můžeme o hodnoty z června roku 2010 (sedimentace 92 mm/ hod, leukocyty 12,4 × 109/ l, hemoglobin 115 g/ l) svědčící pro aktivitu Schnitzler - syndromu a odpovídající rovněž např. za subjektivně udávanou sníženou fyzickou zdatnost.
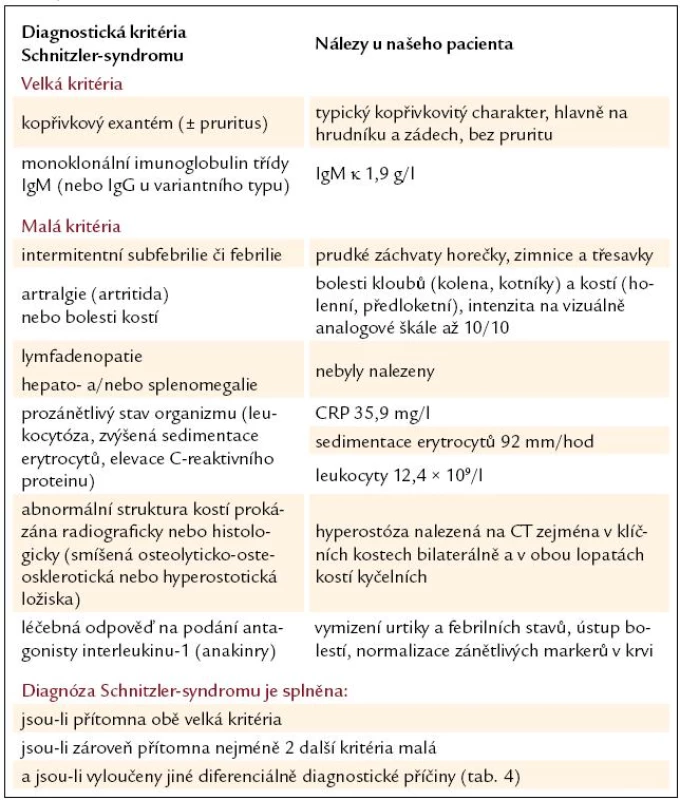
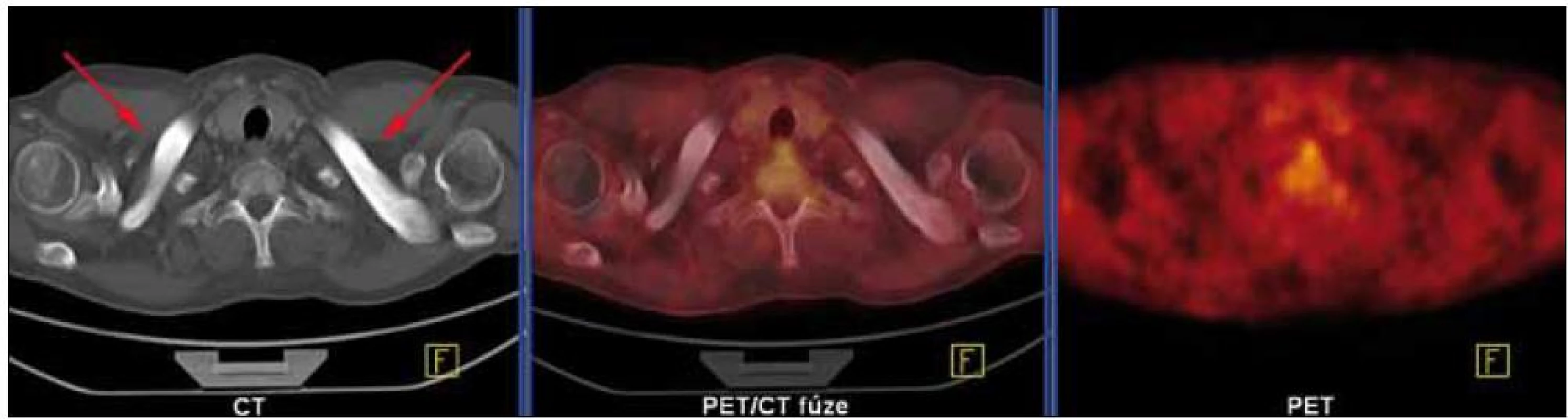
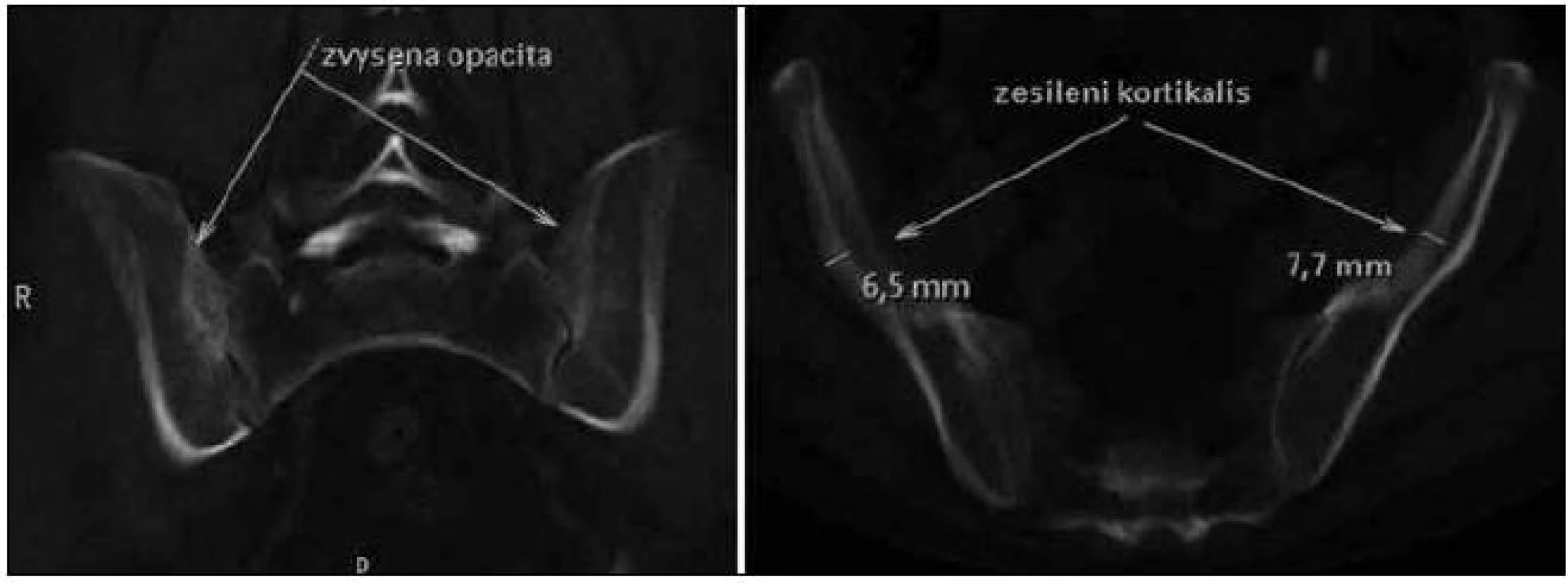
Skiagrafické vyšetření skeletu neprokázalo žádnou významnou patologii, změny zachycené na vyšetření skeletu pomocí magnetické rezonance lze považovat za nesignifikantní. Pacient byl rovněž vyšetřen pomocí PET/ CT vyšetřovací modality (září roku 2009), která sice žádnou patologickou kumulaci radiofarmaka neprokázala, CT komponenta však zachytila hyperostózu v oblasti klíčních kostí, kde byla patrná nápadná sklerotizace bilaterálně se zesílením kortikalis (obr. 1). To bylo na CT nápadné také v jiných lokalizacích, např. v kostech dolních končetin a předloktí. Přibližně za 1/ 2 roku jsme CT vyšetření opakovali (únor roku 2010) a v nálezu byla popsána hyperostóza v oblasti lopat kostí kyčelních oboustranně (obr. 2). Pacient byl rovněž vyšetřen (srpen roku 2009) na celotělové scintigrafii skeletu (obr. 3), která ukázala abnormálně zvýšenou aktivitu radiofarmaka (technecium pyrofosfátu) v celém hrudním koši, nehomogenně vyšší aktivita byla popsána také v proximálních polovinách obou humerů, v distální třetině levého femoru a v proximální polovině obou tibií. Vysoká aktivita byla nalezena také v os sacrum. Hodnoty kostní denzity kyčle a bederní páteře měřené metodou DEXA byly v normě.
V rámci diferenciálně diagnostických rozvah byla indikována dále trepanobiopsie z lopaty kosti kyčelní. Výkon byl stejně jako CT vyšetření opakován s odstupem asi 1/ 2 roku a u žádného z obou vyšetření nebyla nalezena patologie v kostní dřeni. Nutno však podotknout, že samotný výkon odběru kostní dřeně byl neobvykle technicky obtížný, a to zejména pro tuhost a nepoddajnost kyčelní kosti v místě odběru, což korelovalo s nálezem na CT zobrazení, kde se zobrazila, jak je výše uvedeno, hyperostóza.
K vyloučení záměny zdroje pacientových obtíží za případné revmatologické nebo jiné autoinflamatorní onemocnění bylo doplněno rovněž revmatologické konzilium. Klinicky i laboratorně však nebyla prokázána aktivita zánětlivého revmatického onemocnění, kritéria pro systémové onemocnění pojiva tedy splněna nebyla.
Pacient byl proto definitivně předán do péče naší ambulance s diagnózou Schnitzler - syndrom (nálezy u našeho pacienta shrnuje tab. 1). S ohledem na množící se zprávy o excelentní léčebné odpovědi při aplikaci anakinry (firemní název KineretTM), bylo i pro našeho pacienta zažádáno u pojišťovny o schválení této biologické léčby. Než však byla žádost vyřízena, byli jsme na přechodnou dobu nuceni pokračovat v preskripci metylprednizolonu, a to i přes zjevné nežádoucí účinky kortikoterapie, které však dle rozhovorů s pacientem byly tak jako tak únosnější než projevy Schnitzler - syndromu.
Kortikoterapie a rozvoj Cushingova syndromu
Užívání metylprednizolonu znamenalo pro pacienta výraznou úlevu od potíží, odeznění bolestí, záchvatů i kopřivky, ale asi po 2 měsících, na přelomu srpna a září roku 2009, se dostavily obtíže nové, naznačující iatrogenní poškození organizmu vysokými dávkami kortikoidů (48 mg metylprednizolonu odpovídá 192 mg hydrokortizonu, což svým účinkem nahrazuje téměř 10násobek endogenní produkce kortizolu za den). Měnil se kolorit jeho tváře, který dostával cushingoidní vzhled (obr. 4), začaly jej pálit obě oči, objevily se otoky dolních končetin, kolem kotníků a na bércích se tvořily podlitiny. Během několika následujících týdnů se změnila distribuce tělesného tuku s nahromaděním zejména v abdominální krajině. Postupně muž ztrácel svalovou sílu, zejména na dolních končetinách, až po zhruba 1/ 2 roku trvající vysokodávkované kortikoterapii nebyl pacient schopen sám vstát ze dřepu do stoje.

Tyto nové obtíže byly pro něj velmi tíživé, a nelze se proto divit, že se muž pokoušel sám si kortikoidy vysadit. Po přerušení pravidelné medikace glukokortikoidy však vždy nejpozději do 2 dnů kožní eflorescence spolu s dalšími příznaky Schnitzler - syndromu ve své původní intenzitě opět recidivovaly. Po 7 měsících od zahájení kortikoidní léčby byl pacient v lednu roku 2010, kdy byla biologická léčba schválena, konečně objednán na termín přijetí na naše oddělení k zahájení aplikace anakinry (KineretuTM) při postupném snižování dávky glukokortikoidů jako prevenci rozvoje syndromu z odnětí kortikoidů [6].
Objektivně byly u muže patrné typické známky Cushingova syndromu, tedy faciotrunkální obezita s měsíčkovitým obličejem a hubenými končetinami se zvlášť vyjádřenou hypotrofií proximální svalové skupiny dolních končetin, porucha glukózové homeostázy (glykemie nalačno 6,4 mmol/ l), hypertenze (vstupní arteriální tlak 145/ 90 mm Hg), časté močení, kožní mykotické postižení v obou axilách, akné a otoky dolních končetin (obr. 5). Biochemické vyšetření ranního vzorku krve ukázalo supresi hypotalamo - pituito-adrenální osy pod clonou vysokodávkované kortikoterapie (sérový kortizol 75,4 nmol/ l a ACTH < 5 pg/ ml). Snižování dávky kortikoidů bylo proto nutné provádět postupně tak, aby měla hypotalamo - pituito-adrenální osa pacienta možnost se plně restaurovat [7, 8].
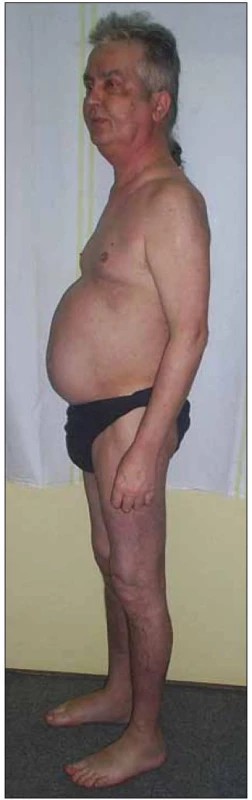
Vzhledem k přítomnosti proximální svalové slabosti byl pacient v únoru roku 2010 vyšetřen neurologickým konziliářem. Závěr z klinického a elektromyografického vyšetření zněl: steroidní myopatie s maximem nálezu na kořenových svalech dolních končetin po dlouhodobém užívání kortikoidů s lehkou axonální polyneuropatií pravděpodobně při monoklonální gamapatii.
Zahájení biologické léčby anakinrou (KineretemTM)
Během 10 dnů od přijetí pacienta na oddělení se nám podařilo snížit perorální dávky glukokortikoidů na 30 mg hydrokortizonu denně s částečnou responzivitou adrenokortikální dráhy (ranní sérový kortizol 170 nmol/ l) a dobrou subjektivní tolerancí, avšak bez jakékoliv formy exacerbace základního onemocnění, tedy bez nutnosti zahájení léčby anakinrou, a proto byl pacient dne 5. 2. 2010 v uspokojivém klinickém stavu propuštěn z našeho oddělení. Příčinu takovéto neočekávané remise Schnitzler - syndromu se nám zcela objasnit nepodařilo. Lze se domnívat, že nastavená substituční kortikoidní léčba v postupně se snižujících dávkách (60 mg hydrokortizonu klesající každé 3 dny o 10 mg na výstupních 30 mg hydrokortizonu při dimisi) byla s to tlumit příznaky Schnitzler - syndromu. V předcházejících pokusech, kdy pacient sám přerušil kortikoterapii, nebyl totiž zajištěn ani bazální dávkou kortikoidů a k exacerbaci onemocnění vždy došlo.
Druhý týden po propuštění, kdy muž dle doporučení sledujícího endokrinologa snížil substituční dávku hydrokortizonu na 20 mg denně, se začaly u našeho pacienta projevovat bolesti pat, na VAS (vizuální analogové škále) dosahující intenzity 5 – 6/ 10, při došlápnutí 8 – 9/ 10. Částečně úlevovou polohu hledal v chůzi po špičkách. Záchvatovitě přicházely bolesti kolen, asi 3 – 4krát za den, na VAS až 8/ 10. Dále byly přítomny i trvalé bolesti kostí holenních, na VAS stabilně kolem 7/ 10. Současně s těmito obtížemi se výrazně zvýšila na dotek citlivost kůže na obou bércích. Nejintenzivnější bolesti (10/ 10 na VAS), reagující pouze na dvojkombinaci Algifenu s Brufenem, postihovaly pravou polovinu hlavy. Hemikranie se objevovaly nárazovitě přes den a neměly vazbu na žádnou činnost. Všechny tyto obtíže pokračovaly střídavě až do 19. 2. 2010, kdy se vpředu na hrudi v oblasti výstřihu objevil urtikariální exantém. Druhý den ráno se vyrážka rozšířila na celá prsa, týž den večer na záda a pak i na obě stehna.
Celkově zesláblý a vyčerpaný, s bolestmi všech kloubů (zejména ramenních, kolenních a kotníků) a s nesvědivou celotělovou kopřivkou, vynechávající oblast hlavy a aker a postihující dominantně hrudník a krk (obr. 6), byl muž přijatý na naše oddělení s diagnózou exacerbace Schnitzler - syndromu k zahájení biologické léčby.
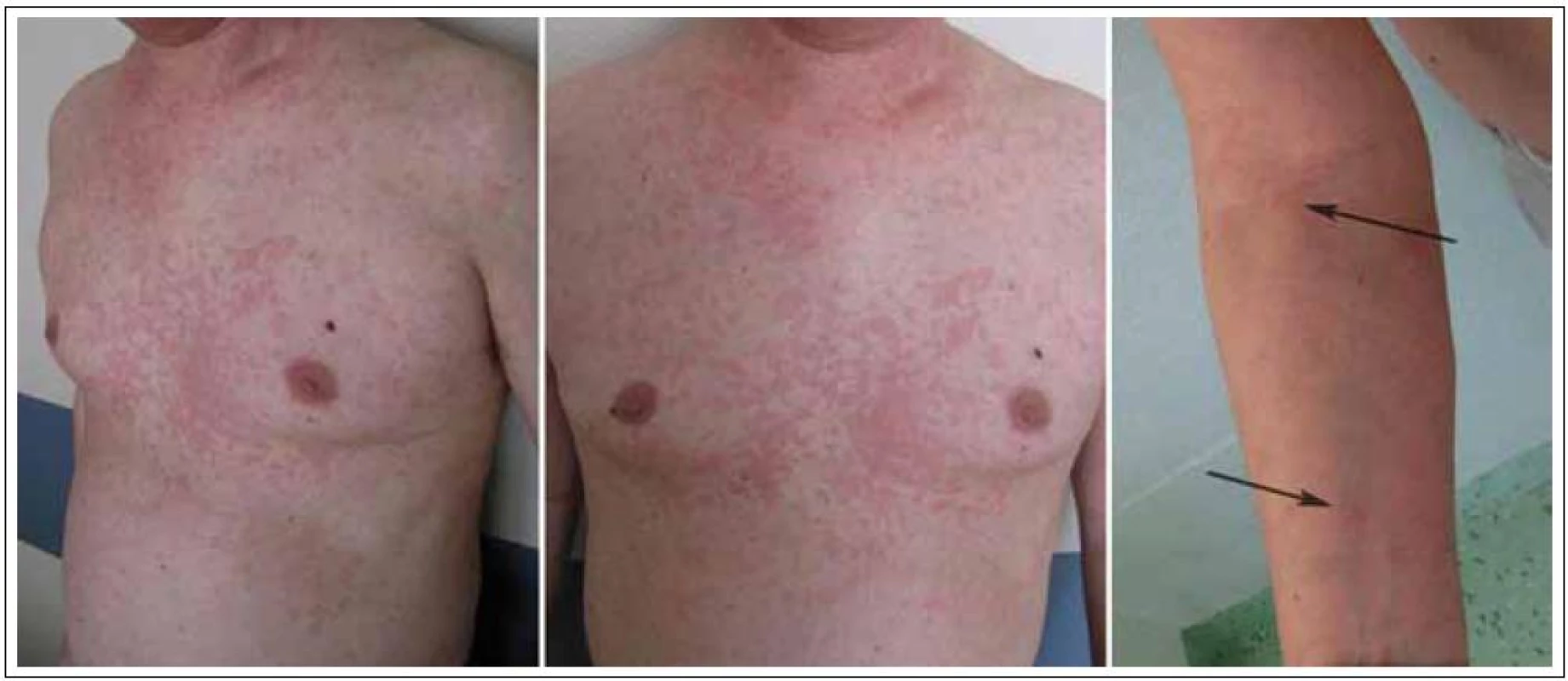
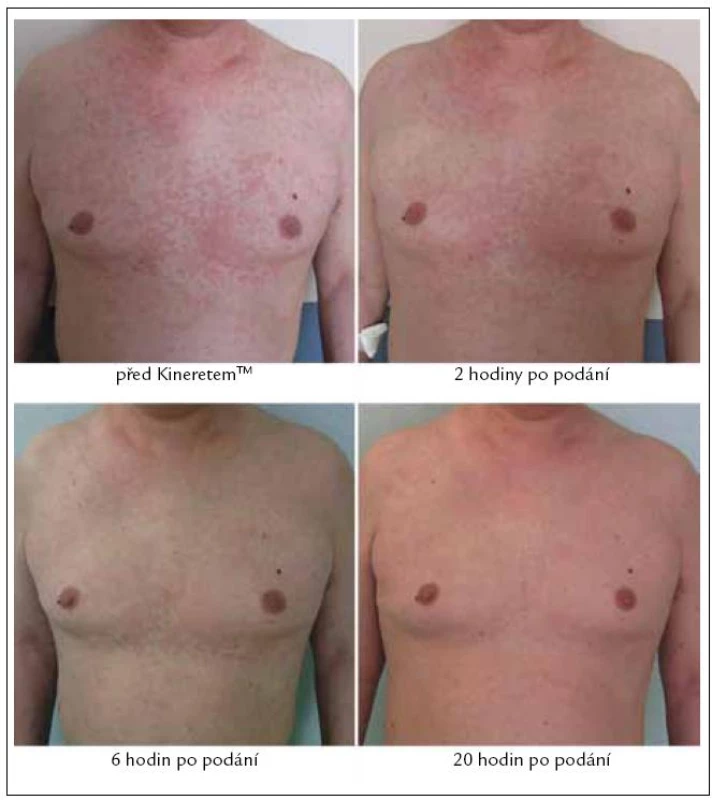
Bezprostředně po aplikaci 1. dávky KineretuTM, která proběhla dne 23. 2. 2010 formou podkožní injekce v abdominální krajině, se žádné lokální ani celkové změny neprojevily. Aplikace proběhla bez komplikací, bez jakýchkoli bezprostředních nežádoucích reakcí. Asi za 2 hodiny bylo patrné, jak se kožní morfy vpředu na hrudníku slévají a mění se jejich konfigurace. Po 6 hodinách začala vyrážka blednout a pacientovi polevily bolesti kolen a pomalu ustupovaly i obtíže s ostatními klouby. Druhý den ráno původní kopřivkové pomfy na hrudi již patrné nebyly (obr. 7), kůže byla čistá, jen na předloktí a stehnech byly nalezeny ojedinělé světle červené papuly s centrálním výbledem, které další den rovněž vymizely. Zároveň s odezníváním těchto příznaků ustupovaly otoky na dorzech chodidel. Po 3. ampulce KineretuTM byl muž bez stálých bolestí, bez kožní vyrážky a jediné, co ještě přetrvávalo, byla povšechná ztuhlost kloubů horních a dolních končetin a celková svalová slabost, tedy zřejmě přetrvávající nežádoucí účinky dlouhodobé kortikoterapie.
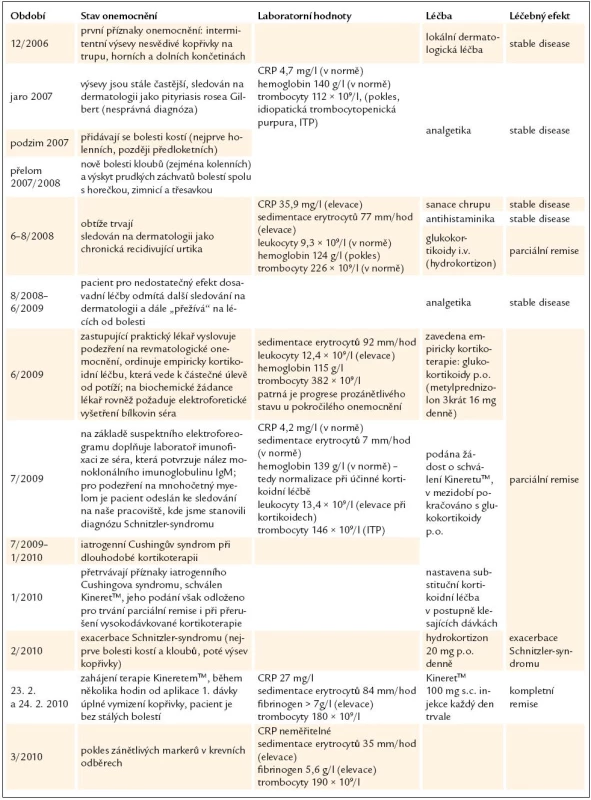
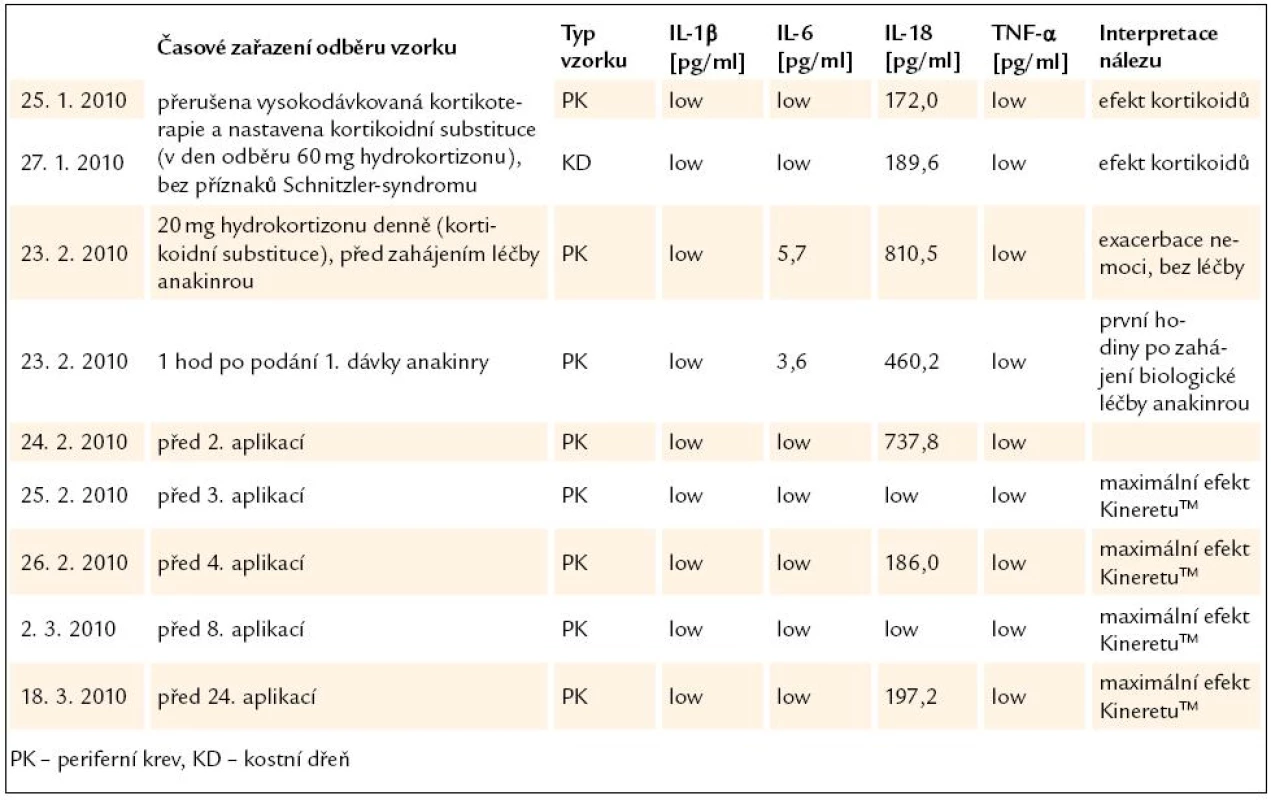
Průběh onemocnění včetně laboratorních nálezů, léčby a léčebného efektu shrnuje tab. 2.
Sledování cytokinové odpovědi organizmu u pacienta
Popis metodiky
Vzorky krve a kostní dřeně byly do laboratoře flowcytometrie a celulární terapie transportovány ve zkumavkách s EDTA a zpracovány do 4 hod po odběru. Po centrifugaci (10 min při 250 g) byla plazma odsáta a uchována při – 80 °C do analýzy.
Ke stanovení hladin jednotlivých cytokinových molekul (IL-1β, IL-6, IL-18, TNF-α) byly použity soupravy Instant ELISA (firmy Bender MedSystems GmbH, Rakousko) dle návodu od výrobce. Absorbance byla měřena při vlnové délce 450 nm laboratorním přístrojem SUNRISE Absorbance Reader vybaveným softwarem Kim32 (Schoeller Pharma, Praha).
Výsledky měření
Při sledování cytokinové odpovědi organizmu u pacienta se Schnitzler - syndromem byly nejsenzitivnějšími ukazateli interleukiny IL-6 a zejména IL-18, zatímco hladiny IL-1β a TNF-α byly při všech měřeních pod limitem detekce. Nejvyšší hodnoty prozánětlivých cytokinů (IL-6 a IL-18) byly naměřeny v době klinické exacerbace choroby před zahájením léčby protilátkou za přítomnosti typických bolestí, kožních příznaků a elevace dalších sérových zánětlivých markerů (CRP, sedimentace erytrocytů). Nízké hladiny IL-6 a IL-18 pak byly naměřeny v bezpříznakovém období (při kortikoterapii stejně tak jako v průběhu léčby KineretemTM). Hladiny cytokinů stanovené ze vzorku kostní dřeně před zahájením terapie se nelišily od hladin v periferní krvi. Výsledky uvádí tab. 3 a grafy 1 a 2.


Diskuze
Cytokiny a etiopatogeneze onemocnění
Etiopatogeneze Schnitzler - syndromunení dosud zcela objasněna. Schnitzler-syndrom se podobá některým autoinflamatorním nemocem, proto byla hledána korelace s cytokinovou odpovědí. Existují hypotézy uvádějící onemocnění do souvislosti s hypersekrecí interleukinu - 1 (IL-1) [3,9,10]. Interleukin-1 reguluje síť prozánětlivých cytokinů. Rodina interleukinu - 1 sestává ze dvou agonistických proteinů IL-1α (převážně v membránové formě) a IL-1β (pouze v solubilní formě), dále pak z inhibitoru IL-1Ra (receptorový antagonista), který se váže na receptor IL-1 a inaktivuje jej [3,11].
U pacientů se Schnitzler - syndromem je nalézána zvýšená plazmatická koncentrace interleukinu - 6 (IL-6) [5,12], který hraje důležitou roli při proliferaci plazmocytů a je spojován s chronicky zvýšenou hodnotou CRP a s anémií chronických chorob, jež je pro tento syndrom rovněž typická. Zvýšené sérové hladiny dalšího interleukinu, IL-18 (cytokinu z IL-1 rodiny štěpeného kaspázou - 1), byly zjištěny u dvou pacientů léčených anakinrou (KineretemTM) [13]. Plazmatické hladiny IL-1β a IL-1α jsou však u pacientů se Schnitzler - syndromem pod limitem detekce ELISA (< 1 pg/ ml) [10,11,13]. Pro jejich stanovení v CD14+ buňkách (monocytech) lze použít stimulaci pomocí bakteriálního endotoxinu (lipopolysacharidu), tato měření jsme však neprováděli.
Aktivita nemoci u našeho pacienta korelovala se sérovou hladinou IL-6 a IL-18, nikoliv však s hladinou tumor necrosis factor a (TNF-α) a IL-1β. Naše práce tedy ve shodě s literaturou potvrzuje korelaci sérových hladin IL-6 a IL-18 s aktivitou nemoci a podtrhuje význam stanovení těchto cytokinů v rámci diagnostiky i dalšího sledování nemoci.
Typické příznaky nemoci
Kožní projevy
Dominujícím příznakem onemocnění jsou kopřivkové morfy. Primární eflorescencí u kopřivky je plošně papulózně vyvýšená, ostře ohraničená tuhá morfa různé velikosti. Výsev se u většiny kopřivek objevuje náhle, během několika minut, a v poměrně krátkém čase spontánně odeznívá, je prchavý. Při vitropresi prosvítá žlutavá barva sérové insudace. Při tlaku z boku lze vyvolat fenomén pomerančové kůry, způsobený vtahováním vlasových folikulů kůže. U chronických urtikárií dochází k výsevům nových eflorescencí po dobu delší než 6 týdnů.
U nemocných se Schnitzler - syndromem jsou popisovány kožní změny charakteru chronicko-recidivující až chronicko-kontinuální kopřivky. Jsou popisovány jako erytematózní makulopapulózní ložiska až splývající červené plaky velikosti od 0,5 až po více než 10 cm v průměru. Všechna ložiska mají stejnou barvu i tvar. Denně se mohou objevovat nové výsevy, trvající 12 – 36 hod a potom pomalu mizící. U některých pacientů vznikají každý den nové morfy, zatímco u jiných se vyskytují i několik týdnů dlouhé klidové pauzy, u většiny popsaných případů však byly patologické kožní erupce přítomny kontinuálně [14,15]. U některých pacientů byl popsán výsev nových morf v souvislosti s konzumací alkoholu, kořeněných jídel či stresem. Postiženy bývají obvykle končetiny a trup, zatímco hlava a krk, stejně tak jako chodidla a ruce zůstávají ušetřeny. Svědění je nekonstantním příznakem, které může zpočátku chybět a objevit se až s odstupem několika měsíců či roků [16], může se však jednat o jinak zcela asymptomatickou kožní vyrážku.
Histologický nález z lézí nejčastěji odpovídá neutrofilní urtikárii, výjimečně pak leukocytoklastické vaskulitidě [17]. Jako nejpravděpodobnější mechanizmus jejich vzniku se jeví hypotéza, podle níž depozita monoklonálního imunoglobulinu typu IgM v dermálně/ epidermálním spojení spouštějí lokální zánětlivou reakci, která vede k erupci kopřivkové morfy na kůži. Tato depozita lze prokázat imunofluorescenčním vyšetřením [18 – 22] a jedná se o stejné izotypy protilátek IgM, které cirkulují v krvi [23].
U našeho pacienta nebyly výsevy provázené pruritem, pálením ani bolestí v místě vyrážky. Morfy měly typický kopřivkovitý charakter, byly prchavé a v počátku se objevovaly v několikatýdenních intervalech. Výsevy postihovaly hlavně hrudník a záda, v menším rozsahu i horní a dolní končetiny. Hlava, dlaně ani plosky postiženy nebyly. Ke zintenzivnění nových výsevů kopřivky došlo po několika měsících společně se záchvaty bolestí kostí a kloubů a horečnatými stavy. Ani po více něž dvouletém průběhu nemoci se u pacienta nevyskytnul pruritus kůže. Angioedém se neobjevil a vyvolávajících faktorů charakteru stravy, alkoholu nebo stresu si pacient nepovšimnul.
Teplota a další symptomy
Intermitentně zvýšená tělesná teplota obvykle bez pocitu zimnice je popisována jako kardinální symptom této nemoci. I když u některých pacientů může dosáhnout až 40 °C, bývá teplota dobře tolerována a ochotně reaguje na nesteroidní antiflogistika. Příčina teploty není jasná, Lipsker popisuje zvýšenou hladinu interleukinu - 6, zatímco hladina tumor necrosis factor α (TNF-α) byla v normálním rozmezí [2]. U našeho pacienta se vyskytovaly prudké záchvaty horečky, zimnice a třesavky. Jelikož dominantně se v těchto záchvatech projevovaly bolesti kostí a kloubů, užíval pacient nesteroidní antiflogistika (ibuprofen) v analgetické indikaci.
Muskuloskeletální postižení je tedy dalším důležitým znakem této nemoci, vyskytuje se asi u 80 % nemocných. Bolesti kostí, nejčastěji v oblasti pánve a holenních kostí, jsou popisovány u 59 % nemocných a často k nim přistupují ještě bolesti kloubů (kyčle, kolena, zápěstí, lokte). Nevedou však k jejich deformacím ani k destrukci. V některých případech byly uvedeny i myalgie [24,25]. Bolesti u našeho pacienta postihovaly v sestupné intenzitě: hlavu (ve formě hemikranie), kolena, holenní kosti, paty, kotníky, předloketní kosti. Myalgie přítomny nebyly.
Palpačně zvětšené uzliny byly popsány u 50 % nemocných a hepatosplenomegalie u 33 % nemocných. Při histologickém vyšetření odpovídal nález pouze nespecifickým zánětlivým změnám [2]. Tyto nálezy u našeho pacienta chyběly.
Laboratorní a zobrazovací nálezy
Monoklonální imunoglobulin typu IgM a další laboratorní ukazatele
Přítomnost monoklonálního imunoglobulinu třídy IgM je nezbytná pro stanovení diagnózy tohoto onemocnění. U 89 % nemocných se jedná o κ IgM. Koncentrace monoklonálního imunoglobulinu typu IgM je obvykle při stanovení diagnózy nízká (pod 10 g/ l) a zůstává stabilní nebo se pozvolna v průběhu času zvyšuje, obvykle o 0,5 – 1,0 g/ l za rok [2], což odpovídá nálezu IgM κ v séru u našeho pacienta a jeho vývoji v čase (v červenci roku 2009 byla koncentrace 1,9 g/ l a v březnu roku 2010 2,4 g/ l). Vyšší hodnoty vyvolávají podezření na transformaci ve Waldenströmovu makroglobulinemii.
Trvale zvýšená hodnota sedimentace erytrocytů a CRP je charakteristickým laboratorním nálezem přítomným u všech nemocných. Trombocytóza a anémie chronických chorob je popisována u 10 % nemocných. U většiny byla zároveň pozorována trvalá leukocytóza. Z krevních odběrů provedených v červnu roku 2008 a červnu roku 2009, tedy před podáním kortikoidní léčby, ale i v červenci roku 2009, tedy po měsíční medikaci metylprednizolonem, byla prokázána hypochromní mikrocytární anémie. Takto laboratorně popsaný typ anémie je typický pro její sideropenickou formu, může se však jednat i o pokročilou formu anémie chronických chorob [26]. Metabolizmus železa nebyl v roce 2008 ani v roce 2009 vyšetřen. Přesto se domníváme, že se jednalo právě o anémii chronických chorob při Schnitzler - syndromu, neboť při kontrole za hospitalizace v lednu roku 2010 (po 7 měsících účinné kortikoidní léčby) byla anémie normochromní normocytární (hemoglobin 126 g/ l, střední objem erytrocytů 89,8 fl, střední množství hemoglobinu v erytrocytech 30,1 pg) při fyziologických hodnotách metabolizmu železa (sérové železo 13,4 μmol/ l, feritin 183,7 μg/ l, transferin 2,23 g/ l).
Změny skeletu
Schnitzler - syndrom způsobuje změny kostního metabolizmu. Zvýšení kostní denzity je nejčastějším radiologickým nálezem. V oblastech zvýšené kostní denzity jsou často pociťovány bolesti [27 – 30]. Osteolytická ložiska byla popsána u 2 nemocných [2,31] a periostální apozice u dalších 2 pacientů [27,32,33]. Scintigrafie skeletu pomocí technecium pyrofosfátu odhalí ložiska se zvýšenou kostní přestavbou [27].
Hyperostotická ložiska byla u našeho pacienta prokázána v obou klíčních kostech a pánvi, částečně i v kostech dolních končetin a předloktí. Na scintigramu zvýšeně akumulovaly radiofarmakum zejména oblast hrudního koše a kosti křížové a dále i humery a skelet dolních končetin. Korelaci výskytu hyperostotických ložisek, zvýšené aktivity radiofarmaka a subjektivně udávané bolesti splňovala oblast holenních kostí.
Diferenciální diagnostika
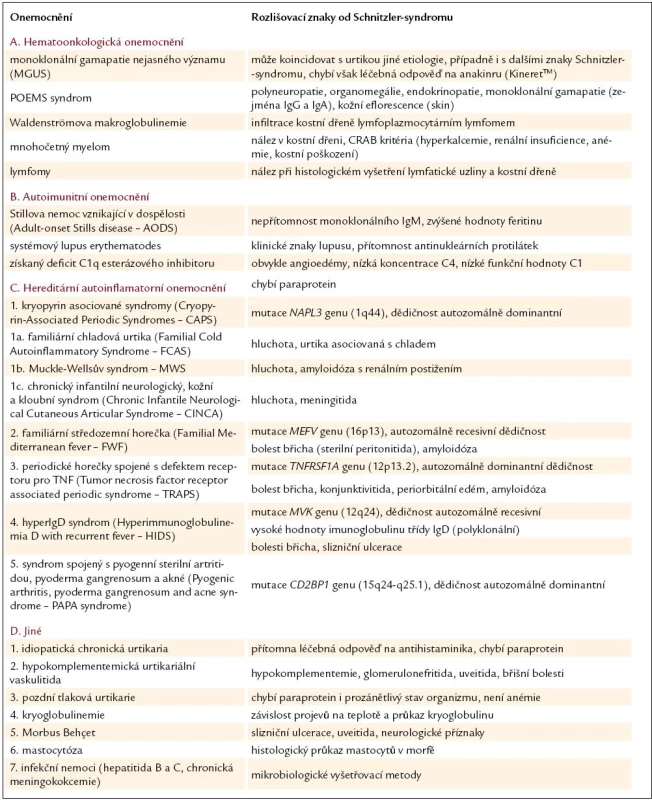
Nemoci, které se také mohou projevovat erytémem a urtikou, uvádí tab. 4 [24,34 – 36] a v následujících kapitolách podrobněji rozebíráme vybrané nejvýznamnější jednotky.
Hematoonkologická onemocnění
Pro diferenciální diagnózu IgM gamapatií je zásadní biopsie kostní dřeně [37]. V době stanovení diagnózy mělo 80 % vyšetřených normální nález v kostní dřeni, u zbývajících 20 % byly nalezeny nespecifické polyklonální lymfocytární nebo plazmocytární infiltráty [2]. Schnitzler - syndrom není jedinou monoklonální gamapatií s kožní manifestací v podobě chronické urtiky. Ta byla totiž popsána jak u pacientů s Waldenströmovou makroglobulinemií [38] a mnohočetným myelomem [39], tak i u pacientů s monoklonální gamapatií nejasného významu [40,41].
Autoimunitní nemoci
Autoimunitní nemoci představují další skupinu z rozsáhlého souboru možných diferenciálně diagnostických příčin. Podobné kožní a systémové projevy (zejména febrilie) jako Schnitzler - syndrom může způsobovat Stillova nemoc vznikající v dospělosti. Kožní manifestací je v tomto případě makulopapulózní prchavá vyrážka lososově růžové barvy typicky v oblasti trupu a na končetinách [42]. Odlišení těchto dvou chorobných stavů je možné pomocí laboratorní metodiky, kdy u Schnitzler - syndromu dominuje monoklonální imunoglobulin IgM, zatímco u Stillovy choroby vysoké hodnoty feritinu, které jsou obvykle vyšší než u jiných autoimunitních nebo zánětlivých onemocnění (typicky více než 1 000 μg/ ml). Glykozylovaná frakce feritinu, která u zdravých jedinců tvoří 50 – 80 % a u zánětlivých stavů klesá na 20 – 50 %, představuje však ještě specifičtější ukazatel, když u Stillovy choroby klesá až pod 20 % [42].
Urtikariální vyrážka, teploty, artralgie a anémie jsou průsečíkem Schnitzler - syndromu a systémového lupus erythematodes. V rámci lupusu se však kožní projevy vyskytují v typických lokalizacích, jako je obličej, a jsou trvalejšího charakteru. Přítomny jsou rovněž orgánově nespecifické protilátky (ANA a anti-dsDNA), které jsou detekovány v nízkých titrech asi u 10 % Schnitzler - syndromu [43].
U získaného C1q-inhibitoru jsou charakteristickým nálezem angioedémy a laboratorně zjišťujeme nízké hladiny složek komplementového systému (zejména C1q-inhibitoru).
Autoinflamatorní onemocnění
Původně označovány jako hereditární periodické horečky tvoří tyto jednotky skupinu vrozených chorob charakterizovanou zdánlivě nevyprovokovanými epizodami zánětu.
Termín kryopyrinopatie zaštiťuje tři autozomálně dominantní onemocnění (familiární chladová urtika, Muckle - Wellsův syndrom a chronický infantilní neurologický, kožní a kloubní syndrom). Podle některých autorů se však jedná o jeden patologický stav s variabilní manifestací, což je v souladu s existencí společné mutace genu NLRP3, dříve nazývaného CIAS1 (Cold Induced Autoinflammatory Syndrome 1 gene). Tento gen kóduje kryopyrin, který se spolupodílí na koordinaci iniciální zánětlivé odpovědi vedoucí ke zvýšení produkce interleukinu - 1β. Nadprodukce tohoto cytokinu pak zodpovídá za řadu klinických projevů (kožní vyrážka, teploty, artralgie, cefalea, konjunktivitida a další) vznikajících po narození a přetrvávajících po celý život postižených jedinců [44].
Familiární středozemní horečka vzniká mutací MEFV genu, který kóduje pyrin zasahující mimo jiné také do produkce cytokinů (zejména interleukinu - 1). Onemocnění je charakterizováno opakovanými atakami febrilií a serozitidami, především sterilní peritonitidou vyvolávající generalizovanou abdominální bolest hůře odlišitelnou od příznaků akutní apendicitidy [45]. Podobně jako u Schnitzler - syndromu bývá postižena kůže v podobě exantému a dále i klouby.
Příznaky periodické horečky spojené s defektem receptoru pro tumor necrosis factor (TNF) jsou značně variabilní a stejně jako u Schnitzler - syndromu mohou být přítomny kožní projevy a myalgie. Často se však setkáme i s bolestmi kostí, konjunktivitidou a periorbitálním edémem [36].
Syndrom hyperimunoglobulinemie D souvisí s mutací pro mevalonát kinázu způsobující mevalonovou aminoacidurii. Se Schnitzler - syndromem sdílí výskyt vysokých horeček, exantému a bolestí svalů a kloubů, u části pacientů však může docházet k rozvoji slizničních ulcerací (zejména v dutině ústní).
Pro PAPA syndrom je typická pyogenní sterilní artritida, pyoderma gangrenosum a kožní projevy ve formě akné [46].
Léčba Schnitzler - syndromu
Zatím nebyl zdokumentován žádný případ spontánní remise Schnitzler - syndromu [3] a do roku 2005, kdy se objevila první zpráva o úspěšné biologické terapii preparátem anakinra [9], byla terapie této choroby svízelná a frustrující a žádný z popsaných léčebných postupů nevedl u všech případů k žádoucí léčebné odpovědi.
Blokátory cyklooxygenázy se mohou uplatnit při symptomatické léčbě teploty a bolestí kostí a kloubů, nemají však až na výjimky [47] žádný vliv na kožní projevy [20 – 22,27]. Bolesti kostí mírní či zcela odstraňují rovněž bisfosfonáty [48]. Antihistaminika jsou u Schnitzler - syndromu na kožní projevy neúčinná [18,22,27]. Léky, které inhibují migraci neutrofilů, jako je kolchicin či dapson, byly také testovány, ale jejich přínos nebyl nikterak přesvědčivý [19,49]. Vyzkoušeny byly také hydroxychlorochin a chlorochin [18], dále plazmaferéza [18,23] a nitrožilní imunoglobuliny [50], stejně tak jako chemoterapeutické léčebné režimy [2]. Vše ovšem bez podstatné léčebné odpovědi.
V předchozích letech bylo popsáno několik alespoň středně účinných alternativ. Léčba interferonem α snižovala v několika případech dlouhodobě intenzitu svědění a rozsah kopřivkového výsevu [9]. Nicméně tato léčba je účinná jen po dobu aplikace a po přerušení se vracejí původní projevy nemoci. Parciální remisi navodil thalidomid [51], ale jeho dlouhodobé použití bylo limitováno jeho neurotoxicitou. Fototerapie metodou PUVA v několika případech zmírnila kožní projevy této nemoci [2]. Glukokortikoidy sice snižují intenzitu kožních projevů, ale pro dosažení léčebného efektu je zapotřebí dostatečně vysokých dávek (48 mg metylprednizolonu u našeho pacienta), které prohlubují jejich nežádoucí účinky ve formě iatrogenního Cushingova syndromu.
Zásadní změnu přinesl až zcela nový preparát anakinra (KineretTM), rekombinantní antagonista receptoru pro interleukin-1. S pomocí medicínské vyhledávací databáze MEDLINE jsme nalezli práce dokumentující úspěšné využití anakinry celkem u 19 nemocných se Schnitzler - syndromem [3,9,30,43,52 – 64]. Společně s naším pacientem se jedná o 20 případů. Nejdelší zkušenost s podáváním preparátu anakinra, popsaná v literatuře, je 3letá. Po celou dobu podávání tohoto léku zůstal nemocný bez jakýchkoliv známek onemocnění [51]. Ve všech popsaných případech navodila 1. injekce ihned kompletní remisi nemoci. Anakinra odstranila zcela svědění kůže a kožní projevy. Léčebný účinek anakinry se u našeho pacienta projevil také v laboratorních nálezech, kde byl patrný pokles zánětlivé odpovědi organizmu (graf 3 a 4). Vzhledem ke krátkému biologickému poločasu anakinry je její aplikace každodenní a trvalá a po vysazení se příznaky dostavují do 24 – 48 hod [24,59]. Po obnovení pravidelné administrace je však dosaženo stejného účinku jako při primoléčbě.


Dosud chybí jakékoliv zprávy o neúspěšnosti této formy biologické léčby. Dovolujeme si tedy vyslovit domněnku, že jedním z charakteristických rysů Schnitzler - syndromu je léčebná odpověď na podání preparátu anakinra. A mezi diagnostická kritéria tohoto onemocnění, jak je v roce 2001 popsal Lipsker [2], proto připojujeme kritérium další, tedy léčebnou odpověď na anakinru (tab. 1). Jelikož monoklonální gamapatie nejasného významu (MGUS) může koincidovat s urtikou jiné etiologie, ale i s dalšími příznaky Schnitzler - syndromu, nabývá toto kritérium léčebné odpovědi na anakinru praktického významu jako přesné diferenciační měřítko k odlišení těchto dvou patologických stavů.
Závěry pro praxi
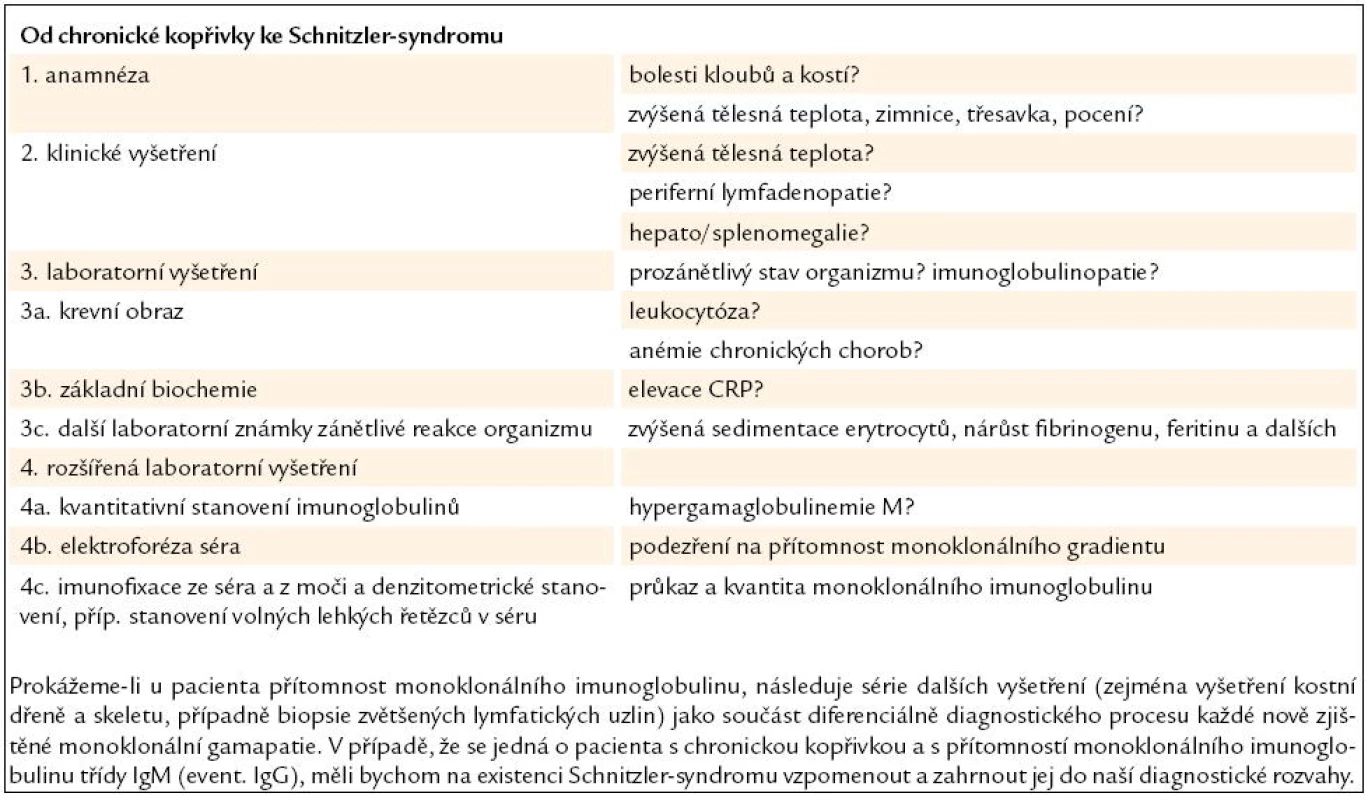
- Chronická kopřivka představuje mnohdy nelehký diferenciálně diagnostický úkol a v některých případech se může jednat o Schnitzler-syndrom. Diagnostický algoritmus u pacienta přicházejícího k lékaři s chronickou kopřivkou přehledně uvádí tab. 5.
- Měření sérových hladin interleukinů IL-6 a IL-18 lze využít při diagnostice Schnitzler - syndromu a při sledování jeho aktivity.
- Navrhujeme, aby byla léčebná odpověď na anakinru zařazena mezi diagnostická kritéria Schnitzler - syndromu, což mimo jiné umožní diferenciálně diagnosticky odlišit např. takové chorobné stavy jako monoklonální gamapatii nejasného významu (MGUS) asociovanou s urtikou.
- Dlouhodobá kortikoterapie, ačkoliv efektivní u řady onemocnění včetně Schnitzler - syndromu, s sebou přináší mnoho nežádoucích účinků v podobě iatrogenního Cushingova syndromu. Mělo by být proto vždy snahou lékařů hledat léčebné režimy minimalizující nutnost použití kortikoidů.
Poděkování
Velmi vzácné nemoci nemohou být předmětem zkoumání klinických studií. Registrace léků pro tyto nemoci nejsou tedy obsaženy v SPC dokumentaci, a přitom je nutné tyto choroby také léčit. Proto ani Schnitzler - syndrom nebude v registrační dokumentaci léčiv. Se žádostí o schválení této zcela výjimečné léčby jsme se obrátili na Všeobecnou zdravotní pojišťovnu, která ji schválila. Chceme proto poděkovat Oddělení revizních lékařů KP VZP ČR pro JMK za velmi vstřícný přístup při zajišťování úhrady léčby preparátem anakinra – KineretTM pro dlouhodobě trpícího člověka.
Fotografická dokumentace této kazuistiky je publikována s písemným souhlasem sledovaného pacienta.
Tato publikace byla připravena v rámci projektu MUNI/ A/ 1012/ 2009 s názvem „Optimalizace diagnostiky a terapie maligních chorob a komplikací, které tyto maligní nemoci provázejí, s využitím nových molekulárně biologických metod“, a také je součástí aktivit v rámci grantů IGA MZ: NR9225, NS9671, NS10387 a NS10406.
MU Dr. Petr Szturz
www.fnbrno.cz
e-mail: petr.szturz@fnbrno.cz
Doručeno do redakce: 30. 6. 2010
Přijato po recenzi: 16. 8. 2010
Sources
1. Schnitzler L, Schubert B, Boasson M et al. Urticaire chronique lesions osseuses macroglobulinémie IgM: Maladie de Waldenström? Bull Soc Fr Dermatol Syph 1974; 81 : 363 – 366.
2. Lipsker D, Veran Y, Grunenberger F et al. The Schnitzler syndrome: four new cases and review of the literature. Medicine (Baltimore) 2001; 80 : 37 – 44.
3. Besada E, Nossent H. Dramatic response to IL1 – RA treatment in longstanding multidrug resistant Schnitzler’s syndrome: a case report and literature review. Clin Rheumatol 2010; 29 : 567 – 571.
4. Klener P et al. Cytokiny ve vnitřním lékařství. Praha: Grada Publishing 1997.
5. Kluger N, Bessis D, Guillot B. Tocilizumab as a potential treatment in Schnitzler syndrome. Med Hypotheses 2009; 72 : 479 – 480.
6. Hochberg Z, Pacak K, Chrousos GP. Endocrine withdrawal syndromes. Endocr Rev 2003; 24 : 523 – 538.
7. Marek J. Léčba kortikoidy. Doporučené postupy. Projekt MZ ČR zpracovaný ČLS JEP za podpory grantu IGA MZ ČR 5390 – 3. Praha: ČLS JEP 2002.
8. Brunová J, Bruna J. Klinická endokrinologie a zobrazovací diagnostika endokrinopatií. Praha: Maxdorf 2009.
9. Martinez - Taboada VM, Fontalba A, Blanco R et al. Successful treatment of refractory Schnitzler syndrome with anakinra: comment on the article by Hawkins et al. Arthritis Rheum 2005; 52 : 2226 – 2227.
10. Loock J, Lamprecht P, Timmann C et al. Genetic predisposition (NLRP3 V198M mutation) for IL-1 - mediated inflammation in a patient with Schnitzler syndrome. J Allergy Clin Immunol 2010; 125 : 500 – 502.
11. Pizzirani C, Falzoni S, Govoni M et al.Dysfunctional inflammasome in Schnitzler’s syndrome. Rheumatology (Oxford) 2009; 48 : 1304 – 1308.
12. Asahina A, Sakurai N, Suzuki Y et al. Schnitzler’s syndrome with prominent neutrophil infiltration misdiagnosed as Sweet’s syndrome: a typical example of urticarial neutrophilic dermatosis. Clin Exp Dermatol 2010; 35: e123 – e126.
13. Migliorini P, Del Corso I, Tommasi C et al. Free circulating interleukin-18 is increased in Schnitzler syndrome: a new autoinflammatory disease? Eur Cytokine Netw 2009; 20 : 108 – 111.
14. Tomková H, Shirafuji Y, Arata J. Schnitzler’s syndrome versus adult onset Still’s disease. Eur J Dermatol 1998; 8 : 118 – 121.
15. SanMartín O, Febrer I, Botella R et al. Urticarial lesions and monoclonal IgM gammopathy. Schnitzler’s syndrome. Arch Dermatol 1994; 130 : 1193 – 1198.
16. Almerigogna F, Giudizi MG, Cappelli F et al. Schnitzler’s syndrome: what’s new? J Eur Acad Dermatol Venereol 2002; 16 : 214 – 219.
17. Kropp JD, Czarnetzki BM. Urticaria – vasculitis und Schnitzler’s syndrome. Allergologie 1994; 17: S17 – S20.
18. Berdy SS, Bloch KJ. Schnitzler’s syndrome: a broader clinical spectrum. J Allergy Clin Immunol 1991; 87 : 849 – 854.
19. Borradori L, Rybojad M, Puissant A et al. Urticarial vasculitis associated with monoclonal IgM gammopathy, Schnitzler’s syndrome. Brit J Dermatol 1990; 123 : 113 – 118.
20. Morita A, Sakakibara S, Yokota M et al. A case of urticarial vasculitis associated with macroglobulinemia (Schnitzler’s syndrome). J Dermatol 1995; 22 : 32 – 35.
21. Lautenschlager S, Itin PH. Schnitzler’s syndrome. Hautarzt 1993; 44 : 781 – 784.
22. Janier M, Bonvalet D, Blanc MF et al. Chronic urticaria and macroglobulinemia (Schnitzler’s syndrome): report of two cases. J Am Acad Dermatol 1989; 20 : 206 – 211.
23. Olsen E, Førre O, Lea T et al. Unique antigenic determinants used as markers in a patient with macroglobulinemia urticaria. Similar idiotypes demonstrated in the skin and on peripheral blood lymphocytes. Acta Med Scand 1980; 207 : 379 – 384.
24. de Koning HD, Bodar EJ, van der Meer JW et al. Schnitzler syndrome: beyond the case reports: review and follow-up of 94 patients with an emphasis on prognosis and treatment. Semin Arthritis Rheum 2007; 37 : 137 – 148.
25. de Koning HD, van der Meer JW, Simon A. Comment on: Schnitzler’s syndrome – exacerbation after anti-TNF treatment. Rheumatology (Oxford) 2007; 46 : 1741.
26. Ščudla V, Adam Z, Ščudlová M. Současné možnosti diagnostiky a léčby anémie chronických chorob. Vnitř Lék 2001; 47 : 400 – 406.
27. Lecompte M, Blais G, Bisson G et al. Schnitzler’s syndrome. Skeletal Radiol 1998; 27 : 294 – 296.
28. De Saint - Pierre V, Ehrhart A, Baron D et al. Systemic urticaria, sclerosing osteopathy, monoclonal gammopathy (Schnitzler’s syndrome). Apropos of a case. Rev Rhum Mal Osteoartic 1992; 59 : 288 – 292.
29. De Waele S, Lecouvet FE, Malghem J et al. Schnitzler’s syndrome: an unusual cause of bone pain with suggestive imaging features. AJR Am J Roentgenol 2000; 175 : 1325 – 1327.
30. Flórez AF, Gallardo Agromayor E, García-Barredo R et al. Radiological aid to clinical diagnosis of Schnizler’s syndrome: multimodality imaging approach. Clin Rheumatol 2008; 27 : 107 – 110.
31. Ferrando FJ, Pujol J, Hortells JL et al. Schnitzler’s syndrome: report of a case with bone osteolysis. J Investig Allergol Clin Immunol 1994; 4 : 203 – 205.
32. Bertrand A, Feydy A, Belmatoug N et al. Schnitzler’s syndrome: 3-year radiological follow-up. Skeletal Radiol 2007; 36 : 153 – 156.
33. Dupuy O, Pinede L, Coppere B et al. Schnitzler’s syndrome with stable course over a 18-year period. Report of a case. Presse Med 1995; 24 : 1402.
34. Adam Z, Krejčí M, Vorlíček J. Maligní krevní nemoci. Praha: Grada Publishing 2008.
35. Adam Z. Diferenciální diagnostika monoklonálních gamapatií. Intern Med pro Prax 2004; 5 : 279 – 283.
36. Šedivá A. Poruchy regulace zánětu a periodické horečky. Alergie 2006; 1 : 36 – 41.
37. Adam Z, Šmardová J, Ščudla V. Waldenströmova makroglobulinemie – klinické projevy, diferenciální diagnostika a prognóza nemoci. Vnitř Lék 2007; 53 : 1325 – 1337.
38. Pujol RM, Barnadas MA, Brunet S et al. Urticarial dermatosis associated with Waldenström’s macroglobulinemia. J Am Acad Dermatol 1989; 20 : 855 – 857.
39. Lipsker D, Cribier B, Maloisel F et al. Chronic urticaria and IgA myeloma. Acta Derm Venereol 1998; 78 : 395.
40. Karakelides M, Monson KL, Volcheck GW et al. Monoclonal gammopathies and malignancies in patients with chronic urticaria. Int J Dermatol 2006; 45 : 1032 – 1038.
41. Lipsker D, Boeckler P. Cutaneous manifestations of paraproteinemia and their mechanisms. Presse Med 2007; 36 : 1135 – 1140.
42. Jarošová K. Stillova choroba v dospělosti. Čes Revmatol 2006; 14 : 159 – 163.
43. Gilson M, Abad S, Larroche C et al. Treatment of Schnitzler’s syndrome with anakinra. Clin Exp Rheumatol 2007; 25 : 931.
44. Glaser RL, Goldbach - Mansky R. The spectrum of monogenic autoinflammatory syndromes: understanding disease mechanisms and use of targeted therapies. Curr Allergy Asthma Rep 2008; 8 : 288 – 298.
45. Padeh S. Periodic fever syndromes. Pediatr Clin North Am 2005; 52 : 577 – 609.
46. Farasat S, Aksentijevich I, Toro JR. Autoinflammatory diseases: clinical and genetic advances. Arch Dermatol 2008; 144 : 392 – 402.
47. Doutre MS, Beylot C. Chronic urticaria and monoclonal IgM: treatment with ibuprofen. J Am Acad Dermatol 1990; 22 : 143 – 144.
48. Obořilová A, Adam Z. Schnitzler’s syndrome. Vnitř Lék 1998; 44 : 423 – 427.
49. Machet L, Vaillant L, Machet MC et al. Schnitzler’s syndrome and associated with pseudoxanthoma elasticum. Acta Derm Venereol (Stockholm) 1991; 72 : 22 – 24.
50. Lebbe C, Rybojad M, Klein F et al. Schnitzler’s syndrome with sensorimotor neuropathy. J Am Acad Dermatol 1994; 30 : 316 – 318.
51. de Koning HD, Bodar EJ, Simon A et al. Beneficial response to anakinra and thalidomide in Schnitzler’s syndrome. Ann Rheum Dis 2006; 65 : 542 – 544.
52. Schneider SW, Gaubitz M, Luger TA et al. Prompt response of refractory Schnitzler syndrome to treatment with anakinra. J Am Acad Dermatol 2007; 56 (Suppl 5): S120 – S122.
53. Crouch R, Akhras V, Sarkany R. Schnitzler’s syndrome: successful treatment with anakinra. Australas J Dermatol 2007; 48 : 178 – 181.
54. Eiling E, Möller M, Kreiselmaier I et al. Schnizler syndrome: treatment failure to rituximab but response to anakinra. J Am Acad Dermatol 2007; 57 : 361 – 364.
55. Klemmer N, Lenain P, Balguerie X et al. Effectiveness of anti-IL1 in Schnizler’s syndrome. Jt Bone Spine 2007; 74 : 509 – 510.
56. Thonhoffer R, Uitz E, Graninger W. Schnitzler’s syndrome – exacerbation after anti-TNF treatment. Rheumatology 2007; 46 : 1041 – 1042.
57. Eiling E, Schröder JO, Gross WL et al. The Schnitzler syndrome: chronic urticaria and monoclonal gammopathy – an autoinflammatory syndrome? J Dtsch Dermatol Ges 2008; 6 : 626 – 631.
58. Devlin LA, Wright G, Edgar JD. A rare cause of a common symptom, Anakinra is effective in the urticaria of Schnitzler Syndrome: a case report. Cases J 2008; 1 : 348.
59. Kluger N, Rivière S, Guillot B et al. Efficacy of interleukin 1 receptor antagonist (anakinra) on a refractory Schnitzler’s syndrome. Acta Derm Venereol 2008; 88 : 287 – 288.
60. Frischmeyer - Guerrerio PA, Rachamalla R, Saini SS. Remission of Schnitzler syndrome after treatment with anakinra. Ann Allergy Asthma Immunol 2008; 100 : 617 – 619.
61. Adam Z, Krejčí M, Pour L. Schnitzlerův syndrom – popis čtrnáctiletého průběhu nemoci a přehled informací o této nemoci. Vnitř Lék 2008; 54 : 1140 – 1153.
62. Saiz E, Gálvez J, Mora A et al. Sindrome de Schnitzler y anakinra. Med Clin (Barc) 2008; 130 : 357 – 358.
63. Lazarevic V, Markuszewska A, Stenberg B et al. Schnitzlers syndrome – okänt, sällsynt med behandlingsbart. Läkartidningen 2008; 105 : 3348 – 3351.
64. Gallo R, Sabroe RA, Black AK et al. Schnitzler’s syndrome: no evidence for autoimmune basis in two patients. Clin Exp Dermatol 2000; 25 : 281 – 284.
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Internal Medicine

2011 Issue 1
-
All articles in this issue
- Obezita, body mass index, obvod pasu a mortalita – editorial
- Obezita, body mass index, obvod pasu a mortalita – editorial
- Akutní srdeční selhání a časný rozvoj dysfunkce levé komory u pacientů s akutním infarktem myokardu s elevacemi ST léčených primární perkutánní koronární intervencí
- Přínos celotělové magnetické rezonance v diagnostice monoklonální gamapatie nejistého významu, mnohočetného myelomu a stanovení stadia pokročilosti nemoci s pomocí systému Durie‑ Salmon Plus
- Faktory ovlivňující přítomnost varixů a varikózního krvácení u pacientů s jaterní cirhózou
- Terapeutická hypotermie po srdeční zástavě na 12 hodin: Karlovy Vary 2006– 2009
- Význam genetiky v predikci rizika osteoporózy
- Obezita, body mass index, obvod pasu a mortalita
- Prečo vzniká fibrilácia predsiení po kardiochirurgických operáciách?
- Schnitzler‑ syndrom: popis případu, zkušenosti s léčbou glukokortikoidy a preparátem anakinra (KineretTM) a sledování cytokinové odpovědi organizmu
- Opoždění diagnózy HELLP syndromu
- Prípad vlajúceho infikovaného trombu v. jugularis interna, septických pneumónií a heparínom indukovanej trombocytopénie
- Diagnostika a léčba akutní plicní embolie v roce 2010
- Terapeutická hypotermie po srdeční zástavě: proč a na jak dlouho? – editorial
- Geny a osteoporóza – editorial
- Charakteristika reziduálních tachykardií spojených s koronárním sinem během ablace dlouhodobé perzistentní fibrilace síní
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue
- Opoždění diagnózy HELLP syndromu
- Diagnostika a léčba akutní plicní embolie v roce 2010
- Obezita, body mass index, obvod pasu a mortalita
- Prípad vlajúceho infikovaného trombu v. jugularis interna, septických pneumónií a heparínom indukovanej trombocytopénie
