Zevní vlivy podmiňující vznik nádorů nebo ochraňující před jejich vznikem
External factors catalyzing the development of tumours or providing protection against them
The number of malignant diseases increases and the question is why. Why is there an increasing incidence of certain cancers and why an increasing number of people dies from them? We do not have a clear answer to these questions. We just know that a development of cancer depends on certain internal predispositions as well as external conditions. We are unable to change our genetic predisposition but we are able, to some extent, influence the intensity of external factors. This paper summarizes information on the effects of external environment on the development of malignant diseases.
Key words:
malignant diseases – carcinogens – physical activity – smoking – human papillomavirus
:
J. Fiala 1; J. Vorlíček 2; Z. Mechl 3; Z. Adam 3
:
Ústav preventivního lékařství Lékařské fakulty MU Brno, přednostka prof. MUDr. Zuzana Derflerová Brázdová, DrSc.
1; Masarykův onkologický ústav Brno, ředitel prof. MUDr. Jiří Vorlíček, CSc.
2; Interní hematoonkologická klinika Lékařské fakulty MU a FN Brno, pracoviště Bohunice, přednosta prof. MUDr. Jiří Mayer, CSc.
3
:
Vnitř Lék 2011; 57(3): 261-284
:
60th birthday of prof. Mudr. Jiřího Vítovce, CSc, FESC
Maligních nemocí přibývá a ptáme se, proč tomu tak je – proč výskyt některých nádorů neustále stoupá a proč na ně více a více lidí umírá. Přesnou odpověď na tuto otázku neznáme. Obecně pouze víme, že vznik nádoru souvisí s určitou vnitřní predispozicí a se zevními podmínkami. Svoje genetické vlohy ovlivnit neumíme, je však v naší moci částečně ovlivnit intenzitu působení zevních faktorů. Tento článek proto shrnuje informace o vlivech zevního prostředí na vznik maligních chorob.
Klíčová slova:
maligní choroby – karcinogeny – fyzická aktivita – kouření – lidský papilomavirus
Přehled hlavních příčin rakoviny globálně
Identifikace hlavních příčin vzniku nádorů má zcela zásadní význam především pro jejich primární prevenci. Pro připomenutí: podstatou primární prevence je snižování rizika samotného vzniku nádorového onemocnění ovlivňováním jeho příčin – tedy tzv. rizikových faktorů, zatímco podstatou sekundární prevence je časné zjištění již vzniklého nádoru (a následkem toho předpoklad jeho úspěšnější léčby).
Významným mezníkem v identifikaci skutečných příčin rakoviny byla především práce „Causes of cancer: quantitative estimates of avoidable risks of cancer in the United States today“ [1] z roku 1981. Tato epidemiologická analýza poprvé přesvědčivě ukázala, že hlavní příčinou rakoviny jsou zevní faktory, z nich pak především životní styl (tab. 1). Tato publikace a její autoři jsou dodnes v souvislosti s daným tématem nejčastěji citováni.
![Podíl jednotlivých příčin na nádorové mortalitě – jak viděno v roce 1981 [1].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/5fc268ebb17b81933057af1a482b6252.jpg)
Stanovení příčin rakoviny z roku 1981 uvádíme rovněž z historických důvodů. Tím myslíme i možnost srovnání vývoje daného pohledu a toho dnešního. V uplynulých desetiletích byla pochopitelně učiněna řada pokusů dopracovat se k co nepřesnější kvantifikaci významu hlavních faktorů, zde zmíníme pouze pár vybraných. Mezi ně patří studie, jejíž autoři hodnotili příčiny rakoviny na celém světě metodou komparativního hodnocení rizika 9 zevních faktorů, zahrnujících jak faktory prostředí, tak faktory životního stylu [2]. Hlavní výsledky shrnujeme v tab. 2.
![Atributivní přispění hodnocených 9 faktorů v procentech k úmrtnosti na vybrané nádory [2].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/b9a4dc6132f833791bd22c70a82d8871.jpg)
V tab. 2 stojí za povšimnutí kromě vlastního obsahu 2 věci: První je rozdělení hodnocení podle bohatství regionu (konkrétně podle příjmu na hlavu). To je samozřejmě aspekt, který v hodnocení významu jednotlivých faktorů také hraje roli, a tab. 2 to ukazuje. Druhou věcí, na kterou je třeba upozornit, je fakt, že z výživy je zde uvedena jen konzumace zeleniny, a celkový význam výživy se zde tedy oproti tabulce dle Dolla et al [1] zdánlivě vytrácí. Souvisí to ale spíše s metodologickým přístupem, respektive metodologickými problémy, kdy je výživa příliš komplexní záležitostí na to, aby ji bylo možné hodnotit jako jednotlivý faktor. Autoři zde tedy dokázali zhodnotit pouze význam ovoce a zeleniny, ale to neznamená, že by celý význam výživy ve vztahu k nádorům byl takto limitován. Vliv výživy na úrovni jednotlivých faktorů bude podrobně rozebrán v příslušných kapitolách.
Další odhad, jeden z nejnovějších, uvádíme v tab. 3. Na rozdíl od všech předchozích uvedených hodnocení se v něm objevuje další prvek, a to je pohlaví. Tab. 3 hned demonstruje, jak je tento prvek důležitý (a to i přesto, že pro ženy jsou data poněkud limitována). Dále je zde ještě jedna významná odlišnost – předchozí 2 tabulky (tab. 1 a 2) se vztahovaly k úmrtím na rakovinu, zatímco tab. 3 se týká incidence. To se nejvíce projevilo na hodnocení slunečního záření, které přispívá k rakovině kůže, a to především z hlediska celkových počtů k „non-melanomům“, které jsou ovšem z více než 95 % dobře vyléčitelné, a projevují se tedy sice výrazněji na incidenci, ale na úmrtnosti pouze minimálně.
![Příčiny rakoviny – jeden z recentních odhadů – proporce nádorové incidence, přičítané jednotlivým faktorům [3].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/7e362d9aa9b3a0b435b7989a112d7d1c.jpg)
Jaké jsou tedy hlavní závěry ohledně nejvýznamnějších příčin vzniku rakoviny? Z celkových součtů atributivních rizik vyplývá, že zevním vlivům lze přičítat vznik 75–95 % všech nádorů. Ať již je skutečnost blíže horní či spodní hranici, v každém případě jsou zevní vlivy jednoznačně tím nejvýznamnějším, co rozhoduje o tom, zda rakovinou onemocníme či nikoli. Nejvýznamnějšími skutečnými příčinami, respektive faktory ovlivňujícími riziko vzniku rakoviny, jsou: kouření a strava, dále pak nadváha a obezita, alkohol, nedostatek pohybu a určité infekce. Oproti některým mylným představám mají podstatně menší reálný význam takové faktory jako expozice chemickým škodlivinám v životním prostředí. Je třeba také varovat před zjednodušeným a chybným pohledem, že by bylo možné dávat rovnítko mezi zevní příčiny rakoviny a seznam karcinogenů. A to kromě jiného i proto, že mezi zevní příčiny je třeba počítat nejen expozici faktorům s karcinogenním potenciálem, ale také třeba naopak nedostatečnou expozici faktorům ochranným [4–8].
Tabák, kouření
Vliv kouření na riziko vzniku rakoviny
Kouření má v etiologii rakoviny mimořádné postavení, je totiž jednoznačně nejvýznamnější jednotlivou příčinou vzniku maligních nádorů, a navíc přitom příčinou jednoznačně preventabilní. Vlivu kouření je v Evropě přisuzován vznik (atributivní podíl na incidenci) celkem 29–38 % všech nádorů. Nejvýraznější, a také obecně nejznámější, je vliv kouření na riziko vzniku rakoviny plic. Kouření způsobuje 87–91 % plicní rakoviny u mužů a 57–86 % u žen [6]. Plicní rakovina ale není rozhodně jediným „nádorovým“ důsledkem kouření. V současnosti je významný podíl kouření na riziku vzniku nádorů prokázán pro řadu nádorových lokalizací. Přehled spolu s kvantitativním hodnocením v podobě relativního rizika (RR) na základě recentní metaanalýzy [9] ukazuje tab. 4.
![Relativní riziko vzniku nádorů vlivem kouření. Upraveno podle [9].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/e2b638512ae3787265d2dca13b508bb2.jpg)
Karcinogenní efekt expozice tabákovému kouři je dnes prokázán a zdokumentován naprosto jednoznačně a stejně tak to, že se jedná o nejsilnější jednotlivou příčinu rakoviny. Z více než 4 000 chemických látek, které se nacházejí v cigaretovém kouři, je několik desítek prokázaných karcinogenů. Celkově patří tabákový kouř samozřejmě také mezi prokázané humánní karcinogeny dle klasifikace IARC [10]. V zásadě jde o velmi zvláštní, ojedinělou situaci, kdy je vysloveně karcinogenní produkt, který u člověka prokazatelně způsobuje rakovinu při běžném použití a konzumaci, povolen k volnému prodeji. Tento paradox je ještě zvýrazněn dalšími skutečnostmi – jednak tím, že kouření způsobuje nejen rakovinu, ale mnoho dalších onemocnění, včetně kardiovaskulárních, a v neposlední řadě tím, že způsobuje silnou závislost, a to fyzickou, zdaleka ne jen psychickou. Nikotin je velmi silnou drogou. Působí stejným mechanizmem jako heroin a kokain (vazba na specifické receptory v mozku) a je s těmito drogami srovnatelný co do schopnosti vyvolat závislost (ve všech 3 případech u 80–85 % uživatelů) i v síle této závislosti.
Nejnovější aktualizaci poznatků o karcinogenitě tabáku a kouření představuje zpráva pracovní skupiny IARC z října roku 2009 [11]. Zpráva znovu potvrzuje a zdůrazňuje, že kouření je celosvětově největší jednotlivou příčinou rakoviny, ale především předkládá některá nová upřesnění. V přehledu uvádíme toto shrnutí v tab. 5.
![Důkazy o karcinogenitě tabáku a kouření pro člověka (karcinogeny skupiny 1) [11].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/aa025811ffb6f79cf2c7352e859595ce.jpg)
Zpráva udává, že jsou nyní již dostatečné důkazy o tom, že kouření způsobuje kolorektální karcinom a rakovinu ovarií. Co se týče rakoviny prsu, bylo zhodnoceno 150 epidemiologických studií. Velké kohortové studie publikované od roku 2002 konzistentně ukazují malou pozitivní asociaci (relativní riziko 1,1–1,3). Mnoho látek v tabákovém kouři způsobuje tumory mléčné žlázy u zvířat a tyto látky se shromažďují v prsní tukové tkáni u žen, proto pracovní skupina učinila závěr, že existují limitované důkazy o tom, že kouření způsobuje rakovinu prsu. Nově byla prokázána příčinná souvislost mezi rodičovským kouřením a rakovinou dětí. Čtyři recentní studie ukázaly, že děti narozené rodičům, kteří kouří (otec, matka nebo oba), včetně prekoncepční periody a těhotenství, mají významně vyšší riziko hepatomablastomu, vzácné embryonální rakoviny. Jestliže kouří pouze otec, je relativní riziko 1,86, jestliže pouze matka, je 2,02, a jestliže kouří oba, zvyšuje se na 4,74. Metaanalýza ukázala spojitost dětské leukemie s rodičovským kouřením před těhotenstvím (relativní riziko 1,12, 95% interval spolehlivosti 1,04–1,21). Pasivní kouření působí rakovinu plic (to je známo již déle), nyní máme omezené důkazy (kategorie „limited evidence“) pro rakovinu hrtanu a hltanu, zatímco souvislost s rakovinou prsu zůstává neprůkazná. Protože pasivní kouření zahrnuje většinu složek, které se nacházejí v hlavním proudu tabákového kouře (mainstream), dá se předpokládat rozšíření důkazů i na další nádory.
Co v cigaretovém kouři a tabáku způsobuje rakovinu, mechanizmy účinku
Jak již bylo zmíněno, v cigaretovém kouři je několik desítek prokázaných lidských karcinogenů a celkově je tabákový kouř jako směs také zařazen mezi humánní karcinogeny dle klasifikace IARC. Přestože bylo použito formulace, že kouření je nejvýznamnější „jednotlivou“ příčinou rakoviny, je to míněno spíše z vnějšího pohledu (kouření jako chování, expozice cigaretovému kouři versus ne-expozice). Z hlediska účinných látek a mechanizmu účinku se jedná o záležitost komplexní, vliv mnoha látek mnoha různými způsoby. Je předvídatelné, že karcinogenní vlastnosti budou mít především produkty hoření. Ale karcinogenita tabáku není vázána jen na vlastní hoření. I samotný nikotin, který byl dříve hodnocen spíše z hlediska vzniku závislosti, je prokazatelně karcinogenní. Rovněž tak jemu příbuzné sloučeniny, nornikotin a atanabin, které rovněž fungují, společně s nikotinem, jako prekurzory dalších látek s karcinogenními účinky, označovaných souborně jako specifické tabákové nitrosaminy. Další skupinou karcinogenů tabákového kouře jsou polycyklické aromatické uhlovodíky, například benzo(a)pyren, vyhodnocený jako silný karcinogen, nebo podobně nebezpečný benz(a)antracen. Mezi karcinogeny patří dále například nestálé těkavé nitrosaminy. Jsou přítomny i látky, které označujeme jako ko-karcinogeny a které zesilují účinky karcinogenů v kouři, jako jsou třeba fenol a katechol. Co se týče vlastních mechanizmů, jsou tedy v cigaretovém kouři jak látky s účinky induktorů nádorové transformace, tak látky působící jako promotory již indukovaných nádorových změn a napomáhající nádorové progresi, stejně jako látky s účinky ko-karcinogenními, které usnadňují pronikání karcinogenů nebo jejich transformační změny v buňkách.
Dále je důležité zmínit otázku závislosti na dávce. Ta platí jen částečně. Riziko nepochybně roste s mírou expozice. Ale na druhé straně neexistuje prahová dávka, pod kterou by nehrozilo nebezpečí. Obecně nelze hovořit o bezpečných dávkách karcinogenů. Lze mluvit pouze o vyšší či nižší pravděpodobnosti nádorové transformace. Navíc existují individuální rozdíly ve vnímavosti k poškozením i ve schopnosti jejich reparace. Proto mohou být stejné dávky karcinogenů u různých jedinců zdrojem různého rizika. V každém případě je pro praxi důležité, že jakákoli expozice tabákovému kouři je riziková. Riziko významně zvyšuje nejen kouření třeba 1 cigarety denně, ale i kouření příležitostné.
Otázky prevence, směry dalšího zkoumání, další informace
Ve vztahu kouření a rizika vzniku rakoviny dnes není prioritní dokazování, že kouření způsobuje rakovinu. To je naprosto nezpochybnitelné stejně jako to, že kouření je vůbec nejvýznamnější příčinou rakoviny. I v této oblasti ale vývoj postupuje, dokladem je výše uvedená aktualizace o nově prokázaném riziku některých nádorů a je možné až pravděpodobné, že riziko bude dostatečně prokázáno i pro některé další nádory. O vlivu kouření na riziko vzniku rakoviny je k dispozici bezpočet prací a stále přibývají nové. Za jednu z nejvíce shrnujících prací o karcinogenitě kouření lze považovat monografii IARC č. 83 z roku 2004 [10] (pro představu – má 1 451 stran). Tu lze tedy doporučit k hlubšímu studiu daného tématu. Jinak ale neustále vycházejí nové práce, které poznání o vlivu kouření na riziko vzniku rakoviny rozšiřují a posunují dále. Z hlediska primární prevence jsou ovšem argumenty zcela dostatečné. Dobře víme, co by nejvíce pomohlo v boji proti rakovině – nekouřit. Boj proti kouření je mnohem širší problém než jen medicínský, nicméně lékaři v něm rozhodně významnou roli hrají a kromě jiného by mělo být samozřejmé například to, že lékař sám je nekuřákem. V opačném případě dává velmi špatný signál (i o svém lékařském vzdělání).
Nikotin a onkologická onemocnění
Vzhledem k tomu, že kouření vyvolává velmi silnou závislost u většiny – až 85 % kuřáků (diagnóza F17) a k léčbě této závislosti se mimo jiné užívá i izolovaný nikotin (žvýkačky, náplasti, inhalátory, tablety), je věnována zvýšená pozornost všem možným biologickým účinkům této drogy, mezi nimi i roli v rakovinovém bujení. Působení nikotinu v těle se uskutečňuje prostřednictvím jeho vazby na určité typy acetylcholinových receptorů, které jsou proto nazývány „nikotinové acetylcholinové receptory“ (nAChRs) a vyskytují se nejen na neuronech a neuromuskulárních spojeních, ale i u širokého spektra tkáňových buněk, včetně epiteliálních a endoteliálních. Stimulace nAChRs nikotinem iniciuje vyplavování neurotransmiterů a hormonů s následnou kaskádou zásahů do různých regulačních systémů, mimo jiné ovlivňujících i buněčnou apoptózu a přežívání buněk. Experimentální studie prokázaly, že izolovaný nikotin indukuje proliferaci endoteliálních buněk i nádorové plicní tkáně, angiogenezi a růst nádorů, a dokonce i jejich metastázy [12]. Tyto účinky byly prokázány mimo jiné i po aplikaci nikotinu pomocí transdermálních náplastí [13].
Experimentální studie vysvětlují epidemiologická pozorování rozdílů v průběhu rakovinových onemocnění u kuřáků a nekuřáků: tumory kuřáků bývají více vaskularizované, častěji metastazují a jsou rezistentní k chemoterapii. U onkologických pacientů, kteří nepřestávají kouřit ani po stanovení diagnózy, tumory rychleji progredují, vyvíjejí se sekundární nádory, častěji dochází k rekurenci po úspěšné léčbě, což významně zhoršuje kvalitu jejich života a šance na přežití [14].
Kromě promotoru nádorového bujení byla u nikotinu zjištěna i jeho účast na iniciaci rakovinového procesu, a to prostřednictvím jeho metabolické přeměny na vysoce karcinogenní nitrosaminy: 4-(metylnitrosamino)-1--(3-pyridyl)-1-butanon (NNK) a N´nitrosonornikotin (NNN). Tyto látky tvoří addukty s buněčnou DNK, které vedou k mutaci v genech významných v karcinogenezi, jako Ras, p53, Rb [15]. V současné době je tedy nikotin pokládán za kompletní karcinogen s iniciačním i promotorským účinkem.
Tyto poznatky mají velký praktický význam:
- U pacientů s onkologickým onemocněním je jednoznačně indikováno naléhavé doporučení zanechat kouření. Pokud získají srozumitelné informace o výhodách této své aktivní spoluúčasti, a naopak o rizicích setrvání v tomto autoagresivním chování, budou mít k jeho změně vysokou motivaci.
- Nikotin nemůže být pokládán za bezpečný způsob léčby u onkologických pacientů, u nichž by pravděpodobně byl spíše indikován jeho agonista vareniklin, který poskytne podobnou „odměnu“ prostřednictvím vyplavení dopaminu po stimulaci nervových acetylcholinových receptorů.
- Pokud pokračující výzkumy potvrdí stávající hypotézu o specifické esenciální roli stimulace nAChRs (zejména v procesu karcinogeneze), bylo by možné zlepšit vyhlídky onkologicky nemocných kuřáků na přežití využitím antagonistů, které budou funkci vybraných receptorů modifikovat.
Výživové faktory
Členění a specifika výživových faktorů obecně
Vlivu výživových faktorů je přisuzován přibližně 30% podíl na celkové úmrtnosti způsobené nádorovými onemocněními. Výživa se tedy tímto dostává spolu s kouřením na nejvýznamnější místo nejen mezi zevními příčinami, ale i mezi příčinami rakoviny celkově. Výživa je ale neobyčejně komplexní záležitostí, zahrnující velmi různorodé faktory a jejich kombinace. Z hlediska posuzování vlivu na riziko vzniku rakoviny si můžeme pro orientaci rozčlenit výživové faktory do několika základních skupin:
- a) Elementární nutriční složky – patří sem hodnocení základních jednotlivých chemických složek stravy – v hlavních skupinách tedy sacharidů, tuků, bílkovin, vitaminů a minerálních látek, případně látek řazených v dalších skupinách (například fytochemikálie, antioxidanty apod.).
- b) Potraviny a nápoje – je důležité si uvědomit, že člověk nekonzumuje v reálné situaci jednotlivé nutriční složky, ale vždy jejich poměrně velmi složité a komplexní kombinace, které označujeme jako potraviny a nápoje. V kombinaci potom může být výsledné působení značně odlišné od vlivu izolované složky. I vzhledem k praktickým důsledkům (výživová doporučení) je posouzení vlivu konzumace potravin a stravy prakticky důležitější než posuzovaní elementárních složek. Na druhé straně je právě tato situace důvodem, proč je velmi nesnadné určit, která konkrétní složka v dané potravině je zodpovědná za případný nepříznivý či příznivý efekt na riziko.
- c) Vlivy zpracování, uchovávání a kuchyňské přípravy – tato kategorie se snaží především zahrnout nejrůznější průniky cizorodých látek, které nejsou přirozenou součástí potravin. K tomu může dojít při výrobě, zpracovávání, uchovávání a kuchyňské přípravě. Patří sem ale i úmyslně přidávané látky, tzv. aditiva („éčka“). Nejde vždy jen o jednotlivé chemické látky, ale i o komplexní vliv určitých způsobů konzervace či úpravy, může jít i o působení fyzikálních či biologických faktorů.
- d) Energie a související faktory – patří sem vlivy výše energetického příjmu se stravou a jeho nejrůznější důsledky na metabolizmus, růst (buněčný i tělesný), množství ukládaného tuku apod. (nadváha a obezita). Je tedy zjevné, že tato kategorie zcela neoddělitelně souvisí rovněž s energetickým výdejem (zejména pohybovou aktivitou).
Pro porozumění účinku výživových faktorů je dále potřeba zdůraznit, že zde zdaleka nejde jen o to, zda se ve své stravě setkáme s nějakým karcinogenem či nikoli. Přinejmenším stejně významné je působení faktorů, které mají naopak ochranný efekt a zvyšují odolnost proti vzniku zhoubného bujení. A dále, vliv výživových faktorů se projevuje na mnoha úrovních, může zasáhnout v různých fázích mnohastupňového modelu karcinogeneze, ve všech stupních, které se nacházejí mezi normální zdravou buňkou na začátku a buňkou s kumulovaným poškozením a karcinogenním potenciálem na konci.
Kategorie důkazů o efektu
Hodnocení vlivu výživy na riziko vzniku rakoviny je natolik rozsáhlou a složitou záležitostí, že může být obtížné posoudit, co je skutečně důležité, a hlavně dostatečně prokázané, a co naopak spadá do kategorie třeba zajímavé a slibné, ale dosud nedostatečně ověřené hypotézy. Je třeba umět posoudit kvalitu důkazů. Naštěstí existují zdroje, jejichž cílem je právě komplexní metaanalytické hodnocení. V tomto směru lze doporučit především rozsáhlou publikaci „Food, Nutrition, Physical Activity, and the Prevention of Cancer: a Global Perspective“ [16]. Jedná se o dosud nejkomplexnější a současně nejkvalitnější shrnutí poznatků, které vypracovalo více než 100 vědců z 30 různých zemí na základě metaanalytického posouzení několika tisíc studií. Publikace je označována také jako „The Second expert report“, protože je druhou verzí, přičemž první byla vydána o 10 let dříve, tedy v roce 1997. Prakticky velmi důležitou informací je rovněž to, že celá zpráva se dá bezplatně stáhnout v elektronické podobě (www.dietandcancerreport.org). V následujícím popisu vlivu jednotlivých složek výživy z výsledků uvedené zprávy do značné míry vycházíme. Nutnou a velice důležitou součástí je hodnocení kvality důkazů o příslušném efektu na riziko. Z tohoto pohledu zpráva používá následující kategorie, jak je uvádí tab. 6.
![Kategorie důkazů o efektu na riziko. Upraveno podle [16].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/a5035c6ecabb3648e8399d203bef3592.jpg)
Obiloviny (zrniny), vláknina stravy
Efekt této potravinové skupiny shrnuje tab. 7. Potraviny z obilovin tvoří jednu z podstatných částí výživy. Obsahují nejen důležité škroby, vitaminy a minerální látky, ale rovněž i nestravitelné části označované jako vláknina. Pojem „celozrnný“ znamená, že obilky jsou méně vymleté, obsahují více slupek, a tím více všech uvedených látek. Obecně jsou takové potraviny považovány za prospěšné zdraví. Ve vztahu k nádorovému riziku byla dříve vláknina uváděna jako jednoznačně ochranný faktor. Při revizi poznatků a obecném zvýšení požadavků na kvalitu důkazů, zejména na přelomu tisíciletí, byla tato role vlákniny značně zpochybněna (důkazy z case-control studií nebyly zcela potvrzovány přesnějšími kohortovými studiemi). Hodnocení vlákniny s sebou nese metodologické problémy tvořené jednak tím, že ve skutečnosti se jedná o dosti nehomogenní skupinu různých látek (nejen typicky tuhé, objemné konzistence, ale i polotuhého až kapalného charakteru), a také tím, že vláknina se zde objevuje jako součást potravin spolu s dalšími látkami s příznivým potenciálem, a není tedy snadné rozlišit samotný efekt vlákniny od efektu ostatních doprovodných látek, ať už v obilovinách, nebo dalších zdrojích vlákniny, například v zelenině. Přestože důkazy o přímém ochranném vlivu vlákniny zůstávají ne zcela přesvědčivé, v posledních letech spíše opět posílily a vláknina ve stravě je nyní hodnocena v kategorii „pravděpodobný“ efekt na snížení rizika kolorektálního karcinomu.
V tab. 7 je zmíněn ještě jeden efekt této potravinové skupiny, v tomto případě rizikový – efekt aflatoxinů, které mohou kontaminovat obiloviny po napadení plísněmi.
![Obiloviny (zrniny), vláknina stravy – vliv na riziko rakoviny [16].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/bd1ccc366f4b5326f2692045f7c31d23.jpg)
Zelenina, ovoce, luštěniny, ořechy, bylinky, koření
Současné poznatky o efektu zeleniny a ovoce shrnuje tab. 8. Je třeba přiznat, že poznatky ze studií vedených od poloviny 90. let minulého století poněkud oslabily důkazy o tom, že zelenina nebo ovoce chrání před vznikem rakoviny. Ve skutečnosti se nyní žádný z hodnocených efektů nedostal do kategorie „přesvědčivý“, přestože v předchozím souborném hodnocení z roku 1997 tomu tak ještě bylo. Obecně je důvodem to, že kohortové studie nedokázaly potvrdit efekt zjištěný pomocí case-control studií. Přesto existují důkazy o tom, že některé typy zeleniny, a ovoce obecně, pravděpodobně chrání proti řadě nádorů.
![Zelenina, ovoce, luštěniny, ořechy, bylinky, koření – vliv na riziko rakoviny [16].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/b8b33a3e83218912e24bc63547bb564a.jpg)
Tzv. „neškrobová zelenina“ (non-starchy vegetables) pravděpodobně chrání proti rakovině úst, hltanu, hrtanu, jícnu a žaludku. Omezené důkazy máme o tom, že chrání rovněž proti rakovině nosohltanu, plic, kolorekta, ovarií a endometria.
Zelenina z tzv. skupiny Allium (kam patří například cibule, česnek) pravděpodobně chrání proti rakovině žaludku. Česnek také pravděpodobně chrání proti kolorektálnímu karcinomu.
Ovoce celkově pravděpodobně chrání proti rakovině úst, hltanu, hrtanu, jícnu, žaludku a plic. Omezené důkazy jsou o tom, že rovněž chrání proti rakovině nosohltanu, pankreatu, jater a kolorekta.
Existují dále omezené důkazy o tom, že mrkev chrání proti rakovině cervixu a že luštěniny (včetně sóji a sójových produktů) chrání proti rakovině žaludku a prostaty.
To, že zelenina, ovoce a luštěniny chrání proti rakovině, je podporováno rovněž důkazy týkajícími se různých mikronutrientů, které slouží jako markery konzumace zeleniny, ovoce, luštěnin a dalších rostlinných potravin. Potraviny obsahující foláty pravděpodobně chrání proti rakovině pankreatu a jsou omezené důkazy, že chrání rovněž proti rakovině jícnu a kolorekta.
Strava obsahující karotenoidy pravděpodobně chrání proti rakovině úst, hltanu hrtanu a plic. Strava obsahující karotenoid β-karoten pravděpodobně chrání proti rakovině jícnu a strava obsahující lykopen, vyskytující se v rajčatech, melounech, guave a meruňkách, pravděpodobně chrání proti rakovině prostaty.
Strava obsahující vitamin C, obsažený v některé zelenině, citrusech i dalším ovoci a v bramborách, pravděpodobně chrání proti rakovině jícnu.
Jsou limitované důkazy, že potraviny obsahující quercetin, jako jablka, čaj či cibule, chrání proti plicní rakovině. Strava obsahující selen pravděpodobně chrání proti rakovině prostaty, podle omezených důkazů rovněž proti rakovině žaludku a kolorekta.
Jsou omezené důkazy, že strava obsahující B vitamin pyridoxin chrání proti rakovině jícnu a prostaty a že strava obsahující vitamin E chrání proti rakovině jícnu a prostaty.
Fytochemikálie (phytochemicals): rostliny obsahují velké množství biologicky aktivních látek, které se obecně označují jako fytochemikálie. Přestože jsou bioaktivní, nejsou ve stravě esenciální a nejsou klasifikovány jako živiny. V mnoha případech tvoří například typickou chuť určité rostlinné potraviny. Předpokládá se, že ochranný efekt zeleniny a ovoce, a obecně rostlinných potravin, je přinejmenším z části způsoben právě přítomností fytochemikálií. Odhaduje se, že může jít o 100 000 různých sloučenin. Fytochemikálie jsou děleny podle chemické struktury a funkčních charakteristik a zahrnují skupiny jako flavonoidy, polyfenoly, inhibitory proteáz, monoterpeny, saponiny, fytosteroly, fytoestrogeny a řadu dalších. Většina fytochemikálií dnes není nejen prozkoumána, ale ani identifikována.
Maso, drůbež, ryby a vejce
Hodnocení shrnuje tab. 9. Od 2. poloviny 90. let minulého století posílily důkazy o karcinogenním vlivu konzumace masa. Zatímco tehdy byly v kategorii „pravděpodobné“, nyní jsou hodnoceny jako „přesvědčivé“. Jsou přesvědčivé důkazy, že tzv. červené maso a masné výrobky (processed meat) působí kolorektální karcinom. Důkazy ohledně podobného vlivu drůbeže, ryb a vajec jsou celkově nepodstatné. Jsou ovšem limitované důkazy o tom, že ryby a potraviny obsahující vitamin D chrání proti kolorektálnímu karcinomu. Jsou také limitované důkazy, že červené maso je příčinou rakoviny jícnu, plic, žaludku a prostaty, že masné výrobky jsou příčinou rakoviny jícnu, plic, žaludku a prostaty a že potraviny obsahující železo jsou příčinou kolorektálního karcinomu. Jsou limitované důkazy o tom, že potraviny, které jsou grilované nebo uzené, způsobují rakovinu žaludku.
![Maso, drůbež, ryby a vejce – vliv na riziko rakoviny [16].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/23a7846e4b3b0a979d67a21dc955da2d.jpg)
Maso je obecně rovněž bohaté na tuky. Vliv tuků na riziko je hodnocen v samostatném oddíle. Maso a masné výrobky patří rovněž mezi potraviny s vysokým energetickým obsahem, a přispívají tak ke vzniku nadváhy a obezity, což jsou další faktory zvyšující riziko vzniku rakoviny (rovněž hodnoceno v samostatném oddíle o energii a nadváze).
Maso obsahuje řadu složek, které mohou zvyšovat riziko vzniku rakoviny. Mutageny a karcinogeny (heterocyklické aminy a polycyklické aromatické uhlovodíky) vznikají při kuchyňské úpravě za použití vysokých teplot. Obsah železa (hem) může vytvářet ve střevě volné radikály, které poškodí DNA. Látky používané při zpracování masných výrobků (například dusičnany/dusitany a sůl) přispívají k tvorbě nitrosaminů, poškozujících DNA. Je také možné, že obsah tuku v mase přispívá k riziku, může například zvyšovat koncentraci sekundárních žlučových kyselin ve stolici, které mohou být karcinogenní nebo účinkovat jako promotory karcinogeneze. Celkově jsou maso a masné výrobky největším zdrojem celkového, a zejména saturovaného tuku a cholesterolu ve stravě.
Maso je ovšem výborným zdrojem vysoce kvalitních bílkovin a mnoha důležitých vitaminů a minerálních látek, vzhledem k riziku vzniku rakoviny je však vhodné určité omezení konzumace (na méně než 1 porci, tj. 80g, denně), zejména pak omezení masných výrobků (uzenin), kde je účinek ještě horší. Je vhodné částečně nahradit konzumaci masa rybami a luštěninami, důležité je rovněž používat šetrné způsoby přípravy (vyvarovat se vysokých teplot, samozřejmě ovšem při zachování mikrobiální a parazitární bezpečnosti).
Mléko a mléčné výrobky
Aktuální poznatky sumarizuje tab. 10. Dříve se ohledně mléka vzhledem k nádorovému riziku neuvažovalo o příliš velkém významu. Úroveň poznatků v 2. polovině 90. let minulého století vedla k závěrům o možném vlivu mléka a mléčných výrobků na zvýšení rizika vzniku rakoviny prostaty a ledvin. Rovněž to vypadalo, že kalcium neovlivňuje riziko kolorektálního karcinomu. Od té doby byly získány nové poznatky, důkazy zesílily a rozšířily se.
![Mléko a mléčné výrobky – vliv na riziko rakoviny [16].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/7cd5030ad9d34be73d4ef2d557477bab.jpg)
Nyní jsou závěry takové, že mléko, mléčné výrobky a strava bohatá na kalcium působí ve vztahu k nádorům rozdílnými směry. Mléko pravděpodobně chrání proti kolorektálnímu karcinomu a jsou limitované důkazy, že i proti rakovině měchýře.
Na druhé straně je strava bohatá na kalcium pravděpodobnou příčinou rakoviny prostaty, dále jsou omezené důkazy o tom, že i přímo mléko a mléčné výrobky zvyšují toto riziko, a rovněž o tom, že sýry zvyšují riziko kolorektálního karcinomu.
Pro údaje o efektu sýrů nebyl identifikován žádný specifický mechanizmus, ale riziko kolorektálního karcinomu by mohly zvyšovat nepřímými mechanizmy spojenými se saturovanými tuky. Ty zvyšují produkci inzulinu a expresi inzulinových receptorů v enterocytech. Saturované tuky mohou rovněž indukovat expresi některých mediátorů zánětu, spojovaných s karcinogenezí. Epidemiologické důkazy pro sýry jsou v kontrastu s pravděpodobným protektivním efektem mléka.
Tuky a oleje
Aktuální poznatky sumarizuje tab. 11. Dříve se celkový příjem tuku hodnotil jako relativně dosti významný vzhledem k nádorovému riziku. Lze říci, že postupně dochází již dlouhou dobu k oslabování tohoto významu, a to včetně kohortových studií provedených od 2. poloviny 90. let minulého století, které celkově snížily sílu a význam asociace mezi tuky a oleji a rizikem vzniku rakoviny.
![Tuky a oleje – vliv na riziko rakoviny [16].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/10b7f3e6d6583cbfbb34503c2946ae73.jpg)
Aktuálně jsou pouze limitované důkazy svědčící o tom, že celkový příjem tuku zvyšuje riziko vzniku rakoviny plic a prsu (post-meno), že strava obsahující živočišný tuk zvyšuje riziko vzniku rakoviny kolorekta a že máslo je příčinou plicní rakoviny. Je třeba zdůraznit, že ve všech případech existují mnohem významnější příčiny, například pro rakovinu plic je hlavní příčinou kouření. Tuky a oleje jsou energeticky vůbec nejvydatnější složkou stravy, proto je třeba je posuzovat i z hlediska jejich příspěvku k nadváze a obezitě (samostatný oddíl). Vztah tuku k nádorovému riziku lze popsat rovněž tak, že jako nejdůležitější se jeví obsah tuku ve vlastním lidském těle (respektive jeho nadbytek), a to mnohem více než přímé působení tuku ve stravě.
Cukry a sůl
Na první pohled jde sice o poněkud nesourodou kombinaci, ale pro účely stručného zhodnocení je možné tyto faktory uvést společně. Mají společné třeba to, že se jedná o jednoduché látky, ať již přidávané do stravy, nebo jako vlastní součást potravin, a to i přirozenou. Hodnocení shrnuje tab. 12. Sůl a slané potraviny jsou pravděpodobnou příčinou rakoviny žaludku. Jsou limitované důkazy svědčící pro to, že jednoduché cukry jsou příčinou kolorektálního karcinomu.
![Cukry a sůl – vliv na riziko rakoviny [16].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/f31d26646025f7eff4de25d6c58edd52.jpg)
Voda, ovocné šťávy a další „soft“ (nealko) nápoje, teplé nápoje
V zásadě se zde jedná o vyhodnocení vlivu všech nealkoholických nápojů. Výsledky shrnuje tab. 13. V této skupině je nejvýraznějším vlivem přesvědčivý efekt anorganického arzenu v pitné vodě na vznik rakoviny plic. Dále je pravděpodobné, že způsobuje rakovinu kůže, a limitované důkazy jsou ohledně rakoviny ledvin a měchýře. Arzen může kontaminovat vodu vlivem zemědělství, důlní těžby, průmyslu, nebo přírodně vlivem vulkanické aktivity. Zdroje důkazů pocházejí spíše z oblastí mimo Evropu (Tchaj-wan, Japonsko), ale některé ekologické studie jsou i z Evropy (Belgie, Švýcarsko). Nezdá se však, že by se jednalo o aktuální ani závažný problém v ČR.
![Voda, ovocné šťávy a ostatní „soft“ nápoje, teplé nápoje – vliv na riziko rakoviny [16].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/541acbe0856be0bcb712689b84ffa8af.jpg)
Horký nápoj maté je pravděpodobnou příčinou rakoviny jícnu, pokud se pije skutečně velmi horký pomocí kovového brčka, jak se to tradičně praktikuje v Jižní Americe. Limitované důkazy jsou ohledně rakoviny úst, hltanu a hrtanu. Rozhodující vliv zde má teplota. Jsou limitované důkazy, že horké nápoje obecně působí rakovinu jícnu.
Ve vztahu k rakovině je často řešen čaj, obzvláště zelenému čaji jsou často přičítány velmi významné účinky proti rakovině, téměř zázračné. Ve skutečnosti se ale takové účinky nepotvrzují. Ještě v předchozí zprávě AICR/WCR z přelomu tisíciletí bylo zhodnoceno, že zelený čaj snad chrání proti rakovině žaludku, aktuální review ale toto nepodporuje. V předchozí zprávě se rovněž objevil posudek, že černý čaj nejspíš nemá žádný vztah k rakovině žaludku, pankreatu a ledvin. Tentokrát ale nejsou celkové důkazy k odmítnutí takového efektu dostatečné, respektive nejsou dostatečné k vyslovení jednoznačného hodnocení.
Pití černé kávy bylo jeden čas v centru podezření kvůli možnému efektu na riziko rakoviny s tím, že pití více než 5 šálků denně by snad mohlo zvyšovat riziko vzniku rakoviny. V současnosti však již byl nashromážděn dostatek důkazů pro to, že káva nemá podstatný efekt na toto riziko, ať již rakoviny pankreatu nebo ledvin, a ani na vliv na další nádory se nepředpokládá.
Nejsou známky toho, že by pití jakýchkoliv dalších nealkoholických nápojů ovlivňovalo významným způsobem riziko vzniku rakoviny.
Alkoholické nápoje
O tom, že pití alkoholických nápojů způsobuje rakovinu, se ví již poměrně dlouho. V klasifikaci IARC jsou zařazeny jako lidské karcinogeny I. třídy. Ale i tak důkazů od poloviny 90. let minulého století dále přibylo. Prokázaný efekt v přehledu shrnuje tab. 14. Jsou přesvědčivé důkazy, že pití alkoholických nápojů způsobuje rakovinu úst, hltanu, hrtanu, jícnu, kolorekta (u mužů) a prsu. Pravděpodobně způsobuje rakovinu jater a u žen rakovinu kolorekta. Potvrzuje se to, co již zjistila předchozí zpráva – tedy že ohledně efektu nejsou rozdíly mezi jednotlivými typy alkoholických nápojů. Neplatí tedy, že by například víno bylo v tomto ohledu méně rizikové než destiláty apod., rozhodující je množství konzumovaného etanolu. Co se týče dávky, obecně není uznávána žádná bezpečná hranice, pod níž by se karcinogenní efekt neprojevoval. Pouze v případě kolorektálního karcinomu je zvýšení rizika prokazatelné až při dávce přesahující 30g etanolu denně. Ale u ostatních nádorů, například u rakoviny prsu, je zvýšení prokazatelné již při konzumaci 10g etanolu denně (odpovídá přibližně 1dl vína nebo půllitru piva „desítky“).
![Alkoholické nápoje – vliv na riziko rakoviny [16].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/852f519ada6582f6b7184d6e44072b7b.jpg)
Naopak byl prakticky vyloučen nepříznivý efekt konzumace alkoholických nápojů na riziko vzniku rakoviny ledvin, který se jeden čas diskutoval.
K mechanizmům účinku: předpokládá se, že reaktivní metabolity etanolu, jako acetaldehyd, mohou být karcinogenní. Efekt alkoholu může být také zprostředkován produkcí prostaglandinů, lipidovou peroxidací a tvorbou volných radikálů. Alkohol může ovlivňovat hladiny hormonů a jiných látek, například v případě rizika vzniku rakoviny prsu může být efekt způsoben alkoholem indukovaným zvýšením cirkulujících estrogenů nebo dalších hormonů v krvi či snížením hladiny kyseliny listové. Může ale jít i o přímý účinek etanolu na prsní tkáň. Pokusy ukázaly, že alkohol ovlivňuje nepříznivě buněčný růst, buněčnou diferenciaci a apoptózu. Alkohol rovněž účinkuje jako rozpouštědlo podporující penetraci karcinogenů do buněk. U všech těchto cest může ovlivňovat riziko rovněž genetický polymorfizmus. A konečně, u těžkých pijáků může být strava deficientní v řadě esenciálních živin, což může tkáně činit náchylnějšími ke karcinogenezi.
Výroba potravin, uchovávání, zpracovávání, příprava
Tato oblast je dnes velmi široká. V celém mnohastupňovém procesu výroby, uchovávání, zpracovávání a přípravy se do potravin a stravy může dostávat či v ní vznikat celá řada nejrůznějších látek. Rostlinné i živočišné produkty mohou obsahovat rezidua agrochemických přípravků, například fertilizérů, herbicidů, pesticidů či látek používaných v živočišné výrobě a veterinárním lékařství. Potravinářské produkty musí být určitým způsobem uchovávány – ať již se jedná o zchlazování a zmrazování, pasterizaci, vakuové balení, uložení v nejrůznějších obalech apod. Pro konzervaci jsou používány různé látky. Během skladování může dojít k průniku látek či jejich tvorbě v důsledku fyzikálních, chemických nebo biologických vlivů, například napadení škůdci (hniloba, plísně atd.). Při zpracování se do potravin přidávají nejrůznější látky upravující jejich vlastnosti – modifikované škroby, přidané cukry či umělá sladidla, hydrogenované tuky, barviva, látky upravující chuť či konzistenci. Vliv je často kombinovaný a přidávání se provádí z více důvodů současně, například z důvodu konzervace i úpravy senzorických a dalších vlastností. Příkladem je výroba uzenin. Na konci celého řetězce je kuchyňská příprava, která může ovšem také velmi významným způsobem zasáhnout, a to obzvláště v rámci tepelné úpravy, při které vzniká řada nových látek.
Z hlediska posuzování možného efektu a závěrů platí to, co platí obecně, tedy že tento efekt může být ve smyslu zvýšení nebo snížení rizika, neutrální (tj. žádný efekt), či že dosud není možno učinit jednoznačné závěry. Trendem posuzování celé této skupiny vlivů je dnes snaha, kdekoli je to možné, posuzovat tento vliv nikoli izolovaně, ale v kontextu konkrétních skupin potravin a nápojů. Proto je toto hodnocení zahrnuto v příslušných kapitolách týkajících se konkrétních skupin potravin. Veškeré tyto vlivy jsou samozřejmě sledovány i izolovaně. Prakticky ve všech případech jde ovšem metodologicky o laboratorní experimenty na zvířatech. Na základě výsledků tohoto typu studií ale nelze činit závěry o reálné karcinogenitě pro člověka. Uvádíme základní přehled nejvýznamnějších faktorů s komentářem k jejich možnému efektu:
Pesticidy a herbicidy. Používání syntetických pesticidů a herbicidů mohutně narostlo od 2. poloviny 20. století. Používání některých z nich, jako je třeba DDT, bylo v mnohých zemích zakázáno. Další organochlorové pesticidy jsou nyní nahrazovány organofosforovými a karbamátovými pesticidy. Tyto nové typy jsou méně perzistentní v prostředí a dle testů nejsou karcinogenní. Používání pesticidů je regulováno a jsou stanoveny mezinárodní maximální limity pro obsah reziduí. Používání perzistentních organických látek (organochlorových pesticidů, furanů, dioxinů a polychlorovaných bifenylů) bude zakázáno v roce 2025 podle Stockholmské dohody, která vstoupila v platnost v roce 2004. Perzistence je obzvlášť velký problém. Mnoho těchto kontaminant má potenciál kumulovat se v potravních systémech a látky, které byly již dříve zakázány a skutečně se nepoužívají, mohou být stále přítomny v dnešní i budoucí stravě. Často mají tendenci shromažďovat se v živých organizmech, zejména v tukové tkáni, a jsou nesnadno metabolizovány a vylučovány. V živých organizmech je množství vyšší než v pozadí (například půdě), a dietární expozice se zvyšuje s každým stupněm v potravním řetězci, kdy predátoři konzumují kořist kontaminovanou těmito rezidui.
Teoreticky mohou existovat důvody k obavám, a proto jsou koncentrace a účinky těchto látek rozsáhle sledovány, na mezinárodní i národní úrovni. Avšak nejsou žádné důkazy a ani známky toho, že by současné expozice jakkoli zvyšovaly riziko vzniku rakoviny.
Veterinární přípravky. Běžná „živočišná výroba“ vyžaduje (na rozdíl od bio-farmářství) konstantní použití antimikrobiálních přípravků k léčbě a prevenci infekčních nemocí a k podpoře růstu. Rezidua těchto látek jsou nacházena v potravinách a nápojích, zpravidla pod hranicemi mezinárodně doporučených maximálních limitů pro rezidua. Pokud byly antimikrobiální přípravky shledány karcinogenními pro zvířata, byla jim licence pro toto užití odebrána. Dále se používají různé hormonální přípravky. Je třeba připomenout, že řada hormonů je podle IARC v experimentálních podmínkách karcinogenní: Estrogeny (IARC třída 1 – lidský karcinogen), progestiny (IARC třída 2B – možný lidský karcinogen), testosteron (IARC třída 1). Rezidua hormonů jsou sledována jako ostatní rezidua, jsou zpravidla pod příslušnými limity a nejsou známky svědčící pro to, že by v dané míře výskytu zvyšovala riziko vzniku rakoviny. Celkově nejsou pro rezidua veterinárních přípravků známky a důkazy o tom, že by v reálném výskytu zvyšovala riziko vzniku rakoviny.
Genetické modifikace. Mezi základní typy genetických modifikací patří křížení rostlin či zvířat za účelem zvýraznění určitých vlastností. V poslední době nastoupily nové technologie genetického přenosu a modifikací, které vzbuzují veřejný zájem i ohledně možných rizik. Potenciální využití technologií moderních genetických modifikací zahrnuje změnu nutričního složení, zvýšení odolnosti rostlin vůči nemocem či zvýšení tolerance vůči herbicidům. Předpokládá se, že případný efekt takových modifikací by byl spíše důsledkem změn typů chemických herbicidů či pesticidů nebo jejich dávkování, spíše než důsledkem samotných genetických modifikací. Geneticky modifikované plodiny mohou vyžadovat menší použití pesticidů a herbicidů. V současnosti není dostatek informací k učinění jakýchkoli závěrů, ale nejsou žádné známky svědčící pro to, že by geneticky modifikované potraviny ovlivňovaly riziko vzniku rakoviny.
Biopotraviny. Podstatou tzv. biopotravin je vyloučení všech fertilizérů, umělých hnojiv, regulátorů růstu, pesticidů, herbicidů a dalších umělých látek v zemědělské či živočišné výrobě. Do biopotravin nesmí být přidávána žádná chemická aditiva. Hlavním smyslem a cílem je celkově nižší ekologická zátěž prostředí. Někdy je celá podstata chybně chápána tak, že biopotraviny mají být především zdravější. Ve skutečnosti ovšem není mnoho důvodů toto předpokládat a také se to neukazuje. Je pravda, že biopotraviny mají podle očekávání nižší rezidua pesticidů. Některé studie ukazují na vyšší koncentrace některých složek jako třeba vitaminu C či vlákniny. Nejsou žádné známky svědčící pro to, že by biopotraviny ovlivňovaly riziko vzniku rakoviny jinak než běžné potraviny.
Aditiva. Do mnoha, ne-li většiny průmyslově vyráběných potravin jsou přidávána tzv. aditiva. Většina běžných lidí je zná jako tzv. „éčka“, protože jsou značena písmenem E a číslem. Mohou být syntetická, přírodně-identická, nebo přírodní. Tyto přídavky upravují určité vlastnosti potravin – barvu, chuť, konzistenci, jiné fyzikální nebo chemické vlastnosti, nebo jejich trvanlivost. U části veřejnosti existují obavy z možného nepříznivého vlivu aditiv. Tyto látky jsou vždy velmi dobře toxikologicky prověřené, jejich používání podléhá přísné regulaci a kontrole. V současnosti nejsou žádné známky, že by potravinová aditiva jakýmkoli nepříznivým způsobem ovlivňovala riziko vzniku rakoviny.
Tepelná úprava. V rámci kuchyňské úpravy je strava před jídlem velmi často tepelně zpracovávána. Tato úprava zahrnuje procesy jako vaření, pečení, dušení, smažení nebo grilování.
Vaření (ve vodě), vaření v páře, dušení – vznikají teploty do 100 °C. Pečení, opékání – teploty do 200 °C, ale ne přímý plamen. Vysoké teploty jsou ale dosahovány pouze na povrchu, zatímco vnitřní části zůstávají pod 100 °C. Mikrovlnná trouba – potraviny vystavuje teplotám do 200 °C. Smažení, grilování, rožnění – generuje teploty do 400 °C a někdy využívá přímý oheň.
Jednou z nejpodstatnějších okolností jsou právě dosahované teploty – rizikové jsou vysoké. Při procedurách využívajících vysokých teplot vznikají vysoké hladiny karcinogenních sloučenin.
Aflatoxiny. Jsou produkovány plísněni Aspergillus flavus a Aspergillus parasiticus, někdy se uvádějí i další druhy. Aspergillus flavus a Aspergillus parasiticus jsou běžné půdní plísně, mohou se vyskytovat téměř ve všech typech zrní, luštěnin apod., i například v léčivých bylinách. Zvláštním problémem je jejich výskyt v arašídech, protože je napaden již květ rostliny a semeno vyroste okolo zárodku plísně. Plíseň potom vyroste při jakémkoli poškození semene při skladování a transportu, může přežít i pražení. Současně jsou arašídy substrát, na kterém je produkce aflatoxinu mohutná. Oba uvedené druhy plísní obsahují toxinogenní a netoxinogenní kmeny, jejichž poměr je značně odlišný v závislosti na typu substrátu, na němž vyrostly (poměr může být od několika málo procent toxinogenních až po více než 90%). Co se týče plísní například na kompotech, marmeládách, ovoci apod., ty jsou tvořeny obvykle jinými druhy, které aflatoxiny neprodukují (jejich výskyt však ani zde nelze vyloučit), ale mohou produkovat karcinogenní kyselinu penicillovou a patulin (prokázaná karcinogenita pro zvířata, u patulinu je stanoven limit v potravinách se zohledněním možné karcinogenity pro člověka, kyselina penicillová nemá limit stanoven). I další plísně mohou produkovat toxické a karcinogenní látky, a to nejen plísně napadající potraviny, ale i další materiály, ze kterých je možná kontaminace, například zdi a stavební materiál, papíry a lepenka (jako obalové materiály), filtry klimatizace a mnoho dalších. V celkovém hodnocení platí, že většina plísní je netoxinogenních, avšak riziko výskytu toxinogenních vždy hrozí. Bez speciálního vyšetření není možno karcinogenitu posoudit. Veškeré plesnivé potraviny v domácnostech by se měly vyhodit, protože neexistuje žádný schůdný způsob, jak se mykotoxinů zbavit. Okrájení nestačí, protože mykotoxiny často pronikají rychle a daleko od místa růstu plísně.
Sýry se záměrně vytvořenou plísní. Specifickou problematikou jsou „plesnivé“ sýry. Zde je pochopitelně třeba rozlišovat, zda jde o plísně produkované úmyslně vypěstovanou, tzv. kulturní, mykoflórou (sýry camembertského typu jako hermelín, nebo rocquefortského typu jako niva), či sýry kontaminované nechtěně (v kterékoliv fázi výrobního řetězce či skladování). Obecně je přítomnost karcinogenních mykotoxinů v sýrech možná (a to i cestou kulturní mykoflóry), ale vzácná. V případě výroby plísňových sýrů se riziko kontroluje především tak, že se používají pouze schválené startovací kultury ze sbírky mlékárenských kultur, neschopné produkovat mykotoxiny.
Suplementa
Randomizované kontrolované studie přinesly dostatečné důkazy o tom, že suplementa, tedy potravinové doplňky, zpravidla ve formě farmaceutických preparátů, s obsahem vitaminů, minerálních či dalších látek, modifikují riziko některých druhů rakoviny. Vysokodávková suplementa mohou mít protektivní účinek, ale mohou také způsobovat rakovinu. Současné poznatky shrnuje tab. 15. Jsou přesvědčivé důkazy, že suplementa β-karotenu způsobují plicní rakovinu u kuřáků. Jsou limitované důkazy, že i suplementa retinolu působí u této skupiny plicní rakovinu. Pochopitelně ale platí, že hlavní a základní příčinou plicní rakoviny je kouření. Vápník pravděpodobně chrání proti kolorektální rakovině. Selen pravděpodobně chrání proti rakovině prostaty. Jsou limitované důkazy, že retinol chrání proti karcinomu kůže ze skvamózních buněk. Také jsou limitované důkazy, že α-tokoferol chrání proti rakovině prostaty, a také pro to, že selen v určitých dávkách chrání proti kolorektálnímu karcinomu (v dávce 200 μg/denně). Jsou limitované důkazy, že suplementa selenu způsobují kožní rakovinu. Je nepravděpodobné, že by suplementa β-karotenu (nebo i strava obsahující β-karoten) měla podstatný vliv na riziko vzniku rakoviny prostaty nebo kůže (non-melanomy).
![Suplementa – vliv na riziko rakoviny [16].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/0b5b03972c16d87dfc4f4d80ece07fa9.jpg)
Znalosti, a hlavně důkazy ohledně suplement mají pochopitelně největší praktický význam vzhledem k formulaci doporučení. Suplementa mohou být jak protektivní, tak i způsobovat rakovinu. Studie, které demonstrují takové efekty, nelze zevšeobecnit na široké použití v obecné populaci, kde rovnováha rizik a přínosů nemůže být spolehlivě předpovězena. Obecné doporučení k užívání suplement k prevenci rakoviny by mohlo mít nečekané nepříznivé efekty. Suplementa nejsou pro prevenci rakoviny doporučena, je preferováno zvýšení příjmu relevantních nutrientů běžnou stravou.
Nadváha a obezita
Potvrzení o tom, že nadbytek tělesného tuku způsobuje rakovinu, je nyní výrazně silnější než před 10 lety. Předchozí zpráva AICR došla pouze k závěru, že vysoký BMI je prokazatelně příčinou rakoviny endometria, a dále že je pravděpodobně příčinou rakoviny prsu a ledvin. Některá ostatní hodnocení byla ještě v kategorii „možných“. Nyní jsou ale přesvědčivé důkazy, že tloušťka (body fatness) způsobuje rakovinu jícnu (adenokarcinom), pankreatu, kolorekta, prsu (postmenopauzální výskyt), endometria a ledvin. Dále pravděpodobně způsobuje rakovinu žlučníku (přímo i nepřímo, cestou žlučových kamenů) a jsou limitované důkazy, že taktéž rakovinu jater. Oproti poslední zprávě se rovněž rozšířily poznatky a důkazy ohledně vlivu distribuce tuku. Jako riziková se potvrdila především abdominální tloušťka, je přesvědčivou příčinou kolorektálního karcinomu a pravděpodobnou příčinou rakoviny pankreatu, prsu (post-meno) a endometria.
Naproti tomu větší obsah tuku v těle pravděpodobně chrání proti rakovině prsu diagnostikované před menopauzou.
Dále jsou určité limitované důkazy, že podváha přispívá k riziku vzniku rakoviny plic, ale zde nemohou být vyloučeny reziduální matoucí faktory jako kouření a plicní onemocnění.
Současné poznatky o vlivu tělesného tuku na riziko vzniku rakoviny shrnuje tab. 16. Odhaduje se, že nadváha a obezita zodpovídá za 14–20 % veškeré nádorové úmrtnosti [17].
![Nadváha a obezita – vliv na riziko rakoviny [16].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/09062c1596e21b870038b0969b15faa2.jpg)
Patofyziologie. Ovlivnění rizika se děje řadou mechanizmů, z nichž některé jsou specifické pro určité nádory (schéma 1). Tyto mechanizmy zahrnují efekt na metabolizmus tuků a cukrů, imunitní funkce, hladiny hormonů (včetně inzulinu a estradiolu), faktory regulující proliferaci a růst buněk (jako tzv. „inzulinu podobný růstový faktor-1“) a na proteiny, které činí hormony méně či více dostupnými pro tkáně (jako pohlavní hormony vázající globulin). Například v případě adenokarcinomu jícnu je riziko zvyšováno zpětným žaludkovo-jícnovým průnikem potravy provázejícím obezitu.

Obezita a nečinnost vedou ke změnám v metabolizmu, včetně metabolizmu endogenních hormonů, inzulinu, biologicky dostupných pohlavních steroidních hormonů, inzulinu podobného růstového faktoru-1 (insulin-like growth factor-1) a jeho vazebných proteinů.
Obezita a fyzická inaktivita vytvářejí chronickou hyperinzulinemii a inzulinovou rezistenci. Chronická hyperinzulinemie způsobuje snížení tzv. insulin--like growht factor binding protein-1 a 2, snížení koncentrace sex hormones binging globulin a vzestup plazmatické hladiny insulin-like growth factor a plazmatické hladiny biologicky aktivních (na proteiny nevázaných) pohlavních hormonů.
Obezita vede k tvorbě estrogenů v periferní tukové tkáni z androgenů, a tedy k vyšším hladinám estrogenů u mužů i u žen.
Konečně u některých premenopauzálních žen může obezita a hyperinzulinizmus způsobit ovariální hyperandrogenizmus, chronickou anovulaci, a tedy nedostatečnou tvorbu gestagenů vaječníky.
Vyšší hladina estrogenů u postmenopauzálních obézních žen je nejspíš jedním z faktorů způsobujících vyšší incidenci karcinomu prsu. U premenopauzálních žen může být vznik karcinomu endometria důsledkem ovariálního hyperandrogenizmu a nedostatku progesteronu.
Souvislosti plazmatických hladin pohlavních hormonů s premenopauzálním karcinomem prsu a karcinomem prostaty jsou již méně jasné. Zřejmě chronicky zvýšená hladina inzulinu může souviset s vyšším rizikem karcinomu endometria a tlustého střeva. Vyšší výskyt karcinomu endometria, tlustého střeva, pankreatu a ledvin je pozorován u diabetiků 2. typu, kteří mají obvykle vyšší hladiny endogenního inzulinu. Chronická hyperinzulinemie je přímým stimulačním faktorem pro inzulinový receptor a může zvýšit biologickou aktivitu insulin-like growth factor-1 tím, že sníží koncentraci jejich vazebných proteinů (insulin-like growth factor binding globulin). V současnosti se považuje souvislost vyšší hladiny insulin-like growth factor-1 s vyšší incidencí premenopauzálního karcinomu prsu, karcinomu prostaty a karcinomu kolorekta za prokázanou.
Stimulační vliv na karcinogenezi může mít i zvýšená nabídka energie buňkám. Vysoký příjem energie se jeví jako faktor s přímým rizikovým vlivem, což je dáno zřejmě tím, že nadbytek přívodu energie do buňky může zvýšit pohotovost k replikaci, a tím i nádorové riziko. Vysoký příjem energie v dětství (spolu s nízkou pohybovou aktivitou) je jednou z příčin rychlého růstu v dětství, vyšší tělesné výšky v dospělosti a časné menarche. Pracovní skupina IARC uvádí, že v experimentech na zvířatech mělo omezení přívodu energie inhibiční vliv na vznik rakoviny mléčné žlázy, tlustého střeva, kůže, jater, hypofýzy a lymfomů.
Tělesný růst
Mohlo by se zdát, že otázka tělesného růstu nepatří mezi výživové faktory, ale ve skutečnosti s výživou velmi úzce souvisí. Zároveň se ukazuje, že překvapivě silně souvisí s nádorovým rizikem. Proto je zde zařazeno hodnocení efektu, tak jako tomu je ve zprávě AICR. Ve skutečnosti oproti 90. létům minulého století ještě značně zesílily důkazy, že faktory, které vedou k větší výšce v dospělosti, nebo jejich důsledky, způsobují rakovinu různých nádorových lokalizací. Jsou přesvědčivé důkazy, že tyto faktory zvyšují riziko karcinomu kolorekta a prsu (postmenopauzální výskyt), a pravděpodobné důkazy o zvýšení rizika pro rakovinu pankreatu, prsu pre-menopauzálně a ovaria. Limitované důkazy jsou ohledně endometria. Ještě je také pravděpodobné, že faktory vedoucí k vyšší porodní hmotnosti zvyšují riziko pre-menopauzálního karcinomu prsu. Všechny tyto výsledky shrnuje tab. 17.
![Růst a tělesná výška v dospělosti – vliv na riziko rakoviny [16].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/c387bc13f79c0fc75a806945c2df4c75.jpg)
Je ovšem nepravděpodobné, že by výška v dospělosti přímo modifikovala riziko vzniku rakoviny. Je spíše markerem pro genetické, environmentální, hormonální a také nutriční faktory, ovlivňující růst od prekoncepčního období až do ukončení růstu.
Pohybová aktivita
Důkazy o vlivu pohybové aktivity na nádorové riziko shrnuje tab. 18. Jsou přesvědčivé důkazy, že pohybová aktivita chrání proti rakovině tlustého střeva. Dále je pravděpodobné, že chrání proti postmenopauzální rakovině prsu a proti rakovině endometria. Důkazy o protektivním vlivu vzhledem k rakovině plic, pankreatu a premenopauzální rakoviny prsu jsou limitované.
![Pohybová aktivita – vliv na riziko rakoviny [16].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/b4397b252d48670cf5abfcddafbc5319.jpg)
Kolorektální karcinom. Existují rozsáhlé epidemiologické údaje z prospektivních studií o snižujícím se riziku s vyšší celkovou hladinou pohybové aktivity, stejně jako s vyšší frekvencí a intenzitou, a je potvrzena závislost efektu na dávce. Přitom je nízká heterogenita, s výjimkou toho, že efekt není tak jasný pro rektální rakovinu jako pro rakovinu tlustého střeva. Jsou také přijatelné vysvětlující mechanizmy. Zahrnují snížení inzulinové rezistence, příznivý efekt pohybu na množství tělesného tuku (tloušťku), účinek na metabolizmus steroidních hormonů a zkrácení doby střevní pasáže.
Rakovina prsu. Ohledně postmenopauzální rakoviny prsu existují rozsáhlá potvrzení z prospektivních studií ukazující snížení rizika s celkově vyššími hladinami pohybové aktivity, včetně efektu závislosti účinku na dávce, ačkoliv zde je určitá heterogenita. Je málo důkazů o vlivu frekvence, trvání, nebo intenzity pohybové aktivity. Existují věrohodné a silné údaje ohledně mechanizmů, kterých je řada, a zahrnují příznivý efekt na množství tělesného tuku (tloušťku), efekt na endogenní metabolizmus steroidních hormonů a pravděpodobné posílení imunitního systému. Pohybová aktivita může snižovat hladiny cirkulujících estrogenů a androgenů.
Co se týče pre-menopauzálního výskytu rakoviny prsu, existují sice poměrně bohaté důkazy z prospektivních studií, ale jsou nekonzistentní.
Endometrium. Celkově jsou konzistentní důkazy o snížení rizika při vyšších hladinách pohybové aktivity, převážně z case-control studií. Existují i věrohodné a potvrzené mechanizmy efektu, jsou v podstatě stejné jako u rakoviny prsu (v obou případech jde o podobně hormonálně podmíněné nádory).
Plíce. Pro rakovinu plic jsou důkazy z prospektivních i case-control studií, ukazující snížení rizika při vyšších hladinách pohybové aktivity, ale nejsou potvrzeny věrohodné vysvětlující mechanizmy. Vztah tedy nemůže být řazen výše než v kategorii „limitované důkazy“. Souvislosti mezi pohybovou aktivitou, BMI a rizikem je obtížné interpretovat. Nemůže být zcela vyloučena možnost, že lidé, kteří jsou ve zvýšeném riziku plicní rakoviny, mohou redukovat svoji pohybovou aktivitu. Vztah mezi pohybovou aktivitou a plicní rakovinou je komplexní. Na rozdíl od mnoha dalších nádorů není plicní rakovina pozitivně asociována s BMI. Pozorovaná asociace mezi pohybovou aktivitou a plicní rakovinou může odrážet tzv. reverzní příčinnou souvislost (reverse causation) vlivem chronického plicního onemocnění.
Pankreas. Jsou důkazy z prospektivních studií ukazující snížení rizika vlivem různých typů pohybové aktivity, nicméně jsou poněkud nekonzistentní. Vysvětlující mechanizmy zahrnují snížení inzulinové rezistence a zkrácený čas střevní pasáže, což má příznivý efekt na obsah žluče a její sekreci a na celkovou pankreatickou aktivitu.
Prostata. Jsou údaje ze studií o snížení rizika vlivem pohybové aktivity, ale nejsou dostatečné k učinění jakýchkoli závěrů. Existuje i několik věrohodných mechanizmů, které by případný efekt mohly vysvětlovat – pohyb může redukovat riziko vzniku rakoviny prostaty snížením hladin testosteronu a inzulinu. Dále může cvičení akutně podpořit tvorbu volných radikálů a u lidí cvičících pravidelně může indukovat produkci enzymů jako superoxiddismutáza (superoxide dismutase – SOD), které chrání před oxidativním stresem. Tyto enzymy mohou rovněž chránit před rizikem vzniku rakoviny, neboť dietární antioxidanty jsou spojeny se snížením rizika.
Celkově se ukazuje, že dostatečná pohybová aktivita je velmi významným faktorem k celkovému snížení rizika vzniku rakoviny. Nebo, vzato opačně, že nečinnost a sedavý způsob života jsou velmi významným rizikovým faktorem. Homo sapiens byl od doby svého vzniku před přibližně 250 000 lety až do doby velice nedávné prakticky po celý život velmi fyzicky aktivní. Dnes obecně převládá sedavý způsob života, pohybová aktivita většiny lidí je naprosto nedostatečná. V zásadě platí, že čím více pohybu, tím lépe. Výjimkou jsou skutečně extrémní výkony a zátěže, kdy dochází k supresi imunitního sytému.
Infekce
Skutečnost, že viry mohou vyvolávat maligní choroby, byla zjištěna nejdříve u zvířat, u nichž jak DNA, tak RNA viry způsobují typické choroby. Pro ilustraci lze uvést například leukemii a sarkomy drůbeže, fibrosarkomy králíků.
Infekce však mají významnou roli i v etiologii humánních nádorových onemocnění. V průmyslově vyspělých zemích se odhaduje, že infekční etiologie přispívá 5–7 %, v rozvojových zemích až 22 % na celkovém počtu maligních onemocnění.
Za nejvýznamnější infekční etiologická agens karcinogeneze se ve vyspělých zemích považuje HPV – Human papiloma virus – lidský papilomavirus, Helicobacter pylori, viry hepatitidy B a C a virus Epsteina-Barrové.
Virus HIV nemá onkogenní potenciál, ale imunosupresí usnadňuje vznik maligních nemocí. V endemických oblastech je pak nutno připočíst ještě human T lymphoma/leukemia virus – HTLV-1 virus.
Vyjmenovaná infekční agens jsou zodpovědná za více než 80 % nádorů asociovaných s infekcemi. Podíl ostatních infekcí je z hlediska přispění k celkové nádorové úmrtnosti velmi nízký (tab. 19).
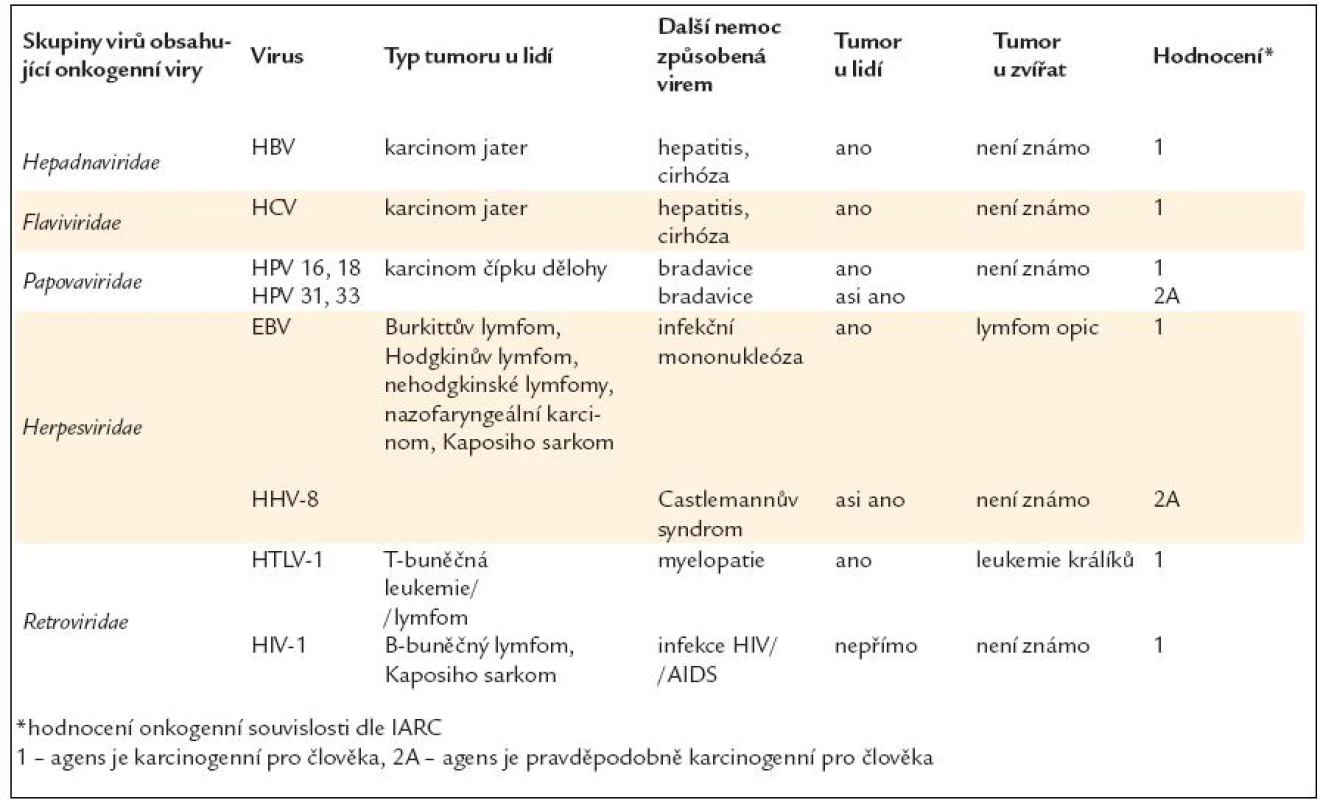
HPV – lidský papilomavirus
Lidské papilomaviry patří do skupiny Papovaviridae. Samotná skupina dnes čítá 70 různých typů. Jsou přenášeny především sexuálním stykem, nebo jinou formou kontaktu s nakaženými částmi lidského těla. Přenos viru je ulehčen v případě narušení povrchu sliznice nebo kůže.
Lidský papilomavirus (HPV) se vyskytuje u lidí téměř běžně, ale pouze u malé skupiny infikovaných osob dojde k vývoji karcinomu. Lidský papilomavirus je DNA virus, který způsobuje onkogenní transformaci hostitelské buňky. Nejčastější malignitou spojovanou s HPV je karcinom čípku. Další malignity spojované s HPV infekcí jsou karcinomy vulvy, vaginy, penisu a konečníku. Překvapivé bylo zjištění z posledních let, že může být také příčinou podskupiny karcinomů hlavy a krku, vyrůstajících z jazykové nebo patrové tonzily. Tím se začala psát nová kapitola o nádorech hlavy a krku.
Epidemiologické studie dokládají, že u mladších osob ve věku 20–44 let dochází k nárůstu výskytu karcinomu orofaryngu o 2,1 % v oblasti kořene jazyka a o 3,9 % v oblasti patrových mandlí. Současné studie prokazují, že nádory hlavy a krku spojené s výskytem HPV představují rozdílnou skupinu tohoto onemocnění s odlišnou genetickou charakteristikou, patogenezou a klinickými rysy. Nárůst výskytu orofaryngeálního karcinomu souvisí se zvýšeným výskytem sexuálních praktik, spojených s přenosem viru. Uvádí se následující faktory:
- sexuální praktiky jako orální sex, orálně-anální kontakt,
- vyšší počet sexuálních partnerů,
- anamnéza HPV pozitivního anogenitálního karcinomu,
- vyšší je riziko pro muže, jejichž ženy mají v anamnéze karcinom in situ nebo invazivní karcinom čípku děložního,
- vyšší je riziko pro muže infikované HIV.
Klinický profil HPV pozitivních pacientů je odlišný. Zatímco dříve byl karcinom orofaryngu diagnostikován převážně u starších osob, kuřáků – alkoholiků a osob nízkého socioekonomického stavu, v současné době je demografie odlišná. S nádory orofaryngu se prezentují osoby mladší, dobrého stavu, vzdělaní, nekuřáci a abstinenti.
Pokud se v ambulanci objeví pacienti s touto charakteristikou, je nutno vždy myslet na možnost etiologie HPV.
Průkaz HPV pozitivity má závažný dopad pro kliniku. V řadě prací byla dokumentována pro HPV pozitivní pacienty lepší prognóza, přichází většinou v dobrém stavu v časnějším stadiu onemocnění, odpovídají lépe na radio - a chemoterapii.
Vzhledem k lepším výsledkům přežití HPV pozitivních pacientů je účelné použití méně intenzivního léčebného režimu, který by snížil akutní a pozdní toxicitu, při zachování stejných léčebných výsledků. Nabízí se řešení nahradit v chemoradioterapii cisplatinu biologickou léčbou cetuximabem, a to pro výrazně odlišnou a méně závažnou toxicitu.
Předmětem intenzivního výzkumu jsou terapeutické a profylaktické vakcíny. Profylaktická vakcína by mohla být protektivní proti HPV infekci, která vede ke karcinomu, ale zřejmě nebude působit jako ochrana, pokud již byl pacient na HPV exponován. Vakcína pro prevenci infekce je již k dispozici a očekávají se výsledky prvních větších studií.
Výskyt karcinomů hlavy a krku spojených s HPV se v posledních letech výrazně zvýšil, zřejmě díky novým sexuálním návykům, spojeným s přenosem virů. Spojení s HPV má být podezříváno u mladých jedinců, nekuřáků, ne-alkoholiků, v dobrém celkovém stavu. Karcinomy spojené s HPV mají lepší prognózu a lépe odpovídají na chemoradioterapii. Použití vakcín v prevenci a léčbě se šetří.
Dnes se uvádí, že lidský papilomavirus (HPV) je zodpovědný za 98–99 % karcinomů hrdla děložního, za 90 % prekanceróz vulvy, za 35 % karcinomů vulvy, za 100 % kondylomat vulvy, za 90 % prekanceróz pochvy a za 50 % karcinomů pochvy. Je také etiologickým původcem karcinomu análního otvoru, karcinomu penisu, ale také papilomatózy laryngu. Proto je zásadním přínosem očkování proti těmto virům. Kvadrivalentní vakcína Silgard chrání proti infekci HVP typu 6, 11, 16 a 18. Vakcína Cervarix chrání proti typu 16 a 18. V současnosti (v roce 2010) se doporučuje očkování pro dívky a ženy ve věku 9–45 let a chlapce ve věku 9–15 let. Změnou oproti předchozím letům je rozšíření doporučení do vyšších věkových ročníků.
Virus hepatitidy B
Epidemiologie: Souvislost karcinomu jater a hepatitidy typu B, která je způsobena malým DNA virem (42 nm), byla potvrzena epidemiologickým šetřením. Později byly geny tohoto viru nalezeny včleněné (integrované) do genomu buněk karcinomu jater.
Prevalence infekce dosahuje v Africe a Číně 5–20 %, v Evropě se pohybuje okolo 0,1–1,0 %. Doba latence mezi infekcí a vznikem hepatocelulárního karcinomu je obvykle velmi dlouhá, 30–40 let. V tomto směru byl prokázán synergizmus HBV s HCV a aflatoxiny. Očkovací látka proti hepatitidě B (HB) je považovaná za první protirakovinnou vakcínu na světě – tím, že nedojde k onemocnění akutní HB, nemůže dojít ani k progresi chronické HB do jaterní cirhózy a následně do hepatocelulárního karcinomu.
Virus hepatitidy C
Prevalence viru hepatitidy C (HCV) v populaci se odhaduje na 0,1–1,0 %, obzvláště vysoká je prevalence této infekce u drogově závislých. Virus hepatitidy C je RNA virus ze skupiny Flaviviridae, objeven byl v roce 1989, za karcinogenní se považuje od roku 1994. Ke karcinogenitě HCV přispívají tzv. quasispecies, tedy různý karcinogenní potenciál způsobený variabilitou HCV genomů v rámci hostitelského organizmu. HCV RNA nemá schopnost se integrovat do hostitelského genomu. HCV ale indukuje chronický jaterní zánět, dochází ke stimulaci protilátkové i buněčné imunitní odpovědi a ve srovnání s chronickou infekcí HBV je u HCV více vyjádřena následná buněčná regenerace.
Na rozdíl od HBV infekce, u nichž byly DNA virové sekvence prokázány v maligních buňkách, zde se na etiologickou souvislost usuzuje pouze z epidemiologických studií.
Epsteina-Barrové virus (EB virus)
Epidemiologie: Endemický africký typ Burkittova lymfomu byl prvním typem lidského tumoru, u něhož byla prokázána souvislost s virovou infekcí. Virus byl izolován již v roce 1964 z lymfomové tkáně afrického pacienta.
Dnes je známo, že tento virus nesouvisí jenom s endemickým Burkittovým lymfomem v Africe (v případě neendemických Burkittových lymfomů v Evropě již není souvislost tak těsná), ale že se podílí na vzniku dalších nádorů: nazofaryngeální karcinom v Číně, v Evropě a USA se podílí na vzniku Hodgkinových i nehodgkinských lymfomů a snad i na nediferencovaném karcinomu žaludku. EB virus je kosmopolitně rozšířen, odhaduje se, že 90 % populace má latentní infekci.
Samotný virus však ještě nestačí k dokončení maligní transformace. V případě Burkittova lymfomu zde hraje důležitou úlohu infekce malárií, jako kofaktor se uvádějí nevhodné hygienické poměry. V případně nazofaryngeálního karcinomu v Číně jsou dalším kofaktorem nitrosaminy. I přes mnoho informací z poslední doby není význam EB viru pro vznik maligních lymfoproliferací zcela jasný. Pierre Brousset shrnul v roce 2002 [18] tuto problematiku do následujících vět: „Všechny teorie vysvětlující roli EB viru v lymfomagenezi jsou stále spekulativní. Molekulární studie připouštějí významnější roli tohoto viru u některých typů lymfomů. EB infekce in vitro většinou způsobuje imortalizaci lymfocytů a ne jejich transformaci. Víme také, že cílem viru nemusí být jen B-, ale také T - a NK-buňky. Infekce EB virem může být iniciačním krokem, případně může indukovat polyklonální proliferaci díky tomu, že je imortalizuje. Pak je ovšem ještě nutný další krok vedoucí k maligní transformaci“.
Humánní herpes virus 8
Kaposiho sarkom má následující formy:
- klasický Kaposiho sarkom,
- endemický Kaposiho sarkom v Africe,
- iatrogenní Kaposiho sarkom u imunosuprimovaných pacientů,
- s AIDS asociovaný Kaposiho sarkom.
Humánní herpes virus 8 je etiologickým faktorem posledních 2 forem, které se vyskytují u imunokompromitovaných pacientů. Zatím není zcela jasné, nakolik je etiologickým faktorem dalších forem. V případě Kaposiho sarkomu imunokompromitovaných nemocných byly části virové DNA nalezeny v genomu maligní buňky. Dalšími chorobami, o nichž se uvádí, že souvisejí s infekcí tímto virem mimo jiných kožních projevů, je multicentrická Castlemanova nemoc a tzv. „primary effusion’s lymphoma“. Zatím je prokázán jen přenos pohlavním kontaktem. U afrických dětí se zvažuje vertikální přenos od rodičů.
Virus humánní T-buněčné leukemie (human T cell leukemia/lymphoma virus)
Ačkoli tumorigenní retroviry byly u zvířat známy již počátkem minulého století jako tzv. RNS tumorové viry, byl u lidí první tumorogenní retrovirus rozpoznán až v roce 1978, a to z kožního lymfomu. Později byl v Japonsku z endemické formy lymfomu/leukemie izolován další virus, který byl s tímto prvním identický. V roce 1982 byl z buněk vlasatobuněčné leukemie izolován další typ, který je nazván HTLV-2.
Dřívější sérologické studie prokázaly tyto viry u různých druhů opic a virus byl pojmenován jako Simian T-lymfotropní virus (STLV). Tento virus je z 90–95 % podobný viru HTLV-1, který koexistuje s člověkem již asi 30 000 let a vytvořil celkem 3 kmeny. Nachází se v endemických oblastech různých částí zeměkoule. Endemickými místy jeho výskytu je jihozápadní Japonsko, kde jeho séroprevalence dosahuje 15 %, dále pak karibská oblast s 2–5% prevalencí a některé africké země, kde činí séroprevalence až 10 %. V Evropě se tato infekce nevyskytuje a byla diagnostikována jen u imigrantů.
Přenos infekce probíhá při kojení, dále při sexuálním kontaktu a kontaminovanou krví.
HTLV-1 je typickým retrovirem, majícím reverzní transkriptázu, která virovou RNA informaci převede do DNA formy a začlení do genomu buňky. Infekce napadá T-buňky. Infekce se diagnostikuje sérologicky a dále metodami molekulární biologie (western blot). Primární infekce probíhá podobně jako skoro u všech infekcí přenášených pohlavním stykem – bez jakýchkoli příznaků. Od infikování do vzniku leukemie, která se vyvine však jen u minority infikovaných, proběhne několik desetiletí.
Helicobacter pylori
Helicobacter pylori je snad první bakterií, u níž byl prokázán karcinogenní účinek.
Infekce má vysokou prevalenci. Epidemiologicky je tato infekce spjata s karcinomem žaludku, pravděpodobnost jeho vzniku zvyšuje 3–6krát. Může však také iniciovat takzvané MALT lymfomy žaludku (mucosa associated lymphatic tissue lymphoma). Infekce je eradikovatelná antibiotickou léčbou.
Další infekční etiologická agens maligních chorob
Jedná se o některé cizokrajné parazitární choroby, které přesahují možnosti tohoto sdělení.
Ionizující a UV záření
Ionizující záření má prokazatelně schopnost vyvolávat maligní onemocnění. Převážná část populační expozice ionizujícímu záření pochází z přirozených zdrojů radiačního pozadí, dalším významným zdrojem je lékařské využití, pro běžnou populaci zejména diagnostické. Nádorové lokalizace mohou být dle konkrétního typu záření a způsobu expozice různé, obvykle leukemie, ale i nádory plic (radon) či zvýšení rizika nádorů prsu jako důsledek medicínského použití. Ve srovnání s ostatními uvedenými zevními faktory je reálný význam ionizujícího záření pro veškerou populaci relativně nízký. Pouze u skupin s profesionálně zvýšenou expozicí je důležitým faktorem.
Bezpečný limit pro dávku záření však neexistuje. Existuje jen závislost mezi rizikem vzniku nádoru a dávkou ozáření. Dávka, kterou člověk dostane při běžném snímku plic (0,05 mGy), zvyšuje pravděpodobnost vzniku nádoru v poměru 1 : 400 000. Radiodiagnostické vyšetřovací metody by tedy měly znamenat jen nepatrné zvýšení rizika vzniku maligního onemocnění.
Prenatální radiologická diagnostika
Epidemiologickými studiemi bylo prokázáno podstatné zvýšení rizika vzniku maligního onemocnění po prenatálním RTG vyšetření. Dávky záření 10–20 mGy zvýšily četnost dětských leukemií o 20 %. Proto by se těhotné ženy měly vyšetřovat RTG, jenom pokud není jiné cesty.
Nutno však zdůraznit, že dítě je sice nejcitlivější na záření během svého intrauterinního života, ale i po svém narození je stále ještě na záření citlivější, než jsou dospělí.
Interval od ozáření do vzniku nádoru
Ozáření zvyšuje riziko maligní transformace ve všech orgánech. Jsou však rozdíly v době, za jakou dojde k manifestaci. Leukemie vznikají obvykle do 10 let od ozáření, zatímco incidence solidních nádorů od ozáření neustále v průběhu života narůstá.
Ultrafialové záření
Ultrafialové záření (ultraviolet irradiation – UV) má etiologickou souvislost s nádory kůže, ať již s melanomy či se spinocelulárními a bazocelulárními karcinomy. Zdrojem expozice je běžné sluneční záření, proto směřují preventivní opatření proti nadměrnému slunění a k používání ochranných prostředků. A opět, podobně jako je tomu u solidních nádorů, mezi zvýšeným osluněním kůže a vznikem kožního nádoru je mnohaletá latence.
Chemická karcinogeneze
První epidemiologická zmínka o souvislosti mezi vznikem rakoviny a kontaktem s určitými chemickými látkami je z roku 1761, kdy John Hill referoval o souvislosti šňupacího tabáku s nádory nosohltanu. O 14 let později zveřejnil Parcival Pott své pozorování o rakovině šourku a varlat u mladých kominíků. Od těch dob se objevují stále další epidemiologické informace o tom, že kontakt s určitou chemickou látkou zvyšuje četnost maligních chorob, stejně jako experimentálních laboratorních průkazů karcinogenity určitých chemikálií.
Mechanizmus účinku chemických karcinogenů
V případě vystavení záření je mechanizmus jasný. V popředí malých dávek záření stojí genotoxický účinek, vyšší dávky ruší pak již přímo proliferaci nebo vedou k buněčné smrti.
Chemické karcinogeny mají velmi různorodý mechanizmus účinku. Alkylační látky působí genotoxicky bez další aktivace. Aromatické aminy a polycyklické aromatické uhlovodíky obvykle potřebují k maximálnímu karcinogennímu efektu metabolickou aktivaci. Anorganické látky (těžké kovy) obvykle působí bez další aktivace. Chemické karcinogeny mají obvykle mutagenní vliv, což po určitém čase může způsobit maligní transformaci.
Problémy s kvantifikací karcinogenního vlivu
Při popisu chemických karcinogenů se setkáváme s jedním zásadním problémem, kterým je nemožnost kvantifikace vlivu karcinogenu.
V případě ionizačního záření můžeme kvantifikovat kumulativní dávku záření a od ní odvodit riziko vzniku maligního bujení.
Dlouhodobou expozici chemickým karcinogenům u běžného vzorku obyvatelstva však nejsme schopni kvantitativně stanovit, takže není možné ani stanovit míru rizika.
Je však možné popsat rozdíl ve výskytu maligních nádorů ve skupině s určitou vyšší expozicí, která je dána typem profese, a porovnat ji s frekvencí nádorů v běžné populaci.
Tak například analýza četnosti maligních lymfomů u zemědělců v USA prokázala, že kontakt s herbicidy zvyšuje riziko 1,6–2,7krát, kontakt s fungicidy až 3,7krát. Také dlouhodobé pití vody s vyšším procentem nitrátů souvisí s vyšším výskytem lymfomů. Stejně tak stoupá riziko vzniku maligních lymfomů při práci s organickými rozpouštědly a těkavými látkami, jak bylo prokázáno v četných epidemiologických studiích.
Které látky jsou karcinogenní?
Organizace International Agency for Research on Cancer při Světové zdravotnické organizaci (SZO) analyzuje veškeré údaje o karcinogenitě jednotlivých látek. Chemické látky třídí do skupiny s již prokázaným karcinogenním účinkem a dále na látky, které pravděpodobně karcinogenně také působí. V těchto tabulkách jsou uvedeny způsoby expozice a cílové orgány. Aktuální informace – nejnovější seznamy karcinogenů – by měly být k nalezení na internetu. Pro názornost uvádíme některé údaje z databáze IARC v tab. 20 a 21 a také internetové adresy http://monographs.iarc.fr/ENG/Classification/index.php a http://en.wikipedia.org/wiki/List_of_IARC_Group_1_carcinogens.
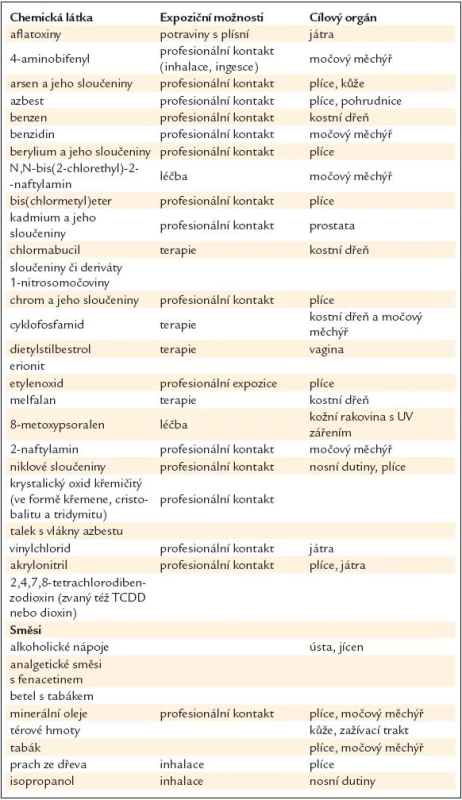

Dioxiny
Jako dioxiny se označuje skupina polychlorovaných aromatických uhlovodíků se 2 benzenovými kruhy v molekule. Z hlediska struktury se dále dělí na PCDD (polychlorované dibenzo-p-dioxiny) a PCDF (polychlorované dibenzofurany). Termín dioxin v užším slova smyslu se vztahuje k nejvíce studovanému a jednomu z nejtoxičtějších dioxinů – 2,3,7,8-tetrachlorodibenzo-p-dioxinu (2,3,7,8-TCDD).
Čisté dioxiny jsou bezbarvé krystalické látky a jejich termolýza nastává při teplotách 600–1 000 °C. Obecně nejsou rozpustné ve vodě, jsou málo těkavé a stabilní v kyselinách i zásadách. Jsou rezistentní i vůči biologickému rozkladu. Tyto vlastnosti předurčují jejich dlouhodobé přetrvávání v životním prostředí. Navíc jsou vysoce lipofilní, a proto se mohou akumulovat v tukové tkáni člověka i zvířat.
Dioxiny nejsou produkovány cíleně, uvolňují se do ovzduší při procesu spalování (likvidace odpadů, hoření paliv) nebo při chemických výrobách jako vedlejší produkty (bělení buničiny, výroba herbicidů, PVC atd.). Mohou se tvořit i při domácím pálení odpadu, při lesních požárech nebo erupcích sopek.
Z tohoto důvodu se považuje za škodlivé spalování umělých hmot v domácnosti. Bohužel však nejen nevzdělaní a hloupí lidé, ale i vysokoškolsky vzdělaní a bezohlední lidé jsou stále schopni spalovat doma umělohmotné předměty, PET láhve a podobně, a zhoršovat tak životní prostřední sobě i ostatním.
Vzhledem k tomu, že dioxiny jsou uvolňovány do ovzduší, mohou být transportovány na velkou vzdálenost od místa vzniku. Proto je lze nalézt prakticky všude na zemi. Jakmile se dostanou do vody, mají tendenci usazovat se v sedimentech, odkud jsou dále transportovány nebo se dostávají do těl ryb a dalších, ve vodě žijících organizmů. Ukládají se rovněž v rostlinách. S potravou se dostávají do těla dalších živočichů.
Zájem o dioxiny vyvolaly studie poukazující na to, že jejich působení může mít nepříznivé vedlejší účinky na lidský organizmus. Akutní toxicita těchto látek nehraje s výjimkou velkých havárií podstatnou roli. Nejčastěji zmiňovaný akutní účinek je chlorakné a jiné kožní poruchy, případně poškození jater. Daleko významnější je chronická toxicita a její důsledky. Mezi ně se řadí zejména riziko karcinogeneze, imunotoxicity a teratogeneze. 2,3,7,8-TCDD, tzv. sevessky dioxin, byl zařazen SZO mezi rakovinotvorné látky s účinkem na člověka.
Biologickým podkladem působení dioxinů je jejich vazba na buněčný Ah-receptor (aromatic hydrocarbon receptor – receptor pro aromatické uhlovodíky). Ah-receptor je podobně jako některé receptory steroidních hormonů lokalizován v cytoplazmě buněk. Jeho přirozený endogenní ligand není znám, váže však řadu xenobiotik s aromatickou planární strukturou. Dioxiny díky své hydrofobicitě snadno penetrují přes buněčnou membránu (podobně jako např. přirozené steroidní hormony) a váží se na tento receptor. Po navázání ligandu se aktivovaný receptor spojuje se specifickým transportním proteinem (AhR nuclear translocator – ARNT) a celý komplex se přesouvá do jádra, kde působí jako transkripční faktor. Váže se ke specifickým místům DNA v regulačních doménách různých genů a řídí tvorbu různých proteinů. Nejvíce studována byla např. indukce syntézy cytochromu P-450, glutation S-transferázy, NAD(P)H-chinon reduktázy. Proteinů, jejichž syntéza může být v závislosti na typu buňky ovlivněna, byla však již rozpoznána celá řada a jsou dávány do souvislosti se zásahy do buněčných regulačních mechanizmů, vyúsťujících v narušení fyziologických procesů v buňce.
Protože dioxiny zasahují plošně celé životní prostředí, je jejich působení vystaven prakticky každý organizmus. Účinek pak závisí na délce expozice, dávce a druhu dioxinu. Inhalační expozice PCDD a PCDF je v průměru nízká. Rovněž jejich příjem v pitné vodě je zanedbatelný. Hlavním zdrojem dioxinů pro člověka, který bezprostředně nepracuje v příslušné chemické výrobě, jsou potraviny, mezi nimiž dominují potraviny živočišného původu, zejména tučné maso. SZO stanovila v roce 1990 na základě pokusů se zvířaty přijatelnou denní dávku (tolerable daily intake – TDI) 10 pg nakg váhy a den pro TCDD. V roce 1998 bylo toto doporučení přehodnoceno a horní hranice příjmu byla stanovena na 4 pg nakg váhy a den s cílem postupně tento limit dále snižovat na hodnotu 1 pg nakg váhy a den.
Problémy dusičnanů (nitrátů) a dusitanů (nitritů) v potravě a v pitné vodě
Kvůli zvýšenému používání syntetických dusíkatých hnojiv se zvýšila jejich koncentrace v pitné vodě, a tedy také jejich konzumace. Zvýšené množství těchto látek konzumujeme jak v přehnojené zelenině, tak v pitné vodě kontaminované zvýšenou koncentrací dusičnanů a dusitanů. Mensinga [19] uvádí, že průměrný příjem dusičnanů je v Evropě 140 mg/den, v USA jen 40–100 mg/den. Nitráty jsou téměř kompletně vstřebány v tenkém střevě, distribuovány do všech tkání a vylučovány močí. Mimoto vyloučí zdravý dospělý člověk denně v průměru 62 mg endogenně syntetizovaného nitrátového aniontu.
Ze vstřebaného množství dusičnanů je 5–8 % přeměněno na dusitany.
Nitráty samotné nejsou pro člověka toxické. Toxickými se stávají až po přeměně na dusitany (nitrity), které mohou způsobit více toxických projevů.
Dusitany indukují methemoglobinemii, ta pak způsobuje tkáňovou hypoxii (únavu, malátnost, nevýkonnost) a při vysoké dávce dokonce smrt. Obzvláště lehce vzniká methemoglobinemie u kojenců, proto jsou pro ně nižší přípustné koncentrace v pitné vodě než pro dospělé.
Dusitany mohou dále reagovat s organickými látkami za vzniku karcinogenních nitrosaminů. Méně známá je hypertrofie štítné žlázy vlivem vyšších dávek nitrátů.
Byly provedeny četné epidemiologické studie s cílem zjistit přijatelný limit příjmu nitrátů ze zevního prostředí, který ještě neohrozí zdraví. Agriculture Ogranization of the UN//WHO a European Comission’s Scientific Committee on Food stanovily bezpečný denní příjem na 0,0–3,7 mg nitrátového aniontu/kg hmotnosti [19].
Závislost vzniku rakoviny na množství konzumovaných nitrosaminů je zřetelná. Protože je možná souvislost mezi zvýšenou koncentrací dusičnanů v pitné vodě a zvýšenou tvorbou nitrosaminů, byla hledána souvislosti mezi zvýšenou koncentrací dusičnanů v pitné vodě a zvýšenou četností maligních nádorů.
Vlivu dusičnanů z potravy i z pitné vody na riziko vzniku různých typů maligních chorob se věnovaly četné epidemiologické studie. Je zjevné, že frekvenci nádorů ovlivňuje současně mnoho faktorů, a proto není divu, že výsledky těchto studií nejsou zcela identické, nicméně většina epidemiologických studií prokázala jisté zvýšení rizika vzniku různých typů maligních chorob.
V klinických studiích byl popsán vyšší výskyt karcinomu tlustého střeva v souvislosti s vyšší koncentrací nitrátů v pitné vodě, obzvláště při nedostatečném přívodu vitaminu C [20], dále zvýšení rizika vzniku karcinomu ezofagu a ža-ludku [21–23], nehodgkinských lymfomů [24,25], karcinomu močového měchýře a ovariálních tumorů, karcinomu ledviny a dalších nádorů [26].
Profesionální expozice
Profesionální expozice jsou vysoce specifické – vázané na konkrétní typ látky s případným karcinogenním účinkem používané na daném pracovišti a na konkrétní, relativně velmi malou populační skupinu exponovaných pracovníků. V současné době je do skupiny humánních karcinogenů zařazeno 13 průmyslových procesů (pracovních expozic), kromě toho jich je ve skupině chemických látek uvedeno 23 jako humánních karcinogenů.
Ve vyspělých zemích je obvykle snahou udržet expozice natolik pod kontrolou, že reálné riziko je poměrně nízké, neboť to vyžaduje tlak veřejnosti na podnikatele.
Hodně se v poslední době v souvislosti s chemizovaným zemědělstvím mluví o rizicích pro zemědělce i pro konzumenty chemicky ošetřovaných produktů. Pro ilustraci faktu, že agrochemikálie nejsou neškodné, uvádíme tab. 22 vyjadřující míru zvýšení rizika nehodgkinských lymfomů u lidí, kteří jsou v kontaktu s agrochemikáliemi.
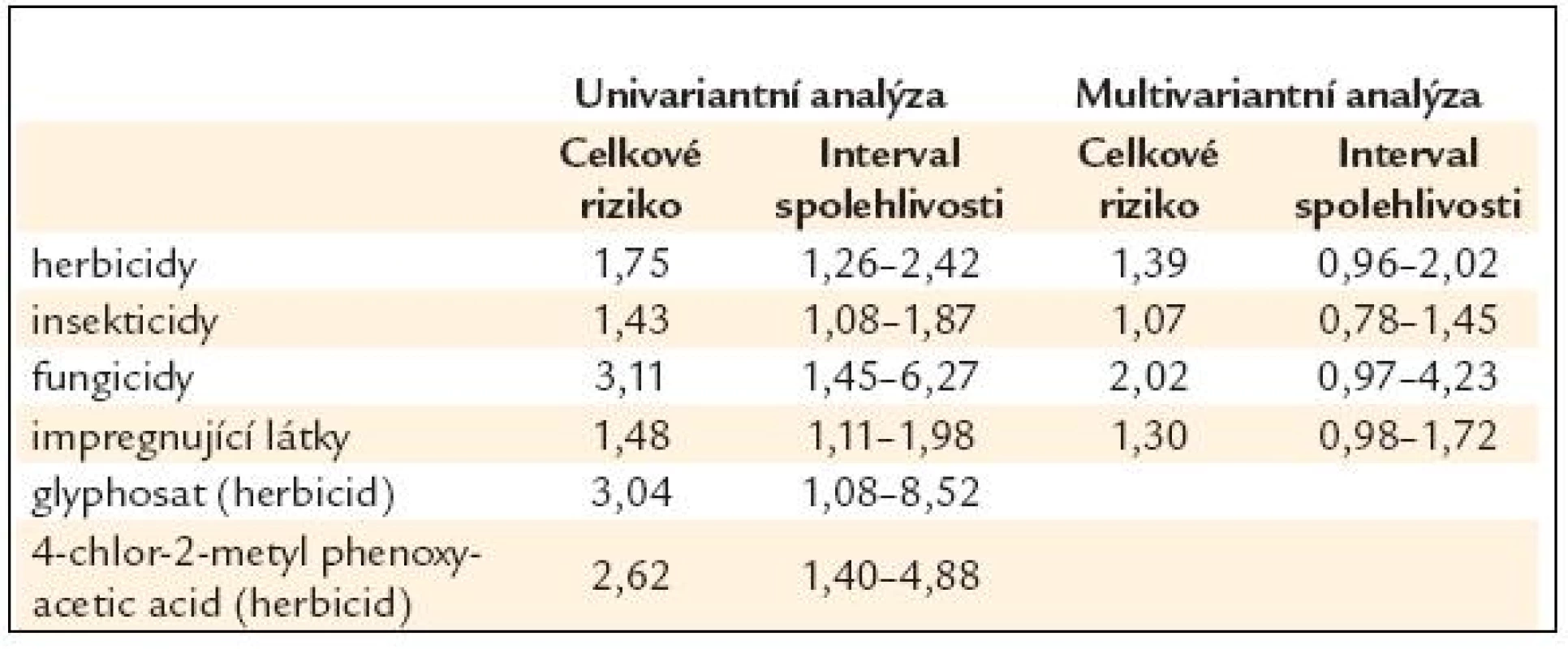
Reprodukční faktory
Reprodukční faktory mohou ovlivnit poměrně významně riziko nádorů prsu a ženských reprodukčních orgánů. Zejména nuliparita zvyšuje riziko pro karcinom prsu, ovarií a endometria. Časná menstruace a pozdní přechod rovněž zvyšují riziko. Reprodukční faktory ale mají svoji vlastní dynamiku a jejich ovlivňování z hlediska prevence není příliš reálné.
Nutnost edukace národa
Informace o zevních faktorech podmiňujících nemoci je nutno v rámci osvěty více šířit mezi lidmi a domníváme se, že by měly být i předmětem výuky na základních školách, neboť z hlediska budoucnosti jsou tyto informace důležitější než znalost nervového systému kroužkovců.
Chemoprofylaxe
Chemoprofylaxe je termín pro prevenci nemocí pomocí podávání chemicky či biologicky připravené látky obecně buď všem zdravým lidem, nebo lidem s vyšším rizikem určité nemoci.
Lidé se často obracejí na své lékaře s otázkou, zda je možné získat na recept či zakoupit si v lékárně nějaké tabletky, které by snížily pravděpodobnost vzniku nového nádorového onemocnění, nebo které by snížily pravděpodobnost recidivy již dříve léčeného onemocnění. Druhá otázka je podstatně častější. Lidé často získávají z reklam naději, že je možné koupit nějaké magické pilulky a s jejich pomocí zažehnat hrozící nebezpeční recidivy nádoru či vzniku nádoru zcela nového.
Látky, které byly či jsou testovány s cílem snížit pravděpodobnost vzniku maligní nemoci, jsou uvedeny v tab. 23.
Možnosti chemoprofylaxe jsou v současné době velmi intenzivně zkoumány a prověřovány in vitro a in vivo. Látky s potenciálním využitím v tomto smyslu lze dělit do 3 hlavních skupin:
- látky s antiestrogenním a antiandrogenním účinkem (například tamoxifen, raloxifen, inhibitory 5-α reduktázy),
- protizánětlivé látky (kyselina acetylsalycilová, indometacin),
- deriváty nutričního původu (zejména vitaminy, antioxidanty, zinek, selen a další).
Přestože byl u některých prokázán určitý pozitivní účinek, nejsou výsledky klinických studií tak přesvědčivé (signifikantní), aby bylo možné v roce 2003 vyslovit jednoznačné doporučení některého preparátu jako vhodného pro chemoprofylaxi, vyjma doporučení antiestrogenů ženám s vysokým rizikem invazivního karcinomu prsu.
V dalších odstavcích jsou zmíněny testované látky, klinické studie a směry výzkumu, z jejichž analýzy plyne výše uvedené shrnutí.
Tamoxifen
Tamopxifen je selektivní antiestrogen, považuje se za účinný chemopreventivní lék pro ženy s vysokým rizikem vzniku karcinomu prsu. K těmto závěrům dospěl Breast Cancer Prevention Trial. Vzhledem k tomu, že v této studii bylo popsáno snížení rizika invazivního karcinomu o 49 % u žen s vysokým rizikem, stal se Tamoxifen prvním lékem pro primární prevenci karcinomu prsu schváleným institucí Food and Drug Administration v roce 1998. Předběžná hodnocení International Breast Cancer Intervention Study ukazují, že u žen s vysokým rizikem vzniku karcinomu užívajících Tamoxifen se jeho incidence snižuje o 33 %.
Výsledky klinických chemoprofylaktických studií dokumentuje tab. 24 (Odds ratio = pravděpodobnostní poměr odhadující velikost rizika. Hodnoty > 1 znamenají zvýšení, hodnoty < 1 zmenšení rizika).
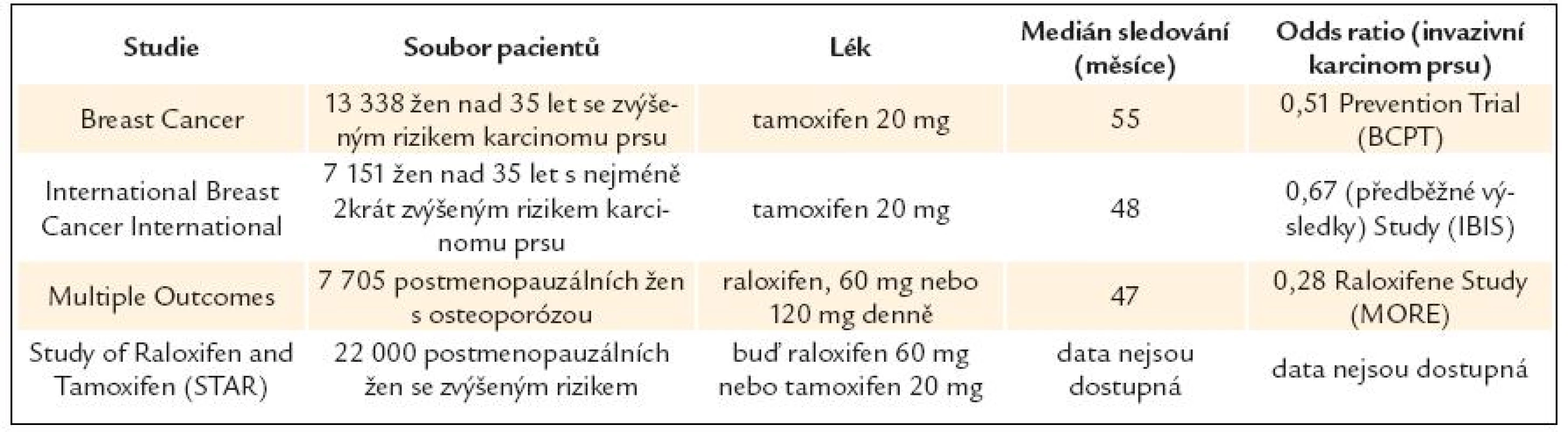
Chemoprofylaxe – závěry pro praxi
S výjimkou podávání antiestrogenů ženám se zvýšeným rizikem karcinomu prsu nejsou zatím výsledky citovaných klinických studií natolik průkazné, aby byly některé výrobky farmaceutického průmyslu standardně doporučovány pro chemoprofylaxi maligních nádorů. Na druhou stranu však lze také konstatovat, že při podávání selenu a vitaminu E v rámci prevence karcinomu prostaty se nevyskytly žádné nežádoucí účinky, které by tuto suplementaci kontraindikovaly. Dle předběžných výsledků má tato substituce pozitivní účinek.
doc. MUDr. Jindřich Fiala, CSc.
www.med.muni.cz
e-mail: jfiala@med.muni.cz
Doručeno do redakce: 29. 12. 2010
Sources
1. Doll R, Peto R. The causes of cancer: quantitative estimates of avoidable risks of cancer in the United States today. J Natl Cancer Inst 1981; 66 : 1191–1308.
2. Danaei G, Vander Hoorn S, Lopez AD et al. Comparative Risk Assessment collaborating group (Cancers). Causes of cancer in the world: comparative risk assessment of nine behavioral and environmental risk factors. Lancet 2005; 366 : 1784–1793.
3. Martin-Moreno JM, Soerjomataram I, Magnusson G. Cancer causes and prevention: A condensed appraisal in Europe in 2008. Eur J Cancer 2008; 44 : 1390–1403.
4. Albreht T, McKee M, Alexe DM et al. Making progress against cancer in Europe in 2008. Eur J Cancer 2008; 44 : 1451–1456.
5. Clapp RW, Howe GK, Jacobs MM. Environmental and occaupational causes of cancer: A call to act on what we know. Biomed Pharmacother 2007; 61 : 631–639.
6. Coleman MP, Alexe DM, Albreht T et al (eds). Responding to the challenge of cancer in Europe. Ljubljana: Institute of Public Health of the Republic of Slovenia 2008.
7. Frieden TR, Myers JE, Krauskopf MS et al. A public health approach to winning the war against cancer. Oncologist 2008; 13 : 1306–1313.
8. Soerjomataram I, deVries E, Pukkala E et al. Excess of cancers in Europe: a study of eleven major cancers amenble to lifestyle change. Int J Cancer 2007; 120 : 1336–1343.
9. Gandini S, Botteri E, Iodice S et al. Tobaco smoking and cancer: A meta-analysis. Int J Cancer 2008; 122 : 155–164.
10. IARC Working Group on the Evaluation of Carcinogenic Risks to Humans. Tobacco smoke and involuntary smoking. IARC Monogr Eval Carcinog Risks Hum 2004; 83 : 1–1438.
11. Secretan B, Straif K, Baan R et al. WHO International Agency for Research on Cancer Monograph Working Group. A review of human carcinogens – Part E: tobacco, areca nut, alcohol, coal smoke, and salted fish. Lancet Oncology 2009; 10 : 1033–1034.
12. Heeschen C, Jang JJ, Weiss M et al. Nicotine stimulates angiogenesis and promotes tumor growth and atherosclerosis. Nat Med 2001; 7 : 833–839.
13. Davis R, Rizwani W, Banrjee S et al. Nicotine promotes tumor growth and metastasis in mouse models of lung cancer. PLoS One 2009; 4: e7524.
14. Garces YI, Yang P, Parkinson J et al. The relationship between cigarette smoking and quality of life after lung cancer diagnosis. Chest 2004; 126 : 1733–1741.
15. Schuller HM, Plummer HK 3rd, Jull BA. Receptor-mediated effects of nicotine and its nitrosated derivate NNK on pulmonary neuroendocrine cells. Anat Rec A Discov Mol Cell Evol Biol 2003; 270A: 51–58.
16. World Cancer Research Fund/American Institute for Cancer Research: Food, Nutrition, Physical Activity, and the Prevention of Cancer: a Global Perspective. Washington DC: AICR 2007.
17. Kushi LH, Byers T, Doyle C et al. American Cancer Society 2006 Nutrition and Physical Activity Guidelines Advisory Committee. American Cancer Society Guidelines on nutrition and physical activity for cancer prevention: Reducing the risk of cancer with healthy food choices and physical activity. CA Cancer J Clin 2006; 56 : 254–281.
18. Brousset P. Is the Epstein-Barr virus infection relevant in lymphomagenesis? Hum Pathol 2002; 33 : 143–145.
19. Mensinga TT, Speijers GJ, Meulenbelt J. Health implications of exposure to environmental nitrogenous compounds. Toxicol Rev 2003; 22 : 41–51.
20. De Roos AJ, Ward MH, Lynch CF et al. Nitrate in public water supplies and the risk of colon and rectum cancers. Epidemiology 2003; 14 : 640–649.
21. Sandor J, Kiss I, Farkas O et al. Association between gastric cancer mortality and nitrate content of drinking water: ecological study on small area inequalities. Eur J Epidemiol 2001; 17 : 443–447.
22. Türkdoğan MK, Testereci H, Akman N et al. Dietary nitrate and nitrite levels in an endemic upper gastrointestinal (esophageal and gastric) cancer region of Turkey. Turk J Gastroenterol 2003; 14 : 50–53.
23. van Loon AJ, Botterweck AA, Goldbohm RA. Intake of nitrate and nitrite and the risk of gastric cancer: a prospective cohort study. Br J Cancer 1998; 78 : 129–135.
24. Ward MH, Mark SD, Cantor KP et al. Drinking water nitrate and the risk of non-Hodgkin’s lymphoma. Epidemiology 1996; 7 : 465–471.
25. Ward MH, Mark SD, Cantor KP et al. Non-Hodgkin’s lymphoma and nitrate in drinking water. J Epidemiol Community Health 2000; 54 : 772–773.
26. Weyer PJ, Cerhan JR, Kross BC et al. Municipal drinking water nitrate level and cancer risk in older women: the Iowa Women’s Health Study. Epidemiology 2001; 12 : 327–338.
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Internal Medicine

2011 Issue 3
-
All articles in this issue
- Internal medicine and cardiology, internists and cardiologists
- Left ventricular end-systolic wall stress during antihypertensive treatment
- Dyslipidemia and obesity 2011. Similarities and differences
- Autoimmune pancreatitis and IgG-positive sclerosing cholangitis
- The incidence of dyslipidemia in a sample of asymptomatic probands established by the means of Lipoprint system
- External factors catalyzing the development of tumours or providing protection against them
- Does the medicine have its “trendy” diseases?
- A growing problem – human papillomavirus and head and neck cancers
- Microalbuminuria. From diabetes to cardiovascular risk
- The ankle brachial index in type 2 diabetes
- Thrombohaemorrhagic syndrome in patients with a myeloproliferative disease with thrombocythemia
- Residual risk of cardiovascular complications and its reduction with a combination of lipid lowering agents
- A network of comprehensive cancer care centres in the Czech Republic
- Variability in blood pressure and arterial hypertension
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue
- Microalbuminuria. From diabetes to cardiovascular risk
- External factors catalyzing the development of tumours or providing protection against them
- Internal medicine and cardiology, internists and cardiologists
- Left ventricular end-systolic wall stress during antihypertensive treatment
