Současné možnosti chirurgické léčby ložiskového postižení jater a pankreatu
Current trends of surgical therapy of focal liver and pancreatic lesions
Focal liver and pancreatic lesions represent important therapeutic problem in a relatively huge group of patients. Secondary liver tumors are the crucial factor affecting morbidity and mortality in patients with malignancies. Radical surgery is the only therapeutic option that gives the chance of long term survival. The authors present current trends in surgical therapy of liver and pancreatic tumors as a review article.
Key words:
liver – pancreas – tumor – liver resection – pancreatic resection – surgical therapy
Authors:
Z. Šubrt 1,2; A. Ferko 1,2; F. Čečka 1; B. Jon 1
Authors‘ workplace:
Chirurgická klinika Lékařské fakulty UK a FN Hradec Králové, přednosta prof. MUDr. Alexander Ferko, CSc.
1; Katedra válečné chirurgie Fakulta vojenského zdravotnictví Univerzity obrany Brno, vedoucí doc. MUDr. Leo Klein, CSc.
2
Published in:
Vnitř Lék 2011; 57(4): 356-363
Category:
12th national Symposium diabetes, "Diabetes and Gastroenterology", Hradec Kralove, 4 to 5 June 2010
Overview
Ložiskové procesy jater a pankreatu představují v současnosti významný léčebný problém u velké skupiny pacientů. Sekundární nádory jater pak patří mezi hlavní příčiny morbidity a mortality u nemocných s maligním onemocněním. Zásadní léčebnou možností ložiskových procesů jater a pankreatu, která významně zlepšuje šanci na dlouhodobé přežití nemocných, je radikální chirurgické odstranění nádoru. Autoři v přehledné práci prezentují současné trendy v chirurgické léčbě nádorů jater a pankreatu.
Klíčová slova:
játra – slinivka břišní – tumor – resekce jater – resekce pankreatu – chirurgická léčba
Úvod
Nádory jater a pankreatu představují skupinu onemocnění, která zůstávala po dlouhá léta nevyléčitelná. Medicínský pokrok současné doby umožňuje vyléčení části pacientů, nebo alespoň významně zvyšuje šanci na přežití bez známek choroby. Zásadní léčbou ložiskových procesů jater a pankreatu je právě chirurgické odstranění nádoru. Např. medián přežití nemocných po resekci jater pro metastázy kolorektálního karcinomu se pohybuje mezi 30–40 měsíci, zatímco u nemocných léčených pouze chemoterapií dosahuje, i přes využití nejmodernější chemoterapie, 10–20 měsíců [1]. 5leté přežití po kurativní resekci metastáz kolorektálního karcinomu je udáváno v rozmezí 16–48 % [2,3]. Nejlepší prognózu má postižení jater solitární metastázou, při kterém dosahuje 5leté přežívání až 72 % [4,5].
Ultrazvukové vyšetření je dnes široce dostupné a stává se základním rutinním vyšetřením dutiny břišní. Díky vzrůstajícím zkušenostem vyšetřujících a stoupající dokonalosti přístrojového vybavení s vysokou rozlišovací schopností je náhodný záchyt ložiskového postižení jater nebo slinivky břišní stále častější. Diferenciálně-diagnostická úvaha vede primárně k rozlišení benigních lézí od maligních procesů a k rozhodnutí, zda jde o onemocnění vyžadující chirurgickou léčbu. V předoperační diagnostice se dnes uplatňuje řada zobrazovacích vyšetření, jako je výpočetní tomografie (CT), magnetická rezonance (MRI či MRCP), pozitronová emisní tomografie (PET, PET/CT) nebo endoskopická retrográdní cholangiopankreatografie (ERCP). V nejasných případech, kdy nelze spolehlivě posoudit biologickou povahu procesu, je zásadní diagnostickou možností perkutánní nebo endosonografická cílená biopsie [6].
Ložiskové procesy jater
Benigní jaterní léze se vyskytují velmi zřídka. Nejčastějším benigním tumorem jater je kavernózní hemangiom a k dalším častěji se vyskytujícím solidním tumorům patří fokální nodulární hyperplazie (FNH) a jaterní adenom. Znalost benigních tumorů je důležitá zejména z pohledu diferenciální diagnostiky incidentálně zachycených ložiskových procesů jater a odlišení malignity. Jaterní hemangiom je relativně častým nálezem ve zdravé populaci, jeho výskyt se na základě pitevních nálezů pohybuje kolem 0,4–7,3 % [7]. Většinou jde o malé asymptomatické léze nevyžadující chirurgickou léčbu. Maligní degenerace nebyla popisována. Riziko masivního krvácení je rovněž zanedbatelné [7]. K chirurgické léčbě by měli být indikováni nemocní se symptomatickým nálezem nebo stavy, kdy dochází k nárůstu velikosti hemangiomu [8].
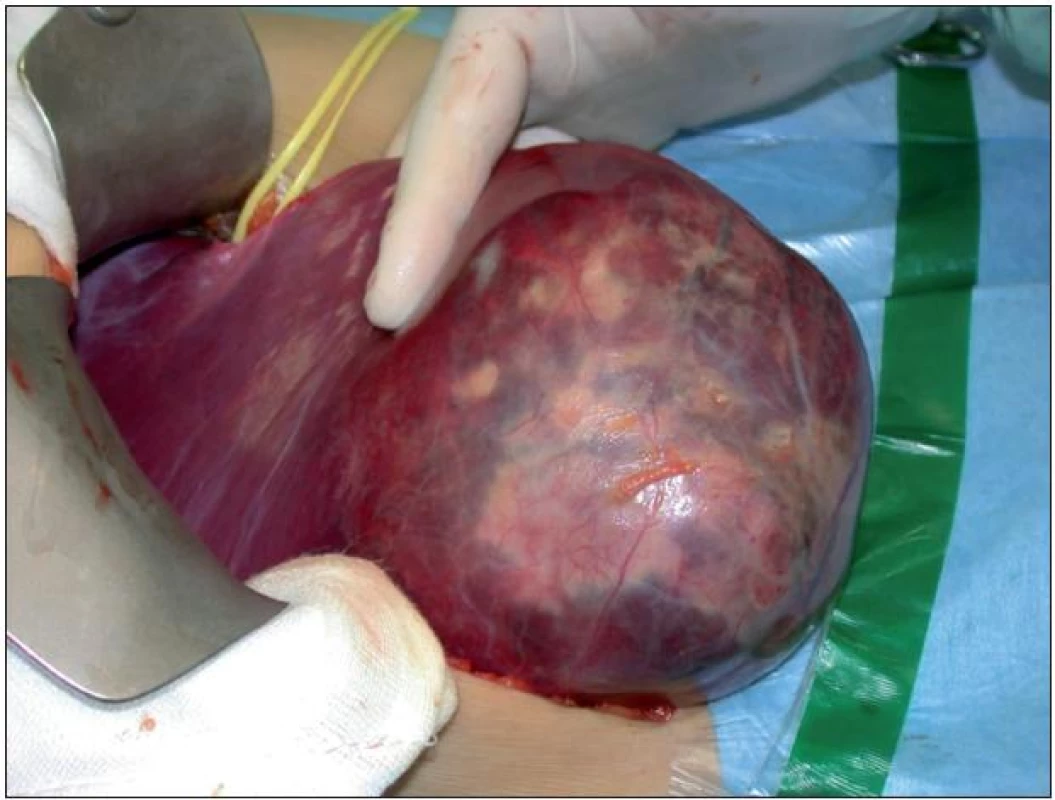
Problematika indikace resekce jater pro jaterní adenom a fokální nodulární hyperplazii (FNH) zůstává dosud neujasněna, zejména u nemocných s anamnézou hormonální léčby, nejčastěji hormonální antikoncepcí. Zásadní zůstává odlišení od maligního tumoru, které lze provést nejčastěji na základě zobrazovacích vyšetření, event. cílené jaterní biopsie. Prvním terapeutickým opatřením je bezprostřední ukončení hormonální léčby a následná dispenzarizace v 3–6měsíčních intervalech. Případy spontánního vymizení jaterních adenomů i FNH byly popsány po vysazení hormonální léčby [9,10]. Jiní autoři primárně doporučují chirurgické řešení, zejména u adenomů o průměru nad 5 cm, které jsou spojeny s vyšším rizikem spontánní ruptury s intraperitoneálním krvácením (obr. 1) nebo rizikem malignizace [1,6–8]. Dle našeho názoru by měly být k jaterní resekci indikovány všechny symptomatické nálezy a jaterní adenomy velikosti nad 5 cm. Vícečetné jaterní adenomy, tzv. adenomatóza, pak mohou být i velmi raritní indikací k transplantaci jater v případě neresekabilního postižení [11].
V centru zájmu jaterní chirurgie stojí v současnosti především léčba maligních ložiskových procesů jater. Malignity jater představují momentálně významný léčebný problém u velké skupiny pacientů a patří mezi hlavní příčiny morbidity a mortality u nemocných s neoplastickým onemocněním [5].
Z primárních nádorů jater převažuje hepatocelulární karcinom (HCC), který představuje 90 % všech primárních nádorů jater. Méně se pak vyskytuje cholangiokarcinom jater vycházející z intrahepatálních žlučových cest. Vzácné jsou primární mezenchymální nádory a primární neuroendokrinní nádory jater. Incidence HCC je ve vyspělých státech relativně nízká, v České republice představuje 4–4,5 případu na 100 000 obyvatel ročně [12]. HCC vzniká většinou (80 %) v terénu jaterní cirhózy. Výskyt má však vzrůstající tendenci, pravděpodobně v důsledku šíření infekcí virem hepatitidy B a C. V našich podmínkách vzniká HCC nejčastěji v terénu toxickonutritivní cirhózy, vzácně pak na podkladě hemochromatózy. Zcela novou klinickou jednotkou, spojenou se zvýšeným výskytem HCC, je nealkoholická steatohepatitida (NASH), která může být zjištěna u obézních pacientů s diabetem a nadměrným kalorickým příjmem [5].
Naproti tomu představují v Evropě sekundární jaterní nádory 90 % všech jaterních malignit [3,5]. Z pohledu indikace k resekci jater lze rozdělit metastázy na skupinu kolorektálních a neuroendokrinních, které jsou typicky indikovány k radikální chirurgické léčbě. Další skupinou jsou pak ne-kolorektální, ne-endokrinní metastázy, které jsou indikovány jen výběrově na základě zhodnocení primárního tumoru, zejména jeho etiologické a biologické povahy [3,5]. Jako tzv. „často vhodné“ jsou uváděny metastázy gastrointestinálních stromálních tumorů (GIST) nebo uveálního melanomu. Ke skupině tzv. „méně vhodných“ patří metastázy karcinomu ledviny, prsu, štítné žlázy nebo kožního maligního melanomu. Metastázy karcinomu plic, pankreatu, žaludku, jícnu, prostaty a ovaria jsou pak považovány za nevhodné k resekci jater a metastatické postižení jater tímto tumorem je považováno za systémovou diseminaci choroby [13]. V České republice dominuje postižení jater kolorektálním karcinomem, dále karcinomem plic, prsu, žaludku a slinivky. Přibližně u 50–60 % pacientů s onemocněním kolorektálním karcinomem se v průběhu choroby vytváří jaterní metastázy [14]. U více než čtvrtiny pacientů je jaterní parenchym, vzhledem k unikátnímu zásobení jater portální žílou, jediným místem postiženým metastatickým procesem [1].
Současné možnosti chirurgické léčby
Resekce jater je metodou první volby u nemocných s maligními nádory jater, která jako jediná nabízí nemocným nejvyšší šanci na dlouhodobé přežití. Části pacientů s neresekabilním postižením lze pak nabídnou celou řadu miniinvazivních technik, které jsou založeny na principu ničení nádorové tkáně s okolním lemem zdravého jaterního parenchymu. Mluvíme o tzv. destrukčních technikách, které jsou založeny buď na fyzikálních metodách aplikace chladu – kryodestrukce, tepla – radiofrekvenční ablace (RFA), mikrovlnné koagulace, laserové koagulace či vysokofrekvenčního ultrazvuku (HIFU) anebo na chemických metodách aplikace koncentrovaného alkoholu – alkoholizace, kyseliny octové apod. Metody transarteriální selektivní embolizace, chemoembolizace či intraarteriální chemoterapie jsou v současné době doménou intervenčních radiologů. Je ale nezbytné připomenut, že všechny tyto techniky patří do komplexní péče o nemocné s ložiskovým postižením jater a měly by být prováděny na specializovaných pracovištích s vysokým počtem jaterních výkonů, která jsou vybavena aktuálními vyspělými technickými možnostmi a disponují kvalitním multidisciplinálním zajištěním ze strany chirurga, anesteziologa, intenzivisty, gastroenterologa, onkologa a radiodiagnostika nebo intervenčního radiologa [3,5].
Technika jaterních resekcí zaznamenala v posledních letech obrovský pokrok zejména díky moderním technologiím. Letalita velkých jaterních resekcí nedosahuje v současnosti ani 5 % a na specializovaných pracovištích se pohybuje kolem 1 % [8]. Původní klasické techniky využívající k přerušení jaterního parenchymu drcení tkáně pomocí prstů, tzv. „digito-klazie“ neboli „finger fracture“ technika, nebo peánů, tzv. „kelly-klazie“, jsou dnes nahrazeny metodami označovanými jako „high-tech“ digitoklazie, které jsou založeny např. na ultrazvuku (CUSA) nebo proudu vody (water-jet) [15–17]. Cílem těchto technik je přerušení parenchymu se zachováním cévních struktur a žlučovodů, které jsou pak selektivně ligovány nebo klipovány. K pokročilým technologiím v jaterní chirurgii patří i harmonický skalpel, argonová plazmakoagulace, „tissue link“ technika nebo radiofrekvenčně asistovaná technika transekce jaterního parenchymu. Všechny tyto techniky mají své výhody i nevýhody a v současné době neexistuje jediná technika, která by byla nadřazena ostatním [18–20].
V posledních letech dochází k rozvoji laparoskopického operování i v oblasti jater. Laparoskopické resekce jater pronikají do jaterní chirurgie už počátkem 90. let minulého století. V roce 1992 publikoval Gagner [21] zprávu o první neanatomické resekci jater, v roce 1996 pak byla provedena první anatomická resekce jater, levostranná lobektomie [22]. Pokrok v úrovni laparoskopických operací jater je dán do jisté míry i zlepšením a vývojem nových laparoskopických nástrojů, rozvojem nových technologií, jako je HDTV zobrazení, zdokonalení možnosti provést laparoskopický ultrazvuk, technické vylepšení endostaplerů nebo nové elektrokoagulační techniky v podobě harmonického skalpelu nebo bipolární technologie. Laparoskopické resekce jater jsou nyní spojeny s rychlejším zotavením operovaných, kratší dobou hospitalizace a konečně i s nižším výskytem pooperační morbidity a letality. Ačkoli mnohé klinické studie ukazují, že krátkodobé výsledky laparoskopických a otevřených resekcí jater jsou srovnatelné, zůstávají dosud nejasné dlouhodobé výsledky léčby u jaterních malignit [23].
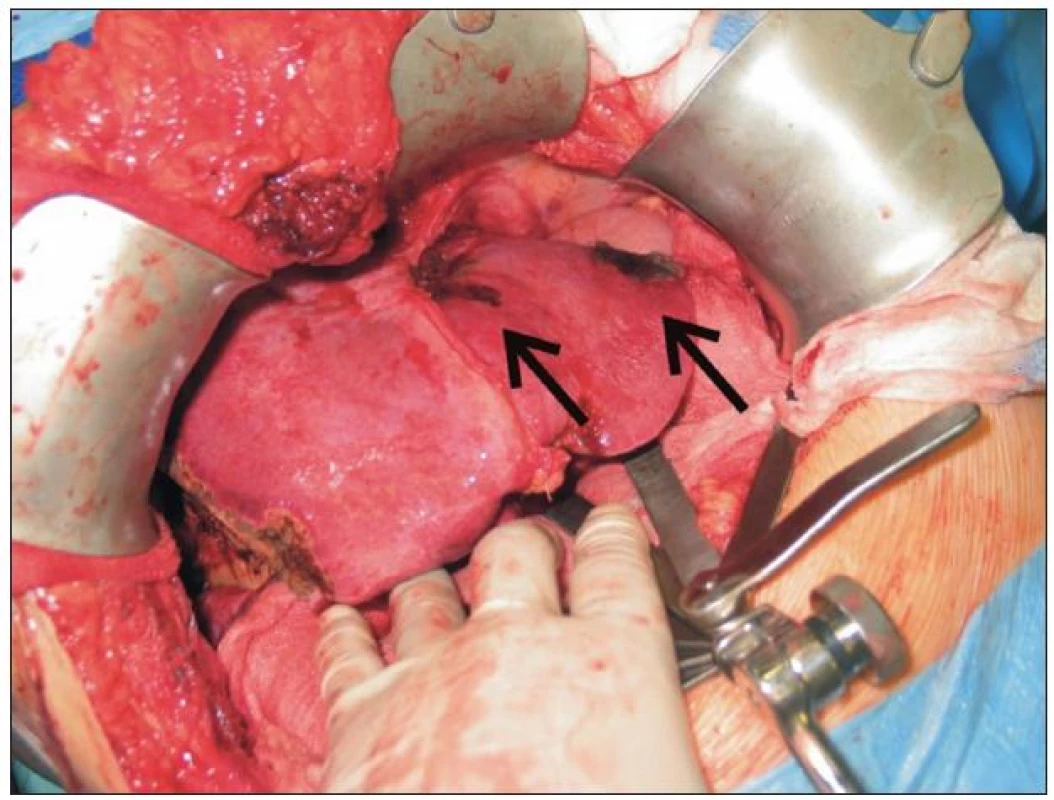
Výběr vlastní techniky resekce je vždy nutné provádět s ohledem na celkový stav nemocného, velikost, lokalizaci a počet ložisek v játrech, zbytkový objem tkáně po resekci a zbytkovou funkční kapacitu jaterní tkáně. Některými autory jsou preferovány tzv. parenchym šetřící techniky, ke kterým patří především neanatomické resekce a segmentektomie. Důvodem je nižší operační zátěž a zachování maxima zdravého jaterního parenchymu z hlediska možných opakovaných výkonů pro recidivu nádoru. I onkologické výsledky tohoto přístupu jsou srovnatelné s velkými resekcemi jater [24]. Velké jaterní resekce, tedy resekce 3 a více jaterních segmentů, jako jsou hemihepatektomie, rozšířené hemihepatektomie nebo centrální resekce, mají v jaterní chirurgii stále pevné postavení (obr. 2). Jsou indikovány především u velkých nádorů, mnohočetného postižení nebo nádorů v blízkosti velkých cév a žlučovodů. Základním snahou u všech resekčních výkonů je dosažení adekvátní onkologické radikality, tzv. R0 výkonu, tedy mikroskopicky negativního resekčního okraje. Dlouho přijímané dogma o tom, že bezpečný lem zdravé tkáně přesahuje velikost 1 cm, je v současné době opouštěno a jako dostatečný výkon je některými autory považován jakýkoli mikroskopicky negativní okraj [25]. R0 resekce zabezpečí nejlepší prognózu a nejdelší dlouhodobé přežití nemocných [26].
Celosvětovým problémem zůstává nízká resekabilita. Jen u 15–20 % nemocných jsou maligní nádory jater v době stanovení diagnózy radikálně resekabilní [14,27]. Neresekabilita je dána velikostí ložiska, počtem uzlů, nevhodnou lokalizací a interní komorbiditou pacienta neschopného podstoupit resekční výkon na játrech [28,29]. Naopak, extrahepatální šíření již není v současné době absolutní kontraindikací jaterní resekce. K jaterní resekci jsou v dnešní době indikováni pacienti s resekabilními plicními metastázami nebo chirurgicky odstranitelnými metastázami v dutině břišní (v případě kolorektálního karcinomu). Také postižení uzlin hepatoduodenálního ligamenta již není absolutní kontraindikací jaterní resekce [1]. Řešením iniciálně nízké resekability jaterních metastáz je použití tzv. etapových výkonů nebo neoadjuvantní chemoterapie. Etapové výkony využívají kombinace resekčních výkonů s miniinvazivními postupy a radiodiagnostickými metodami [5,28]. Pro zvýšení objemu jaterní tkáně před odstraněním nádoru je možno provést předoperační embolizaci portální žíly (PVE) na straně nádoru. PVE způsobuje ischemizaci vyživované oblasti jater portální krví a kompenzatorní zvýšení toku krve do druhostranného řečiště s hypertrofií reziduálního jaterního parenchymu. K hypertrofii jaterní tkáně dochází zpravidla po 4–6 týdnech. Poté je možné provést resekci jater na straně embolizace [5]. Další možností redukce nádorové hmoty v játrech jsou, při postižení obou laloků jater nádorovým procesem, miniinvazivní postupy, vedoucí k likvidaci ložisek nádoru v jednom laloku, se současnou PVE druhého laloku. Jinou možností v případě bilobárního postižení jater je postupná resekce jaterního parenchymu postiženého nádorovým procesem, tzv. „two-stage hepatectomy“. Tyto etapové výkony je také možné kombinovat s embolizací portální žíly nebo destrukčními technikami [5,30]. Cílem neoadjuvantní systémové nebo lokoregionální chemoterapie před vlastní resekcí nádoru jater je redukce objemu nádorové masy. Tento tzv. „down-staging“ a „down-sizing“ může technicky umožnit resekci původně inoperabilního nádoru. Neoadjuvantní chemoterapii lze samozřejmě kombinovat s předoperační embolizací portální žíly nebo etapovými postupy. Problémem tohoto postupu je, že neoadjuvantní chemoterapie způsobuje steatózu až steatohepatitidu jater (CASH), snižuje regeneraci jaterní tkáně, a tak zvyšuje pooperační morbiditu nemocných [1]. Použitím kombinovaných a etapových výkonů lze zvýšit resekabilitu až o dalších 30 % [1,3,5].
Až u 60 % nemocných se v různém časovém odstupu po primární jaterní resekci rozvíjí recidiva nádoru v játrech. Podle literárních údajů se až 85 % recidiv objevuje v prvních 30 měsících po výkonu. Při včasném záchytu recidivy nádoru lze provést opakované reresekce nebo ablační techniky, které značně prodlouží dobu přežití. Pětileté přežití u nemocných po reresekcích jater dosahuje až výše 30–35 %. Důležitým faktem je, že morbidita a letalita těchto reresekcí je srovnatelná s primárními výkony na játrech [24].
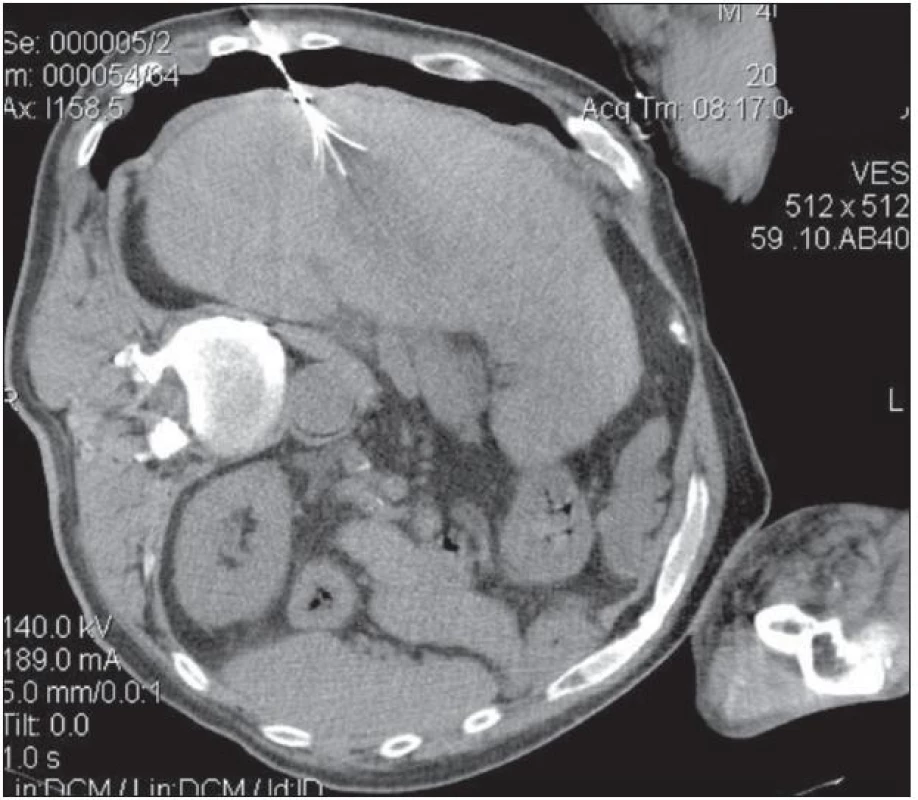
Z miniinvazivních technik je v současné době nejvíce používána radiofrekvenční ablace (RFA). Základním principem metody RFA je aplikace vysokofrekvenčního střídavého proudu o frekvencích v rozsahu 200 až 1 000 kHz, který vede k zahřívání tkáně. Při radiofrekvenční termické koagulaci dosahují teploty v ložisku hodnot od 60 do 120 °C, v závislosti na typu systému. RFA může být indikována samostatně jako primární výkon u pacientů s neresekabilním postižením jater. Možná je i kombinace s resekčním výkonem na játrech. Literární zdroje uvádějí, že až u 20–38 % pacientů jsou v průběhu resekčního výkonu nalezena další ložiska, která zásadním způsobem ovlivňují, nebo dokonce znemožňují plánovaný resekční výkon. V případě bilobárního postižení lze kombinovat resekci jednoho laloku s radiofrekvenční destrukcí ložisek v kontralaterálním laloku. Další možností využití RFA jsou případy incidentálního nálezu jaterní metastázy v průběhu primární extrahepatální resekce. K dosažení kurabilního výkonu v jedné době lze ložisko ošetřit pomocí RFA. Jako příklad uveďme kombinaci resekce tračníku nebo rekta a nálezu jaterní metastázy v průběhu operačního výkonu. Jaterní resekce takto zjištěného a ošetřeného ložiska může být provedena v druhé době po přípravě pacienta [31–33]. Na některých pracovištích je možnou indikací provedení RFA ložisek HCC u pacientů čekajících na vhodného dárce před elektivní transplantací jater jako tzv. „bridging“ metoda. Cílem je v tomto případě kontrola tumoru a odvrácení progrese velikosti tumoru, která by vedla ke kontraindikaci vlastní transplantace [34,35]. Nevyjasněná stále zůstávají indikační kritéria týkající se počtu a velikosti nádorových ložisek v jaterním parenchymu. Někteří autoři doporučují jako kritérium k léčbě RFA maximální počet 5 ložisek o průměru do 5 cm [36]. Jiní autoři se vyhýbají stanovení jasných kritérií, i když je velikost a počet ložisek prediktivním faktorem rekurence nádoru a horšího přežívání [37,38]. Stoupající agresivita léčby pacientů s jaterními malignitami smazává v rámci multimodálního přístupu v posledních letech postupně hranice počtu a velikosti nádorových ložisek. Zásadní předností RFA je, že může být aplikována miniinvazivně perkutánně pod kontrolou zobrazovacích metod (obr. 3), laparoskopicky asistovaně nebo při otevřeném chirurgickém výkonu, kdy je dosahováno nejlepších výsledků ve smyslu minimalizace recidiv tumoru a dosažení dlouhodobého přežití. Miniinvazivní ablační techniku lze úspěšně opakovaně aplikovat za účelem destrukce nádorových ložisek s možností dlouhodobé kontroly choroby. Problémem zůstává ponechání zbytku nádorové hmoty v ložisku ošetřeném RFA, tzv. non-ablace, která je příčinou časných recidiv po proceduře. Podle publikovaných studií se morbidita spojená s RFA pohybuje pod 10 % a letalita mezi 0–1 %. Mezi nejčastější lokální komplikace přímo související s RFA patří krvácení, které většinou spontánně ustává a jen zřídka vyžaduje operační revizi. Mezi závažné komplikace patří nitrojaterní absces nebo biliom, který se vyskytuje po RFA velkých centrálně uložených tumorů v blízkosti jaterního hilu. Termické poškození okolních struktur může vést k perforaci bránice nebo dutého orgánu s následnou peritonitidou [39].
K transplantaci jater jsou v současné době indikováni nemocní s primárními tumory jater. Základní indikací je především hepatocelulární karcinom. Transplantace jater kvůli cholangiokarcinomu je dnes velmi diskutována a není standardně prováděna. V případě HCC v cirhotických játrech řeší transplantace oba problémy, odstraňuje nádor a zároveň postižená játra, která jsou prekancerózním terénem. Malý počet dárcovských orgánů a iniciálně špatné výsledky v přežití v porovnání s jinými indikacemi transplantace postupně vedly k vytvoření indikačních kritérií. Dodnes jsou celosvětově přijímána Milánská kritéria profesora Mazzaferra, která stanoví jako indikaci jeden uzel do 5 cm nebo tři tumory do 3 cm bez makrovaskulární invaze. V posledních letech se objevují práce rozšiřující kritéria pro transplantaci. Existují tzv. UCSF (University of California San Francisco) expandovaná kritéria nebo kritéria up-to--seven. Nicméně čím více jsou kritéria expandována, tím horší jsou výsledky z hlediska dlouhodobého přežití nemocných [6].
Nádory pankreatu a možnosti chirurgické léčby
Nejčastějším nádorem pankreatu je duktální adenokarcinom, který tvoří 90 % všech tumorů pankreatu. Zbylých 10 % představují cystické nádory, neuroendokrinní tumory, lymfomy a metastázy nádorů [40]. K chirurgické léčbě jsou nejčastěji indikováni nemocní s duktálním adenokarcinomem a neuroendokrinními nádory pankreatu. Radikální chirurgická resekce je jediná potenciálně kurativní metoda léčby těchto tumorů. Vzácně jsou k chirurgické léčbě indikovány metastázy nádorů jiné primární lokalizace. V takových případech jde nejčastěji o solitární metastázy Grawitzova tumoru ledviny, které se mohou objevit ve velmi dlouhém intervalu od operace primárního tumoru [41]. Relativně novou skupinou indikovanou k chirurgickému řešení jsou cystické nádory pankreatu tvořící 1–5 % tumorů pankreatu. Podíl jejich záchytu v posledních letech s rozvojem zobrazovacích metod stoupá. Zásadním problémem diferenciální diagnostiky je rozlišení benigních seriózních cystických tumorů od potenciálně maligních mucinózních tumorů – intraduktální papilární mucinózní neoplazie (IPMN) a mucinózní cystické neoplazie (MCN), které by měly být indikovány k radikální chirurgické léčbě [40].
Pooperační letalita výkonů na slinivce se v současné době pohybuje do 5 % [40]. Podobně jako u jaterních malignit by měly být výkony na slinivce prováděny ve specializovaných centrech, kde jsou prokázány lepší výsledky – vyšší resekabilita nádoru, nižší pooperační morbidita, letalita a dlouhodobé výsledky ve smyslu dlouhodobého přežití [42]. Problémem je opět nízká resekabilita, která se pohybuje kolem 20 %. Neresekabilita nádorů je dána lokálním prorůstáním nádoru do horních mezenterických cév, jaterní tepny, metastatickým postižením jater nebo diseminací po peritoneu. Při limitovaném prorůstání nádoru do horní mezenterické žíly je možná resekce nádoru spolu s resekcí žíly a vaskulární rekonstrukcí. Resekční výkony s cévní rekonstrukcí v případě infiltrace tepenných struktur podle některých autorů nepřináší šanci dlouhodobého přežití [43]. Podobně neprodlužuje přežití ani extenzivní lymfadenektomie [44].
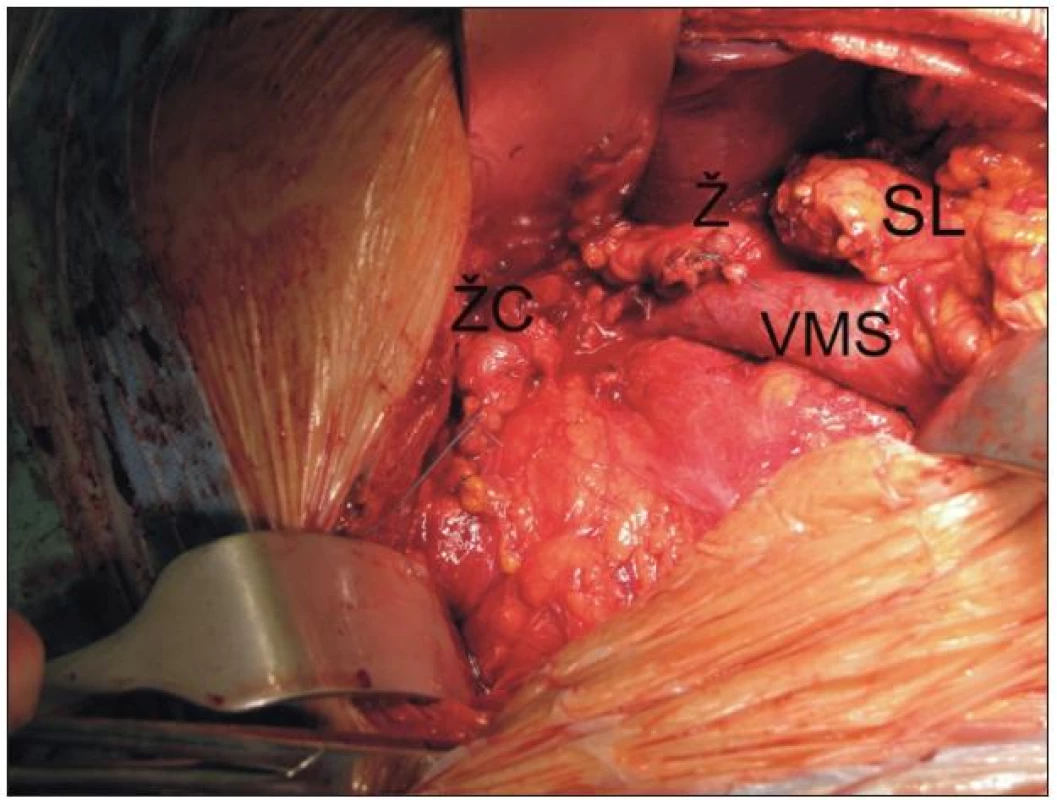
Pro nádory hlavy slinivky, Vaterské papily a distální části žlučových cest je indikována parciální duodenopankreatektomie podle Whippla (obr. 4). Pylorus šetřící modifikace podle Traverso-Longmira byla poprvé popsána v roce 1978. Oba výkony jsou srovnatelné, co se týče pooperační morbidity a letality nebo dlouhodobého přežití. Klasická Whipplova operace má nižší incidenci zpomaleného vyprazdňování žaludku, modifikace dle Traverso-Longmira je na druhou stranu podle některých autorů spojována s větším nárůstem hmotnosti pacientů po operaci a vyšší kvalitou života [45]. Pro karcinomy těla a kaudy slinivky je indikována levostranná resekce se splenektomií. V případě neuroendokrinního tumoru či cystického tumoru je preferován výkon s ponecháním sleziny. Totální duodenopankreatektomie (TDPE) je indikována pro multifokální nádor zasahující hlavu i tělo nebo ocas, nebo v případě, že při DPE je pozitivní resekční linie v krčku. Odstranění celé slinivky však nedosáhne větší radikality a prodloužení přežití v porovnání se standardní DPE. Navíc dochází při odstranění celé slinivky ke vzniku obtížně kompenzovatelného sekundárního diabetu. V případě cystických nebo neuroendokrinních tumorů je možné provádět limitované výkony, jako jsou centrální resekce nebo prosté enukleace [40,46].
Pokud je při laparotomii zjištěn neresekabilní nádor, pak je indikována paliativní operace, jejímž cílem je zmírnit symptomy onemocnění a zlepšit kvalitu života. Paliativní chirurgická léčba zahrnuje spojkové operace – gastroenteroanastomózu, biliodigestivní spojku nebo splanchnikektomii. Pokud je neresekabilní nádor zjištěn již v diagnostickém procesu před provedením laparotomie, pak je v současné době možná paliativní endoskopická nebo radiologická intervence [29,47,48]. Pokud není jasná kontraindikace resekce, jako je rozsáhlé metastatické postižení jater nebo prokázaná diseminace po peritoneu, pak někteří autoři v poslední době preferují chirurgickou exploraci a event. chirurgický paliativní výkon [49]. Hlavním důvodem je, že o resekabilitě nádoru je možné definitivně rozhodnout až při chirurgické exploraci. Dalším důvodem je možnost chirurgického provedení paliativních výkonů, čímž odpadá hlavní nevýhoda endoskopické paliace s nutností výměny endoskopicky zavedených stentů při jejich obstrukci [50]. Při volbě paliativního postupu je nutné individuálně zvážit všechny faktory včetně celkového stavu pacienta a předpokládané délky přežití.
Podobně jako v chirurgii jater dochází v posledních letech i k rozvoji laparoskopického operování na slinivce. Iniciálně byly prováděny jednodušší výkony jako laparoskopické enukleace tumorů s následnými levostrannými resekcemi bez splenektomie i s ní. V roce 1992 byla publikována zpráva o první laparoskopické duodenopankreatektomii. Standardními výkony jsou v současné době především enukleace a levostranné resekce pankreatu. V případě laparoskopické duodenopankreatektomie, která představuje složitý komplexní laparoskopický výkon zejména v rekonstrukční fázi, jde zatím jen o malé skupiny pacientů nebo kazuistická sdělení. Podle výsledků klinických studií jsou laparoskopické resekce spojeny s rychlejší rekonvalescencí a kratší dobou hospitalizace. Výskyt pooperační morbidity a letality je u otevřených i laparoskopických výkonů srovnatelný, včetně výskytu nejzávažnější komplikace, jakou je pankreatická píštěl. Dosud ale probíhá diskuze o tom, zda mají být laparoskopicky operováni nemocní s maligními nádory slinivky [51].
Práce byla podpořena výzkumným záměrem Ministerstva zdravotnictví České republiky MZO 00179906 a výzkumným záměrem Fakulty vojenského zdravotnictví UO MOO FVZ0000503.
MUDr. Zdeněk Šubrt, Ph.D.
www.lfhk.cuni.cz
e-mail: subrt@email.cz
Doručeno do redakce: 29. 10. 2010
Sources
1. Skalický T, Třeška V, Šnajdauf J. Chirurgie jater. Praha: Maxdorf 2005.
2. Are C, Gonen M, Zazzali K et al. The impact of margins on outcome after hepatic resection for colorectal metastasis. Ann Surg 2007; 246: 295–300.
3. Poston GS, Blumgart LH (eds). Surgical management of hepatobiliary and pancreatic disorders. London: Martin Dunitz 2003.
4. Aloia TA, Vauthey JN, Leyer EM et al. Solitary colorectal liver metastasis: resection determines outcome. Arch Surg 2006; 141: 460–467.
5. Válek V, Kala Z, Kiss I et al. Maligní ložiskové procesy jater. Diagnostika a léčba včetně minimálně invazivních metod. 1. vyd. Praha: Grada Publishing 2006.
6. Ehrmann J, Hůlek P et al. Hepatologie. Praha: Grada Publishing 2010.
7. Terblanche J. Surgery of liver tumors. HPB Surg 1989; 1: 173–184.
8. Tanabe KK. The past 60 years in liver surgery. Cancer 2008; 113 (Suppl 7): 1888–1896.
9. Kapp N, Curtis KM. Hormonal contraceptive use aminy women with liver tumors: a systematic review. Contraception 2009; 80: 387–390.
10. Buell JF, Tranchart H, Canon R et al. Management of benign hepatic tumors. Surg Clin North Am 2010; 90: 719–735.
11. Di Sandro S, Slim AO, Lauterio A et al. Liver adenomatosis: a rare indication for living donor liver transplantation. Transplant Proc 2009; 41: 1375–1377.
12. ÚZIS ČR. Novotvary 2004. Praha: ÚZIS ČR 2007.
13. Fraker DL, Soulen M. Regional therapy of hepatic metastase. Hematol Oncol Clin North Am 2002; 16: 947–967.
14. Manfredi S, Lepage C, Hatem C et al. Epidemiology and management of liver metastases from colorectal cancer. Ann Surg 2006; 244: 254–259.
15. Aloia TA, Zorzi D, Abdalla E et al. Two--surgeon technique for hepatic parenchymal transection of the non-cirrhotic liver using saline-linked cautery and ultrasonic dissection. Ann Surg 2005; 242: 172–177.
16. Takayama T, Makuuchi M, Kubota K et al. Randomized comparison of ultrasonic vs clamp transection of the liver. Arch Surg 2001; 136: 922–928.
17. Rau HG, Wichmann MW, Schinkel S et al. Wasserstrahldissektion bei Leberresektion: Ultraschallaspirator versus Jet-Cutter. Eine prospektiv randomisierte studie. Zentralbl Chir 2001; 126: 586–590.
18. Lupo L, Gallerani A, Panzera P et al. Randomized Clinical Trial of Radiofrequency-Assisted Versus Clamp-Crushing Liver Resection. Br J Surg 2007; 94: 287–291.
19. Castaldo ET, Earl TM, Chari RS et al. A Clinical Comparative Analysis of Crush/Clamp, Stapler, and Dissecting Sealer Hepatic Transection Methods. HPB 2008; 10: 321–326.
20. Lesurtel M, Selzner M, Petrowsky H et al. How Should Transection of the Liver Be Performed?: a Prospective Randomized Study in 100 Consecutive Patients: Comparing Four Different Transection Strategies. Ann Surg 2005; 242: 814–823.
21. Lee KF, Cheung YS, Chong CN et al. Laparoscopic versus open hepatectomy for liver tumours: a case control study. Hong Kong Med J 2007; 13: 442–448.
22. Gigot JF, Glineur D, Santiago Azagra J et al. Hepatobiliary and Pancreatic Section of the Royal Belgian Society of Surgery and the Belgian Group for Endoscopic Surgery. Laparoscopic liver resection for malignant liver tumors: preliminary results of a multicenter European study. Ann Surg 2002; 236: 90–97.
23. Mala T, Edwin B, Rosseland AR et al. Laparoscopic liver resection: experience of 53 procedures at a single center. J Hepatobiliary Pancreat Surg 2005; 12: 298–303.
24. Třeška V. Technika jaterních resekcí – současné možnosti. Rozhl Chir 2007; 86: 335–336.
25. Poultsides GA, Schulick RD, Pawlik TM. Hepatic resection for colorectal metastates: the impact of surgical margin status on outcome. HPB 2010; 12: 43–49.
26. Nuzzo G, Giuliante F, Ardito F et al. Influence of surgical margin on type of recurrence after liver resection for colorectal metastases: a single-center experience. Surgery 2008; 143: 384–393.
27. Sjövall A, Järv V, Blomqvis L et al. The potential for improved outcome in patients with hepatic metastases from colon cancer: a population-based study. Eur J Surg Oncol 2004; 30: 834–841.
28. Adam R. Developing strategies for liver metastases from colorectal cancer. Sem Oncol 2007; 34 (2 Suppl 1): 7–11.
29. Liu LX, Zhang WH, Juany HC. Current treatment for liver metastases from colorectal cancer. World J Gastroenterol 2003; 9: 193–200.
30. Jaeck D, Oussoulztzoglou E, Rosso E et al. A two-stage hepatectomy procedure combined with portal vein embolization to achieve curative resection for initially unresectable multiple and bilobar colorectal liver metastases. Ann Surg 2004; 240: 1037–1051.
31. Berber E, Senagore A, Remzi F et al. Laparoscopic radiofrequency ablation of liver tumors combined with colorectal procedures. Surg Laparosc Endosc Percutan Tech 2004; 14: 186–190.
32. Curley SA. Radiofrequency ablation of malignant liver tumors. Oncologist 2001; 6: 14–23.
33. Curley SA, Izzo F, Delrio P et al. Radiofrequency ablation of unresectable primary and metastatic hepatic malignancies: results in 123 patients. Ann Surg 1999; 230: 1–8.
34. Mazzaferro V, Battiston C, Perrone S et al. Radiofrequency ablation of small hepatocellular carcinoma in cirrhotic patients awaiting liver transplantation: a prospective study. Ann Surg 2004; 240: 900–909.
35. Pulvirenti A, Garbagnati F, Regalia E et al. Experience with radiofrequency ablation of small hepatocellular carcinomas before liver transplantation. Transplant Proc 2001; 33: 1516–1517.
36. McGahan JP. Radiofrequency ablation for hepatocellular carcinoma. J Am Coll Surg 2004; 198: 853–855.
37. Abdalla EK, Vaulthey JN, Ellis LM et al. Recurrence and outcomes following hepatic resection, radiofrequency ablation, and combined resection/ablation for colorectal liver metastases. Ann Surg 2004; 239: 818–827.
38. Bleicher RJ, Allegro DP, Nora DT et al. Radiofrequency ablation in 447 complex unresectable liver tumors: lessons learned. Ann Surg Oncol 2003; 10: 52–58.
39. Wood TF, Rose DM, Chung M et al. Radiofrequency ablation of 231 unresectable hepatic tumors: indications, limitations, and complications. Ann Surg Oncol 2000; 7: 593–600.
40. Kala Z, Kiss I, Válek V et al. Nádory podjaterní oblasti. Praha: Grada Publishing 2010.
41. Čečka F, Jon B, Hatlová J et al. Renal cell carcinoma metastatic to the pankreas: a single center experience. Hepatogastroenterology 2009; 56: 1529–1532.
42. Joseph B, Morton J, Hernandez-Boussard MT et al. Relationship between hospital volume, system clinical resources, and mortality in pancreatic resection. J Am Coll Surg 2009; 208: 520–527.
43. Yekebas EF, Bogoevski D, Cataldegirmen G et al. En bloc vascular resection for locally advanced pancreatic malignancies infiltrating major blood vessels: perioperative outcome and long-term survival in 136 patients. Ann Surg 2008; 247: 300–309.
44. Riall TS, Cameron JL, Lillemoe KD et al. Pancreaticoduodenectomy with or without distal gastrectomy and extended retroperitoneal lymphadenectomy for periampullary adenocarcinoma – part 3: update on 5-year survival. J Gastrointest Surg 2005; 9: 191–1204.
45. Diener MK, Knaebel HP, Heukaufer C. A systematic review and meta-analysis of pylorus-preserving versus classical pancreaticoduodenectomy for surgical treatment of periampullary and pancreatic carcinoma. Ann Surg 2007; 245: 187–200.
46. Kleeff J, Diener MK, Z’graggen K et al. Distal pancreatectomy: risk factors for surgical failure in 302 consecutive cases. Ann Surg 2007; 245: 573–582.
47. Andtbacka RH, Evans DB, Pisters PW. Surgical and endoscopic palliation for pancreatic cancer. Minerva Chir 2004; 59: 123–136.
48. Bradley EL 3rd, Bem J. Nerve blocks and neuroablative surgery for chronic pancreatitis. World J Surg 2003; 27: 1241–1248.
49. Smith AC, Dowsett JF, Russell RC et al. Randomised trial of endoscopic stenting versus surgical bypass in malignant low bile duct obstruction. Lancet 1994; 344: 1655–1660.
50. Köninger J, Wente MN, Müller MW et al. Surgical palliation in patients with pancreatic cancer. Langenbecks Arch Surg 2007; 392: 13–21.
51. Takaori K, Tanigawa N. Laparoscopic pancreatic resection: the past, present, and future. Surg Today 2007; 37: 535–545.
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Internal Medicine

2011 Issue 4
Most read in this issue
- Xerostomie, hyposialie, sicca syndrom – kvantitativní poruchy salivace
- Léčba diabetes mellitus 2. typu GLP-1 agonisty
- Autonomní neuropatie gastrointestinálního traktu
- Diabetes mellitus a jaterní cirhóza
