Inkretinové hormony
Incretin hormones
Incretin hormones are peptides that are secreted from endocrine cell of gastrointestinal tract after nutrient ingestion and stimulate insulin secretion. Glucosodependent Insulinotropic Peptide – GIP is released from K-cells of duodenum and proximal jejunum, recently GIP synthesis has been proved in pancreatic α cells. Besides the incretin effect causes GIP increased lipogenesis and decreased lipolysis in fat tissue, increased bone formation and decreased resorption and has protective and proliferative effect on CNS neurons. Both GIP agonists (to treat diabetes) and antagonist (to treat obesity) are being studied. Another incretin hormone is derived in intestinal l-cells by posttranslational processing of proglucagon – glucagon-like peptides 1 and 2 (GLP-1 and GLP-2). GLP-1 stimulates insuline production and inhibits glucagon secretion, exerts proliferative and antiapoptotic effect on β-cells. Via receptors on vagal nerve and central mechanisms decreases food intake and decreases body weight. By deceleration of gastric emptying it attenuates increases in meal-associated blood glucose levels. It exerts cardioprotective effects. GLP-1 receptors have been proved in liver recently but decreased liver glucose production and increased glucose uptake by liver and muscle are mediated indirectly by altering insulin and glucagons levels. GLP-2 stimulates enterocytes proliferation, up-regulates intestinal nutrient transport, improves intestinal barrier function, and inhibits gastric and intestinal motility. GLP-2 also reduces bone resorption.
Key words:
incretin hormones – GIP – GLP-1 – GLP-2
Authors:
J. Čáp
Authors‘ workplace:
II. interní klinika Lékařské fakulty UK a FN Hradec Králové, přednosta prof. MUDr. Jaroslav Malý, CSc.
Published in:
Vnitř Lék 2011; 57(4): 405-410
Category:
12th national Symposium diabetes, "Diabetes and Gastroenterology", Hradec Kralove, 4 to 5 June 2010
Overview
Inkretinové hormony jsou peptidy, které jsou secernovány endokrinními buňkami zažívacího traktu po požití potravy a mají schopnost zvyšovat sekreci inzulinu. Inzulinotropní peptid závislý na glukóze (Glucosodependent Insulinotropic Peptide – GIP) se tvoří v K-buňkách lokalizovaných v duodenu a proximální části jejuna, nejnověji byla prokázána syntéza GIP také v α-buňkách Langerhansových ostrůvků. Kromě inkretinového účinku způsobuje zvýšení tvorby a snížení odbourávání tuku v tukové tkáni, tlumí resorpci a stimuluje novotvorbu v kosti a má protektivní a proliferační účinek na buňky centrálního nervového systému. Terapeuticky se uvažuje jak o použití agonistů GIP ke zvýšení sekrece inzulinu, při léčbě osteoporózy a některých degenerativních onemocnění CNS, tak antagonistů GIP k ovlivnění obezity. Další peptidy s inkretinovým účinkem vznikají posttranslační modifikací proglukagonu. Ve střevních L-buňkách, a také v mozku, je štěpen mimo jiné na glucagon-like peptide 1 a 2 (GLP-1 a GLP-2). GLP-1 vede v Langerhansových ostrůvcích ke stimulaci sekrece inzulinu a k utlumení sekrece glukagonu, má proliferační a protektivní účinky na β-buňky. Centrálním působením i přes receptory na vláknech vagu vede ke snížení příjmu potravy a váhovému úbytku. Inhibuje tvorbu kyseliny a vyprazdňování žaludku, čímž snižuje vzestup glykemie po jídle. Má protektivní účinky při poškození srdečního svalu. Receptory byly prokázány i v játrech, ale snížená produkce a zvýšené vychytávání glukózy játry a svaly je dáno především nepřímo, změnou hladiny inzulinu a glukagonu. GLP-2 stimuluje proliferaci enterocytů, zvyšuje vstřebávání živin a snižuje motilitu střeva i žaludku. Inhibuje také kostní resorpci.
Klíčová slova:
inkretinové hormony – GIP – GLP-1 – GLP-2
Úvod
Již počátkem minulého století byla vyslovena teorie, že po požití potravy vyplaví střevní sliznice látky, které stimulují sekreci endokrinního pankreatu, a tak snižují glykemii [1]. Dokonce se uskutečnily i pokusy léčit diabetes kyselými extrakty sliznice dvanáctníku [2]. Termín inkretin byl poprvé použit ve 30. letech minulého století [3]. Po objevu radioimunoanalýzy inzulinu bylo zřejmé, že perorální podání glukózy stimuluje sekreci inzulinu mnohem více než intravenózně podané množství, které vede ke stejnému vzestupu glykemie [4,5]. Tento fenomén byl označen jako inkretinový efekt s tím, že je zodpovědný za 50–70 % celkové sekrece inzulinu po požití cukru. Inkretinové hormony jsou tedy secernovány do krve zažívacím traktem po požití potravy a zvyšují sekreci inzulinu.
GIP
První inkretinový hormon byl izolován ze sliznice vepřového tenkého střeva a nazván gastric inhibitory peptide – GIP, podle schopnosti tlumit histaminem stimulovanou sekreci kyselé žaludeční šťávy. Záhy se však ukázalo, že hlavním fyziologickým účinkem GIP je potenciace sekrece inzulinu působením glukózy. Proto je dnes nazýván „inzulinotropní peptid závislý na glukóze“ (Glucosodependent Insulinotropic Peptide). GIP gen je umístěn na dlouhém raménku 17. chromozomu a kóduje delší peptid pro GIP, který se posttranslačním štěpením mění na fyziologicky aktivní peptid o 24 aminokyselinách. Jeho aminokyselinové složení je podobné jako u řady obratlovců. Biologický poločas tohoto peptidu je v řádu několika minut, hlavní cestou katabolizmu je štěpení v poloze 3 enzymem dipeptidylaminopeptidáza 4 (obr. 1).
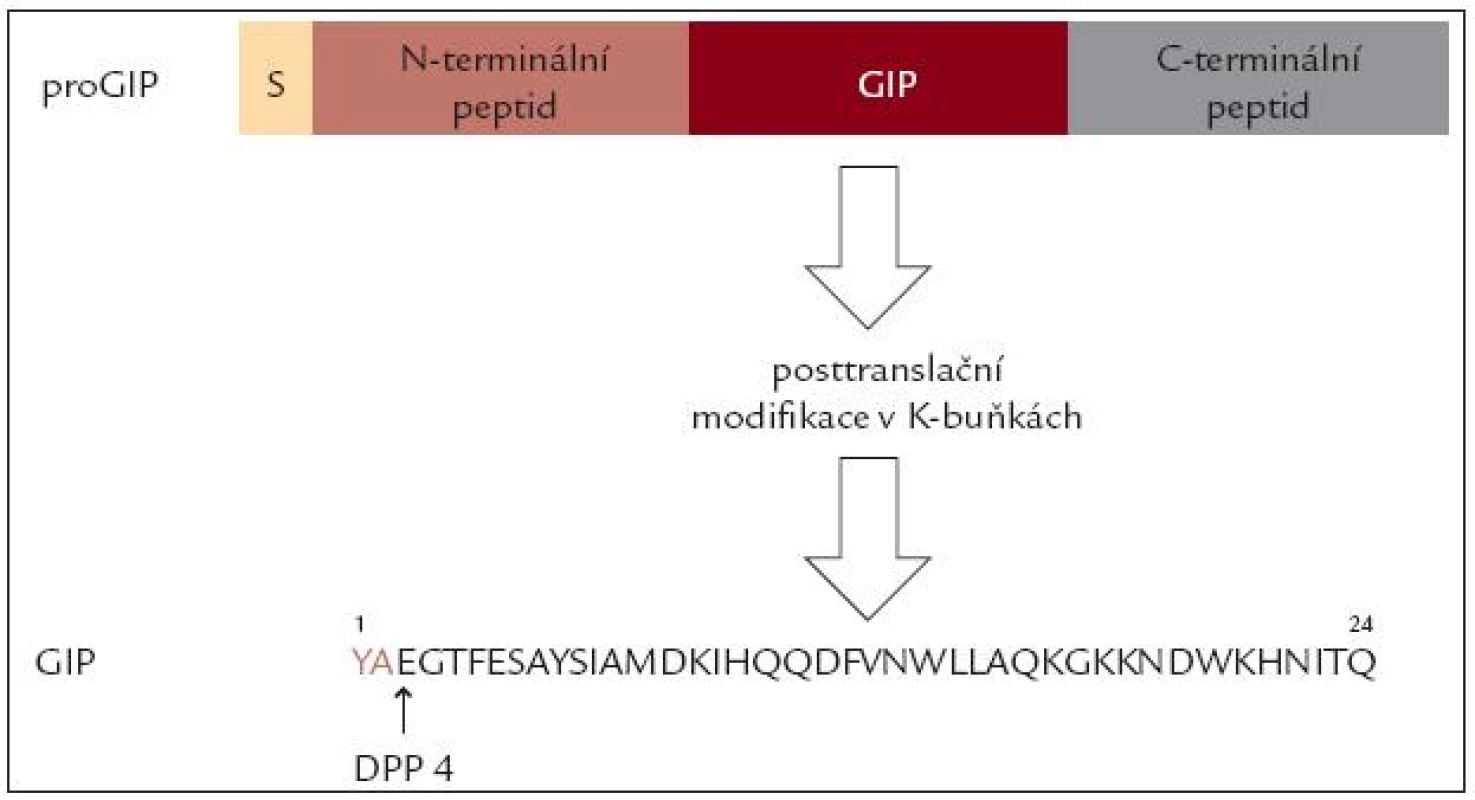
GIP je syntetizován a secernován především ve specifických K-buňkách lokalizovaných v duodenu a v proximální části jejuna. V menším množství jsou L-buňky přítomny v celém tenkém střevě, v některých buňkách je lokalizován spolu s GLP-1 [6]. Podnětem k jeho vyplavení je požití potravy, především s obsahem glukózy a tuku. Sekrece je dána více rychlostí absorpce těchto živin než jejich přítomností a snižuje se při malabsorpci [7]. Nejnověji byla prokázána syntéza GIP také v α-buňkách Langerhansových ostrůvků různých druhů, včetně člověka. Díky odlišnému posttranslačnímu štěpení zde vniká peptid 1–30, který je ale biologicky účinný a může se podílet na regulaci sekrece inzulinu [8].
Receptor pro GIP je membránový receptor spřáhnutý s G-proteinem. Vyskytuje se v Langerhansových ostrůvcích pankreatu, v žaludku, tenkém střevě, tukové tkáni, na kostních osteoblastech, srdci, v kůře nadledvin, v hypofýze, štítné žláze, varlatech, na endoteliálních buňkách cév, průdušnici, slezině, thymu, ledvinách, v plicích a v různých oblastech mozku.
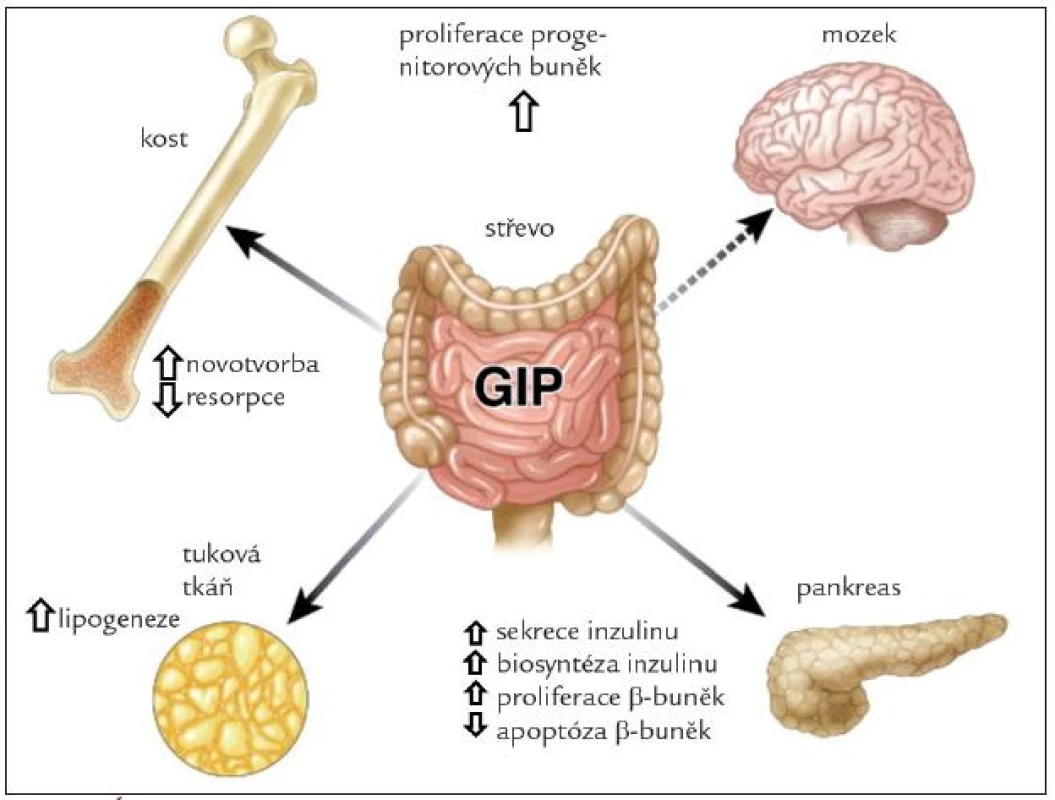
Účinky GIP jsou schematicky znázorněny na obr. 2. Hlavním fyziologickým účinkem je inkretinový efekt, tedy zvýšení sekrece inzulinu v β-buňkách Langerhansových ostrůvků v závislosti na glykemii. U laboratorních zvířat vede vyloučení GIP signální dráhy k porušené glukózové toleranci a snížení glukózou navozené sekrece inzulinu [7]. Synergicky s glukózou stimuluje GIP proliferaci a inhibuje různými mechanizmy navozenou apoptózu β-buněk. V tukové tkáni zvyšuje GIP aktivitu lipoproteinové lipázy, stimuluje lipogenezi, zvyšuje vychytávání glukózy a mastných kyselin, potencuje inzulinem navozené vychytávání mastných kyselin a inhibuje lipolýzu navozenou jak glukagonem, tak adrenergní stimulací. Dieta s vysokým obsahem tuku vede k hyperplazii K-buněk a hladina GIP je u obézních osob zvýšená [9]. Vyřazení GIP signální dráhy zabrání vzniku obezity při vysokotukové dietě, a dokonce zmírní obezitu u ob/ob myší. U osob s metabolickým syndromem má tak GIP jak příznivé, tak nepříznivé účinky (tab. 1). Proto se terapeuticky uvažuje nejen o mimeticích GIP, ale také o použití jeho antagonistů. Vyřazení sekrece GIP z proximální části zažívacího traktu je pravděpodobně jedním z mechanizmů příznivého metabolického efektu bariatrických operací u obezity [10,11].

V kosti je receptor pro GIP lokalizován na osteoblastech. GIP zvyšuje počet a aktivitu osteoblastů a inhibuje parathormonem navozenou aktivaci osteoklastů. V experimentu na zvířeti vede vyřazení GIP receptoru k nízké kostní hmotě a porušení kostní architektoniky pro zvýšení resorpce a snížení kostní novotvorby. Transgenní myši s vyšší aktivitou GIP mají naopak kostní hmotu zvýšenou a úbytek kostní hmoty s věkem je pomalejší. Je pravděpodobné, že intermitentní stimulace osteoblastů GIP po jídle je důležitá pro udržení kostní hmoty [12].
V posledních letech byl GIP gen prokázán v hipokampu a jeho exprese korelovala s proliferační aktivitou neuronů [13]. Imunocytochemicky byl prokázán kromě hipokampu také v čichovém bulbu a v Purkyňových buňkách [14]. Receptory pro GIP jsou přítomny v hipokampu, mozkové kůře, mozečku a bazálních gangliích [15]. GIP hraje roli v proliferaci progenitorových buněk a jejich diferenciaci, ovlivňuje také plasticitu neuronů a má protektivní účinek při experimentálním poškození mozkové tkáně. Je možné, že najde terapeutické uplatnění u temporální epilepsie, Parkinsonovy a Alzheimerovy choroby [15].
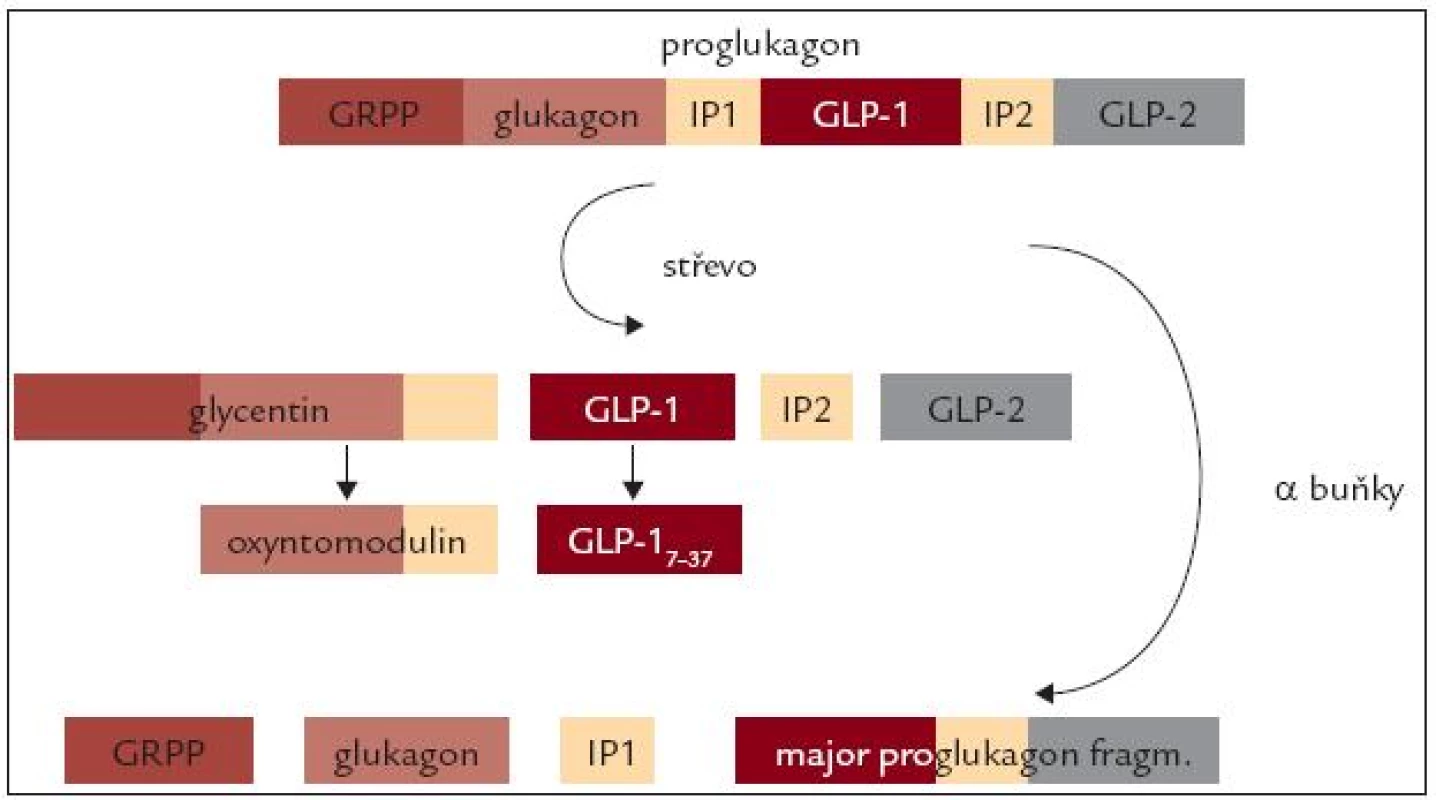
Další peptidy s inkretinovým účinkem vznikají ve střevě posttranslační modifikací proglukagonu. V α-buňkách Langerhansových ostrůvků je proglukagon štěpen prohormon konvertázou 2 na glukagon a další 3 peptidy (glucagon related polypeptide – GRPP, intrvening peptide 1 – IP1 a Major proglucagon fragment). Ve střevních buňkách, a také v mozku, je štěpen prohormon konvertázou 1/3 na glycerin, glucagon-like peptide 1 (GLP-1), intervening peptide 2 (IP2) a glucagon-like peptide 2 (GLP-2). Dalším působením stejné konvertázy potom vzniká z glycentinu oxyntomodulin a z GLP-1 kratší, ale fyziologicky účinný fragment GLP-17-37 (obr. 3).
Glicentin
Je peptid o 69 aminokyselinách. Původně byl izolován z tenkého střeva jako součást „enteroglukagonu“. Je také exprimován v mozku, zejména v hypotalamu a v mozkovém kmeni. Je secernován L-buňkami střevní sliznice spolu s GLP-1 a GLP-2. Jeho prokázané účinky zahrnují inhibici kyselé žaludeční sekrece, vyplavení inzulinu a proliferaci střevní sliznice. Je pravděpodobné, že tyto efekty jsou zprostředkovány vazbou na receptory pro GLP-1 a GLP-2. Specifický receptor pro tento peptid ani jeho fyziologická úloha nejsou známy.
Oxyntomodulin
Jde o peptid o 37 aminokyselinách. Bylo prokázáno, že inhibuje kyselou žaludeční sekreci u hlodavců, má účinky podobné glukagonu. Opět jde zřejmě o účinky zprostředkované vazbou na receptory pro GLP-1 a glukagon. Jeho účinky na snížení příjmu potravy a zvýšení energetického výdeje byly popsány i u člověka [16].
Glucagon-like peptide 1 (GLP-1)
Tento peptid je secernován L-buňkami ve 2 molekulárních formách (GLP-17-36 amid a GLP-17-36), které mají stejnou účinnost. L-buňky jsou lokalizovány především v distálním ileu a v tračníku. GLP-1 se ale vyskytuje v endokrinních buňkách i v jiných částech zažívacího traktu, někdy společně s GIP [17]. Stimulem pro vyplavení GLP-1 je požití potravy, zejména cukru a tuku. Sekrece je dvojfázová, s prvním vrcholem za 10–15 min a druhým za 30–60 min po jídle [18]. První fáze nastává dříve, než potrava dorazí do distálního ilea a je zprostředkována nervovými impulzy (cestou vagu s cholinergní i peptidergní inervací) a humorálně, především stimulací GIP [7].
Biologický poločas GLP-1 v plazmě je kratší než 2 min, protože je rychle inaktivován všudypřítomným enzymem diepetidyaminopaptidázou 4 (DPP-4) [19]. Degradace začíná již v endotelu kapilár tenkého střeva bezprostředně po sekreci, takže jen asi 25 % vyplaveného hormonu dosáhne jater a po průchodu játry zbývá jen 10–15 % aktivního hormonu [20]. Je pravděpodobné, že GLP-1 kromě endokrinního působení účinkuje stimulací zakončení vagových vláken přímo ve sliznici tenkého střeva před degradací. Neurogenní cestou potom stimuluje centra v prodloužené míše a v hypotalamu a eferentními vlákny vagu ovlivňuje motilitu žaludku a sekreci Langerhansových ostrůvků [21]. Řada studií u zvířat i lidí prokázala, že inhibice enzymu DPP-4 vede k prodloužení poločasu intaktního, biologicky účinného GIP-1. U obézních a diabetiků 2. typu je postprandiální vzestup GIP snížen, pravděpodobně v důsledku nižší sekrece, protože metabolizmus se nemění [22].
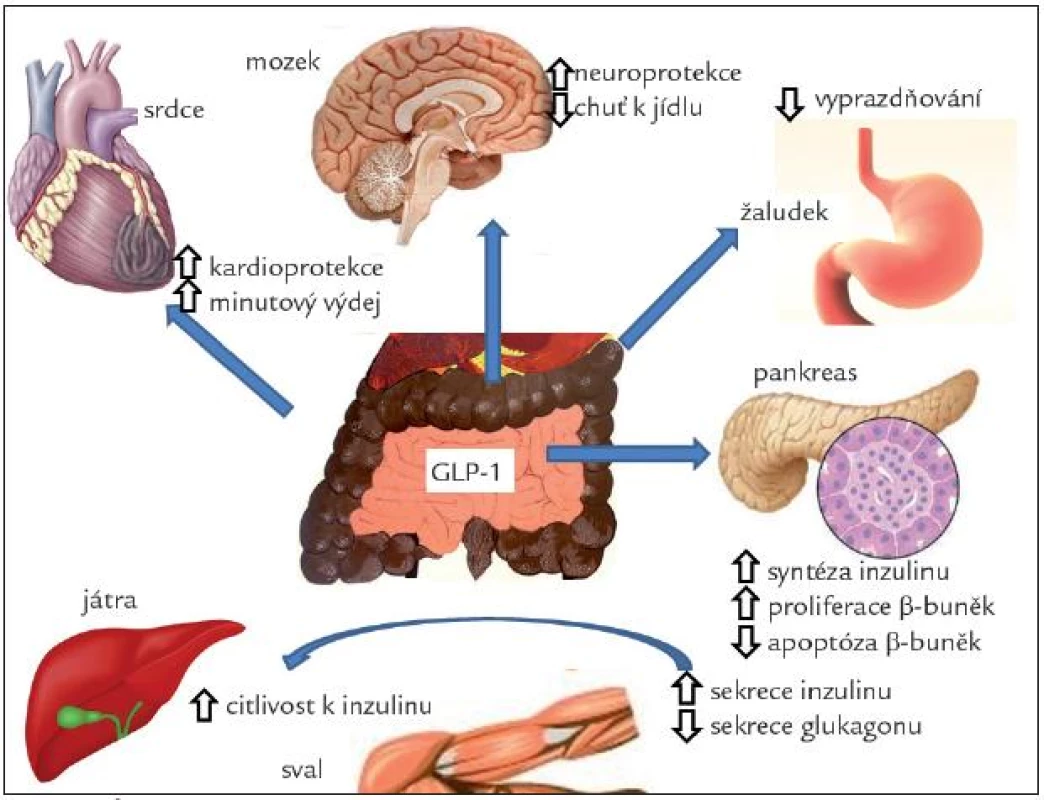
Receptor pro GLP-1 je přítomen v řadě tkání, především v Langerhansových ostrůvcích, plicích, srdci, ledvinách, žaludku, tenkém střevě, hypofýze, kůži, na gangliích vagu a v řadě oblastí CNS. U člověka nebyl zjištěn v tukové tkáni, játrech ani ve svalech. Účinky GIP-1 jsou schematicky znázorněny na obr. 4.
V Langerhansových ostrůvcích stimuluje sekreci inzulinu v závislosti na glykemii. Působí také synergicky s glukózou na zvýšení transkripce genu pro inzulin a syntézy inzulinu na úrovni translace. Tak pomáhá udržet sekreční kapacitu β-buněk [23]. GLP-1 zvyšuje expresi glukózových transportérů a glukokináz, tedy molekulárních komponent glukózových senzorů β-buněk. Tento mechanizmus může být vysvětlením pro obnovení citlivosti rezistentních β-buněk na glukózu. GLP-1 také inhibuje sekreci glukagonu a stimuluje vyplavení somatostatinu z Langerhansových ostrůvků. Glukagonostatické působení GLP-1 je také závislé na glukóze [24]. GLP-1 agonisté stimulují proliferaci a novotvorbu β-buněk a inhibují jejich apoptózu [25]. GLP-1 je proto důležitým faktorem, určujících funkční masu β-buněk [26].
Receptory pro GLP-1 a nervová vlákna s obsahem GLP-1 jsou přítomny v oblastech mozku, které regulují příjem potravy, motilitu žaludku, glukoregulaci a kardiovaskulární funkce. Stimulace GLP-1 vede ke snížení příjmu potravy a úbytku hmotnosti [27]. GLP-1 je malý peptid přestupující snadno hematoencefalickou bariéru, takže může působit přímo v mozkových centrech. Receptory jsou ale také na zakončeních vagu, jak bylo zmíněno výše. Zdá se, že ovlivnění příjmu potravy je zprostředkováno stimulací receptorů na periferních nervech. Stimulace GLP-1 receptoru vykazuje v CNS proliferativní, antiapoptotické a diferenciační účinky, kdy potencuje účinek nervového růstového faktoru [28]. Má také neuroprotektivní účinek při různých experimentálních mechanizmech poškození nervové tkáně. Agonisté GLP-1 zlepšovaly u krys proces učení [29] a uvažuje se o tom, že by mohly být použitelné v léčbě neurogedenerativních chorob a jiných nervových poruch, včetně diabetické neuropatie.
V žaludku GLP-1 výrazně inhibuje sekreci žaludeční kyseliny stimulované jídlem a pentagastrinem a snižuje motilitu a vyprazdňování žaludku. Pomalejší evakuace žaludku může přispívat ke snížení postprandiálního vzestupu glykemie, i když podle nejnovějších prací se na něm nejvíce podílí inhibice glukagonu [30]. Receptory pro GLP-1 jsou přítomny na parietálních buňkách. Zdá se ale, že hlavní mechanizmus, kterým ovlivňuje GLP-1 žaludeční motilitu a sekreci, je zprostředkován vagem, a to přes receptory pro GLP-1 na aferentních vláknech nebo v CNS.
Receptory pro GLP-1 se nacházejí v srdci a také v oblastech mozku, které regulují kardiovaskulární funkce (area postrema, jádra solitárního traktu). U hlodavců vede podání GLP-1 agonisty ke zvýšení systolického i diastolického tlaku a ke vzestupu tepové frekvence. U lidí významná změna těchto parametrů prokázána nebyla [31]. U savců byl prokázán kardioprotektivní účinek GLP-1 na vývoj kardiomyopatie navozené rychlou stimulací [32] a na rozsah ložiska u ischemie [33]. U lidí byl naopak prokázán pokles krevního tlaku, zlepšení endoteliálních funkcí u nemocných s diabetem a funkce levé komory u osob se srdečním selháním [34]. Infuze u nemocných s akutním infarktem myokardu trvající 72 hod snížila postižení funkce levé komory, a dokonce snížila mortalitu [35]. U nemocných s chronickou insuficiencí levé komory naopak nevedlo krátkodobé podání GLP-1 agonisty ke zlepšení srdečního výdeje [36].
GLP-1 působí snížení jaterní produkce glukózy, zvýšení vychytávání glukózy a syntézy glykogenu v játrech a ve svalech. Tento efekt byl prokázán i na izolovaných tkáních, a může tak jít o přímý periferní účinek tohoto hormonu. Přesto není jasné, zda jsou v játrech a svalech přítomny receptory pro GLP-1, a tyto účinky mohou být in vivo zprostředkovány především přímo přes změnu hladiny inzulinu a glukagonu [37]. Nejnověji se však zdá být průkaz receptorů v játrech přesvědčivý [38]. GLP-1 vedl u ob/ob myší k redukci obsahu tuku v játrech [39] a je možné, že bude vhodným lékem v terapii nealkoholické jaterní steatózy [38].
Účinky v dalších tkáních. V hypofyzárních buňkách hlodavců stimuluje GLP-1 sekreci TSH a gonadotropinů, v hypotalamu pak sekreci GnRH a vazopresinu. Myš s vyřazeným receptorem pro GLP-1 má však hypofyzární funkce normální [40]. U člověka vede akutní podání GLP-1 k přechodnému vzestupu ACTH a kortizolu. Fyziologická úloha v regulaci hypotalamo-hypofyzárních funkcí zůstává nejasná. V plicích vede GPL-1 ke zvýšení sekrece hlenu, uvolnění hladké svaloviny bronchů a k tvorbě surfaktantu. V ledvinách působí GLP-1 zvýšení glomerulární filtrace a snížení reabsorpce sodíku v proximálním tubulu. Zvýšení natriurézy dokáže zabránit vzniku hypertenze u vnímavých myší při dietě s vysokým obsahem soli. Podobně vedla infuze GLP-1 u obézních lidí ke zvýšenému vylučování sodíku a snížené hyperfiltraci, což může svědčit pro projektivní účinek na ledvinu [41].
Glucagon-like peptide 2 (GLP-2)
GLP-2 je peptid o 22 aminokyselinách, který vzniká štěpení proglukagonu a je secernován spolu s GLP-1 z L-buněk tenkého střeva v závislosti na příjmu potravin. Receptor pro GLP-2 není lokalizován na enterocytech, ale na střevních neuronech, myofibroblastech a neuroendokrinních buňkách, včetně samotných L-buněk [42]. Účinkuje tedy prostřednictvím lokálně působících humorálních mechanizmů, které jsou postupně poznávány. Např. stimulace vstřebávání tuků je zprostředkována sekrecí IGF-I, která stimuluje produkci receptoru CD36 [43]. Hlavním fyziologickým účinkem GLP-2 je inhibice intestinální motility a kyselé žaludeční sekrece, stimulace absorpce živin a snížení propustnosti střevní sliznice. Stimuluje proliferaci enterocytů a tlumí jejich apoptózu [44]. V experimentu snižuje rozsah poškození a urychluje regeneraci sliznice tenkého i tlustého střeva. Předpokládá se terapeutické využití pro zlepšení hojení po operaci střeva [45], v léčbě syndromu krátkého tenkého střeva a mukositidy po chemoterapii [46].
GLP-2 také působí v kosti, kde po injekci dochází u člověka k útlumu kostní resorpce, zatímco novotvorba zůstává nezměněna. Je možné, že absence GLP-2 přispívá k fyziologickému vzestupu kostní resorpce v nočních hodinách. Čtyřměsíční podávání GLP-2 na noc vedlo u postmenopauzálních žen k signifikantnímu vzestupu kostní hmoty [47].
Podpořeno projektem „Výzkumné záměry“ MSM 0021620820.
prof. MUDr. Jan Čáp, CSc.
www.fhk.cuni.cz
e-mail: capj@lfhk.cuni.cz
Doručeno do redakce: 24. 2. 2011
Sources
1. Bayliss WM, Starling EH. On the causation of the so-called “peripheral reflex secretion” of the pancreas. Proceedings of the Royal Society of London (Biol) 1902; 69 : 352–353.
2. Edie ES. Further Observations on the Treatment of Diabetes Mellitus by Acid Extract of Duodenal Mucous Membrane. Biochem J 1906; 1 : 446–454.
3. La Barre J. Sur les possibilites d’un traitement du diabete par l’incretine. Bull Acad R Med Belg 1932; 12 : 620–634.
4. McIntyre N, Holdsworth CD, Turner DS. New Interpretation of Oral Glucose Tolerance. Lancet 1964; 2 : 20–21.
5. McIntyre N, Holdsworth CD, Turner DS. Intestinal factors in the control of insulin secretion. J Clin Endocrinol Metab 1965; 25 : 1317–1324.
6. Mortensen K, Christensen LL, Holst JJ et al. GLP-1 and GIP are colocalized in a subset of endocrine cells in the small intestine. Regul Pept 2003; 114 : 189–196.
7. Baggio LL, Drucker DJ. Biology of incretins: GLP-1 and GIP. Gastroenterology 2007; 132 : 2131–2157.
8. Fujita Y, Wideman RD, Asadi A et al. Glucose-dependent insulinotropic polypeptide is expressed in pancreatic islet alpha-cells and promotes insulin secretion. Gastroenterology 2010; 138 : 1966–1975.
9. Irwin N, Gault V, Flatt PR. Therapeutic potential of the original incretin hormone glucose-dependent insulinotropic polypeptide: diabetes, obesity, osteoporosis and Alzheime’s disease? Expert Opin Investig Drugs 2010; 19 : 1039–1048.
10. Flatt PR. Dorothy Hodgkin Lecture 2008. Gastric inhibitory polypeptide (GIP) revisited: a new therapeutic target for obesity-diabetes? Diabet Med 2008; 25 : 759–764.
11. Irwin N, Flatt PR. Evidence for beneficial effects of compromised gastric inhibitory polypeptide action in obesity-related diabetes and possible therapeutic implications. Diabetologia 2009; 52 : 1724–1731.
12. Walsh JS, Henriksen DB. Feeding and bone. Arch Biochem Biophys 2010; 503 : 11–19.
13. Nyberg J, Anderson MF, Meister B et al. Glucose-dependent insulinotropic polypeptide is expressed in adult hippocampus and induces progenitor cell proliferation. J Neurosci 2005; 25 : 1816–1825.
14. Nyberg J, Jacobsson C, Anderson MF et al. Immunohistochemical distribution of glucose-dependent insulinotropic polypeptide in the adult rat brain. J Neurosci Res 2007; 85 : 2099–2119.
15. Figueiredo CP, Pamplona FA, Mazzuco TL et al. Role of the glucose-dependent insulinotropic polypeptide and its receptor in the central nervous system: therapeutic potential in neurological diseases. Behav Pharmacol 2010; 21 : 394–408.
16. Wynne K, Park AJ, Small CJ et al. Oxyntomodulin increases energy expenditure in addition to decreasing energy intake in overweight and obese humans: a randomised controlled trial. Int J Obes (Lond) 2006; 30 : 1729–1736.
17. Theodorakis MJ, Carlson O, Michopoulos S et al. Human duodenal enteroendocrine cells: source of both incretin peptides, GLP-1 and GIP. Am J Physiol Endocrinol Metab 2006; 290: E550–E559.
18. Herrmann C, Göke R, Richter G et al. Glucagon-like peptide-1 and glucose-dependent insulin-releasing polypeptide plasma levels in response to nutrients. Digestion 1995; 56 : 117–126.
19. Deacon CF, Nauck MA, Toft-Nielsen M et al. Both subcutaneously and intravenously administered glucagon-like peptide I are rapidly degraded from the NH2-terminus in type II diabetic patients and in healthy subjects. Diabetes 1995; 44 : 1126–1131.
20. Holst JJ. The physiology of glucagon-like peptide 1. Physiol Rev 2007; 87 : 1409–1439.
21. Holst JJ, Deacon CF. Glucagon-like peptide-1 mediates the therapeutic actions of DPP-IV inhibitors. Diabetologia 2005; 48 : 612–615.
22. Vilsbøll T, Krarup T, Deacon CF et al. Reduced postprandial concentrations of intact biologically active glucagon-like peptide 1 in type 2 diabetic patients. Diabetes 2001; 50 : 609–613.
23. Alarcon C, Wicksteed B, Rhodes CJ. Exendin 4 controls insulin production in rat islet beta cells predominantly by potentiation of glucose-stimulated proinsulin biosynthesis at the translational level. Diabetologia 2006; 49 : 2920–2929.
24. Nauck MA, Heimesaat MM, Behle K et al. Effects of glucagon-like peptide 1 on counterregulatory hormone responses, cognitive functions, and insulin secretion during hyperinsulinemic, stepped hypoglycemic clamp experiments in healthy volunteers. J Clin Endocrinol Metab 2002; 87 : 1239–1246.
25. Li Y, Hansotia T, Yusta B et al. Glucagon-like peptide-1 receptor signaling modulates beta cell apoptosis. J Biol Chem 2003; 278 : 471–478.
26. Lavine JA, Attie AD. Gastrointestinal hormones and the regulation of beta-cell mass. Ann N Y Acad Sci 2010; 1212 : 41–58.
27. Szayna M, Doyle ME, Betkey JA et al. Exendin-4 decelerates food intake, weight gain, and fat deposition in Zucker rats. Endocrinology 2000; 141 : 1936–1941.
28. Perry T, Haughey NJ, Mattson MP et al. Protection and reversal of excitotoxic neuronal damage by glucagon-like peptide-1 and exendin-4. J Pharmacol Exp Ther 2002; 302 : 881–888.
29. During MJ, Cao L, Zuzga DS et al. Glucagon-like peptide-1 receptor is involved in learning and neuroprotection. Nat Med 2003; 9 : 1173–1179.
30. Nicolaus M, Brödl J, Linke R et al. Endogenous GLP-1 regulates postprandial glycemia in humans: relative contributions of insulin, glucagon, and gastric emptying. J Clin Endocrinol Metab 2011; 96 : 229–236.
31. Meier JJ, Nauck MA. Glucagon-like peptide 1(GLP-1) in biology and pathology. Diabetes Metab Res Rev 2005; 21 : 91–117.
32. Nikolaidis LA, Elahi D, Hentosz T et al. Recombinant glucagon-like peptide-1 increases myocardial glucose uptake and improves left ventricular performance in conscious dogs with pacing-induced dilated cardiomyopathy. Circulation 2004; 110 : 955–961.
33. Zhao T, Parikh P, Bhashyam S et al. Direct effects of glucagon-like peptide-1 on myocardial contractility and glucose uptake in normal and postischemic isolated rat hearts. J Pharmacol Exp Ther 2006; 317 : 1106–1113.
34. Papazafiropoulou A, Pappas SI, Papadogiannis D et al. Cardiovascular effects of glucagon-like peptide 1. Mini Rev Med Chem 2011; 11 : 97–105.
35. Nikolaidis LA, Mankad S, Sokos GG et al. Effects of glucagon-like peptide-1 in patients with acute myocardial infarction and left ventricular dysfunction after successful reperfusion. Circulation 2004; 109 : 962–965.
36. Halbirk M, Nørrelund H, Møller N et al. Cardiovascular and metabolic effects of 48-h glucagon-like peptide-1 infusion in compensated chronic patients with heart failure. Am J Physiol Heart Circ Physiol 2010; 298: H1096–H1102.
37. Abu-Hamdah R, Rabiee A, Meneilly GS et al. Clinical review: The extrapancreatic effects of glucagon-like peptide-1 and related peptides. J Clin Endocrinol Metab 2009; 94 : 1843–1852.
38. Gupta NA, Mells J, Dunham RM et al. Glucagon-like peptide-1 receptor is present on human hepatocytes and has a direct role in decreasing hepatic steatosis in vitro by modulating elements of the insulin signaling pathway. Hepatology 2010; 51 : 1584–1592.
39. Ding X, Saxena NK, Lin S et al. Exendin-4, a glucagon-like protein-1 (GLP-1) receptor agonist, reverses hepatic steatosis in ob/ob mice. Hepatology 2006; 43 : 173–181.
40. MacLusky NJ, Cook S, Scrocchi L et al. Neuroendocrine function and response to stress in mice with complete disruption of glucagon-like peptide-1 receptor signaling. Endocrinology 2000; 141 : 752–762.
41. Gutzwiller JP, Tschopp S, Bock A et al. Glucagon-like peptide 1 induces natriuresis in healthy subjects and in insulin-resistant obese men. J Clin Endocrinol Metab 2004; 89 : 3055–3061.
42. Guan X, Karpen HE, Stephens J et al. GLP-2 receptor localizes to enteric neurons and endocrine cells expressing vasoactive peptides and mediates increased blood flow. Gastroenterology 2006; 130 : 150–164.
43. Hsieh J, Longuet C, Maida A et al. Glucagon-like peptide-2 increases intestinal lipid absorption and chylomicron production via CD36. Gastroenterology 2009; 137 : 997–1005.
44. Drucker DJ. Biologic actions and therapeutic potential of the proglucagon-derived peptides. Nat Clin Pract Endocrinol Metab 2005; 1 : 22–31.
45. Redstone HA, Buie WD, Hart DA et al. The effect of glucagon-like Peptide-2 receptor agonists on colonic anastomotic wound healing. Gastroenterol Res Pract 2010; doi 10.1155/2010/672453.
46. Yazbeck R. Teduglutide, a glucagon-like peptide-2 analog for the treatment of gastrointestinal diseases, including short bowel syndrome. Curr Opin Mol Ther 2010; 12 : 798–809.
47. Henriksen DB, Alexandersen P, Hartmann B et al. Four-month treatment with GLP-2 significantly increases hip BMD: a randomized, placebo-controlled, dose-ranging study in postmenopausal women with low BMD. Bone 2009; 45 : 833–842.
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Internal Medicine

2011 Issue 4
-
All articles in this issue
- Diabetes mellitus a dutina ústní
- Xerostomie, hyposialie, sicca syndrom – kvantitativní poruchy salivace
- Gastroduodenální vředová choroba u diabetika
- Poruchy motility a evakuace žaludku u diabetika. Současné možnosti diagnostiky a léčby
- Současné možnosti chirurgické léčby ložiskového postižení jater a pankreatu
- Steatóza a steatohepatitida u diabetika
- Diabetes mellitus a jaterní cirhóza
- Akutní pankreatitida u diabetika
- Celiakie a diabetes
- Kolorektální karcinom a diabetes
- Analoga amylinu, inhibitory α-glukosidáz a trávicí systém v regulaci homeostázy
- Autonomní neuropatie gastrointestinálního traktu
- Dyspeptický syndrom při antidiabetické léčbě
- Metabolická chirurgie – nejúčinnější léčba diabetu
- Metabolická chirurgie – nový směr v léčbě některých onemocnění
- Inkretinové hormony
- Léčba diabetes mellitus 2. typu GLP-1 agonisty
- Inkretinová léčba a metabolický syndrom
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue
- Xerostomie, hyposialie, sicca syndrom – kvantitativní poruchy salivace
- Léčba diabetes mellitus 2. typu GLP-1 agonisty
- Autonomní neuropatie gastrointestinálního traktu
- Diabetes mellitus a jaterní cirhóza