Hypertenze a kardiovaskulární komplikace chronického selhání ledvin
Hypertension and cardiovascular complications of chronic renal failure
Chronic renal failure is associated with a significant cardiovascular risk due to an increased incidence of cardiovascular risk factors (hypertension, diabetes mellitus, dyslipidemia). Cardiovascular mortality is due to an increased incidence of left ventricular hypertrophy, ischemic heart disease and chronic heart failure. Management focuses on risk factors, mainly high blood pressure in patients with mild to moderate chronic kidney disease, but it often fails in patients with chronic kidney failure.
Key words:
chronic renal failure – cardiovascular complications – arterial hypertension – antihypertensive agents
Authors:
M. Souček 1; V. Monhart 2; M. Nedbálková 1
Authors‘ workplace:
II. interní klinika Lékařské fakulty MU a FN u sv. Anny v Brně, přednosta prof. MUDr. Miroslav Souček, CSc.
1; Interní klinika 1. lékařské fakulty UK a ÚVN Praha, přednosta prof. MUDr. Miroslav Zavoral, Ph. D.
2
Published in:
Vnitř Lék 2011; 57(7&8): 615-619
Category:
136th internal medicine day, XXIV. Vanýskův den, Brno 2011
Overview
Chronické selhání ledvin je spojeno s výrazně vyšším kardiovaskulárním rizikem v důsledku zvýšeného výskytu kardiovaskulárních rizikových faktorů (hypertenze, diabetes mellitus, dyslipidemie). Příčinou kardiovaskulární mortality je zvýšený výskyt hypertrofie levé komory srdeční, ischemické choroby srdeční a chronického srdečního selhání. Léčba je zaměřena na rizikové faktory, především vysoký krevní tlak již u pacientů s chronickým onemocněním ledvin mírného až středního stupně, u pacientů v chronickém selhání ledvin ale často selhává.
Klíčová slova:
chronické selhání ledvin – kardiovaskulární komplikace – arteriální hypertenze – antihypertenziva
Úvod
Pod pojmem chronické selhání ledvin (CHSL) se obvykle rozumí konečná fáze chronického onemocnění ledvin (CKD) s poklesem glomerulární filtrace pod 0,25 ml/s. CHSL vyžadující léčbu náhradou funkce ledvin (dialýzou nebo transplantací) je poměrně vzácné. V České republice postihuje méně než 0,1 % populace (asi 800 pacientů na milion obyvatel). Dialyzovaní pacienti s CHSL mají ovšem velmi špatnou prognózu (roční mortalita je asi 15–20 %) [1].
Nejčastější příčinou CHSL je diabetická nefropatie, dále ischemická choroba ledvin, primární a sekundární glomerulopatie, chronická tubulointersticiální nefritida a autozomálně dominantně dědičná polycystická choroba ledvin. Chronické selhání ledvin často probíhá klinicky téměř bez příznaků nebo zcela asymptomaticky. Pacient si může všimnout změny vzhledu nebo množství moče, může trpět polyurií, polydipsií či sklonem k dehydrataci, ale také otoky, oligurií nebo anurií. Často se vyskytuje dušnost v důsledku hypervolemie, metabolické acidózy a anémie. Velmi často se onemocnění projeví příznaky vyplývajícími z arteriální hypertenze, jako jsou bolesti hlavy nebo obtíže se zrakem. Časté jsou gastrointestinální příznaky nebo únava, jejíž hlavní příčinou je anémie. Výskyt nechutenství, nevolnosti a zažívacích obtíží často provází progresi CHSL a akcentuje nutnost zahájení dialyzační léčby.
Pacienti se selháním ledvin mají ve srovnání s běžnou populací zhruba 10krát vyšší kardiovaskulární mortalitu [2]. Příčinou zvýšené kardiovaskulární mortality u dialyzovaných nemocných je ve srovnání s osobami stejného věku zvýšený výskyt hypertrofie levé komory srdeční, ischemické choroby srdeční a chronického srdečního selhání už při zahájení dialyzační léčby [3]. K vývoji kardiovaskulárních komplikací tak dochází již u nemocných s mírnou až středně závažnou chronickou renální insuficiencí. Kardiovaskulární mortalita a morbidita se zvyšují již při poklesu glomerulární filtrace pod 1 ml/s/1,73 m2 a s poklesem glomerulární filtrace dále rostou. U pacientů s chronickým selháním ledvin se častěji vyskytují běžné kardiovaskulární rizikové faktory, jako je hypertenze, hyperlipidemie a diabetes mellitus. Některé rizikové faktory jsou chronickým selháním modifikovány: dyslipidemie, oxidační stres, chronický zánět nebo hyperhomocysteinemie; a některé rizikové faktory jsou pro chronické selhání ledvin specifické: hyperhydratace, anémie či poruchy kalciumfosfátového metabolizmu.
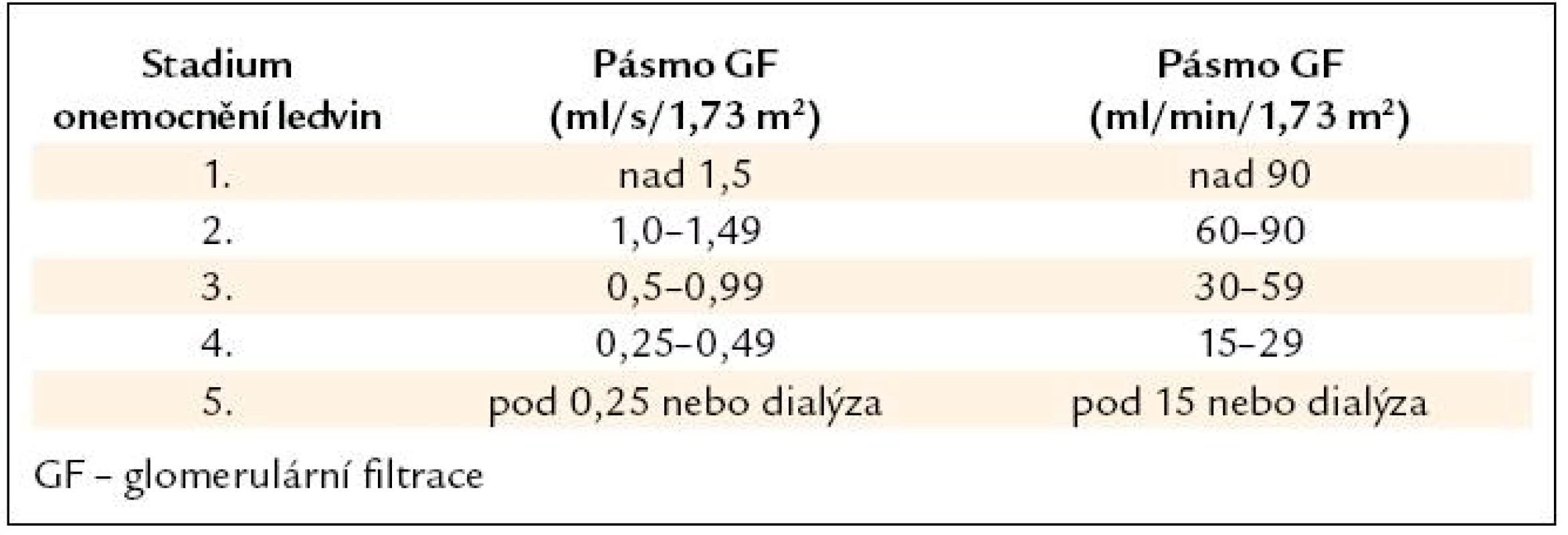
V roce 2002 publikovala americká National Kidney Foundation (NKF) praktická doporučení týkající se hodnocení, klasifikace a stratifikace chronických onemocnění ledvin (K/DOQI Guidelines) [4]. Klasifikace je založena na hodnocení glomerulární filtrace. K odhadu glomerulární filtrace byla použita kalkulace dle studie MDRD podle Leveyho. K výpočtu stačí věk, pohlaví a sérový kreatinin. Z důvodů jednoduchosti lze použít jen s menší přesností kalkulaci glomerulární filtrace podle Cockrofta a Gaulta: Ckreat = (140 – věk) × hmotnost/49 × sérový kreatinin. Sérový kreatinin je udáván v μmol/ l a kalkulovaná glomerulární filtrace je udávána v ml/s. Vzorec udává kalkulovanou GF pro muže, pro ženy se vypočtené číslo násobí koeficientem 0,85 (tab. 1).
Kardiovaskulární komplikace u pacientů s chronickým selháním ledvin
Hypertrofie levé komory u dialyzovaných nemocných
Hypertrofie levé komory (HLK) se vyvíjí již v predialyzačním období, rozhodujícím faktorem přispívajícím ke vzniku koncentrické hypertrofie je nedostatečně korigovaná arteriální hypertenze, faktorem přispívajícím k vývoji dilatace levé komory je anémie. Výskyt HLK srdeční se zvyšuje také s dobou dialýzy [5,6]. HLK byla nalezena asi u 30–45 % pacientů s chronickým onemocněním ledvin, kteří ještě nebyli zařazeni do dialýzy [7]. Koncentrická HLK byla echograficky prokázána u 42 % pacientů na začátku dialýzy a u 75 % pacientů po 10 letech dialýzy [8]. HLK je důležitým prediktorem mortality u pacientů s CKD, např. v prospektivní studii 1 249 starších jedinců s průměrnou glomerulární filtrací 0,5 ml/s/1,73 m2 byla HLK spojena s větším výskytem absolutního rizika, než je riziko spojené s DM, kouřením a systolickou hypertenzí [9]. U pacientů s terminálním selháním ledvin a u nemocných v dialyzačním programu figurují další faktory, které mohou zhoršovat volumové přetížení levé komory srdeční, zejména to je chronická hypervolemie a hyperkinetická cirkulace v důsledku arteriovenózního zkratu. Mortalita dialyzovaných nemocných závisí na echokardiografickém nálezu v době zahájení léčby. Z kohorty 433 dialyzovaných pacientů přežívalo 6 let po zahájení dialyzační léčby 70 % nemocných se vstupně normálním echokardiografickým nálezem, 40 % nemocných se vstupním nálezem koncentrické hypertrofie levé komory srdeční, 25 % nemocných s excentrickou hypertrofií (dilatací) levé komory a jen 10 % nemocných se systolickou dysfunkcí levé komory [10]. U dialyzovaných pacientů s nedilatovanou levou komorou zvyšuje mortalitu výrazně zvýšená hmotnost stěny levé komory, u pacientů s dilatací levé komory je pro prognózu nemocných důležitější rozsah dilatace levé komory než hmotnost stěny levé komory [11]. Pokles indexu hmotnosti levé komory nejlépe koreluje s poklesem krevního tlaku [12]. K regresi hypertrofie levé komory dochází u části nemocných po transplantaci ledvin. Normalizace hemoglobinu nevede u dialyzovaných pacientů s normální systolickou funkcí k regresi hypertrofie levé komory, ale zabrání zřejmě progresi dilatace levé komory [13]. Hypertrofie levé komory je tedy u dialyzovaných pacientů častým nálezem, který závažně ovlivňuje jejich kardiovaskulární prognózu. Ovlivnění již vyvinuté hypertrofie levé komory je obtížné, hlavním cílem by měla být její prevence, nebo alespoň co nejčastější léčba (zejména kontrola krevního tlaku, hydratace a průtok arteriovenózním shuntem).
Ischemická choroba srdeční u dialyzovaných pacientů
U pacientů s chronickou renální insuficiencí a chronickým selháním ledvin dochází k výskytu řady faktorů, které přispívají k vzniku či progresi aterosklerózy. Obvykle zjišťujeme hypertriglyceridemii se vzestupem VLDL, IDL a malých denních LDL. Často je zvýšen fibrinogen, lipoprotein A a homocystein. K vývoji aterosklerózy také přispívá s uremií často spojovaný chronický zánět se zvýšením CRP a IL-6, oxidační stres a poruchy kalciumfosfátového metabolizmu [14]. Prevalence angiograficky prokázaných významných stenóz koronárních tepen kolísá u dialyzovaných pacientů od 24 % u mladých nediabetiků, vyšetřovaných před zařazením do čekací listiny na transplantaci ledviny, až po 85 % u dlouhodobě dialyzovaných diabetiků starších 45 let [15]. Pacienti s chronickým selháním ledvin mají mnohem častější komplikované kalcifikované léze, podobně jako diabetici. Hlavní rozdíl mezi pacienty s chronickým selháním ledvin a normální renální funkcí je tedy ve složení aterosklerotických plátů, nikoli v jejich velikosti. Uremičtí pacienti s koronární aterosklerózou mají ve srovnání s uremickými pacienty bez aterosklerózy vyšší hladiny lipidů, lipoproteinu A a fibrinogenu [16]. Dialyzovaní pacienti s anamnézou anginy pectoris nebo infarktu myokardu mají významně vyšší mortalitu a riziko rozvoje chronického srdečního selhání [17]. Bolesti na hrudi jsou u dialyzovaných pacientů velmi nespolehlivým ukazatelem ischemické choroby srdeční. Angina pectoris se může vyskytovat u mnoha dialyzovaných pacientů s normálním koronarografickým nálezem, což může souviset s anémií a hypertrofickým myokardem [18]. Dialyzovaní pacienti mohou mít asymptomatickou, těžkou koronární sklerózu, někdy i s kritickými lézemi kmenů koronárních tepen, snad v důsledku uremické autonomní neuropatie a omezené fyzické zátěže [16]. Dušnost nemusí být spolehlivým příznakem, protože může být vyvolána anémií, převodněním či těžkou metabolickou acidózou. Prognóza dialyzovaných pacientů s akutním infarktem myokardu je velmi špatná, roční přežití je 53 % [19]. Nespolehlivé jsou i další běžně používané metody. Dialyzovaní pacienti mají často abnormální klidové EKG, zejména v důsledku hypertrofie levé komory a iontových změn. Zátěžové EKG je limitováno anémií, svalovou slabostí, bolestmi kloubů a obtížnou interpretací změn tepové frekvence při autonomní neuropatii. V současné době je tak u dialyzovaných pacientů koronarografie jedinou spolehlivou metodou k průkazu přítomnosti a závažnosti koronární aterosklerózy [20].
Hypertenze a chronická onemocnění ledvin
Renální hypertenze se v celkové populaci hypertoniků vyskytuje v 5–6 % [21]. Podle současné klasifikace chronických onemocnění ledvin se odhaduje, že 10 % dospělé populace má nezávažné postižení ledvin charakterizované přítomností mikroalbuminurie nebo mírně sníženou filtrační funkci ledvin (GF < 60 ml/min/1,73 m2), většina z nich má současně i arteriální hypertenzi. V posledním období dochází především k vzestupu 2 skupin onemocnění – diabetické nefropatie na podkladě diabetes mellitus 2. typu a vaskulární nefropatie, která zahrnuje především renální důsledky hypertenze (hypertenzní nefrosklerózu) a ischemickou nefropatii (vznikající na podkladě oboustranného aterosklerotického obliterujícího postižení renálních tepen). U osob s onemocněním ledvin bez výraznější poruchy ledvinné funkce je prevalence renální hypertenze až 60 % a dále stoupá s rozvojem CKD [22]. Vyskytuje se u 70–90 % pacientů léčených konzervativně pro chronickou ledvinnou nedostatečnost. V průběhu dialýzy nastává v 50–70 % a u pacientů s peritoneální dialýzou v 30–80 % [4].
Při vzniku hypertenze u pacientů s CKD se uplatňuje [23]:
- retence sodíku a vody (u 85–90 %),
- zvýšená aktivace sympatiku,
- aktivace (nedostatečná suprese) RAS,
- endoteliální dysfunkce (endotelin, NO),
- parathormon, erytropoetin,
- kalcifikace aortální stěny.
Léčba hypertenze u pacientů s CKD
Doporučení ESH/ESC z roku 2007 uvádělo snížení krevního tlaku pod 130/80 mm Hg u pacientů s onemocněním ledvin, nicméně důkazy o přínosu intenzivnější léčby chybí [24]. V posledních letech nebyla dokončena žádná velká studie zaměřená na pacienty s renální insuficiencí a v žádné nebyl cílový TK pod 130 mm Hg. Metaanalýza randomizovaných kontrolovaných studií u dialyzovaných pacientů prokázala, že antihypertenzní terapie snížila kardiovaskulární příhody o 29 %, celkové o 20 % a kardiovaskulární mortalitu o 29 %. Pokles tlaku byl o 4,5/2,3 mm Hg [25]. Bohužel chybí informace o absolutní hodnotě dosaženého krevního tlaku. Nejčastěji užívané blokátory systému renin-angiotenzin u pacientů s renální insuficiencí mají navíc zřejmě samy o sobě specificky nefroprotektivní účinek, což dále znesnadňuje posouzení vlivu samotného krevního tlaku na prognózu pacientů.
Na základě aktuálních dat jsou cílové hodnoty zpochybňovány a vyžadují ověření velkými prospektivními randomizovanými studiemi. Doporučené cílové hodnoty TK se pohybují v rozmezí 130–139/80–85 mm Hg se snahou dosáhnout nižší hranice rozmezí.
Léčebné postupy zahrnují nefarmakologická opatření, farmakologickou léčbu a také invazivní výkony, např. nově zaváděnou sympatickou denervaci renálních arterií.
Farmakologická léčba vyžaduje u většiny pacientů kombinaci více antihypertenziv [24].
- Zahájení léčby: inhibitory ACE nebo AT1 blokátor nebo kombinaci obou lékových skupin u proteinurických nemocných.
- Při nedostatečném účinku – přidání diuretika nebo blokátoru kalciových kanálů.
- Není-li dosaženo kontroly hypertenze – kombinace s centrálně působícím antihypertenzivem, α1-blokátorem nebo beta-blokátorem.
Inhibitory angiotenzin konvertujícího enzymu (inhibitory ACE)
Před zahájením léčby inhibitory ACE je třeba posoudit funkci ledvin, stav vodní a elektrolytové rovnováhy a samozřejmě kontraindikace. Je nutné vysadit kalium šetřící diuretika. Protože jsou všechny inhibitory ACE vylučovány ledvinami, léčbu zahajujeme nízkou dávkou. Výhodné je použití některých inhibitorů ACE, které jsou kromě ledvin vylučovány také játry – fosinopril, spirapril a trandolapril. Při zvyšování dávky je třeba monitorovat renální funkce a sérový draslík. Důvodem pro přerušení léčby mohou být nežádoucí účinky: kašel, zhoršení funkce ledvin, hyperkalemie, angioneurotický edém, exantém či dyspepsie.
Antagonisté angiotenzinu II – blokátory AT1 receptorů
Mají srovnatelný účinek s ACE inhibitory na snížení krevního tlaku a na proteinurii. AT1 blokátory nezvyšují hladinu bradykininu a ve srovnání s inhibitory ACE méně ovlivňují funkci ledvin. Zvýšená opatrnost se doporučuje při hodnotě clearance kreatininu < 0,25 ml/s. AT1 blokátory patří mezi nejlépe snášená antihypertenziva. Mohou se kombinovat s inhibitory ACE, diuretiky, blokátory kalciových kanálů a beta-blokátory. Kombinace AT1 blokátorů s inhibitory ACE výrazně snižuje proteinurii jak u diabetických, tak i u nediabetických onemocnění ledvin [26,27].
Blokátory kalciových kanálů (BKK)
Antiproteinurický účinek při léčbě diabetických i nediabetických nefropatií byl prokázán při použití nedihydropyridinových BKK (verapamil). Podání retardovaných dihydropyridinových BKK u hypertoniků s CHRI nevyžaduje úpravu dávkování, naopak u verapamilu je nutná restrikce denní dávky.
Diuretika
V léčbě jsou využívány i malé dávky thiazidů (hydrochlorothiazid 12,5 mg, indapamid 1,25 mg). Jejich účinek však výrazně klesá při hladině sérového kreatininu > 220 μmol/ l, kdy již musí být nahrazovány kličkovými diuretiky. Výhodné je i dávkování 2krát denně. Kalium šetřící diuretika zvyšují riziko hyperkalemie u závažnějších poruch funkce ledvin při současném podání inhibitorů ACE, nesteroidních antirevmatik a neselektivních beta-blokátorů.
Beta-blokátory
Beta-blokátory působí na β1-receptory, které nacházíme především v srdci a ledvinách. Důležitá je blokáda sympatické aktivity a snížení tvorby reninu. Snížené dávkování u osob se závažným CKD je nutné u hydrofilních beta-blokátorů.
Centrálně působící antihypertenziva
Centrálně působící antihypertenziva jsou jediní agonisté v léčbě hypertenze. Jsou to agonisté I1 imidazolinových receptorů (moxonidin, rilmenidin). Urapidil je lék s centrálním i periferním účinkem na α receptory.
Blokátory periferních α1-adrenergních receptorů
Blokátory periferních α1-adrenergních receptorů vedou k poklesu krevního tlaku snížením periferní cévní rezistence. U mužů s benigní hyperplazií prostaty současně ovlivňují dynamickou složku obstrukce močových cest.
Přímý inhibitor reninu
Aliskiren je perorálně podávané antihypertenzivum, jehož mechanizmus účinku spočívá v přímé inhibici reninu. V dávkách 150–300 mg 1krát denně prokázal účinnost v léčbě hypertenze a renoprotektivní účinky. Je velmi dobře snášen. Studie AVOID (Aliskiren in the evaluation of proteinuria in diabetes trial) byla mezinárodní, randomizovanou, dvojitě slepou studií, do které bylo zařazeno 599 pacientů s diabetes mellitus 2. typu a nefropatií. Primárním cílem bylo procentuální snížení poměru albumin/kreatinin. Léčba byla zahájena maximální doporučenou renoprotektivní dávkou losartanu 100 mg denně a mohla být přidána další antihypertenzní léčba s cílem dosáhnout krevního tlaku < 130/80 mm Hg. Po dobu 3 měsíců dostávali randomizovaní pacienti 150 mg aliskirenu a dále byla dávka zvýšena na 300 mg, účinek byl srovnáván s podáním placeba. Léčba 300 mg aliskirenu denně vedla k poklesu poměru albumin/kreatinin o 20 % ve srovnání s placebem. Snížení o 50 % a více bylo dosaženo u 24,7 % pacientů, kteří dostávali aliskiren, ve srovnání s 12,5 % pacientů v placebové skupině. Rozdíl v krevním tlaku byl minimální. Aliskiren může v doporučené dávce působit renoprotektivně nezávisle na poklesu TK u pacientů s hypertenzí, s diabetes mellitus 2. typu a u pacientů s nefropatií [28].
Ačkoli se u pacientů s chronickým onemocněním ledvin vyskytuje zvýšená prevalence téměř všech kardiovaskulárních rizikových faktorů, je přínos řady z nich k zvýšené kardiovaskulární mortalitě a morbiditě zajímavý v tom, že na rozdíl od běžně populace roste u pacientů s chronickým selháním ledvin kardiovaskulární riziko nejvíce při poklesu těchto parametrů pod určitou hranici [29].
Kardiovaskulární riziko u pacientů s chronickým selháním ledvin léčených hemodialýzou i peritoneální dialýzou strmě roste při poklesu systolického krevního tlaku pod 110 mm Hg [30]. Předpokládá se, že hlavním důvodem je častá koincidence hypotenze s chronickým srdečním selháním, které je u pacientů s chronickým selháním ledvin velmi časté. Vysokou mortalitu mají i pacienti s chronickým selháním ledvin a nízkým indexem tělesné hmotnosti a nízkým sérovým cholesterolem [31].
Závěr
Kardiovaskulární komplikace jsou u dialyzovaných pacientů s chronickým selháním ledvin výrazně častější než v běžné populaci a jsou hlavní příčinou vysoké mortality těchto nemocných. Kardiovaskulární riziko stoupá již velmi časně i s jen mírným poklesem renální funkce a pravděpodobně dále narůstá s progresí chronické renální insuficience. Prognózu dialyzovaných pacientů nepříznivě ovlivňuje jak přítomnost hypertrofie levé komory srdeční, tak ischemické choroby srdeční. I když jsou terapeutické intervence zaměřeny na regresi hypertrofie levé komory a koronární revaskularizaci efektivní i u dialyzovaných pacientů, účinnější je pravděpodobně prevence rozvoje těchto komplikací již ve fázi chronické renální insuficience, zejména účinná léčba hypertenze a dyslipidemie.
prof. MUDr. Miroslav Souček, CSc.
www.fnusa.cz
e-mail: miroslav.soucek@fnusa.cz
Doručeno do redakce: 2. 5. 2011
Sources
1. Tesař V. Kardiovaskulární rizikové faktory u chronického selhání ledvin. Kardiol Rev 2009; 11 : 111–116.
2. Foley RN, Parfrey PS, Sarnak MJ. Clinical epidemiology of cardiovascular disease in chronic renal disease. Am J Kidney Dis 1998; 32 (5 Suppl 3): S112–S119.
3. Levey AS, Beto JA, Coronado BE et al. Controling the epidemic of cardiovascular disease in chronic renal disease: What do we know? What do we need to learn? Where do we go from here? National Kidney Foundation Task Force on Cardiovascular Disease. Am J Kidney Dis 1998; 32 : 853–906.
4. National Kidney Foundation. K/DOQI clinical practice quidelines for chronic kidney disease: evaluation, classification, and stratification. Am J Kidney Dis 2002; 39 (Suppl 2): S1–S266.
5. Levin A, Thompson CR, Ethier J et al. Left ventricular mass index increase in early renal disease: impact of decline in hemoglobin. Am J Kidney Dis 1999; 34 : 125–134.
6. Moran A, Katz R, Jenny NS et al. Left ventricular hyperthrophy in mild and moderate reduction in kidney function determined using cardiac magnetic resonance imaging and cystatin C: the multi-ethnic study of atherosclerosis (MESA). Am J Kidney Dis 2008; 52 : 839–845.
7. Levin A, Singer J, Thompson CR et al. Prevalent left ventricular hypertrophy in the predialysis population: identifying oportunities for intervention. Am J Kidney Dis 1996; 27 : 347–353.
8. Parfrey PS, Foley RN. The clinical epidemiology of cardiac disease in chronic renal failure. J Am Soc Nephrol 1999; 10 : 1606–1611.
9. Parfrey PS, Harnett JD, Foley RN et al. Impact of renal transplantation on uremic cardiomyopathy. Transplantation 1995; 60 : 908–914.
10. Shlipak MG, Fried LF, Cushman M et al. Cardiovascular mortality risk in chronic kidney disease: comparison of traditional and novel risk factors. JAMA 2005; 293 : 1737–1743.
11. Foley RN, Parfrey PS, Kent GM et al. Long-term evolution of cardiomyopathy in dialysis patients. Kidney Int 1998; 54 : 1720–1725.
12. Foley RN, Parfrey PS, Harnett JD et al. The prognostic importance of left ventricular geometry in uremic cardiomyopathy. J Am Soc Nephrol 1995; 5 : 2024–2031.
13. Foley RN, Parfrey PS, Morgan J et al. Effect of hemoglobin levels in hemodialysis patients with asymptomatic cardiomyopathy. Kidney Int 2000; 58 : 1325–1335.
14. Goldsmith D, Covic A. Coronary artery disease in uremia: etiology, diagnosis, and therapy. Kidney Int 2001; 60 : 2059–2078.
15. Manske CL, Thomas W, Wang Y et al. Screening diabetic transplant candidates for coronary artery disease: identification a low risk subgroup. Kidney Int 1993; 44 : 617–621.
16. Koch M, Gradus F, Schoebel FC et al. Relevance of conventional cardiovascular risk factors for the prediction of coronary artery disease in diabetic patients on renal replacement therapy. Nephrol Dia Transplant 2001; 16 : 1198–1202.
17. Parfrey PS, Foley RN, Harnett JD et al. Outcome and risk factors of ischemic heart disease in chronic uremia. Kidney Int 1996; 49 : 1428–1434.
18. Törnig J, Amann K, Ritz E et al. Arteriolar wall thickening, capillary rarefaction and interstitinal fibrosis in the heart of rats with renal failure: the effects of ramipril, nifedipine and moxonidine. J Am Soc Nephrol 1996; 7 : 667–675.
19. Chertow GM, Normand SL, Silva LR et al. Survival after acute myocardial infarction in patients with end-stage renal disease: results from the cooperative cardiovascular project. Am J Kidney Dis 2000; 35 : 1217–1220.
20. Pidgeon GB, Lynn KL, Bailey RR et al. Coronary angiography prior to renal tranplantation. Nephrology 1995; 1 : 59–64.
21. Kaplan NM, Flynn JT. Kaplan’s clinical hypertension. 9th ed. Philadelphia: Lippincott Williams & Wilkins 2006.
22. Franklin SS, Polez VA, Wong ND et al. Prevalence, treatment, and control of hypertension in U.S. adults, 2001–2002, overall and individually among high cardiovascular disease risk groups. J Hypertens 2006; 24 (Suppl 6): S41.
23. Monhart V. Hypertenze u chronické renální insuficience. Medicína pro praxi 2009; 6 : 73–76.
24. Mancia G, Laurent S, Agabiti-Rosei E et al. European Society of Hypertension. Reappraisal of European guidelines on hypertension management: a European Society of Hypertension Task Force document. J Hypertens 2009; 27 : 2121–2154.
25. Heerspink HJ, Ninomiya T, Zoungas S et al. Effect of lowering blood pressure on cardiovascular events and mortality in patients on dialysis: a systematic review and meta-analysis of randomised controlled trials. Lancet 2009; 373 : 1009–1015.
26. Jacobsen P, Andersen S, Rossing K et al. Dual blockade of the renin-angiotensin system versus maxima recommended dose of ACE inhibitor in diabetic nephropathy. Kidney Int 2003; 63 : 1874–1880.
27. Nakao N, Yoshimura A, Morita H et al. Combination treatment of angiotensin-II receptor blocker and angiotensin-converting-enzyme inhibitor in non-diabetic renal disease (COOPERATE): a randomised controlled trial. Lancet 2003; 361 : 117–124.
28. Parving H, Persson F, Lewis J et al. for the AVOID Study Investigators. Aliskiren combined with losartan in type 2 diabetes and nephropathy. N Engl J Med 2008; 358 : 2433–2446.
29. Levin NW, Handelman GJ, Coresh J et al. Reverse epidemiology; confounding, and inaccurate term. Semin Dial 2007; 20 : 586–592.
30. Kalantar-Zadeh K, Kilpatrick RD, McAllister CJ et al. Reverse epidemiology of hypertension and cardiovascular death in the hemodialysis population: the 58th annual fall conference and scientific sessions. Hypertension 2005; 45 : 811–817.
31. Goldfarb-Rumyantzev AS, Baird BC, Leypoldt JK et al. The association between BP and mortality in patients on chronic peritoneal dialysis. Nephrol Dial Transplant 2005; 20 : 1693–1701.
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Internal Medicine

2011 Issue 7&8
-
All articles in this issue
- Biologická léčba po transplantaci ledviny
- Imunosupresivní terapie a její úskalí
- Minulost, současnost a budoucnost náhrady funkce ledvin
- Etiologie a klinický obraz chronického selhání ledvin
- Hypertenze a kardiovaskulární komplikace chronického selhání ledvin
- Kostní choroba u chronického selhání ledvin a její moderní terapie
- Infekce močového traktu a chronické selhání ledvin
- Anémie u chronického selhání ledvin
- Peritoneální dialýza a její modifikace v léčbě chronického selhání ledvin
- Hemodialýza – současná praxe
- Přehled výsledků transplantací ledvin v České republice
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue
- Hemodialýza – současná praxe
- Anémie u chronického selhání ledvin
- Imunosupresivní terapie a její úskalí
- Etiologie a klinický obraz chronického selhání ledvin
