Peritoneální dialýza a její modifikace v léčbě chronického selhání ledvin
Peritoneal dialysis and its modification in the treatment of chronic renal failure
Three methods can be used to treat chronic renal failure – haemodialysis, peritoneal dialysis and renal transplantation (from a living donor or transplantation of a cadaver kidney). In 2009, 5 763 patients were treated with haemodialysis in the Czech Republic, while peritoneal dialysis was used in just 8% (458) of patients. This low number of peritoneal dialyses may be due to the still high number of chronic renal failure patients who come to dialysis centres “off the street”. Following acute initiation of haemodialysis, these patients are usually retained on haemodialysis. Poor awareness of peritoneal dialysis among patients as well as health care professionals is another reason for the low number of peritoneal dialysis patients. Peritoneal dialysis is suitable for home treatment. Peritoneum serves as the dialysis membrane, peritoneal cavity is filled with dialysis solution and the metabolism waste products and water are excreted into this solution. A base to correct metabolic acidosis then passes from dialysis solution into the body. Permanent catheter is inserted into the abdominal cavity to enable infusion of the dialysis solution. The dialysis is continual and this ensures stability of the inner environment and thus most closely resembles own kidney function. The advantages of peritoneal dialysis include longer preservation of residual renal function, inner environment stability and no need for venous access. Peritoneal dialysis is associated with a lower risk of infections. Peritoneal dialysis is contraindicated in patients after an extensive intraabdominal surgery and in patients with a stoma. Peritoneal damage is a serious complication of peritoneal dialysis; the risk increases with the treatment duration and thus peritoneal dialysis is not a long-term treatment choice. With the traditional CAPD (continual ambulatory peritoneal dialysis), the patient performs an exchange of dialysis solution him/herself 4 to 5 times a day. With APD (automated peritoneal dialysis) a machine performs dialysis solution exchanges, dialysis is performed at night and the patient may engage in other activities during a day. From the perspective of log-term survival of patients with chronic renal failure, peritoneal dialysis appears to be the method of choice. The patient is first treated with peritoneal dialysis and subsequently receives a transplant. Should the renal allograft be rejected, the patient returns to the dialysis programme, either peritoneal or haemodialysis. Patients should be provided with true and objective information about their disease and be informed about all treatment options for chronic renal failure. The choice of method has to be tailored to the overall health status of the patient as well as his/her lifestyle.
Key words:
peritoneal dialysis – haemodialysis – transplantation – CAPD – automated peritoneal dialysis – peritonitis – peritoneal dialysis solution
Authors:
V. Bednářová; Z. Hrušková; V. Motáň; M. Neprašová
Authors‘ workplace:
Klinika nefrologie 1. lékařské fakulty UK a VFN Praha, přednosta prof. MUDr. Vladimír Tesař, DrSc.
Published in:
Vnitř Lék 2011; 57(7&8): 635-639
Category:
136th internal medicine day, XXIV. Vanýskův den, Brno 2011
Overview
Pro léčbu chronického selhání ledvin lze využít 3 metody – hemodialýzu, peritoneální dialýzu a transplantaci ledviny (od žijícího dárce nebo transplantaci kadaverózní ledviny). V roce 2009 bylo v České republice léčeno hemodialýzou 5 763 pacientů, peritoneální dialýzou pak pouhých 8 % pacientů (458). Jedním z důvodů malého počtu pacientů léčených peritoneální dialýzou může být stále velké množství těch, kteří přicházejí do dialyzačního centra s chronickým selháním ledvin tzv. „z ulice“. Tito pacienti po akutním zahájení hemodialyzační léčby již na hemodialýze zůstávají. Dalším důvodem malého počtu peritoneálně dialyzovaných pacientů je malá informovanost pacientů, ale i zdravotnických pracovníků o této léčebné metodě. Peritoneální dialýza je metoda domácí léčby. Peritoneum je vlastní dialyzační membránou, do dutiny peritoneální je napouštěn dialyzační roztok, do kterého jsou z krve vylučovány odpadové produkty metabolizmu a voda. Do organizmu pak z dialyzačního roztoku přestupují baze ke korekci metabolické acidózy. K napouštění dialyzačního roztoku je do dutiny břišní zaveden trvalý katetr. Dialýza probíhá nepřetržitě, což zajišťuje stálost vnitřního prostředí, a přibližuje se tak nejvíce funkci vlastní ledviny. Výhodou peritoneální dialýzy je delší zachování reziduální funkce ledvin a stálé vnitřní prostředí. Není zároveň nutné zakládat cévní přístup pro hemodialýzu. Při peritoneální dialýze je menší riziko přenosu infekcí. Metoda je kontraindikovaná u pacientů po rozsáhlých nitrobřišních operacích a u pacientů se stomiemi. Závažnou komplikací peritoneální dialýzy je poškození peritonea, přičemž riziko poškození stoupá s délkou léčby. Z tohoto důvodu není peritoneální dialýza metodou dlouhodobé léčby. Klasická CAPD (continual ambulatory peritoneal dialysis) je metoda, v rámci které si pacient dělá výměny dialyzačního roztoku sám, a to 4–5krát denně. Při APD (automated peritoneal dialysis) neboli přístrojové dialýze dělá výměny dialyzačního roztoku přístroj, dialýza probíhá v noci a přes den pacient může vykonávat jinou činnost. Z pohledu dlouhodobého přežívání pacientů s chronickým selháním ledvin se jeví koncepce peritoneální dialýzy jakožto léčebné metody první volby nejvýhodnější. Pacient je nejprve léčen peritoneální dialýzou, pak je provedena transplantace. Po selhání funkce ledvinného štěpu se vrací zpět do dialyzačního programu, buď peritoneálního, nebo hemodialyzačního. Pacient musí být pravdivě a objektivně informován o svém onemocnění, musí být tedy informován o všech možnostech léčby chronického selhání ledvin. Výběr metody musí být přizpůsoben nejen celkovému zdravotnímu stavu pacienta, ale i jeho způsobu života.
Klíčová slova:
peritoneální dialýza – hemodialýza – transplantace – CAPD – automatizovaná peritoneální dialýza – peritonitida – peritoneální dialyzační roztok
Úvod
Pacient s chronickým selháním ledvin by měl být při poklesu glomerulární filtrace pod 0,25 ml/s (= 15 ml/min, stadium V chronického renálního onemocnění dle mezinárodní klasifikace podle K/DOQI) připravován na léčbu některou z metod náhrady funkce ledvin. V úvahu připadají hemodialýza, peritoneální dialýza a transplantace ledviny z žijícího nebo zemřelého dárce.
V roce 2009 bylo v naší republice léčeno 5 763 pacientů hemodialýzou a 458 pacientů peritoneální dialýzou, což představuje 8 %, z toho bylo 30 % pacientů léčeno automatizovanou peritoneální dialýzou. Transplantaci prodělalo 373 pacientů [1]. V České republice se peritoneální dialýza provádí již 30 let, ale k rozšíření této metody došlo až v posledních 10 letech. V současné době může většina dialyzačních středisek tuto metodu léčby svým pacientům nabídnout. Přesto je počet pacientů léčených peritoneální dialýzou malý. Pouze 13 dialyzačních středisek má více než 10 pacientů léčených peritoneální dialýzou. V Evropě a v USA je peritoneální dialýzou léčeno od 5 do 20 % pacientů, výjimkou je Velká Britanie, kde je touto metodou léčeno 50 % pacientů. V některých méně vyspělých zemích je naopak počet pacientů léčených peritoneální dialýzou vyšší než počet hemodialyzovaných pacientů. V Mexiku je peritoneální dialýzou léčeno 90 % pacientů. Zastoupení peritoneální dialýzy v léčbě pacientů s chronickým selháním ledvin je závislé na řadě faktorů (ekonomické podmínky země, úhrada zdravotní pojišťovnou, počet dialyzačních středisek, dojezdová vzdálenost na dialýzu, informovanost pacientů a lékařů nefrologů i lékařů internistů a praktických lékařů o této metodě) [2]. Jedním z důvodů malého počtu pacientů léčených peritoneální dialýzou u nás může být i skutečnost, že stále existuje velký počet pacientů, kteří přicházejí do dialyzačního centra s chronickým selháním ledvin tzv. „z ulice“. Tito pacienti jsou pro renální selhání zpočátku hemodialyzováni. Přestože jsou informováni o peritoneální dialýze, většinou se rozhodnou pokračovat v hemodialyzační léčbě. V roce 2009 bylo do dialyzačního programu zařazeno 932 pacientů, kteří byli sledování v nefrologické ambulanci, a 832 pacientů přišlo do dialyzačního programu ve stadiu konečného selhání ledvin, aniž by byli sledováni v nefrologické ambulanci („z ulice“). Žádný z pacientů „z ulice“ si nezvolil jako metodu léčby peritoneální dialýzu. Množství pacientů zařazených do dialyzačního programu „z ulice“ hodnotíme jako velmi znepokojující, poukazuje totiž na to, že pacienti jsou nedostatečně sledováni praktickým lékařem, nebo že jsou pozdě odesíláni k nefrologovi. Tito pacienti nejsou vůbec informováni o možnostech léčby ani transplantace ledvin, nemají vytvořený dialyzační přístup a nejsou očkováni proti hepatitidě B. Jejich mortalita i morbidita je vyšší ve srovnání s pacienty přicházejícími z nefrologických ambulancí [3].
Princip peritoneální dialýzy
Peritoneální dialýza je metoda domácí léčby, pacient si provádí dialýzu doma a na kontroly do dialyzačního střediska dochází v měsíčních intervalech.
Princip peritoneální dialýzy byl popsán před 50 lety dr. Boenem z Amsterodamu [4]. Peritoneum je vlastní dialyzační membránou, do peritoneální dutiny je napouštěn dialyzační roztok, do kterého jsou z krve vylučovány odpadové produkty metabolizmu a voda. Do organizmu pak z dialyzačního roztoku přestupují baze ke korekci metabolické acidózy, v dialyzačním roztoku je obsažen buď laktát, nebo bikarbonát, případně kombinace obou. Složení dialyzačního roztoku je obdobné jako složení dialyzačního roztoku pro hemodialýzu. Rozdíl spočívá v tom, že v peritoneálním dialyzačním roztoku je neměnná koncentrace sodíku a že neobsahuje draslík. Odstranění vody z organizmu, tzv. ultrafiltrace, je zajištěna přítomností osmoticky aktivní látky. Jako osmoticky aktivní látka se do dialyzačního roztoku přidává glukóza. Podle koncentrace glukózy se mění osmotická aktivita roztoku, a tím i velikost ultrafiltrace. Dialyzační roztok je do peritoneální dutiny napouštěn a z ní vypouštěn pomocí katetru, který je do ní trvale zaveden (obr. 1). Peritoneální roztok se dodává v plastikových vacích, přičemž jeden vak slouží k vypouštění roztoku z dutiny břišní a druhý vak obsahuje dialyzační roztok, objem vaku je 2 000 ml (schéma 1). Peritoneální dialýza je metoda kontinuální léčby, což zajišťuje stálost vnitřního prostředí, a blíží se tak nejvíce funkci vlastní ledviny, a na rozdíl od hemodialýzy, která je léčbou intermitentní a probíhá obvykle 3krát týdně.
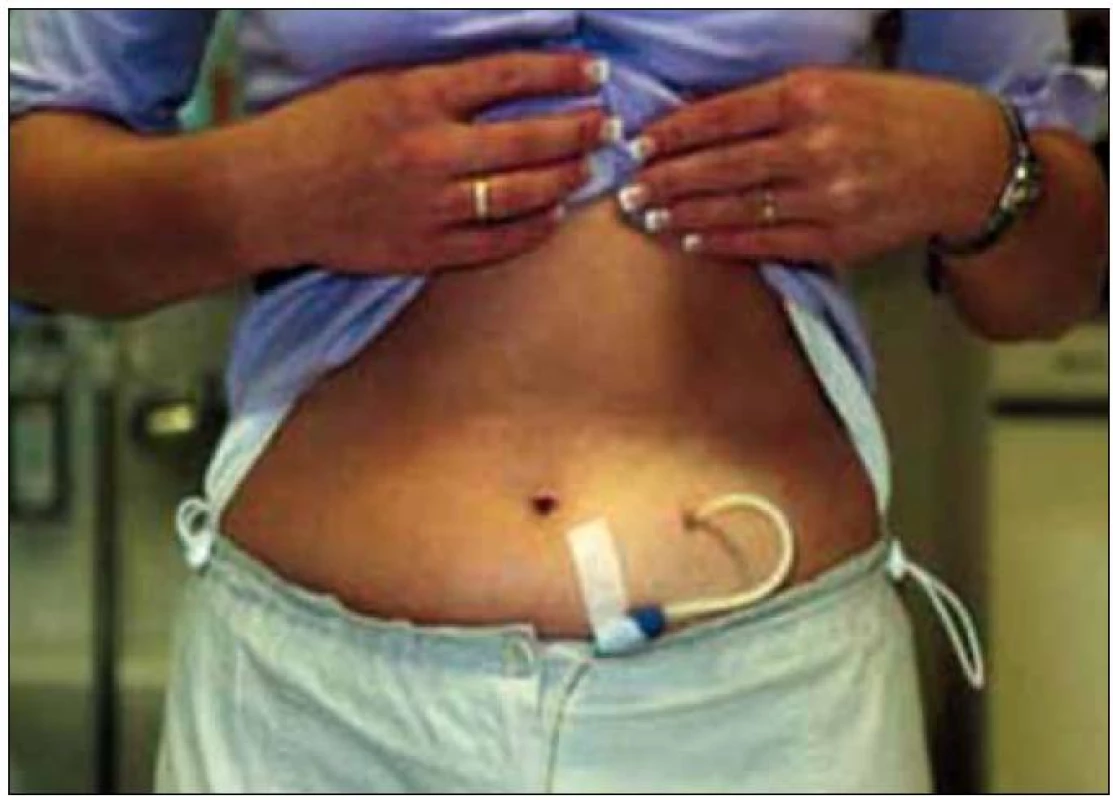

Indikace a kontraindikace peritoneální dialýzy
Peritoneální dialýzou mohou být léčeni téměř všichni pacienti. V roce 2009 byla publikována práce, která sledovala 1 303 pacientů s chronickým selháním ledvin ve stadiu predialýzy. Více než 90 % pacientů bylo vhodných pro léčbu hemodialýzou, až 83 % pro léčbu peritoneální dialýzou a 51 % pacientů bylo schopných podstoupit transplantaci ledvin. Důvodem nevhodnosti peritoneální dialýzy byl věk pacientů, obezita a výskyt srůstů v peritoneální dutině [5].
Absolutní kontraindikací peritoneální dialýzy je stav po rozsáhlých nitrobřišních operacích, stomie a rozsáhlé chirurgicky neřešitelné hernie. Peritoneální dialýza je metodou první volby pro dětské pacienty. Vysoký věk není kontraindikací peritoneální dialýzy, volba metody je ale individuální. U pacientů s diabetem byla peritoneální dialýza dříve považována za metodu první volby, nyní se však ukazuje, že je vhodná pouze pro mladší pacienty s diabetem. Pacienti s diabetem nad 65 let lépe prospívají na hemodialýze [6].
Tito pacienti mají více peritonitid, hůře kompenzovatelný diabetes a potíže s odstraňováním tekutin. U obézních pacientů vzniká více infekčních komplikací a více komplikací s průchodností katetru. Senioři pak mají hlavně problémy s praktickým prováděním výměn roztoku. V těchto případech musíme pečlivě zvažovat výběr metody s přihlédnutím jak k medicínským, tak k sociálním podmínkám daného pacienta. Nutný je zájem pacienta a rodiny.
Výhody peritoneální dialýzy a možné komplikace
Výhodou peritoneální dialýzy je především delší zachování reziduální funkce ledvin a stálé vnitřní prostředí. Navíc není nutné zakládat cévní přístup pro hemodialýzu ani není nutné pacientovi podávat léky proti agregaci destiček, které se používají u hemodialyzovaných pacientů k prevenci uzávěru cévního přístupu. Nepodává se systémová antikoagulace jako při hemodialýze. Snižuje se tak riziko krvácení do trávicího traktu. Velkou výhodou je menší riziko krevního přenosu infekcí (hepatitida C) [7]. Pacienti mají lépe kompenzovanou anémii, neboť nevznikají ztráty při mimotělním oběhu jako při hemodialýze. Odpadá také nutnost napichování arteriovenózní spojky při každé hemodialýze. Kvalita života pacientů s peritoneální dialýzou je v prvních letech lepší ve srovnání s kvalitou života hemodialyzovaných pacientů [8], neboť peritoneální dialýza je metoda domácí léčby, pacient není závislý na přístroji ani zdravotnickém personálu. Má větší svobodu pohybu, může např. cestovat, léčbu lze přizpůsobit jeho běžným aktivitám (škola, zaměstnání).
Nejzávažnější komplikací při peritoneální dialýze je poškození peritonea, přičemž riziko poškození stoupá s délkou léčby a s množstvím používaného dialyzačního roztoku. Z tohoto důvodu není peritoneální dialýza metodou dlouhodobé léčby. Dochází k poškození mezoteliálních buněk, fibrotizaci intersticia, ztrátě elasticity, neokapilarizaci a poškození endotelu. Snižuje se místní obranyschopnost díky poškození makrocytární a opsonizační schopnosti lymfatických buněk. Poškození peritonea může u některých pacientů vést až k rozvoji sklerozující peritonitidy. Prognóza sklerozující peritonitidy je špatná, onemocnění může skončit úmrtím pacienta. V Evropě a USA včetně naší republiky je tato komplikace velmi vzácná (0,1 % pacientů), častěji se vyskytuje v Asii (8 % pacientů) [9]. Vysvětlením může být dlouhodobá léčba pacientů peritoneální dialýzou v zemích, kde nejsou prováděny transplantace a hustota hemodialyzačních center je malá. Hlavní příčinou poškození peritonea je nefyziologické složení peritoneálního dialyzačního roztoku. Nízké pH, vysoká koncentrace glukózy (vyšší než 100 mmol/ l), přítomnost baze (laktát) a přítomnost degradačních produktů glukózy, které vznikají při sterilizaci roztoku rozpadem glukózy. V současné době jsou k dispozici roztoky, které díky nové technologii výroby obsahují méně degradačních produktů glukózy, mají neutrální pH a glukóza je v nich nahrazena částečně polymerem glukózy nebo aminokyselinami [10].
Další komplikací je postupný rozvoj protein kalorické malnutrice u peritoneálně dialyzovaných pacientů. Příčina této komplikace je multifaktoriální – zvýšená náplň dutiny peritoneální, resorpce glukózy z dialyzačního roztoku nebo ztráty bílkovin do dialyzační tekutiny, které mohou představovat až 10 g denně. Obávanou komplikací peritoneální dialýzy je infekce peritonea – peritonitida. Podle ISPD (International Society for Peritoneal Dialysis) z roku 2010 nesmí být počet peritonitid v centru vyšší než 1 peritonitida za 24 měsíců léčby u jednoho pacienta. Výskyt peritonitidy se v poslední době dramaticky snížil díky zavedení nových spojovacích systémů a používání biokompatibilních roztoků. Některá pracoviště uvádějí výskyt 1 peritonitidy za 72 měsíců léčby u jednoho pacienta. V České republice činí průměrný výskyt peritonitidy 1 případ na 42 měsíců léčby. Peritonitida může být při nekomplikovaném průběhu léčena doma. Antibiotika se přidávají do vaku, délka léčby je obvykle 14 dní. Hospitalizaci vyžadují pacienti s gramnegativní peritonitidou, poruchou ultrafiltrace a hyperhydratací [11].
Modifikace peritoneální dialýzy
Klasická CAPD (continual ambulatory peritoneal dialysis) je metoda, v rámci které si pacient dělá výměny dialyzačního roztoku sám, a to 4–5krát denně. Při APD (automated reritoneal dialysis) neboli přístrojové dialýze provádí sérii krátkých výměn dialyzačního roztoku přístroj, dialýza probíhá v domácím prostředí v noci a přes den je dutina břišní buď prázdná (NIPD – nightly intermittent peritoneal dialysis), nebo je napuštěna dialyzačním roztokem CCPD (continual cycling peritoneal dialysis). Pacient se večer před spaním připojí k přístroji a ráno se odpojí. Během dne si další výměny roztoku obvykle neprovádí. Automatizovaná peritoneální dialýza je indikována pro pacienty s vysokou propustností peritonea. Tito pacienti mají při delších prodlevách potíže s odstraněním vody. (Prodleva je doba, po kterou se roztok vyskytuje v dutině peritoneální, při 4 výměnách denně je délka prodlevy 4–5 hod přes den a 7–8 hod v noci. Při APD je délka prodlevy 1–2 hod.) Velmi rychle dochází k přestupu nízkomolekulárních látek do roztoku a glukózy peritoneem do organizmu, a snižuje se tak osmotická účinnost dialyzačního roztoku zároveň s poklesem množství odstraněné vody (ultrafiltrace). Pacienti jsou trvale převodněni, což má následně negativní dopad na jejich kardiovaskulární aparát [12]. Metodou APD je v zemích západní Evropy a USA léčeno více než 40 % pacientů, u nás je to 30 % pacientů. Pacienti léčení APD mají nižší výskyt peritonitid, především peritonitid vyvolaných gramnegativními mikroorganizmy. Z Holandského registru (NEDOSAD) dialyzovaných pacientů vyplývá, že technické i medicínské přežívání je u pacientů léčených CAPD a APD srovnatelné [13,14]. Při automatizované peritoneální dialýze se díky krátkým prodlevám nedostatečně odstraňují látky s větší molekulou, ale je zajištěna dostatečná osmotická účinnost peritoneálního dialyzačního roztoku, a tím i dostatečná ultrafiltrace. K dostatečnému odstraňování metabolitů je zapotřebí větší množství dialyzačního roztoku. U pacientů bez diurézy to může být až 18 l dialyzačního roztoku denně. Při rozhodování o tom, jakou metodu peritoneální dialýzy pro pacienta zvolit, je potřeba respektovat vlastnosti peritonea, velikost diurézy, hmotnost a výšku pacienta. Automatizovaná peritoneální dialýza není vhodná pro pacienty s nízkou propustností peritonea, neboť k odstranění katabolitů je u těchto pacientů zapotřebí, aby byl roztok v dutině peritoneální delší dobu, potřebují tedy delší prodlevu. Pro tyto pacienty je vhodná klasická CAPD metoda. NIPD není vhodná pro pacienty, kteří nemají dostatečnou reziduální funkci ledvin, metoda je naopak vhodná pro pacienty s dostatečnou diurézou a pro pacienty s rizikem tvorby hernií, neboť mohou mít přes den dutinu břišní prázdnou. Jinak je zapotřebí maximálně přizpůsobit léčbu pacientovi tak, aby se co nejméně měnil způsob jeho života.
Automatizovaná peritoneální dialýza je metodou první volby pro děti. Lze ji použít i u pacientů, kteří si nejsou schopni provádět výměny dialyzačního roztoku sami a peritoneální dialýzu jim provádí rodinný příslušník nebo zdravotník (staří pacienti, pacienti s poruchou zraku nebo poruchou motility), jedná se o asistovanou peritoneální dialýzu. Automatizovaná peritoneální dialýza je metoda vhodná pro mladé a aktivní pacienty [15].
Peritoneální dialýza jako metoda první volby
Z pohledu dlouhodobého přežívání pacientů s chronickým selháním ledvin se jeví koncepce peritoneální dialýzy jakožto léčebné metody první volby nejvýhodnější. Pacient je nejprve léčen peritoneální dialýzou, pak je provedena transplantace. Po selhání funkce ledvinného štěpu se vrací zpět do dialyzačního programu, buď peritoneálního, nebo hemodialyzačního. V druhém případě se mu teprve nyní vytváří cévní spojka pro hemodialýzu. Tento způsob léčby si vybírá to nejlepší z obou metod. Peritoneální dialýza je metoda spojená v prvních 3 letech s nižším výskytem komplikací a s menší mírou mortality. Zároveň je déle zachována reziduální renální funkce. V dalším období již peritoneální dialýza ztrácí své výhody. Po ztrátě diurézy je velmi obtížné dosáhnout dostatečnou účinnost v odstraňování metabolitů a vody. U některých pacientů se po 3–4 letech může objevit syndrom vyhoření, pacient je z metody unaven. Pokud je pacient schopen transplantace, je obvykle do této doby provedena [16]. Pacienti s jiným závažným onemocněním, které je kontraindikací transplantace ledvin, musí být pečlivě kontrolováni a při známkách malnutrice, při změnách propustnosti peritonea, při častých infekcích peritonea nebo při nedostatečné ultrafiltraci a známkách retence tekutin musí být včas převedeni na hemodialýzu. Tímto způsobem léčby můžeme zásadně ovlivnit kvalitu života pacientů s chronickým onemocněním ledvin, jejich morbiditu a mortalitu.
Závěr
Léčba chronického selhání ledvin představuje nejen náhradu funkce ledvin, ale i komplexní léčbu všech komplikací. Jedná se o dlouhodobou léčbu, během které najdou uplatnění všechny způsoby léčby: hemodialýza, peritoneální dialýza i transplantace ledvin. Ty mohou být postupně použity u jednoho pacienta. Pacient musí být pravdivě a objektivně informován o svém onemocnění a o možnostech léčby chronického selhání ledvin. Musí být informován včas, aby mohl sám rozhodnout o způsobu léčby a k dané léčbě byl včas připraven. Výběr metody musí být přizpůsoben nejen celkovému zdravotnímu stavu pacienta, ale i jeho způsobu života.
MUDr. Vladimíra Bednářová, CSc.
www.vfn.cz
e-mail: bednarova.vladimira@seznam.cz
Doručeno do redakce: 2. 5. 2011
Sources
1. Rychlík I, Lopot F. Statistická ročenka dialyzační léčby v České republice v roce 2009. Česká nefrologická společnost, 2010, www.nefrol.cz.
2. Bouvier N, Durand PY, Testa A et al. Regional discrepancies in peritoneal dialysis utilization in France: the role of the nephrologist’s opinion about peritoneal dialysis. Nephrol Dial Transplant 2009; 24 : 1293–1297.
3. Perl J, Bargman JM. Predialysis interventions for postdialysis outcomes. Perit Dial Int 2009; 29 : 270–273.
4. Guest S, Filho DJ, Krediet RT. Celebration of the 50th Anniversary of the thesis on peritoneal dialysis by Dr. Fred S.T. Boen. Perit Dial Int 2009; 29 : 601–604.
5. Mendelssohn DC, Mujais SK, Soroka SD et al. A prospective evaluation of renal replacement therapy modilaty eligibility. Nephrol Dial Transplant 2009; 24 : 555–561.
6. Vonesh EF, Snyder JJ, Foley RN et al. Mortality studies comparing peritoneal dialysis and hemodialysis: What do they tell us? Kidney Int Suppl 2006; 103: S3–S11.
7. Chiu YW, Jiwakanon S, Lukowsky L et al. An update on the comparison of mortality outcomes of hemodialysis and peritoneal dialysis patiens. Semin Nephrol 2011; 31 : 152–158.
8. Fruktoso M, Castro R, Oliveira L et al. Quality of life in chronic kidney disease. Nephrologia 2011; 31 : 91–96.
9. Kim YL. Update on mechanisms of ultrafiltration failure. Perit Dial Int 2009; 29 (Suppl 2): S123–S127.
10. Diaz-Buxo JA, Himmele R. Strategies to universally improve peritonitis rates, including use of dialysis solutions with low glucose degradation products. Adv Perit Dial 2010; 26 : 37–40.
11. Tao Li PK, Szeto CC, Piraino B et al. Peritoneal dialysis – related infections recommendations: 2010 update. Perit Dial Int 2010; 30 : 693–423.
12. Davies SJ, Mushahar L, Yu Z et al. Determinant of peritoneal membrane function over time. Semin Nephrol 2011; 31 : 172–188.
13. Vonesh E. On small solute clearance and patient outcomes: evindental practice or observational trepidation? Perit Dial Int 2009; 29 : 623–629.
14. NECOSAD Nephrol Dial Transplant 2007; 22 : 2991–2998.
15. Bednářová V. Automatizovaná peritoneální dialýza. In: Bednářová V, Dusilová Sulková S et al (eds). Peritoneální dialýza. Praha: Maxdorf 2007 : 216–231.
16. Sezer S, Karakan S, Özdemir AFN et al. Dialysis as a bridge to renal transplantation: comparison of graft outcomes according to mode of dialysis treatment. Transplant Proc 2011; 43 : 485–487.
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Internal Medicine

2011 Issue 7&8
-
All articles in this issue
- Biologická léčba po transplantaci ledviny
- Imunosupresivní terapie a její úskalí
- Minulost, současnost a budoucnost náhrady funkce ledvin
- Etiologie a klinický obraz chronického selhání ledvin
- Hypertenze a kardiovaskulární komplikace chronického selhání ledvin
- Kostní choroba u chronického selhání ledvin a její moderní terapie
- Infekce močového traktu a chronické selhání ledvin
- Anémie u chronického selhání ledvin
- Peritoneální dialýza a její modifikace v léčbě chronického selhání ledvin
- Hemodialýza – současná praxe
- Přehled výsledků transplantací ledvin v České republice
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue
- Hemodialýza – současná praxe
- Anémie u chronického selhání ledvin
- Imunosupresivní terapie a její úskalí
- Etiologie a klinický obraz chronického selhání ledvin
