Běžné, standardizované a doporučené postupy v diagnostice a monitorování paroxysmální noční hemoglobinurie průtokovou cytometrií
Common, standardized and recommended approaches in the diagnosis and monitoring of paroxysmal nocturnal haemoglobinuria using flow cytometry
Paroxysmal nocturnal hemoglobinuria is an acquired clonal disease characterized by proliferation of stem cells, deficient of proteins linked to the membrane via glycophosphatidylinositol (GPI) anchors. PNH cell characterization by flow cytometry was introduced in 1986, since 1996 is considered as method of choice for PNH diagnosis. Flow cytometry PNH analysis is nowadays crucial for disease monitoring in terms of progression, regression, remission or response to therapy and screening for small PNH clones (< 1.0%) in patients with aplastic anemia or myelodysplastic syndrome. Flow cytometry is unfortunately still poorly standardized, there is a variety of different methodological approaches for PNH evaluation and results from external quality assurances schemes reveal heterogeneous results. The aim of this work is to review the applicability of flow cytometry for the diagnosis and monitoring of PNH with respect to our experience and in the context of the recent trends and guidelines for PNH evaluation by flow cytometry.
Key words:
paroxysmal nocturnal hemoglobinuria – flow cytometry – standardized approaches
Authors:
I. Marinov1ihash2ihash4 ,2 ,2 ,2
Authors‘ workplace:
Ústav hematologie a krevní transfuze Praha, ředitel prof. MUDr. Marek Trněný, CSc.
1; Ústav klinické a experimentální hematologie 1. lékařské fakulty UK a Ústavu hematologie a krevní transfuze Praha, přednosta prof. MUDr. Marek Trněný, CSc.
2
Published in:
Vnitř Lék 2012; 58(1): 31-37
Category:
Reviews
Overview
Paroxysmální noční hemoglobinurie (PNH) je získané klonální onemocnění krvetvorby. Patří do skupiny získaných hemolytických anémií a projevuje se hemolýzou červených krvinek různé intenzity a nadměrnou tendencí ke vzniku trombóz. Vzniká z důvodu proliferace kmenové buňky, které chybí povrchové antigeny vázané na buněčné membráně pomocí glykosylfosfatidylinositolové kotvy (GPI). Průtoková cytometrie se používá na stanovení PNH klonů od roku 1986 a od roku 1996 se považuje za metodu volby pro diagnostiku onemocnění. Vyšetření v současné době zahrnuje též monitorování velikosti PNH klonů v průběhu onemocnění – ve vztahu k progresi, regresi, remisi, transformaci či odpovědi na terapii – a dále je též zaměřeno na detekci nízkých počtů PNH buněk (< 1,0 %) v rámci monitorování pacientů s aplastickou anémií (AA) a myelodysplastickým syndromem (MDS). V praxi se používají odlišné metodické postupy. Průtoková cytometrie je stále nedostatečně standardizovanou metodou, závěry externích kontrol kvality navíc poukazují na různorodost jednotlivých výsledků. Cílem následující práce je poskytnout přehled současných možností vyšetření PNH buněk průtokovou cytometrií v souladu s naší dlouholetou zkušeností a v kontextu aktuálních trendů a doporučení pro diagnostiku a monitorování PNH.
Klíčová slova:
paroxysmální noční hemoglobinurie – průtoková cytometrie – standardizované postupy
Úvod
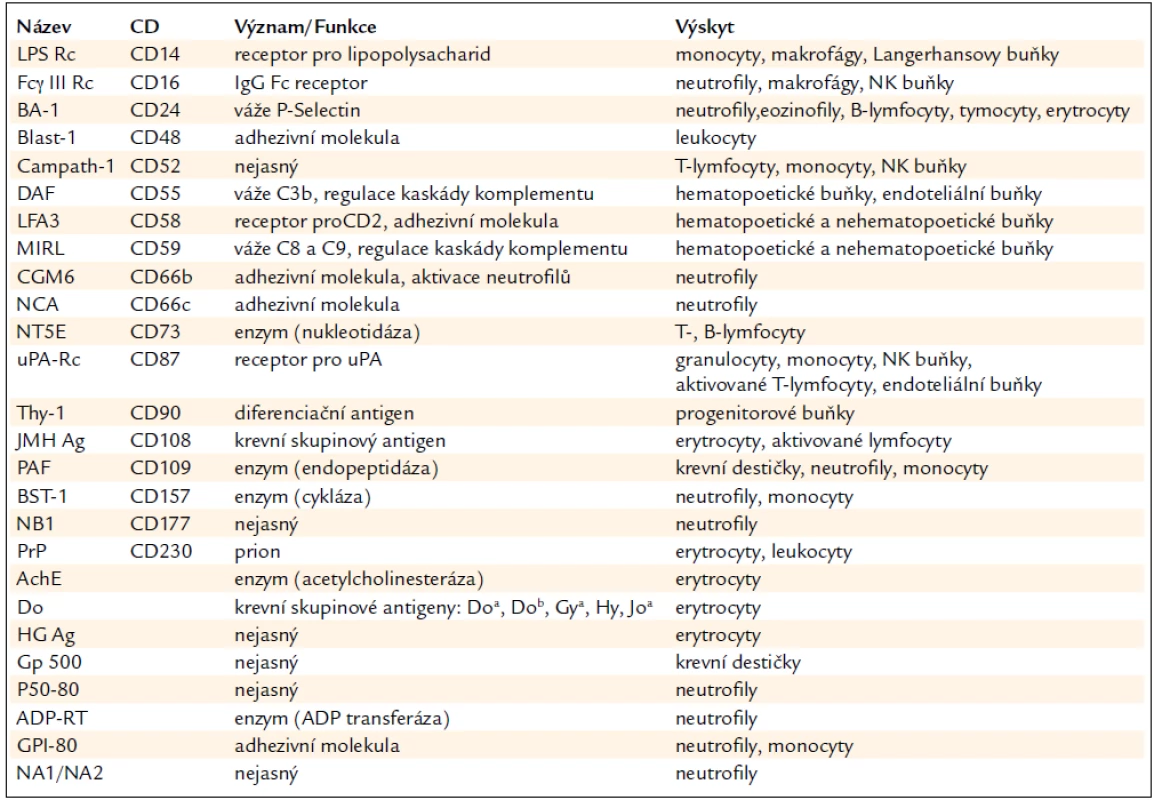
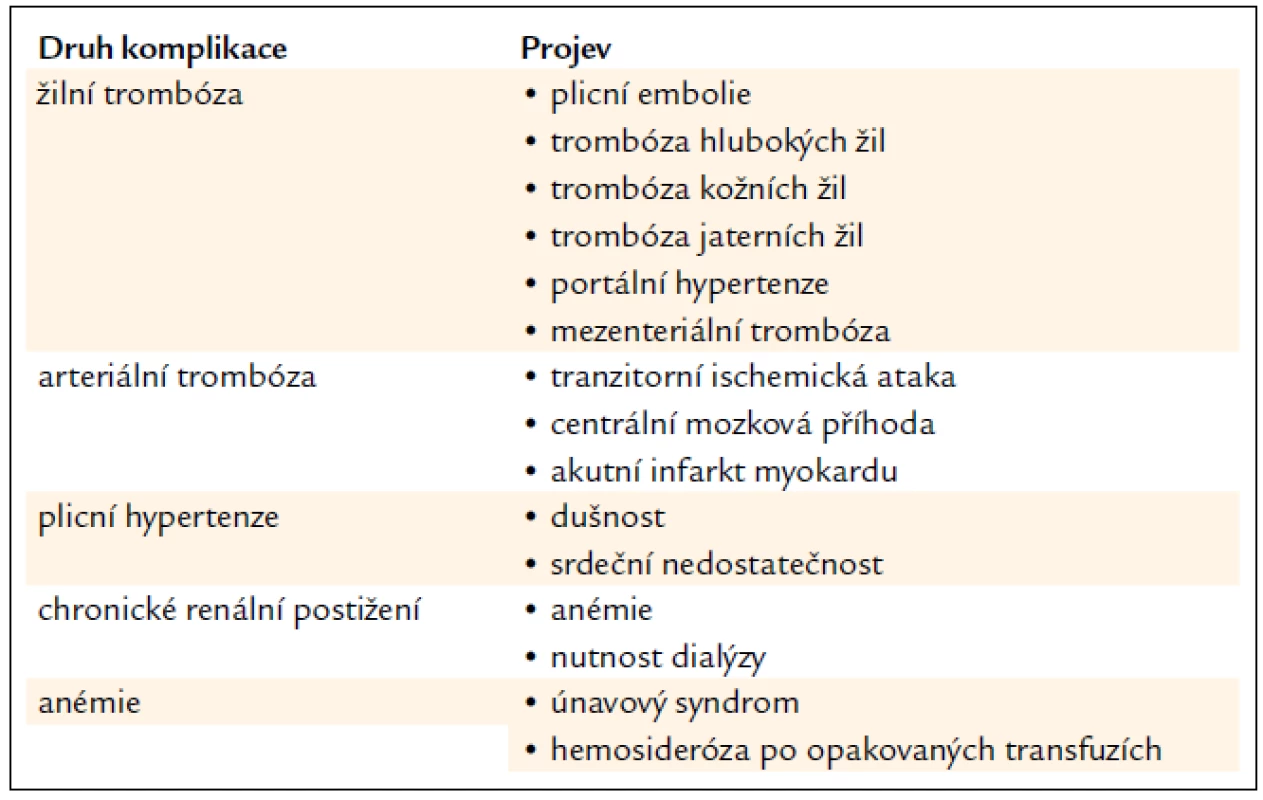
Paroxysmální noční hemoglobinurie (PNH) je vzácné klonální onemocnění krvetvorby, které se projevuje intravaskulární hemolýzou s hemoglobinurií (hemolytická forma), imunitně podmíněnou aplazií kostní dřeně (hypoplastická forma) a sklonem k trombózám [1,2]. Biologickou podstatou onemocnění je somatická mutace PIG-A genu (phosphatidyl inositol glycan class A) na úrovni kmenové buňky, která blokuje syntézu GPI kotvy [3,4]. Důsledkem mutace je částečný nebo kompletní deficit GPI kotvených proteinů na povrchu PNH buněk (tab. 1) [5,6]. GPI kotvené glykoproteiny CD55 (DAF) a CD59 (MIRL) hrají klíčovou roli pro inhibici aktivity C3, C5, C5b, C6, C8, C9 složek komplementu, jejich nepřítomnost je hlavní příčinou akutních a chronických atak intravaskulární hemolýzy [7,8]. Volný hemoglobin, nedostatečné odbourávání oxidu dusnatého a hemoglobinurie jsou podstatou patogenetického mechanizmu vzniku klinických komplikací (tab. 2) [9]. Klinické projevy závisí na velikosti patologického klonu a mohou být rozličné od trvalé hemolýzy různého stupně přes opakovaně hemolytické krize se známkami akutní renální insuficience až ke klinicky němému průběhu, jehož první manifestací může být až obraz Budd-Chiariho syndromu se splenomegalií a známkami jaterního selhávání.
Klinické indikace k vyšetření PNH klonů (screening, diagnostika, monitorování)
PNH je komplexní onemocnění, v kontextu klinických příznaků je každý pacient jedinečný. Riziko závažných klinických komplikací a moderní léčba hemolytické formy humanizovanou protilátkou proti C5 složce komplementu vedlo k rozšíření klinických indikací pro vyšetření tohoto onemocnění (tab. 3) [10,11]. U pacientů s již stanovenou diagnózou a významným PNH granulocytárním klonem (> 90 %) chorobu monitorujeme každých 6 měsíců první 2 roky a dále 1krát ročně. U pacientů s AA bez přítomnosti PNH buněk nebo s jejich nízkým počtem je vhodné častější monitorování (1krát za 3 měsíce), obzvlášť u pacientů se zahájenou imunosupresivní terapií z důvodu rizika vzniku nebo nárůstu již přítomného PNH klonu a přechodu do PNH. U pacientů s PNH granulocytárním klonem v rozmezí 20–80 % a zachovanou reziduální hematopoézou se doporučuje častější monitorování množství PNH buněk k posouzení dynamiky choroby. Vyšetření zastoupení PNH klonu je nutné provést vždy při známkách progrese choroby na základě pravidelných kontrol krevního obrazu a LDH [12,13]. V současné době neexistuje konsenzus týkající se frekvence vyšetření PNH klonů u pacientů na terapii eculizumabem.

Princip vyšetření průtokovou cytometrií
Základním principem vyšetření průtokovou cytometrií je průkaz částečného nebo kompletního deficitu nejméně dvou GPI-kotvených proteinů na povrchu buněk nejméně ze dvou vývojových řad (erytrocyty, monocyty, neutrofily) [14,15].
Stanovení PNH erytrocytů
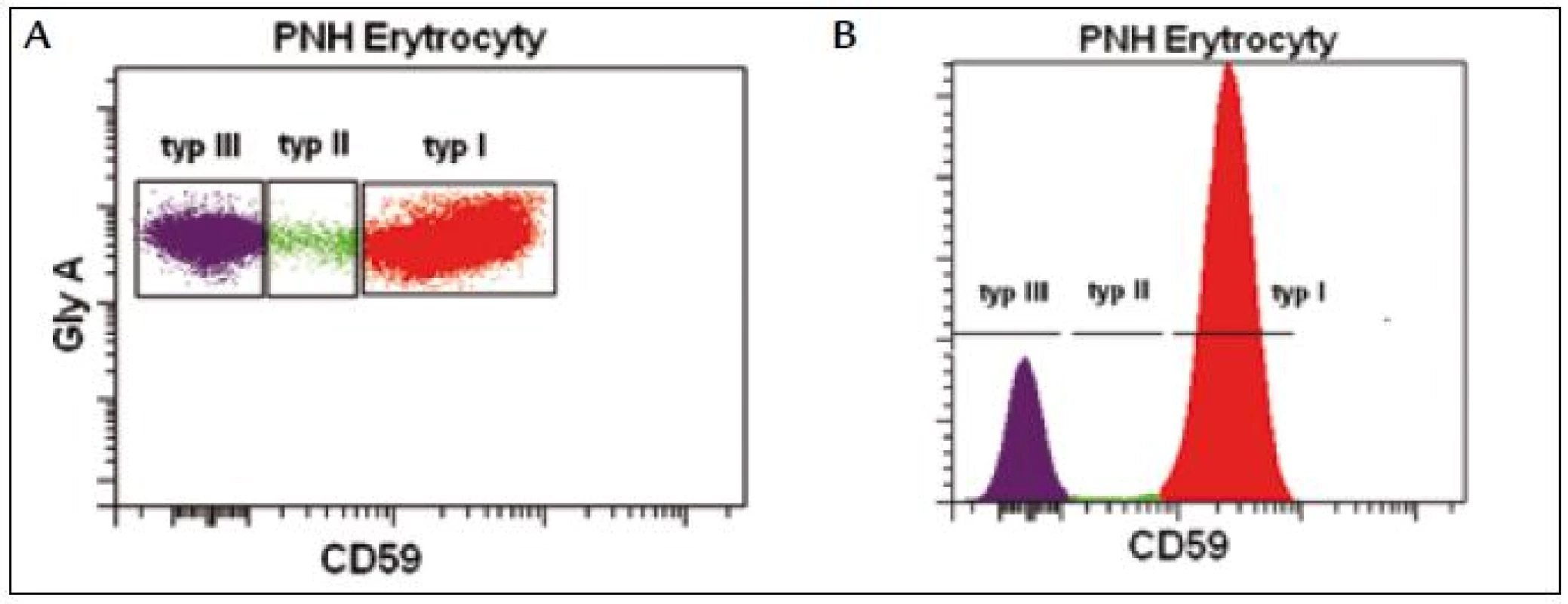
Průkaz PNH erytrocytů se standardně provádí vyšetřením exprese povrchových GPI kotvených proteinů CD55 a CD59. Cílem vyšetření je detekovat a odlišit erytrocyty s normální antigenní expresí (typ I), s částečnou antigenní expresí (typ II) a erytrocyty s kompletním antigenním deficitem (typ III) (obr. 1). Průkaz PNH erytrocytů poskytuje důležitou klinickou informaci, přesto přítomnost čerstvě transfundovaných erytrocytů (nepřesný odhad velikosti PNH klonu), častá in vivo hemolýza PNH erytrocytů typu III a výskyt vzácných forem PNH bez přítomnosti PNH erytrocytů omezují jeho diagnostický význam [9,14]. Nicméně z klinické praxe je známo, že přítomnost méně než 15 % PNH erytrocytů typu III je většinou spojena jen s mírnými laboratorními příznaky hemolýzy bez klinických projevů a komplikací, tento nález bývá často přítomen u tzv. „PNH like“ MDS. Nález více než 30 % PNH erytrocytů typu III bývá velmi často spojen s klinickými příznaky a opakovaným nálezem hemoglobinurie a nemocní s > 50 % PNH erytrocytů tohoto typu mívají opakovaně ataky závažné hemolýzy s vysokým rizikem zejména trombotických komplikací [16].
Běžné postupy vyšetření PNH erytrocytů
Expresi antigenů CD55 a CD59 stanovujeme kvalitativně (bez kvantifikace fluorescence) za použití vhodných kontrol: neznačené erytrocyty pacienta slouží jako negativní kontrola, značené non-PNH erytrocyty od pacienta (PNH klon < 100 %), případně od zdravého dárce, naopak jako pozitivní kontrola. Exprese CD59 na erytrocytech je silnější, což umožňuje lepší rozlišování PNH erytrocytů typu III od PNH erytrocytů typu II. Kompletní deficit CD59 na erytrocytech (typ III) souvisí přímo s intravaskulární hemolýzou, je-li PNH klon arbitrárně větší než 20 %. Pacienti s PNH erytrocyty typu II bez přítomnosti PNH erytrocytů typu III mají oproti tomu převážně retikulocytózu, zvýšené LDH a minimální hemolýzu. Význam stanovení exprese CD55 na erytrocytech není v literatuře jednoznačně dokumentován, jeho samostatné vyšetření se z tohoto důvodu nedoporučuje. Identifikace erytrocytů na základě fyzikálních parametrů dopřední (FSC) a boční (SSC) rozptyl je pro běžná vyšetření PNH erytrocytů dostačující, pro zlepšení citlivosti metodiky lze použít i další erytrocytární znak – CD235a [15].
Standardizované metody analýzy PNH erytrocytů
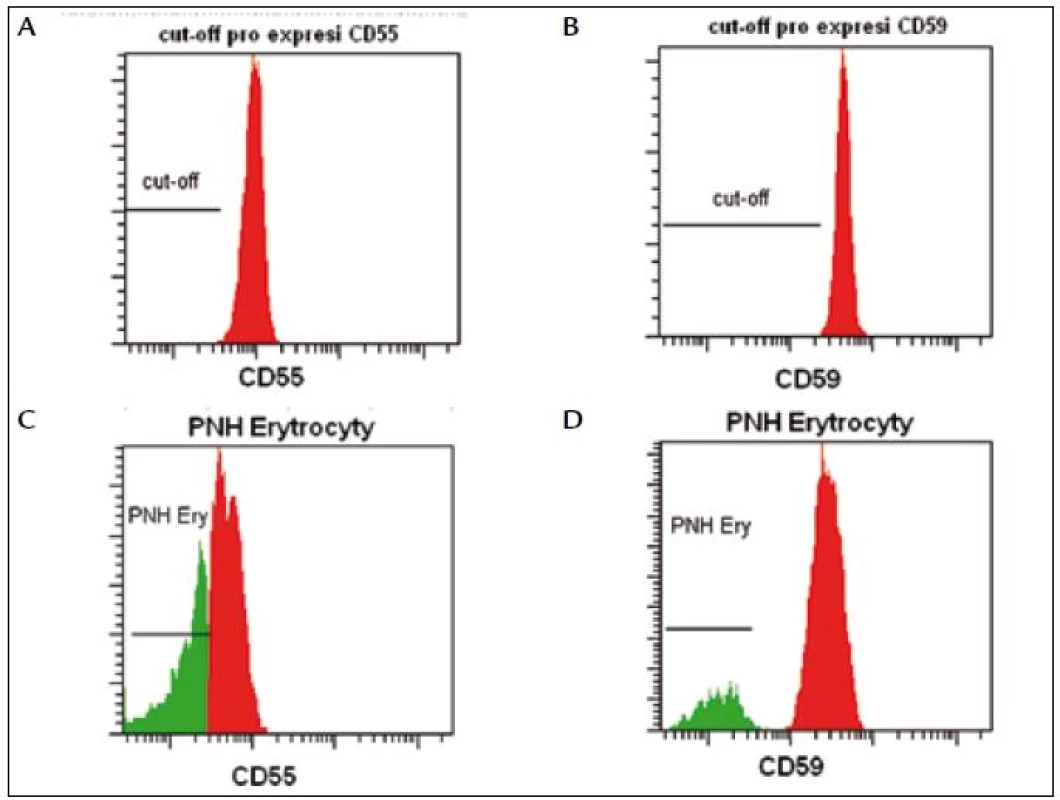
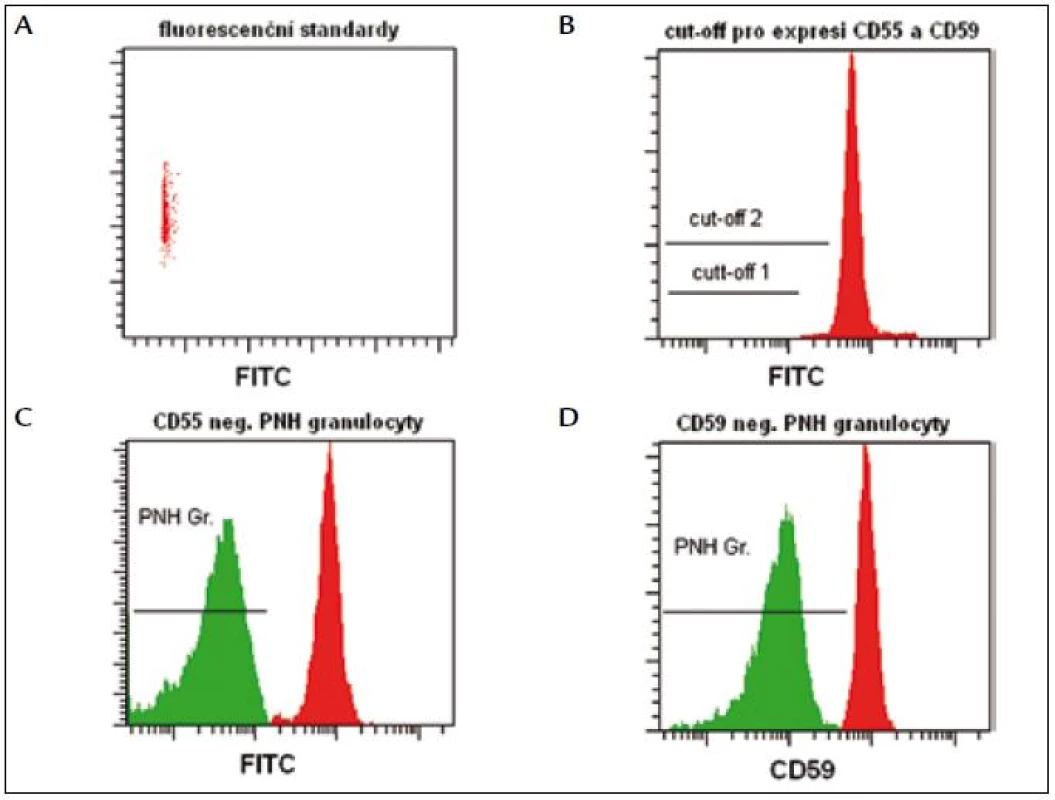
PNH RedquantTM (Biocytex, Francie) je jediná komerčně dostupná souprava, která umožňuje standardizované (CE, IVD) stanovení PNH erytrocytů. Za použití fluorescenčních standardů se definuje fluorescenční práh (cut-off), podle kterého odlišujeme normální erytrocyty (oblast nad prahem) od PNH erytrocytů (oblast pod prahem) (obr. 2). Vzhledem k citlivosti (3 % PNH buněk) metodika není vhodná pro detekci nízkých počtů PNH klonů u pacientů s AA a myelodysplastickým syndromem (MDS). Relativním nedostatkem kromě vysoké ceny je časová náročnost vyšetření.
Doporučené postupy pro analýzu PNH erytrocytů
Mezinárodní společnost pro klinickou průtokovou cytometrii (ICCS) vydala v roce 2010 vůbec první dokument týkající se doporučených postupů pro diagnostiku a monitorování PNH průtokovou cytometrií. Dokument rozlišuje rutinní/diagnostické vyšetření PNH a vyšetření metodikou s vysokou citlivostí na průkaz nízkých počtů PNH buněk [15].
Rutinní vyšetření PNH erytrocytů
Účel rutinního vyšetření PNH erytrocytů je diagnostický. Požadovaná citlivost je 1 % PNH buněk, proto je nutná analýza minimálně 5 000 erytrocytů. Identifikace erytrocytů se provádí na základě fyzikálních parametrů FSC/SSC. Stanovuje se exprese antigenu CD59, samostatně nebo v kombinaci s antigenem CD55. Z dostupných fluorochromů na značení anti-CD59 monoklonální protilátky (MP) volíme phycoerythrin (PE). Optimální titrace MP je kriticky důležitá pro analýzu z důvodu aglutinačního efektu na erytrocytech. Účelem vyšetření je stanovení PNH erytrocytů typu III, přítomnost PNH erytrocytů typu II je nutné popsat. Neznačené erytrocyty pacienta slouží jako negativní kontrola, značené non PNH erytrocyty pacienta (PNH klon < 100 %), případně zdravého dárce, naopak jako pozitivní kontrola.
Techniky s vysokou citlivostí na analýzu PNH erytrocytů
Účelem vyšetření metodikou s vysokou citlivostí je detekce nízkých počtů PNH erytrocytů u pacientů s AA a refrakterní cytopenií s dysplazií v jedné řadě (RCUD). Imunosupresivní terapie může vést ke vzniku nebo nárůstu stávajícího PNH klonu, dokonce až ke vzniku PNH. Cílová citlivost vyšetření je 0,01 %, proto je nutná analýza 250 000–1 000 000 erytrocytů. Identifikaci erytrocytů provádíme na základě fyzikálních a fluorescenčních parametrů FSC/SSC/CD235, analýzu dat provádíme ve dvouparametrových grafech (obr. 1). Analyzujeme expresi CD59, případně v kombinaci s CD55. Z dostupných fluorochromů pro anti-CD235a MP přednostně volíme fluorescein isothiokyanát (CD235a FITC) a pro anti-CD59 MP phycoerytrin (CD59 PE). Neznačené erytrocyty pacienta slouží jako negativní kontrola, značené erytrocyty zdravého jedince nebo non PNH erytrocyty pacienta (PNH klon < 100 %) naopak jako pozitivní kontrola.
Stanovení PNH leukocytů
Stanovení PNH neutrofilů a monocytů poskytuje přesnější informaci o reálném zastoupení PNH klonu, vyšetření má diagnostický význam. Analýza PNH lymfocytů se nedoporučuje z důvodu variabilní exprese GPI-kotvených proteinů [14,17].
Běžné metodiky na vyšetření PNH granulocytů a monocytů
Pro stanovení PNH leukocytů se dlouhodobě provádělo a stále provádí kvalitativní vyšetření exprese antigenů CD55 a CD59. Exprese CD55 na monocytech je silnější než exprese CD59, proto má na rozdíl od erytrocytů větší diagnostický význam. Analýza exprese CD55 a CD59 antigenů na granulocytech má však omezenou schopnost pro identifikaci PNH buněk, často bývá příčinou záchytu nižších PNH klonů, vyšetření se navíc vyznačuje vysokým variačním koeficientem. V praxi se vyšetřují přednostně jiné GPI kotvené proteiny: CD14, CD16, CD24, CD48, CD66b, CD157 [18].
Standardizované metody analýzy PNH leukocytů
PNH CellquantTM (Biocytex, Francie) je jediný komerčně dostupný, standardizovaný (CE, IVD) kit na stanovení PNH granulocytů. I v tomto případě se používají fluorescenční standardy na stanovení fluorescenčního prahu, podle kterého definujeme normální (oblast nad prahem) a PNH granulocyty (oblast pod prahem) (obr. 3). Citlivost metodiky (3 % PNH buněk) určuje její význam pouze pro diagnostiku. Jistá nevýhoda je časová náročnost vyšetření a nutnost zpracování materiálu nejpozději do 8 hod po odběru.
Kvalitativní vyšetření exprese dalších GPI kotvených proteinů
CD14 je transmembránový glykoprotein, který je silně exprimován na povrchu monocytů a makrofágů. Exprese na povrchu mladých monocytů je slabá, přesto je marker vhodný pro diagnostické účely (≥ 1 % PNH monocytů), samostatně nebo v kombinaci s jinými PNH markery (CD24). Přítomnost dendritických buněk v periferní krvi, které neexprimují antigen CD14, může být příčinou falešného PNH klonu, z toho důvodu není vyšetření vhodné pro stanovení nízkých počtů (< 0,1 %) PNH monocytů vysoce citlivými technikami [18].
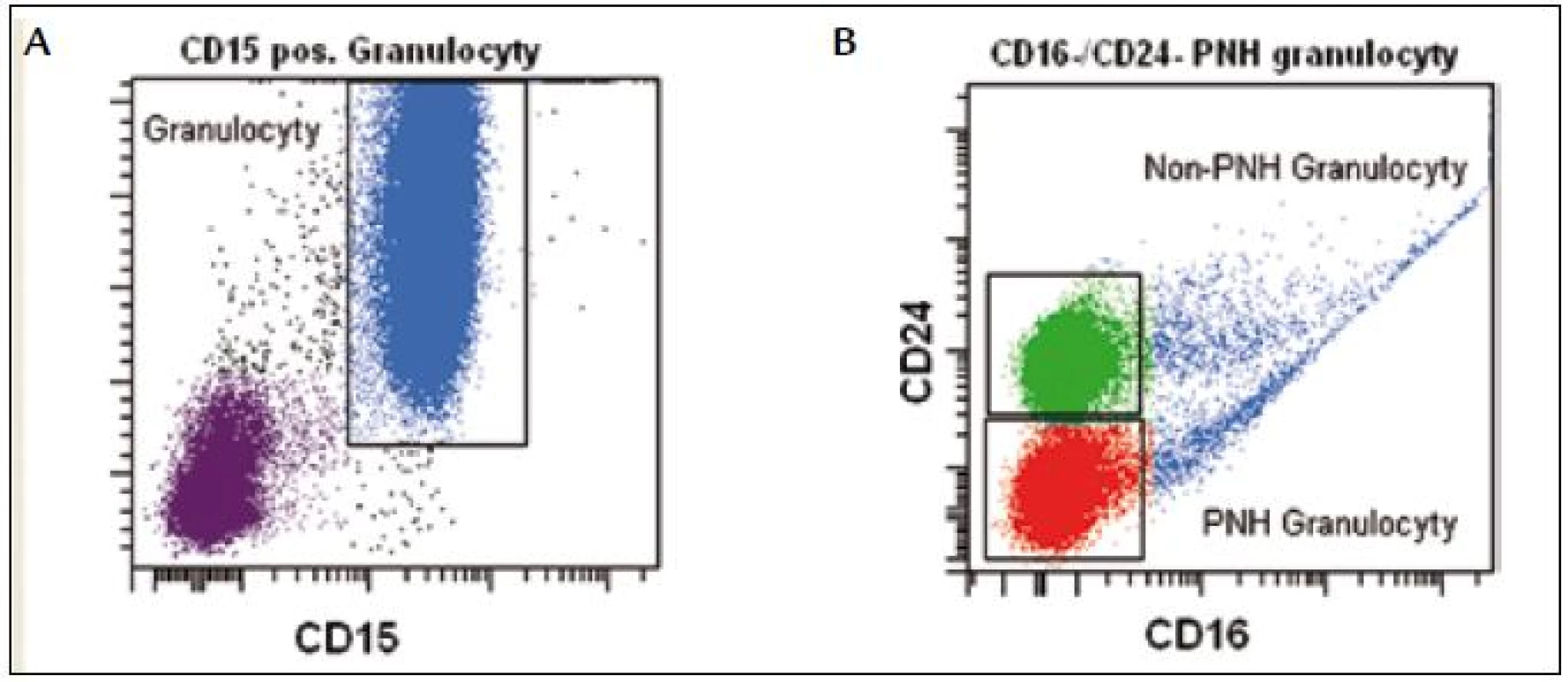
CD16 z rodiny imunoglobulinů je Fc receptorem pro imunoglobuliny třídy IgG. Vyskytuje se na povrchu NK buněk, makrofágů a neutrofilů. Eozinofily neexprimují CD16 a jejich přítomnost v periferní krvi může být příčinou falešného PNH klonu. Použití CD16 jako samostatného markeru se nedoporučuje, lze ho však použít v kombinaci s jiným PNH markerem (CD24, CD55, CD58, CD59). Dalším potenciálním problémem je částečný nebo kompletní deficit CD16 antigenu na granulocytech u pacientů s MDS (obr. 4) [18]. CD24 je malý, povrchový sialoglykoprotein, který je exprimován na povrchu zralých lymfocytů a přetrvává až do plazmocytární diferenciace. CD24 je vhodný marker na průkaz PNH granulocytů a monocytů rutinními nebo vysoce citlivými technikami, nejlépe v kombinaci s dalším PNH markerem. CD66b je transmembránový glykoprotein z rodiny imunoglobulinů, který je převážně exprimován na povrchu granulocytů. Na průkaz PNH neutrofilů se používá vždy v kombinaci s dalším PNH markerem.
Stanovení PNH leukocytů metodou FLAER
Aeromonas hydrophila syntetizuje bakteriální enzym proaerolyzin (52 kD), jehož aktivní forma aerolyzin rozpoznává GPI kotvu a následně lyzuje non PNH buňky. FLAER představuje inaktivovanou formu aerolyzinu značenou fluorochromem Alexa 488. V posledních letech se používá v diagnostice PNH s narůstající oblibou, obzvlášť v detekci nízkých počtů PNH buněk vysoce citlivými technikami. FLAER lze použít samostatně, většinou však v kombinaci s dalšími PNH markery a markery na specifickou identifikaci cílových populací [19,20].
Doporučené postupy pro analýzu PNH leukocytů dle ICCS
Rutinní vyšetření leukocytů za účelem stanovení diagnózy
Požadovaná citlivost vyšetření je 1 %, proto je nutná analýza 5 000–10 000 neutrofilů.
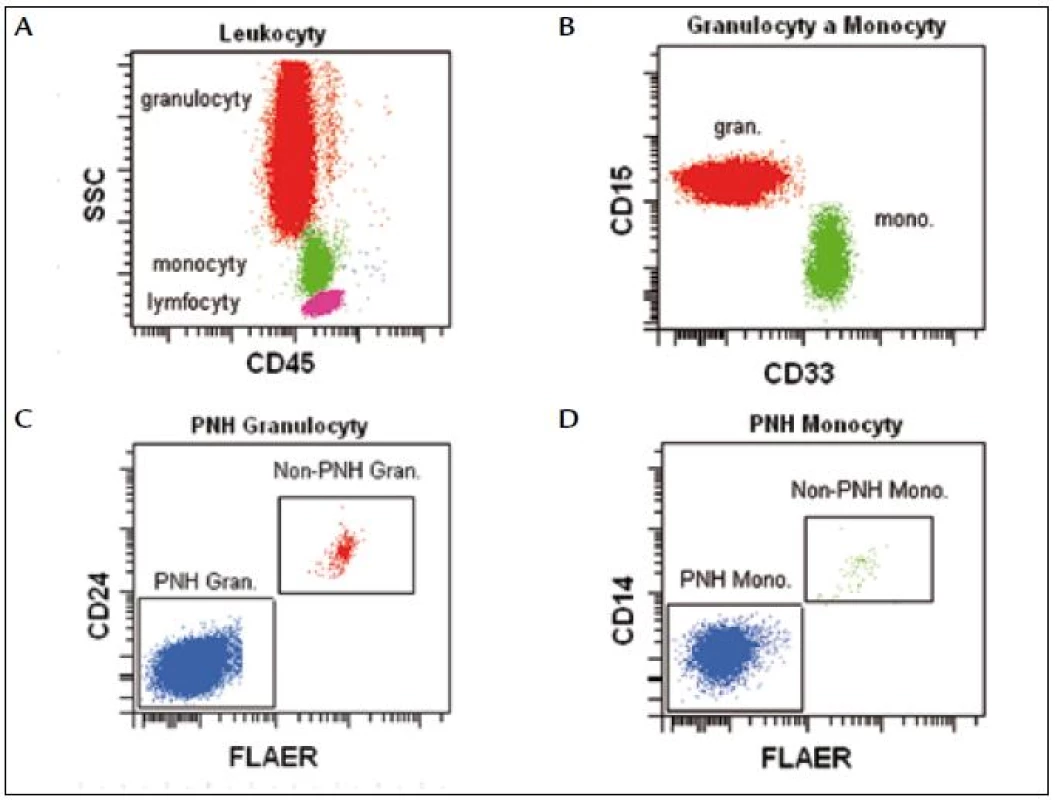
Identifikaci monocytů a granulocytů provádíme na základě fyzikálních a fluorescenčních parametrů FSC//SSC/CD45. Pro vyšší citlivost používáme markery specifické pro vývojovou řadu: CD15 pro granulocyty a CD33 pro monocyty. Na cílových populacích analyzujeme expresi FLAER v kombinaci s CD24 (granulocyty) a CD14 (monocyty) (obr. 5).
Vyšetření leukocytů za účelem monitorování PNH klonů u AA/MDS
Požadovaná citlivost vyšetření je 0,01 %, proto je nutná analýza nejméně 250 000 neutrofilů. Identifikaci leukocytů provádíme na základě fyzikálních a fluorescenčních parametrů: SSC/CD45/CD15silně+/CD33slabě+ (granulocyty), SSC/CD45/CD15slabě+/CD33silně+ (monocyty). Na cílových populacích vyšetřujeme expresi FLAER v kombinaci s CD24 (neutrofily) a CD14 (monocyty).
V souvislosti s laserovým vybavením průtokového cytometru lze pro analýzu neutrofilů a monocytů volit 4barevný (FLAER/CD24/CD14/CD33), 5barevný (FLAER/CD24/CD14/CD15/CD45, FLAER/CD24/CD14/CD33/CD45, FLAER/CD24/CD14/CD15/CD33) nebo 6barevný (FLAER/CD24/CD14/CD15/CD33/CD45) protokol. Součástí jednotlivých protokolů jsou jak markery na identifikaci cílových populací, tak i nejméně 2 markery pro každou řadu na průkaz GPI defektu.
Preanalytické požadavky k vyšetření PNH erytrocytů a leukocytů dle ICCS
Pro vyšetření PNH je nutné dodat 1–3 ml periferní krve (v souvislosti s WBC) odebrané do zkumavek s antikoagulačním činidlem. Lze použít kyselinu ethylendiamintetraoctovou (EDTA), heparin nebo citrát sodný (ACD). Stabilita vzorku při pokojové teplotě je 24 hod, následně je nutné materiál uchovat při 4 °C. Analýzu leukocytů provádíme do 48 hod po odběru, analýzu erytrocytů můžeme provést do 7 dní. Pro lyzaci erytrocytů lze použít ammonium chloratum (NH4Cl) komerční nebo vlastní výroby.
Hlášení výsledku a externí hodnocení kvality vyšetření (EHK)
Při záchytu PNH populace je nutné popsat vývojovou řadu (erytrocyty, monocyty, granulocyty), procentuální zastoupení klonu a charakter defektu (kompletní – typ III, částečný – typ II). Při menších počtech PNH buněk je vhodné doplnit, že výsledek nesvědčí pro hemolytickou formu PNH, při negativních nálezech u pacientů s AA nebo MDS je naopak vhodné doporučit další vyšetření s časovým odstupem. Při opakovaném vyšetření popisujeme vývoj nálezu.
Nutná součást správné laboratorní praxe (SLO) je účast v cyklech externího hodnocení kvality nebo mezilaboratorního porovnání. Externí hodnocení kvality vyšetření v rámci Evropy zajišťuje zatím pouze UK NEQAS [21].
Závěr
Průtoková cytometrie se používá pro fenotypizaci PNH buněk od roku 1986, od roku 1996 se stává metodou volby pro diagnostiku a monitorování onemocnění. Velikost a charakter PNH klonu při diagnóze bezprostředně souvisí s klinickým průběhem – vstupní záchyt více než 90 % PNH granulocytů vylučuje možnost remise onemocnění, monitorování u pacientů s nižším PNH granulocytárním klonem je důležité k posouzení progrese, regrese, remise či odpovědi na terapii. Dostupnost metodiky s vysokou citlivostí (< 0,1 %) umožňuje sledování pacientů s AA a včasné zjišťování změn v klinickém průběhu ve smyslu hemolýzy a rizika trombózy. Velikost PNH erytrocytárního klonu má rovněž význam pro posouzení stupně závažnosti choroby a rizika zejména trombotických komplikací.
Narůstající význam vyšetření PNH průtokovou cytometrií v posledních letech výrazně kontrastoval s absencí konsenzuálního dokumentu týkajícího se doporučených laboratorních postupů. Tento paradox byl vyřešen na konci roku 2010, kdy ICCS vydala guidelines pro diagnostiku a monitorování PNH průtokovou cytometrií. Dokument obsahuje podrobnou analýzu doposud běžně používaných metod, popisuje nová reagencia a laboratorní protokoly v souladu s pokrokem průtokové cytometrie, nabízí standardizované postupy pro analýzu a poskytuje nezbytné podklady pro zavedení a validaci vlastních postupů pro adekvátní vyšetření PNH, které však musí být ověřené v externích cyklech kontroly kvality.
MUDr. Iuri Marinov, CSc.
www.uhkt.cz
e-mail: iuri.marinov@uhkt.cz
Doručeno do redakce: 7. 3. 2011
Přijato po recenzi: 19. 4. 2011
Sources
1. Oni SB, Osunkoya BO, Luzzatto L. Paroxysmal nocturnal hemoglobinuria: Evidence for monoclonal origin of abnormal red cells. Blood 1970; 36: 145–152.
2. Moyo VM, Mukhina GL, Garrett ES et al. Natural history of paroxysmal nocturnal haemoglobinuria using modern diagnostic assays. Br J Haematol 2004; 126: 133–138.
3. Bessler M, Mason PJ, Hillmen P et al. Paroxysmal nocturnal hemoglobinuria (PNH) is caused by somatic mutations in the PIG-A gene. EMBO J 1994; 13: 110–117.
4. Nafa K, Bessler M, Castro-Malaspina H et al. The spectrum of somatic mutations in the PIG-A gene in paroxysmal nocturnal hemoglobinuria includes large deletions and small duplications. Blood Cells Mol Dis 1998; 24: 370–384.
5. van der Schoot CE, Huizinga TW, van’t Veer-Korthof ET et al. Deficiency of glycosyl-phosphatidylinositol-linked membrane glycoproteins of leukocytes in paroxysmal nocturnal hemoglobinuria, description of a new diagnostic cytofluorometric assay. Blood 1990; 76: 1853.
6. Hillmen P, Bessler M, Mason PJ et al. Specific defect in N-acetylglucosamine incorporation in the biosynthesis of the glycosylphosphatidylinositol anchor in cloned cell lines from patients with paroxysmal nocturnal hemoglobinuria. Proc Natl Acad Sci USA 1993; 90: 5272–5276.
7. Yamashina M, Ueda E, Kinoshita T et al. Inherited complete deficiency of 20-kilodalton homologous restriction factor (CD59) as a cause of paroxysmal nocturnal hemoglobinuria. N Engl J Med 1990; 323: 1184–1189.
8. Motoyama N, Okada N, Yamashina M et al. Paroxysmal nocturnal hemoglobinuria due to hereditary nucleotide deletion in the HRF20 (CD59) gene. Eur J Immunol 1992; 10: 2669–2673.
9. Parker C, Omine M, Richards S et al. International PNH Interest Group. Diagnosis and management of paroxysmal nocturnal hemoglobinuria. Blood 2005; 106: 3699–3709.
10. Hillmen P, Lewis SM, Bessler M et al. Natural history of paroxysmal nocturnal hemoglobinuria. N Engl J Med 1995; 333: 1253–1258.
11. Hill A, Hillmen P, Richards SJ et al. Sustained response and long-term safety of eculizumab in paroxysmal nocturnal hemoglobinuria. Blood 2005; 106: 2559–2565.
12. Hillmen P, Richards SJ. Flow cytometry in PNH: Serial analysis and the prediction of outcome (abstract). Blood 1999; 94 (S1): 412a.
13. Richards SJ, Cullen MJ, Dickinson AJ et al. Evolution of GPI-deficient clones predicts clinical course in paroxysmal nocturnal haemoglobinuria. Blood 2004; 104: 53a.
14. Richards SJ, Rawstron AC, Hillmen P. Application of flow cytometry to the diagnosis of paroxysmal nocturnal hemoglobinuria. Cytometry (Comm Clin Cytom) 2000; 42: 223.
15. Borowitz MJ, Craig FE, Di Giuseppe JA et al. Clinical Cytometry Society. Cytometry. Part B. Clinical Cytometry 2010; 78B: 211–230.
16. Čermák J, Marinov I, Jelínek J. Clinical significance of CD55 and CD59 deficiency in patients with primary myelodysplastic syndrome. Blood 2000; 96: 146–147a.
17. Hall SE, Rosse WF. The use of monoclonal antibodies and flow cytometry in the diagnosis of paroxysmal nocturnal hemoglobinuria. Blood 1996; 87: 5332.
18. Olteanu H, Karanadikar NJ, McKenna RW et al. Differential usefulness of various markers in the flow cytometric detection of paroxysmal nocturnal hemoglobinurie in blood and bone marrow. Am J Clin Pathol 2006; 126: 781–788.
19. Sutherland DR, Kuek N, Davidson J et al. Diagnosing PNH with FLAER and Multiparameter Flow Cytometry. Cytometry B Clin Cytom 2007; 72B: 167.
20. Brodsky RA, Mukhina GL, Nelson KL et al. Resistance of paroxysmal nocturnal hemoglobinuria cells to the glycosylphosphatidylinositol-binding toxin aerolysin. Blood 1999; 93: 1749–1756.
21. Granger V, Whitby L, Richards SJ et al. Development and evaluation of a stabilized whole-blood preparation as a quality control material for screening for paroxysmal nocturnal haemoglobinuria by flow cytometry (abstract). Cytometry B Clin Cytom 2005; 68B: 59.
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Internal Medicine

2012 Issue 1
Most read in this issue
- Endokrinné zmeny pri chorobách pečene
- Hyponatriémia pri syndróme neprimeranej sekrécie vazopresínu (SIADH) – možnosti liečby
- Podrobná studie o polypech tlustého střeva
- Hyponatrémia – komplikácia liečby karbamazepínom
