Lenalidomid indukoval léčebnou odpověď u pacienta s agresivní multisystémovou formou histiocytózy z Langerhansových buněk (LCH), rezistentní ke 2-chlorodeoxyadenosinu a časně relabující po vysokodávkované chemoterapii BEAM s autologní transplantací kmenových hemopoetických buněk
Lenalidomide induced therapeutic response in a patient with aggressive multi-system Langerhans cell histiocytosis resistant to 2-chlorodeoxyadenosine and early relapsing after high-dose BEAM chemotherapy with autologous peripheral blood stem cell transplantation
Adult Langerhans cell histiocytosis (LCH) usually follows a favorable course. Very rarely, however, multi-system (multi-organ) LCH difficult to manage either with traditional first line treatment (vinblastine, mercaptopurine, prednisone or etoposide) or 2-chlorodeoxyadenosine occurs. In these patients, other treatment modalities have to be used. We describe a patient with LCH manifesting with generalized lymphadenopathy and infiltrating the pulmonary parenchyma and skin. The disease activity was always associated with B-symptoms (weight loss, subfebrile states, night sweats). Histological investigations repeatedly showed higher proliferation activity than that usual in adult patients with LCH. Expression of Ki-67 proliferation marker was up to 30% and there were 8–10 cells in mitosis in the microscope viewing field. Therefore, therapy started with the application of stimulation regimen (cyclophosphamide 2 g/m2 on day 1 and etoposide 200 mg/m2 on days 1–3) followed by collection of peripheral blood stem cells. Then, treatment with 2-chlorodeoxyadenosine, the first 3 cycles as monotherapy of 5 mg/m2 SC on days 1–5 in 28-day cycles, the next 3 cycles in combination with cyclophosphamide 150 mg/m2 on days 1–5 and methylprednisolone 250 mg on days 1–5, was used. However, the disease relapsed 2 months after completion of the therapy. This early relapse was treated with 4 cycles of CHOEP chemotherapy (cyclophosphamide, doxorubicin, vincristine, etoposide, prednisone). Following the 4th cycle of CHOEP, high-dose BEAM chemotherapy (carmustine, etoposide, cytarabine, melphalan) with autologous stem cell transplantation were administered. According to the follow-up PET-CT examination, this treatment resulted in complete disease remission. However, the disease relapsed again in the lymph nodes, lungs, skin and bones 5 months after the high-dose chemotherapy. The progression was documented on PET-CT scanning. Lenalidomide 25 mg daily for 21 days in 28-day cycles with dexamethasone 20 mg once a week were administered as the 4th line treatment. After the 4th cycle of lenalidomide, PET-CT was performed, where the CT component suggested a significant reduction (more than 50%) in the size of the lymph nodes and the PET component showed substantial reduction in fluorodeoxyglucose accumulation in the affected lymph nodes as well as in the bone lesions. HRCT showed disappearance of pulmonary nodules. During the treatment, CRP levels declined and hemoglobin rose from 110 to 141 g/l, i.e. partial remission was achieved after 4 cycles. Etoposide (100 mg IV) was added to lenalidomide and dexamethasone on days 22, 23 and 24 of the above mentioned 28-day cycle. The added etoposide further intensified treatment response. In all, 11 cycles of this chemotherapy were given, resulting in complete remission confirmed by follow-up PET-CT. The achieved remission was consolidated using allogeneic bone marrow transplantation after FLAMSA reduced intensity conditioning without amsacrine. Four months after allogeneic transplantation, the patient has been relapse free. Herein we presented treatment response of highly aggressive LCH to lenalidomide. The used four cycles led to partial remission only and with the combination of lenalidomide, dexamethasone and etoposide the treatment response was further intensified to complete remission.
Key words:
Langerhans cell histiocytosis – lenalidomide – 2-chlorodeoxyadenosine – etoposide
Authors:
Z. Adam 1; Z. Řehák 2; R. Koukalová 2; P. Szturz 1; M. Krejčí 1; L. Pour 1; L. Zahradová 1; M. Moulis 3; R. Kodet 4; T. Nebeský 5; M. Brejcha 6; Z. Adamová 7; R. Hájek 1; J. Mayer 1
Authors‘ workplace:
Interní hematoonkologická klinika Lékařské fakulty MU a FN Brno, pracoviště Bohunice, přednosta prof. MUDr. Jiří Mayer, CSc.
1; Oddělení nukleární medicíny, centrum PET Masarykova onkologického ústavu Brno, přednosta prim. MUDr. Karol Bolčák
2; Ústav patologie Lékařské fakulty MU a FN Brno, pracoviště Bohunice, přednosta doc. MUDr. Josef Feit, CSc.
3; Ústav patologie a molekulární medicíny 2. lékařské fakulty UK a FN Motol Praha, přednosta prof. MUDr. Roman Kodet, CSc.
4; Radiologická klinika Lékařské fakulty MU a FN Brno, pracoviště Bohunice, přednosta prof. MUDr. Vlastimil A. Válek, CSc.
5; Hematologické oddělení Komplexního onkologického centra Nový Jičín, přednosta prim. MUDr. Martin Brejcha
6; Chirurgické oddělení Nemocnice Vsetín, přednosta prim. MUDr. Jaroslav Sankot
7
Published in:
Vnitř Lék 2012; 58(1): 62-71
Category:
Case Reports
Overview
Histiocytóza z Langerhansových buněk (LCH) u dospělých je ve většině případů příznivě probíhající nemoc. Zcela ojediněle se však vyskytne LCH s multisystémovým (multiorgánovým) postižením, která nereaguje na klasickou léčbu první linie (vinblastin, merkaptopurin, prednison anebo etoposid) ani na léčbu 2-chlorodeoxyadenosinem. U těchto pacientů je nutné testovat jiné léčebné alternativy. Popisujeme pacienta s LCH, která způsobila generalizovanou lymfadenopatii, infiltrovala plicní parenchym a kůži. Aktivitu nemoci vždy provázely B symptomy (úbytek hmotnosti, subfebrilie a febrilie, noční pocení). Histologické vyšetření opakovaně prokázalo vyšší proliferační aktivitu, než je obvyklá u dospělých pacientů s LCH. Exprese proliferačního markeru Ki-67 dosahovala až 30 % a v zorném poli mikroskopu bylo 8–10 mitóz. Proto byla léčba zahájena sběrem kmenových krvetvorných buněk z periferní krve po aplikaci stimulačního režimu (cyklofosfamid 2 g/m2 den 1 a etoposidu 200 mg/m2 den 1–3). Následovala léčba 2-chlorodeoxyadenosinem, v prvních 3 cyklech v monoterapii, 5 mg/m2 s.c. den 1–5 v 28denních cyklech, v dalších 3 cyklech v kombinaci s cyklofosfamidem, 150 mg/m2 den 1–5 a metylprednisolonem 250 mg den 1–5. Po 2 měsících od ukončení léčby však nemoc relabovala. Tato časná recidiva byla léčena 4 cykly chemoterapie CHOEP (cyklofosfamid, doxorubicin, vinkristin, etoposid, prednison). Po 4. cyklu CHOEP následovala vysokodávkovaná chemoterapie BEAM (BCNU, cytosin-arabinosid, etoposid, melfalan) s transplantací autologních kmenových buněk. Dle kontrolního PET-CT bylo po této léčbě dosaženo kompletní remise. Ale po 5 měsících od podání vysokodávkované chemoterapie došlo k relapsu LCH opět v uzlinách, v plicích, v kůži i v kostech. Progrese byla dokumentována pomocí PET-CT vyšetření. V rámci 4. linie léčby byl podán lenalidomid 25 mg denně po dobu 21 dní v 28denních cyklech a 1krát týdně dexametazon 20 mg. Po 4. cyklu léčby lenalidomidem bylo provedeno kontrolní PET-CT vyšetření. Dle CT zobrazení došlo k výraznému (o > 50 %) zmenšení uzlin. Dle PET hodnocení došlo k výraznému poklesu akumulace fluorodeoxyglukózy v postižených uzlinách i v kostních ložiscích. Dle HRCT vymizely plicní nodularity. U pacienta poklesly hodnoty CRP v průběhu léčby a vystoupila hodnota hemoglobinu ze 110 na 141 g/l. Takže po 4 cyklech bylo dosaženo parciální remise. Od 6. cyklu byl k dvojkombinaci lenalidomid a dexametazon přidán etoposid (100 mg i.v. ) ve dnech 22, 23 a 24 výše uvedeného 28denního cyklu. Přidání etoposidu dále výrazně prohloubilo léčebnou odpověď. Celkem bylo podáno 11 cyklů této chemoterapie, která navodila dle kontrolního PET-CT kompletní remisi. V dosažené remisi byla provedena konsolidace pomocí alogenní transplantace kostní dřeně po přípravném režimu s redukovanou intenzitou (reduced intensity conditioning) FLAMSA bez amsakrinu. Při poslední kontrole 4 měsíce po alogenní transplantaci je pacient bez recidivy nemoci. Prokázali jsme léčebnou odpověď velmi agresivní formy LCH po podání lenalidomidu. Po 4 cyklech bylo dosaženo parciální remise a léčebná odpověď byla dále prohloubena kombinací revlimid, dexametazon a etoposid do kompletní remise.
Klíčová slova:
histiocytóza z Langerhansových buněk – lenalidomid – 2-chlorodeoxyadenosin – etoposid
Úvod
Histiocytóza z Langerhansových buněk (LCH) se u dospělých nejčastěji projeví osteolytickými kostními ložisky, podobně jako mnohočetný myelom [1], nebo postižením plic s tvorbou nodularit, kavitovaných nodularit a cyst či infiltrací kůže. Méně často tato nemoc poškozuje i další tkáně a orgány (CNS, zevní zvukovod, dásně, lymfatické uzliny, játra a trávicí trubici) [2–4].
Ve většině případů LCH odpovídá velmi dobře na léčbu 1. linie a nemocní se dostanou do kompletní remise. Existuje však část nemocných, u nichž je LCH na standardní léčbu 1. linie (vinblastin, merkaptopurin, prednison anebo etoposid) rezistentní. V rámci 2. léčebné linie, anebo v rámci 1. linie u agresivních forem, se používá 2-chlorodeoxyadenosin, který je u LCH velmi účinný. Výjimečně se objeví agresivní formy této nemoci, které nereagují ani na 2-chlorodeoxyadenosin, takže nemoc dále progreduje a svého hostitele nakonec usmrtí [5–7].
Na otázku, jaký lék použít při nedostatečné účinnosti 2-chlorodeoxyadenosinu, neexistuje žádné oficiální doporučení.
V posledních letech se objevily zprávy o léčebném účinku thalidomidu u LCH. Thalidomid byl prvním lékem ze skupiny zvané „IMIDS“ neboli imunoregulatory drugs. Novějším preparátem z této skupiny je lenalidomid, který se již před lety stal standardním lékem pro mnohočetný myelom. Osvědčil se však také u jiných maligních krevních chorob. Do března roku 2011 však nebyla v literatuře publikována žádná zpráva popisující účinek lenalidomidu u LCH [8,9].
Z našich i publikovaných zkušeností s léčbou mnohočetného myelomu thalidomidem anebo lenalidomidem víme, že léčebný efekt lenalidomidu nastupuje podstatně rychleji než léčebný efekt thalidomidu. Proto jsme pro pacienta s velmi agresivní formou LCH, časně relabující po léčbě 2-chlorodeoxyadenosinem i po vysokodávkované chemoterapii s autologní transplantací krvetvorných buněk, zvolili lenalidomid. Následující popis případu dokumentuje dosažení více než parciální remise čili dobré léčebné odpovědi po 4 cyklech (4 měsících) léčby tímto preparátem a další prohloubení léčebné odpovědi kombinací lenalidomidu, dexametazonu a etoposidu.
Popis případu
Lymfomu podobný průběh LCH
Muž narozený roku 1973 byl až do roku 2008, do svých 35 let, zcela zdráv. Od léta roku 2008 začal pociťovat patologickou únavu (fatigue). Práce ho unavovala natolik, že po práci musel pro nezvladatelnou únavu ulehnout a prospat se, což u něho dříve nebývalo zvykem. Zvětšených uzlin v oblasti levého třísla si poprvé všiml v říjnu roku 2008. Postupně zjišťoval, že zvětšené uzliny má nejen v třísle, ale také na krku. Ve stejné době se objevily bolesti v oblasti pravého třísla a v bederní krajině. Od listopadu roku 2008 začaly kolísavé subfebrilie až febrilie lehce přesahující 38 °C, které trvaly až do zahájení léčby.
Histologické potvrzení nemoci
První uzlina byla extirpována z nadklíčku v listopadu roku 2008 a histologický závěr zněl: histiocytóza z Langerhansových buněk (LCH). K tomuto histologickému závěru shodně došli na morfologickém pracovišti v Novém Jičíně a v Ústavu patologie a molekulární medicíny ve FN Motol Praha.
První návštěva pacienta na našem pracovišti proběhla v únoru roku 2009. V té době již měl generalizované zvětšení lymfatických uzlin (průměr zvětšených uzlin byl 2,0–2,5 cm). Klinický obraz i průběh (mnohočetné uzlinové postižení, B symptomy) byl typický pro maligní lymfom. S podobným klinických průběhem jsme se u našich pacientů s LCH nikdy nesetkali a také v literatuře jsou LCH formy s generalizovaným postižením lymfatických uzlin a B symptomy uváděny jako výjimečné.
Proto jsme požádali chirurgické pracoviště Nemocnice Vsetín o exstirpaci další uzliny z třísla a o provedení excise kůže z perianální krajiny k histologickému vyšetření. Opakovaným histologickým vyšetřením jsme vyloučili záměnu s maligním lymfomem. Chirurgové ze Vsetína tyto diagnostické výkony ihned excelentně provedli a odebrané tkáně poslali dle naší domluvy do Ústavu patologie a molekulární medicíny v Praze a dále do Šiklova patologickoanatomickému ústavu v Plzni. Na obou pracovištích byla potvrzena opět diagnóza LCH s typickou expresí CD1a antigenu a s přítomností proteinu S-100 v patologických buňkách, které infiltrovaly jak odebrané lymfatické uzliny, tak i vzorek kůže z perianální krajiny.
Byla také vyšetřena proliferační frakce patologických buněk ve vzorku lymfatické uzliny infiltrované LCH. Patologové popsali pro tuto diagnózu zcela nezvykle vysoký proliferační index Ki-67. V jednotlivých místech preparátu kolísá od 1+ až po 3+ čili frakce od 10 % až do 30 % buněk s jasnou expresí proliferačního markeru Ki-67. Tak vysokou proliferační aktivitou se tento vzorek výrazně odlišuje od běžných nálezů u starších dětí a dospělých s LCH.
Nebylo tedy nejmenších pochyb o tom, že máme před sebou pacienta s velmi neobvyklou formou LCH, která postihuje generalizovaně lymfatické uzliny, plicní parenchym a kůži.
Stanovení rozsahu nemoci
Po histologickém ověření diagnózy vždy standardně následuje vyšetření rozsahu nemoci. Za nejdůležitější vyšetření pro vyhodnocování rozsahu a aktivity nemoci považujeme PET-CT [52].
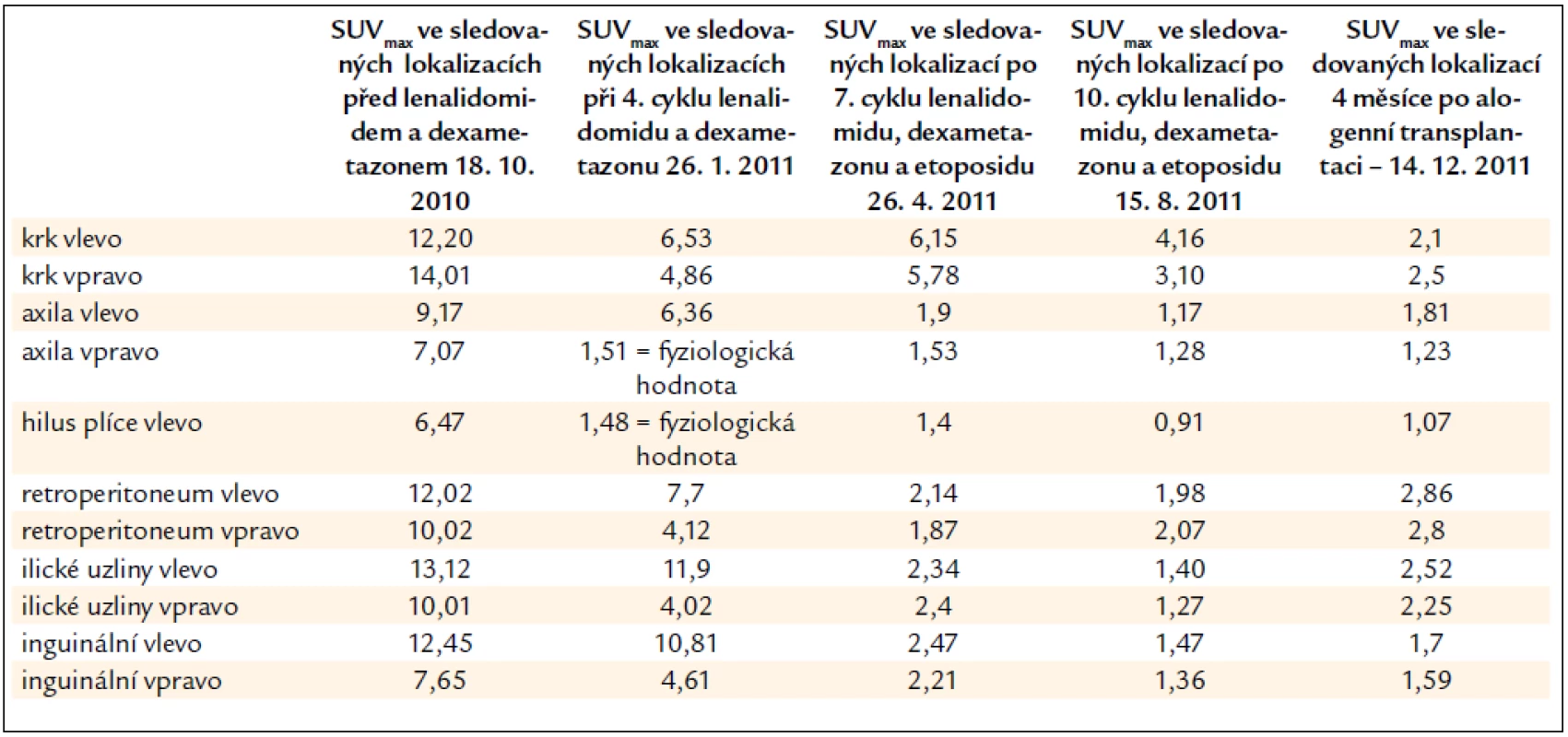
Dle vstupního PET-CT vyšetření bylo v CT obrazu zřetelné patologické zvětšení uzlin na krku, v podpaží i v retroperitoneu. V malé pánvi byly uzliny největší, jejich průměr se pohyboval kolem 3,5 cm. Při PET zobrazení tyto zvětšené uzliny výrazně akumulovaly fluorodeoxyglukózu. Míra metabolické aktivity neboli akumulace fluorodeoxyglukózy se vyjadřuje semikvantitativní analýzou SUVmax (maximum standardized uptake value). Hodnota SUVmax měřená v oblasti zvětšených uzliny byla nejnižší v oblasti axilárních uzlin (SUVmax 5,0) a nejvyšší v oblasti pravých ilických uzlin (SUVmax 12,3).
Kostní postižení nebylo v té době detekováno. Low dose CT zobrazení, provedené v rámci PET-CT vyšetření, zobrazilo v plicním parenchymu četné nodularity odpovídající plicní formě LCH.
Měli jsme tedy před sebou pacienta, u něhož LCH postihovala 3 systémy (generalizovaně lymfatické uzliny, plicní parenchym a kůži perianálně). Klinický průběh byl na tuto diagnózu nezvykle agresivní a této agresivitě odpovídal pro tuto diagnózu nezvykle vysoký proliferační index Ki-67. Tato fakta jsme zohlednili při plánování léčby.
Léčba
Etoposid a cyklofosfamid s následným sběrem kmenových buněk krvetvorby z periferní krve
Vzhledem k agresivní formě nemoci jsme se rozhodli zahájit léčbu sběrem kmenových buněk krvetvorby z periferní krve (peripheral blood stem cells – PBSC), abychom v případně neúspěchu klasické chemoterapie mohli použít vysokodávkovanou chemoterapii s autologní transplantací PBSC. Plánovaná léčba 2-chlorodeoxyadenosinem by výrazně snížila vyhlídky na úspěšný sběr po ukončení této léčby, a proto bylo nutné provést sběr před podáním 2-chlorodeoxyadenosinu. První chemoterapeutický režim, který pacient dostal v březnu roku 2009, byla tedy kombinace obsahující etoposid a cyklofosfamid (etoposid 200 mg/m2 i.v. 1., 2. a 3. den a cyklofosfamid 2 g/m2 jen 1. den). Po této chemoterapii vymizely febrilie či subfebrilie a došlo k výraznému zmenšení uzlin. Pomocí aferézy byly získány kmenové buňky krvetvorby z periferní krve, které byly zamraženy do 3 vaků. Každý ze 3 vaků obsahuje CD34+ buňky v množství 12,43 × 106/kg.
Několik dní po této chemoterapii došlo k výraznému zmenšení uzlin. Při palpačním vyšetření již velikost lymfatických uzlin nepřesahovala fyziologickou velikost (1 cm). Vymizely také klinické příznaky, subfebrilie až febrilie, noční pocení a patologická únava.
Monoterapie 2-chlorodeoxyadenosinem
V dubnu roku 2009 byla zahájena léčba 2-chlorodeoxyadenosinem 5 mg/m2 s.c. 5 dní po sobě. V průběhu této léčby byl nemocný bez jakýchkoli nežádoucích účinků a také zcela bez symptomů nemoci.
Až 25. června 2009, kdy se pacient dostavil na 4. cyklus této léčby, nás informoval o návratu svědění perianální krajiny. Dále si všiml zvětšení uzliny v pravé axile. Pohmatové vyšetření potvrdilo zvětšenou uzlinu v podpaží a sonografické vyšetření upřesnilo velikost lymfadenopatie (28 × 10 mm).
V pořadí 2. PET-CT vyšetření bylo provedeno 18. 6. 2009 (15 dní po podání chemoterapie) a bylo konstatováno, že uzliny, které byly před léčbou jednoznačně patologicky zvětšené, se zmenšily na fyziologickou velikost, a hlavně již nevykazovaly patologickou akumulaci fluorodeoxyglukózy. Toto PET-CT vyšetření také ukázalo, že došlo k částečnému zlepšení transparence obou plicních křídel.
Měli jsme tedy dle PET-CT excelentní léčebnou odpověď, ale i drobné signály pomalé recidivy. PET-CT byl tedy zdánlivě v protikladu k subjektivním potížím i sonografickému nálezu v pravé axile. Pravděpodobně to bylo způsobeno krátkým, 15denním intervalem mezi poslední injekcí 2-chlorodeoxyadenosinu (3. 6. 2009) a provedení PET CT (18. 6. 2009). Sonografické vyšetření uzlin v podpaží bylo provedeno o týden později než PET-CT vyšetření.
Svědění v perianální krajině, stejné jako před zahájením léčby, jsme vyhodnotili jako jasný signál recidivy. I sonograficky dokumentované zvětšení uzliny v pravém podpaží mohlo mít pravděpodobně původ v recidivě nemoci.
Velmi neradi jsme tedy akceptovali, že po počátečním kompletním vymizení lymfadenopatie a infiltrátu perianální krajiny opět v průběhu 3 cyklů chemoterapie 2-chlorodeoxyadenosinu dochází k recidivě nemoci.
Kombinace 2-chlorodeoxyadenosinu, cyklofosfamidu a metylprednisolonu
Vzhledem k progresi při 3. cyklu jsme se rozhodli pokračovat od 4. cyklu kombinací 2-chlorodeoxyadenosin 5 mg/m2 s.c. + cyklofosfamid 150 mg/m2 i.v. infuze + metylprednisolon 250 mg infuze, vše 5 dní po sobě.
Pacient dostal celkem 6 cyklů chemoterapie s 2-chlorodeoxyadenosinem, v posledních 3 cyklech byl 2-chlorodeoxyadenosin podáván ve výše uvedené kombinaci, poslední byl podán dne 26. 8. 2009.
Při podání poslední chemoterapie se popisovaný mladý muž cítil dobře, svědění kůže perianální krajiny vymizelo a nebyly hmatné žádné zvětšené periferní lymfatické uzliny. Klinicky byl tedy v kompletní remisi nemoci.
Kontrolní PET-CT jsme plánovali 10 týdnů po podání posledního cytostatika, na 11. 11. 2009.
Jenže 5. 11. 2009 byl pacient přijat pro zhoršení stavu (kašel, dušnost, teploty). Stáli jsme před následující otázkou: „Jde o infekci nebo recidivu aktivity nemoci?“
V pořadí 3. PET-CT vyšetření prokázalo v low dose CT obrazu nezvětšené lymfatické uzliny, stejně jako 2. PET-CT vyšetření. Novinkou však byla 2 osteolytická ložiska v kostech kyčelních. V PET obraze došlo při srovnání s předchozím PET-CT vyšetřením z června roku 2010 k podstatnému zvýšení akumulace fluorodeoxyglukózy v zatím nezvětšených lymfatických uzlinách na krku, hodnota SUVmax v uzlinách byla 4,8, což je již patologická hodnota. Novinkou byla vysoká akumulace fluorodeoxyglukózy (SUVmax 9,8) v obou osteolytických ložiscích v kyčelních kostech. Současně bylo provedeno také HRCT vyšetření plic, které zobrazilo četné nodularity, místy s tvorbou drobných cystoidních formací. Proces postihoval nejvíce střední a horní plicní pole.
Patologická infiltrace pánve byla velmi dobře rozpoznatelná i v MR obraze. Při vyšetření nemocného jsme opět objevili zvětšené lymfatické uzliny, opět byla jedna z nich na krku 16. 11. 2009 excidována a histologické vyšetření opět potvrdilo LCH. Druhé čtení bylo provedeno ve FN Motol Praha, kde opět vyšetřili proliferační index (pozitivitu Ki-67) a pozitivu nalezli u 10 % patologických buněk.
Léčba kombinací CHOEP (cyklofosfamid, doxorubicin, etoposid, vinkristin a prednison)
V listopadu roku 2010 jsme tedy opětovně stáli před otázkou, jakou chemoterapii zvolit pro časnou recidivu po předchozí léčbě. Vzhledem k excelentní léčebné odpovědi po chemoterapii (etoposid a cyklofosfamid), která předcházela sběr PBSC, jsme se rozhodli pro chemoterapii CHOEP (cyklofosfamid 750 mg/m2 i.v. infuze 1. den, etoposid 100 mg/m2 i.v. infuze 1.–3. den, doxorubicin 50 mg/m2 i.v. 1. den, vinkristin 1,4 mg/m2 i.v. 1. den a prednison 100 mg p.o. 1.–5. den). První cyklus této chemoterapie dostal pacient 1. prosince 2009. Ale pouze 1. cyklus jsme podali v plné dávce. Pro neutropenii jsme postupně redukovali dávky cytostatik a v rámci posledního 4. cyklu dostal pacient již pouze etoposid ve výše uvedené dávce.
Pro časné vyhodnocení léčebné účinnosti této léčby bylo provedeno kontrolní 4. PET-CT vyšetření (dne 26. 1. 2010) před podáním 3. cyklu chemoterapie CHOEP.
V low dose CT obraze přetrvávaly mnohočetné nodularity v oblasti plic, do 8 mm, které však oproti předchozímu vyšetření začaly nabývat cystoidní vzhled. Na rozdíl od předchozího vyšetření však na PET zobrazení již nebyla patrná zvýšená akumulace fluorodeoxyglukózy. PET-CT vyšetření tedy potvrdilo opět velmi dobrou léčebnou odpověď na zvolenou chemoterapii.
Vysokodávkovaná chemoterapie BEAM
Po 4 cyklech chemoterapie CHOEP následovala vysokodávkovaná chemoterapie BEAM (BCNU 300 mg/m2 2hodinová i.v. infuze den –7, Cytosara-rabinosid 200 mg/m2 3hodinová infuze 2krát denně den –6 až –3, etoposid 200 mg/m2 2hodinová infuze den –6 až –3, melfalan 140 mg/m2 den –2) a v den 0 (30. 3. 2010) byla provedena transplantace jednoho vaku autologních kmenových buněk krvetvorby.
Vyjma běžné mukozitidy po této léčbě s nutností dočasné parenterální výživy neměl pacient jiné komplikace.
Kontrolní PET-CT vyšetření bylo provedeno 8. 7. 2010. V low dose CT byla popsána regrese plicní LCH infiltrace, vymizely opacity a miliární nodularity a také defekty v kostech byly méně nápadné, takže obraz dokumentoval probíhající rekalcinaci. V PET obraze nebyla zřetelná žádná patologická akumulace fluorodeoxyglukózy.
Takže po 3 měsících od vysokodávkované chemoterapie BEAM byla potvrzena kompletní remise nemoci.
V srpnu roku 2010 byl pacient přijat na infekční oddělení nemocnice Vsetín pro pásový opar a byl léčen acyklovirem v infuzích.
Po přeléčení pásového oparu k nám pacient přišel v září roku 2010 na kontrolu a opět si stěžoval na zvětšení uzliny na krku. Tyto uzliny byly palpačně velmi dobře hmatné, o velikosti 2–3 cm.
Opět jsme provedli histologické ověření, chtěli jsme nalézt odpověď na otázku, zda nedošlo k transformaci LCH do sarkomu z Langerhansových buněk či zda nevzniklo jiné onemocnění. Patolog potvrdil, že se jedná stále o LCH, opět byla nalezena vysoká mitotická aktivita 8–10 mitóz/10 zorných polí při zvětšení 400krát. Při barvení proliferačního markeru Ki-67 byla pozitivita nalezena v 10–20 % buněk.
Nemoc tedy prokazatelně recidivovala již 5 měsíců po provedení vysokodávkované chemoterapie BEAM.
Léčba lenalidomidem
Otázkou bylo, jak dále léčit tuto nezvykle agresivní formu LCH.
Zvolili jsme lenalidomid (Revlimid) a 21. 10. 2011 jsme zahájili léčbu lenalidomidem v dávce 25 mg denně 1.–21. den v 28denních cyklech. Lenalidomid jsme kombinovali s dexametazonem (40 mg p.o. 1krát týdně). Profylakticky jsme tuto léčbu doplnili podáváním nízkomolekulárního heparinu (Clexan v dávce 0,6 ml denně).
Léčbu lenalidomidem a dexametazonem toleroval pacient výborně. Nezaznamenali jsme žádné nežádoucí účinky této léčby a hematologická tolerance léku je excelentní.
Kontrolní PET-CT vyšetření v průběhu 6. cyklu lenalidomidu bylo provedeno 26. 1. 2011. V CT obraze byla oproti původnímu zřetelná částečná regrese velikosti i počtu patologických uzlin na krku. Dále byla zřetelná jen nevýrazná rezidua původně patologické lymfadenopatie v nadklíčcích. V pravé axile došlo ke zmenšení uzlin na fyziologickou velikost, vlevo měla největší uzlina 26 mm v průměru bez podstatných změn oproti předchozímu vyšetření.
V retroperitoneu byla zřetelná částečná regrese patologických uzlin. V kraniálním úseku přetrvávají rezidua do 23 mm, bez korelátu v PET obraze, metabolicky jsou aktivní uzliny od L4 směrem do pánve, největší uzlina u zevního ilického svazku vlevo má průměr kolem 24 mm. Proběhla částečná regrese patologických uzlin v tříslech, ale přetrvává patologické zvětšení uzlin vlevo. V plicním parenchymu opět, ve srovnání s PET-CT z 18. 10. 2011, ubylo nodularit včetně těch nejnápadnějších, jak ilustruje obr. 1.
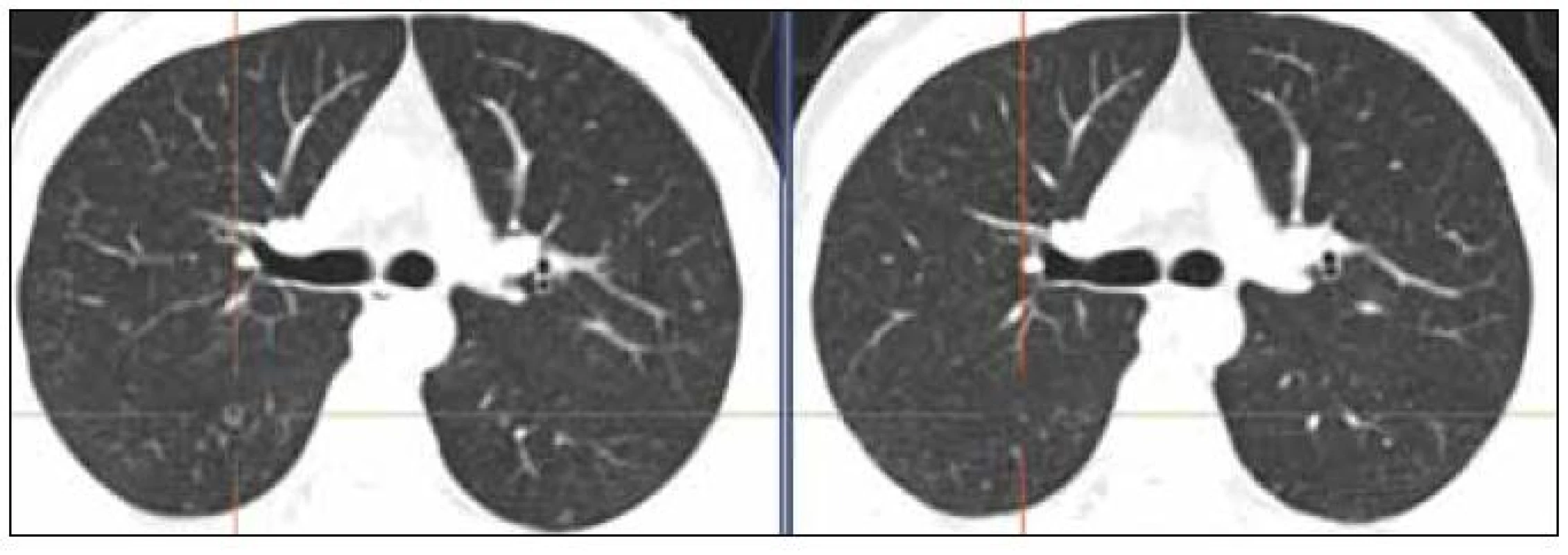
Stav lymfatických uzlin před léčbou ilustruje obr. 2 a jejich zmenšení při 4. cyklu lenalidomidu obr. 3.
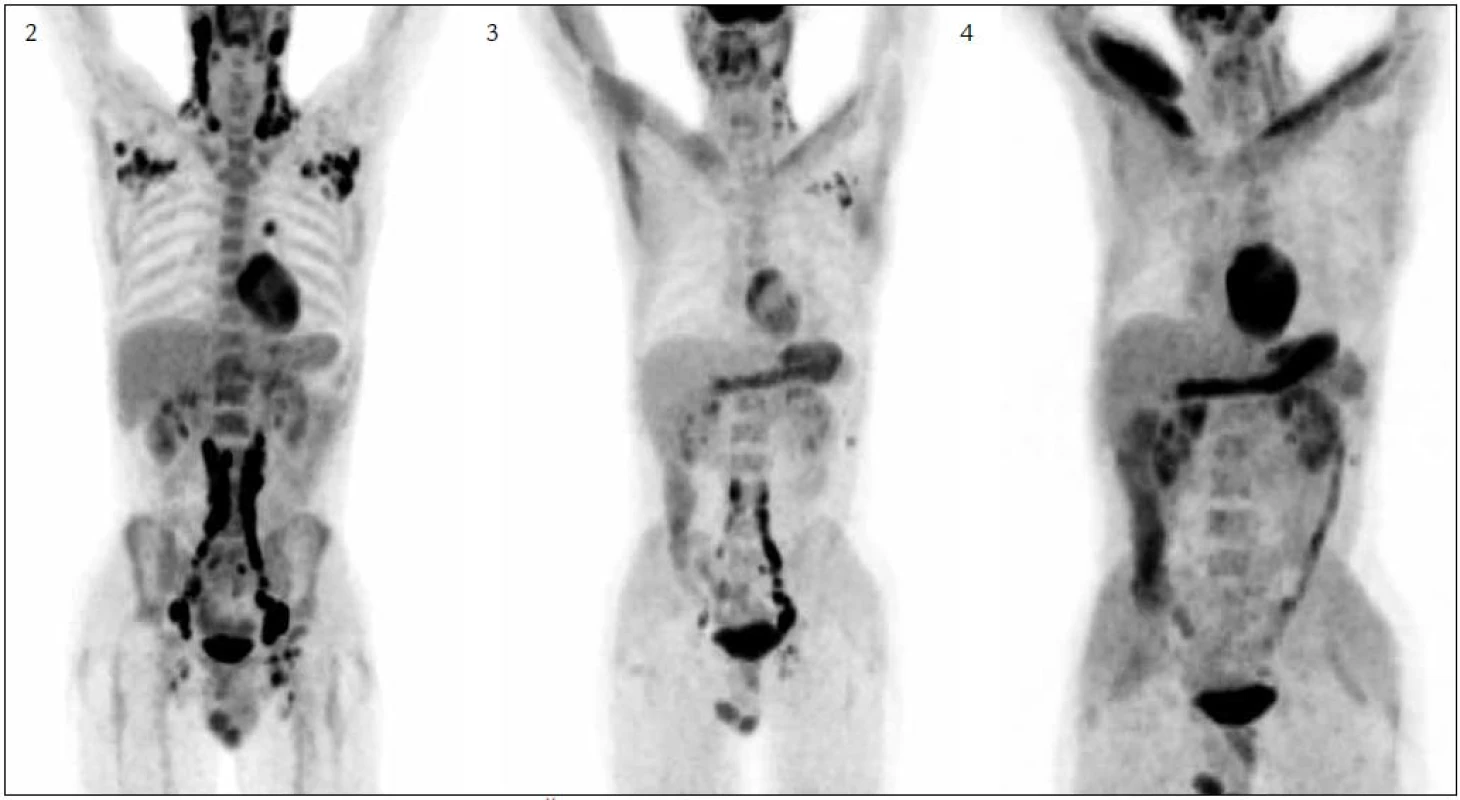
V mediastinu vymizela patologická uzlina v pravém hilu. Hodnoty SUVmax před podáním lenalidomidu a v průběhu 4. cyklu léčby dokumentuje tab. 1.
Od 6. cyklu jsme přidali do léčby etoposid 100 mg i.v. ve dnech 22, 23 a 24. Přidání etoposidu dále posílilo léčebnou odpověď. Po 7. cyklu bylo provedeno další kontrolní PET-CT vyšetření, na němž jsou zřetelná již jen nepatrná rezidua nemoci, jak prokazuje obr. 4.
Popsaná chemoterapie byla ukončena po 11 cyklech v srpnu roku 2011. Na kontrolním PET-CT vyšetření po 11. cyklu v srpnu roku 2011 byl shledán další pokles akumulace fluorodeoxyglukózy v krčních uzlinách na SUVmax 4,16, v ostatních lokalizacích nebyla zřetelná zvýšená akumulace fluorodeoxyglukózy. Došlo tedy k dalšímu výraznému prohloubení léčebné odpovědi, které hodnotíme jako kompletní remisi nemoci.
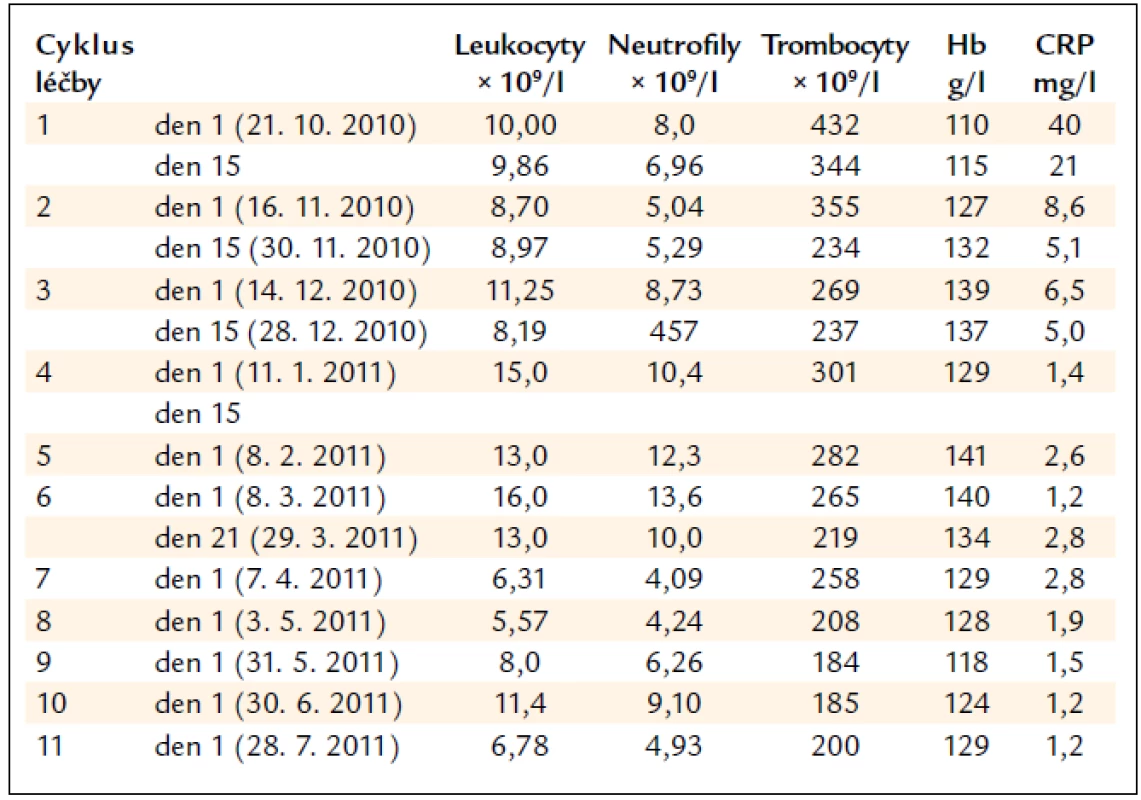
Protože u pacientů s mnohočetným myelomem je nejobávanějším nežádoucím účinkem myelosuprese, dokumentujeme tab. 2, že u tohoto pacienta je hematologická tolerance výborná. Z tab. 2 je zřetelné, že po zahájení chemoterapie velmi rychle poklesla původně zvýšená hodnota CRP na normální hodnoty a zvýšila se koncentrace hemoglobinu, také na normální hodnoty. Vzestup koncentrace hemoglobinu dáváme do souvislosti s poklesem koncentrace prozánětlivých cytokinů, které před léčbou způsobily zvýšenou hodnotu CRP.
Zakončení léčby alogenní transplantací kostní dřeně po nemyeloablativním přípravném režimu
Po dosažení remise výše uvedenou chemoterapií byla v září roku 2011 provedena alogenní transplantace kostní dřeně po nemyeloablativním přípravném protokolu s akronymem FLAMSA bez amsakrinu s celotělovým ozářením. Přípravný režim před alogenní transplantací měl následujícím složení: fludarabin 30 mg/m2 ve dnech –12 až –9; cytosinarabinosid 2 000 mg/m2 ve dnech –12 až –9; celotělové ozáření v dávce 4 Gy den –5; cyklofosfamid 40 mg/kg ve dnech –4 až –3; antithymocytární globulin 10 mg/kg ve dnech –4 až –2. Den 0 pak proběhla alogenní transplantace kostní dřeně s následující kombinovanou imunosupresivní léčbou. V prosinci roku 2011 je pacient 4 měsíce po alogenní transplantaci bez známek recidivy nemoci.
Diskuze
Klasickým lékem pro pacienty s histiocytózou z Langerhansových buněk (LCH) je vinblastin v kombinaci s merkaptopurinem a kortikoidy. Přibližně stejně účinná je léčba etoposidem. Účinek byl popsán také u dalších cytostatik, ale již v menší míře [1–4].
Kladribin (2-chlorodeoxyadenosin)
Pro pacienty s agresivní formou LCH a také pro pacienty s nemocí rezistentní na výše uvedenou léčbu se osvědčil 2-chlorodeoxyadenosin [5–9]. Informace o účinnosti 2-chlorodeoxyadenosinu u rezistentní formy či u recidivujících forem lze najít v mnoha popisech případů, ale pouze 4 publikované soubory měly více než 10 pacientů. Stručně tyto zkušenosti shrneme.
V souboru ze Scripps Clinic z USA léčili 2-chlorodeoxyadenosinem 13 pacientů, u 4 z nich nebylo dosaženo ani parciální remise [10].
V roce 1999 shrnula Sheila Weitzman v kritickém přehledu publikované zkušenosti. V té době měla k dispozici zprávy od 23 pacientů léčených 2-chlorodeoxyadenosinem. Věk těchto pacientů se pohyboval od 2 měsíců do 49 let. 2-chlorodeoxyadenosin navodil 13 kompletních remisí, ale osud těch 10 osob, u nichž nebylo dosaženo kompletní remise, není popsán [11]. Japonci uvádějí v kolektivu 17 dětí 10 léčebných odpovědí, což znamená, že opět u 7 dětí nebylo dosaženo dostateční léčebné odpovědi [12].
Aplikaci 2-chlorodeoxyadenosinu (5 mg/m2 2hodinová infuze) u pacientů s LCH hodnotí pouze jedna prospektivní multicentrická studie, do níž bylo zařazeno 92 dětí s rezistentní či relabující formou LCH. V nízce rizikové skupině bylo popsáno 62 % léčebných odpovědí, což znamená, že ve 38 % nebylo dosaženo léčebné odpovědi. Ve vysoce rizikové skupině byla léčebná odpověď zaznamenána pouze u 22 % léčených, tedy u 78 % nebylo dosaženo léčené odpovědi [13].
Takže 2-chlorodeoxyadenosin je jistě jeden z nejúčinnějších léků pro agresivní formy a relabující formy LCH, ale nedosahuje bohužel kompletní remise u všech pacientů, kterým je v této indikaci podán. Proto jsou intenzivně hledány další léčebné alternativy.
V posledních 15 letech jsme zažili renezanci thalidomidu. Jeho účinnost není omezena pouze na mnohočetný myelom, kde se používá asi nejvíce, ale jeho pozitivní účinek byl popsán i u mnoha krevních chorob.
Thalidomid
Účinnost thalidomidu u LCH dokumentují četné popisy úspěšně léčených případů, takže se stává dalším standardním lékem pro tuto nemoc, protože má potenciál navodit kompletní remise u mnoha pacientů s LCH [14–29].
Lenalidomid
Lenalidomid je nejnovějším derivátem thalidomidu, podobně jako thalidomid je řazen do skupiny IMIDS – immunomodularory drugs [30]. Protinádorový účinek lenalidomidu, podobně jako thalidomidu, se vysvětluje několika mechanizmy, byť dopodrobna není ještě úplně znám.
Z preklinických i klinických studií jsou známa následující fakta:
- lenalidomid zvyšuje aktivitu buněk lymfocytů ze skupiny natural killer (NK-buňky) a T-buněk namířenou proti maligním buňkám;
- lenalidomid potencuje cytoxickou reakci proti buňkám s navázanými anti-CD20 protilátkami, takže je považován za vhodný do kombinace s rituximabem či jinými monoklonálními protilátkami u maligních lymfoproliferací;
- lenalidomid zasahuje do poměru proinflamatorních a antiinflamatorních cytokinů v okolí tumoru, snižuje tak reakci hostitele na přítomnost nádorových buněk a mění ji. V přítomnosti lenalidomidu se snižuje tvorba proinflamatorních cytokinů (tumor necrosis factor α, interleukin 1, interleukin 6);
- lenalidomid působí přímo také na maligní buňky, brzdí jejich proliferaci a vede k jejich apoptotické smrti;
- lenalidomid, podobně jako thalidomid, má antiangiogenní účinek [29–34]. Tento multifunkční účinek lenalidomidu znázorňuje schéma 1.

Lenalidomid je standardním lékem pro mnohočetný myelom. Dále je používám u 5q-typu myelodysplastického syndromu. Bylo by však chybné se domnívat, že lenalidomid má léčebný účinek pouze u výše uvedených dvou diagnóz. V literatuře lze nalézt četné publikace, které popisují účinek tohoto léku rezistentní chronické lymfatické leukemie, u folikulárního lymfomu, u lymfomu z plášťových buněk (mantle cell lymphoma) a u difuzního velkobuněčného lymfomu a také u Hodgkinova lymfomu [35–45]. Tyto první publikace ukazují, že lenalidomid bude mít v hematologii mnohem širší použití než pouze u mnohočetného myelomu. V současnosti je lenalidomid v kombinaci s rituximabem testován u mnoha maligních lymfomů z B-buněk. Očekává se, že lenalidomid může stimulací cytotoxické destrukce buněk s navázanými protilátkami zvýšit účinnost monoklonální protilátky anti-CD20 (rituximabu).
Lenalidomid u recidivující formy LCH
Protože jsme měli před sebou nemocného s nezvykle agresivní formou LCH, tak jsme se domnívali, že thalidomid by nebyl dostatečně účinný. Proto jsme zvolili raději lenalidomid ve stejném dávkování, jaké se používá u mnohočetného myelomu – 25 mg denně 21 dní se 7denní pauzou.
K tomuto rozhodnutí jsme dospěli na základně našich zkušeností s thalidomidem a lenalidomidem u mnohočetného myelomu. Lenalidomid dosahuje léčebné odpovědi podstatně rychleji než thalidomid a v monoterapii je účinnější než thalidomid.
U našeho pacienta byl lenalidomid použit v rámci léčby 4. linie. V rámci léčby 1. linie měl pacient 2-chlorodeoxyadenosin v kombinaci s cyklofosfamidem s metylprednisolonem. Po této léčbě LCH recidivovala necelé 2 měsíce po jejím ukončení. Pak následovala léčba etoposidovým režimem CHOEP (tab. 3). Na chemoterapii CHOEP navázala další léčba, vysokodávkovaná chemoterapie BEAM. 5 měsíců po této léčbě však nemoc znovu recidivovala. Takže v rámci 4. linie nyní dostává pacient lenalidomid v kombinaci s dexametazonem.
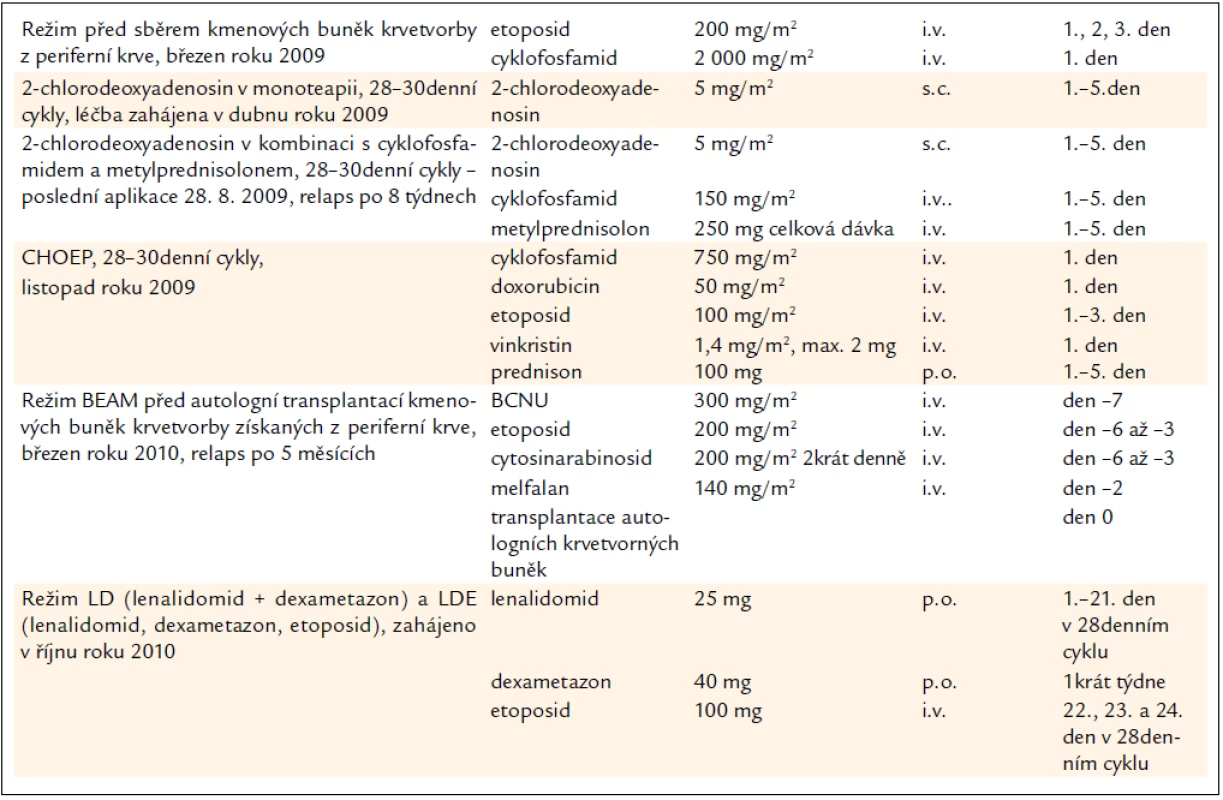
Léčbu toleruje excelentně, lenalidomid užívá bez jakýchkoli nežádoucích účinků. U některých pacientů s myelomem, neboli s nemocí postihující kostní dřeň, míváme při léčba lenalidomidem problémy s myelosupresivním účinkem tohoto léku. U tohoto pacienta s LCH (bez postižení kostní dřeně) jsme však žádnou cytopenii nezpozorovali, jak dokumentujeme v tab. 2.
Účinnost léčby hodnotíme na základně pohmatového nálezu v oblasti dříve zvětšených uzlin a na základě PET-CT vyšetření a HRCT vyšetření plic.
Již po 4 cyklech lenalidomidu a dexametazonu jsme dosáhli velmi dobré parciální remise. Pro posílení účinnost jsme od 6. cyklu přidali k této kombinaci etoposid a po celkem 11 cyklech lenalidového režimu bylo dosaženo kompletní remise. Vzhledem k nezvykle agresivnímu průběhu a časným recidivám jsme se rozhodli využít dosažené remise pro konsolidaci alogenní transplantací kostní dřeně po nemyeloablativním přípravném režimu.
Zjistili jsme, že lenalidomid je účinný také u velmi agresivní formy LCH s vysokou proliferační aktivitou a že má potenciál navodit léčebnou remisi, i když je použit po neúspěchu 3 léčebných modalit.
Alogenní transplantace kostní dřeně
LCH formy, které velmi rychle recidivují, jsou poměrně vzácné. Podobně jako u jiných chemosenzitivních maligních chorob jsou tito pacienti léčeni jak autologní transplantací, tak i transplantací alogenní s redukovanou intenzitou přípravného režimu. Zkušeností s vysokodávkovanou chemoterapií s alogenní transplantací je poměrně málo. Z přehledu publikovaných zkušeností vyplývá, že tento léčebný postup byl přínosný pouze pro část takto léčených pacientů [46–51]. Vzhledem k nízkému věku nemocného byla provedena alogenní transplantace kostní dřeně po nemyeloablativním přípravném režimu FLAMSA bez amsakrinu. Při poslední kontrole 4 měsíce po transplantaci byl bez recidivy nemoci. Alogenní transplantace kostní dřeně jsou možnou alternativou pro pacienty s agresivními formami histiocytózy z Langerhansových buněk.
Význam PET-CT pro sledování vývoje LCH
U LCH není znám žádný marker nemoci, který by odrážel vývoj aktivity nemoci, podobně jako třeba monoklonální imunoglobulin odráží vývoj mnohočetného myelomu. Proto je hodnocení progrese či regrese nemoci založeno, podobně jako u lymfomů, na klasických zobrazovacích vyšetřeních. V posledních letech byl zkoumán přínos PET-CT vyšetření pro tuto chorobu a všechny publikace se shodují na tom, že PET-CT odráží aktivitu této nemoci nejlépe ze všech dostupných vyšetření. Přehled všech publikací, vyhodnocujících PET-CT vyšetření u pacientů s LCH, byl uveden v časopise Vnitřní lékařství minulý rok [52].
Závěr
Lenalidomid v běžném dávkování je účinným lékem pro agresivní formu LCH s vysokou mitotickou aktivitou, relabující po léčbě režimem obsahujícím 2-chlorodeoxyadenosin a dále režimem CHOEP s vysokodávkovanou chemoterapií BEAM. Zatím jde o první příznivou zkušenost s lenalidomidem u jednoho pacienta s LCH. Považujeme za vhodné tuto léčbu testovat v rámci širší studie.
Poděkování
Léčba pacienta se uskutečnila za laskavé podpory firmy Celgene, s. r. o., z projektu Compassionate Use Program určeného pro pacienty se vzácnými hematoonkologickými onemocněními.
Tato publikace vznikla v rámci výzkumného záměru Ministerstva zdravotnictví ČR: FUNDIN MZ0MOU2005; a dále v rámci aktivity následujících grantů: grantu IGA ČR NT 12215-4, grantů MŠMT MSM0021622434, LC06027 a grantů IGA MZd NT11154, NT12130, NT12215 a NS10408.
prof. MUDr. Zdeněk Adam, CSc.
www.fnbrno.cz
e-mail: z.adam@fnbrno.cz
Doručeno do redakce: 18. 4. 2011
Přijato po recenzi: 23. 5. 2011, aktualizace 30. 11. 2011
Sources
1. Ščudla V, Roček V, Dušek B et al. Multifokální eozinofilní granulom v dospělosti. Vnitř Lék 1987; 33 : 1078–1086.
2. Doberauer C. Langerhans cell histiocytosis in adults. Vnitř Lék 2010; 56 (Suppl 2): 22–26.
3. Fichter J, Doberauer C, Seegenschmiedt H. Langerhans cell histiocytosis in adults: An interdisciplinary challenge. Dtsch Arztebl 2007; 104: A2347–A2353.
4. Aricò M, Gischikovsky M, Généreau T et al. Langerhans cell histiocytosis in adults. Report from the International Registry of the Histiocyte Society. Eur J Cancer 2003; 39 : 2341–2348.
5. Mottl H, Ganevová M, Radvanská J et al. Treatment results of Langerhans cell histiocytosis with LSH II protocol. Čas Lék Čes 2005; 144 : 753–755.
6. Mottl H, Starý J, Chánová M et al. Treatment of recurrent Langerhans cell histiocytosis in children with 2-chlorodeoxyadenosine. Leuk Lymphoma 2006; 47 : 1881–1884.
7. Teng CL, Lin TH, Young JH et al. Rapidly fatal Langerhans’ cell histiocytosis in an adult. J Formos Med Assoc 2005; 104 : 955–659.
8. McClain KL. Drug therapy for the treatment of Langerhans cell histiocytosis. Expert Opin Pharmacother 2005; 6 : 2435–2441.
9. Allen CE, McClain KL. Langerhans cell histiocytosis: a review of past, current and future therapies. Drugs Today 2007; 43 : 627–643.
10. Saven A, Burian C. Cladribine activity in adult Langerhans-cell histiocytosis. Blood 1999; 93 : 4125–4130.
11. Weitzman S, Wayne AS, Arceci R at al. Nucleoside analogues in the therapy of Langerhans cell histiocytosis: a survey of members of the histiocyte society and review of the literature. Med Pediatr Oncol 1999; 33 : 476–481.
12. Imamura T, Sato T, Shiota Y et al. Outcome of pediatric patients with Langerhans cell histiocytosis treated with 2 chlorodeoxyadenosine: a nationwide survey in Japan. Int J Hematol 2010; 91 : 646–651.
13. Weitzman S, Braier J, Donadieu J et al. 2’-Chlorodeoxyadenosine (2-CdA) as salvage therapy for Langerhans cell histiocytosis (LCH). Results of the LCH-S-98 protocol of the Histiocyte Society. Pediatr Blood Cancer 2009; 53 : 1271–1276.
14. Sander CS, Kaatz M, Elsner P. Successful treatment of cutaneous langerhans cell histiocytosis with thalidomide. Dermatology 2004; 208 : 149–152.
15. Kolde G, Schulze P, Sterry W. Mixed response to thalidomide therapy in adults: two cases of multisystem Langerhans’ cell histiocytosis. Acta Derm Venereol 2002; 82 : 384–386.
16. Claudon A, Dietemann JL, Hamman De Compte A et al. Interest in thalidomide in cutaneo-mucous and hypothalamo-hypophyseal involvement of Langerhans cell histiocytosis. Rev Med Interne 2002; 23 : 651–656.
17. Lair G, Marie I, Cailleux N et al. Langerhans histiocytosis in adults: cutaneous and mucouslesion regression after treatment with thalidomide. Rev Med Interne 1998; 19 : 196–198.
18. Dallafior S, Pugin P, Cerny T et al. Successful treatment of a case of cutaneous Langerhans cell granulomatosis with 2-chlorodeoxyadenosine and thalidomide. Hautarzt 1995; 46 : 553–560.
19. Meunier L, Marck Y, Ribeyre C et al. Adult cutaneous Langerhans cell histiocytosis: remission with thalidomide treatment. Br J Dermatol 1995; 132 : 168.
20. Thomas L, Ducros B, Secchi T et al. Successful treatment of adult’s Langerhans cell histiocytosis with thalidomide. Report of two cases and literature review. Arch Dermatol 1993; 129 : 1261–1264.
21. Misery L, Larbre B, Lyonnet S et al. Remission of Langerhans cell histiocytosis with thalidomide treatment. Clin Exp Dermatol 1993; 18 : 487–488.
22. Bensaid P, Machet L, Vaillant L et al. Langerhans-cell histiocytosis in the adult: regressive parotid involvement following thalidomide therapy. Ann Dermatol Venereol 1992; 119 : 281–283.
23. Chen M, Doherty SD, Hsu S. Innovative uses of thalidomide. Dermatol Clin 2010; 28 : 577–586.
24. Li R, Lin T, Gu H et al. Successful thalidomide treatment of adult solitary perianal Langerhans cell histiocytosis. Eur J Dermatol 2010; 20 : 391–392.
25. Broekaert SM, Metzler G, Burgdorf W et al. Multisystem Langerhans cell histiocytosis: successful treatment with thalidomide. Am J Clin Dermatol 2007; 8 : 311–314.
26. Alioua Z, Hjira N, Oumakhir S et al. Thalidomide in adult multisystem Langerhans cell histiocytosis: a case report. Rev Med Interne 2006; 27 : 633–636.
27. McClain KL, Kozinetz CA. A phase II trial using thalidomide for Langerhans cell histiocytosis. Pediatr Blood Cancer 2007; 48 : 44–49.
28. Wu JJ, Huang DB, Pang KR et al. Thalidomide: dermatological indications, mechanisms of action and side-effects. Br J Dermatol 2005; 153 : 254–273.
29. Mauro E, Fraulini C, Rigolin GM et al. A case of disseminated Langerhans’ cell histiocytosis treated with thalidomide. Eur J Haematol 2005; 74 : 172–174.
30. Crane E, List A. Immunomodulatory drugs. Cancer Invest 2005; 23 : 625–634.
31. De Sanctis JB, Mijares M, Suárez A et al. Pharmacological properties of thalidomide and its analogues. Recent Pat Inflamm Allergy Drug Discov 2010; 4 : 144–148.
32. Dreicer R. Lenalidomide: immunomodulatory, antiangiogenic, and clinical activity in solid tumors. Curr Oncol Rep 2007; 9 : 120–123.
33. Knight R. IMiDs: a novel class of immunomodulators. Semin Oncol 2005; 32 (4 Suppl 5): S24–S30.
34. Kotla V, Goel S, Nischal S et al. Mechanism of action of lenalidomide in hematological malignancies. J Hematol Oncol 2009; 2 : 36–40.
35. Galustian C, Dalgleish A. Lenalidomide: a novel anticancer drug with multiple modalities. Expert Opin Pharmacother 2009; 10 : 125–133.
36. Awan FT, Johnson AJ, Lapalombella R et al. Thalidomide and lenalidomide as new therapeutics for the treatment of chronic lymphocytic leukemia. Leuk Lymphoma 2010; 51 : 27–38.
37. Fine HA, Kim L, Albert PS et al. A phase I trial of lenalidomide in patients with recurrent primary central nervous system tumors. Clin Cancer Res 2007; 13 : 7101–7106.
38. Mandac I, Kolonic SO. Lenalidomide induced good clinical response in a patient with multiple relapsed and refractory Hodgkin’s lymphoma. J Hematol Oncol 2010; 3 : 20–25.
39. Sher T, Miller KC, Lawrence D et al. Efficacy of lenalidomide in patients with chronic lymphocytic leukemia with high-risk cytogenetics. Leuk Lymphoma 2010; 51 : 85–88.
40. Böll B, Borchmann P, Topp MS et al. Lenalidomide in patients with refractory or multiple relapsed Hodgkin lymphoma. Br J Haematol 2010; 148 : 480–482.
41. Habermann TM, Lossos IS, Justice G et al. Lenalidomide oral monotherapy produces a high response rate in patients with relapsed or refractory mantle cell lymphoma. Br J Haematol 2009; 145 : 344–349.
42. Tempescul A, Ianotto JC, Morel F et al. Lenalidomide, as a single agent, induces complete remission in a refractory mantle cell lymphoma. Ann Hematol 2009; 88 : 921–922.
43. Wiernik PH, Lossos IS, Tuscano JM et al. Lenalidomide monotherapy in relapsed or refractory aggressive non-Hodgkin’s lymphoma. J Clin Oncol 2008; 26 : 4952–4957.
44. Chanan-Khan AA, Cheson BD. Lenalidomide for the treatment of B-cell malignancies. J Clin Oncol 2008; 26 : 1544–1552.
45. Battoo SA, Hernandez-Ilizaliturri F. The emerging role of lenalidomide in the management of lymphoid malignancies. Ther Adv Hematom 2011; 2 : 45–53.
46. Kudo K, Ohga S, Morimoto A et al. Improved outcome of refractory Langerhans cell histiocytosis in children with hematopoietic stem cell transplantation in Japan. Bone Marrow Transplant 2010; 45 : 901–906.
47. Caselli D, Aricò M. EBMT Paediatric Working Party. The role of BMT in childhood histiocytoses. Bone Marrow Transplant 2008; 41 (Suppl 2): S8–S13.
48. Kesik V, Citak C, Kismet E et al. Hematopoietic stem cell transplantation in Langerhans cell histiocytosis: case report and review of the literature. Pediatr Transplant 2009; 13 : 371–374.
49. Ingram W, Desai SR, Gibbs JS et al. Reduced-intensity conditioned allogeneic haematopoietic transplantation in an adult with Langerhans’ cell histiocytosis and thrombocytopenia with absent radii. Bone Marrow Transplant 2006; 37 : 713–715.
50. Steiner M, Matthes-Martin S, Attarbaschi A et al. Improved outcome of treatment-resistant high-risk Langerhans cell histiocytosis after allogeneic stem cell transplantation with reduced-intensity conditioning. Bone Marrow Transplant 2005; 36 : 215–225.
51. Akkari V, Donadieu J, Piguet C et al. French Langerhans Cell Study Group. Hematopoietic stem cell transplantation in patients with severe Langerhans cell histiocytosis and hematological dysfunction: experience of the French Langerhans Cell Study Group. Bone Marrow Transplant 2003; 31 : 1097–1103.
52. Adam Z, Řehák Z, Koukalová R et al.Plicní forma histiocytózy z Langerhansových buněk – hodnocení aktivity nemoci a léčebné odpovědi pomocí PET-CT (indexu SUVmax Pulmo/SUVmax Hepar). Popis vlastních zkušeností a přehled literatury. Vnitř Lék 2010; 56 : 1228–1251.
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Internal Medicine

2012 Issue 1
-
All articles in this issue
- Význam globálnej kontraktilnej rezervy u pacientov s resynchronizačnou liečbou
- Podrobná studie o polypech tlustého střeva
- Endokrinné zmeny pri chorobách pečene
- Běžné, standardizované a doporučené postupy v diagnostice a monitorování paroxysmální noční hemoglobinurie průtokovou cytometrií
- Nemoc z ukládání lehkých řetězců imunoglobulinu (light chain deposition disease)
- Způsoby hodnocení krevní perfuze tkání pomocí intersticiální mikrodialýzy – přehled současných znalostí
- Hyponatriémia pri syndróme neprimeranej sekrécie vazopresínu (SIADH) – možnosti liečby
- Doporučený postup k posouzení kardiovaskulárního rizika a prevenci kardiovaskulárních onemocnění a diabetes mellitus 2. typu u žen se syndromem polycystických ovarií
- Septický šok v dôsledku infekčnej endokarditídy stimulačného systému implantabilného kardioverter defibrilátora
- Lenalidomid indukoval léčebnou odpověď u pacienta s agresivní multisystémovou formou histiocytózy z Langerhansových buněk (LCH), rezistentní ke 2-chlorodeoxyadenosinu a časně relabující po vysokodávkované chemoterapii BEAM s autologní transplantací kmenových hemopoetických buněk
- Hyponatrémia – komplikácia liečby karbamazepínom
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue
- Endokrinné zmeny pri chorobách pečene
- Hyponatriémia pri syndróme neprimeranej sekrécie vazopresínu (SIADH) – možnosti liečby
- Podrobná studie o polypech tlustého střeva
- Hyponatrémia – komplikácia liečby karbamazepínom
