Gen pro FTO a jeho role v genetické determinaci obezity
FTO gene and his role in genetic determination of obesity
Obesity is a risk factor for development of cardiovascular disease, type 2 diabetes and some cancers. Substantial proportions of obese people die from diseases caused by complications of overweight. The incidence of obesity in different populations exceeds 15%. The emergence of obesity is influenced by external factors (especially excessive energy intake and reduced physical activity). Body Mass Index (BMI) is also influenced by genetic factors, estimates of the degree of inheritance of obesity, according to the type of study range from 30 to 70%. Newly detected genetic risk factor for body weight is the FTO gene (“fat mass and obesity associated”). Variants in the first (and in some populations also in the third) intron of this gene are associated with BMI values and the presence of one risk allele is associated with an increase of body weight by about 1.5–2 kg. Studies on the possible causality (impact on energy intake, basal metabolism, physical activity) did not show consistent results. Variants in the first intron are also associated with higher risk of type 2 diabetes, polycystic ovary syndrome, and cardiovascular disease and seem to play a role in the determination of certain types of cancer and are associated with higher mortality. The exact mechanism of the effect of FTO on BMI determination is not yet known, however, the FTO exhibit a DNA demethylase activity and its role is designed as a transcription coactivator.
Key words:
FTO – obesity – BMI – polymorphism
:
D. Dlouhá; J. A. Hubáček
:
Laboratoř pro výzkum aterosklerózy, Centrum experimentální medicíny IKEM Praha, vedoucí pracoviště prof. MUDr. Luděk Červenka, CSc., MBA
:
Vnitř Lék 2012; 58(3): 208-215
:
Reviews
Obezita je rizikovým faktorem rozvoje kardiovaskulárních onemocnění, diabetes mellitus 2. typu či některých nádorových onemocnění a značná část obézních lidí umírá v důsledku onemocnění způsobených komplikacemi z nadváhy. V různých populacích je obézních více než 15 % jedinců. Vznik nadváhy je ovlivněn celou řadou vnějších faktorů (především nadměrným energetickým příjmem a nedostatkem fyzické aktivity). Index tělesné hmotnosti (Body Mass Index – BMI) je ovlivněn také genetickými faktory, odhady o míře dědičnosti obezity se dle typu studie pohybují od 30 do 70 %. Nově rozpoznaným genetickým rizikovým faktorem determinujícím tělesnou hmotnost je gen pro FTO (fat mass and obesity associated protein). Varianty v 1. (a v některých populacích i ve 3.) intronu tohoto genu jsou spojeny s hodnotami BMI a přítomnost jedné rizikové alely je spojena s nárůstem tělesné hmotnosti o asi 1,5–2 kg. Studie sledující možnou kauzalitu (vliv na energetický příjem, bazální metabolizmus, fyzickou aktivitu) nepřinesly konzistentní výsledky. Varianty v 1. intronu jsou spojeny i s vyšším rizikem vzniku diabetes mellitus 2. typu, syndromem polycystických ovarií, s kardiovaskulárním onemocněním a zdá se, že hrají roli i v determinaci určitých druhů nádorových onemocnění a jsou spojeny s vyšší úmrtností. Přesný mechanizmus účinku FTO na determinaci BMI dosud znám není, nicméně FTO vykazuje DNA demetylázovou aktivitu a funguje jako transkripční koaktivátor, lze tedy očekávat určitou roli regulační.
Klíčová slova:
FTO – obezita – BMI – polymorfizmus
Úvod
Obezita provází lidstvo po celou dobu jeho existence. V posledních desetiletích se z ní však stala epidemie postihující miliony jedinců po celém světě. Podle údajů International Obezity Task Force z roku 2000 dosahuje prevalence nadváhy v některých evropských zemích až 40 %. Pod pojmem obezita se rozumí nadměrné nahromadění tělesného tuku v poměru k tělesným proporcím. U mužů je udávána hranice > 25 % a u žen > 30 %. Obezita je definována pomocí indexu tělesné hmotnosti [Body Mass Index (BMI) = hmotnost (kg)/výška (m2)]. Hodnoty BMI 25–29,9 značí nadváhu, 30–34,9 obezitu I. stupně, 35–39,9 obezitu 2. stupně a hodnoty > 40 obezitu 3. stupně [1].
Obezita představuje velký problém pro zdravotní systém v moderní společnosti po celém světě a je odpovědná za asi 5 % přímých nákladů ve zdravotnictví. Nemocnost obézních je až dvojnásobná. Obezita významně zvyšuje celkovou morbiditu a mortalitu, zejména na kardiovaskulární onemocnění, diabetes mellitus 2. typu, ale i na nádorová onemocnění (karcinom tlustého střeva, prsu, prostaty, dělohy, jícnu). V posledních letech byly zjištěny i přímé vztahy mezi obezitou a duševními poruchami, zejména depresí a úzkostí [2].
Je však třeba zmínit i hypotézu tzv. „reverzní epidemiologie“. Ta naznačuje, že zvýšený BMI je u starších lidí a u pacientů s některým chronickým onemocněním (chronické srdeční selhání, ischemická kardiomyopatie, chronické onemocnění ledvin, chronické obstrukční plicní onemocnění, revmatoidní artritida, nádorová onemocnění) spojen s lepší prognózou a delším přežíváním [3,4].
Obezita je výsledkem kombinace genetických, biochemických, psychologických a sociálních faktorů. Nezbytným předpokladem nárůstu BMI je pozitivní energetická bilance na podkladě především vyššího kalorického příjmu v porovnání s kalorickým výdejem. V současné době jsou diskutovány další faktory. Nárůst hmotnosti je např. nejčastějším vedlejším účinkem u celé řady léčiv, jejichž preskripce v posledních desetiletích strmě narůstá. Svoji roli může hrát i nedostatek spánku či zvýšený teplotní komfort domácností [5].
Genetika obezity
Genetické faktory určují tělesnou hmotnost přibližně z 30–70 % a široké rozpětí odhadů je výsledkem odlišných typů studií. Nejvyšší dědičnost je výsledkem studií dvojčat, nejnižší pak obvykle vychází z populačních průřezových studií [6].
Korelační koeficient BMI dětí a jejich biologických rodičů nebo sourozenců je okolo 0,3. Mnohem vyšší korelace BMI (až 0,8) byla zjištěna u jednovaječných dvojčat bez ohledu na jejich věk. Další studie na jednovaječných dvojčatech, vychovávaných odděleně, ukázaly, že změny BMI jsou ze 2/3 podmíněny genetickými faktory a rozdíly v BMI u nich nebyly zásadně ovlivněny zevním prostředím. Význam vlivu genetických faktorů na BMI potvrzují i studie u adoptovaných dětí. BMI adoptovaných dětí koreluje více s BMI biologických rodičů než s BMI adoptivních rodičů [2].
Obezita má primárně polygenní charakter, tzn. že se na jejím vzniku podílí mnoho variant v (odhadem) několika desítkách genů. Ty jsou někdy popisovány jako geny obezigenní, tj. ty, které ke vzniku obezity přispívají, a geny leptogenní, tj. ty, které rozvoji obezity brání [7].
Monogenní formy obezity (způsobené jedinou mutací v jediném genu) jsou klinicky velice zajímavé, ale v populaci se vyskytují velice zřídka, a nemají proto v epidemiologii obezity, kdy v naší populaci má více než polovina obyvatelstva BMI přes 25 kg/m2, žádný velký význam. Mohou však pomoci nalézt a identifikovat geny, které hrají ve vzniku a vývoji obezity důležitou roli [2,7].
Dle frekvence lze genetické faktory rozdělit do 2 skupin. První skupinu tvoří vzácné mutace genů (dle definice s výskytem pod 1 %), které významně podporují vznik obezity (syndromy, kde je mutace kauzální příčinou). Ačkoli je známo okolo 40 mendelovsky děděných syndromů odpovědných za lidskou obezitu, hrají díky své minimální frekvenci výskytu v populačním měřítku minoritní roli. Druhou skupinu tvoří běžné varianty genů, polymorfizmy, které tvoří základ pro rozvoj obezity [1].
Primárně se pro studium genetické predispozice k obezitě využívaly tzv. kandidátní geny, tj. geny se známou funkcí, která zapadá do fyziologických představ o vzniku obezity. V posledních letech se objevily, především díky extrémnímu rozvoji metodologických možností, nové cesty detekce genetických variant spojených (nejen) s obezitou.
Celogenomové screeningy („genome wide association study“ – GWAs) jsou jednou z možností, jak detekovat nové, dosud neznámé asociace fenotypu s DNA variantami bez informací o kauzalitě. V GWAs studiích jsou zkoumány statisíce až miliony jednonukleotidových polymorfizmů („single nucleotide polymorphisms“ – SNPs), víceméně rovnoměrně rozložených podle celého genomu. GWAs hledá asociace mezi jednou či více variantami a fenotypem. Výsledky se obvykle replikují na řadě populací a na řádově tisících jedinců. Často se stává, že kandidátní varianta je lokalizována v genu/oblasti s neznámou funkcí nebo v genu, jehož dosud známé funkce nejsou spojeny s patofyziologií sledovaného onemocnění [8].
V souvislosti s lidskou obezitou bylo již zmíněno více než 250 kandidátních genů či chromozomálních oblastí a jejich variant. Pozitivní asociace mezi genem a BMI, množstvím tuku nebo jiným fenotypem spojeným s obezitou byly pak nalezeny téměř u 60 kandidátních genů [9]. GWAs studie odhalily potenciální role celé řady nových genů v determinaci BMI. Příkladem mohou být geny pro INSIG2 (insulin-induced gene 2), MC4R (melanocortin-4 receptor gene) nebo dosud nejsilnější genetický determinant hodnot BMI, gen pro FTO (fat mass and obesity associated protein) [1,9].
Animální studie
Gen pro FTO
FTO (dříve také známý pod názvem Fatso) byl poprvé popsán [10] u myší jako jeden ze 6 genů uvnitř rozsáhlé delece na chromozomu 8, odpovědných za Ft (fused toes – „srůstání prstů“) fenotyp. Homozygotní myši s touto delecí umíraly během prenatálního vývoje, vykazovaly vážné malformace hlavy, vývojové defekty centrálního nervového systému, pravo-levou asymetrii, polydaktylii a růstovou retardaci. Heterozygotní myši vykazovaly syndaktylii předních končetin a zvětšení brzlíku. Změny hmotnosti u těchto myší však pozorovány nebyly [11] a gen na řadu let upadl v zapomnění.
Studie na hlodavcích prokázaly nejvyšší hladiny Fto mRNA v mozku a hypotalamu. Hypotalamus hraje klíčovou roli při regulaci energetické rovnováhy a genů odpovědných za funkci monogenní obezity. Exprese Fto je regulována stavem výživy (hladovění nebo přejídání) a vykazuje tkáňově specifické odlišnosti. Není však známo, zda jsou tyto rozdíly příčinou nebo důsledkem obezity [10,12–14]. U myší byly popsány dva modely Fto nedostatečností: Fto-/- s nulovou mutací, s celkovou absencí exprese Fto proteinu, a druhý model s částečnou ztrátou exprese Fto proteinu, způsobenou bodovou mutací v sekvenci aminokyselin izoleucin → fenylalanin na pozici 367 (I367F). Tato substituce pravděpodobně negativně ovlivňuje funkci Fto tvorbou heterodimerů, což způsobuje změny v energetické rovnováze. U Fto-/- je tělesná hmotnost regulována již od počátku života, u FtoI367F až v dospělosti. Fto-/- myši vykazovaly 30–40% redukci tělesné hmotnosti v porovnání s kontrolami, kdežto FtoI367F vykazovaly pouze 10% pokles. U Fto-/- myší se vyskytovaly růstové retardace a časná perinatální úmrtnost. Oba modely vykazovaly během vysokotukové diety snížení tělesné hmotnosti a bílé tukové tkáně v porovnání s kontrolami. Existuje tedy předpoklad, že ztráta funkce Fto může působit proti vzniku obezity indukované stravou. V porovnání s myšími kontrolami neexistoval rozdíl v absolutním množství příjmu potravy, přesto byly Fto-/- myši menší a lehčí, pokles tukové hmoty u Fto deficitních myší tedy není zprostředkován nižším energetickým příjmem. Pro oba modely je charakteristický také vyšší bazální metabolizmus. Vyšší energetický výdej nesouvisel s fyzickou aktivitou, ale byl ovlivněn zvýšenou aktivitou sympatického nervového systému, který může podporovat lipolýzu a termogenezi tukové tkáně a svalů [15–17].
Humánní studie
Charakteristika lidského genu pro FTO
FTO („fat mass and obesity associated“) obsahuje 9 exonů o celkovém rozpětí více než 400 kb, je lokalizován na lidském chromozomu 16 v pozici 16q12.2. Protein kódovaný tímto genem se skládá z 505 aminokyselin (NCBI Reference Sequence: NP_001073901.1, OMIM ID 610966). Většina funkčně zajímavých polymorfizmů (cluster asi 40 SNPs) je lokalizována na 1. intronu genu, a to v oblasti s mezidruhově silně konzervovanou sekvencí [12]. FTO je exprimován ve všech lidských embryonálních a dospělých tkáních, nejvyšší hladina exprese byla zjištěna v mozku, hypotalamu a játrech [11].
Funkce FTO in vivo je v detailu neznámá [17], nicméně bylo zjištěno [18], že FTO sdílí sekvenční motivy s Fe2+ a 2-oxoglutarát-dependentními oxygenázami. Rekombinantní lidský a myší FTO katalyzuje demetylace 3-methylthyminu in vitro [19]. Dále bylo zjištěno, že FTO působí i jako transkripční koaktivátor [20].
Tyto FTO aktivity mohou regulovat expresi genů zapojených do energetického hospodaření, což může vést ke vzniku obezity.
Polymorfizmy v genu pro FTO a jejich role v determinaci BMI
Intron 1
V roce 2007 se objevily prakticky současně 3 práce [13,14,21] popisující asociaci variant v genu pro FTO a BMI v několika nezávislých bělošských populacích. Primárně byly sledovány 3 varianty: rs9939609 (T/A), rs1421085 (C/T) a rs17817449 (G/T). Alely A (rs9939609), C (rs1421085) a G (rs17817449) byly silně spjaty s fenotypem obezity. Jak se později ukázalo [22], tyto varianty jsou v silné vazebné nerovnováze (přítomnost určitého nukleotidu v jedné pozici je téměř vždy vázána na přítomnost jiného nukleotidu v jiné pozici). U bělošských populací má alespoň 1 rizikovou alelu asi 60 % populace, okolo 20 % je nositelem 2 těchto alel. Vztah FTO k tělesné hmotnosti není z klinického hlediska nijak ohromující, ale u bělošských populací byl nalezen velice konzistentní vztah – přítomnost každé rizikové alely je spojena s přibližně 1,5–2,0 kg tělesné hmotnosti navíc [12–14,21].
Na evropských populacích bylo dosud provedeno několik desítek studií s různým designem a různým počtem sledovaných jedinců, nicméně s velice konzistentními výsledky. Nejdůležitější studie jsou shrnuty v tab. 1. Relativně malá pozornost byla dosud věnována úloze FTO u různě definovaných podskupin. Existují studie, které naznačují, že by se vliv FTO mohl lišit mezi pohlavími (v několika studiích nebyl potvrzen vztah FTO variant k BMI u žen [23,24]) či by mohl do určité míry záviset na menopauzálním statusu žen [22].
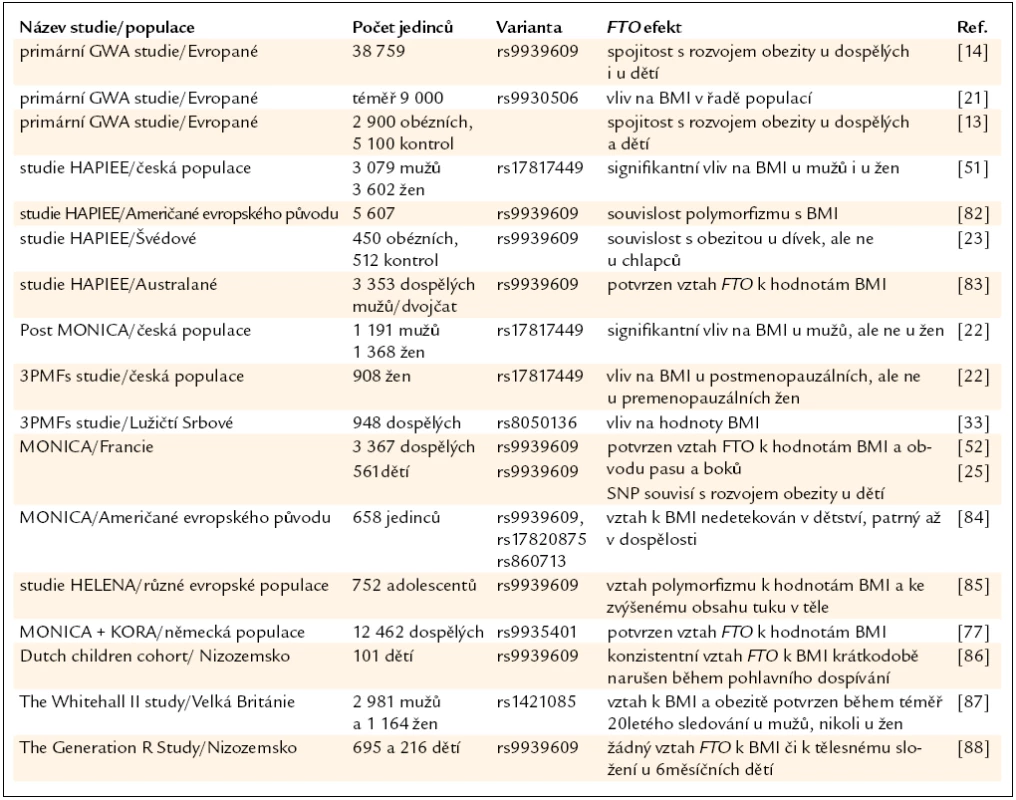
Nedlouho po prvních studiích na bělošských populacích byly publikovány výsledky získané na dalších etnických skupinách. Primárně je nezbytné zmínit, že FTO vykazuje významné mezietnické rozdíly jak ve frekvencích alel, tak v míře nalezené vazebné nerovnováhy. Studie s dostatečným počtem jedinců prokázaly vztah FTO variant k BMI jak u populací afrických, tak asijských, i když kauzální polymorfizmy spojené s BMI/obezitou jsou v některých případech odlišné. Analýzy Hispánců a obyvatelů Tichomoří nejsou vzhledem k relativně nízkým počtům sledovaných jedinců příliš průkazné [25–32].
Intron 3
GWA analýza izolované populace Lužických Srbů detekovala varianty v oblasti intronu 3 jako další a na intronu 1 nezávislé prediktory hodnot BMI. Kombinace alel C a G u SNPs rs10521308 a rs17818902, spojená s nižším průměrným BMI, se vyskytuje přibližně u 18 % populace. Vztah byl potvrzen u germánské populace, ale překvapivě ne v sousední slovanské populaci [33,34].
Mutace
FTO byl kompletně sekvenován u 1 433 extrémně obézních (753 dospělých a 680 dětí) a u stejného počtu štíhlých (1 221 dospělých a 212 dětí) Evropanů. Přestože byly objeveny mutace deaktivující FTO, vyskytovaly se jak u obézních, tak u štíhlých jedinců, a je tedy jasné, že nemají přímou souvislost se vznikem obezity jako takové [35]. Jedna z mutací, inaktivujících FTO, byla zmíněna ve spojitosti s autozomálně recesivní determinací úmrtnosti [11].
Potenciální vliv FTO na skladbu konzumované stravy, energetický příjem, subjektivní pocity sytosti a preference vysokokalorických potravin
Exprese FTO v hypotalamu (který je znám svou úlohou v regulaci chuti k jídlu) naznačuje, že kontrola energetického příjmu by mohla zprostředkovávat vliv rizikových alel FTO na hmotnost. Byla provedena celá řada studií sledujících potenciální vliv FTO variant na skladbu konzumované stravy či energetický příjem. Výsledky však nejsou konzistentní, což je nepochybně z části způsobeno i odlišnými protokoly studií.
Berentzen et al [36] nezjistili souvislost mezi energetickým výdejem nebo příjmem a FTO genotypy (u skupiny 234 mladých obézních mužů a 323 kontrol bělošského původu). Intervenční studie provedené u dětí a zdravých dospělých jedinců [37] či u diabetických pacientů [38] neprokázaly souvislost mezi variantami v 1. intronu genu pro FTO a poklesem hodnot BMI po fyzické zátěži. Hakanen et al [39] ve své studii nenašli souvislost mezi energetickým příjmem a fyzickou aktivitou u 15letých a podobně nebyla zjištěna souvislost mezi energetickým příjmem a FTO variantami u 2 300 prepubertálních dětí [40]. Liu et al [27] nepotvrdili souvislost mezi energetickým příjmem a fyzickou aktivitou u téměř 2 000 dospělých jedinců. Konečně ani studie 756 párů dvojčat nenašla souvislost mezi variantami v FTO a energetickým příjmem nebo fyzickou aktivitou [41]. Rovněž tak pokles BMI u 107 nediabetických českých žen s nadváhou neukázal po 10 týdnech kombinované intervence (optimalizovaný energetický příjem a zvýšená fyzická aktivita) významnou souvislost mezi poklesem BMI a variantami v genu pro FTO [42].
Naproti tomu alela spojovaná s obezitou souvisela se vzrůstajícím energetickým příjmem (ale ne s hmotností přijaté potravy) u skupiny 97 dětí [43]. U 150 dospělých jedinců, kteří podstoupili intervenční studii se změnou životního stylu [44], i u mnohem početnější skupiny 3 500 dětí [45], byl pozorován významný vliv varianty FTO jak na celkový energetický příjem, tak na denní příjem tuku. Některá, ale ne všechna, sledování dětí naznačují, že FTO genotyp odpovědný za vznik obezity může souviset s vyšším prahem pocitu sytosti vedoucím ke zvýšenému příjmu potravy [28,40,46].
Přestože v uvedených studiích nebyly analyzovány vždy stejné SNPs, je nepravděpodobné, že by tato skutečnost vysvětlila nalezené rozdíly. Všechny analyzované varianty v asociačních studiích souvisí s BMI podobným způsobem a všechny SNPs na 1. intronu FTO jsou v téměř kompletní vazebné rovnováze. Varianty FTO se tak pravděpodobně nepodílí na regulaci energetického výdeje/fyzické aktivity, ale mohou hrát roli při kontrole příjmu potravy a preferenci vysokokalorických potravin [43].
Vliv na energetický příjem je pozorovatelný spíše u dětí a adolescentů, ale ne u dospělých jedinců. Protože vztah FTO k obezitě je patrný již v dětství [13,14,26,47], je možné, že rozdíly získané v raném věku „pouze“ přetrvávají do dospělosti. Prozatímní studie neukázaly, že by FTO alely mohly ovlivnit fyzickou aktivitu jedinců per se. Nicméně existuje studie provedená u dánské populace (skupina 6 000 jedinců) ukazující, že genetická predispozice ke vzniku obezity nebo nadváhy u homozygotních jedinců s rizikovými alelami může být potlačena dostatečnou fyzickou aktivitou [47].
U zdravých žen byla prokázána korelace mezi hladinami FTO mRNA v tukové tkáni a rostoucím BMI a nositelky rizikové alely měly sníženou lipolytickou aktivitu, a to nezávisle na BMI [48].
FTO a bazální metabolizmus (BMR)
Skotská studie (150 jedinců) nepotvrdila souvislost mezi FTO variantami a BMR [50].
V The Quebec Family Study (908 jedinců) byla zjištěna souvislost mezi FTO variantami a klidovým metabolizmem. Vztah nicméně vymizel po adjustaci k BMI [50]. Podobně se ukázalo, že riziková varianta FTO může ovlivnit negativním směrem bazální metabolizmus vztažený na kg hmotnosti jedince [51].
Další charakteristiky a patofyziologie analyzované ve spojitosti s genem pro FTO
Diabetes mellitus 2. typu (DM2T)
Primárně byl gen pro FTO detekován pomocí GWAs studie zaměřené na analýzu genetických dispozic k DM2T [14]. Cluster SNPs na intronu 1 FTO vykazoval významnou souvislost s DM2T, avšak vztah zmizel po adjustaci na BMI. Později se ale objevilo několik studií potvrzujících vztah mezi FTO rs9939609 polymorfizmem a rizikem vzniku DM2T. Toto riziko bylo vyšší přibližně o 48 % ve francouzské studii MONICA [52], o 50 % u nositelů alely A ve finské studii [53] a přibližně o 25 % ve studii „The Wellcome Trust Case-Control Consortium“ [54]. Souvislost mezi FTO a DM2T je tak patrně částečně, ale ne zcela, zprostředkován přes BMI.
Bylo zjištěno, že množství mRNA FTO a proteinu je v kosterních svalech u pacientů s DM2T výrazně vyšší v porovnání s obézními nediabetiky a s pacienty s DM1T. Studie provedené in vitro podpořily možnost vlivu FTO na oxidační metabolizmus, lipogenezi a oxidační svalové napětí [55].
Vztah FTO k DM2T není omezen pouze na bělošské západoevropské etnikum, ale byl prokázán i v rozsáhlé metaanalýze pákistánské populace (3 919 DM2T pacientů a 4 172 kontrol) [56].
Další metaanalýza na 41 504 jedincích ze Skandinávie potvrdila souvislost FTO s DM2T [57]. V jiné studii na japonské populaci (6 781 pacientů a 7 307 kontrol) byla prokázána významná souvislost FTO s diabetem po adjustaci k BMI [58]. V další studii (vzorky vybrány ze studie CURES, 1 001 kontrol, 851 diabetiků), provedené na populaci jižní Indie, bylo analyzováno celkem 6 polymorfizmů FTO lokalizovaných na 3 intronech, přičemž většina z nich souvisela s DM2T [59].
Doney et al [60] ve své studii 4 897 pacientů zjistili, že větší množství tukové hmoty u nositelů rizikové alely A (rs9939606) nesouvisí pouze s rizikem rozvoje DM2T, ale také s aterogenním lipidovým profilem a rizikem vzniku infarktu myokardu (IM).
FTO a kardiovaskulární onemocnění (KVO)
Další studie poukázaly na možný vztah mezi variantami v intronu 1 FTO a KVO.
Lapplainen et al zjistili, že polymorfizmus rs9969609 FTO může přispívat k rozvoji KVO u mužů s abnormálním metabolizmem glukózy [61]. Naše studie potvrdila vyšší výskyt rizikového genotypu u pacientů s akutním koronárním syndromem. Vztah byl nezávislý na BMI pacientů a zůstal signifikantní jak po adjustaci na diabetes, tak po vyloučení diabetiků z analýzy [62]. Americká studie zaměřená na frekvenci výskytu KVO u zdravých žen bělošského původu (21 674 jedinců) zjistila vyšší riziko KVO u žen s rizikovou alelou a současně s nižší pohybovou aktivitou [63].
Nádorová onemocnění
Obezita je známým rizikovým faktorem rozvoje nádorových onemocnění, a proto se přímo nabízí otázka, zda varianty FTO spojené s hodnotami BMI ovlivní i výskyt tohoto onemocnění. První publikovaná studie (rs9939609) nalezla zvýšené riziko vzniku nádorových onemocnění v ledvinách především v mladším věku (do 50 let) a zároveň poněkud překvapivě spojitost mezi přítomností alely zvyšující BMI a nižším rizikem plicních nádorových onemocnění [64].
Dvě nezávislé studie sledovaly potenciální vliv FTO na karcinom endometria. První z nich [65] sledovala primárně 417 polských pacientek a 406 kontrol (replikační studie pak 2 347 případů a 3 140 kontrol ze 3 nezávislých studií; ženy evropského a australského původu) a nepotvrdila souvislost mezi polymorfizmy a rizikem vzniku nádorového onemocnění. Další studie (3 601 bělošek s histologicky potvrzeným karcinomem endometria a 5 275 kontrolních zdravých žen) zjistila zvýšené riziko vzniku rakoviny endometria u nositelek genotypu asociovaného s BMI. I když vztah byl nesignifikantní po adjustaci na BMI, výsledek naznačil, že onemocnění může být zprostředkováno genem způsobujícím nadváhu [66].
Lewis et al [67] popsali souvislost mezi FTO rs9939609 a rizikem vzniku nádorových onemocnění prostaty. Přítomnost rizikové alely A nepřímo souvisela s celkovým rizikem onemocnění, ale jasně souvisela s vyšším stupněm karcinomu prostaty.
Nock et al [68] ve své studii sledovali celkem 5 nejznámějších SNP FTO. U bělošské populace nenalezli souvislost mezi polymorfizmy a rizikem vzniku adenomů, ale u populace afrického původu byla přítomnost jedné nebo dvou kopií variantních alel u SNPs rs17817449 a rs8050136 spojena se zvýšeným rizikem výskytu kolorektálního adenomu.
Polycystická ovaria (PCOS)
Cílem několika studií bylo zjistit spojitost mezi variantami v genu pro FTO a syndromem PCOS. PCOS se u premenopauzálních žen vyskytuje s prevalencí 5–7 % a velmi často koexistuje s obezitou a DM2T [69,70]. Studie provedená u více než 1 700 britských a 1 000 finských žen ukázala, že varianty FTO ovlivňují vznik PCOS prostřednictvím tukové hmoty a obezity analogicky jako u DM2T [71].
V další studii byl popsán vliv FTO na rozvoj PCOS prostřednictvím metabolického syndromu a jeho složek, zejména prostřednictvím intolerance glukózy [72].
Varia
Byla popsána i spojitost mezi FTO variantou rs17817449 a renálním selháním (studie zahrnující 2 196 pacientů a 9 048 zdravých kontrol, vždy 2 nezávislé skupiny). Nositelé genotypu spojeného s obezitou měli o asi 25 % vyšší riziko selhání ledvin oproti ostatním a vztah byl signifikantní i po adjustaci na BMI [73].
Bassols et al [74] popsali, že FTO je vysoce exprimován v placentě a ovlivňuje výši porodní hmotnosti a délku dětí jak prvorodiček, tak vícerodiček. Exprese placentárního FTO se může účastnit kontroly váhového přírůstku plodu nebo rozdělování přírůstku mezi plod a placentu.
Rozsáhlá, dlouhodobá dánská studie prokázala u mužů signifikantní vztah mezi FTO a úmrtností. Vyšší úmrtnost nesouvisela s žádným specifickým onemocněním (nejvyšší, nicméně nevýznamná, asociace FTO a úmrtnosti byla u neurodegenerativních onemocnění) a vztah nebyl ovlivněn hodnotami BMI. Vliv genu na celkovou úmrtnost byl podobný jako vliv kouření [75].
Švédská studie (rs9939609) na 22 799 jedincích oproti tomu neprokázala souvislost mezi genotypy FTO a celkovou úmrtností u žen ani u mužů. FTO genotyp může ovlivňovat souvislost mezi fyzickou aktivitou a kardiovaskulární mortalitou [76].
Na rozsáhlé německé studii KORA byla provedena analýza putativního vztahu FTO k nejvyššímu dosaženému vzdělání a ekonomickému statusu [77]. Tyto dvě socioekonomické charakteristiky byly ve sledované populaci nezávislé na variantách FTO genu. Protože je německá populace jednou z nejvzdělanějších a ekonomicky nejlépe zabezpečených populací, analyzovali jsme stejné charakteristiky i na sousední české populaci, kde je především ekonomické zabezpečení obyvatelstva signifikantně nižší. Ani zde jsme nenalezli žádný vztah k dosaženému vzdělání nebo ekonomickému statusu (Hubáček et al, připravováno k publikaci). Je tedy velice pravděpodobné, že gen pro FTO neovlivní socioekonomickou situaci jedince a vztah FTO k řadě výše zmíněných onemocnění není zprostředkován touto cestou.
S využitím dat ze skupinové studie Tanno-Sobetsu (1 514 Japonců) byla popsána asociace FTO varianty rs1121980 s hladinou plazmatického imunoreaktivního inzulinu (IRI) s hodnotami homeostatické inzulinové rezistence (HOMA-IR), a to i po adjustaci k věku, pohlaví a BMI [78].
FTO a riziko vzniku závislosti na tabáku či alkoholu
SNP na intronu 2 FTO byl před několika lety detekován i jako rizikový faktor rozvoje závislosti na tabáku [79]. Asociace mezi FTO polymorfizmem a kuřáckým statusem byla prokázána u žen, ale ne u mužů. Nebyl nalezen vztah k počtu vykouřených cigaret. Genotyp na intronu 1 predisponující k vyšším hodnotám BMI je spojen i s mírně zvýšeným počtem vykouřených cigaret u kuřáků v době jejich nejintenzivnějšího kouření a s počátkem kouření v nižším věku, ale zdá se být protektivní proti vzniku závislosti na alkoholu v polské populaci [80]. V české studii post-MONICA nebyl nalezen vztah mezi kuřáckým statusem či počtem vykouřených cigaret pro varianty v intronech 1, 2 a 3 FTO [81].
Závěr
Varianty v genu pro FTO jsou prozatím nejsilnějším detekovaným genetickým determinantem hodnot BMI. Přítomnost jedné rizikové alely je spjata s nárůstem tělesné hmotnosti přibližně o 1,5–2,0 kg. Stejné alely souvisí i se zvýšeným rizikem vzniku DM2T, KVO a alespoň některých nádorových onemocněních a s celkově vyšší mortalitou, a to nezávisle na hodnotách BMI. Přesný mechanizmus tohoto vlivu je však neznámý.
Poděkování
Autoři jsou podporováni projektem č. 00023001 (IKEM, ČR).
Mgr. Dana Dlouhá
www.ikem.cz
e-mail: dadl@ikem.cz
Doručeno do redakce: 28. 7. 2011
Přijato po recenzi: 11. 11. 2011
Sources
1. Marinou K, Tousoulis D, Antonopoulos AS et al. Obesity and cardiovascular disease: from pathophysiology to risk stratification. Int J Cardiol 2010; 138 : 3–8.
2. Hainer V et al. Základy klinické obezitologie. II. přepracované a doplněné vydání. Praha: Grada publishing 2011.
3. Lizicárová D, Hirnerová E, Krahulec B. Obesity – the risk factor of cardiovascular disease in patients with chronic kidney disease? Vnitř Lék 2010; 56 : 1088–1092.
4. Martín-Ponce E, Santolaria F, Alemán-Valls MR et al. Factors involved in the paradox of reverse epidemiology. Clin Nutr 2010; 29 : 501–506.
5. Hubacek JA. Eat less and exercise more – is it really enough to knock down the obesity pandemia? Physiol Res 2009; 58 (Suppl 1): S1–S6.
6. Stunkard AJ, Harris JR, Pedersen NL et al. The body-mass index of twins who have been reared apart. N Engl J Med 1990; 322 : 1483–1487.
7. Hainerová IA. Genetics of obesity. Vnitř Lék 2010; 56 : 1035–1042.
8. Hainer V, Zamrazilová H, Spálová J et al. Role of hereditary factors in weight loss and its maintenance. Physiol Res 2008; 57 (Suppl 1): S1–S15.
9. Bogardus C. Missing heritability and GWAS utility. Obesity (Silver Spring) 2009; 17 : 209–210.
10. Peters T, Ausmeier K, Rüther U. Cloning of Fatso (FTO), a novel gene deleted by the Fused toes (Ft) mouse mutation. Mamm Genome 1999; 10 : 983–986.
11. Boissel S, Reish O, Proulx K et al. Loss-of-function mutation in the dioxygenase-encoding FTO gene causes severe growth retardation and multiple malformations. Am J Hum Genet 2009; 85 : 106–111.
12. Loos RJ, Bouchard C. FTO: the first gene contributing to common forms of human obesity. Obes Rev 2008; 9 : 246–250.
13. Dina C, Meyre D, Gallina S et al. Variation in FTO contributes to childhood obesity and severe adult obesity. Nat Genet 2007; 39 : 724–726.
14. Frayling TM, Timpson NJ, Weedon MN et al. A common variant in the FTO gene is associated with body mass index and predisposes to childhood and adult obesity. Science 2007; 316 : 889–894.
15. Fischer J, Koch L, Emmerling C et al. Inactivation of the FTO gene protects from obesity. Nature 2009; 458 : 894–898.
16. Church C, Lee S, Bagg EA et al. A mouse model for the metabolic effects of the human fat mass and obesity associated FTO gene. PLoS Genet 2009; 5: e1000599.
17. Fawcett KA, Barroso I. The genetics of obesity: FTO leads the way. Trends Genet 2010; 26 : 266–274.
18. Gerken T, Girard CA, Tung YC et al. The obesity-associated FTO gene encodes a 2-oxoglutarate-dependent nucleic acid demethylase. Science 2007; 318 : 1469–1472.
19. Jia G, Yang CG, Yang S et al. Oxidative demethylation of 3-methylthymine and 3-methyluracil in single-stranded DNA and RNA by mouse and human FTO. FEBS Lett 2008; 582 : 3313–3319.
20. Wu Q, Saunders RA, Szkudlarek-Mikho M et al. The obesity-associated FTO gene is a transcriptional coactivator. Biochem Biophys Res Commun 2010; 401 : 390–395.
21. Scuteri A, Sanna S, Chen WM et al. Genome-wide association scan shows genetic variants in the FTO gene are associated with obesity related traits. PLoS Genet 2007; 3: e115.
22. Hubacek JA, Pitha J, Adamkova V et al. A common variant in the FTO gene is associated with body mass index in males and postmenopausal females but not in premenopausal females. Czech post-MONICA and 3PMFs studies. Clin Chem Lab Med 2009; 47 : 387–390.
23. Jacobsson JA, Danielsson P, Svensson V et al. Major gender difference in association of FTO gene variant among severely obese children with obesity and obesity related phenotypes. Biochem Biophys Res Commun 2008; 368 : 476–482.
24. Song Y, You NC, Hsu YH et al. FTO polymorphisms are associated with obesity but not diabetes risk in postmenopausal women. Obesity (Silver Spring) 2008; 16 : 2472–2480.
25. Bollepalli S, Dolan LM, Deka R et al. Association of FTO gene variants with adiposity in African-American adolescents. Obesity (Silver Spring) 2010; 18 : 1959–1963.
26. López-Bermejo A, Petry CJ, Díaz M et al. The association between the FTO gene and fat mass in humans develops by the postnatal age of two weeks. J Clin Endocrinol Metab 2008; 93 : 1501–1505.
27. Liu G, Zhu H, Lagou V et al. FTO variant rs9939609 is associated with body mass index and waist circumference, but not with energy intake or physical activity in European - and African - American youth. BMC Med Genet 2010; 11 : 57.
28. Rendo T, Moleres A, Marti Del Moral A. Effects of the FTO gene on lifestyle intervention studies in children. Obes Facts 2009; 2 : 393–399.
29. Demerath EW, Lutsey PL, Monda KL et al. Interaction of FTO and physical activity level on adiposity in African-American and European-American adults: the ARIC Study. Obesity (Silver Spring) 2011; 19 : 1866–1872.
30. Liu Y, Liu Z, Song Y et al. Meta-analysis added power to identify variants in FTO associated with type 2 diabetes and obesity in the Asian population. Obesity (Silver Spring) 2010; 18 : 1619–1624.
31. Cheung CY, Tso AW, Cheung BM et al. Obesity susceptibility genetic variants identified from recent genome-wide association studies: implications in a chinese population. J Clin Endocrinol Metab 2010; 95 : 1395–1403.
32. Adeyemo A, Chen G, Zhou J et al. FTO genetic variation and association with obesity in West Africans and African Americans. Diabetes 2010; 59 : 1549–1554.
33. Tönjes A, Zeggini E, Kovacs P et al. Association of FTO variants with BMI and fat mass in the self-contained population of Sorbs in Germany. Eur J Hum Genet 2010; 18 : 104–110.
34. Dlouha D, Adamkova V, Lanska V et al. Lack of association between a new tag SNP in the FTO gene and BMI in Czech-Slavonic population. Eur J Hum Genet 2010; 18 : 1274.
35. Meyre D, Proulx K, Kawagoe-Takaki H et al. Prevalence of loss-of-function FTO mutations in lean and obese individuals. Diabetes 2010; 59 : 311–318.
36. Berentzen T, Kring SI, Holst C et al. Lack of association of fatness-related FTO gene variants with energy expenditure or physical activity. J Clin Endocrinol Metab 2008; 93 : 2904–2908.
37. Müller TD, Hinney A, Scherag A et al. Fat mass and obesity associated gene (FTO): no significant association of variant rs9939609 with weight loss in a lifestyle intervention and lipid metabolizm markers in German obese children and adolescents. BMC Med Genet 2008; 9 : 85.
38. Lappalainen TJ, Tolppanen AM, Kolehmainen M et al. Diabetes Prevention Study Group. The common variant in the FTO gene did not modify the effect of lifestyle changes on body weight: the Finnish Diabetes Prevention Study. Obesity (Silver Spring) 2009; 17 : 832–836.
39. Hakanen M, Raitakari OT, Lehtimäki T et al. FTO genotype is associated with body mass index after the age of seven years but not with energy intake or leisure-time physical activity. J Clin Endocrinol Metab 2009; 94 : 1281–1287.
40. Johnson L, van Jaarsveld CH, Emmett PM et al. Dietary energy density affects fat mass in early adolescence and is not modified by FTO variants. PLoS One 2009; 4: e4594.
41. Hasselbalch AL, Angquist L, Christiansen L et al. A variant in the fat mass and obesity-associated gene (FTO) and variants near the melanocortin-4 receptor gene (MC4R) do not influence dietary intake. J Nutr 2010; 140 : 831–834.
42. Dlouha D, Suchanek P, Lanska V et al. Body mass index change in females after short-time life style intervention is not dependent on the FTO polymorphisms. Physiol Res 2011; 60 : 199–202.
43. Cecil JE, Tavendale R, Watt P et al. An obesity-associated FTO gene variant and increased energy intake in children. N Engl J Med 2008; 359 : 2558–2566.
44. Haupt A, Thamer C, Staiger H et al. Variation in the FTO gene influences food intake but not energy expenditure. Exp Clin Endocrinol Diabetes 2009; 117 : 194–197.
45. Timpson NJ, Emmett PM, Frayling TM et al. The fat mass - and obesity-associated locus and dietary intake in children. Am J Clin Nutr 2008; 88 : 971–978.
46. Wardle J, Llewellyn C, Sanderson S et al. The FTO gene and measured food intake in children. Int J Obes (Lond) 2009; 33 : 42–45.
47. Andreasen CH, Stender-Petersen KL, Mogensen MS et al. Low physical activity accentuates the effect of the FTO rs9939609 polymorphism on body fat accumulation. Diabetes 2008; 57 : 95–101.
48. WÅhlén K, Sjölin E, Hoffstedt J. The common rs9939609 gene variant of the fat mass and obesity associated gene (FTO) is related to fat cell lipolysis. J Lipid Res 2008; 49 : 607–611.
49. Speakman JR, Rance KA, Johnstone AM. Polymorphisms of the FTO gene are associated with variation in energy intake, but not energy expenditure. Obesity (Silver Spring) 2008; 16 : 1961–1965.
50. Do R, Bailey SD, Desbiens K et al. Genetic variants of FTO influence adiposity, insulin sensitivity, leptin levels, and resting metabolic rate in the Quebec Family Study. Diabetes 2008; 57 : 1147–1150.
51. Hubacek JA, Pikhart H, Peasey A et al. FTO variant, energy intake, physical activity and basal metabolic rate in Caucasians. The HAPIEE study. Physiol Res 2011; 60 : 175–183.
52. Legry V, Cottel D, Ferrières J et al. Effect of an FTO polymorphism on fat mass, obesity, and type 2 diabetes mellitus in the French MONICA Study. Metabolism 2009; 58 : 971–975.
53. Scott LJ, Mohlke KL, Bonnycastle LL et al. A genome-wide association study of type 2 diabetes in Finns detects multiple susceptibility variants. Science 2007; 316 : 1341–1345.
54. Burton PR, Clayton DG, Cardon LR et al. The Wellcome Trust Case-Control Consortium. Genome-wide associationstudy of 14,000 cases of seven common diseases and 3,000 shared--controls. Nature 2007; 447 : 661–678.
55. Bravard A, Lefai E, Meugnier E et al. FTO is increased in muscle during type 2 diabetes, and its overexpression in myotubes alters insulin signaling, enhances lipogenesis and ROS production, and induces mitochondrial dysfunction. Diabetes 2011; 60 : 258–268.
56. Rees SD, Islam M, Hydrie MZ et al. An FTO variant is associated with Type 2 diabetes in South Asian populations after accounting for body mass index and waist circumference. Diabet Med 2011; 28 : 673–680.
57. Hertel JK, Johansson S, Sonestedt E et al. FTO, type 2 diabetes and weight gain throughout adult life: a meta-analysis of 41,504 subjects from the Scandinavian HUNT, MDC and MPP studies. Diabetes 2011; 60 : 1637–1644.
58. Takeuchi F, Yamamoto K, Katsuya T et al. Association of genetic variants for susceptibility to obesity with type 2 diabetes in Japanese individuals. Diabetologia 2011; 54 : 1350–1359.
59. Ramya K, Radha V, Ghosh S et al. Genetic variations in the FTO gene are associated with type 2 diabetes and obesity in south Indians (CURES-79). Diabetes Technol Ther 2011; 13 : 33–42.
60. Doney AS, Dannfald J, Kimber CH et al. The FTO gene is associated with an atherogenic lipid profile and myocardial infarction in patients with type 2 diabetes: a Genetics of Diabetes Audit and Research Study in Tayside Scotland (Go-DARTS) study. Circ Cardiovasc Genet 2009; 2 : 255–259.
61. Lappalainen T, Kolehmainen M, Schwab US et al. Finnish Diabetes Prevention Study Group. Association of the FTO gene variant (rs9939609) with cardiovascular disease in men with abnormal glucose metabolizm – The Finnish Diabetes Prevention Study. Nutr Metab Cardiovasc Dis 2011; 21 : 691–698.
62. Hubacek JA, Stanek V, Gebauerová M et al. A FTO variant and risk of acute coronary syndrome. Clin Chim Acta 2010; 411 : 1069–1072.
63. Ahmad T, Chasman DI, Mora S et al. The fat-mass and obesity-associated (FTO) gene, physical activity, and risk of incident cardiovascular events in white women. Am Heart J 2010; 160 : 1163–1169.
64. Brennan P, McKay J, Moore L et al. Obesity and cancer: Mendelian randomization approach utilizing the FTO genotype. Int J Epidemiol 2009; 38 : 971–975.
65. Gaudet MM, Yang HP, Bosquet JG et al. No association between FTO or HHEX and endometrial cancer risk. Cancer Epidemiol Biomarkers Prev 2010; 19 : 2106–2109.
66. Lurie G, Gaudet MM, Spurdle AB et al. Australian National Endometrial Cancer Study Group; Epidemiology of Endometrial Cancer Consortium (E2C2). The obesity-associated polymorphisms FTO rs9939609 and MC4R rs17782313 and endometrial cancer risk in non-Hispanic white women. PLoS One 2011; 6: e16756.
67. Lewis SJ, Murad A, Chen L, et al. Associations between an obesity related genetic variant (FTO rs9939609) and prostate cancer risk. PLoS One 2010; 5: e13485.
68. Nock NL, Plummer SJ, Thompson CL et al. FTO polymorphisms are associated with adult body mass index (BMI) and colorectal adenomas in African-Americans. Carcinogenesis 2011; 32 : 748–756.
69. Asunción M, Calvo RM, San Millán JL et al. A prospective study of the prevalence of the polycystic ovary syndrome in unselected Caucasian women from Spain. J Clin Endocrinol Metab 2000; 85 : 2434–2438.
70. Legro RS. The genetics of obesity. Lessons for polycystic ovary syndrome. Ann NY Acad Sci 2000; 900 : 193–202.
71. Barber TM, Bennett AJ, Groves CJ et al. Association of variants in the fat mass and obesity associated (FTO) gene with polycystic ovary syndrome. Diabetologia 2008; 51 : 1153–1158.
72. Attaoua R, Ait El, Mkadem S et al. FTO gene associates to metabolic syndrome in women with polycystic ovary syndrome. Biochem Biophys Res Commun 2008; 373 : 230–234.
73. Hubacek JA, Viklicky O, Dlouha D et al. The FTO gene polymorphism is associated with end-stage renal disease: two large independent case--control studies in a general population. Nephrol Dial Transplant 2012; 27 : 1030–1035.
74. Bassols J, Prats-Puig A, Vázquez-Ruíz M et al. Placental FTO expression relates to fetal growth. Int J Obes (Lond) 2010; 34 : 1365–1370.
75. Zimmermann E, Kring SI, Berentzen TL et al. Fatness-associated FTO gene variant increases mortality independent of fatness – in cohorts of Danish men. PLoS One 2009; 4: e4428.
76. Sonestedt E, Gullberg B, Ericson U et al. Association between fat intake, physical activity and mortality depending on genetic variation in FTO. Int J Obes (Lond) 2011; 35 : 1041–1049.
77. Holzapfel C, Grallert H, Huth C et al. Genes and lifestyle factors in obesity: results from 12,462 subjects from MONICA/KORA. Int J Obes (Lond) 2010; 34 : 1538–1545.
78. Shimaoka I, Kamide K, Ohishi M et al. Association of gene polymorphism of the fat-mass and obesity-associated gene with insulin resistance in Japanese. Hypertens Res 2010; 33 : 214–218.
79. Bierut LJ, Madden PA, Breslau N et al. Novel genes identified in a high-density genome wide association study for nicotine dependence. Hum Mol Genet 2007; 16 : 24–35.
80. Sobczyk-Kopciol A, Broda G, Wojnar M et al. Inverse association of the obesity predisposing FTO rs9939609 genotype with alcohol consumption and risk for alcohol dependence. Addiction 2011; 106 : 739–748.
81. Hubacek JA, Dlouha D, Lanska V et al. Lack of an association between three tagging SNPs within the FTO gene and smoking behavior. Nicotine Tob Res 2011 [Epub ahead of print].
82. Hunt SC, Stone S, Xin Y et al. Association of the FTO gene with BMI. Obesity (Silver Spring) 2008; 16 : 902–904.
83. Cornes BK, Lind PA, Medland SE et al. Replication of the association of common rs9939609 variant of FTO with increased BMI in an Australian adult twin population but no evidence for gene by environment (G × E) interaction. Int J Obes (Lond) 2009; 33 : 75–79.
84. Mei H, Chen W, Srinivasan SR et al. FTO influences on longitudinal BMI over childhood and adulthood and modulation on relationship between birth weight and longitudinal BMI. Hum Genet 2010; 128 : 589–596.
85. Ruiz JR, Labayen I, Ortega FB et al. HELENA Study Group. Attenuation of the effect of the FTO rs9939609 polymorphism on total and central body fat by physical activity in adolescents: the HELENA study. Arch Pediatr Adolesc Med 2010; 164 : 328–333.
86. Rutters F, Nieuwenhuizen AG, Bouwman F et al. Associations between a single nucleotide polymorphism of the FTO gene (rs9939609) and obesity-related characteristics over time during puberty in a dutch children cohort. J Clin Endocrinol Metab 2011; 96: E939–E942.
87. Kivimäki M, Jokela M, Hamer M et al. Examining overweight and obesity as risk factors for common mental disorders using fat mass and obesity-associated (FTO) genotype-instrumented analysis: The Whitehall II Study, 1985–2004. Am J Epidemiol 2011; 173 : 421–429.
88. Mook-Kanamori DO, Ay L, Hofman A et al. No association of obesity gene FTO with body composition at the age of 6 months. The Generation R Study. J Endocrinol Invest 2011; 34 : 16–20.
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Internal Medicine

2012 Issue 3
-
All articles in this issue
- Blood pressure changes in chronically haemodialysed patients
- The benefits of centralization of care for patients with acute upper gastrointestinal bleeding
- Vitamin D – remarks of known and overwiev of new facts
- Oxidative stress in kidney disease patients
- FTO gene and his role in genetic determination of obesity
- Castleman’s disease
- Secondary dyslipidemias
- Androgen deficit and diabetes
- Guidelines for alemtuzumab treatment in chronic lymphocytic leukaemia (CLL)
- Recommendations of care for patients with prediabetes
- The role of PET-CT in decision making on the treatment of localized nodular form of pulmonary AL-amyloidosis
- The seroprevalence of HCV among injecting drug users in the years 2004–2008 in Slovakia
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue
- Castleman’s disease
- The role of PET-CT in decision making on the treatment of localized nodular form of pulmonary AL-amyloidosis
- FTO gene and his role in genetic determination of obesity
- Blood pressure changes in chronically haemodialysed patients
