Chronická myeloidní leukemie – zásadní změna prognózy nemocných po zavedení léčby inhibitory tyrozinových kináz
Chronic myeloid leukaemia – a crucial change to the patient prognosis after an introduction of tyrosine kinase inhibitors
Chronic myeloid leukaemia (CML) is an example of a disease where new knowledge in molecular biology enabled thorough understanding of the nature of the disease as well as it led to a discovery of completely new, targeted treatment principle, i.e. inhibition of tyrosine kinase Bcr-Abl, now the main therapeutic target. Introduction of tyrosine kinase inhibitors (TKI) imatinib, dasatinib, nilotinib into clinical practice meant a revolutionary change to treatment strategy with a significant effect on survival and patient quality of life. A disease with originally fatal prognosis has changed in patients diagnosed in its chronic phase to a disease with expected median survival estimated at more than 25 years.
Key words:
chronic myeloid leukaemia – tyrosine kinase inhibitors – imatinib – dasatinib – nilotinib – interferone alpha
:
H. Klamová
:
Ústav hematologie a krevní transfuze Praha, ředitel prof. MUDr. Marek Trněný, CSc.
:
Vnitř Lék 2012; 58(Suppl 2): 27-37
:
Chronická myeloidní leukemie (CML) je příkladem onemocnění, kde nové poznatky v molekulární biologii umožnily nejen důkladné poznání podstaty nemoci, ale vedly také k objevení zcela nového, cíleného principu léčby, a to inhibici tyrozinové kinázy Bcr-Abl, která se tak stala hlavním terapeutickým cílem. Zavedení inhibitorů tyrozinových kináz (TKI) imatinibu, dasatinibu a nilotinibu do klinické praxe znamenalo převratnou změnu v léčebné strategii a významně ovlivnilo jak přežití, tak také kvalitu života nemocných. Onemocnění z původně fatální prognózou se změnilo u pacientů diagnostikovaných v chronické fázi nemoci v onemocnění s očekávaným mediánem přežití odhadovaným na více než 25 let.
Klíčová slova:
chronická myeloidní leukemie – inhibitory tyrozinové kinázy – imatinib – dasatinib – nilotinib – interferon α
Úvod
Výzkum na poli chronické myeloidní leukemie (CML) a odhalení podstaty molekulární patogeneze choroby umožnily studovat také zcela nové možnosti léčby, kterými se v 1. dekádě 21. století staly inhibitory tyrozinových kináz (TKI), které pak zcela zásadním (revolučním) způsobem změnily léčebnou strategii a výrazně zlepšily také prognózu onemocnění.
Definice a epidemiologie
Chronická myeloidní leukemie (CML) je klonální myeloproliferativní onemocnění charakterizované přítomností Filadelfského chromozomu (Ph), vzniklého reciprokou translokací mezi chromozomy 9 a 22 t(9;22)(q34;q11), vyvolávající vznik fúzního genu BCR-ABL1. Gen kóduje konstitutivně aktivovanou tyrozinovou kinázu, která hraje klíčovou roli při vzniku onemocnění [1].
CML představuje asi 15–20 % všech leukemií. Údaje o celkové incidenci se různí a pohybují se od 0,6 do 2,0 nových případů na 100 000 obyvatel za rok. Nejčastěji je udáván počet nově zjištěných onemocnění od 1,0 do 1,5 na 100 000 obyvatel za rok, s mírnou predispozicí mužů (1,4 : 1) a během posledních let se výrazně nemění [2]. Počet nových onemocnění narůstá s přibývajícím věkem, medián věku při stanovení diagnózy je 65 let, 75 % nemocných je starších 50 let. S věkem stoupá také mortalita. Nebyla popsána rodová, rasová ani geografická predispozice. Přesný výskyt CML v České republice stanovený formou epidemiologické studie není k dispozici, podle hlášení do Národního onkologického registru je udávána incidence 1,1–1,5 na 100 000 obyvatel, každým rokem je tedy diagnostikováno 100–150 nových onemocnění [3]. V současné době jsou všichni nově diagnostikovaní pacienti zařazeni (evidováni) v klinických databázích projektů CAMELIA a INFINITY a současně také v Evropském populačním registru, který vznikl v rámci projektu odborné společnosti European Leukemia Net (ELN) a farmaceutické společnosti Novartis s názvem European Treatment Outcome Study for CML (EUTOS) a který od roku 2009 shromažďuje všechny nově diagnostikované pacienty s CML v geograficky vymezených oblastech Evropy [4].
Patogeneze
CML je prvním lidským nádorem, u kterého se podařilo prokázat, že jeho příčinou je genetická abnormalita. Historie objevů u CML začala průkazem filadelfského chromozomu v roce 1960 Nowelem a Hungerfordem ve Filadelfii a pokračovala v 70. až 90. letech minulého století díky pokrokům v molekulární biologii. Za jeden z nejvýznamnějších objevů je v roce 1985 považováno zjištění, že RNA specifická pro CML je transkriptem fúze 2 genů, a v roce 1990 zjištění, že protein p210 Bcr-Abl vykazuje tyrozinkinázovou aktivitu a přenesením chromozomu Philadelphia lze u myší vyvolat chronickou myeloidní leukemii. Poprvé se také v souvislosti s léčbou, a to díky prof. Druckerovi, začíná hovořit o koncepci specifické, tzv. cílené léčby [5].
Filadelfský chromozom (Ph chromozom), jak již bylo řečeno, je výsledkem reciproké translokace mezi chromozomy 9 a 22, při které vzniká fúzní gen BCR-ABL. Při translokaci t(9;22) fúzuje větší část genu ABL po zlomení 9. chromozomu s částí zlomeného genu BCR na 22. chromozomu a vytváří tak chimerický gen BCR-ABL nesoucí vždy část informace obou genů. Ten kóduje protein p210BCR/ABL, který vykazuje tyrozinkinázovou aktivitu proteinu c-ABL. Od c-ABL se však významně liší v několikanásobně zvýšené tyrozinkinázové aktivitě a tím, že tento protein je autofosforylován, což zabraňuje jeho jakékoli regulaci. Je lokalizován výlučně v cytoplazmě, což umožňuje přístup k substrátu, jež díky své vysoce účinné aktivitě může fosforylovat, a tím aktivovat. Při vzniku fúzního genu BCR-ABL dochází většinou ke zlomům genů v několika jejich oblastech, vždy výlučně v intronech (nekódují oblast DNA). V genu ABL je to po obou stranách nebo mezi exony Ia a Ib, zatímco v genu BCR dochází ke zlomům na 3 místech nazývaných M-bcr (major), m-bcr (minor) a mikro-bcr (micro). Nejčastějším místem zlomů však jsou 2 introny v oblasti M-bcr, které se také vyskytují u 99 % BCR-ABL pozitivních CML. Výsledkem jsou pak fúzní geny označované jako b2a2 (dle novější nomenklatury e13-a2) nebo b3a2 (resp. e14-a2). Z hlediska klinického jsou obě tyto varianty rovnocenné a oba kódují stejný protein o hmotnosti 210 kD – p210BCR/ABL. Přítomnost t(9;22) je prokázána v 95 % případů, v ostatních sice chybí chromozomální translokace, ale je možné prokázat existenci fúzního genu BCR-ABL [6]. Bcr-Abl onkoprotein lokalizovaný v cytoplazmě Ph pozitivních somatických buněk (na rozdíl od c-Abl kinázy, která je v jádře vázaná na DNA a její aktivita je za normálních podmínek přísně regulovaná) svojí zvýšenou tyrozinkinázovou aktivitou ovlivňuje řadu intracelulárních signálních drah. Onkogenní účinek BCR-ABL1 tedy není výsledkem jedné abnormálně regulované signální dráhy, ale celé signální sítě, což v konečné fázi způsobuje nádorovou transformaci buňky. Bcr-Abl je účinný onkoprotein, který je schopen ovlivnit řadu signálních drah včetně STAT5, Ras, PI3K/Akt a NF-kB. Signální dráhy ovlivněné konstitutivní aktivací Bcr-Abl kinázy pak způsobují indukci neoplastické transformace a buněčné proliferace, inhibici adheze myeloidních progenitorů v kostní dřeni a inhibici apoptózy leukemických buněk [7]. Progrese CML a přechod do blastické fáze zatím nebyly zcela objasněny. Za nejdůležitější faktory, které byly popsány ve spojitosti s progresí, jsou považovány blok diferenciace, aktivace tumor-supresorových genů a zvýšená exprese Bcr-Abl kinázy a s ní související genomová nestabilita a vývoj dalších cytogenetických aberací v Ph+ buňkách. Bcr-Abl může být aktivována také různými geny s prokázanou proliferační a antiapoptotickou aktivitou a také inhibovat protein p53 – hlavní regulátor buněčného cyklu – nebo tumor-supresorový gen PP2A [8]. V současné době je pozornost výzkumníků věnována také nádorové leukemické kmenové buňce (LSC) v souvislosti s hledáním mechanizmu, který zřejmě umožňuje LSC nepodlehnout účinku tyrozinkinázových inhibitorů.
Klinický obraz
Klinický obraz onemocnění je rozmanitý a liší se podle stadia, ve kterém se choroba v daném okamžiku nachází. CML je nejčastěji diagnostikována v chronické fázi (CP), kdy nemocný udává jen mírné, neurčité obtíže způsobené anémií, event. splenomegalií. Kolem 30 % onemocnění je diagnostikováno náhodně, např. v rámci preventivní prohlídky nebo předoperačního vyšetření krevního obrazu. Prvním steskem bývá často zvýšená únava, bolesti kloubů, kostí a svalů, ztráta výkonnosti, nechutenství, hubnutí, subfebrilie, známky dnavé artritidy a pocit tlaku pod levým obloukem žeberním, jehož příčinou je různě velká splenomegalie, někdy velkých rozměrů, zasahující až do malé pánve, s leukemickou infiltrací. Bolesti v této oblasti jsou způsobeny jak mechanickým zvětšováním a napínáním pouzdra, tak probíhajícími infarkty [9].
Asi u 15 % nemocných pozorujeme příznaky vyvolané leukostázou a poruchou cirkulace v plicích nebo centrálním nervovém systému. U nemocných se vstupními počty leukocytů nad 300 × 109/l pak bývají vyjádřeny příznaky typu dušnost, tachykardie, hučení v uších, závratě, hemoragie na očním pozadí, poruchy vědomí.
V průběhu onemocnění se postupně mění vlastnosti nádorové kmenové buňky, stává se agresivnější, zvyšuje rychlost proliferace, ztrácí citlivost na léčbu a pacient se dostává do akcelerované fáze (AP). Doba jejího trvání se pohybuje od několika měsíců do 1,5 roku. Stupňují se obtíže plynoucí ze zvětšující se sleziny způsobující dyspeptické potíže a bolesti v levé polovině břicha, může dojít k infarktu nebo ruptuře sleziny. Objevují se teploty neinfekčního původu. Třetí fází nemoci je blastický zvrat (BP) s klinickými příznaky již rozvinuté akutní leukemie. Rozlišujeme blastický zvrat myeloidního typu (u 2/3 nemocných) a lymfoidního typu. Pacient má často teplotu, infekční komplikace, bolesti v kostech, je významně unavený v souvislosti s anémií, krvácí při současné trombocytopenii, zvýrazněna je také splenomegalie. U menší části nemocných dochází k rozvoji blastického zvratu ve formě extramedulární infiltrace, která může postihnout jakýkoli orgán, nejčastěji kosti a kůži, jedná se o tzv. myelosarkom nebo chlorom.
Diagnostika
Podezření na CML lze vyslovit při nálezu splenomegalie a typických změn v periferní krvi a aspirátu kostní dřeně, k definitivnímu potvrzení diagnózy je nutný průkaz Ph chromozomu nebo fúzního genu BCR-ABL. Onemocnění diagnostikujeme ve stadiu chronické fáze, akcelerované fáze a blastického zvratu (www.nccn.org).
Subjektivní potíže nemocných s CML v době diagnózy jsou většinou nespecifické a pramení ze splenomegalie, chudokrevnosti, hemoragické diatézy a z metabolických důsledků onemocnění. Při objektivním vyšetření dominuje splenomegalie, event. hepatosplenomegalie.
Základním laboratorním vyšetřením je kompletní krevní obraz s diferenciálním rozpočtem bílých krvinek, tedy leukocytóza, trombocytóza (u 30–40 %), bazofilie a v diferenciálním rozpočtu převaha neutrofilních granulocytů s výskytem všech stadií nezralých forem včetně promyelocytů, event. blastů. Dalším zcela nezbytným vyšetřením pro stanovení diagnózy CML je vyšetření kostní dřeně. U aspirátu kostní dřeně (sternální punkce) je provedeno vyšetření cytologické: hypercelularita s hyperplazií granulopoézy, event. megakaryopoézy, na úkor linie erytroidní, zmnožení mladších forem granulopoézy, bazofilů a eozinofilů při definovaném počtu blastů, event. promyelocytů, dle fáze (stadia) nemoci (CP, AP nebo BP); cytogenetické: přítomnost Ph chromozomu (u 90–95 % nemocných) – metodou konvenčního cytogenetického vyšetření, event. doplněné metodou FISH (fluorescenční in situ hybridizace), event. další chromozomální aberace s významem pro další prognózu onemocnění. Imunofenotypizace má význam v případě přítomnosti blastického zvratu k rozlišení blastické populace myeloidního nebo lymfoidního typu. Histologické vyšetření kostní dřeně (trepanobiopsie) má význam hlavně při obtížné aspiraci kostní dřeně a při podezření na blastickou transformaci.
Z dalších laboratorních vyšetření sledujeme hladinu kyseliny močové, laktátdehydrogenázy (LD), jaterní enzymy, ureu, kreatinin, β2-mikroglobulin, minerály, koagulační parametry. Ultrazvukové vyšetření břicha verifikuje velikost sleziny a jater, event. prodělané infarkty (pouzdra), event. přítomnou lymfadenopatii při blastickém zvratu lymfoidního typu [10]. Pro potvrzení diagnózy je zcela nezbytné provedení molekulární analýzy (z periferní krve) – průkaz transkriptu BCR-ABL metodou multiplexní RT-PCR (reverzní transkriptázové PCR) a také kvantitativní vyšetření hladiny transkriptu, které má význam pro následnou monitoraci tzv. reziduální nemoci metodou Q-RT-PCR (kvantitativní RT-PCR), umožňující sledování dynamiky a kvality odpovědi na vedenou léčbu, která v současné době zahrnuje hlavně tyrozinkinázovými inhibitory.
Prognózu nemocných s CML pomáhají odhadnout indexy relativního rizika (RR), hodnocené podle prognostického skórovacího systému dle Sokala a Hasforda, nejnověji také Euro skóre, a rozlišující 3 rizikové skupiny pacientů: s nízkým, středním a vysokým rizikem. Výpočet je k dispozici na webové stránce www.leukemia-net.org/content/e58/e459/e11733/ [11,12].
Odhad rizika zvažované alogenní transplantace krvetvorných buněk (alog TKB) nám umožní Gratwohlovo (EBMT) skóre [13].
Léčba CML
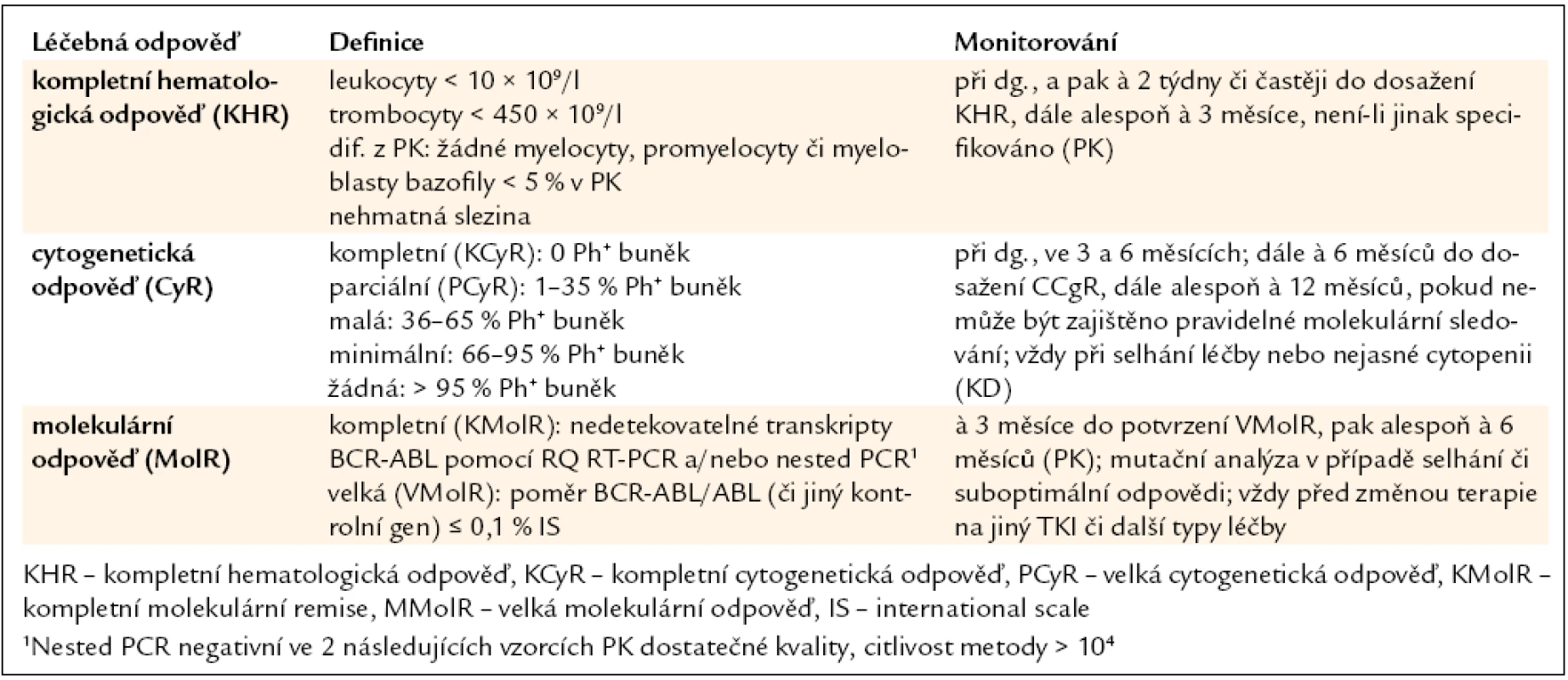
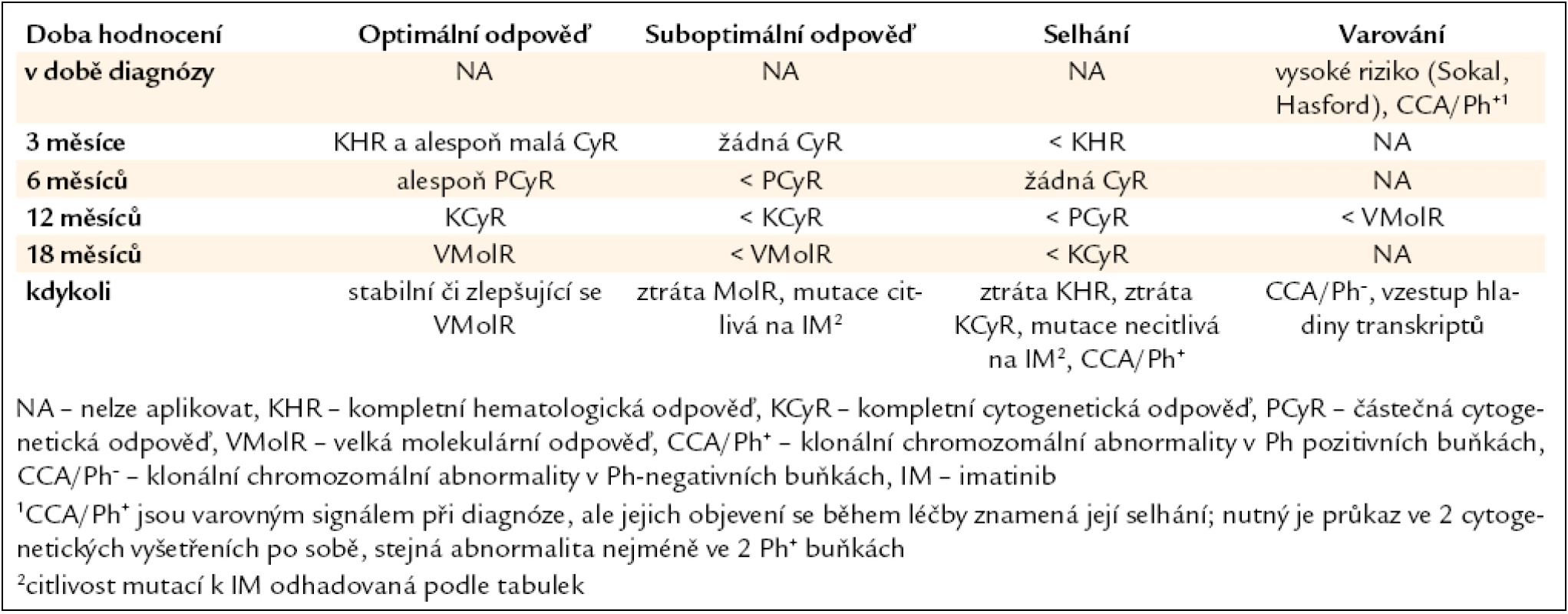
Úspěšnost léčby je do značné míry dána také správným hodnocením jejího efektu. Jsou definovány typy léčebných odpovědí: hematologická, cytogenetická a molekulární, monitorované ve stanovených časových bodech, a následně pak kvalita odpovědi, hodnocená podle aktualizovaných European Leukemia Net (ELN) 2009 doporučení jako optimální, suboptimální a selhání léčby (tab. 1, 2) [14]. Správné zhodnocení kvality dosažené odpovědi v daných časových úsecích (bodech) má význam při rozhodování o dalším léčebném postupu [15].
Mutace v kinázové doméně BCR-ABL genu jsou považovány za jednu z nejčastějších příčin rezistence na léčbu imatinibem [16]. V časné chronické fázi se vyskytují zřídka, u zjištěné rezistence na imatinib se vyskytují v 50–90 % případů. Vyšetření se proto doporučuje provést vždy při selhání léčby imatinibem, při progresi choroby a individuálně při suboptimální odpovědi na léčbu nebo při převedení na jiný TKI [17]. Detekce přítomnosti mutace T315I, která je, jak známo, rezistentní vůči v současné běžné praxi podávaným TKI (imatinibu, dasatinibu a nilotinibu), je indikací k jejich vysazení, event. časnému provedení alogenní TKB.
Hodnocení nežádoucích účinků léčby neboli toxicita je prováděno dle kritérií National Cancer Institute Common Toxicity Criteria (CTCAE v3.0; http://ctep.cancer.gov). Nežádoucí účinky hodnocené stupněm 1 nebo 2 jsou většinou řešitelné symptomatickou léčbou, závažnější účinky hodnocené stupněm 3 nebo 4 vyžadují redukci dávky, dočasné přerušení, event. definitivní ukončení léčby konkrétním TKI.
Pozornost je třeba věnovat také možnosti lékových interakcí, které mohou efekt léčby významně ovlivnit (http://medicine.jupui.edu/flockhart/table.htm).
Léčba: historie
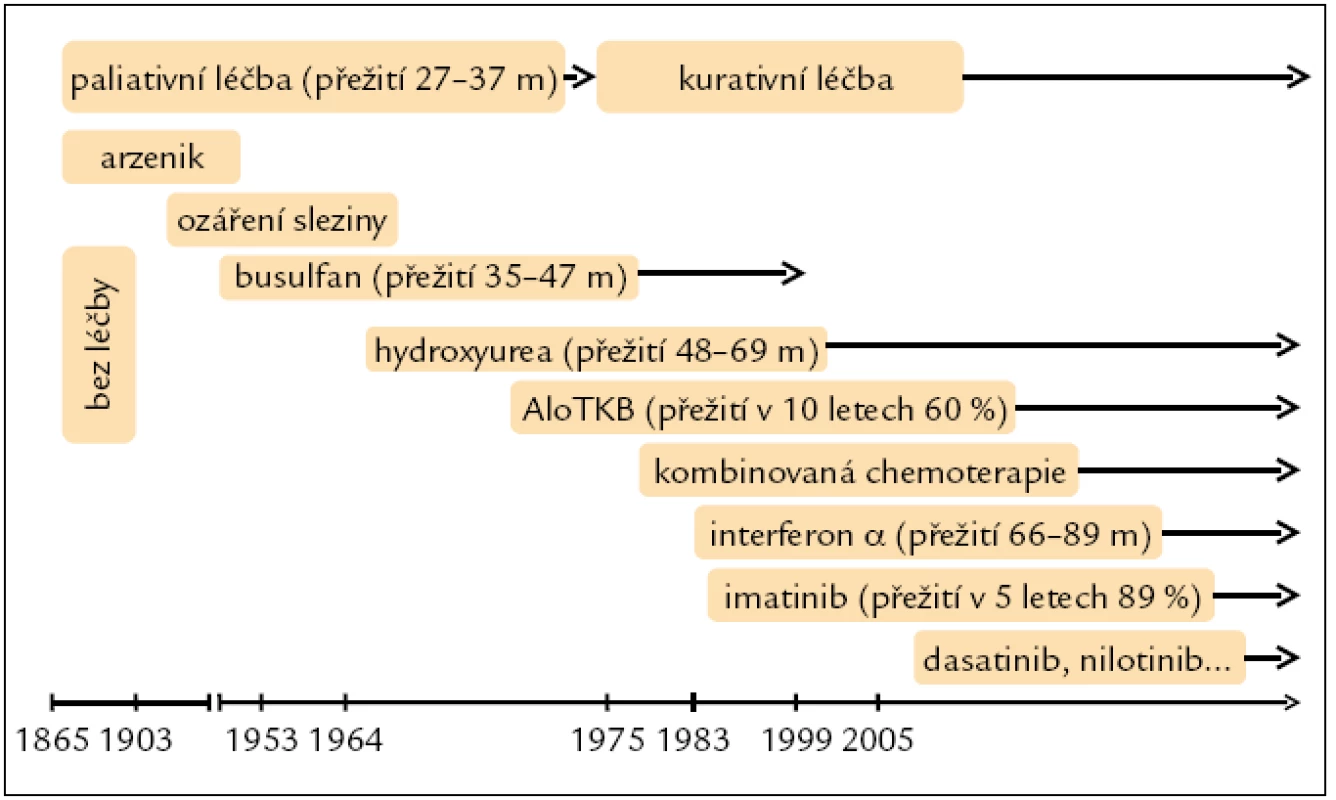
První informace o léčbě CML pochází z roku 1885, kdy byl poprvé v této indikaci podán arzenik. Pak následovalo ozáření sleziny a cytoredukční látky busulfan a hydroxyurea, které však byly pouze paliativní léčbou, jež sice na určitou dobu dokázala potlačit příznaky nemoci a navodit hematologickou odpověď, ale její trvání bylo limitované (obr. 1). V 90. letech minulého století vstoupil do klinické praxe interferon α (IFNα). Byl objeven v roce 1957 jako látka vznikající v lidských buňkách při virové infekci. Z celé řady těchto glykoproteinů lze u CML k léčbě použít IFNα 2a získaný rekombinantní technologií od roku 1980. IFNα je biologický mediátor, glykoprotein s inhibičním účinkem na leukemickou buňku a schopností diferenciačního efektu, obnovení apoptózy, adhezivity kmenové buňky ke stromatu a imunomodulace. První práce na toto téma byla publikována v roce 1983 Talpazem et al. Vzbudila velký zájem a svými výsledky přispěla k uznání IFN jakožto nového standardu netransplantační léčby CML.
Nejdůležitější retrospektivní studie zaměřené na léčbu CML interferonem pocházejí z Institutu M. D. Andersona z Houstonu. U 274 léčených pacientů bylo dosaženo 80 % KHR, 38 % signifikantních cytogenetických odpovědí a 26 % kompletních cytogenetických remisí. Medián přežití nemocných byl 89 měsíců [18].
The Italian Cooperative Study Group 1994 publikovala srovnání celkem 322 pacientů, a to 218 léčených IFN a 104 léčených hydroxyureou, s mediánem přežití 76 měsíců na IFN oproti 46 měsícům na hydroxyurei. Také metaanalýza 1 554 nemocných s CML Trialists’ Collaborative Group 1997 jednoznačně potvrdila IFN za nejlepší tzv. konzervativní léčbu v době do objevení TKI, s mediánem přežití nemocných 5–7 let a dosahovanou významnou cytogenetickou odpovědí u 68 % a kompletní odpovědí u 32 % léčených. Rekombinantní forma IFN byla aplikována subkutánně v dávce 3–5 mil. jednotek (UI/m2) denně za pravidelných kontrol krevního obrazu, biochemických parametrů a kvality cytogenetické odpovědi. Ještě vyšší účinnosti bylo dosahováno při podávání v kombinaci s cytosinarabinosidem [19].
Projevy nežádoucích účinků léčby však vedly k častému redukování dávky, přerušování léčby a z toho plynoucí ztrátě účinnosti. Se vstupem tyrozinkinázových inhibitorů do klinické praxe se používání IFNα v léčbě CML výrazně snížilo. V současné době je podáván nemocným s významnou rezistencí k TKI, které nelze transplantovat, nebo je léčba TKI kontraindikovaná, např. v průběhu těhotenství. Recentně popsané imunologické změny indukované IFN u nemocných v dlouhodobé molekulární odpovědi jej činí významným pro identifikaci optimálně reagujících pacientů. V současné době začíná opět stoupat jeho význam, a to ve smyslu podávání pegylovaného IFN v kombinaci s imatinibem, s dosažením 68 % velkých molekulárních odpovědí u nemocných s kompletní cytogenetickou remisí. Limitací je však výrazná hematologická toxicita a z toho důvodu ukončení podávání IFN u 59 % nemocných [20].
Alogenní transplantace krvetvorných buněk byla první kurativní léčbou CML, datovanou rokem 1975, a byla také až do zavedení TKI do klinické praxe doporučována a prováděna všem mladším nemocným s nalezeným vhodným dárcem. Tyrozinkinázové inhibitory odsunuly tuto léčbu až do 2., event. 3. linie u pacientů v chronické fázi, kde selhala předchozí léčba TKI, a transplantace má u těchto pacientů roli víceméně záchranné léčby [21].
Alogenní TKB je však vždy indikována u nemocných po prodělané úspěšné chemoterapii pokročilé fáze choroby, pokud bylo dosaženo druhé chronické fáze onemocnění.
Léčba CML po roce 2000
Pokroky v molekulární biologii a biochemii umožnily syntetizovat látky s určitými proteinovými katalytickými schopnostmi, a odtud byl již v roce 1996 jen krůček k syntetizování látky označované jako CGP7148B, následně jako STI571 (signal transduction inhibitor), nyní známé jako imatinib (lék Glivec). Poprvé bylo o jeho využití pro léčbu CML referováno Druckerem v roce 1999 na sjezdu Americké hematologické společnosti. Byly studovány také další látky podobného mechanizmu účinku, a to dasatinib a nilotinib. Tyrozinová kináza Bcr-Abl se tak stala hlavním terapeutickým cílem v moderní éře léčby CML [22].
Imatinib
Imatinib (imatinib mesylát) je derivátem fenylaminopyrimidinu. Účinkuje jako selektivní kompetitivní inhibitor tyrozinových kináz Abl, Bcr-Abl, c-Kit, PDGFRα, PDGFRβ a Arg. Mechanizmus jeho účinku je nejlépe prozkoumán v BCR-ABL1 pozitivních buňkách.
Imatinib interaguje s bílkovinou Bcr-Abl tak, že zabraňuje ve vazbě ATP a stabilizuje enzym v inaktivní konformaci. Nedochází proto k přenosu aktivního fosfátu na tyrozin bílkovin, které patří k substrátům leukemické tyrozinové kinázy. Inhibicí fosforylace tyrozinových zbytků proteinů se zastaví aktivace signálních drah, které se podílejí na vzniku leukemického fenotypu buňky. Dochází tak k inhibici proliferace patologického klonu, tedy leukemických buněk, a současně také k jejich apoptóze. Imatinib sice nezabraňuje vzniku leukemického genu BCR-ABL1, brání však v realizaci jeho účinku na úrovni proteinové. Proto se zatím v současné době i při dosažení dlouhodobé stabilní molekulární negativity BCR-ABL1 doporučuje lék v běžné klinické praxi trvale užívat.
Imatinib byl syntetizován v roce 1992, v roce 1996 byla potvrzena jeho účinnost u myšího modelu. Klinické zkoušky byly zahájeny v roce 1998 a již v roce 2001 byl schválen americkým Úřadem pro kontrolu potravin a léků – Food and Drug Administration (FDA) pro léčbu nemocných s chronickou myeloidní leukemií. Stal se prvním molekulárně cíleným lékem užitým v léčbě nádorového onemocnění, který úspěšně prošel všemi fázemi klinického zkoušení, kde prokázal výbornou účinnost a dobrou snášenlivost, a v roce 2001 se tak stal vůbec nejrychleji schváleným protinádorovým lékem pro užití v klinické praxi.
Nejdůležitější studií, která definitivně potvrdila místo imatinibu v léčbě nově diagnostikovaných nemocných s CML, byla prospektivní randomizovaná klinická studie IRIS – International Randomized Study of Interferon versus STI-571. Celkem 1 106 pacientů bylo randomizováno do ramene imatinib 400 mg denně nebo interferon a Ara-C, v obou ramenech bylo shodně hodnoceno 553 nemocných. Již krátkodobé dosažené výsledky potvrdily předpokládanou účinnost. Po 18 měsících byla pravděpodobnost dosažení velké cytogenetické odpovědi při terapii imatinibem 87 % oproti 35 % na léčbě IFN, pravděpodobnost přežití bez progrese 97 % oproti 92 %. Rychlý byl také nástup odpovědi hematologické a molekulární. Po více než 7 letech sledování studie jednoznačně prokázala vysokou účinnost léku co do počtu dosažených hematologických a cytogenetických odpovědí (97 % a 88 %) a výrazně se zvýšila také pravděpodobnost dlouhodobého přežívání nemocných a kvalita jejich života [23].
Osm let od zahájení studie dosahují pacienti léčení IM celkového přežití (OS) v 85 %, bez progrese do AP/BP 92 %, přežití bez události (EFS) 81 %; kompletní cytogenetickou odpověď (KCyR) udrželo a v léčbě IM pokračovalo 55 % nemocných. 45 % nemocných léčení přerušilo z různých důvodů. Také profil bezpečnosti léčby zůstává nezměněn [24].
Podobných výsledků je dosahováno také v běžné klinické praxi. Analýza více než 3 000 pacientů s CML zahrnutých ve švédské databázi v letech 1973–2008 potvrdila výrazné zlepšení přežití nemocných všech věkových kategorií po roce 2001. Také několik publikací českých autorů zdokumentovalo, že podobně optimistických výsledků, jako např. v klinické studii IRIS, bylo dosaženo i v běžné klinické praxi [25–27].
Aktuálně je diskutováno téma bezpečné možnosti vysazení imatinibu u pacientů s dlouhodobou (více než 2 roky trvající) hlubokou molekulární odpovědí (kompletní molekulární remisí). Výsledky krátkodobého sledování ukazují, že dosaženou odpověď udrží kolem 40 % pacientů v mediánu 12 měsíců po vysazení léčby [28].
Nicméně i přes vysokou účinnost imatinibu a jeho místo v první linii existuje skupina nemocných, kteří jsou vůči němu rezistentní nebo jej netolerují, a tato léčba je proto u nich neúčinná. Mezi velmi časté důvody rezistence na IM patří mutace v kinázové doméně BCR-ABL a také aktivace na BCR-ABL nezávislých signálních drahách, např. příslušníky rodiny Src kináz. I tyto situace jsme již v současné době schopni řešit, a to změnou léčby za tyrozinkinázové inhibitory druhé generace, kterými jsou dasatinib a nilotinib.
Dasatinib
Dasatinib, látka původně označovaná jako BMS-354825, je poněkud jiné struktury než imatinib (obr. 2). Je selektivním kompetitivním duálním (Src a Abl) inhibitorem tyrozinových kináz Abl, Bcr-Abl, c-Kit, EPHA2, PDGFRβ a současně inhibitorem kináz rodiny Src (SFK) (k nimž patří také Lck, Fyn, Hck, Lyn a Yes). In vitro jde zatím o nejúčinnější blokátor tyrozinové kinázy Bcr-Abl, 325krát účinnější než IM a 16krát účinnější než nilotinib, vysoce účinný také u nemocných s přítomnou mutací v kinázové doméně BCR-ABL (s výjimkou T315I). Prvnímu pacientovi byl podán v roce 2003, registrační řízení v USA a Evropě proběhlo koncem roku 2006, od listopadu roku 2006 je registrován také v ČR. Zcela zásadní byly výsledky 5 multicentrických klinických studií nazvaných START (Src/Abl tyrosine kinase inhibitor activity: research trials of dasatinib), které zahrnovaly a následně hodnotily nemocné léčené v akcelerované fázi (START-A), blastickém zvratu (START-B), Ph+ ALL (START-L), chronické fázi (START-C) a v chronické fázi srovnávající dávku 400 mg/d s vyšší dávkou IM (START-R). Vždy se jednalo o léčbu nemocných, u kterých selhala nebo nebyla tolerována léčba IM, tedy podávání dasatinibu ve druhé linii léčby [29].
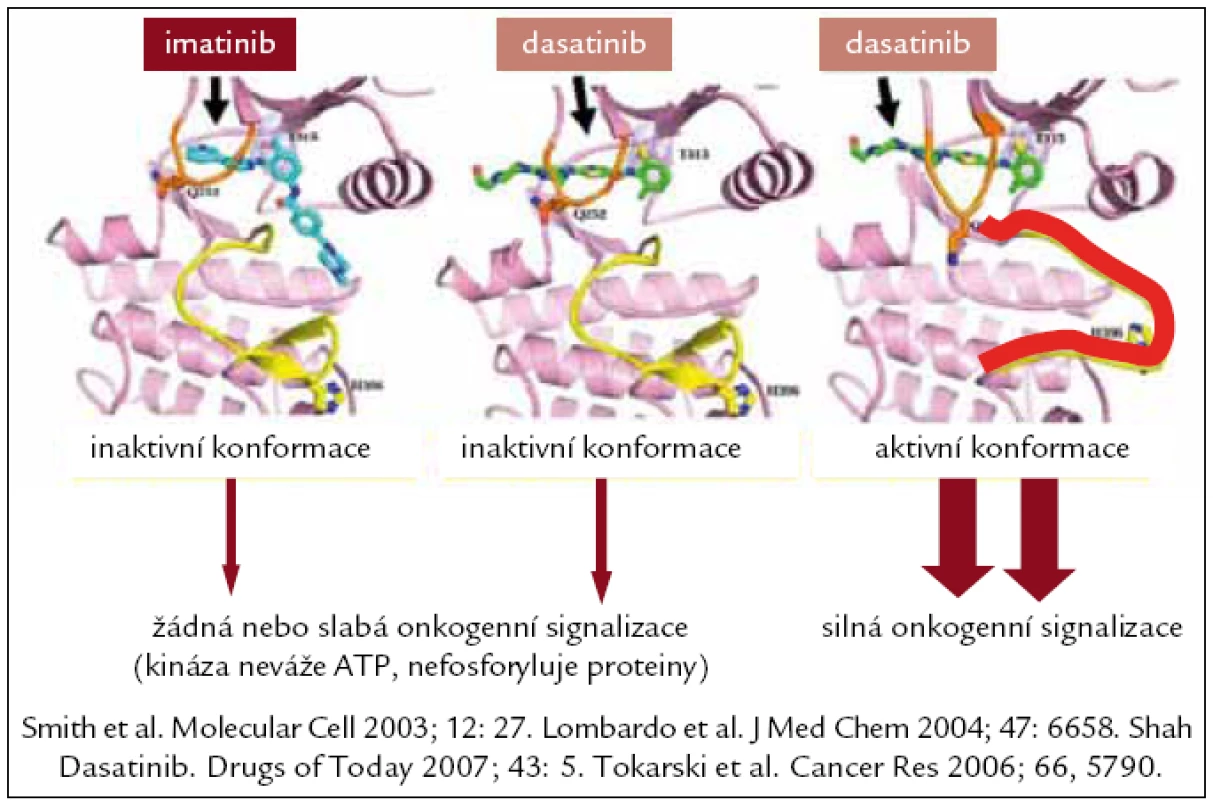
Nejvýznamnější z nich START-C stanovila optimální denní terapeutickou dávku 100 mg jednou denně (u AP/BP 70 mg 2krát denně). První výsledky v mediánu 15 měsíců léčby ukázaly celkové přežití 96 %, MCyR 59 %, KCyR 49 %. Studie ukázala, že 42 % pacientů, kteří na předchozí léčbě IM neměli cytogeneticku odpověď, na léčbě dasatinibem velké cytogenetické remise dosáhli. Analýzy v rámci START studií potvrdily u pacientů rezistentních na IM v CP přežití bez progrese u 80 %, celkové přežití pak u 92 %. Z nežádoucích účinků byla významná hematologická toxicita 3. nebo 4. stupně u téměř 50 % pacientů, pleurální výpot-ky zastiženy u 2 % nemocných [30].
V ÚHKT Praha jsme první zkušenosti s léčbou dasatinibem začali získávat již v roce 2005 v rámci klinické studie fáze III. U nemocných v CP léčených dasatinibem v dávce 100 mg denně jsme si ověřili nejen jeho rychlou účinnost, ale také trvání odpovědi s tolerovatelnými nežádoucími účinky většinou 1. nebo 2. stupně, nejzávažnějšími v podobě trombocytopenií a pleurální efuze.
Nilotinib
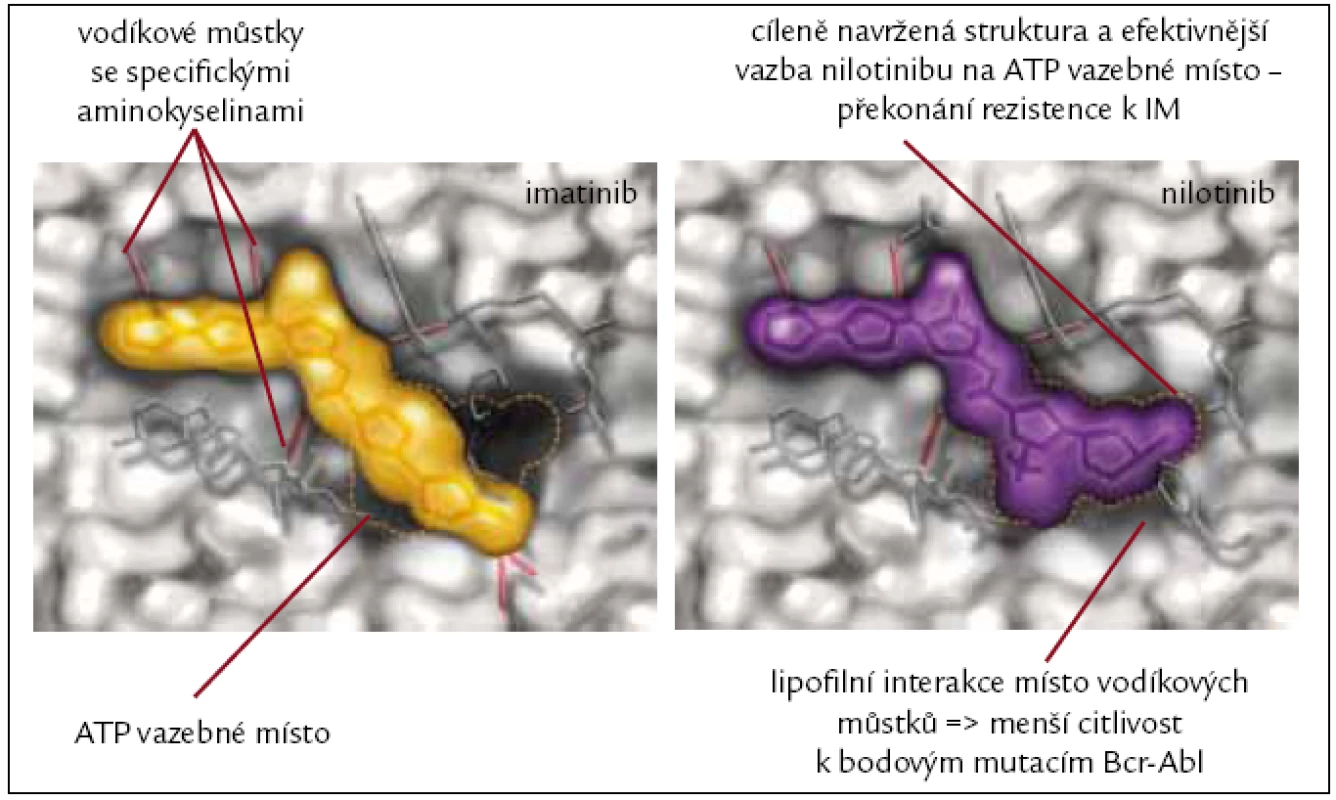
Nilotinib (dříve také označovaný jako AMN107) je derivát fenylamino-pyrimidinu, látka, která stejně jako imatinib selektivně kompetitivně inhibuje tyrozinové kinázy Bcr-Abl, Kit, PDGFR, CSF-1R a ephrin-A4 receptorových kináz. K Abl kinázové doméně se váže s 30krát větší afinitou než imatinib. Zásadním klinickým přínosem nilotinibu je jeho schopnost in vitro inhibovat 32 z 33 klinicky relevantních mutací, které způsobují rezistenci na imatinib (obr. 3). Lék není účinný u mutace T315I a jeho účinnost je také nižší dle in vitro výsledků i dle klinických studií u mutací Y253H, F359V a E255K [31].
Kantarjian a Giles vyhodnotili v roce 2007 data 279 nemocných v CP CML rezistentních na imatinib nebo jej netolerujících. Medián trvání léčby byl 247 dnů, medián dávkové intenzity 797 mg/den. Kompletní hematologické remise bylo dosaženo u 74 % nemocných, velké cytogenetické odpovědi u 52 % a kompletní u 34 %. U 78 % nemocných nedošlo do 1 roku k progresi nemoci, po 18 měsících sledování přežívalo bez progrese 64 % [32].
Zajímavé a velmi optimistické jsou aktualizované výsledky studie fáze II pacientů v chronické fázi CML rezistentních na imatinib nebo jej netolerujících (studie CAMN107A2101), kterým byl podáván nilotinib v dávce 400 mg 2krát denně. Výsledky aktualizované po 48 měsících léčby udávají odhadované celkové přežití 78 % bez zaznamenaného signifikantního rozdílu v celkovém přežití mezi skupinami pacientů s mutacemi citlivými a necitlivými na nilotinib zjištěnými při zařazení do studie. Z nežádoucích účinků lze jmenovat elevace jaterních, pankreatických enzymů, z hematologických relativně malý výskyt těžké myelosuprese. Projevy nežádoucích účinků nebyly v porovnání s obdobím prvních 24 měsíců léčby významně vyšší, s délkou sledování tedy nedochází k jejich navyšování. Vyšší podíl přežití pacientů bez progrese, kteří byli při vstupu do studie v kompletní hematologické remisi, svědčí pro možnost vyšší účinnosti při včasném provedení změny léčby z imatinibu na nilotinib ještě před ztrátou hematologické odpovědi [33].
Pro každodenní klinickou praxi měla význam také multicentrická studie rozšířené dostupnosti pro nemocné v chronické a akcelerované fázi CML, kteří byli rezistentní na imatinib nebo jej nesnášeli, s názvem ENACT (Expanding Nilotinib Access in Clinical Trials), do které bylo zařazeno více než 1 600 nemocných, včetně pacientů z ČR. Po úspěšném klinickém zkoušení byl nilotinib v roce 2007 schválen pro podávání pacientům s CML, kteří jsou v chronické a akcelerované fázi rezistentní na imatinib nebo jej netolerují a od roku 2008 je možnost jej podávat v této indikaci také nemocným v ČR.
Randomizovaná studie přímo srovnávající účinnost a toxicitu nilotinibu a dasatinibu dosud provedena nebyla. Při volbě TKI vycházíme mimo jiné také z přítomnosti a znalosti typu mutace v kinázové doméně BCR-ABL1, existujících komorbidit pacienta, známých projevů toxicity léčby, event. jeho již zavedených medikací. Nikdy však nelze s jistotou, tedy jednoznačně, predikovat, který ze zvolených TKI 2. generace bude u daného pacienta účinnější. Zjednodušené srovnání léčby při možnosti podávat tyrozinkinázové inhibitory s dobou před rokem 2000 ukazuje tab. 3.
Řada klinických studií fáze III potvrzuje ještě větší účinnost TKI 2. generace při jejich podávání u nově diagnostikovaných nemocných ve smyslu kvality a rychlosti dosažené odpovědi, tolerance léčby, parametrů přežití. Tedy daleko již není doba, kdy v naší každodenní klinické praxi nastane reálná možnost volby mezi 3 tyrozinkinázovými inhibitory, a to imatinibem, dasatinibem a nilotinibem již v první linii léčby. Indikace volby konkrétního tyrozinkinázového inhibitoru je však zatím ještě široce diskutována.
Nové léky
Bosutinib je duální SRC-ABL TKI 2. generace. Dle výsledků klinické studie fáze I/II u 288 pacientů léčených bosutinibem z důvodu rezistence nebo nesnášenlivosti IM bylo za dobu sledování v mediánu 23 měsíců docíleno u 41 % nemocných kompletních cytogenetických remisí, z čehož je 64 % velkých molekulárních odpovědí. OS bylo ve 2 letech 92 %, PFS 79 % [34]. Nežádoucí účinky vyššího stupně byly zaznamenány u méně než 10 % léčených pacientů.
Ponatinib (AP24534) je multipotentní TKI účinný in vitro u všech mutací rezistentních vůči imatinibu, včetně mutace T315I (navíc inhibuje také cíle včetně c-KIT a FLT3). Klinická studie zahrnovala celkem 74 nemocných s CML (z nich 44 v CP), většina předléčena minimálně 2 TKI a vstupně přítomna mutace BCR-ABL1, u 1/3 mutace T315I. U 50 % dosaženo kompletních cytogenetických remisí, u pacientů s mutací T315I u 8 z 9 nemocných. Pravděpodobnost dosažení velké molekulární odpovědi byla 42 %. 23 % nemocných ukončilo studii pro významnou toxicitu. V několika evropských zemích byla zahájena II. fáze klinického zkoušení [35].
Experimentální léčba v klinických studiích fáze I a preklinického zkoušení se zaměřuje na 2 místa možného zásahu:
- a) úroveň genomu a mRNA (BCR-ABL1 gen), představitelem jsou antisense oligonukletidy (ASO) a RNA interference;
- b) úroveň proteinů‚ Bcr-Abl protein a proteiny následných signálních drah, např. Ras signální dráha (inhibitory farnesyltransferázy, MAP kinázové inhibitory), PI3K signální dráha (inhibitory mTOR, PI3K a další).
Pokud bude v klinických studiích potvrzena účinnost vakcinace, bude např. možno pomocí peptidové vakcíny ještě více snížit a event. odstranit reziduální nemoc dosaženou předchozí léčbou, jež byla vedena např. imatinibem a interferonem [36,37].
Současný doporučený postup léčby
Následující doporučení vychází z materiálů National Comprehensive Cancer Network, Clinical Practice Guidelines in Oncology (NCCN; www.nccn.org), European Leukemia Net (ELN) a ESMO (Evropská společnost klinické onkologie) a České hematologické společnosti (ČHS) a shrnuje současné nejnovější poznatky o diagnostice, léčbě a monitorování onemocnění [14,38–40].
- Cytoredukce: znamená podávání hydroxyurey; při symptomatické leukocytóze, event. trombocytóze leukocytaferéza, event. trombocytaferéza, anagrelid (riziko trombotických komplikací). Podpůrná léčba: alopurinol (prevence hyperurikemie), dostatečná hydratace, monitorování vnitřního prostředí.
- Léčba první linie: imatinib 400 mg 1krát denně.
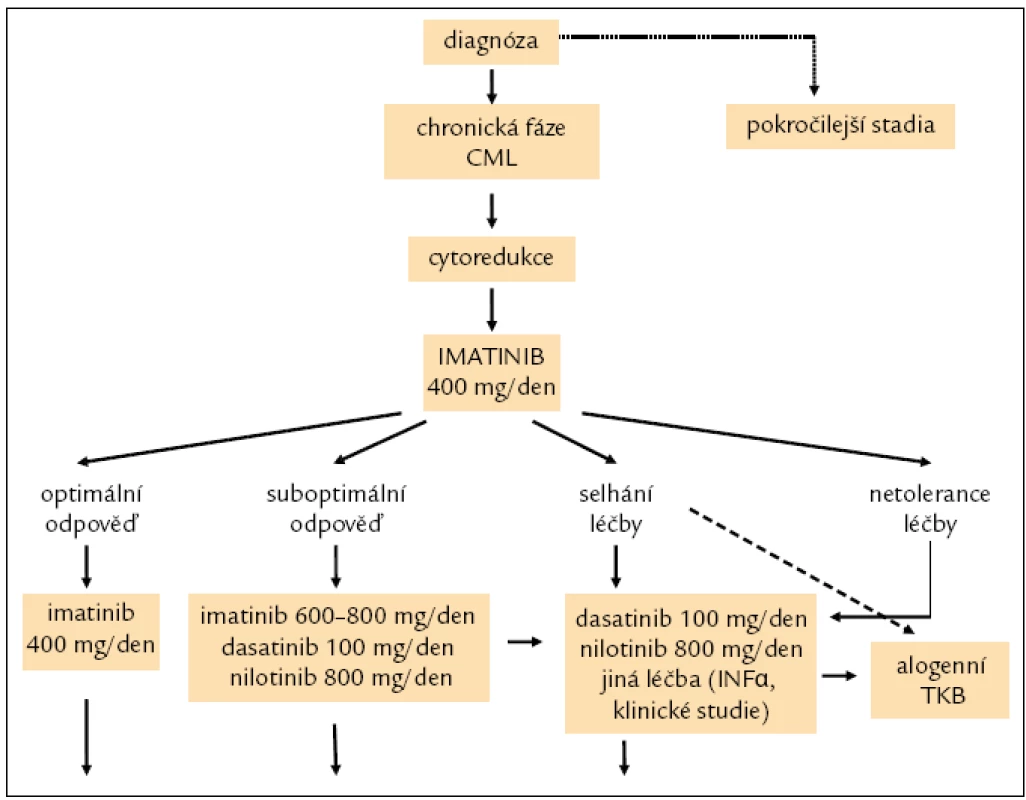
Monitorování odpovědi na léčbu bylo již zmíněno. Na základě hodnoceného typu kvality odpovědi v definovaných časových bodech dle ELN kritérií při dosažení optimální odpovědi a dobré toleranci pokračování v terapii imatinibem, při odpovědi suboptimální nebo selhání léčby nebo její netoleranci změna léčby za tyrozinkinázový inhibitor 2. generace dasatinib 100 mg 1krát denně, nebo nilotinib 400 mg 2krát denně. Alogenní TKB v jednoznačně indikovaných situacích, jednou z nich je např. detekce mutace T315I [14].
Dle ELN a NCCN zatím nejsou doporučení pro léčbu akcelerované fáze a blastického zvratu zcela jednoznačná a nemají zcela obecnou platnost. Záleží na tom, zda AP nebo BP léčíme při stanovení diagnózy nebo při progresi na léčbě imatinibem. V úvahu pak přichází TKI 2. generace dasatinib podávaný v dávce 140 mg/den (u AP a BP) a nilotinib v dávce 800 mg/den (pouze AP) a event. současně kombinovaná chemoterapie následovaná alogenní TKB.
Doporučení pro léčbu pacientů v chronické fázi CML je uvedeno na obr. 8.
CML na našem pracovišti
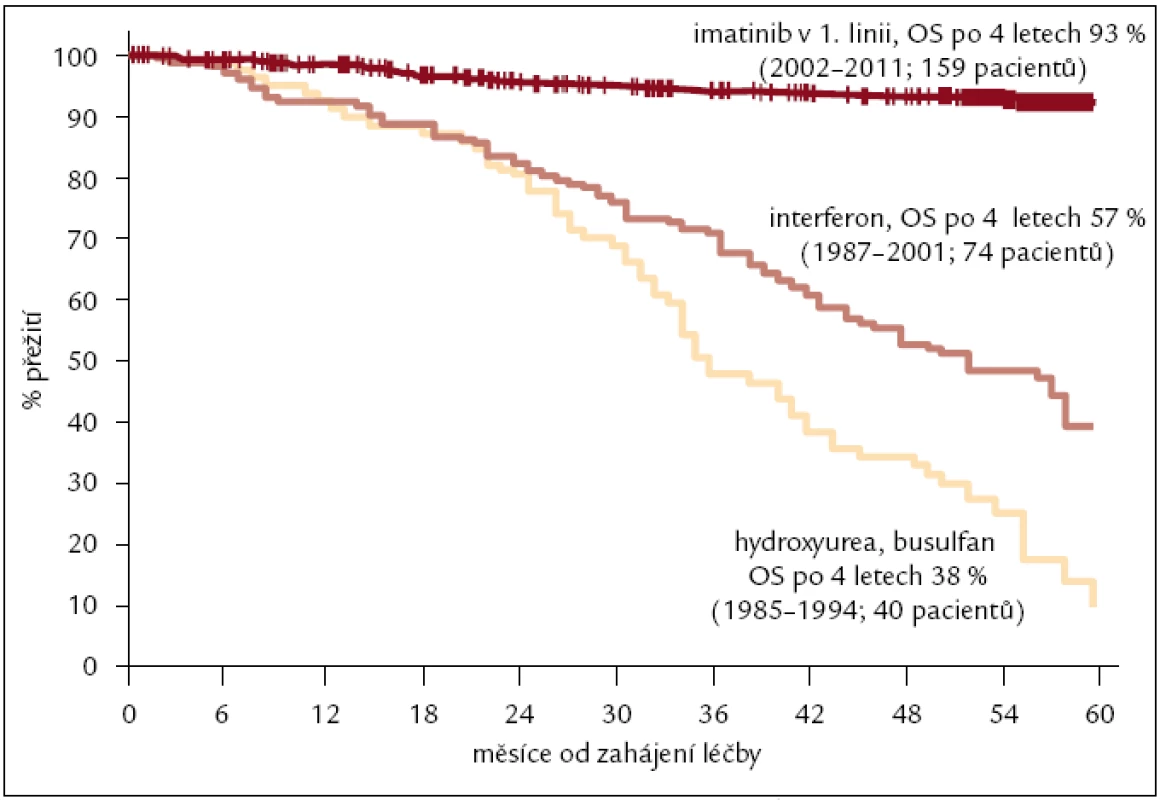
Léčba chronické myeloidní leukemie busulfanem a hydroxyureou na našem pracovišti v 70. letech minulého století vedla pouze k několikaměsíční hematologické odpovědi. IFN α v 80. a 90. letech minulého století již vedl u více než 30 % nemocných k navození cytogenetické odpovědi a významnějšímu prodloužení jejich přežití na téměř 60 % po 4 letech léčby [41]. 90. léta minulého století a začátek 21. století byla, až do vstupu tyrozinkinázových inhibitorů do klinické praxe, také obdobím, kdy alternativní léčbou první linie, tedy interferonu, byla alogenní transplantace krvetvorných buněk. První transplantace pacienta s CML byla na našem pracovišti provedena v roce 1988, dárcem byl HLA shodný sourozenec. Transplantován byl od té doby do roku 2004 každý mladší pacient se shodným dárcem, což bylo každým rokem 8–14 nemocných. Dosud bylo na našem pracovišti léčeno alogenní transplantací KB celkem 159 nemocných s CML (více o problematice v článku MUDr. Vítka).
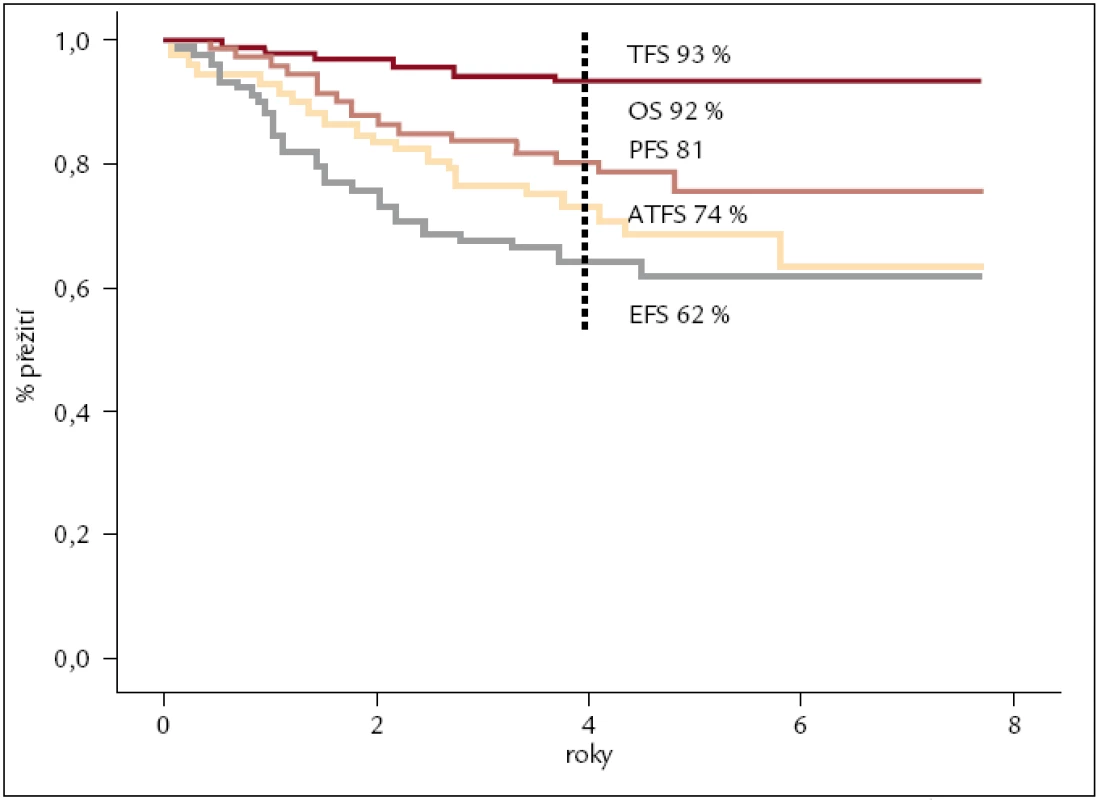
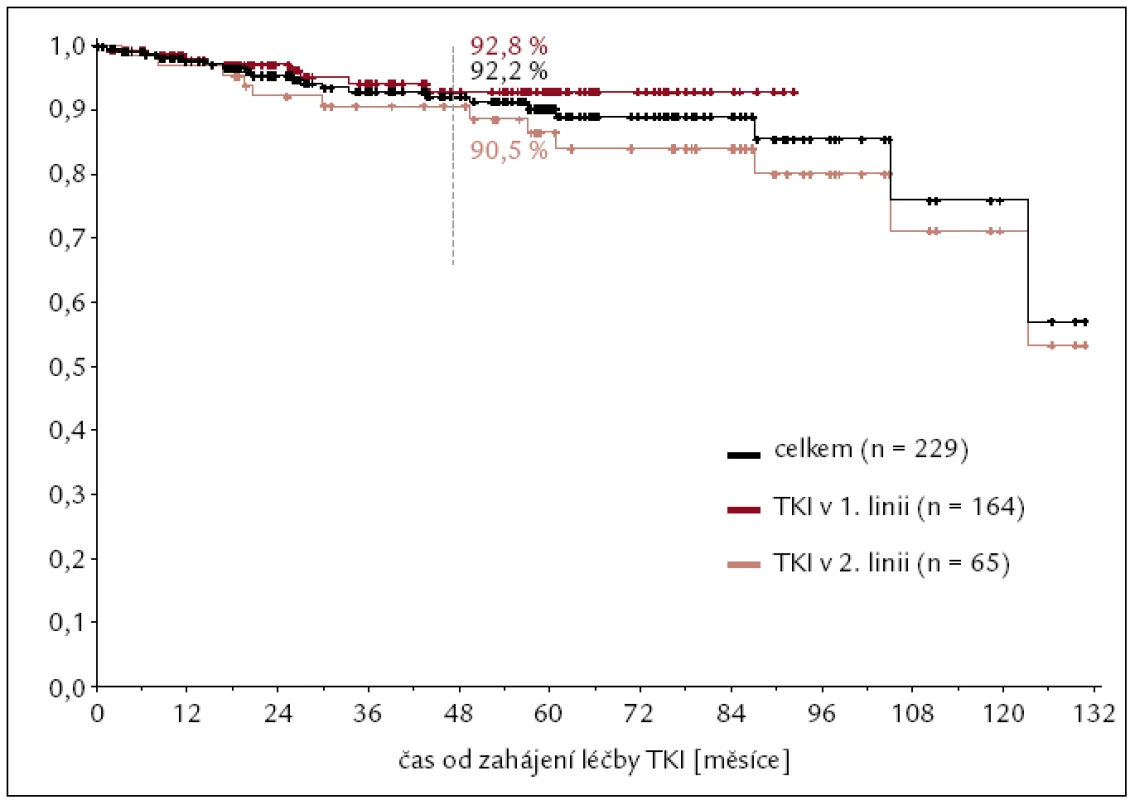
Od roku 2002 jsme imatinibem léčili nemocné, kteří nedosáhli dostatečné cytogenetické odpovědi na terapii interferonem nebo jej významně netolerovali. V souboru 72 nemocných léčených IM v této indikaci, tedy ve 2. linii, bylo dosaženo 71 % cytogenetických remisí s téměř 80% pravděpodobností přežití bez známek progrese po 4 letech léčby (obr. 4). Imatinibem v 1. linii, tedy nově diagnostikované CML, léčíme od roku 2004. V hodnoceném souboru 159 nemocných, u kterých byla léčba IM zahájena do konce roku 2011, je 4letý odhad celkového přežití 92 %, bez transformace do pokročilejšího stadia nemoci 93 % a do progrese dle ELN kritérií 81 % (obr. 5). Výrazně lepší je také kvalita života nemocných ve srovnání s léčbou IFN. Z pohledu reálné klinické praxe jsme iniciovali zpracování léčby nemocných s CML v chronické fázi v celé České republice a na Slovensku. V souboru celkem 458 nemocných s mediánem sledování 34 měsíců byla kumulativní incidence velké cytogenetické odpovědi ve 4 letech 82 %, kompletní pak 74 %. Očekávané celkové přežití po 5 letech léčby bylo 90 %, bez transformace 94 %. Na léčbě imatinibem zůstává (po 5 letech) 62 % nemocných. První zkušenosti s léčbou TKI 2. generace dasatinibem a nilotinibem jsme získali v rámci klinických studií a od roku 2007, resp. 2008, je standardně podáváme pacientům, u kterých selhala nebo není tolerovaná (předchozí) léčba imatinibem.
V souboru celkem 71 nemocných z 6 hematoonkologických pracovišť ČR a Slovenska léčených dasatinibem po selhání předchozí terapie imatinibem bylo dosaženo 39 % velkých a 33 % kompletních cytogenetických remisí, léčba byla dobře tolerována [42]. Alogenně nyní transplantujeme pacienty v chronické fázi pouze po selhání léčby tyrozinkinázovými inhibitory a také nemocné po předchozí chemoterapii AP/BP a dosažení 2. chronické fáze onemocnění, počet transplantací je 1–2 za rok.
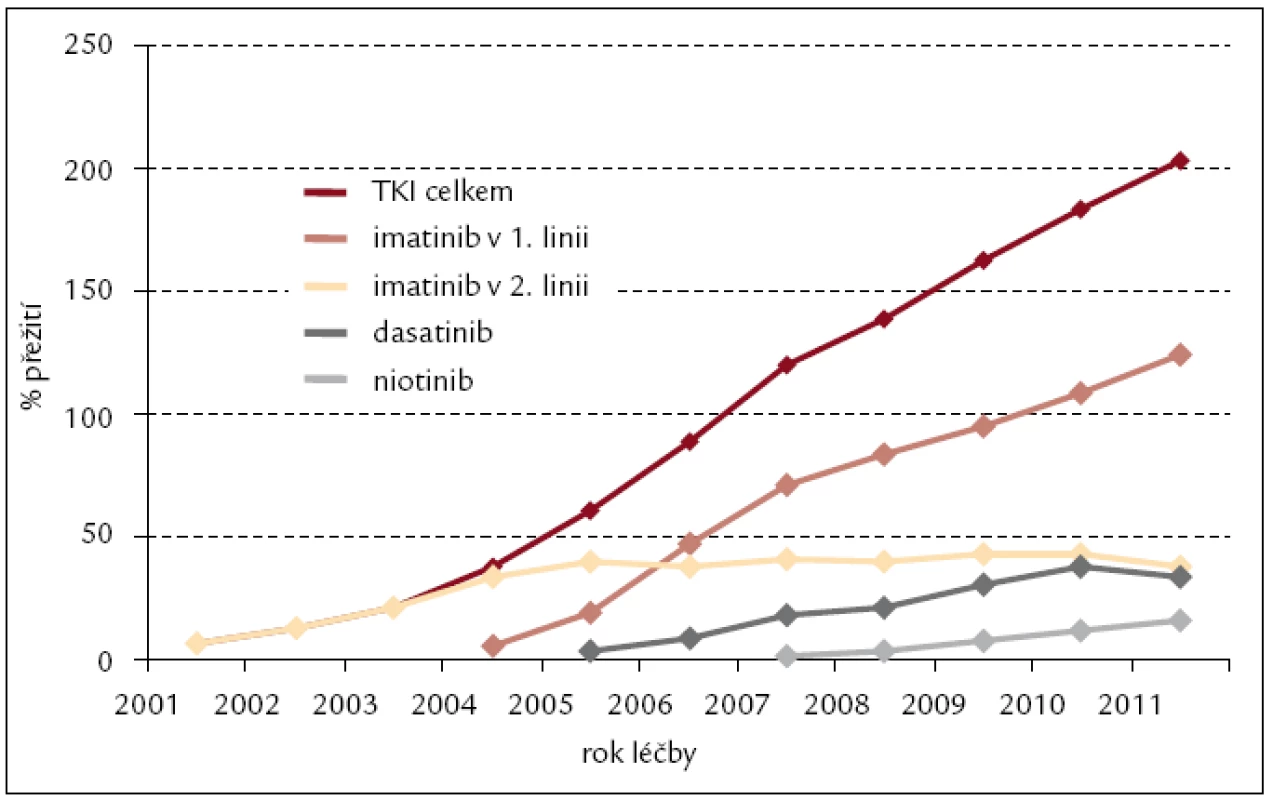
Inhibitory tyrozinových kináz jsme od roku 2000 léčili celkem 229 nemocných s CML s trvale se zvyšující prevalencí nejvíce patrnou u imatinibu: z 59 nemocných léčených v roce 2005 na 162 nemocných léčených IM v roce 2011 (obr. 6). Odhad 4letého celkového přežití pacientů s CML na léčbě TKI v období let 2000–2011 je 92 % (obr. 7).
Na našem pracovišti máme také praktické zkušenosti s léčbou chronické myeloidní leukemie v těhotenství. Celkem 8 těhotenství žen s diagnózou CML bez větších problémů skončilo fyziologickým porodem zdravých dětí. Těhotenství byla považovaná za riziková, nicméně ve spolupráci s gynekologem a genetikem nevzniklo poškození plodu ani nedošlo k významnějšímu zhoršení léčené nemoci [43]. Otci se stalo také 11 mužů s léčenou CML. V současné době se rovněž podílíme na několika klinických studiích fáze III, jejichž cílem je potvrdit kvalitu a rychlost dosažené odpovědi, toleranci léčby a parametry přežití pro tyrozinkinázové inhibitory 2. generace podávané v 1. linii léčby, tedy u nově diagnostikovaných nemocných s CML. I zde jsou výsledky po 18 a 24 měsících léčby velmi optimistické. Několik let probíhá také spolupráce našeho pracoviště v rámci České leukemické skupiny pro život (CELL). Od roku 2008 se aktivně účastníme také spolupráce na mezinárodní úrovni v rámci European Leukemia Net (ELN) Working pack-age 4 (WP4), zahrnující sekce Out-study patients, Population-based registry s cílem reálně zmapovat epidemiologii CML v Evropě a také The European Registry of CML Patients in Failure after Imatinib Therapy, dlouhodobě monitorujícího pacienty z celé Evropy, u kterých selhala léčba imatinibem.
Závěr
Vstup inhibitorů tyrozinových kináz do klinické praxe znamenal skutečně zásadní převrat v léčbě CML, která je v ČR realizovaná v hematoonkologických centrech, kde probíhá nejen vlastní léčba, ale také pravidelná monitorace průběhu onemocnění. Významně se prodloužilo přežití nemocných bez progrese nemoci, celkové přežití, výrazně se zlepšila také kvalita života. Rychlá diagnostika, podávání imatinibu a současně včasné odhalení nemocných, kteří na léčbu první linie nereagují optimálně, umožňují individuálně volit léčbu 2. linie tyrozinkinázovými inhibitory 2. generace, kterými jsou nilotinib nebo dasatinib, a dosáhnout tak optimálního výsledku léčby. Léčba TKI tak splňuje cíl moderní onkologie, kterým je návrat nemocného zpět do života, rodinného prostředí a zaměstnání, a to s léčbou, která probíhá komfortně a většinou v ambulantním režimu.
MUDr. Hana Klamová, CSc.
www.uhkt.cz
e-mail: hana.klamova@uhkt.cz
Doručeno do redakce: 15. 5. 2012
Sources
1. Hehlmann R, Hochhaus A, Baccarani M. European Leukemia Net. Chronic myeloid leukaemia. Lancet 2007; 370 : 342–350.
2. Rohrbacher M, Berger U, Hochhaus A et al. Clinical trials underestimate the age of chronic myeloid leukemia (CML) patients. Incidence and median age of Ph/BCR-ABL-positive CML and other chronic myeloproliferative disorders in a representative area in Germany. Leukemia 2009; 23 : 602–604.
3. Dušek L, Mužík J, Kubásek M et al. Epidemiologie zhoubných nádorů v České republice. Brno: Masarykova univerzita 2005. Dostupné na: www: http://www.svod.cz.
4. Mužík J, Faber E. Epidemiologie. In: Faber E, Indrák K (eds). Chronická myeloidní leukemie. Praha: Galén Publishing 2010 : 9–16.
5. Druker BJ, Tamura S, Buchdunger E et al. Effect of selective inhibitor of the Abl tyrosine kinase on the growth of Bcr-Abl positive cells. Nat Med 1996; 2 : 561–566.
6. Faderl S, Talpaz M, Estrov Z et al. Chronic myelogenous leukemia: biology and therapy. Ann Intern Med 1999; 131 : 207–219.
7. Agami R, Blandino G, Oren M et al. Interaction of c-Abl and p73alpha and their collaboration to induce apoptosis. Nature 1999; 399 : 809–813.
8. Goldman JM, Green AR, Vannucchi AM et al. Chronic myeloproliferative diseases with and without the Ph chromosome: some unresolved issues. Leukemia 2009; 23 : 1708–1715.
9. Faber E. Chronická myeloidní leukemie. In: Mayer J, Starý J et al (eds). Leukemie. Praha: Grada Publishing 2002 : 300–310.
10. Voglova J, Kašparová P, Vrbacký F. Klinický obraz, diagnostika a diferenciální diagnostika. In: Faber E, Indrák K (eds). Chronická myeloidní leukemie. Praha: Galén Publishing 2010 : 51–64.
11. Sokal JE, Cox EB, Baccarani M et al. Prognostic discrimination in good-risk chronic granulocytic leukemia. Blood 1984; 63 : 789–799.
12. Hasford J, Pfirmann M, Hehlmann R et al. A new prognostic score for survival of patients with chronic myeloid leukemia treated with interferon alfa. J Natl Cancer Inst 1998; 90 : 850–858.
13. Gratwohl A, Hermans J, Goldman JM et al. Risk assessment for patients with chronic myeloid leukaemia before allogeneic blood or marrow transplantation: Chronic Leukemia Working Party of European Group for Blood and Marrow Transplantation. The Lancet 1998; 352 : 1087–1092.
14. Baccarani M, Cortes J, Pane F et al. Chronic myeloid leukemia: an update of concepts and management recommendations of European Leukemia Net. J Clin Oncol 2009; 27 : 6041–6051.
15. Goldman JM. Treatment strategies for CML. Best Pract Res Clin Haematol 2009; 22 : 303–313.
16. Kantarjian H, Schiffer C, Jones D et al. Monitoring the response and course of chronic myeloid leukemia in the modern era of BCR-ABL tyrosine kinase inhibitors: practical advice on the use and interpretation of monitoring methods. Blood 2008; 111 : 1774–1780.
17. Branford S. Chronic myeloid leukemia: molecular monitoring in clinical practice. Hematology Am Soc Hematol Educ Program 2007 : 376–382.
18. Kantarjian HM, O’Brien S, Cortes JE et al. Complete cytogenetic and molecular response to interferon-alfa-based therapy for chronic myelogenous leukemia are associated with excellent long-term prognosis. Cancer 2003; 97 : 1033–1041.
19. Guilhot F, Chastang C, Michallet M et al. Interferon-alfa-2b combined with cytarabine versus interferon alone in chronic myelogenous leukemia. N Engl J Med 1997; 337 : 223–229.
20. Baccarani M, Martinelli G, Rosti G et al. Imatinib and pegylated human recombinant interferon-alpha2b in early chronic phase chronic myeloid leukemia. Blood 2004; 104 : 4245–4251.
21. Oehler VG, Gooley T, Snyder DS et al. The effect of imatinib mesylate treatment before allogeneic transplantation for chronic myeloid leukemia. Blood 2007; 109 : 1782–1789.
22. Druker BJ, Talpaz M, Resta DJ et al. Efficacy and safety of a specific inhibitor of the BCR-ABL tyrosine kinase in chronic myeloid leukemia. N Engl J Med 2001; 344 : 1031–1037.
23. Hochhaus A, O’Brien SG, Guilhot F et al. Six-year follow-up of patients receiving imatinib for the first-line treatment of chronic myeloid leukemia. Leukemia 2009; 23 : 1054–1061.
24. Deininger M, O’Brien DG, Guilhot F et al. International Randomize Study of Interferon and STI-571 (IRIS) 8-year follow-up: sustained and low risk for progression or events in patients with newly diagnosed chronic myeloid leukemia in chronic phase treated with imatinib. Blood 2009; 114 : 462. Abstract 1126.
25. Zackova D, Klamova H, Dusek L et al. Imatinib as the first-line treatment of patients with chronic myeloid leukemia diagnosed in the chronic phase: can we compare real life data to the results from clinical trials? Am J Hematol 2011; 86 : 318–321.
26. Faber E, Mužík J, Koza V et al. Treatment of consecutive patients with chronic myeloid leukaemia in the cooperating centres from the Czech Republic and the whole of Slovakia after 2000 – a report from the population-based CAMELIA Registry. Eur J Haematol 2011; 87 : 157–168.
27. Klamova H, Zackova K, Faber E et al. The Outcome of Unselected Patients with CML in Chronic Phase Treated with Imatinib In the First Line and the Prognostic Value of ELN Defined Responses-Population Based Analysis of 458 Patients Treated Between 2003–2009. Blood 2010; 116. Abstract 1239.
28. Mahon FX, Réa D, Guilhot J et al. Discontinuation of imatinib in patients with chronic myeloid leukemia who have maintained complete molecular remission for at least 2 years: the prospective, multicentre Stop Imatinib (STIM) trial. Lancet Oncol 2010; 11 : 1029–1035.
29. Cortes J, Rousselot P, Kim DW et al. Dasatinib induces complete hematologic and cytogenetic responses in patients with imatinib-resistant or -intolerant chronic myeloid leukemia in blast crisis. Blood 2007; 109 : 3207–3213.
30. Hochhaus A, Kantarjian HM, Baccarani M et al. Dasatinib induces notable hematologic and cytogenetic responses in chronic-phase chronic myeloid leukemia after failure of imatinib therapy. Blood 2007; 109 : 2303–2309.
31. O’Hare T, Eide CA, Deininger MW. Bcr-Abl kinase domain mutations, drug resistance, and the road to a cure for chronic myeloid leukemia. Blood 2007; 110 : 2242–2249.
32. Kantarjian HM, Giles F, Gattermann N et al. Nilotinib (formerly AMN107), a highly selective BCR-ABL tyrosine kinase inhibitor, is effective in patients with Philadelphia chromosome-positive chronic myelogenous leukemia in chronic phase following imatinib resistance and intolerance. Blood 2007; 110 : 3540–3546.
33. Philips D, Coutre MD, Giles FJ et al. Nilotinib in Imatinib-Resistant or Intolerant Patients with chronic myeloid leukemia in chronic phase: 48 Months Follow-Up Results of a Phase 2 Study. Blood 2011; 118. Abstract 3770.
34. Cortes JE, Kantarjian HM, Brümmendorf TH et al. Safety and efficacy of bosutinib (SKI-606) in chronic phase chronic Philadelphia chromosome-positive chronic myeloid leukemia patients with resistance or intolerance to imatinib. Blood 2011; 118 : 4567–4576.
35. Cortes JE, Talpaz M, Bixby D et al. A phase 1 trial of oral ponatinib (AP24534) in patients with refractory chronic myelogenous leukemia and other hematologic malignancies. Blood 2010; 116. Abstract 210.
36. Bocchia M, Gentili S, Abruzzese E et al. Effect of a p210 multipeptide vaccine associated with imatinib or interferon in patients with chronic myeloid leukaemia and persistent residual disease: a multicentre observational trial. Lancet 2005; 365 : 631–632.
37. Bocchia M, Lauria F. Immunotherapy of chronic myeloid leukemia. In: Cortes J, Deininger M (eds). Chronic myeloid leukemia. New York: Informa Healthcare 2007 : 95–108.
38. National Comprehensive Cancer Network (NCCN) Clinical Practice Guidelines in Oncology, version 2.2011. Available from: www.nccn.org.
39. Hochhaus A, Dreyling M. Chronic myelogenous leukemia: ESMO clinical recommendations for the diagnosis, treatment and follow-up. Ann Oncol 2008; 19 (Suppl 2): ii63–ii64.
40. Klamová H, Voglová J. Chronická myeloidní leukemie. Transfuze Hematol Dnes 2010; 16 : 17–20.
41. Klamova H, Vitek A, Michalova K et al. Interferon alfa – lék volby pro nemocné s chronickou myeloidní leukemií. Čas Lék Česk 1998; 134 : 552–556.
42. Klamova H, Faber E, Žáčková D et al. Dasatinib in imatainib-resistant or -intolerant CML patients: data from the clinical practice of 6 hematological centers in the Czech Republic. Neoplasma 2010; 57 : 355–359.
43. Klamova H, Markova M, Machova K et al. Response to treatment in women with chronic myeloid leukemia during pregnancy and after delivery. Leuk Res 2009; 33 : 1567–1569.
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Internal Medicine

2012 Issue Suppl 2
-
All articles in this issue
- Myelodysplastic syndromes. Progress in diagnosis and treatment within 30 years of myelodysplastic syndromes registry in Institute of Hematology in Prague
- Acute myeloid leukaemia – the post and present of the treatment in the world and the Institute of Heamatology and Blood Transfusion in Prague
- Acute lymphoblastic leukemia: past and present
- Chronic myeloid leukaemia – a crucial change to the patient prognosis after an introduction of tyrosine kinase inhibitors
- Molecular genetics in the chronic myeloid leukemia diagnostics and therapy
- Transplantation of haematopoietic cells and its role in the treatment of haematopoiesis during the last 25 years
- Prevention and treatment of infectious complications in haematooncology
- Emergency situations in hematology
- Care for patients with haemophilia and their families at The Institute of Haematology and Blood Transfusion in Prague
- Studies of structural and functional changes of fibrinogen
- Use of label-free protein chips for proteomics of oncohematological diseases
- Hemapheresis – the efficient therapeutic technique in clinical practice
- Immunohaematology – the history, current knowledge and the role of The Institute of Haematology and Blood Transfusion in Prague
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue
- Immunohaematology – the history, current knowledge and the role of The Institute of Haematology and Blood Transfusion in Prague
- Emergency situations in hematology
- Hemapheresis – the efficient therapeutic technique in clinical practice
- Chronic myeloid leukaemia – a crucial change to the patient prognosis after an introduction of tyrosine kinase inhibitors