Paraneoplastická hypoglykémia – popis prípadu a prehľad problematiky
Paraneoplastic hypoglyacemia
Paraneoplastic hypoglyacemia (PH) is a relatively rare phenomenon, which may be caused by insulinomas or non‑islet cell tumours (NICT). Both types are among the major “fasting” hypoglyacemia as opposed to reactive postprandial hypoglyacemia. The most common group of non‑islet cell tumours causing hypoaglycemia are large mesenchymal tumours, which account for over 50 % of all neoplasms associated with hypoglyacemia. Neuroglycopenic symptoms in patients with NICT may be present for months or years before the actual diagnosis of the underlying disease. Differentiation and correct diagnosis of this type of disease leads to significant improvement in the quality of life of these patients.
Key words:
paraneoplastic hypoaglycemia – non‑islet cell tumors – diagnosis – therapy
Authors:
I. Ságová; A. Klimentová; D. Prídavková; D. Kantárová; J. Sadloňová; P. Galajda; M. Mokáň
Authors‘ workplace:
I. interná klinika Jesseniovej lekárskej fakulty UK a UN Martin, Slovenská republika, prednosta prof. MU Dr. Marián Mokáň, DrSc., FRCP Edin.
Published in:
Vnitř Lék 2013; 59(5): 402-406
Category:
Case Report
Overview
Paraneoplastická hypoglykémia (PH) je pomerne vzácny fenomén, ktorý môže byť spôsobený inzulinómom alebo neostrovčekovým tumorom (NICT). Obidva typy patria medzi závažné hypoglykémie „nalačno“ na rozdiel od reaktívnych postprandiálnych hypoglykémií. Najčastejšou skupinou neostrovčekových tumorov spôsobujúcich hypoglykémiu sú veľké mezenchýmové tumory, ktoré predstavujú viac ako 50 % všetkých neoplaziem asociovaných s hypoglykémiou. Neuroglykopenické symptómy u pacientov s NICT môžu byť prítomné niekoľko mesiacov až rokov pred samotným diagnostikovaním základného ochorenia. Oddiferencovanie a správna diagnostika tohto typu ochorenia vedie k významnému zlepšeniu kvality života týchto pacientov.
Kľúčové slová:
paraneoplastická hypoglykémia – neostrovčekové tumory – diagnostika – liečba
Úvod
Paraneoplastická hypoglykémia sa vyskytuje ako pomerne zriedkavý prejav nádorových ochorení. Spomedzi neostrovčekových tumorov (NICT) bolo opísaných niekoľko typov tumorov manifestujúcich sa hypoglykémiou, pričom viac ako polovicu tvorili veľké mezenchýmové nádory lokalizované hlavne v retroperitoneu a v pelvických priestoroch (65 %) alebo v hrudníku (30 %). Podiel epitelových nádorov predstavuje menej ako 0,1 %. Gastrointestinálne stromálne tumory (GIST) sú často spájané s týmto prejavom. Najbežnejším miestom výskytu GIST je žalúdok (60 – 70 %), nasleduje tenké črevo, rektum a hrubé črevo [1]. Zriedkavo sa môžu GIST prejavovať ako pelvické masy [2]. Z gynekologických nádorov sú to najmä leiomyosarkóm, solitárny fibrózny tumor a fibrosarkóm [3]. Spomedzi ďalších je nutné spomenúť mezotelióm, hemangiopericytóm, solitárne fibrózne tumory, fibrosarkómy, synoviálne sarkómy, myxoidný liposarkóm, chondrosarkóm, Ewingov sarkóm a nediferencovaný pleiomorfný sarkóm. Hoci sprievodným javom fibróznych tumorov pleury (FTP) býva hypoglykémia, jej výskyt je približne v 5 % prípadov [4]. Doege a Potter ako prví opísali tento fenomén v spojitosti s intratorakálnymi tumormi v roku 1930 pod názvom Doege - Potterov syndróm [5,6]. Je častejším prejavom pri pravostrannej lokalizácii FTP a 3-krát častejšie sa vyskytuje u žien ako u mužov [7]. Viac prípadov hypoglykémie sa spája s malígnou formou fibrózneho tumoru pleury s priemerom viac ako 10 cm. Z predstaviteľov primárnych epiteliových nádorov boli opisované prípady hypoglykémie pri veľkobunkovom adenokarcinóme, hepatocelulárnom karcinóme, karcinóme obličiek, fyloidnom tumore prsníka a adenokarcinóme ovária. Prehľad neostrovčekových nádorov spájajúcich sa s prejavmi paraneoplastickej hypoglykémie uvádzame v tab. 1. Niektoré z paraneoplastických hypoglykémií pri karcinómoch sa spájajú s ich metastatickým šírením, pričom ich črtou je zvýšená hladina inzulínu podobného rastového faktora IGF‑1 s normálnou hladinou IGF‑2 [8].
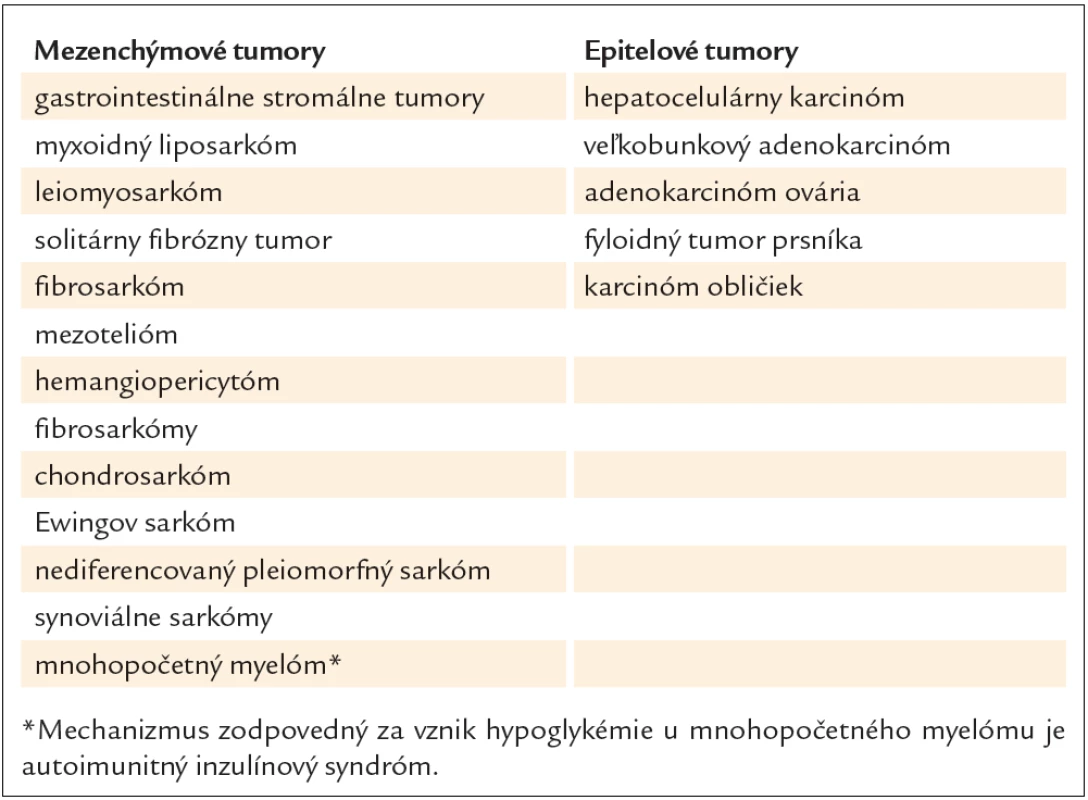
Patogenéza
Patomechanizmus spôsobujúci hypoglykémie pri NICT zahrňuje deštrukciu inzulínu alebo inzulínových receptorov infiltratívnym rastom tumoru spolu s nadmernou utilizáciou glukózy spôsobenou zvýšenou sekréciou prohormónu inzulínového rastového faktoru 2 (IGF‑2) nazývaného „big“ IGF‑2 [9]. Gén IGF‑2 je nadmerne exprimovaný v neoplastických tkanivách, čo spôsobuje nadmernú produkciu prekurzorov IGF‑2, tzv. „big“ IGF‑2, ktoré sa viažu na inzulínové receptory a receptory pre inzulínový rastový faktor v pečeni a svale, v dôsledku čoho dochádza k zníženiu produkcie glukózy a zvýšenej utilizácii glukózy periférnymi tkanivami [10]. Celková hladina IGF‑2 môže byť v norme, dôležitá je zvýšená hladina prohormómu IGF‑2, tzv. „big“ IGF‑2, ako aj pomer IGF‑2 : IGF‑1, ktorý je zvýšený [11]. Zvýšenou koncentráciou IGF‑2 sa inhibuje sekrécia inzulínu a rastového hormónu a redukcia koncentrácie rastového hormónu má za následok zníženie cirkulujúcich komplexov IGF‑1 a IGF viažucého proteínu ‑ 3 [12]. Výsledkom uvedeného procesu je nízka hladina sérovej glukózy nalačno, nízka hladina proinzulínu, inzulínu (IRI) pod 4,0 µU/ ml, C ‑ peptidu pod 0,1 ng/ ml, rastového hormónu pod 0,1 ng/ ml a IGF‑1 faktoru (normálna hodnota 46 – 284 ng/ ml) so zvýšenou hladinou „big“ IGF‑2 (normálna hodnota IGF‑2 a IGF‑2 prekurzorov 28 – 444 ng/ ml), ako aj zvýšeným pomerom IGF‑2 : IGF‑1, za patognomický sa považuje pomer viac ako 10 : 1, čo môžeme demonštrovať chromatografickými metodikami.
Liečba
Popredné postavenie v liečbe paraneoplastickej hypoglykémie predstavuje liečba samotného vyvolávajúceho ochorenia s dosiahnutím remisie pomocou chirurgického odstránenia nádoru s následnou adjuvantnou chemoterapiou, prípadne rádioterapiou. U pacientov neprofitujúcich z chirurgickej liečby, prípadne u pacientov s neresekovateľným tumorom, je indikovaná symptomatická liečba [13]. Na zvládnutie akútnej hypoglykémie je nutné kontinuálne podávanie 10% roztokov glukózy. Ďalšie potenciálne možnosti terapie predstavuje i. m. alebo i. v. aplikácia glukagónu, glukokortikoidy, pridanie humánneho rastového hormónu a diazoxidu/ chlortiazidu [14]. V súčasnosti sa ukázalo úspešné podávanie imatinibu (inhibítor tyrozínovej kinázy) u pacientov s gastrointestinálnymi stromálnymi tumormi a antagonistu receptora IGF pri Ewingovom sarkóme.
Kazuistika
Uvádzame prípad 76-ročnej pacientkys fibrómom pleury, ktorý bol zachytený v rámci prehliadky v roku 2000 na RTG snímke hrudníka. V tom čase bola pacientka bez klinických ťažkostí. Doplnené CT vyšetrenie hrudníka s nálezom periférneho solitárneho ložiska benígneho vzhľadu, v.s. fibrómu, vľavo. Fibrobronchoskopicky bez jednoznačných tumoróznych zmien, cytologicky aj histologicky bez nálezu malígnych buniek. V auguste roku 2000 bola zrealizovaná klinovitá resekcia periférneho tumoru ľavého laloka cestou videotorakoskopie s histologickým záverom fibrózneho tumoru pleury. Pacientka bola následne sledovaná v spáde. V roku 2006 počas gynekologickej prehliadky USG verifikovaný tumor mammae riešený segmentálnou mastektómiou vpravo s exstirpáciou 6 axilárnych lymfatických uzlín – histologicky zodpovedajúci stredne diferencovanému invazívnemu karcinómu prsníka. Pacientka však nenastúpila na doporučenú liečbu, nechodila na pravidelné prehliadky. Až v júli roku 2007, kedy sa u pacientky objavila námahová dušnosť s potením. Na CT hrudníka prítomné 2 ložiská, v.s. fibrómy, na laterálnej strane ľavého hemitoraxu. Fibrobronchoskopicky bez potvrdenia malignity. V septembri roku 2007 zrealizovaná axiálna torakotómia vľavo s exstirpáciou 7 infiltrátov hrudnej steny vľavo a jedného infiltrátu z mediastinálnej pleury vľavo. Histologicky sa jedná o infiltratívne rastúci silne hypercelulárny nádor z vretenovitých buniek, bez nekróz a výraznejších atypií, v ktorom mitotická aktivita presahuje 4 mf/ 10 HPF. Imunohistochemicky sú nádorové bunky pozitívne pri dôkaze vimentínu, CD 34, CD 99 a bcl ‑ 2, dôkaz CK 7, CK 8/ 18, EMA a calretínu je negatívny. Proliferačná aktivita (index Ki ‑ 67) je asi 20 – 30 %. Uvedená charakteristika zodpovedá malígnemu solitárnemu fibrómu pleury. Pacientka odmietla navrhovanú liečbu. V marci roku 2009 došlo k recidíve solitárneho fibrózneho nádoru pleury s mnohopočetnými metastázami na parietálnej mediastinálnej pleure vľavo a v ľavých pľúcach. Klinicky dominuje dyspnoe pri minimálnej námahe. Pre progresiu ochorenia operačné riešenie nebolo indikované. V roku 2011 došlo k progresii základného ochorenia pleury s mnohopočetnými metastázami vľavo s prerastaním do neuroforamina a hrudných stavcov 2 – 3 vľavo s miernym útlakom mediastinálnych štruktúr a srdca. V auguste roku 2011 pacientka hospitalizovaná v spáde za účelom diagnostiky kvantitatívnej poruchy vedomia v zmysle krátkodobého bezvedomia (zaznamenaného o 6 : 00 ráno), kedy RLP nameraná glykémia 1,00 mmol/ l riešená podaním 40 ml 40% glukózy i.v. s postupnou obnovou vedomia s následnou glykémiou 12,3 mmol/ l. Počas 3 dní hospitalizácie opakovane namerané symptomatické hypoglykémie nalačno s maximálnym poklesom glykémie na 1,3 mmol/ l s varovnými adrenergnými symptómami (potením, tachykardiou), bez kvalitatívnej a kvantitatívnej poruchy vedomia riešené kontinuálnym intravenóznym podávaním roztokov glukózy. Následne pacientka preložená na I. internú kliniku UN Martin za účelom ďalšej diagnostiky hypoglykémií. Klinicky dominuje pri základnom ochorení u pacientky dyspnoe pri minimálnej námahe, bez bolestí na hrudníku, bez hemoptýzy, bez prítomnosti kašľa. Sú prítomné prejavy iritácie krčného sympatika s plne vyjadreným Claude ‑ Bernard ‑ Hornerovou triádou. Počas hospitalizácie je nutné nepretržité parenterálne podávanie roztokov 10% glukózy. Po celonočnom hladovaní bola potvrdená symptomatická hypoglykémia nalačno 0,3 mmol/ l, k tomu prislúchajúce IRI 0,000 µU/ ml a C ‑ peptid 0,066 ngl/ ml. Doplnené vyšetrenie IGF‑1 (29,410 ng/ ml) s normálnou hladinou IGF‑1 (46 – 284 ng/ ml). Hladina IGF‑2 pre nedostupnosť vyšetrenia v rámci SR nezrealizovaná. Jediným varovným andrenergným symptómom počas hypoglykémie bolo potenie, z neuroglykopenickým prejavov dominovala spavosť (somnolencia).
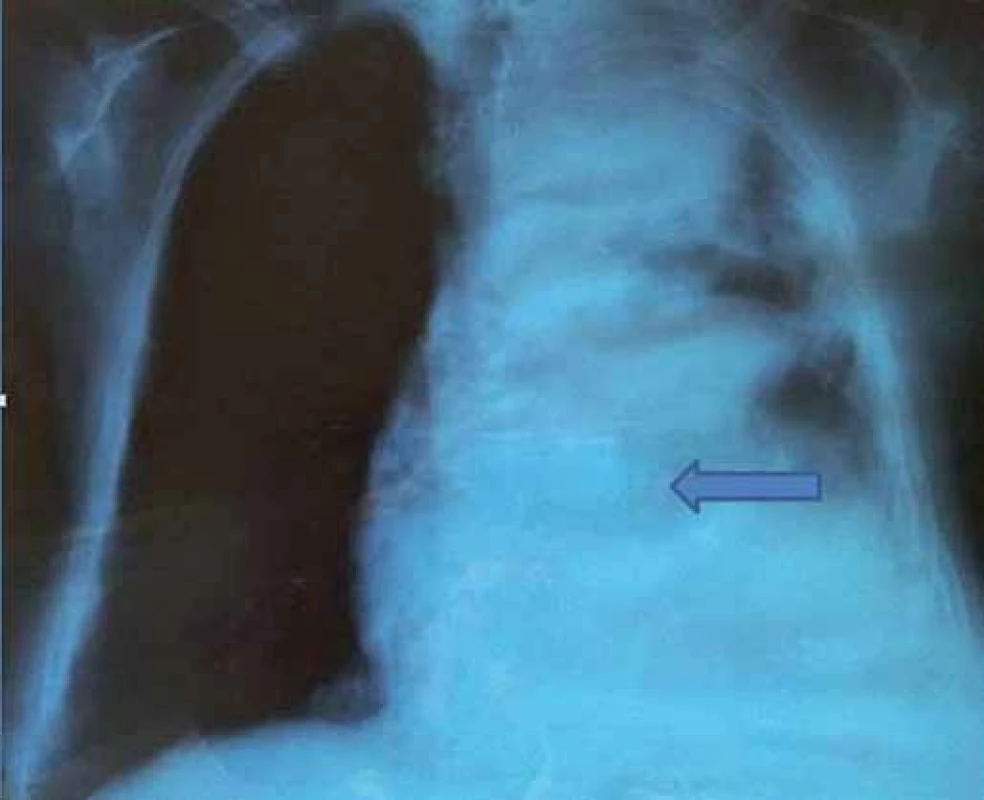
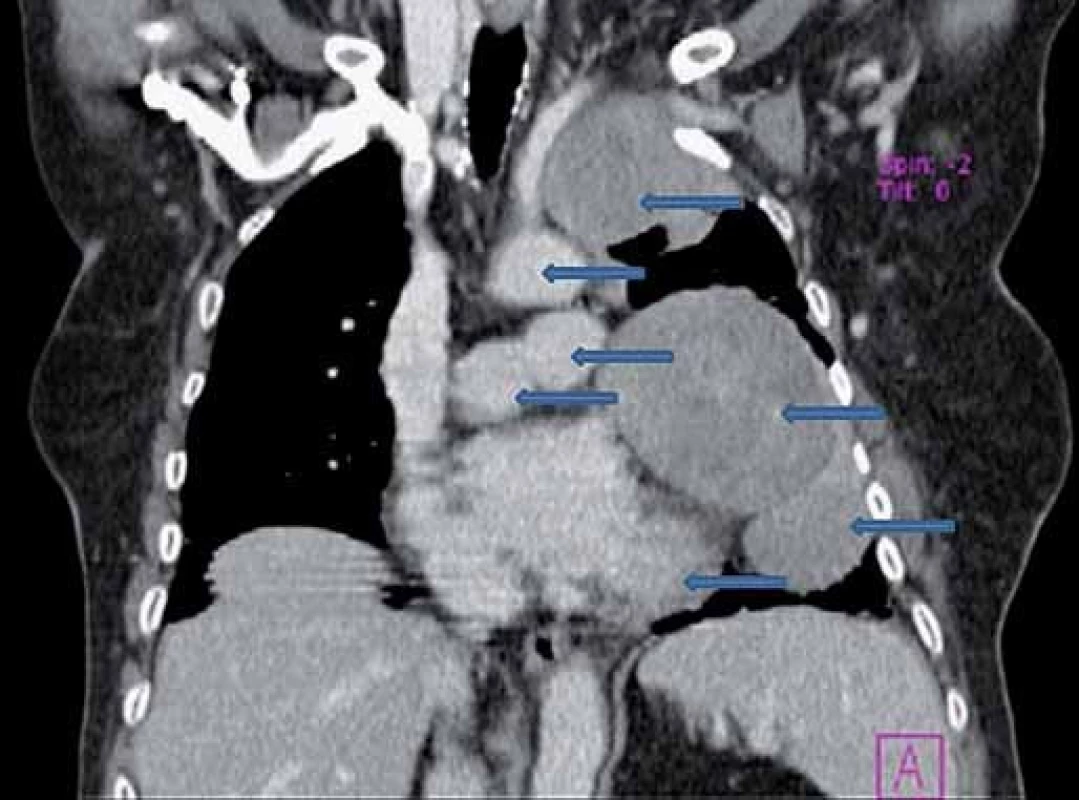
Na základe uvedených laboratórnych vyšetrení hodnotíme hypoglykémiu ako sekundárnu – paraneoplastickú pri základnom ochorení. V snahe o zníženie metabolizmu nádorovej masy konzultujeme onkológa, ktorý neindikuje paliatívnu chemoterapiu vzhľadom na rozsah ochorenia. Zahájená kortikoterapia v dávke 16 mg metylprednisolonu denne rozdelenej do 3 dávok (8 - 4 - 4 mg), na ktorej je pacientka bez recidívy hypoglykemických epizód v pásme euglykémie.
Diskusia
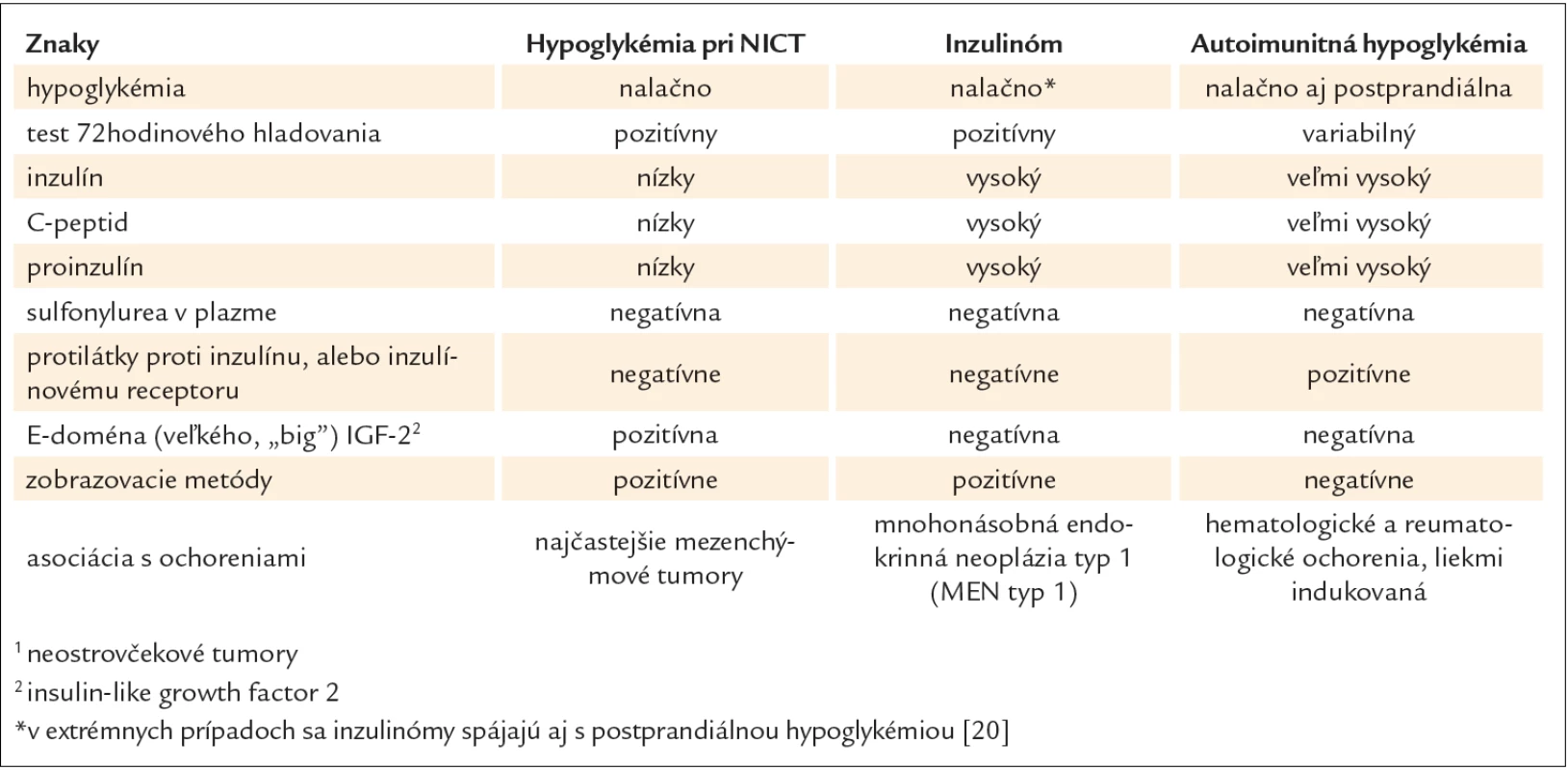
Paraneoplastická hypoglykémia je vzácnym príznakom nádorových ochorení. V mnohých prípadoch PH je nádorové ochorenie už známe, zvyčajne v pokročilom štádiu. Avšak môže byť aj prvým klinickým prejavom nádoru, preto je nutné pri nejasnej diagnostike myslieť aj na túto možnosť. Charakteristickým znakom PH je ťažká hypoglykémia „nalačno“, ktorá je perzistentná, vyžadujúca kontinuálne intravenózne podávanie roztokov glukózy na jej zrušenie. Vzhľadom k tomu, že nástup hypoglykémií „nalačno“ je často postupný, vegetatívne príznaky sú minimálne alebo žiadne, vo väčšine prípadov prevažujú neuroglykopenické prejavy. Diferenciálna diagnostika zahàňa všetky ďalšie podmienky, ktoré môžu spôsobovať hypoglykémiu „nalačno“, a to najmä zlyhanie obličiek alebo pečene, nedostatočnosť nadobličiek, sepsu, B bunkové nádory pankreasu, požitie etanolu alebo liekov (zvyčajne inzulínu alebo derivátov sulfonylurey) [15,16]. Väčšina z nich sa dá ľahko vylúčiť a oddiferencovanie zvyčajne zahàňa iba B bunkové nádory pankreasu, neostrovčekové nádory, nedostatočnosť nadobličiek alebo sekundárne hypoglykémie pri exogénnom podávaní inzulínu alebo derivátov sulfonylurey. Avšak v rámci diferencionálnej diagnostiky paraneoplastickej hypoglykémie netreba zabúdať na v našich podmienkach raritnú hypoglykémiu popisovanú v súvislosti s monoklonálnymi gamapatiami. Mechanizmus zodpovedný za jej vznik je autoimunitný inzulínový syndróm (AIS), ktorého výskyt je vzácny v Európe a bežný v Japonsku, kde predstavuje 3. najčastejšiu príčinu hypoglykémie po inzulinóme a hypoglykémie pri NICT. Mimo Ázie bolo popísaných celkovo 58 prípadov autoimunitnej hypoglykémie najmä v súvislosti s prítomnosťou mnohopočetného myelómu – plazmocytómu [17]. AIS sa môže ľahko klinicky zameniť za inzulinóm a s istotou sa môže diagnostikovať iba demonštrovaním (auto)protilátok proti inzulínu v plazme pacienta, ktorý nikdy nedostal exogénny inzulín, alebo potvrdením protilátok proti inzulínovým receptorom. Na rozdiel od hypoglykémie pri neostrovčekových tumoroch a inzulinómoch pri AIS môže byť prítomná okrem hypoglykémie „nalačno“ aj reaktívna postprandiálna hypoglykémia [18]. Základnú klinickú a biochemickú charakteristiku hypoglykémie pri neostrovčekových tumoroch, inzulinómoch a AIS ukazuje tab. 2. Keďže tento druh hypoglykémie je často sekundárny pri preexistujúcej chorobe – už diagnostikovanej, vyšetrenie protilátok je málokedy potrebné [19].
Liečba tohto pomerne zriedkavého typu hypoglykémie môže byť náročná. Títo pacienti často vyžadujú nepretržité podávanie roztokov glukózy na vymiznutie symptómov. V prípade našej pacientky trvalo toto obdobie až 6 týždňov. Ďalšiu možnosť liečby predstavujú glukokortikoidy, ktoré môžu vyvolať terapeutické rozpaky pre obavy z nežiaducich účinkov, avšak pri tejto povahe ochorenia prevažuje benefit v zmysle udržania trvalej euglykémie bez nutnosti kontinuálneho i. v. podávania glukózy nad vedľajšími účinkami. V našom prípade bolo podávanie glukokortikoidov v jednej dávke neúčinné, až rozloženie na 3 dávky zabezpečilo euglykemický stav. V niektorých prípadoch sa osvedčil diazoxid (silný inhibítor sekrécie inzulínu). Efekt operačnej liečby môže priniesť úľavu, najmä u pacientov s pomalým rastom mezenchymových nádorov. Pri možnosti špecifickej liečby je potrebné začať čo najskôr, napr. podávaním imatinibu pri gastrointestinálnych stromálnych nádoroch. Vo väčšine prípadov je však výsledok často zlý vzhľadom na veľkosť a stupeň pokročilosti nádoru.
Záver
V súvislosti s rastúcou incidenciou nádorových ochorení v poslednom období narastá počet paraneoplastických syndrómov. Paraneoplastická hypoglykémia patrí do pestrej škály týchto syndrómov, ktorých adekvátna liečba môže významne zlepšiť kvalitu života pacienta.
MU Dr. Ivana Ságová
www.unm.sk
e‑mail: iva.sagova@gmail.com
Doručeno do redakce: 26. 12. 2012
Přijato po recenzi: 28. 2. 2013
Sources
1. Miettinen M, Lasota J. Gastrointestinal stromal tumors (GIST tumors): definition, occurrence, pathology, differential diagnosis and molecular genetics. Pol J Pathol 2003; 13 : 157.
2. Angioli R, Battista C, Muzii L et al. A gastrointestinal stromal tumor presenting as a pelvic mass. Oncol Rep 2009; 21 : 899 – 902.
3. Groot J, Rikhof B, van Doorn J et al. Non ‑ islet cell tumour‑induced hypoglycaemia: a review of the literature including two new cases. Endocr Relat Cancer 2007; 14 : 979 – 993.
4. Graadt van Roggena JF, Hogendoorn PCW. Solitary fibrous tumour: the emerging clinicopathologic spectrum of an entity and its differential diagnosis. Current Diagnostic Pathology 2004; 10 : 229 – 235.
5. Doege KW. Fibrosarcoma of the Mediastinum. Ann Surg 1930; 92 : 955.
6. Potter RE. Intrathoracic tumors. Radiology 1930; 14 : 60 – 62.
7. England DM, Hochholzer L, McCarthy MJ. Localized benign and malignant fibrous tumors of the pleura. A clinicopathologic review of 223 cases. Am J Surg Pathol 1989; 13 : 640 – 658.
8. Daughaday WH. Hypoglycemia due to paraneoplastic secretion of insulin growth factor ‑ 1. J Clin Endocrinol Metab 2007; 92 : 1616.
9. Pollak M. Insulin and insulin‑like growth factor signalling in neoplasia. Nat Rev Cancer 2008; 8 : 915 – 928.
10. Daughaday WH, Trivedy B. Meaurement of derivates of proinsulin‑like growth factor ‑ II in serum by radioimmunoassay directed againsthe E ‑ domain in normal subjects and patients with noninslet cell tumor hyglycemia. J Clin Endocrinol Metab 1992; 75 : 110 – 115.
11. Pink D, Schoeler D, Lindner T et al. Severe hypoglycemia caused by paraneoplasticproduction of IGF‑II in patients with advanced gastrointestinal stromal tumors: a report of two cases. J Clin Oncol 2005; 23 : 6809 – 6811.
12. Mokáň M, Galajda P. Hypoglykémia pri vybraných vnútorných chorobách. Quickprint Martin 2011; 119 s.
13. de Boer Jager PL, Wiggers T, Nieboer P et al. The therapeutics challenge of a nonresectable solitary fibrou tumour of the pleura. Int J Clin Oncol 2006; 11 : 478 – 481.
14. Teale JD, Wark G. The effectiveness of different treatment options for non‑islet cell tumor hypoglycemia. Clin Endocrinol (Oxf.) 2004; 60 : 457 – 460.
15. Service FJ. Diagnostic approach to adults with hypoglycemic disorders. Endocrinol Metab Clin North Am 1999; 28 : 519 – 532.
16. Service FJ. Classification of hypoglycemic disorders. Endocrinol Metab Clin North Am 1999; 28 : 501 – 517.
17. Lupsa BC, Chong AY, Cochran EK et al. Autoimmune Forms of Hypoglycemia. Medicine 2009; 88 : 141 – 153.
18. Waldron ‑ Lynch F, Inzucchi SE, Menard L et al. Relapsing and Remitting Severe Hypoglycemia due to a Monoclonal gammapathy. Evidence for monoclonal insulin autoantibodies. Diabetes Care 1989; 12 : 147 – 150.
19. Mokáň M. Hypoglykémia. Vnitř Lék 2008; 54 : 387 – 394.
20. Kar P, Price P, Sawers S et al. Insulinomas may present with normogylcemia after prolonged fasting but glucose‑stimulated hypoglycemia. J Clin Endocrinoll Metab 2006; 91 : 4733 – 4736.
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Internal Medicine

2013 Issue 5
-
All articles in this issue
- Spondyloartritidy: aktuální pohled na diagnostiku a klasifikaci
- Diastolická dysfunkce levé komory ve vyšším věku. Nemoc, nebo fyziologický projev stárnutí?
- Fixní kombinace telmisartanu a thiazidového diuretika v léčbě hypertenze
- Paraneoplastická hypoglykémia – popis prípadu a prehľad problematiky
- Malígnym melanómom imitovaný akútny koronárny syndróm alebo reálny akútny koronárny syndróm?
- Spondylodiscitida, epidurální empyém jako komplikace syndromu diabetické nohy
- Distribuce s lipoproteiny asociované fosfolipázy A2 v české populaci a její interakce s konvenčním kardiovaskulárním rizikem
- Možný vplyv génového polymorfizmu v oblasti GSTs génov na sérovú hladinu polychlorovaných bifenylov (PCB)
- Srovnání MRCP a ERCP v diagnostice choledocholitiázy
- Poruchy srdcového rytmu u pacientov s diabetes mellitus
- Kombinovaná terapie arteriální hypertenze
- Prevence náhlé srdeční smrti při sportu ve světle nových doporučení
- Choroby způsobené lepkem
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue
- Diastolická dysfunkce levé komory ve vyšším věku. Nemoc, nebo fyziologický projev stárnutí?
- Spondyloartritidy: aktuální pohled na diagnostiku a klasifikaci
- Srovnání MRCP a ERCP v diagnostice choledocholitiázy
- Choroby způsobené lepkem
