Cystické nádory pankreatu – naše zkušenosti
Cystic tumors of the pancreas – our experience with diagnostics
Number of newly diagnosed cystic pancreatic tumors is permanently increasing. This fact is primarily related to the development of new diagnostic methods. The main representative ones are: serous cystadenoma, mucinous cystic neoplasm, intraductal papillary mucinous neoplasm and solid pseudopapillar tumor. Because of the malignant potential of these lesions, proper indication of surgical treatment is extremely important. The article highlights and describes our experience in diagnostics and therapy of cystic pancreatic tumors diagnosed in the General Teaching Hospital Prague in the period: 1/ 2008 – 12/ 2012. All patients were investigated by computerised tomography and endoscopic ultrasound with fine – needle aspiration biopsy. Thirty seven patients in total were diagnosed with cystic pancreatic tumors: 19 with serous cystadenoma, 5 with mucinous cystic neoplasm, 5 with mucinous cystadenocarcinoma, 5 with intraductal papillary mucinous neoplasm and 3 with solid pseudopapillar tumor. In 14 cases patients were indicated for surgery, in 1 case signs of malignant transformation were found. Determination of the optimal strategy for diagnostic and therapeutic procedures in patients with cystic pancreatic tumors requires the diagnosis, treatment and follow‑up observation in adequately equiped specialized centers.
Key words:
cystic pancreatic tumors – serous cystadenoma – mucinous cystic neoplasm – intraductal papillary mucinous neoplasm – solid pseudopapillary tumor – diagnostics – therapy – endoscopic ultrasound – fine ‑ needle apiration biopsy
Authors:
T. Krechler 1; J. Ulrych 2; M. Dvořák 1; D. Hoskovec 2; J. Macášek 1; T. Švestka 1; J. Hořejš 3
Authors‘ workplace:
IV. interní klinika – klinika gastroenterologie a hepatologie 1. lékařské fakulty UK a VFN Praha, přednosta prof. MU Dr. Aleš Žák, DrSc.
1; I. chirurgická klinika – břišní, hrudní a úrazové chirurgie 1. lékařské fakulty UK a VFN Praha, přednosta prof. MU Dr. Zdeněk Krška, CSc.
2; Radiodiagnostická klinika 1. lékařské fakulty UK a VFN Praha, přednosta prof. MU Dr. Jan Daneš, CSc.
3
Published in:
Vnitř Lék 2013; 59(7): 572-577
Category:
Overview
Počet nově diagnostikovaných cystických nádorů pankreatu se stále zvyšuje. Souvisí to především s rozvojem nových diagnostických metod. Mezi hlavní představitele patří: serózní cystadenom, mucinózní cystická neoplazie, intraduktální papilární mucinózní neoplazie a solidní pseudopapilární tumor. Vzhledem k malignímu potenciálu těchto lézí je velmi důležitá správná indikace chirurgické léčby. Tato práce popisuje naše zkušenosti s diagnostikou a léčbou cystických nádorů pankreatu, diagnostikovaných ve Všeobecné fakultní nemocnici v Praze v období leden roku 2008 až prosinec roku 2012. U všech pacientů bylo provedeno vyšetření počítačové tomografie a endoskopické ultrasonografie, spojené s odběrem aspirační biopsie tenkou jehlou. Celkem bylo diagnostikováno 37 případů s cystickými tumory pankreatu. Z toho bylo: 19 pacientů se serózním cystadenomem, 5 s mucinózní cystickou neoplazií, 5 s mucinózním cystadenokarcinomem, 5 s intraduktální papilární mucinózní neoplazií a 3 se solidním pseudopapilárním tumorem. Ve 14 případech byli pacienti indikováni k chirurgickému řešení. U 1 pacienta byly zjištěny známky maligní transformace. Stanovení optimální strategie diagnostického a terapeutického postupu u pacientů s cystickými nádory pankreatu vyžaduje jejich diagnostiku, léčbu a další sledování v centrech s vysokými zkušenostmi, dostatečným odborným a přístrojovým vybavením.
Klíčová slova:
cystické nádory pankreatu – serózní cystadenom – mucinózní cystadenom – intraduktální papilární mucinózní neoplazie – solidní pseudopapilární tumor – diagnostika – léčba – endoskopická ultrasonografie – aspirační biopsie tenkou jehlou
Úvod
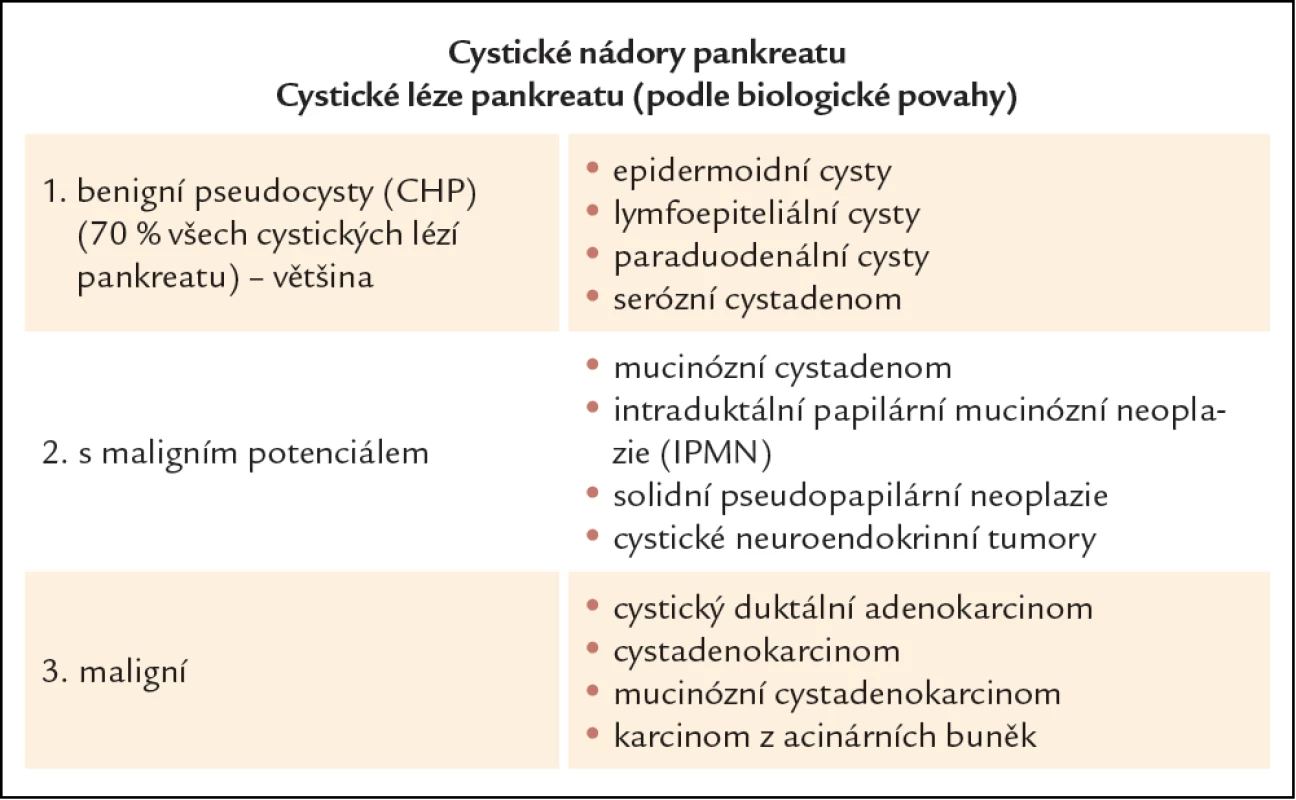
Cystické nádory pankreatu představují skupinu onemocnění pankreatu, jejichž incidence vzhledem k rozvoji moderních diagnostických zobrazovacích metod trvale vzrůstá. Velmi často se jedná o náhodné nálezy u asymptomatických pacientů. Z klinického pohledu je nutné především odlišit nálezy benigní od nálezů s možným maligním potenciálem a nádory jednoznačně maligní. Rozdělení cystických lézí pankreatu podle biologické povahy vidíme v tab. 1. Z cystických nádorů benigních s možným maligním potenciálem mají klinický význam: serózní cystadenom (SCA), mucinózní cystická neoplazie (MCN), intraduktální papilární mucinózní neoplazie (IPMN) a solidní pseudopapilární tumor (SPT). Většinu (více než 70 %) cystických lézí pankreatu tvoří pankreatické pseudocysty [1]. Pankreatické pseudocysty se velmi často objevují jako komplikace akutní pankreatitidy, dále v průběhu chronické pankreatitidy či následek nitrobřišního traumatu [2]. Diagnóza pseudocyst se opírá především o anamnézu, spojenou s celou škálou diagnostických zobrazovacích metod: abdominální ultrasonografie (USG), endoskopická ultrasonografie (EUS), počítačová tomografie (CT), magnetická rezonance (MR), často spojené s odběrem obsahu cystické léze na cytologické a biochemické vyšetření. Prostá pankreatická pseudocysta nemá biologicky maligní potenciál, ale z klinické praxe i odborné literatury jsou známy případy celé řady cystických nádorů s jednoznačným maligním potenciálem, které byly diagnostikovány jako prosté pseudocysty [3 – 6]. Pro benigní pankreatickou pseudocystu svědčí celá řada ukazatelů: předchozí břišní trauma či akutní pankreatitida, spíše solitární cysty, cystické léze bez septace se šíří stěny do 4 mm, ve více než 65 % přítomnost komunikace s pankreatickým vývodným systémem, nízká viskozita obsahu cysty s vysokým obsahem amyláz, nález zánětlivých elementů při cytologickém vyšetření obsahu cysty a při definitivním histologickém vyšetření fibrotické změny ve stěně pseudocysty. Naopak pro cystické nádory pankreatu svědčí: spíše němá traumatická anamnéza, multilokularita lézí, širší stěna, méně častá komunikace s pankreatickým vývodným systémem, vyšší viskozita sekretu a nízký obsah amyláz, maligní elementy v cytologii, vysoká hladina nádorových markerů v obsahu cystických lézí a při definitivním histologickém zpracování nález maligních či nemaligních elementů. Vzhledem k tomu, že diferenciální diagnostika cystických lézí pankreatu je poměrně složitá, vyžaduje úzké multidisciplinární propojení gastroenterologa, radiologa, cytopatologa, chirurga a onkologa.
Materiál a metodika
Do studie byli zařazeni pacienti, diagnostikovaní na IV. interní klinice 1. lékařské fakulty UK a VFN v Praze v období leden roku 2008 až prosinec roku 2012. Jednalo se o pacienty, u kterých byla vyslovena suspekce na ložiskový proces pankreatu po předchozím vyšetření (většinou transabdominální ultrasonografie či CT břicha). Na našem pracovišti bylo u všech těchto pacientů provedeno klinické vyšetření, včetně podrobného odebrání anamnézy. Důraz byl kladen na předchozí onemocnění pankreatu – akutní či chronická pankreatitida a nitrobřišní úrazy. Pečlivě byla analyzována symptomatologie, především váhový úbytek, bolesti, přítomnost ikteru a některých komorbidit (jiné cystické léze, diabetes melitus aj.). Dále byli pacienti kompletně laboratorně vyšetřeni (základní biochemické vyšetření, nádorové markery – CA 19 - 9, CEA, α1 - fetoprotein, CA 72 - 4, CA 125, NSE, gastrin, chromogranin). U všech pacientů byla provedena endoskopická ultrasonografie s odběrem obsahu cystoidu na cytologické a biochemické vyšetření (včetně nádorových markerů – CEA, α1 - fetoprotein, CA 19 - 9). Dále bylo provedeno CT vyšetření břicha s podáním kontrastní látky, v některých diagnosticky sporných případech bylo provedeno PET ‑ CT, MR, MRCP a ERCP. Všichni pacienti byli odreferování na multioborovém gastrochirurgickém semináři, který pravidelně probíhá na I. chirurgické klinice 1. lékařské fakulty UK a VFN v Praze za přítomnosti gastroenterologa, chirurga, radiologa a onkologa. Další diagnosticko‑léčebný postup byl veden dle doporučení semináře. Operační výkony byly prováděny na I. chirurgické klinice 1. lékařské fakulty UK a VFN v Praze.
Výsledky
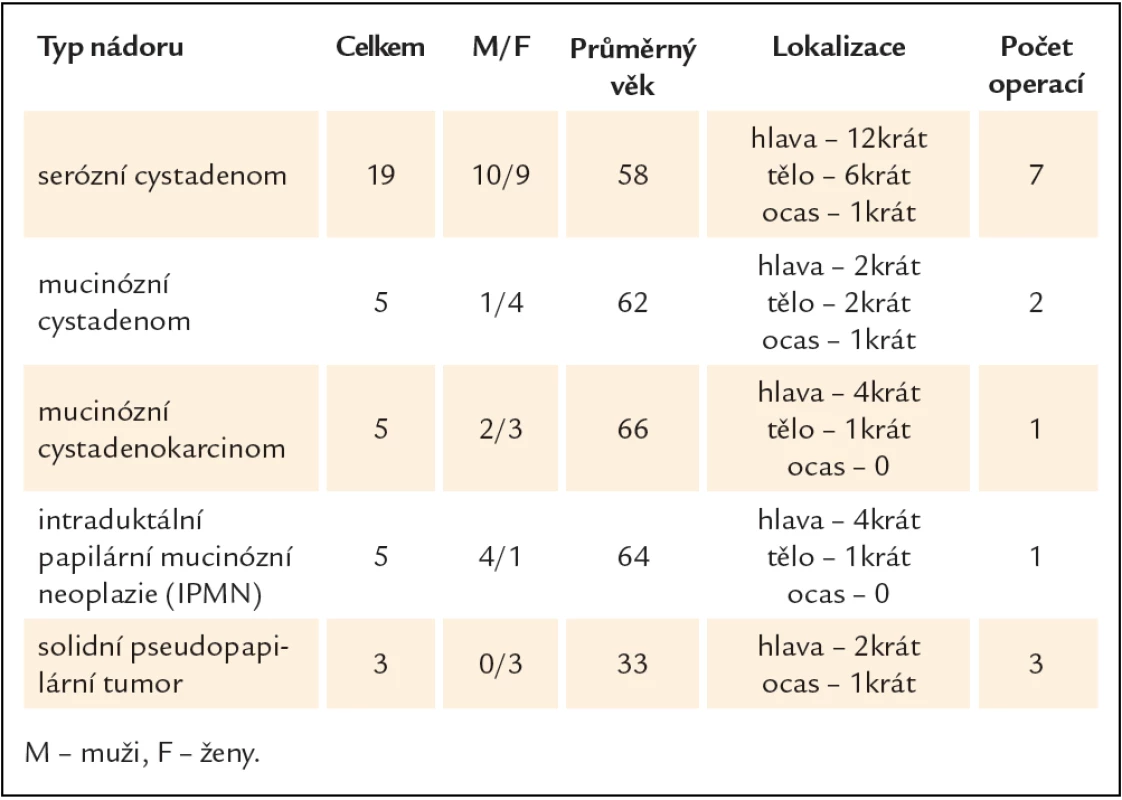
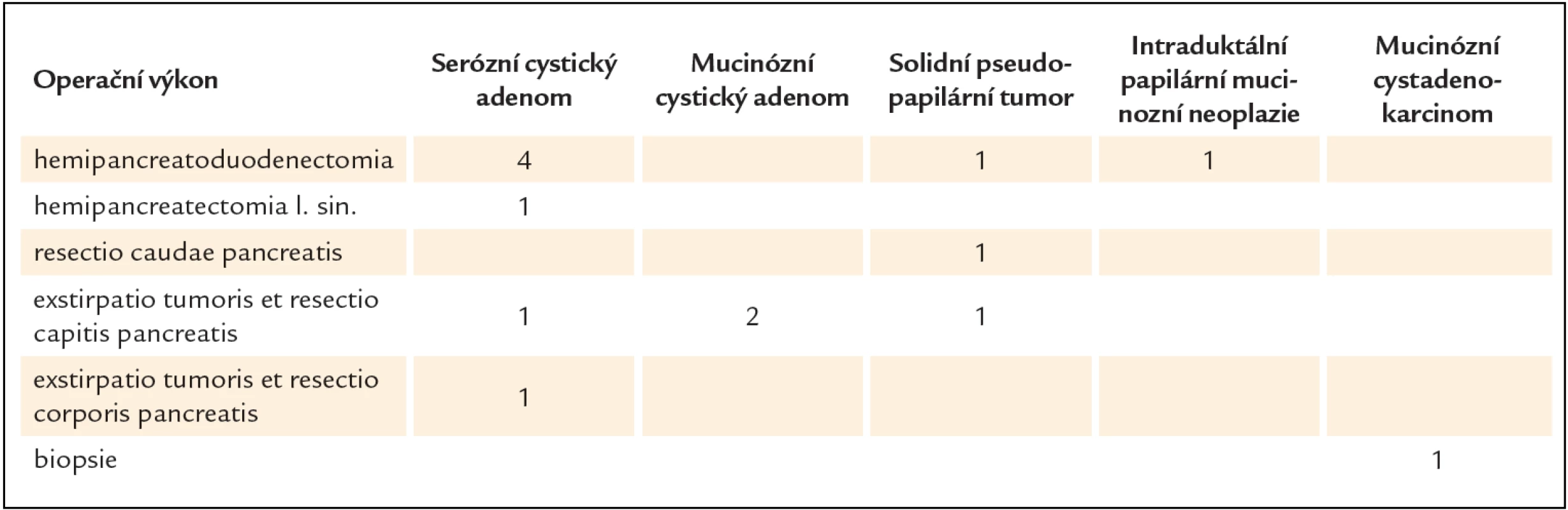
V období leden roku 2008 až prosinec roku 2012 bylo na gastroenterologickém oddělení Fakultní polikliniky IV. interní kliniky 1. lékařské fakulty UK a VFN provedeno 848 vyšetření endoskopickou ultrasonografií. Z toho bylo diagnostikováno 37 cystických nádorů pankreatu. Operovaných bylo 14 pacientů. Klinická charakteristika souboru je popsána v tab. 2. Typy provedených chirurgických výkonů jsou shrnuty v tab. 3.
Diskuze
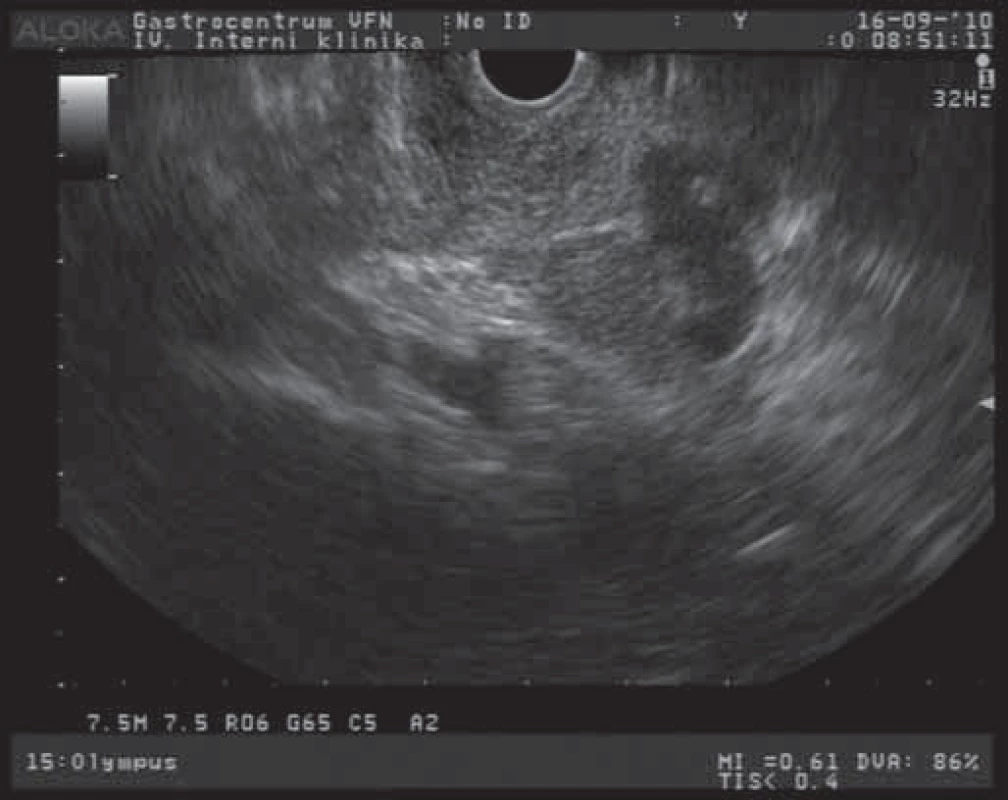
Závažnost nálezu cystických tumorů pankreatu spočívá v častých diferenciálně diagnostických obtížích při odlišení lézí s možným maligním potenciálem a ve stanovení optimální terapeutické strategie. Mezi benigní cystické léze patří především serózní cystadenom (SCA). Morfologicky jsou tyto léze charakterizovány různým množstvím většinou drobných cyst (mnohdy až houbovitého vzhledu) a vazivovými septy [7]. EUS obraz serózního cystadenomu s větším množstvím cystických projasnění a mnohočetnými septy je na obr. 1. Celková velikost lézí je většinou menší než 5 cm s mediánem velikosti 25 – 30 mm. Podle velikosti cyst rozlišujeme cystadenomy makrocystické a mikrocystické. SCA neprodukují mucin a obsahují buňky, nevykazující cytologické známky premaligních lézí. Makrocystická varianta je klinicky významnější a morfologicky obsahuje větší cysty s menším množstvím septací. Někdy je obtížné radiologicky odlišit tyto tumory od mucinózní cystické neoplazie (MCN). Maligní transformace těchto SCA se udává asi u 3 % případů [8]. SCA jsou většinou asymptomatické, v případě potíží pacienti popisují břišní bolesti a dyskomforty různého stupně, u velkých lézí mohou být přítomny příznaky obstrukce žlučových cest nebo výtokové části bulbu duodena. Velké tumory jsou někdy i hmatné. Ve většině případů jsou tyto nádory s velkou přesností diagnostikovatelné běžnými zobrazovacími metodami (transabdominální USG, CT, EUS). V těchto případech se jedná o mikrocystickou variantu s typickým voštinovitým vzhledem a mnohočetnými septacemi. U 10 – 30 % případů jsou přítomny kalcifikace v septech a centrální zjizevnatění. U makrocystických variant (s většími cystami a jen ojedinělými septy) je většinou nutné rozšířit diagnostický proces i o analýzu sekretu cystoidů a cytologické vyšetření. V terapii těchto tumorů postupujeme u asymptomatických a menších nádorů konzervativně a pacienty dlouhodobě sledujeme. Symptomatičtí pacienti s tumory většími než 4 cm jsou indikováni k chirurgické resekci. Rovněž pacienti s progresivním růstem tumoru jsou indikováni k chirurgickému řešení, i když není jednoznačně prokázán vztah dynamiky růstu k maligní transformaci [9].
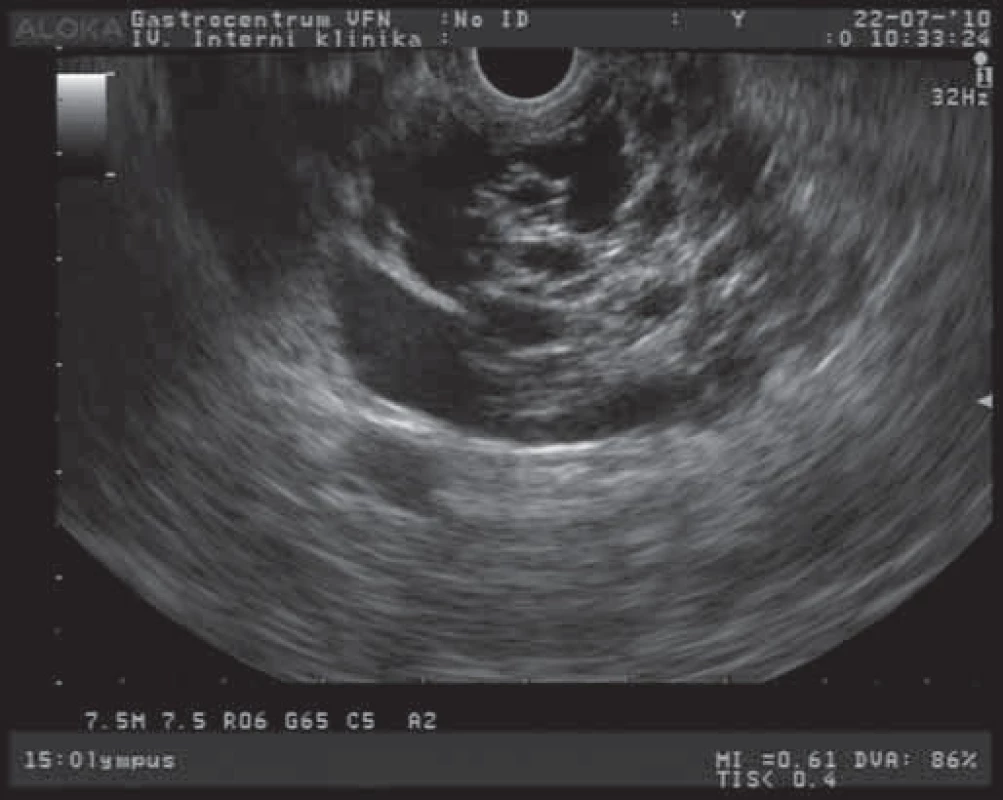
Mucinózní cystické neoplazie (MCN)jsou obvykle lokalizovány v těle a ocase pankreatu, postihují většinou ženy s průměrným věkem 40 let [10]. Jedná se o cystické léze různých velikostí (dosahující až 35 cm). Tyto léze obsahují různý počet cystoidů s širší fibrotickou stěnou [7,11]. Na obr. 2 je EUS obraz MCN zobrazený jako cystický útvar s nepravidelně rozšířenou stěnou. Nebývá popisována komunikace s pankreatickým vývodným systémem [7,11]. Obsah cystoidů je mucinózního vzhledu, ale může být i hemoragický či nekroticky změněný. Pokud tumor obsahuje větší zastoupení solidní masy, je nutno uvažovat o přítomnosti nádorových buněk s vysokým stupněm dysplazie nebo již o invaziním karcinomu [12]. V některých případech podobnosti stromální složky těchto tumorů s acinózními tumory ovarií, retroperitonea a jater jsou nazývány jako „ovarian‑like“ [7,12]. Pro symptomatologii těchto tumorů je typický různý stupeň břišního dyskomfortu či bolesti. Pokud je přítomen váhový úbytek a nechutenství, je nutno uvažovat již o maligním potenciálu nádoru. V rámci diagnostiky těchto nádorů zobrazovacími metodami (CT, EUS, MR) jsou MCN z větší části zobrazeny jako solitární cystické léze s četnými septacemi, nekomunikujícími s pankreatickým vývodným systémem. Síla stěny cystoidů a sept mají podobnou šíři [11]. Pokud jsou přítomny periferní kalcifikace, rozšířené stěny, papilární proliferace a hypervaskularizace, je nutno uvažovat o maligní transformaci léze [10]. Při aspirační biopsii získáváme u těchto lézí hyperviskózní tekutinu s vysokým obsahem mucinu a s nízkým obsahem amyláz. U pacientů s maligní transformací zjišťujeme přítomnost KRAS2 mutace (v 89 %) a zvýšené hladiny nádorových markerů (CEA, Ca 19 - 9) [14]. Velmi důležité pro další diagnostický postup je cytopatologické vyšetření buněk, odebraných většinou v rámci FNA biopsie pod EUS kontrolou z rozšířené stěny či stromální složky tumoru (obr. 2). Cystické nádory pankreatu jsou potenciální premaligní léze, které mohou ve většině případů progredovat do malignity. Proto je u všech MCN indikována chirurgická terapie (pokud nejsou jednoznačné kontraindikace) [13]. Jak ukazují případy pacientů z našeho souboru, je nutno se rozhodovat individuálně (v mnoha případech se jedná o starší pacienty s nemožností radikálního chirurgického výkonu). Chirurgická resekce u přítomného karcinomu in situ je kurabilním výkonem. V přítomnosti známek již invazivního růstu (jen asi v 1/ 3 případů) je doporučován radikální chirurgický výkon s úplným odstraněním nádorové tkáně [14]. Pokud jsou přítomny známky invazivního nádorového růstu, mohou to již být změny, spojené s přítomností mucinózního cystadenokarcinomu duktálního či tubulárního původu. U těchto případů pak je prognóza velmi špatná, srovnatelná s duktálním adenokarcinomem pankreatu.
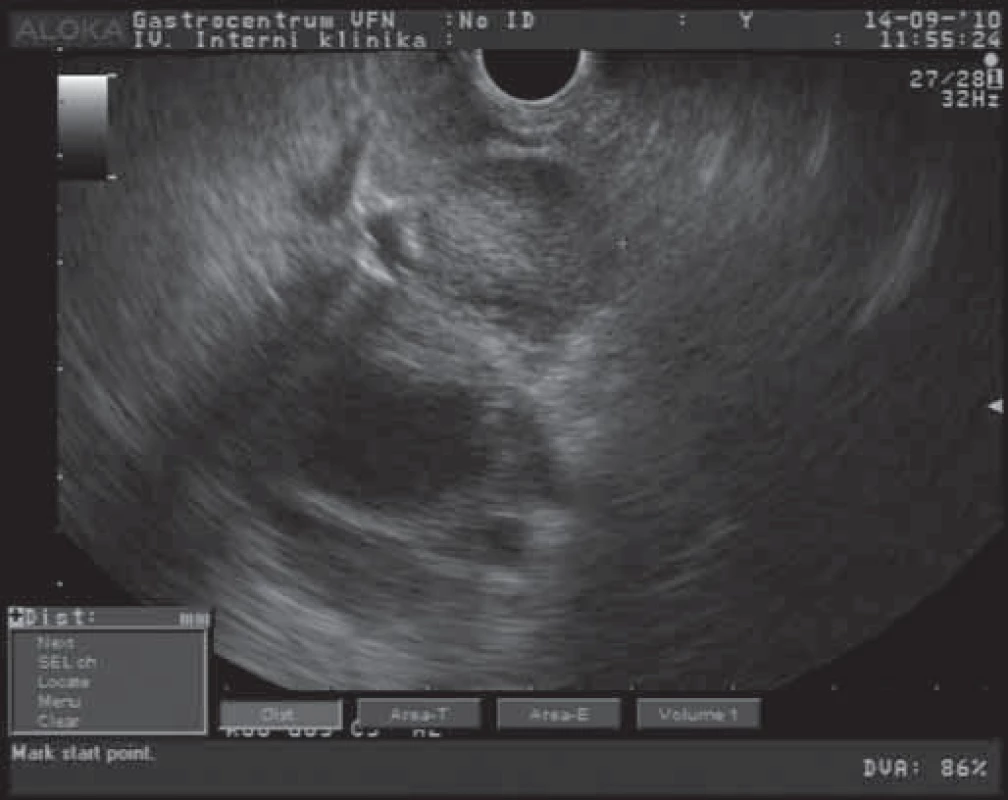
Intraduktální papilární mucinózní neoplazie (IPMN) je lokalizována především v hlavě pankreatu, ale může postihovat i celý pankreas. IPMN (na rozdíl od MCN) komunikují většinou s pankreatickým vývodným systémem, vyskytuje se převážně v hlavě pankreatu (častěji v processus uncinatus) a převažuje u starších mužských pacientů (medián 70 let). IMPN je tvořena mucin produkujícími buňkami, které jsou uspořádány do papilárních struktur v pankreatických vývodech [7]. Vzhledem k akumulaci mucinu v pankreatickém vývodném systému dochází k jeho cystické dilataci. Pozorujeme u nich četné cystoidní léze, větší než 1 cm, které obsahují buňky s různým stupněm atypií (dysplazie až carcinoma in situ). IPMN většinou postihuje hlavní pankreatický vývod – „main duct‑type“. EUS obraz s nálezem dilatovaného hlavního pankreatického vývodu s polypoidními prominencemi do lumen je na obr. 3. IPMN se ale v některých případech vyskytuje i ve vedlejších pankreatických vývodech – „branch duct-type“. Tento typ se popisuje spíše u mladších pacientů a má nižší maligní potenciál než „main duct‑type“ (nebo typ kombinovaný) [12,15]. Klinicky se IPMN projevuje bolestmi v epigastriu s častou iradiací do zad. Vzhledem k přítomnosti mucinu v pankreatickém vývodném systému je často bolest vyprovokována požitím jídla, což může vést k chybné diagnóze chronické pankreatitidy. Mezi další symptomy patří: úbytek na váze, obstrukční ikterus a teploty [16]. IPMN představuje cystický nádor s nižším maligním potenciálem než MCA. U „branch type“ se pohybuje frekvence výskytu malignit mezi 6 a 46 % (v průměru 25 % a frekvence invazivních lézí v průměru 15 %). Nicméně frekvence malignit u „main duct“ IPMN se pohybuje mezi 60 a 92 % (v průměru 70 %) [13]. Predikce délky progrese IPMN do maligních lézí není známa, uvažuje se o délce trvání léze mezi 5 a 7 lety [11,17]. Pro možný maligní potenciál IPMN svědčí: „main duct-type“, dilatace hlavního pankreatického vývodu nad 5 mm, tumory větší než 30 mm s přítomností nepravidelného ztluštění stěny až charakteru uzlíků, přítomnost ikteru, diabetes mellitus a sekrece hlenu z Vaterovy papily [18 – 24]. U asymptomatických pacientů s „branch ‑ duct type“ nádory, menšími než 3 cm je doporučováno dlouhodobé sledování [13,22,24]. Chirurgické řešení je doporučováno u všech pacientů s „main duct-type“ a kombinovanými typem IPMN. U pacientů s „branch duct-type“ IPMN se indikuje chirurgické řešení u symptomatických pacientů s většími lézemi (více než 3 cm), u lézí s rychlou progresí růstu, dilatací hlavního pankreatického vývodu nad 6 mm a při přítomnosti uzlíků ve stěně vývodu [13,25]. Pětileté přežití kurativních resekcí neinvazivních tumorů je popisováno až v 70 %, v případech invazivního růstu dosahuje 5leté přežití 40 % [17,26,27]. Mezi charakteristiky, výrazně redukující přežití pacienta, patří postižení lymfatických uzlin, vaskulární invaze a pozitivní resekční linie [26,27]. Vzhledem k tomu, že v 5 – 10 % postihuje IPMN celý pankreas, může být u těchto pacientů indikována i totální pankreatektomie [28]. V těchto případech však hraje významnou roli únosnost výkonu pro pacienta. V některých případech „branch duct - -type“ IMPN, které postihují celou žlázu, se doporučuje odstranění dominantní léze a následné další sledování [13].
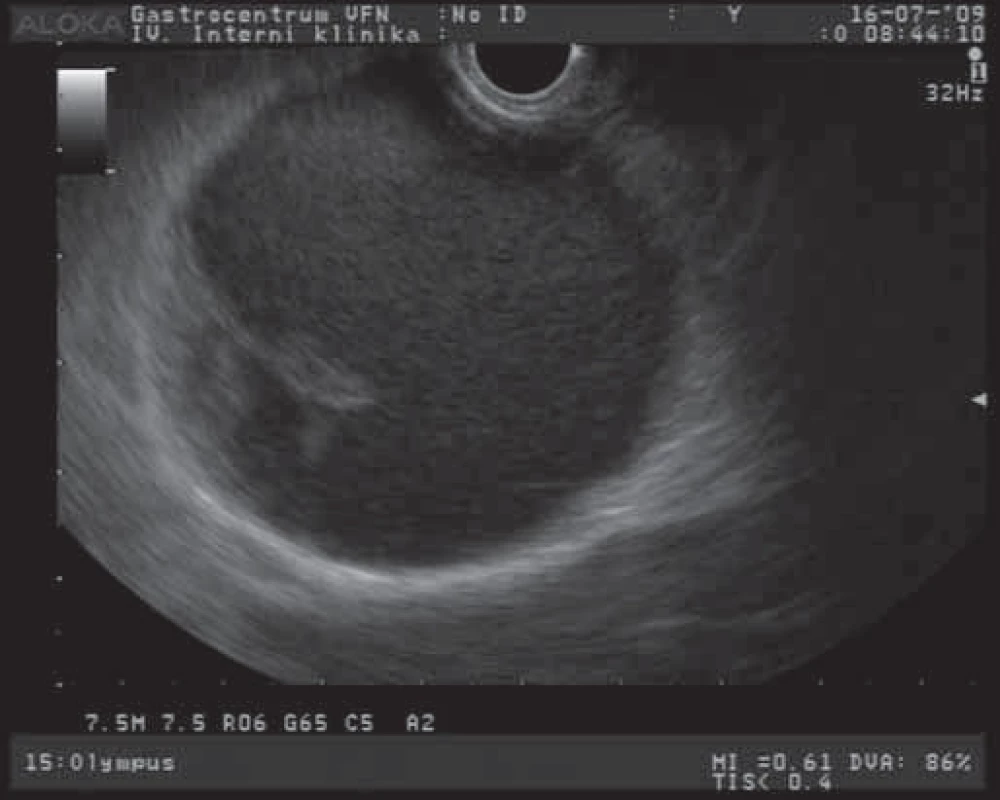
Solidní pseudopapilární tumor (SPT) je epiteliální nádor s nízkým maligním potenciálem. Tento nádor se během svého vývoje mění: začíná jako solidní nádor, který postupně prochází degenerativními procesy (nekrotizace) a mění se ve smíšenou cystickou lézi [8]. EUS obraz SPT jako objemné cystoidní léze s polypoidní prominencí do lumen je na obr. 4. Jedná se o poměrně vzácný nádor, postihující převážně mladší ženy (medián 30 let), může dosahovat velikosti až 10 cm a vyskytuje se v kterékoliv části pankreatu. Tyto větší tumory mohou mít maligní potenciál, ale histologické rysy, predikující jejich maligní potenciál, nejsou jednoznačně popsány. Jsou však popisovány jaterní, retroperitoneální a kožní metastázy těchto nádorů [7,12,28]. Klinicky se projevují bolestmi břicha, váhovým úbytkem, nechutenstvím a hmatnou rezistencí v epigastriu. Diagnóza se určí vyšetřením zobrazovacími metodami (CT, MR, EUS), kdy je možno detekovat většinou dobře ohraničenou lézi se smíšenou vnitřní strukturou (solidní a cystická složka). Tumory bývají většinou hojně vaskularizované s četnými hemoragiemi a centrálními kalcifikacemi. Více než 80 % těchto nádorů je léčeno kurativní resekcí s možnými reoperacemi pro rekurenci nádoru [29,30].
Mezi další klinicky významné cystické nádory pankreatu patří především cystický duktální adenokarcinom, který tvoří asi 1 % všech duktálních adenokarcinomů pankreatu a je způsoben cystickou degenerací solidního tumoru [31]. Centrální nekróza může vytvořit většinou unilokulární cystickou formaci, jejíž stěnu tvoří lem viabilních nádorových elementů. Poměrně vzácně vytvářejí mikrocystické formace endokrinní nádory pankreatu [32] a acinární adenokarcinom pankreatu [7].
Závěr
Pacienti s nálezem cystických útvarů pankreatu (asymptomatičtí i symptomatičtí) by měli být vyšetřeni v centru s příslušnými zkušenostmi a přístrojovým vybavením. U všech musí být provedeno vyšetření CT nebo MR. Dále se doporučuje u těchto pacientů provést vyšetření EUS (většinou současně s biopsií tenkou jehlou a odběrem cystické tekutiny) [25,33]. Z komplexu informací (klinické údaje, výsledky celé škály zobrazovacích metod, výsledky cytologické a biochemické analýzy obsahu cysty) by měla vzejít další terapeutická strategie (včetně chirurgického ošetření). Resekční chirurgický výkon se doporučuje u všech symptomatických lézí MCN, „main‑duct type“ IPMN a SPT. U „branch ‑ duct type“ IPMN je doporučováno chirurgické řešení u symptomatických pacientů s většími lézemi (více než 3 cm), u lézí s rychlou progresí růstu, dilatací hlavního pankreatického vývodu nad 6 mm a při přítomnosti uzlíků ve stěně vývodu [25]. U indikovaných případů se typ resekce odvíjí od lokalizace, stupně postižení pankreatu a samozřejmě i věku pacienta a počtem komorbidit, což může představovat značnou limitaci v počtu indikací k operačnímu výkonu, jak vyplývá i z našich zkušeností. Onkologická resekce by měla být provedena u všech lézí, podezřelých z malignity a u „main‑duct type“ IPMN, v ostatních případech se doporučují orgány šetřící resekční výkony. U asymptomatických a menších lézí (méně než 3 cm) je doporučováno trvalé sledování. Stejně by měli být sledováni pacienti, kteří podstoupili chirurgický terapeutický výkon. U pacientů s prokázaným jednoznačným maligním potenciálem lézí je indikována kombinovaná chirurgická a onkologická terapie.
Práce byla podpořena projektem: MZ ČR – RVO VFN64165.
MU Dr. Tomáš Krechler, CSc.
www.vfn.cz
e‑mail: Tomas.Krechler@vfn.cz
Doručeno do redakce: 30. 4. 2013
Sources
1. Singhal D, Kakodkar R, Sud R el al. Issues in the management of pancreatic pseudocysts. JOP 2006; 7 : 502 – 507.
2. Warshaw AL. Pancreatic cysts and pseudocysts: new rules for a new game. Br J Surg 1989; 76 : 533 – 534.
3. Yamaguchi T, Takahashi H, Kagawa R et al. Huge pseudocysts of the pancreas caused by poorly differential invasive ductal adenocarcinoma with osteoclas‑like cells: report of a case. Hepatogastroenterology 2007; 54 : 599 – 601.
4. Oehler U, Jürs M, Klöppel G et al. Osteoclast‑like giant cell tumour of the pancreas presenting as pseudocyst‑like lesion. Virchows Arch 1997; 431 : 215 – 218.
5. Jin YM, Yim H, Choi IJ et al. Pancreas serous cystadenoma mimicking pseudocyst. Yonsei Med J 1997; 38 : 63 – 65.
6. Myung SJ, Kim MN, Lee SK et al. Adenosquamous carcinoma of the pancreas: differentiation from pancreatic pseudocyst. Gastrointest Endosc 1998; 47 : 410 – 413.
7. Volkan Adsay N. Cystic lesions of the pancreas. Mod Pathol 2007; 20 (Suppl 1): S71 – S93.
8. Strobbel O, Z’graggen K, Schmitz ‑ Winnenthal FH et al. Risk of malignancy in serous cystic neoplasms of the pancreas. Digestion 2003; 68 : 24 – 33.
9. Tseng IF, Warshaw AL, Sahani DV et al. Serous cystadenoma of the pancreas: tumour growth rates and recommendations for treatment. Ann Surg 2005; 242 : 413 – 421.
10. Goh BK, Tan YM, Yap YM et al. Pancreas serous oligocystic adenomas: clinicopathologic features and a comparison with serous microcystic adenomas and mucinous cystic neoplasma. World J Surg 2006; 30 : 1553 – 1559.
11. Salvia R, Festa J, Butturini G et al. Pancreatic cystic tumours. Minerva Chir 2004; 59 : 185 – 207.
12. Campbell F, Azadeh B. Cystic neoplasms of the exocrine pancreas. Histopathology 2008; 52 : 539 – 551.
13. Tanaka M, Chari S, Adsay NV et al. International consensus guidelines for management of intraductal papillary mucinous neoplasms and mucinous cystic neoplasms of the pancreas. Pancreatology 2006; 6 : 17 – 32.
14. Singh M, Maitra A. Precursor lesions of pancreatic cancer: molecular pathology and clinical implications. Pancreatology 2007; 7 : 9 – 19.
15. Tanaka M. Intraductal papillary mucinous neoplasm of the pancreas: diagnosis and management. Pancreas 2004; 28 : 282 – 288.
16. Nagai K, Doi R, Kida A et al. Intraductal papillary mucinous neoplasms of the pancreas: clinicopathologic characteristic and long‑term follow‑up after resection. World J Surg 2008; 32 : 271 – 280.
17. Sohn TA, Yeo CI, Cameron JL et al. Intraductal papillary mucinous neoplasms of the pancreas: an updated experience. Ann Surg 2004; 239 : 788 – 799.
18. Shima Y, Mori M, Takakura N et al. Diagnosis and management of cystic pancreatic tumours with mucin production. Br J Surg 2000; 87 : 1041 – 1047.
19. Yamaguchi T, Ogawa Y, Chijiiwa K et al. Mucin‑hypersecreting tumours of the pancreas: assessing the grade of malignancy preoperatively. Am J Surg 1996; 171 : 427 – 431.
20. Traverso LW, Peralta EA, Ryan JA Jr et al. Intraductal neoplasms of the pancreas. Am J Surg 1998; 175 : 426–432.
21. Sugiyama M, Atomi Y. Intraductal papillary mucinous tumours of the pancreas: imaging studies and treatment strategies. Ann Surg 1998; 228 : 685 – 691.
22. Matsumoto M, Aramaki M, Yada K et al. Optimal management of the branch duct type intraductal papillary mucinous tumours of the pancreas. J Clin Gastroenterol 2003; 36 : 261 – 265.
23. Sugiyama M, Izumisato Y, Abe N et al. Predictive factors for malignancy in intraductal papillary ‑ mucinous tumours of the pancreas. Br J Surg 2003; 90 : 1244 – 1249.
24. Rodriguez IR, Salvia R, Crippa S et al. Branch ‑ duct intraductal papillary mucinous neoplasms: observations in 145 patients who underwent resection. Gastroenterology 2007; 133 : 72 – 79.
25. Del Chiaro M, Verbeke C, Salvia R et al. European experts consensus statement on cystic tumours of the pancreas. Dig Liver Dis 2013. In press.
26. D’Angelica M, Brennan MF, Suriawanata AA et al. Intraductal papillary mucinous neoplasms of the pancreas: an analysis of clinicopathologic features and outcome. Ann Surg 2004; 239 : 400 – 408.
27. Michaels PJ, Brachtel EF, Bounds BC et al. Intraductal papillary mucinous neoplasm of the pancreas: cytologic features predict histologic grade. Cancer 2006; 108 : 163 – 173.
28. Garcea G, Ong SL, Rajesh A et al. Cystic lesions of the pancreas. A diagnostic and management dilemma. Pancreatology 2008; 8 : 236 – 251.
29. Tipton SG, Smyrk TC, Sarr MC et al. Malignant potential of solid pseudopapillary neoplasm of the pancreas. Br J Surg 2006; 93 : 733 – 737.
30. Roggin KK, Chennat J, Oto A et al. Pancreatic cystic neoplasm. Curr Probl Surg 2010; 47 : 459 – 510.
31. Adsay NV, Andea A, Weawer DC. Cen-trally necrotic invasive ductal adenocarcinomas of the pancreas presenting clinically as macrocystic leasions. Mod Pathol 2001; 13 : 1125A.
32. Thompson NW, Eckhauser FE, Vinik AI et al. Cystic neuroendocrine neoplasms of the pancreas and liver. Ann Surg 1984; 199 : 158 – 164.
33. Repak R, Rejchrt S, Bartova J et al. Endoscopic ultrasonography (EUS) and EUS ‑ guided fine ‑ needle aspiration with cyst fluid analysis in pancreatic cystic neoplasms. Hepatogastroenterology 2009; 56 : 629 – 635.
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Internal Medicine

2013 Issue 7
-
All articles in this issue
- Onemocnění jater u diabetiků
- Účinky GLP-1 (glucagon‑like peptide 1) na játra
- Polypózy trávicího traktu
- Vrozené hyperbilirubinemie a molekulární mechanizmy žloutenky
- Cystické nádory pankreatu – naše zkušenosti
- Wilsonova choroba
- Vliv jaterní cirhózy na farmakokinetiku a farmakodynamiku léčiv
- Katetrizace jaterních žil – vybrané aspekty hodnocení
- Reaktivace chronické hepatitidy B
- Akutní pankreatitida – novinky v léčbě
- Postižení jater u nemocných s ne-Hodgkinovým lymfomem
- Léčba chronické infekce virem hepatitidy C na začátku nové éry
- Vztah bilirubinu k nemocem vyvolaným zvýšeným oxidačním stresem
- Inhibitory tyrozinových kináz – zásadní změna v prognóze chronické myeloidní leukemie
- Mnohočetný myelom
- Pokroky v léčbě chronické lymfocytární leukemie
- Myelodysplastický syndrom – pokrok v léčbě v 21. století
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue
- Vztah bilirubinu k nemocem vyvolaným zvýšeným oxidačním stresem
- Cystické nádory pankreatu – naše zkušenosti
- Onemocnění jater u diabetiků
- Akutní pankreatitida – novinky v léčbě