Reaktivace chronické hepatitidy B
Reactivation of chronic hepatitis B
Hepatitis B (HBV) is a DNA virus, which cannot be eradicated completely from the organism by treatment, only its replication can be suppressed to low levels. The pathogenesis of liver damage due to HBV is immune ‑ mediated, the infected hepatocytes represent the target structures of immune reaction. In individuals who spontaneously achieved the state of inactive carriage of the virus or even achieved HBsAg negativity, we deal only with immune control of viral replication. Chemotherapy or immunosuppressive treatment disrupt the immune control of HBV infection, the virus replication substantially increases and hepatitis B reactivates. HBV reactivation manifests as further flare‑up of chronic inflammation with rapid progression of liver cirrhosis or even as a fulminant hepatitis with liver failure. The risk of reactivation increases with degree of induced immunosuppression, the highest risk is associated with corticosteroid and rituximab therapy. HBV reactivation threatens patients during solid tumours treatment as well as haemato ‑ oncological malignancies, patients treated with immunosuppressive and biological therapies for systemic inflammatory diseases and inflammatory bowel diseases, as well as patients on maintenance haemodialysis, after kidney transplantation and patients with HBV/ HIV co ‑ infection. HBV reactivation increases both morbidity and mortality in listed groups of patients. The patients threatened by HBV reactivation can be identified easily based on HBV serological markers assessment. Preemptive therapy with nucleos(t)ide analogues significantly reduces the risk of HBV reactivation, the effect of long‑term antiviral therapy is described in detail in kidney transplant recipients in whom the 3rd generation antivirals (entecavir and tenofovir) completely obviate the negative impact of HBV on long‑term survival. In oncological patients who are treated for a determined time period, we can use lamivudine, which is not suitable for long‑term treatment due to high risk of resistance emergence.
Key words:
hepatitis B – reactivation – screening – preemptive therapy
Authors:
J. Šperl
Authors‘ workplace:
Klinika hepatogastroenterologie IKEM Praha, přednosta prof. MU Dr. Julius Špičák, CSc.
Published in:
Vnitř Lék 2013; 59(7): 591-596
Category:
Overview
Virus hepatitidy B (HBV) je DNA virus, který nelze dostupnou léčbou z organizmu eradikovat, jen udržovat replikaci na nízké úrovni. Patogeneze poškození jater vlivem chronické infekce virem hepatitidy B je imunitně zprostředkovaná, cílovou strukturou imunitní reakce jsou infikované hepatocyty. I u osob, které spontánně dosáhly stadia inaktivního nosičství viru nebo dokonce negativity HBsAg, se jedná pouze o imunitní kontrolu virové replikace. Chemoterapie nebo imunosupresivní léčba oslabí imunitní kontrolu HBV infekce, replikace viru opět excesivně naroste, hepatitida B se reaktivuje. Klinickými projevy reaktivace mohou být vzplanutí chronického zánětu s rychlým vývojem cirhózy jater nebo i fulminantní hepatitida s selháním jater. Riziko reaktivace HBV stoupá s hloubkou navozené imunosuprese, nejvyšší riziko je spojeno s léčbou kortikosteroidy a rituximabem. Reaktivace HBV ohrožuje pacienty při léčbě solidních tumorů a v hematoonkologii, pacienty při imunosupresivní a biologické léčbě systémových zánětlivých chorob a idiopatických střevních zánětů, dále pacienty hemodialyzované a po transplantaci ledviny a také pacienty s HBV a HIV koinfekcí. Reaktivace HBV zvyšuje mortalitu i morbiditu ve vyjmenovaných skupinách pacientů. Identifikovat pacienty ohrožené reaktivací HBV lze snadno na základě vyšetření sérologických markerů HBV. Preemptivní léčba nukleos(t)idovými analogy významně snižuje riziko reaktivace HBV, efekt dlouhodobé protivirové léčby je nejlépe popsán u pacientů po transplantaci ledviny, kdy podávání antivirotik III. generace (entekavir, tenofovir) zcela eliminuje negativní vliv HBV na dlouhodobé přežití pacientů. U onkologických pacientů, kdy chemoterapie má trvat jen omezenou dobu, lze k preemptivní léčbě použít lamivudin, který se nehodí k dlouhodobé léčbě pro vysoké riziko vzniku rezistence.
Klíčová slova:
hepatitida B – reaktivace – screening – preemptivní léčba
Virus hepatitidy B
Virem hepatitidy B (HBV) je celosvětově infikováno asi 350 – 400 milionů osob. Tři čtvrtiny jich žijí v tzv. endemických oblastech Asie, jižního Pacifiku, subsaharské Afriky a Středního východu. Prevalence chronické HBV infekce v ČR je podle údajů z roku 2001 nízká, jen 0,56 % HBsAg pozitivních osob, ale 6 % anti‑HBc pozitivních. HBV infekce se přenáší parenterální cestou. Přenos je perinatální, transkutánní a sexuální. HBV si udržuje virulenci po dlouhou dobu i mimo organizmus. Virus hepatitidy B patří mezi hepadnaviridae. HBV DNA tvoří cirkulární, parciálně dvojitá DNA, složená z přibližně 3 200 párů bází. Ve virovém genomu lze identifikovat 4 zčásti se překrývající otevřené čtecí rámce, kódující povrchový (surface) protein (pre‑S/ S), vnitřní (core) protein (precore/ core), polymerázu a X ‑ protein. Pre‑S/ S otevřený čtecí rámec kóduje 3 varianty povrchového glykoproteinu (HBs antigenu), small (S), middle (M) a large (L). Translací precore/ core otevřeného čtecího rámce vzniká precore polypeptid, který se v posttranslační úpravě štěpí na nukleokapsidový, vnitřní protein (HBc antigen) a na sekreční, nestrukturální protein (HBe antigen). Virus hepatitidy B je klasifikován do 8 genotypů (A – H) podle sekvence genomu, jednotlivé genotypy mají odlišnou geografickou distribuci. Genotyp A se vyskytuje nejvíce v Severní Americe, severní Evropě, Indii a Africe. Genotypy B a C v Asii, genotyp Dv jižní Evropě, na Středním východě a v Indii, genotyp E v západní a v jižní Africe, genotyp F v Jižní a ve Střední Americe a genotyp G v USA a Evropě. Replikační cyklus HBV začíná vazbou HBV k hepatocytu. V jádru hepatocytu se dokončí syntéza plus vlákna HBV DNA, čímž je virový genom konvertován do molekuly podobné plazmidu nazývané cccDNA (covalently closed circular DNA) [1]. Molekula cccDNA je templátem pro syntézu pregenomické RNA, která je transkribována do minus vlákna HBV ‑ DNA. V průběhu replikační fáze HBV infekce se v infikovaných hepatocytech syntetizuje a vylučuje velké množství HBs antigenu a HBe antigenu, protilátky anti‑HBs a anti‑HBe jsou vyvázány v imunokomplexech a nejsou prokazatelné. Virus hepatitidy B není cytopatogenní, poškození hepatocytů je zprostředkováno imunitními mechanizmy.
Mechanizmus reaktivace HBV
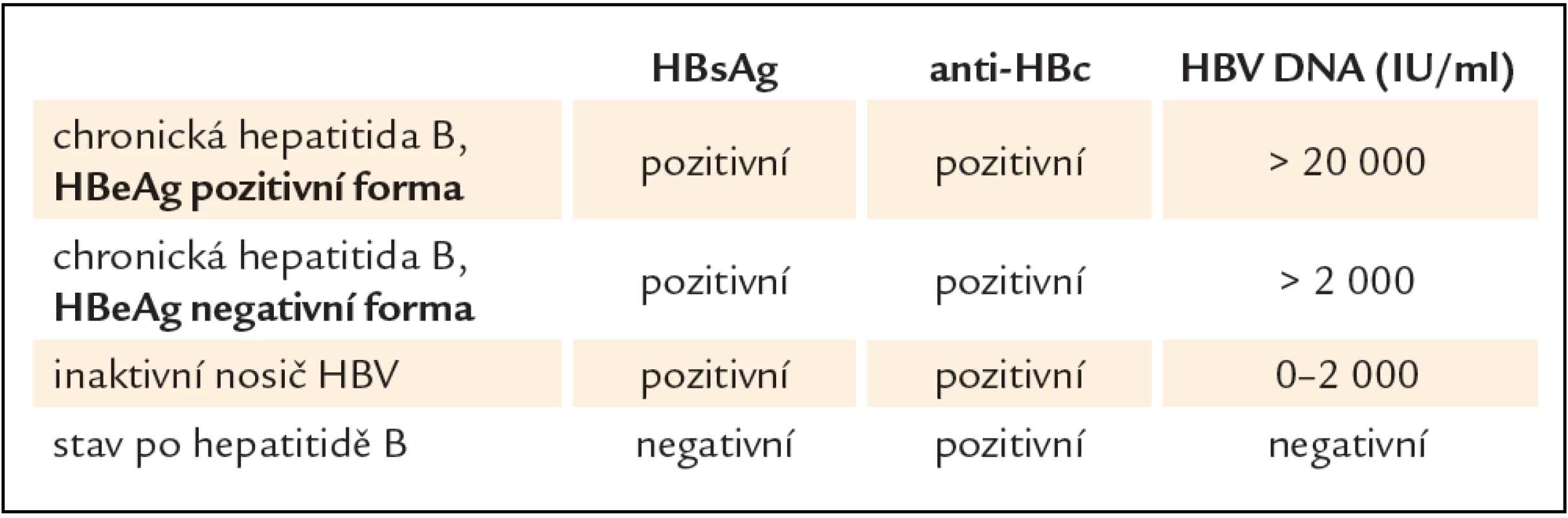
Chronická hepatitida B je morfologicky charakterizována jako nekroticko‑zánětlivý proces s následnou fibrotizací a přestavbou jater a je výsledkem imunitně zprostředkovaných pochodů. Cílovými strukturami, proti kterým se buněčná imunitní reakce obrací, jsou virové antigeny v komplexu s HLA I antigeny na membránách infikovaných hepatocytů. Imunosupresivní léčba oslabí cytotoxickou imunitní reakci namířenou proti infikovaným hepatocytům, oslabí ale také intracelulární mechanizmy vrozené imunity, které kontrolují úroveň replikace viru. Replikace HBV v hepatocytech při imunosupresi se zvyšuje, zvyšuje se podíl infikovaných hepatocytů v játrech. Virová nálož v hepatocytech může dosáhnout úrovně, kdy již vede k přímému poškození infikovaných hepatocytů, virus hepatitidy B se tím stává cytopatogenní. Klinickým obrazem popsaných pochodů je rozvoj vzplanutí chronické hepatitidy („flare‑up“), v krajním případě i fulminantní hepatitida se selháním jater, t.j. reaktivace hepatitidy. Imunosupresivní léčba může vést k výraznému nárůstu viremie a vzplanutí hepatitidy u nejen u neléčeného pacienta s chronickou hepatitidou B, který má prokazatelnou viremii, ale i u dosud inaktivního nosiče viru (HBsAg pozitivního), který má velmi nízkou či neprokazatelnou viremii. Reaktivací hepatitidy B jsou ohroženi i lidé, kteří v minulosti prodělali infekci virem hepatitidy B, jsou již HBsAg negativní, lze je identifikovat pouze podle pozitivity protilátek proti core antigenu viru, anti‑HBc. Současná data založená na výsledcích molekulárně biologických metod dokládají, že k úplné eliminaci viru hepatitidy B z jater nikdy nedojde. V játrech doživotně perzistuje zmíněná molekula cccDNA [2]. Při imunosupresivní léčbě se může HBsAg u osob, které HBV infekci „prodělaly“, stát znovu pozitivním (reverze), a pak následuje reaktivace HBV (tab. 1).
Zásadním bodem, který modifikuje průběh onemocnění jater při chronické HBV infekci u osob léčených imunosupresivy, je zvýšení úrovně replikace viru, zvýšení virové nálože v hepatocytech. Výsledkem je vzplanutí zánětu, zrychlení procesu fibrózy jater, rozvoje cirhózy [3] a jejích komplikací a vznik hepatocelulárního karcinomu [4]. Incidence hepatocelulárního karcinomu u imunosuprimovaných osob je vyšší než v běžné populaci, a to zejména u osob s chronickou HBV infekcí. Dalším možným mechanizmem v poškození jater virem hepatitidy B při imunosupresi je přímá toxicita virových proteinů intracelulárně. Tímto způsobem se vysvětluje méně obvyklá, ale nebezpečná forma reaktivace HBV, tzv. fibrotizující cholestatická hepatitida [5]. Třetím mechanizmem, kdy imunosupresiva mohou poškodit játra, je náhlé ukončení jejich podávání. Imunosupresiva oslabují cytotoxickou reakci HBV ‑ specifických T‑lymfocytů, která je namířena proti infikovaným hepatocytům. Po vysazení imunosupresiv se cytotoxická reakce vedoucí k nekróze či apoptóze hepatocytů obnoví a přestřelí (rebound fenomén). Po vysazení imunosuprese se tak může rozvinout fulminantní hepatitida se selháním jater. Dalším důsledkem oslabené cytotoxické reakce proti infikovaným hepatocytům je vysoká pravděpodobnost přechodu do chronicity u osob, které HBV infekci akvírovaly při imunosupresivní léčbě [6].
Klinický obraz a výskyt
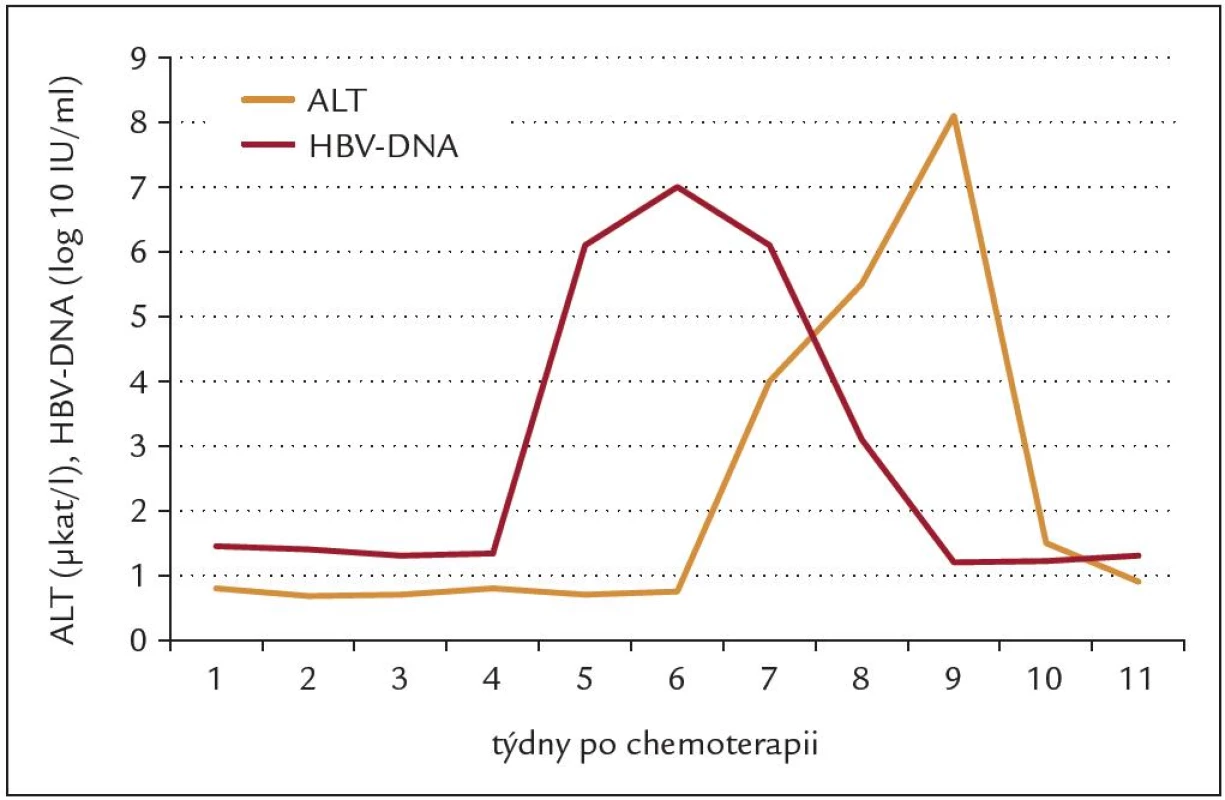
Reaktivace hepatitidy B je obvykle definována jako opětná pozitivita viremie u inaktivního nosiče nebo její vzestup o více než 1 log (nebo o 20 000 IU/ ml) u pacienta s aktivní chronickou hepatitidou. U osob s pouhou anti‑HBc pozitivitou výše popsaným pochodům musí ještě předcházet reverze HBsAg. Po vzestupu viremie následuje vzplanutí zánětu, které se projeví vzestupem aktivity ALT v séru. Tíže vzplanutí hepatitidy je definována výší ALT, mírné do 3násobku normy, střední mezi 3násobkem a 10násobkem, vyšší aktivita ALT znamená těžké vzplanutí hepatitidy [7]. Průběh reaktivace HBV při cyklické chemoterapii tumoru plic je znázorněn na obr. 1, nejprve nastává excesivní vzestup viremie, které byla před chemoterapií na hranici detekce, vzestup ALT se opožďuje. Úprava nastává ve stejném pořadí, nejprve klesá viremie, později ALT. Aktivita ALT může být vysoká ještě po poklesu viremie, což může vést k mylné diagnóze lékové toxicity (obr. 1). U pacientů léčených imunosupresivy při reaktivaci HBV trvale stoupá viremie i ALT, k poklesu ale spontánně nedochází. Klinický obraz reaktivace HBV byl popsán již před 20 lety, reaktivace HBV nastala při léčbě maligního lymfomu u 3/ 4 HBsAg pozitivních pacientů, u 2/ 4 se jednalo jen o asymptomatické zvýšení ALT, u 1/ 4 se projevila jako akutní hepatitida s ikterem, jen u 4 pacientů ze 100 se jednalo o fulminantní hepatitidu s letálním zakončením [8]. Spontánní reaktivace HBV jsou u Evropanů raritní, resp. velmi obtížně se odlišují od akutní hepatitidy B,výskyt spontánních reaktivací není proto u naší populace přesně popsán. Většina publikovaných dat o reaktivacích HBV se týká reaktivací po chemoterapii nebo po imunosupresivech. Z hlediska dalšího popisu je vhodné se zvlášť zabývat reaktivací HBV:
- při léčbě solidních tumorů a v hematoonkologii,
- při imunosupresivní a biologické léčbě systémových zánětlivých chorob a idiopatických střevních zánětů,
- u pacientů hemodialyzovaných a po transplantaci ledviny,
- u pacientů s HIV koinfekcí.
Jak bude dále popsáno, pacienti ohrožení rizikem reaktivace HBV by měli současně s chemoterapií nebo imunosupresí dostávat preemptivní léčbu antivirotiky, které reaktivaci zabrání. Základním předpokladem pro správný výběr pacientů k preemptivní léčbě antivirotiky je vyšetření sérologických markerů hepatitidy B před zahájením chemoterapie či imunosuprese. V doporučených postupech Evropské asociace pro studium jater [9] je vyšetření sérologických markerů HBV u všech kandidátů chemoterapie či imunosupresivní léčby považováno za racionální, takový přístup byl převzat i do doporučených postupů České hepatologické společnosti. V doporučeném postupu Americké asociace pro studium chorob jater je vyšetření sérologických markerů HBV doporučeno pouze u rizikových skupin osob z hlediska výskytu HBV infekce [10]. Za rizikové skupiny se považují zejména intravenózní uživatelé drog, osoby s tetováží, sexuálně promiskuitní osoby heterosexuální i homosexuální orientace a cizinci pocházející z endemických oblastí. Asociace amerických klinických onkologů bohužel zatím zahrnula do svých doporučení pouze vyšetření HBsAg u rizikových osob.
Prevence reaktivace
Preemptivní léčba nukelos(t)idovými analogy je v současné době doporučena u všech HBsAg pozitivních pacientů podstupujících chemoterapii nebo imunosupresivní léčbu bez ohledu na to, jaké cystostatikum nebo imunosupresivum je podáváno. Prvním antivirotikem v léčbě chronické HBV infekce byl lamivudin, byl i prvním lékem v léčbě a v prevenci rekurence HBV. V systematickém přehledu je doloženo, že preemptivní podávání lamivudinu snižuje výskyt reaktivací HBV během chemoterapie ‑ imunosuprese 4 – 7krát, tolerance lamivudinu byla i v této indikaci vynikající. Lau et al ve své studii doložili užitečnost preemptivního podávání lamivudinu u onkologických pacientů proti zahajování léčby lamivudinem až při prvních známkách reaktivace HBV [11]. Většina dat dokládajících přínos preemptivní léčby antivirotiky je podložena údaji o lamivudinu [12], vývoj ale ukázal, že lamivudin má vysokou frekvenci vzniku rezistentních mutací a v současných doporučeních je nahrazován entekavirem a tenofovirem. Preemptivní léčbu mají dostávat i vybrané skupiny pacientů HBsAg negativních jen s izolovanou anti‑HBc pozitivitou, jedná se o pacienty léčené rituximabem nebo pacienty podstupující transplantaci kostní dřeně [13]. Preemptivní léčba u onkologických pacientů má být zahájena nejméně týden před podáním chemoterapie a ukončena 6 – 12 měsíců po ukončení chemoterapie. Preemptivní léčba se ale ukončuje jen u pacientů, kteří byli před zahájením chemoterapie inaktivními nosiči HBV, s velmi nízkou nebo negativní viremií [14]. Doporučení Evropské asociace pro studium jater ohledně prevence a léčby reaktivace HBV jsou shrnuta v tab. 2.

Pacienti léčení chemoterapií pro tumory
Riziko reaktivace HBV u HBsAg pozitivních pacientů léčených chemoterapií pro hematologické malignity se pohybuje mezi 33 a 67 %. Riziko reaktivace je významně vyšší při léčbě režimy obsahujícími rituximab a kortikosteroidy. Yeo et al [15] popsali riziko reaktivace mezi 6,9 % u gastrointestinálních tumorů a 41 % u plicních tumorů, riziko se zvyšovalo při použití režimů s kortikosteroidy a s antracykliny, které se hojně používají i v hematoonkologii. Předložená data napovídají, že riziko reaktivace spíše souvisí s použitými léky a s navozenou hloubkou imunosuprese, než s typem tumoru. Postupně byly identifikovány další negativní prognostické faktory, kterými jsou vysoká viremie (HBV DNA) před léčbou, mužské pohlaví a vysoká hodnota ALT. Výrazně negativní průběh měli pacienti, u kterých se reaktivace HBV projevila ikterem, a došlo k přerušení onkologické léčby [16].
Zcela ojedinělým řešením reaktivace HBV s fulminantním selháním jater může být urgentní transplantace jater. Transplantace jater musí ale zůstat metodou jen pro omezený okruh pacientů, kteří v době reaktivace mají dobrou prognózu svého onkologického onemocnění. Úspěšná léčba reaktivace HBV transplantací jater byla popsána u několika pacientů léčených pro maligní lymfomy rituximabem, reaktivace nastala pozdně, až v době, kdy bylo dosaženo remise lymfomu. Pacienti po transplantaci žijí již 3 – 5 let a nedošlo u nich k rekurenci tumoru.
Pacienti se systémovými zánětlivými chorobami
Tato skupina zahrnuje pacienty léčené pro idiopatické střevní záněty, revmatoidní artritidu a pacienty s psoriázou, reaktivace HBV u nich může nastat jak po klasické léčbě (kortikoidy, metotrexat, azatioprin), tak po tzv. biologické léčbě preparáty s anti‑TNFα aktivitou. Reaktivace HBV byla opakovaně popsána po infliximabu a adalimumabu a zcela ojediněle po etanerceptu. Odlišný efekt jednotlivých preparátů s anti‑TNFα aktivitou na průběh chronické hepatitidy B se vysvětluje jejich rozdílným mechanizmem účinku. Infliximab je chimérická monoklonální protilátka složená z humánního konstantního a myšího variabilního fragmentu, podíl humánní složky je asi 66 %. Infliximab neutralizuje solubilní i na membránách navázané molekuly TNFα. Buňky nesoucí navázaný infliximab jsou pak destruovány vazbou komplementu nebo cytotoxickými lymfocyty. Adalimumab je též monoklonální IgG protilátka, na rozdíl od předchozí plně humánní. Též neutralizuje solubilní i membránové molekuly TNFα a identickými mechanizmy vede k destrukci buněk nesoucích TNFα na povrchu. Etanercept je rekombinantní, kovalentně vázaný dimer solubilních TNF receptorů (p75 TNF‑R) fúzovaný s Fc fragmentem lidského IgG1. Váže se pouze na cirkulující, nikoliv na membránové TNFα molekuly. Infliximab, který se podává v měsíčních intervalech ve vysokých dávkách, má tzv. „cytokine washout effect“, zatímco etanercept podobný efekt nemá. Infliximab negativně ovlivňuje produkci cytokinů CD4+ a CD8+ T‑lymfocyty včetně produkce IFN γ, zatímco etanercept produkci IFN γ zvyšuje. Po ukončení léčby infliximabem dochází k restituci počtu i funkce makrofágů. Restituce CD+ T‑lymfocytů může vyvolat rebound fenoménem „flare‑up“ chronické hepatitidy B i několik měsíců po ukončení léčby infliximabem.
Recentní studie identifikovala faktory predikující nepříznivý průběh (fulminantní hepatitida a úmrtí) reaktivace HBV u pacientů léčených preparáty s anti‑TNFα aktivitou. Jedná se o asijský původ, přítomnost nespecifického zánětu střevního, současnou léčbu azatioprinem. Dalšími nepříznivými faktory byly pozdní diagnostika reaktivace HBV a léčba lamivudinem ve srovnání s léčbou entekavirem nebo tenofovirem [17].
Pacienti hemodialyzovaní a po transplantaci ledviny
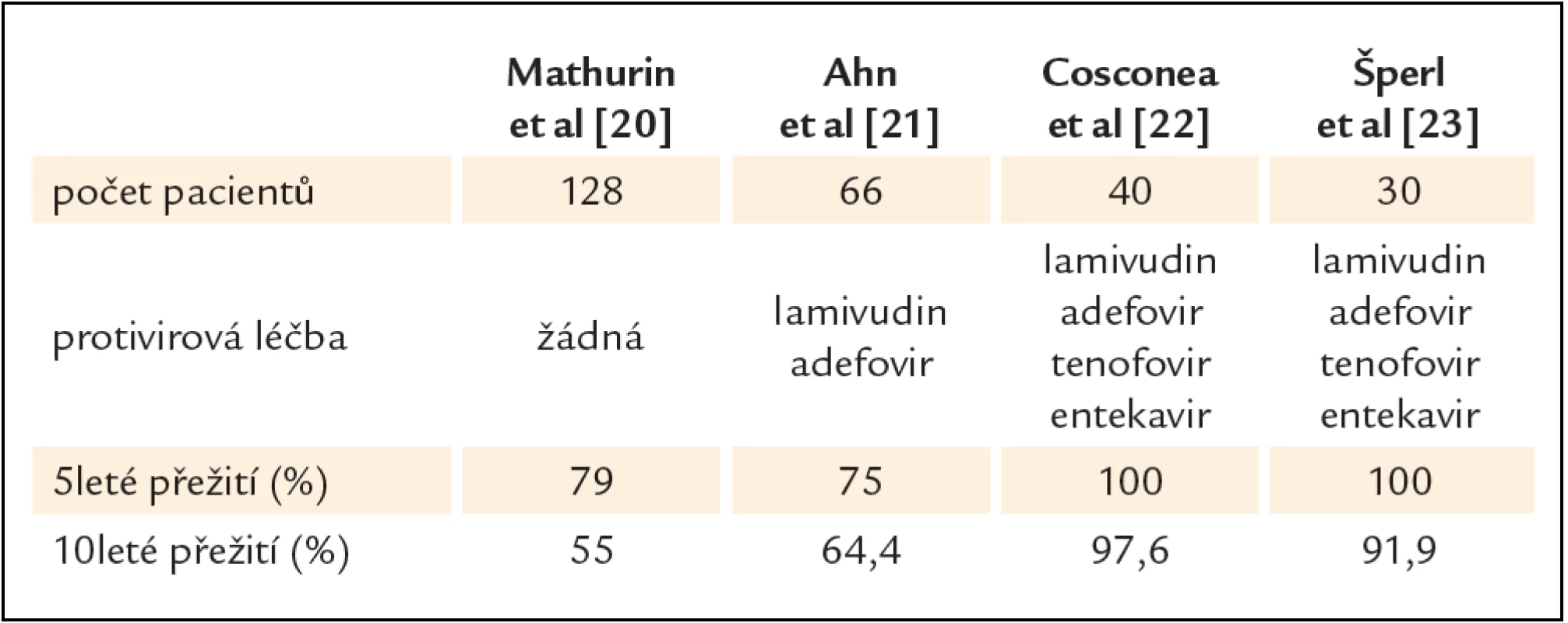
Hemodialyzovaní pacienti i pacienti s transplantovanou ledvinou se od předchozích skupin určitým způsobem liší. Jednak jsou naprosto všichni pravidelně vyšetřováni na markery HBV, jednak jsou dlouhodobě sledováni na jednom pracovišti a jsou k dispozici data jejich dlouhodobého sledování a efektu dlouhodobé léčby antivirotiky [18,19]. Pacienti po transplantaci ledviny proto představují modelovou skupinu pacientů, kteří imunosupresiva i antivirotika užívají dlouhodobě. Na velké skupině pacientů po transplantaci ledviny prokázali Mathurin et al [20] negativní vliv HBV infekce na dlouhodobé přežití. Desetileté přežití pacientů po transplantaci ledviny s HBV infekcí bylo významně horší (58 %) oproti pacientům bez HBV infekce (82 %), nárůst mortality ve skupině s HBV infekcí byl způsoben nárůstem mortality na jaterní choroby. Jedná se o historická data, neboť studie se uskutečnila v době, kdy ještě nebyl ani lamivudin v klinické praxi a nikdo z pacientů nedostával antivirotika. V dalších studiích, které dokládají příznivý efekt dlouhodobé léčby antivirotiky u pacientů s HBV po transplantaci ledviny, též vyplynul přesvědčivý doklad o nevhodnosti lamivudinu k dlouhodobé léčbě [21 – 23]. Lamivudin a adefovir, antivirotika s vysokým rizikem vzniku rezistence, přinesly pacientům po transplantaci ledviny jen mírné zlepšení přežití, zato v souborech, kde pacienti dostávali i antivirotika s vysokou rezistenční bariérou, entekavir a tenofovir, se přežití pacientů s HBV infekcí a bez infekce významně nelišilo (tab. 3).
Protivirová léčba má být zahajována již u hemodialyzovaných pacientů. U pacientů s chronickou hepatitidou Bs vysokou viremií ihned při stanovení diagnózy, u pacientů s nízkou viremií a inaktivních nosičů v době zařazení do čekací listiny k transplantaci. Léčba se má zahajovat entekavirem u pacientů dosud neléčených nebo tenofovirem u pacientů, kteří již mají prokázanou rezistenci na lamivudin. Viremie musí být kontrolována ve 3 – 6měsíčních intervalech do transplantace i po transplantaci.
Pacienti s koinfekcí HBV a HIV
Volba léčebného schématu pro pacienta s koinfekcí HBV a HIV závisí na aktuálním stavu replikace obou virů, současná doporučení lze jen obtížně zkrátit a zjednodušit. U HBsAg pozitivního pacienta by měl být do léčebného režimu první volby zařazen tenofovir v kombinaci s lamivudinem nebo s emtricitabinem. Kombinace s tenofovirem je vysoce účinná i u pacientů s HIV koinfekcí, vyplývá to z poklesu mortality na jaterní choroby u pacientů léčených ART. Po dlouhodobé léčbě kombinací s tenofovirem může u pacientů s HIV koinfekcí dojít k vymizení HBsAg. Vysazení tenofoviru naopak pro pacienta s HIV koinfekcí představuje riziko těžkého vzplanutí hepatitidy [24 – 26].
Závěr
Reaktivace HBV je komplikace chemoterapie nebo imunosupresivní léčby, která díky nízké prevalenci HBV infekce ohrožuje v naší zemi relativně malý počet léčených osob. Na druhou stranu může vést až k rozvoji fulminantního selhání jater s fatálním koncem. Pacienty ohrožené reaktivací HBV lze snadno odhalit sérologickým vyšetřením před léčbou a preemptivní léčbou antivirotiky reaktivaci HBV zabránit.
MU Dr. Jan Šperl, CSc.
www.ikem.cz
e‑mail: jase@medicon.cz
Doručeno do redakce: 6. 5. 2013
Sources
1. Werle ‑ Lapostolle B, Bowden S, Locarnini Set al. Persistence of cccDNA during the natural history of chronic hepatitis B and decline during adefovir dipivoxil therapy. Gastroenterology 2004; 126 : 1750 – 1758.
2. Hui CK, Bowden S, Jackson K et al. Clinical significance of intrahepatic hepatitis B virus covalently closed circular DNA in chronic hepatitis B patients who received cytotoxic chemotherapy. Blood 2005; 105 : 2616 – 2617.
3. Iloeje UH, Yang HI, Su J et al. Predicting cirrhosis risk based on the level of circulating hepatitis B viral load. Gastroenterology 2006; 130 : 678 – 686.
4. Kremsdorf D, Soussan P, Paterlini‑Brechot P et al. Hepatitis B virus‑related hepatocellular carcinoma: paradigms for viral‑related human carcinogenesis. Oncogene 2006; 25 : 3823 – 3833.
5. Lau JY, Bain VG, Davies SE et al. High‑level expression of hepatitis B viral antigens in fibrosing cholestatic hepatitis. Gastroenterology 1992; 102 : 956 – 962.
6. Marcucci F, Mele A, Spada E et al. High prevalence of hepatitis B virus infection in B ‑ cell non‑Hodgkinʼs lymphoma. Haematologica 2006; 91 : 554 – 557.
7. Hoofnagle JH. Reactivation of hepatitis B. Hepatology 2009; 49 (Suppl 5): S156 – S165.
8. Lok AS, Liang RH, Chiu EK et al. Reactivation of hepatitis B virus replication in patients receiving cytotoxic therapy. Report of a prospective study. Gastroenterology 1991; 100 : 182 – 188.
9. European Association For the Study of the Liver. EASL clinical practice guidelines: management of chronic hepatitis B virus infection. J Hepatol 2012; 57 : 167 – 185.
10. Lok AS, McMahon BJ. Chronic hepatitis B: update 2009. Hepatology 2009; 50 : 661 – 662.
11. Lau GK, Yiu HH, Fong DY et al. Early is superior to deferred preemptive lamivudine therapy for hepatitis B patients undergoing chemotherapy. Gastroenterology 2003; 125 : 1742 – 1749.
12. Martyak LA, Taqavi E, Saab S. Lamivudine prophylaxis is effective in reducing hepatitis B reactivation and reactivation‑related mortality in chemotherapy patients: a meta‑analysis. Liver Int 2008; 28 : 28 – 38.
13. Lau GK, Leung YH, Fong DY et al. High hepatitis B virus (HBV) DNA viral load as the most important risk factor for HBV reactivation in patients positive for HBV surface antigen undergoing autologous hematopoietic cell transplantation. Blood 2002; 99 : 2324 – 2330.
14. Terrier B, Pol S, Thibault V et al. Management of the risk of hepatitis B virus reactivation in patients receiving immunosuppressive and immunomodulatory agents in internal medicine: data from the REACTI ‑ B survey and proposal for a management algorithm. Rev Med Interne 2012; 33 : 4 – 12.
15. Yeo W, Zee B, Zhong S et al. Comprehensive analysis of risk factors associating with Hepatitis B virus (HBV) reactivation in cancer patients undergoing cytotoxic chemotherapy. Br J Cancer 2004; 90 : 1306 – 1311.
16. Loomba R, Rowley A, Wesley R et al. Systematic review: the effect of preventive lamivudine on hepatitis B reactivation during chemotherapy. Ann Intern Med 2008; 148 : 519 – 528.
17. Esteve M, Saro C, Gonzalez ‑ Huix F et al. Chronic hepatitis B reactivation following infliximab therapy in Crohnʼs disease patients: need for primary prophylaxis. Gut 2004; 53 : 1363 – 1365.
18. Berger A, Preiser W, Kachel HG et al. HBV reactivation after kidney transplantation. J Clin Virol 2005; 32 : 162 – 165.
19. Vallet ‑ Pichard A, Fontaine H, Mallet V et al.Viral hepatitis in solid organ transplantation other than liver. J Hepatol 2011; 55 : 474 – 482.
20. Mathurin P, Mouquet C, Poynard T et al. Impact of hepatitis B and C virus on kidney transplantation outcome. Hepatology 1999; 29 : 257 – 263.
21. Ahn HJ, Kim MS, Kim YS et al. Clinical out-come of renal transplantation in patients with positive pre‑transplant hepatitis B surface antigen. J Med Virol 2007; 79 : 1655 – 1663.
22. Cosconea S, Fontaine H, Meritet JF et al. Benefits associated with antiviral treatment in kidney allograft recipients with chronic hepatitis B virus infection. J Hepatol 2012; 57 : 55 – 60.
23. Sperl J, Frankova S, Spicak J et al. Further evidence of the benefits associated with antiviral treatment in kidney allograft recipients with chronic hepatitis B virus infection. J Hepatol 2013; 58 : 833 – 835.
24. Piroth L, Mahy S, Pol S et al. Current management and recommendations on hepatitis B therapy in HIV ‑ coinfected patients. Hepatol Int 2011. In press.
25. Konopnicki D, Mocroft A, de Wit S et al. Hepatitis B and HIV: prevalence, AIDS progression, response to highly active antiretroviral therapy and increased mortality in the EuroSIDA cohort. AIDS 2005; 19 : 593 – 601.
26. Soriano V, Puoti M, Bonacini M et al. Care of patients with chronic hepatitis B and HIV co ‑ infection: recommendations from an HIV ‑ HBV International Panel. AIDS 2005; 19 : 221 – 240.
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Internal Medicine

2013 Issue 7
-
All articles in this issue
- Onemocnění jater u diabetiků
- Účinky GLP-1 (glucagon‑like peptide 1) na játra
- Polypózy trávicího traktu
- Vrozené hyperbilirubinemie a molekulární mechanizmy žloutenky
- Cystické nádory pankreatu – naše zkušenosti
- Wilsonova choroba
- Vliv jaterní cirhózy na farmakokinetiku a farmakodynamiku léčiv
- Katetrizace jaterních žil – vybrané aspekty hodnocení
- Reaktivace chronické hepatitidy B
- Akutní pankreatitida – novinky v léčbě
- Postižení jater u nemocných s ne-Hodgkinovým lymfomem
- Léčba chronické infekce virem hepatitidy C na začátku nové éry
- Vztah bilirubinu k nemocem vyvolaným zvýšeným oxidačním stresem
- Inhibitory tyrozinových kináz – zásadní změna v prognóze chronické myeloidní leukemie
- Mnohočetný myelom
- Pokroky v léčbě chronické lymfocytární leukemie
- Myelodysplastický syndrom – pokrok v léčbě v 21. století
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue
- Vztah bilirubinu k nemocem vyvolaným zvýšeným oxidačním stresem
- Cystické nádory pankreatu – naše zkušenosti
- Onemocnění jater u diabetiků
- Akutní pankreatitida – novinky v léčbě
