LDL-aferéza v léčbě familiárních hyperlipoproteinemií
LDL-apheresis in the treatment familial hypercholesterolemia
LDL-apheresis is an extracorporeal elimination technique, which specifically removes LDL-cholesterol from the circulation. There are six methods for the selective LDL-cholesterol removal these days. The main indications for LDL-apheresis are the diagnosis of homozygous familial hypercholesterolemia, heterozygous familial hypercholesterolemia which is refractory the standard care and intolerance of routine care, and also patients with lipoprotein(a) increase resistant to the farmacotherapy. There is still debate which LDL-cholesterolemia is indication for LDL-apheresis therapy, and the recommendation differs among various countries. Despite large randomized trials are missing, there are several good quality studies to conclude, that the beneficial cardiovascular effects of LDL-apheresis in severe hypercholesterolemia are important and beneficial
Key words:
atherosclerosis – cardiovascular disease – hypercholesterolemia – hypolipidemic therapy – LDL-apheresis
:
Vladimír Bláha 1; Milan Bláha 2; Miriam Lánská 2; Eduard Havel 1; Pavel Vyroubal 1; Zdeněk Zadák 1; Pavel Žák 2; Luboš Sobotka 1
:
III. interní gerontometabolická klinika LF UK a FN Hradec Králové, přednosta prof. MUDr. Luboš Sobotka, CSc.
1; IV. interní hematologická klinika LF UK a FN Hradec Králové, přednosta doc. MUDr. Pavel Žák, Ph. D.
2
:
Vnitř Lék 2014; 60(11): 970-976
:
Reviews
LDL-aferéza je extrakorporální eliminační metodika, která usiluje o pokud možno specifické odstranění LDL-cholesterolu z cirkulující krve. V současnosti je používáno 6 účinných metod k selektivnímu odstranění LDL-cholesterolu. Mezi hlavní indikace k léčbě LDL-aferézou patří diagnózy homozygotní familiární hypercholesterolemie, heterozygotní familiární hypercholesterolemie refrakterní nebo při intoleranci k standardní léčbě, a dále pacienti se zvýšením lipoproteinu(a) refrakterní nebo intolerantní k farmakoterapii. Dosud však není jednoty o tom, jaká hladina LDL-cholesterolu je rozhodující pro zahájení LDL-aferézy, názory se liší i v jednotlivých státech. I když neexistují klasické velké randomizované studie, existuje dostatečný počet dobře řízených studií k tomu, aby v celém světě bylo uznáváno, že je efekt LDL-aferézy na kardiovaskulární prognózu u závažné hypercholesterolemie významný.
Klíčová slova:
ateroskleróza – hypercholesterolemie – hypolipidemická léčba – kardiovaskulární onemocnění – LDL-aferéza
Úvod
Léčba familiární hypercholesterolemie (FH) je obecně oproti nedávné minulosti podstatně účinnější, ale přesto zbývají pacienti, u nichž nelze docílit přijatelně nízkých hodnot LDL-cholesterolu – jde o pacienty rezistentní k léčbě, netolerující dostatečně vysoké dávky léků či pacienty alergické na léky, anebo jde o kontraindikaci léků (např. v těhotenství). Toto malé a zmenšující se procento pacientů se recentně odhaduje asi na 1 % [16]. Vzhledem k poměrně frekventní incidenci FH to však není číslo zanedbatelné. V České republice by mohlo jít o asi 10 homozygotů a asi 200 heterozygotů. Tento počet však není v současné praxi možno léčit ani v zemích s nejvíce rozšířenou sítí center, používajících v léčbě metodu LDL-aferéz, jako je Německo (léčí asi 1 500 pacientů, ale je to jen 30–50 % těch, u nichž by byla léčba indikovaná) [16]; v ČR jsou současné možnosti asi 3krát menší.
Vymezení pojmů
LDL-aferéza je extrakorporální eliminační (EE) metodika, která usiluje o pokud možno specifické odstranění LDL-cholesterolu z cirkulující krve. Je obecně řazená mezi léčebné (hem)aferézy (což jsou metody odnětí nežádoucích krevních elementů nebo patogeneticky účinných substancí vyskytujících se v plazmě – jde např. o léčebnou plazmaferézu, leukocytaferézu, trombocytaferézu, erytrocytaferézu a další). Je prováděna specializovanými hemaferetickými pracovišti, řazenými v ČR mezi hematologická nebo transfuziologická pracoviště, jinde ve světě většinou mezi nefrologické subspecializace.
Historická poznámka
První extrakorporální eliminací LDL-cholesterolu byly klasické léčebné plazmaferézy (tj. prosté odstranění či výměna plazmy). Úspěšné použití plazmaferézy v léčbě FH bylo poprvé popsáno Thompsonem et al v roce 1975 [36]. Již v roce 1980 byla tato léčba zahájena v Československu [17]. Plazmaferéza je zcela nespecifická, protože znamená prosté odnětí plazmy a její náhradu náhradními roztoky. S žádaným odstraněním LDL-cholesterolu tedy odstraníme řadu užitečných substancí. Podle některých názorů se obvykle musí k odstranění 1–2 g patologické bílkoviny odstranit až 150 g jiných bílkovin [30]. Budoucnost proto patřila specifičtějším metodám, jako je klasická LDL-aferéza imunoadsorpční metodou, zavedená Stoffelem a Borbergem roku 1981 [34] a používaná dosud, v Československu poprvé použitá roku 1996 [6]. Pozornost v celém světě byla věnována samozřejmě především nejtěžší formě FH – homozygotním nemocným. Podle PubMed bylo za posledních 10 let do roku 2013 publikováno 47 článků a léčeno 243 pacientů s homozygotní FH [37]. Pokud jde o heterozygotní formy rezistentní FH, v PubMed bylo problematice heterozygotů FH věnováno za léta 2003–2013 celkem 20 prací o léčbě 213 pacientů [37].
Terminologická poznámka
Pojem LDL-aferéza doporučil prof. Arens (Rockefeler Univeristy) roku 1983 prof. Borbergovi pro Stoffelovu a Borbergovu metodu odstraňování LDL-cholesterolu imunoadsorpcí na principu reakce antigen-protilátka [7]. Tuto metodu klinicky rozpracoval Borberg a jeho kolektiv [8] a zprvu byl originální název „LDL-aferéza“ používán pouze pro tuto metodu. V současné době je však tento název všeobecně používán pro všechny metody selektivní extrakorporální eliminace LDL-cholesterolu a toto pravidlo respektujeme v této publikaci. Někteří autoři dávají přednost názvu „lipidaferéza“ nebo „lipoproteinaferéza“. Další poznámku zaslouží pojem „selektivní“. Někteří autoři namítají, že selektivní metoda na molekulární úrovni v současnosti neexistuje. Přesto se pojem „selektivní“ metoda eliminace LDL-cholesterolu běžně používá [37,40], protože vystihuje snahu o odstranění jen LDL-cholesterolu a co možno nejmenšího množství dalších substancí, a tím také o vymezení pojmu od prosté výměny plazmy.
Principy současných metod LDL-aferézy
V současnosti je používáno 6 účinných metod k selektivnímu odstranění LDL-cholesterolu (tab. 1). Principy lze jednoduše sumarizovat: LDL-cholesterol lze z krve oddělit buď imunoadsorpcí, iontovou vazbou, filtrací, anebo precipitací. Dvě metody odstraňují LDL-cholesterol přímo z plné krve (DALI a dextransulfátová přímá adsorpce), další čtyři primárně získávají plazmu buď centrifugací, nebo filtrací a s ní dále pracují.
![Přehled současných možností LDL-aferézy. Upraveno podle [40].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/aea65973d0bf3cb065cc01dd6f86e629.jpg)
Na našem pracovišti se extrakorporálními eliminačními metodikami dlouhodobě zabýváme. Pokud jde o eliminaci LDL-cholesterolu, vybrali jsme po seznámení se se všemi výše uvedenými metodami k dlouhodobé terapii 2 metodiky, které jsou vysoce účinné, bezpečné a relativně ekonomicky v našich podmínkách výhodné: vlastní modifikaci klasické Stofellovy a Borbergovy LDL-aferézy [7,8] – imunoadsorpci, a jako druhou metodu filtraci plazmy (plazmafiltraci) – jde o modifikaci dvojité filtrace plazmy, při níž se k oddělení plazmy nepoužívá filtr, ale centrifugační separátor.
Klasická imunoadsorpční LDL-aferéza
Klasickou imunoadsorpční LDL-aferézu zobrazuje schéma 1: krev je odebírána z periferní žíly, z krve je oddělena plazma centrifugačním separátorem (může být použit i membránový separátor). Plazma je dále čerpána do dvojice (páru) adsorberů uložených v řídicím adsorpčně-desorpčním automatu. Adsorbery obsahují sepharózu, na kterou je kovalentně navázána ovčí protilátka proti lidskému apoproteinu B, takže imunologickou reakcí antigen-protilátka je v adsorberu zachycena bílkovina obsahující apoprotein B. První adsorber je po průtoku určitého množství plazmy zaplněn a pak automat přepne na druhý adsorber. Zaplněný adsorber je promýván fyziologickým roztokem, potom glycinem o nízkém pH (1,8–2,4), čímž se apoprotein B uvolní z vazby a odtéká do odpadu. Potom je tento adsorber promyt pufrem PBS (tím se upraví pH), následně ještě fyziologickým roztokem a je připraven k dalšímu použití. Systém páru adsorberů tak pracuje střídavě a opakovaně, až je docíleno žádaného snížení množství LDL-cholesterolu (teoreticky neomezený počet cyklů). V praxi je promýváno průměrně 1,5 objemu plazmy, což při přítoku z periferní žíly trvá asi 3–5 hodin. Antikoagulace je zajištěna úvodním bolusem heparinu (4 000 j) a pak kontinuálním přidáváním ACD-A (acidum citricum + dextróza) v poměru 1 : 22. Adsorpční kolony mohou být pro daného pacienta používány opakovaně, garantuje se 50 použití (což je ekonomicky výhodné). Mezi jednotlivými procedurami jsou adsorbery zaplněny roztokem NaN3 a uloženy v chladničce. Nevýhodou je styk plazmy s ovčí protilátkou.

Plazmafiltrace (dvojitá filtrace plazmy – double plasma filtration)
Plazma, získaná stejným postupem jako u imunoadsorpce, je proháněna „druhým stupněm“ – filtrem. Rozhodující je velikost pórů filtru, používají se filtry o velikosti průduchů 30–40 nanometrů. Sami používáme filtry Evaflux 4A (Kuraray, Osaka, Japonsko). Jde o simultánní odstranění LDL-cholesterolu, ale i spektra některých dalších vysokomolekulárních bílkovin (např. α2-makroglobulin, fibrinogen, Lp(a), von Willebrandův faktor, IgM, fibronektin a multimerický vitronektin), proto touto metodou léčíme pacienty se současně zvýšeným fibrinogenem. Odstraňováním výše definovaného spektra reologicky účinných proteinů se mění reologické vlastnosti krve. Jde tedy také o formu lékařské reoterapie [5]. Proto pro tuto metodiku používáme termín reohemaferéza nebo reoferéza, zavedený německými autory [8,20].
Průtok plazmy je opět kontinuální, množství zpracované plazmy je 1,5 tělesného objemu plazmy (vypočteno separátorem). Antikoagulace se provádí kombinací heparinu (bolus i.v. v úvodu) a ACD-A. Schematicky princip znázorňuje schéma 2.

Indikace k LDL-aferéze u FH
Ve světě bylo dosud publikováno několik prací o indikacích k LDL-aferéze [12,18,37,39,40]. Podle Thompsona [37] jsou 3 hlavní indikace k léčbě LDL-aferézou:
- homozygotní familiární hypercholesterolemie (HFH)
- heterozygotní familiární hypercholesterolemie refrakterní nebo při intoleranci k standardní léčbě
- pacienti se zvýšením lipoproteinu(a) refrakterní nebo intolerantní k vysokým dávkám kyseliny nikotinové
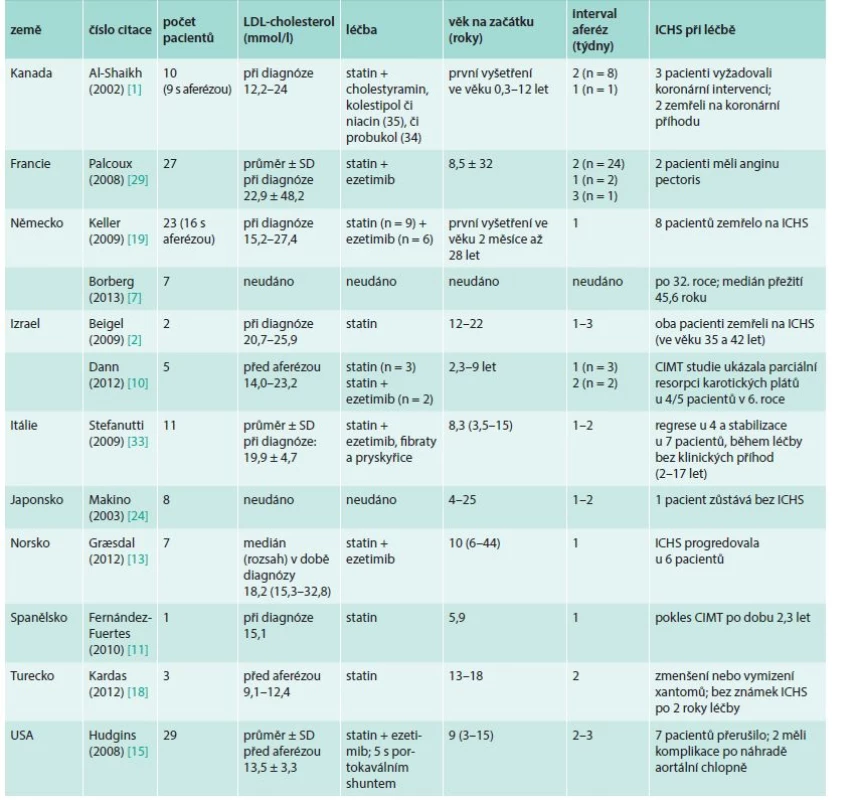
Dosud však není jednoty o tom, jaká hladina LDL-cholesterolu je při FH rozhodující pro zahájení LDL-aferézy, názory se liší i v jednotlivých státech (tab. 2).
![Kritéria pro LDL-aferézu. Upraveno podle [28].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/8cf779eb5bdd73ee06e55b64c1297f5e.jpg)
Striktní jsou kritéria v Německu [12]. Cílové hodnoty LDL-cholesterolu jsou podle posledního konsensu European Atherosclerosis Society u pacientů s FH < 2,5 mmol/l a u pacientů s FH a projevy ICHS nebo diabetem < 1,8 mmol/l [18]. Není ani úplná jednota v tom, kdy se má začít s LDL-aferézou u dětí, zejména homozygotů. Jisté je, že je třeba začít časně. Thompson et al (2010) doporučují zahájit léčbu v 7 letech věku [35], Graesdal et al (2012) ve věku 3–5 let [13], Dann et al (2013) při dosažení hmotnosti 14 kg [10], což odpovídá v České republice věku asi 3 roky. European Atherosclerosis Society Consensus Panel on Familial Hypercholesterolaemia z roku 2014 doporučuje začít v 5 letech, nejpozději v 8 [9].
Vliv LDL-aferézy na kardiovaskulární riziko u FH
„Tvrdá“ data podle klasických pravidel (evidence based medicine), tj. randomizovaných velkých mezinárodních, prospektivních, zaslepených a placebem kontrolovaných studií, která by detailně zhodnotila vliv LDL-aferézy na kardiovaskulární riziko u homozygotů familiární hypercholesterolemie, nemáme. Existuje ovšem dostatečný počet dobře řízených studií k tomu, aby v celém světě bylo uznáváno, že efekt LDL-aferézy na prognózu FH je prokázán do této míry:
- úspěch LDL-aferézy u homozygotů se pokládá za nesporný [9,14,18,37,38], podle znalců dokonce v tomto směru není třeba dalších studií [37]
- pokládá se rovněž za prokázané, že u heterozygotní FH s postižením koronárních tepen je LDL-aferéza jednoznačně prospěšná [9,14,18,22,27,38]
- u heterozygotů při progredující ateromatóze bez postižení koronárních tepen je nejspíše také vhodná, ale je nutno ještě některé detaily dořešit [12,28,37]
Z hlediska medicíny založené na důkazech (evidence based medicine) je do budoucna obtíž v tom, že obvyklá klasická prospektivní randomizovaná studie je z etických důvodů již nevhodná [37]. I když tomu ale tak je, platí stále, že nejdůležitější ukazatel efektu léčby je délka přežití [7]. V období, než byla léčba LDL-aferézou dostupná, se pacienti s HoFH zřídka dožili 3. decénia [38]. Podle klinického pozorování se však v současnosti dožívají pacienti s HoFH, léčení všemi dostupnými prostředky, řádově 4.-5. decénia [9]. Proto je oprávněné tvrzení, že LDL-aferéza významně (i když to není změřeno exaktně) prodlužuje přežití. LDL-aferéza také prokazatelně snižuje riziko ICHS u heterozygotní FH [3].
Výhody a omezení LDL-aferézy
Rozsáhlá data, která máme k dispozici z registrů pro aferézy, a zkušenosti z velkých center potvrzují klinický benefit pravidelné a dlouhodobé léčby LDL-aferézou zejména u HoFH (tab. 3). Poměr nákladů a efektivity léčby je rovněž jednoznačně pozitivní [9].
Jednoznačná výhoda platná pro současné metody (a to pro všech 6 metod LDL-aferézy) je, že sníží v krátké době LDL-cholesterol hluboce pod normu (naše cílová hodnota je 0,5–1 mmol/l na konci procedury). Obecně se udává jako úspěšné průměrné snížení LDL-cholesterolu o 70–80 % [26], naše výsledky z poslední doby ukázaly 80–90 % [21]. Tohotu efektu nelze docílit žádným jiným dosud známým (např. medikamentózním) způsobem. Po LDL-aferéze proto vznikne velmi důležitá asi jednotýdenní perioda hypocholesterolemie, během níž se redistribuuje LDL-cholesterol z tkání. Dojde ovšem k opětnému poměrně rychlému vzestupu hladiny LDL-cholesterolu a původní hladiny je dosaženo asi za 2 týdny (u homozygotů pomaleji, u heterozygotů rychleji – podle poměrně složité „rebound“ dynamiky a procesu odbourávání – [26,35], graf. Proto je nutno výkony v přesně definovaných intervalech opakovat.
![Dynamika hladiny LDL-cholesterolu po LDLaferéze. Upraveno dle [35].](https://pl-master.mdcdn.cz/media/image/8ade793e50ca91577b2fb21e68300c85.jpg?version=1537795144)
LDL-aferéza je také jako jediná možná v těhotenství, kdy jsou statiny i ezetimib kontraindikovány a díky léčbě LDL-aferézou může těhotenství někdy hladce proběhnout i u homozygotních pacientek [4].
Omezením při LDL-aferéze jsou především cévní problémy. Dobrý přítok krve do přístrojů někdy nezajistí periferní žíly, zejména u dětí. Provádějí se A-V shunty, což přináší obvyklé možnosti komplikací, jako jsou infekční nebo trombotické problémy. Pokud jde o dospělé, zpravidla vystačíme s periferními žilami. Další problém je časová ztráta pro nemocné, a to nejméně půl dne, často celý den – samotná procedura trvá 3–5 hodin, čas zabere doprava do centra a po výkonu se cítí někteří nemocní unavení. Bolestivý je jen vpich do žil, ale při výkonu je nepohodlím nutnost ležet v klidu, obvykle s jehlami zavedenými do žil obou horních končetin. Další komplikace LDL-aferézy jsou řídké, jde o slabost, nevolnost, krátkodobá hypotenze, obtíže z hypokalcemie (může ji působit předávkování antikoagulans – ACD-A) aj; komplikace jsme zaznamenali u 3,1 % pacientů [21]. Obdobný výsledek udává celosvětový registr WAA (World Apheresis Registry), do nějž údaje o všech výkonech pravidelně hlásíme.
Výhled do budoucna
I když je v poslední době k disposici nebo ve vývoji několik účinných nových hypolipidemik, nepokládá se za pravděpodobné, že by bylo možno dosáhnout cílových hodnot LDL-cholesterolu zejména u homozygotů bez LDL-aferézy [25,32]. Naopak se však předpokládá pozitivum, že by se vytvořily kombinace nejúčinnějších a nejekonomičtějších postupů – kombinace léků a LDL-aferézy, aby bylo možno u více pacientů dosáhnout nejoptimálnějších cílových hodnot tak, že by se progrese FH nejen pozastavila, ale zcela odstranila. Bude také možno více přihlížet k vedlejším účinkům, přáním pacientů (upravit časový harmonogram podle možností pacientů bez následků na omezenou účinnost) a regulovat intenzitu LDL-aferéz (snížit frekvenci nebo mohutnost pro pacienta nepříjemných procedur).
Situace v České republice
EE cholesterolu používáme na našem pracovišti od roku 1994, zprvu plazmaferézu, od roku 1996 LDL-aferézu. Homozygotní pacienti jsou soustřeďováni do našeho centra z České republiky. Dlouhodobě sledujeme 14 pacientů s FH (8 mužů, 6 žen) ve věku 28–70 let (věkový průměr 52,5 roků; medián 57 let; rozmezí 28–70 let). Jedná se o 5 homozygotů FH, u nichž je věkový průměr nižší – 35 let (rozmezí 28–59 let) a 9 heterozygotů FH s věkovým průměrem 59 let (rozmezí 48–70 let). Medián sledování pacientů je 8,5 roku (rozmezí 1–17 let). 10 pacientů je léčeno imunoadsorpcí (5 homozygotů a 5 heterozygotů) a 4 pacienti reohemaferézou (2 muži, 2 ženy, všichni heterozygoti). Od roku 1996 bylo na našem pracovišti provedeno celkem 1 922 výkonů, z toho 1 590 LDL-imunoadsorpcí a 332 reohemaferéz. Průměrná hodnota cholesterolu a LDL-cholesterolu byla před výkonem 5,34 a 3,12 mmol/l u imunoadsorpcí, u reohemaferéz 5,07 a 2,86; po výkonu 1,73 a 0,72 (pokles o 72 a 85 %), resp. 1,96 a 0,97 mmol/l (pokles o 61 a 66 %). Ve sledovaném období nedošlo ke vzniku nové koronární příhody ani k úmrtí žádného pacienta léčeného LDL-aferézou.
Závěr
LDL-aferéza účinně a relativně selektivně odstraní 70–80 % LDL-cholesterolu u homozygotních nebo těžkých heterozygotních pacientů. I když rychle dochází k tzv. rebound fenoménu, může zajistit průměrný pokles (time-average reduction) LDL-cholesterolu asi o 40 %. Oproti plazmaferéze nemá klinicky negativní dopad na HDL-cholesterol, albumin nebo imunoglobuliny. I když neexistují klasické velké randomizované studie, pokládá se její pozitivní efekt na kardiovaskulární prognózu u FH za prokázaný.
Práce byla podpořena projekty IGA MZ ČR NT/12287–5 a PRVOUK P37/12.
prof. MUDr. Vladimír Bláha, CSc.
blaha@lfhk.cuni.cz
III. interní gerontometabolická klinika LF UK a FN, Hradec Králové
www.fnhk.cuni.cz
Doručeno do redakce 29. 9. 2014
Přijato po recenzi 15. 10. 2014
Sources
1. Al-Shaikh AM, Abdullah MH, Barclay A et al. Impact of the characteristics of patients and their clinical management on outcomes in children with homozygous familial hypercholesterolemia. Cardiol Young 2002; 12(2): 105–112.
2. Beigel R, Beigel Y. Homozygous familial hypercholesterolemia: long term clinical course and plasma exchange therapy for two individual patients and review of the literature. J Clin Apher 2009; 24(6): 219–224.
3. Benlian P. Genes of lipoprotein metabolism. In: Genetics of dyslipidemia. Kluwer Academic Publishers: London 2001. ISBN 0–7923–7362–6. 41–181.
4. Bláha M, Lánská M, Bláha V. Pregnancy in homozygous familial hypercholesterolemia – importance of LDL-apheresis. Atherosclerosis Suppl. Přijato do tisku 2014.
5. Bláha M, Rencová E, Malý R et al. Léčba hemorheoferézou (současný stav a vlastní zkušenosti). Aktuality z nefrologie 2008; 14(3): 118–124.
6. Bláha M, Zadák Z, Havel E et al. Léčba těžké hyperlipoproteinémie LDL-aferézou. Transfuze dnes 1997; 19 : 9–10.
7. Borberg H. The lower the better: target values after LDL-Apheresis and semi-selective LDL-elimination therapies. Transfus Apher Sci 2013; 48(2): 203–206.
8. Borberg H. 26 years of LDL-apheresis: a review of experience. Transfus Apher Sci 2009; 41(1): 49–59.
9. Cuchel M, Bruckert E, Ginsberg HN et al. European Atherosclerosis Society Consensus Panel on Familial Hypercholesterolaemia. Homozygous familial hypercholesterolaemia: new insights and guidance for clinicians to improve detection and clinical management. A position paper from the Consensus Panel on Familial Hypercholesterolaemia of the European Atherosclerosis Society. Eur Heart J 2014; 35(32): 2146–2157.
10. Dann EJ, Shamir R, Mashiach T et al. Early-onset plasmapheresis and LDL-apheresis provide better disease control for pediatric homozygous familial hypercholesterolemia than HMG-CoA reductase inhibitors and ameliorate atherosclerosis. Transfus Apher Sci 2013; 49(2): 268–277.
11. Fernández-Fuertes LF, Tapia Martín M, Nieves Plá I et al. Low-density lipoprotein apheresis using double filtration plasmapheresis: 27-month use in a child with homozygous familial hypercholesterolemia. Ther Apher Dial 2010; 14(5): 484–485.
12. Fischer S, Schatz U, Julius U. Current standards in diagnosis and therapy of hyperlipoproteinemia. Atheroscler Suppl 2013; 14(1): 15–18.
13. Græsdal A, Bogsrud MP, Holven KB et al. Apheresis in homozygous familial hypercholesterolemia: the results of a follow-up of all Norwegian patients with homozygous familial hypercholesterolemia. J Clin Lipidol 2012; 6(4): 331–339.
14. Harada-Shiba M, Arai H, Oikawa S et al. Guidelines for the management of familial hypercholesterolemia. J Atheroscler Thromb 2012; 19(12): 1043–1060.
15. Hudgins LC, Kleinman B, Scheuer A et al. Long-term safety and efficacy of low-density lipoprotein apheresis in childhood for homozygous familial hypercholesterolemia. Am J Cardiol 2008; 102(9): 1199–1204.
16. Julius U, Taseva K, Fischer S et al. Current situation of lipoprotein apheresis in Saxony. Atheroscler Suppl 2013; 14(1): 51–55.
17. Kalinová M, Zadák Z, Bláha M. Léčba hyperlipoproteinémií kontinuálními plazmaferézami. Lék Zprávy (Hradec Králové) 1981; 26 : 135–142.
18. Kardaş F, Cetin A, Solmaz M et al. Successful treatment of homozygous familial hypercholesterolemia using cascade filtration plasmapheresis. Turk J Haematol 2012; 29(4): 334–341.
19. Keller C. LDL-apheresis in homozygous LDL-receptor-defective familial hypercholesterolemia: the Munich experience. Atheroscler Suppl 2009; 10(5): 21–26.
20. Klingel R, Fassbender C, Fassbender T et al. Rheopheresis: rheologic, functional, and structural aspects. Ther Apher 2000; 4(5): 348–357.
21. Lánská M, Bláha M, Žák P. Extrakorporální eliminace cholesterolu u familiární hypercholesterolémie – srovnání dvou metodik. Transfuze a hematologie dnes. Přijato do tisku 2014.
22. Leebman J, Roeseler E, Julius U et al. Lipoprotein apheresis in patients with maximally tolerated lipid-lowering therapy, lipoprotein(a)-hyperlipoproteinemia, and progressive cardiovascular disease: prospective observational multicenter study. Circulation 2013; 128(24): 2567–2576.
23. Mabuchi H, Koizumi J, Shimizu M et al. Long-term efficacy of low-density lipoprotein apheresis on coronary heart disease in familial hypercholesterolemia. Hokuriku-FH-LDL-Apheresis Study Group. Am J Cardiol 1998; 82(12): 1489–1495.
24. Makino H, Harada-Shiba M. Long-term effect of low-density lipoprotein apheresis in patients with homozygous familial hypercholesterolemia. Ther Apher Dial 2003; 7(4): 397–401.
25. Marais AD, Blom DJ. Recent advances in the treatment of homozygous familial hypercholesterolaemia. Curr Opin Lipidol 2013; 24(4): 288–294.
26. McGowan MP. Emerging low-density lipoprotein (LDL) therapies: Management of severely elevated LDL cholesterol – the role of LDL-apheresis. J Clin Lipidol 2013; 7(3 Suppl): S21-S26.
27. Nordestgaard BG, Chapman MJ, Humphries SE et al. Familial hypercholesterolaemia is underdiagnosed and undertreated in the general population: guidance for clinicians to prevent coronary heart disease: consensus statement of the European Atherosclerosis Society. Eur Heart J 2013; 34(45): 3478–3490.
28. Page MM, Bell DA, Hooper AJ et al. Lipoprotein apheresis and new therapies for severe familial hypercholesterolemia in adults and children. Best Pract Res Clin Endocrinol Metab 2014; 28(3): 387–403.
29. Palcoux JB, Atassi-Dumont M, Lefevre P et al. Low-density lipoprotein apheresis in children with familial hypercholesterolemia: follow-up to 21 years. Ther Apher Dial 2008; 12(3): 195–201.
30. Pták J. Changes of plasma proteins after immunoadsorption using Ig-Adsopak columns in patients with myasthenia gravis. Transfus Apher Sci 2004; 30(2): 125–129.
31. Schwarz J, Winters JL, Padmanabhan A et al. Guidelines on the use of therapeutic apheresis in clinical practice-evidence-based approach from the Writing Committee of the American Society for Apheresis: the sixth special issue. J Clin Apher 2013; 28(3): 145–284.
32. Stefanutti C. Treatment of severe genetic dyslipidemia: where are we going? Ther Apher Dial 2013; 17(2): 122–123.
33. Stefanutti C, Vivenzio A, Di Giacomo S et al. Aorta and coronary angiographic follow-up of children with severe hypercholesterolemia treated with low-density lipoprotein apheresis. Transfusion 2009; 49(7): 1461–1470.
34. Stoffel W, Borberg H, Greve V. Application of specific extracorporeal removal of low density lipoprotein in familial hypercholesterolaemia. Lancet 1981; 2(8254): 1005–1007.
35. Thompson GR, Barbir M, Davies D et al. Efficacy criteria and cholesterol targets for LDL apheresis. Atherosclerosis 2010; 208(2): 317–321.
36. Thompson GR, Miller JP, Breslow JL. Improved survival of patients with homozygous familial hypercholesterolaemia treated by plasma exchange. Br Med J (Clin Res Ed) 1985; 291(6510): 1671–1673.
37. Thompson GR. The evidence-base for the efficacy of lipoprotein apheresis in combating cardiovascular disease. Atheroscler Suppl 2013; 14(1): 67–70.
38. Watts GF, Gidding S, Wierzbicki AS et al. Integrated guidance on the care of familial hypercholesterolemia from International FH Foundation. J Clin Lipidol 2014; 8(2): 148–172.
39. Winters JL. American society for apheresis guidelines on the use of apheresis in clinical practice: Practical, concise, evidence-based recommendations for the apheresis practitioner. J Clin Apher 2014; 29(4): 191–193.
40. Winters JL. Low-density lipoprotein apheresis: principles and indications. Semin Dial 2012; 25(2): 145–151.
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Internal Medicine

2014 Issue 11
-
All articles in this issue
- New SGLT2 inhibitor empagliflozin: modern and safe treatment of diabetes
- Prevention of cardiovascular diseases in clinical practice: is it possible to achieve improvement?
- Residual cardiovascular risk markers
- New aspects of hormone replacement therapy
- News in lipid lowering treatment
- Non-pharmacological treatment – results from Poděbrady
-
Familial hypercholesterolemia – past and present.
My experiences and findings in our group of patients with familial hypercholesterolemia - LDL-apheresis in the treatment familial hypercholesterolemia
- Extended options of anticoagulant treatment in thromboembolism
- What do have arterial and venous disease in common?
- Cardiovascular risk profile in 40-year old men and 50-year old women in the Czech Republic: results of a cross-sectional survey
-
Adherence of type 2 diabetes patients on insulin analogues application: missed dose, time imprecision and dose reduction
The results of GAPP2TM(Global Attitudes of Physicians and Patient) survey in the Czech Republic
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue
- New aspects of hormone replacement therapy
- LDL-apheresis in the treatment familial hypercholesterolemia
- New SGLT2 inhibitor empagliflozin: modern and safe treatment of diabetes
- Extended options of anticoagulant treatment in thromboembolism
