Význam Pneumonia Severity Index u pacientů s pneumonií hospitalizovaných na jednotce intenzivní pneumologické péče
Utility of Pneumonia Severity Index in hospitalized patients with pneumonia in intensive respiratory care units
Introduction:
The aim of this study was to evaluate the prognostic value of Pneumonia Severity Index (PSI) for prediction of 30-day mortality in patients admitted to intensive care unit (ICU) for community-acquired pneumonia (CAP). In patients with CAP, comorbidities, complications, and physical, laboratory, radiological and microbiological findings were evaluated relative to their prognosis.
Patient and methods:
In the study, 197 patients with CAP, hospitalised at ICU of Department of Respiratory Medicine, University Hospital Olomouc between 2008 and 2012, were enrolled. Risk factors according to PSI were assessed in all patients.
Results:
In the studied cohort of patients with CAP, mean values of PSI were 115.4 ± SD 30.4 points. Overall, 29 patients (14.7 %) deceased. When comparing deceased and survived patients, statistically significant differences were found in PSI (mean ± SD: 137.4 ± 26.1 vs 111.7 ± 29.6 points, p < 0.0001), age (mean ± SD: 76.3 ± 12.9 vs 65.5 ± 14.7 years, p < 0.0001), incidence of heart diseases (86.2 % vs 67.3 %, p = 0.04) and ischaemic heart disease (58.6 % vs 38.7 %, p = 0.04). Assessment of physical and laboratory findings showed that deceased patients had significantly increased incidence of tachycardia above 90/min (51.7 % vs 27.4 %, p = 0.01), tachypnoe above 30/min (37.9 % vs 13.7 %, p = 0.001) and acidosis with pH < 7.35 (27.6 % vs 8.9 %, p = 0.004) comparing to survived patients. No significant correlation between PSI and the length of hospitalisation in survived patients was observed. In patients with Staphylococcus sp. and Klebsiella pneumoniae infection, longer hospitalisation period was observed. Comparison of other parameters such as comorbidities, physical and laboratory findings, and pathogens showed no significant differences when comparing deceased to survived patients.
Conclusion:
Our study showed that PSI represents an important predictor of 30-day mortality in patients with CAP at ICU, but does not correlate neither with the length of hospitalisation nor with particular pathogens. Independent negative prognostic factors in CAP were age, incidence of heart diseases (most importantly ischaemic heart disease), tachycardia, tachypnoe and acidosis. Staphylococcus sp. and Klebsiella pneumoniae infection led to longer hospitalisation period. All these factors point out the need for increased care in CAP patients.
Key words:
pneumonia – pneumonia severity index – severity scoring system
Authors:
MUDr. Beáta Hutyrová, Ph.D. 1; Petr Jakubec 1; Zdena Šindelářová 1; Jana Šubová 1; Kateřina Langová 2; Vítězslav Kolek 1
Authors‘ workplace:
Klinika plicních nemocí a tuberkulózy LF UP a FN Olomouc, přednosta prof. MUDr. Vítězslav Kolek, DrSc.
1; Ústav lékařské biofyziky LF UP Olomouc, přednostka prof. RNDr. Hana Kolářová, CSc.
2
Published in:
Vnitř Lék 2015; 61(1): 15-23
Category:
Original Contributions
Overview
Úvod:
Cílem studie bylo hodnocení významu Pneumonia Severity Index (PSI) pro predikci 30denní mortality pacientů s komunitní pneumonií (CAP) hospitalizovaných na jednotce intenzivní pneumologické péče (JIP). U pacientů byly hodnoceny komorbidity, komplikace, fyzikální, laboratorní, RTG a mikrobiologické nálezy a jejich vztah k prognóze nemocných.
Pacienti a metody:
Do studie bylo zařazeno 197 pacientů hospitalizovaných pro CAP na JIP Kliniky plicních nemocí a TBC LF UP a FN Olomouc v letech 2008–2012. U všech pacientů byla hodnocena riziková kritéria dle systému PSI.
Výsledky:
V celém souboru pacientů s CAP byla průměrná hodnota PSI 115,4 ± SD 30,4 bodů. Z celkového počtu 197 pacientů zemřelo 29 nemocných (14,7 %). Při srovnání skupin zemřelých a přeživších pacientů byly prokázány statisticky významné rozdíly v PSI (průměr ± SD: 137,4; 26,1 vs 111,7 ± 29,6 bodů; p < 0,0001), věku pacientů (průměr ± SD: 76,3 ± 12,9 vs 65,5 ± 14,7 let; p < 0,0001) a výskytu onemocnění srdce (86,2 % vs 67,3 %; p = 0,04) s nejvyšším podílem ICHS (58,6 % vs 38,7 %; p = 0,04). Dále při hodnocení fyzikálních a laboratorních nálezů byla prokázána u zemřelých pacientů oproti přeživším významně vyšší frekvence výskytu tachykardie nad 90/min (51,7 % vs 27,4 %; p = 0,01), tachypnoe > 30/min (37,9 % vs 13,7 %; p = 0,001) a acidózy s pH < 7,35 (27,6 % vs 8,9 %; p = 0,004). Korelační analýza neprokázala statisticky významnou závislost mezi PSI a délkou hospitalizace u přeživších pacientů. U pacientů s infekcí Staphylococcus sp. a Klebsiella pneumoniae byla zjištěna statisticky signifikantně delší doba hospitalizace. Hodnocení souvislosti ostatních sledovaných komorbidit, fyzikálních, laboratorních nálezů a patogenů s mortalitou neprokázalo významné rozdíly.
Závěr:
Naše studie prokázala, že PSI je významným prediktorem 30denní mortality pacientů s CAP na JIP, ale nekoreluje s délkou hospitalizace ani s nálezem jednotlivých patogenů. Nezávislými negativními prognostickými faktory u pacientů s CAP jsou věk, výskyt nemocí srdce (zejména ICHS), tachykardie, tachypnoe a acidóza. Výskyt infekce Staphylococcus sp. a Klebsiella pneumoniae se významně podílejí na prodloužení doby hospitalizace. Všechny tyto faktory mohou upozorňovat na potřebu zvýšené péče o pacienty s CAP.
Klíčová slova:
pneumonia severity index – pneumonie – skórovací systémy
Úvod
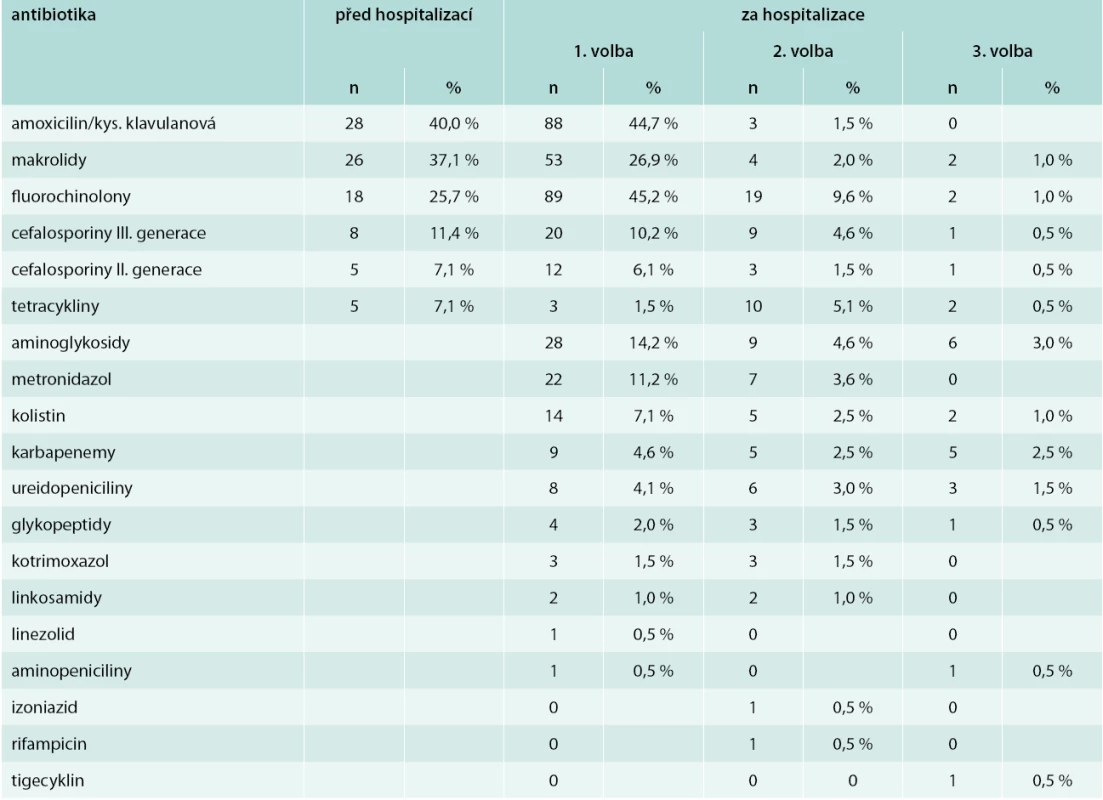
Komunitní pneumonie (community-acquired pneumonia – CAP) je poměrně časté onemocnění, které představuje významný celosvětový zdravotní i ekonomický problém. V globálním měřítku jsou pneumonie 3. nejčastější příčinou mortality [1–5]. Za účelem stratifikace nemocných, odhadu mortality a závažnosti pneumonie byla vyvinuta řada skórovacích systémů, které mají význam v rozhodování o dalším managementu pacienta a doporučení způsobu léčby (ambulantní, hospitalizace na standardním lůžku nebo na JIP). Jedním z nejčastěji používaných skórovacích systémů jsou kritéria PSI (Pneumonia Severity Index) dle Fineho [6]. PSI systém Americké hrudní společnosti (American Thoracic Society – ATS) je nepropracovanějším prediktorem mortality a možných komplikací pneumonie (tab. 1). Podle počtu rizikových bodů jsou pacienti rozděleni do 5 skupin. Předpokládaná mortalita v jednotlivých skupinách dle indexu PSI je následující:
- skupina I (< 50 bodů u mužů a < 55 bodů u žen) – 0,1 %
- skupina II (< 70 bodů) – 0,6 %
- skupina III (71–90 bodů) – 2,8 %
- skupina IV (91–130 bodů) – 8,2 %
- skupina V (> 130 bodů) – 29,2 %
![Pneumonia Severity Index (PSI) [6]](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/22d2e74e4d03931f6eac84df11bcf5f5.png)
Jako těžké pneumonie jsou označeny skupiny IV a V, které jsou vzhledem k vysoké mortalitě zejména ve skupině V indikovány k hospitalizaci na JIP.
Cílem této studie bylo hodnocení významu indexu PSI pro predikci 30denní mortality pacientů s pneumonií hospitalizovaných na JIP Kliniky plicních nemocí a tuberkulózy LF UP a FN Olomouc. U pacientů byly hodnoceny komorbidity, komplikace, fyzikální, laboratorní, RTG a mikrobiologické nálezy a jejich vztah k prognóze nemocných.
Metody
Do studie bylo zařazeno 197 pacientů, kteří byli konsekutivně hospitalizováni pro komunitní pneumonii (CAP) na JIP Kliniky plicních nemocí a tuberkulózy LF UP a FN Olomouc v letech 2008–2012. U nemocných byla diagnostikována pneumonie na základě nálezu čerstvého infiltrativního zastínění na skiagramu hrudníku spolu s nejméně 2 příznaky infekce respiračního traktu (kašel, dušnost, bolest na hrudníku, horečka a poslechový nález) [2]. U všech pacientů byla hodnocena riziková kritéria dle systému Pneumonia Severity Index dle Fineho (PSI) (tab. 1) [6]. U všech pacientů byla provedena základní laboratorní vyšetření (krevní obraz s diferenciálním rozpočtem, biochemické vyšetření) a zobrazovaní metody (skiagram hrudníku, ev. CT hrudníku). K určení etiologie pneumonie byly použity mikrobiologické metody: bakteriologická, mykologická a klasická kultivace na Mycobacterium tuberculosis komplex sputa, pleurálního výpotku nebo endosekretu získaného při bronchoskopickém vyšetření, sérologické vyšetření protilátek proti Chlamydia sp., Mycoplasma pneumoniae, Legionella pneumophila, vyšetření legionellového antigenu a antigenu Streptococcus pneumoniae v moči, Bactec MGIT diagnostika (urychlená metabolická kultivace mykobakterií), průkaz Mycobacterium tuberculosis komplex a Virus influenzae A metodou polymerázové řetězové reakce (polymerase chain reaction – PCR). Použité metody byly vybrány na základě klinického průběhu, stavu pacienta a dostupnosti biologického materiálu, nebyly použity v plném rozsahu u všech pacientů. Kultivační bakteriologické vyšetření sputa bylo ve většině případů provedeno i kvantitativně. Za pravděpodobnou infekci dolních cest dýchacích jsme považovali koncentrace CFU > 107/ml. Délka hospitalizace byla počítána jako doba strávená na Klinice plicních nemocí a tuberkulózy (celkem na JIP i standardním oddělení) u přeživších pacientů, kteří nevyžadovali překlad na Kliniku anesteziologie, resuscitace a intenzivní medicíny LF UP a FN Olomouc (KARIM). U pacientů byla hodnocena 30denní mortalita.
Statistická analýza byla provedena s použitím metod deskriptivní statistiky, testů normality (Kolmogorovův-Smirnovův test, Shapirův-Wilkův test), parametrických (Studentovy t-testy) a neparametrických metod (Mannův-Whitneyův U-test), korelační analýzy (Spearmanův korelační koeficient) a Pearsonův χ2 test. Hodnoty p ≤ 0,05 byly považovány za statisticky signifikantní.
Výsledky
Anamnéza, fyzikální, laboratorní a RTG nálezy
Do souboru bylo zařazeno 197 nemocných, z toho 134 mužů (68 %) a 63 žen (32 %). Průměrný věk pacientů byl 67,1 ± SD 14,9 let (věkové rozmezí 22–97 let).
Z přidružených nemocí (tab. 2) bylo nejčastěji registrováno onemocnění srdce u 138 nemocných (70,1 %), z toho hypertenzní nemoc 113 pacientů (57,4 %), ischemická choroba srdeční 82 pacientů (41,6 %), fibrilace síní 11 pacientů (5,6 %), kardiomyopatie 1 pacient (0,5 %).
Plicní onemocnění se vyskytlo u 83 nemocných (42,1 %), z toho chronická obstrukční plicní nemoc u 62 pacientů (31,5 %), astma bronchiale u 15 pacientů (7,6 %), intersticiální plicní nemoc (IPP) u 4 pacientů (2,0 %), cystická fibróza u 1 pacienta (0,5 %), tuberkulóza anamnesticky u 2 pacientů (1 %).
Onemocnění cév bylo zjištěno u 20 pacientů (10,1 %), z toho cévní mozkové příhody – 14 pacientů (7,6 %), ischemická choroba dolních končetin – 2 pacienti (1 %), flebotrombóza – 3 pacienti (1,5 %) a embolizace do a. pulmonalis – 1 pacient (0,5 %).
Z nemocí jater, která byla přítomná u 28 pacientů (14,2 %), byla nejčastější nespecifikovaná hepatopatie – 19 nemocných (9,6 %).
Onemocnění ledvin se vyskytlo u 24 nemocných (12,2 %), z toho 17 pacientů mělo chronickou renální insuficienci (8,6 %). 50 nemocných (25,4 %) bylo dlouhodobě léčeno pro metabolické nemoci (diabetes mellitus, hyperlipidemie).
Z méně častých komorbidit se vyskytlo onemocnění kloubů u 10 pacientů (5,1 %). U 52 nemocných bylo zjištěno maligní onemocnění (26,4 %).
Ze symptomů nemocní udávali zejména dušnost – 144 pacientů (73,1 %) a kašel – 110 pacientů (55,8 %).
Z ostatních příznaků se vyskytly bolesti na hrudi u 55 pacientů (27,1 %), hemoptýza u 20 pacientů (10,2 %), alterace vědomí u 35 pacientů (17,8 %), febrilie > 38,0 °C u 64 pacientů (32,5 %).
Délka trvání příznaků udávaných pacienty byla průměrně 9,4 ± 11,4 dnů (medián 5,0 dnů, interkvartilní rozmezí/interquartile range – IQR 2–14).
Při fyzikálním vyšetření byla zjištěna hypotenze < 90/60 mm Hg u 10 pacientů (5,1 %). Hypotermie < 36,0 °C se nevyskytla u žádného nemocného. Tachykardie > 90/min byla zaznamenána u 63 nemocných (32 %), tachypnoe > 30/min u 36 pacientů (18,3 %).
Při hodnocení vstupních laboratorních výsledků byla zjištěna trombocytopenie < 150 ×109/l u 10 nemocných (5,1 %), hypoxemie pod 8,0 kPa u 97 pacientů (49,2 %), hyperkapnie > 6,5 kPa u 29 pacientů (14,7 %), acidóza s pH < 7,35 u 23 pacientů (11,7 %), leukocytóza nad 10 × 109/l u 157 pacientů (79,7 %), elevace hladiny urey > 7,0 mmol/l u 96 pacientů (48,7 %).
Na vstupním skiagramu hrudníku bylo zjištěno unilaterální infiltrativní zastínění u 146 nemocných (74,1 %), bilaterální pneumonie u 51 pacientů (25,9 %), pleurální výpotek u 30 jedinců (15,2 %) a známky abscedující pneumonie u 7 nemocných (3,6 %).
Komplikace a mortalita
Frekvence dalšího výskytu komplikujících faktorů v průběhu hospitalizace u pacientů s pneumonií je následující: pleurální výpotek 30 pacientů (15,2 %), kardiální selhání 15 pacientů (7,6 %), hemoptýza 10 pacientů (5,1 %), pneumotorax 6 pacientů (3 %), sepse 5 pacientů (2,5 %), plicní embolie 4 pacienti (2 %), cévní mozková příhoda 2 pacienti (1 %), plicní absces 7 pacientů (3,6 %).
Délka hospitalizace pacientů na JIP byla průměrně 9,0 ± SD 6,9 dnů (rozsah 1–39 dnů).
Z důvodu nutnosti umělé plicní ventilace bylo 27 nemocných (13,7 %) přeloženo na KARIM.
U 12 nemocných (6,1 %) stav umožňoval přímé propuštění z JIP do ambulantní péče, 112 pacientů (56,9 %) bylo přeloženo na standardní oddělení Kliniky plicních nemocí a tuberkulózy LF UP a FN Olomouc a 19 nemocných (9,6 %) bylo přeloženo na oddělení následné péče.
Z celkového počtu 197 pacientů zemřelo 29 nemocných (14,7 %), z toho 24 pacientů (12,2 %) na JIP a 5 pacientů (2,5 %) zemřelo po překladu na KARIM. Průměrná délka hospitalizace do úmrtí pacientů byla 10,2 ± SD 7,8 dnů (rozsah 1–28 dnů). Délka hospitalizace na KARIM do smrti pacientů byla 4–22 dní. Zastoupení pohlaví u zemřelých pacientů bylo téměř stejné: 14 mužů a 15 žen. Věkový rozdíl mezi pacienty zemřelými (průměr 76,3 ± SD 12,9 let) a přeživšími (průměr 65,5 ± SD 14,7 let) byl statisticky významný (p < 0,0001).
Výskyt komorbidit u zemřelých a přeživších pacientů je uveden v tab. 2. Ve skupině zemřelých byl signifikantně vyšší celkový výskyt onemocnění srdce ve srovnání s ostatními pacienty (86,2 % vs 67,3 %; p = 0,04; odds ratio – OR 3,0; 95% CI 1,01–9,17), nejvyšší podíl měla ischemická choroba srdeční (58,6 % vs 38,7 %; p = 0,04; OR 2,3; 95% CI 1,01–5,0). U zemřelých ve srovnání s přeživšími nemocnými nebyly zjištěny signifikantní rozdíly ve výskytu plicních onemocnění (44,8 % vs 41,7 %; p = 0,75) ani samotné CHOPN (34,5 % vs 31,0 %; p = 0,7). Při hodnocení fyzikálních a laboratorních nálezů byla prokázána u zemřelých pacientů oproti přeživším významně vyšší frekvence výskytu tachykardie > 90/min (51,7 % vs 27,4 %; p = 0,01; OR 2,8, 95% CI 1,3–6,3), tachypnoe > 30/min (37,9 % vs 13,7 %; p = 0,001; OR 3,9, 95% CI 1,6–9,2) a acidózy < 7,35 (27,6 % vs 8,9 %; p = 0,004; OR 3,9; 95% CI 1,5–10,3). Ostatní sledované komorbidity, fyzikální a laboratorní nálezy se významně nelišily mezi skupinou zemřelých a přeživších pacientů.
Terapie
V předhospitalizačním období byla antibiotická terapie zahájena u 70 pacientů (35,5 %). Antibiotická terapie podávaná před hospitalizací, následně v průběhu hospitalizace a další nefarmakologická léčba za hospitalizace na JIP jsou uvedeny v tab. 3 a tab. 4.
PSI a prognóza pacientů
U všech pacientů s pneumonií byla kalkulována hodnota PSI, jehož průměrné hodnoty dosahovaly 115,4 ± SD 30,4 bodů (rozsah 45–192). U mužů byla vyšší průměrná hodnota PSI (117,5 ± SD 30,7) než u žen (110,8 ± SD 29,4 bodů), rozdíl nebyl statisticky signifikantní. Dvouvýběrovým t-testem byl prokázán statisticky významný rozdíl mezi PSI zemřelých pacientů (137,4 ± SD 26,1) a pacientů, kteří nezemřeli (111,7 ± SD 29,6), p < 0,0001 (graf 1). U pacientů, kteří vyžadovali umělou plicní ventilaci na KARIM, byla zjištěna vyšší průměrná hodnota PSI (122,6 ± SD 30,3) než u pacientů, kteří nebyli přeloženi na KARIM (110,0 ± SD 29,2), rozdíl však není statisticky signifikantní (p = 0,057). Ve skupině přeživších pacientů nebyly prokázány statisticky významné rozdíly v hodnotách PSI mezi nemocnými, kteří byli propuštěni z JIP přímo do ambulantní péče, nebo přeloženi na standardní oddělení a oddělení následné péče. Korelační analýza neprokázala statisticky významnou závislost mezi PSI a délkou hospitalizace (Spearmanův korelační koeficient r = 0,12; p = 0,15).
Vliv patogenů na délku hospitalizace, PSI a mortalitu
Frekvence výskytu jednotlivých patogenů detekovaných mikrobiologickými metodami v celém souboru pacientů je uvedena v tab. 5. Ve většině případů se jednalo o smíšené infekce (60,9 % pacientů). Zcela negativní mikrobiologický nález byl přítomný pouze u 29 pacientů (14,7 %). Statisticky významný rozdíl byl prokázán mezi délkou hospitalizace pacientů s infekcí Staphylococcus sp. (včetně Staphylococcus aureus, 1 případ methicillin-rezistentní Staphylococcus aureus – MRSA) (průměr 12,3 ± SD 9,0, medián 9,5, IQR 7–16) a bez ní (průměr 8,5 ± SD 5,7, medián 8, IQR 4–11), p = 0,02 (graf 2). Taktéž infekce Klebsiella pneumoniae měla signifikantní vliv na délku hospitalizace: pacienti s nálezem Klebsiella pneumoniae (průměr 12,1 ± SD 8,2, medián 9, IQR 7–16) a bez Klebsiella pneumoniae (průměr 8,8 ± SD 6,4, medián 8, IQR 4–13), p = 0,02 (graf 3). Nebyl prokázán statisticky významný rozdíl mezi délkou hospitalizace nemocných s infekcí Pseudomonas aeruginosa (průměr 11,2 ± SD 7,2, medián 9, IQR 4–14) a bez ní (průměr 9,4 ± SD 7,1, medián 8, IQR 4–13), p = 0,16, ani pacientů s kultivačním nálezem Streptococcus sp. (průměr 10,8 ± SD 8,5, medián 9, IQR 5–13) a bez tohoto nálezu (průměr 9,5 ± SD 6,8, medián 8, IQR 4–14), p = 0,6. Taktéž délka hospitalizace u pacientů s aktivní chlamydiovou infekcí s pozitivitou protilátek IgM a IgA proti Chlamydia sp. (průměr 10,0 ± 7,8, medián 8,0, IQR 3,9–14,1) se významně nelišil od nemocných bez této infekce (průměr 9,6 ± 6,9, medián 9,0, IQR 4–13).


Nebyly zjištěny statisticky významné rozdíly mezi PSI pacientů v závislosti na nejčastějších patogenech: pacienti s Pseudomonas aeruginosa (průměr 106,6 ± SD 25,4) a bez Pseudomonas aeruginosa (průměr 117,1 ± SD 31,1), p = 0,069; pacienti se Staphylococcus sp. (průměr 112,8 ± SD 25,5) a bez Staphylococcus sp. (průměr 116,6 ± SD 32,5), p = 0,403; pacienti s Klebsiella pneumoniae (průměr 115,2 ± SD 27,7) a bez Klebsiella pneumoniae (průměr 115,4 ± SD 31,3), p = 0,968; pacienti se Streptococcus sp. (průměr 105,9 ± SD 26,0) a bez Streptococcus sp. (průměr 116,7 ± SD 30,8), p = 0,103; pacienti s aktivní chlamydiovou infekcí (průměr 118,7 ± SD 30,3) a bez ní (průměr 114,3 ± SD 30,5), p = 0,385. Hodnocení souvislosti patogenů s mortalitou neprokázalo statisticky významné rozdíly.
Diskuse
Komplexní americký skórovací systém PSI dle Fineho z roku 1997 zahrnuje 20 položek s různou váhou a relativně dobře predikuje komplikace a mortalitu nemocných (area under curve – AUC 0,70–0,89) [6,7]. V naší studii jsme prokázali signifikantní rozdíl v PSI mezi zemřelými a přeživšími pacienty hospitalizovanými na JIP. Tento výsledek je ve shodě s dosavadními studiemi [6,8,9]. Bylo prokázáno, že využívání tohoto systému pro stratifikaci pacientů a management léčby zlepšuje péči o nemocné, ale jako každý skórovací systém má i svoje limitace. Významnou váhu v tomto systému má věk pacienta a komorbidity. Z toho plyne i nevýhoda PSI, že pacient může být klasifikován jako těžká pneumonie (třídy IV a V) pouze na základě věku a přidružených nemocí. A naopak PSI může podhodnocovat závažnost pneumonie u mladších pacientů, u kterých nemusí predikovat nutnost hospitalizace na JIP nebo výskyt komplikací. Proto stejně jako ostatní skórovací systémy je doporučováno PSI brát v úvahu při rozhodování o hospitalizaci pouze v korelaci s celkovým klinickým stavem pacienta.
Jako nezávislé negativní prognostické faktory pro 30denní mortalitu se v naší studii ukázaly být věk, tachykardie > 90/min, tachypnoe > 30/min, acidóza s pH < 7,35 a z přidružených onemocnění zejména kardiální nemoci, z kterých největší podíl měla ischemická choroba srdeční. Překvapujícím poznatkem bylo, že chronické plicní nemoci v tomto souboru nemocných nezvyšovaly úmrtnost pacientů s pneumonií. V naší studii byla prokázána signifikantní asociace tachykardie již > 90/min s mortalitou pacientů, ačkoliv PSI a řada studií uvádí ve svých kritériích tachykardii > 125/min.
Souvislost acidózy, tachykardie a tachypnoe s mortalitou pacientů byla prokázána u pneumonie i akutního syndromu respirační tísně [10–12]. Časná respirační acidóza je prokázaným rizikovým faktorem pro vývoj postoperační pneumonie u pacientů po plicních resekčních výkonech [13]. Pokročilý věk, městnavé srdeční selhání, hypotenze, acidóza, poruchy výměny krevních plynů, hypotermie, trombocytopenie a pleurální výpotek jsou faktory asociované se selháním léčby u CAP [14]. V souboru našich pacientů byla s mortalitou asociována acidóza nezávisle na hyperkapnii nebo hypoxemii, u kterých nebyl prokázán signifikantní rozdíl mezi zemřelými a přeživšími pacienty. Jako hlavní prognostické kritérium pro rozhodnutí o hospitalizaci na JIP byla acidóza s pH < 7,3 nově navržena jako doplněk skórovacího systému Americké společnosti pro infekční nemoci a Americké hrudní společnosti (IDSA/ATS) pro CAP z roku 2007 [15]. Acidóza je ve spojitosti s pneumonií a sepsí považována za dvousečnou zbraň. Permisivní hyperkapnická acidóza je důležitým protektivním faktorem využívaným při umělé plicní ventilaci zlepšujícím prognózu pacientů [16]. Patofyziologickým podkladem je suprese imunitních reakcí, zejména vlivem na cytokinovou síť, funkci fagocytů a adaptivní imunitní odpověď. U zvířecích modelů bylo prokázáno, že hyperkapnická acidóza snižuje poškození plicní tkáně v časných fázích bakteriální pneumonie, ale u déle trvajícího zánětu může naopak zhoršovat plicní poškození mechanizmem inhibice funkce neutrofilů [16].
Dalším prokázaným závažným rizikovým faktorem ovlivňujícím prognózu nemocných s pneumonií jsou onemocnění srdce. Vztah pneumonie a kardiálních nemocí je velmi úzký. Epidemiologická data ukazují, že onemocnění myokardu a srdečních chlopní vedoucí k chronickému srdečnímu selhání jsou rizikovým faktorem pro vznik pneumonie [17]. Pacienti s chronickým srdečním selháním mají sníženou obranyschopnost z důvodu interference plicní kongesce s fyziologickými obrannými mechanizmy probíhajícími na alveolárním epiteliálním povrchu (např. snížení efektivity opsonizace nebo aktivity makrofágů), čímž se zhoršuje mikrobiální clearence a dochází k množení patogenů v plicní tkáni a rozvoji pneumonie [17,18]. A naopak u nemocných s pneumonií se velmi často vyskytují kardiální komplikace a významně zvyšují mortalitu pacientů [19]. Bylo zjištěno, že akutní onemocnění srdce (např. akutní srdeční selhání, akutní srdeční infarkt, některé klinicky závažné arytmie) jsou často předcházeny akutní respirační infekcí včetně pneumonie, a proto se předpokládá kauzální souvislost [20,21]. U pacientů s pneumonií byly prokázány mnohočetné účinky na kardiovaskulární systém – snížená reaktivní hyperemie a odezva na oxid dusný, zvýšená koncentrace endotelinu 1 a adrenomedullinu, snížená systolická funkce myokardu levé komory, myokarditida, akutní arytmie, akutní zánětlivé změny v aterosklerotických plátech koronárních arterií, koronární vazokonstrikce, zvýšení tlaku v a. pulmonalis, porucha funkce kardiovaskulárního autonomního nervového systému, zvýšená prokoagulační aktivita, zvýšená tvorba vazopresinu, snížení aktivity angiotenzin konvertujícího enzymu, retence vody a další [17]. Metaanalýza 25 studií zabývajících se incidencí kardiálních komplikací u pacientů hospitalizovaných pro pneumonii v prvních 30 dnech ukázala 14 % pacientů s nově zjištěným nebo zhoršeným srdečním selháním (rozmezí 7–33 %), 5 % pacientů s nově zjištěnými nebo zhoršenými arytmiemi (rozmezí 1–11 %) a 5 % pacientů s akutním koronárním syndromem – infarkt myokardu nebo nestabilní angina pectoris (rozmezí 1–11 %) [22]. V našem souboru pacientů srdeční selhání komplikovalo průběh hospitalizace u 7,6 % nemocných. Arytmie (fibrilace síní) byla zjištěna při přijetí u 5,6 % pacientů. Tento výskyt je v souladu s rozmezím uváděném v metaanalýze autorů Corrales-Medina et al [22].
Z důvodu vysoké incidence a mortality kardiálních příhod u pneumonie byl recentně publikován nový skórovací systém ke stratifikaci rizika kardiálních komplikací u pacientů s CAP [23]. Tento skórovací systém predikuje riziko kardiálních komplikací v prvních 30 dnech nemoci lépe než PSI. Skórovací systémy pro CAP jsou neustálým předmětem zkoumání a ověřování validity. Perspektivou je využití panelu biomarkerů, které v kombinaci s klinickými nálezy mohou zlepšit predikci dalšího vývoje pneumonie [7]. Kromě rutinně používaného C-reaktivního proteinu, je užitečným markerem prokalcitonin a N-terminální fragment natriuretického peptidu typu B (NT-proBNP) [24,25]. Podle novějších poznatků je NT-proBNP velmi silným prediktorem časné mortality u CAP nezávislým na klinických prognostických indikátorech a je srovnatelný s PSI [25]. Patofyziologický mechanizmus této asociace není dosud přesně objasněn. Předpokládá se, že srdeční dysfunkce je velmi důležitým faktorem mortality u pneumonie a pacienti s elevací NT-proBNP i bez klinických známek srdečního selhání mají vysoké riziko úmrtí na pneumonii, a proto vyžadují odlišný terapeutický přístup.
Naše studie neprokázala signifikantní souvislost mezi PSI, mortalitou a výskytem jednotlivých patogenů, avšak délku hospitalizace ovlivňovala významně infekce Staphylococcus sp. a Klebsiella pneumoniae. Staphylococcus sp. a Klebsiella pneumoniae byly nejčastějšími identifikovanými bakteriálními patogeny v našem souboru pacientů. Podíl Staphylococcus aureus z celkového počtu nálezů Staphylococcus sp. byl minoritní (pouze u 5,6 % pacientů) a většinu ostatních nalezených stafylokoků lze považovat za součást kolonizující flóry dýchacích cest, která nemá přímou kauzální souvislost s pneumonií. Proto lze usuzovat, že nejčastějším patogenem, který byl primárním etiologickým agens způsobujícím pneumonii u našich pacientů s pneumonií na JIP, byla Klebsiella pneumoniae. Souvislost etiologie pneumonie se závažností nemoci a PSI byla dříve prokázána u infekcí Pseudomonas aeruginosa a gramnegativními bakteriemi, méně senzitivní jsou skórovací systémy u smíšených infekcí [26]. Tyto patogeny se častěji vyskytují ve skupině středně těžké a těžké pneumonie. Infekce Klebsiella pneumoniae a Pseudomonas aeruginosa je asociována i s mortalitou pneumonie [26,27]. Tento fakt se v našem souboru pacientů nepotvrdil, ale limitací studie je relativně nízký počet pacientů.
Závěr
Závěrem lze říct, že PSI je významným prediktorem 30denní mortality pacientů s CAP na JIP, ale nekoreluje s délkou hospitalizace ani s nálezem jednotlivých patogenů. Nezávislými negativními prognostickými faktory u pacientů s CAP jsou věk, výskyt kardiálních onemocnění (zejména ICHS), tachykardie, tachypnoe a acidóza. Výskyt infekce Staphylococcus sp. a Klebsiella pneumoniae se signifikantně podílejí na prodloužení doby hospitalizace. Všechny tyto faktory mohou upozorňovat na potřebu zvýšené péče o pacienty s CAP.
Grantová podpora: IGA MZ ČR NT11117 a IGA_LF UP_2014_020.
MUDr. Petr Jakubec, Ph.D.
petr.jakubec@fnol.cz
Klinika plicních nemocí a tuberkulózy LF UP a FN, Olomouc
www.fnol.cz
Doručeno do redakce 21. 8. 2014
Přijato po recenzi 20. 10. 2014
Sources
1. Kolek V. Prognóza nemocných s komunitní pneumonií. Poučení z klinických doporučení, skórovacích systémů a dalších parametrů. Postgraduální medicína 2013; 15(8): 51–56.
2. Kolek V, Kolář M, Kašák V et al. Diagnostika a léčba komunitní pneumonie dospělých. In: Kolek V et al. Doporučené postupy v pneumologii. Maxdorf: Praha 2013 : 107–123. ISBN 978–80–7345–359–6.
3. Beneš J, Džupová O, Blechová Z et al. Skórovací systémy hodnotící prognózu komunitních pneumonií. Vnitř Lék 2012; 58(5): 357–364.
4. Jakubec P. Těžká komunitní pneumonie – uptodate 2013. Postgraduální medicína 2014; 16(2): 181–190.
5. Jakubec P, Kolek V, Kolář M. Diagnostika a léčba těžké pneumonie. In: Kolek V et al. Doporučené postupy v pneumologii. Maxdorf: Praha 2013 : 124–140. ISBN 978–80–7345–359–6.
6. Fine MJ, Auble TE, Yealy DM et al. A prediction rule to identify lowrisk patients with community acquired pneumonia. N Engl J Med 1997; 336(4): 243–250.
7. Chalmers JD, Rutherford J. Can we use severity assessment tools to increase outpatient management of community-acquired pneumonia? Eur J Int Med 2012; 23(5): 398–406.
8. Renaud B, Coma E, Hayon J et al. PNEUMOCOM study investigators: Investigation of the ability of the Pneumonia Severity Index to accurately predict clinically relevant outcomes: a European study. Clin Microbiol Infect 2007; 13(9): 923–931.
9. Angus DC, Marrie TJ, Obrosky DS et al. Severe community-acquired pneumonia: use of intensive care services and evaluation of American and British Thoracic Society Diagnostic criteria. Am J Respir Crit Care Med 2002; 166(5): 717–723.
10. Choudhury G, Chalmers JD, Mandal P et al. Physician judgement is a crucial adjunct to pneumonia severity scores in low-risk patients. Eur Respir J 2011; 38(3): 643–648.
11. Bhadade RR, de Souza RA, Harde MJ et al. Clinical characteristics and outcomes of patients with acute lung injury and ARDS. J Postgrad Med 2011; 57(4): 286–290.
12. Calle A, Márquez MA, Arellano M et al. Geriatric Assessment and Prognostic Factors of Mortality in Very Elderly Patients With Community-Acquired Pneumonia. Arch Bronconeumol 2014; 50(10):429–434.
13. Planquette B, Le Pimpec-Barthes F, Trinquart L et al. Early respiratory acidosis is a new risk factor for pneumonia after lung resection. Interact Cardiovasc Thorac Surg 2012; 14(3): 244–248.
14. Aliberti S, Amir A, Peyrani P et al. Incidence, etiology, timing, and risk factors for clinical failure in hospitalized patients with community-acquired pneumonia. Chest 2008; 134(5): 955–962.
15. Sibila O, Meduri GU, Mortensen EM et al. Improving the 2007 Infectious Disease Society of America/American Thoracic Society severe community-acquired pneumonia criteria to predict intensive care unit admission. J Crit Care 2013; 28(3): 284–290.
16. Corrales-Medina VF, Musher DM, Shachkina S et al. Acute pneumonia and the cardiovascular system. Lancet 2013; 381(9865): 496–505.
17. Curley G, Contreras MM, Nichol AD et al. Hypercapnia and acidosis in sepsis: a double-edged sword? Anesthesiology 2010; 112(2): 462–472.
18. Mor A, Thomsen RW, Ulrichsen SP et al. Chronic heart failure and risk of hospitalization with pneumonia: a population-based study. Eur J Intern Med 2013; 24(4): 349–353.
19. Corrales-Medina VF, Musher DM, Wells GA et al. Cardiac complications in patients with community-acquired pneumonia: incidence, timing, risk factors, and association with short-term mortality. Circulation 2012; 125(6): 773–781.
20. Khand AU, Gemmell I, Rankin AC et al. Clinical events leading to the progression of heart failure: insights from a national database of hospital discharges. Eur Heart J 2001; 22(2): 153–164.
21. Corrales-Medina VF, Madjid M, Musher DM. Role of acute infection in triggering acute coronary syndromes. Lancet Infect Dis 2010; 10(2): 83–92.
22. Corrales-Medina VF, Suh KN, Rose G et al. Cardiac complications in patients with community-acquired pneumonia: a systematic review and meta-analysis of observational studies. PLoS Med 2011; 8(6): e1001048. Dostupné z DOI: <http://doi.org/10.1371/journal.pmed.1001048>.
23. Corrales-Medina VF, Taljaard M, Fine MJ et al. Risk stratification for cardiac complications in patients hospitalized for community-acquired pneumonia. Mayo Clin Proc 2014; 89(1): 60–68.
24. Lippi G, Meschi T, Cervellin G. Inflammatory biomarkers for the diagnosis, monitoring and follow-up of community-acquired pneumonia: clinical evidence and perspectives. Eur J Intern Med 2011; 22(5): 460–465.
25. Chang CL, Mills GD, Karalus NC et al. Biomarkers of Cardiac Dysfunction and Mortality from Community-Acquired Pneumonia in Adults. PLoS One 2013; 8(5): e62612. Dostupné z WWW: <http://www.plosone.org/article/info%3Adoi%2F10.1371%2Fjournal.pone.0062612>.
26. Cillóniz C, Ewig S, Polverino E et al. Microbial aetiology of community-acquired pneumonia and its relation to severity. Thorax 2011; 66(4): 340–346.
27. Lee YT, Chen SC, Chan KC et al. Impact of infectious etiology on the outcome of Taiwanese patients hospitalized with community acquired pneumonia. J Infect Dev Ctries 2013; 7(2): 116–124.
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Internal Medicine

2015 Issue 1
-
All articles in this issue
- POET2 – editorial
- Překvapivě starý kostlivec ve skříni – editorial
- HevyLite™ – nová metoda detekce monoklonálních imunoglobulinů – editorial
- Význam Pneumonia Severity Index u pacientů s pneumonií hospitalizovaných na jednotce intenzivní pneumologické péče
- Registr POET2: srovnání přímých ročních zdravotnických nákladů na léčbu diabetu 2. typu po zahájení léčby inzulinem NPH nebo inzulinem glargin v kombinaci s perorálními antidiabetiky v České republice
- Terapeutické monitorování amikacinu a gentamicinu v rutinní klinické praxi
- Asymptomatická hyperurikémia a metabolický syndróm u mladistvých
- Studium souvislostí poruch spánku, obstrukční spánkové apnoe a vzniku a léčby arteriální hypertenze – módní vlna nebo dlouhodobý trend?
- Tachykardií indukovaná kardiomyopatie
- Význam vyšetření párů těžkých/lehkých řetězců imunoglobulinu u monoklonálních gamapatií
-
Akútne a chronické aortové choroby hrudníkovej a brušnej aorty u dospelých
Odporúčania Angiologickej sekcie Slovenskej lekárskej komory pre klasifikáciu a diagnózu chorôb aorty (AS SLK, 2014) - Distribuce hodnot glykovaného hemoglobinu v populaci diabetiků 2. typu: projekt Valetudo
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue
- Terapeutické monitorování amikacinu a gentamicinu v rutinní klinické praxi
- Asymptomatická hyperurikémia a metabolický syndróm u mladistvých
- Tachykardií indukovaná kardiomyopatie
- Význam vyšetření párů těžkých/lehkých řetězců imunoglobulinu u monoklonálních gamapatií