Novinky v diagnostice a léčbě MEN1
News in diagnostics and therapy of multiple endocrine neoplasia type 1
MEN1 syndrome is an autosomal dominant disorder caused by mutation in the menin gene located on the 11th chromosome. It is a rare disorder with incidence of 1 : 30 000. It involves functional or cancerous diseases of parathyroid glands, hypophysis, endocrine pancreas, adrenal glands, or other tumors. The diagnosis of MEN1 is suspected if at least 2 components of this multiple tumor syndrome occur simultaneously. The increase in diagnostic precision enables detection of MEN1 in its early stages. Currently, the most frequently discussed topics include the use of biomarkers for diagnostics and new approaches in surgical treatment of MEN1.
Key words:
endosonography – chromogranin A – menin – multiple endocrine neoplasia type 1 – neuroendocrine tumor – pituitary adenoma – primary hyperparathyroidism
Authors:
Karel Starý
Authors‘ workplace:
Endokrinologické pracoviště Interní gastroenterologické kliniky LF MU a FN Brno, pracoviště Bohunice, přednosta prof. MUDr. Aleš Hep, CSc.
Published in:
Vnitř Lék 2015; 61(10): 896-899
Category:
Reviews
Overview
Syndrom MEN1 je autozomálně dominantní onemocnění, které je způsobeno mutací genu pro menin na 11. chromozomu. Svou incidencí 1 : 30 000 se řadí mezi onemocnění vzácná. Sdružuje funkční či nádorová onemocnění příštítných tělísek, hypofýzy, endokrinního pankreatu, nadledvin, případně jiné nádory. Diagnóza MEN1 je podezřelá, vyskytnou-li se společně alespoň 2 složky tohoto mnohonádorového syndromu. Se zvyšující se přesností diagnostických metod je snaha zachytit MEN1 v časnější fázi. Mezi nejvíce diskutovaná témata patří využití biomarkerů v diagnostice a nové přístupy v chirurgické léčbě MEN1.
Klíčová slova:
adenom hypofýzy – endosonografie – chromogranin A – menin – mnohočetná endokrinní neoplazie – neuroendokrinní nádory – primární hyperparatyreóza
Úvod
Syndrom mnohočetné endokrinní neoplazie typu 1 (multiple endocrine neoplasia type 1 – MEN1, Wermerův syndrom) je autozomálně dominantní onemocnění, které je způsobeno mutací tumor supresorového genu na dlouhém raménku 11. chromozomu (11q13). Gen byl identifikován v roce 1988 Larssonem. První informace o genetickém podkladu MEN1 podal Wermer již v roce 1963. Gen kóduje protein menin. Jedná se o jaderný protein složený z 610 aminokyselin. Jeho role je v replikaci a opravách DNA. Selhává tak role regulátoru buněčné proliferace [1]. Mutace genu jen v 10 % vzniká nově v raném embryonálním stadiu, v ostatních případech se dědí od postiženého rodiče [1]. Při zjištění mutace v genu MEN1 je indikováno vyšetření v přímé příbuzenské linii. Doposud bylo nutné odesílat vzorky k vyšetření do zahraničí, recentně je možné vyšetření v Endokrinologickém ústavu v Praze.
MEN1 se řadí mezi onemocnění vzácná. S incidencí 1 : 30 000 se však s MEN1 téměř jistě setká každý lékař mnohokrát během své praxe. Jelikož je primární hyperparatyreóza (PHP) nejčastějším a většinou i prvním projevem MEN1, každý nález hyperkalcemie by měl diferenciálně diagnostickou rozvahu vést i tímto směrem.
MEN1 je charakterizován hyperplazií, adenomy či malignitami endokrinních tkání. Většina nádorů, které vznikají v souvislosti s mutací genu pro menin, je benigních [2]. Klinické projevy nejčastěji souvisejí s jejich hormonální hyperaktivitou. Funkční endokrinní symptomatologie je proto většinou nápadnější než příznaky obecně onkologické.
Primární hyperparatyreóza
Primární hyperparatyreóza je nejčastěji prvním projevem MEN1. Postihuje téměř všechny pacienty s MEN1 (95–98 %) [3]. Podkladem je hyperplazie či adenom příštítného tělíska. Karcinom příštítného tělíska je diagnóza raritní. Je metabolicky neobyčejně aktivní, diagnóza je potvrzena histologicky [4]. Pokud je pacient léčen pro primární hyperparatyreózu, na souvislost s MEN1 nás může přivést časná recidiva onemocnění. Multiplicitní postižení příštítných tělísek je pro MEN1 typické [5].
Základem diagnózy PHP je biochemické vyšetření (hyperkalcemie, hyperparatyreóza a hypofosfatemie). Lokalizace zvětšeného příštítného tělíska ve zvyklém uložení nebývá ve většině případů problém. Sonografické vyšetření je metodou volby, často jej doplňujeme o biochemické vyšetření aspirátu PTH (parathormon, hormon příštítných tělísek). U všech nemocných s PHP provádíme scintigrafii MIBI (metoxyizobutylizonitril). Nález atypicky uloženého adenomu nebo náhodné zjištění multiplicitního postižení příštítných tělísek není nijak vzácné. Využití dalších zobrazovacích metod (CT či MR) má v diagnostice PHP význam právě jen u atypicky uložených adenomů, případně u objemných hyperplastických tělísek k objektivizaci před operací.
Efektivita chirurgické léčby PHP souvisí se zkušenostmi pracoviště, do kterého jsou pacienti centralizováni. Každý případ PHP vyžaduje individuální přístup. Využití gammanavigované explorace příštítných tělísek, peroperační sonografie i peroperační stanovení plazmatické hladiny PTH se mnohokrát vyplatilo [6,7]. Některá pracoviště prezentují výsledky mininvazivních technik v operaci příštítných tělísek nebo využití radiofrekvenční ablace v léčbě PHP. Nelze však hovořit o širším využití těchto léčebných metod.
Neuroendokrinní nádory pankreatu
Neuroendokrinní nádory pankreatu (pNEN) se vyskytují u 60 % pacientů s MEN1. Zastoupení jednotlivých pNEN je z různých pracovišť prezentováno velmi rozdílně. Gastrinom je zastoupen přibližně v 60 %, inzulinom v 20 %, dále se vyskytuje afunkční pNEN a další vysloveně raritní pNEN jako glukagonom, VIPom a další. Jeden z největších souborů byl prezentován letos italskými autory Milanetto et al. U jejich pacientů s MEN1 se nejčastěji vyskytují afunkční pNEN [8].
Při zobrazení slinivky je standardem CT či MRI, řada pNEN je lépe zobrazitelných pomocí endo(ultra)sonografie (EUS). Pro drobné inzulinomy je to vysloveně typické. Možnost cytologického nebo histologického vyšetření ložiska pod EUS kontrolou řadí tuto metodu na první místo při vyšetření pNEN s výjimkou kaudy, která je vyšetřitelná endosonograficky jen orientačně. Senzitivita EUS pro diagnostiku pNEN je 94 % (obr).
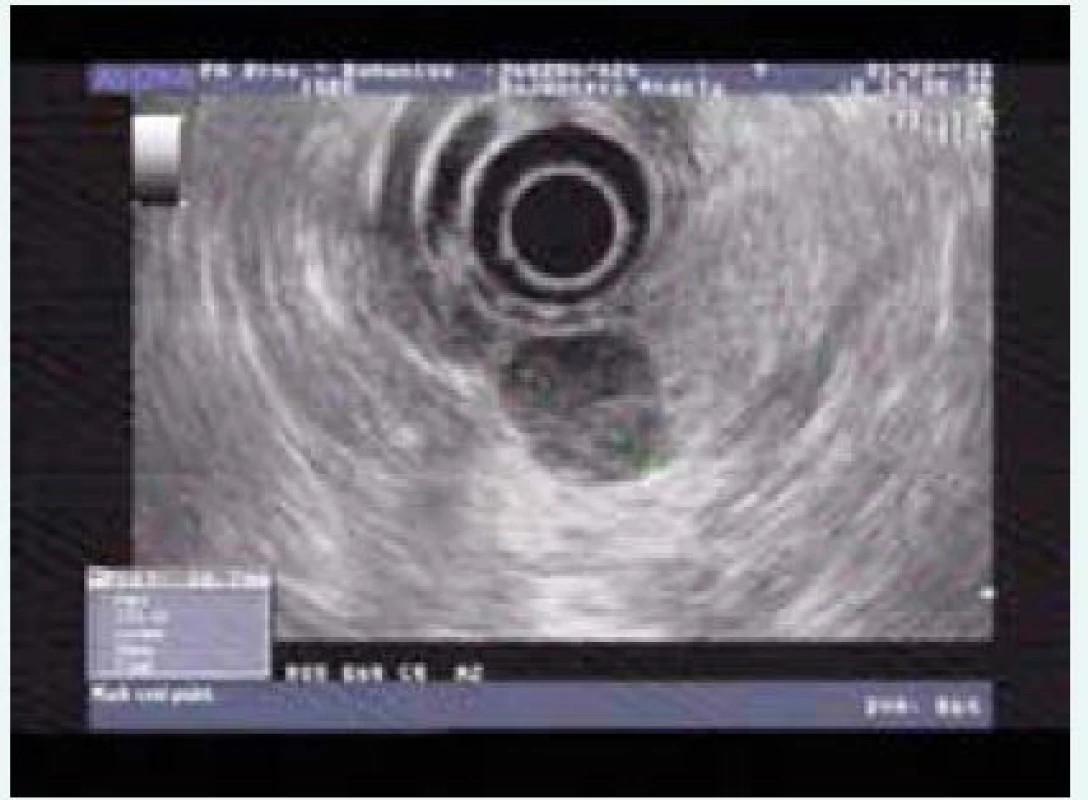
Na ENETS 2015 (European Neuroendocrine Tumor Society) byly prezentovány výsledky srovnání jednotlivých scintigrafických metod. Pro diagnostiku inzulinomu má 68Ga-DOTA-PET-CT 100% senzitivitu, OctreoScan dosahuje senzitivity 45–50 %, výtěžnost 18F-FDG-PET závisí na biologické povaze tumoru. Ve stejné studii měla MRI (3 Tesla) senzitivitu pouze 71 %. Ve výjimečných případech funkčních pNEN žádáme operatéra o exploraci pankreatu peroperační sonografií (senzitivita 75–90 %) a palpací (senzitivita 70 %).
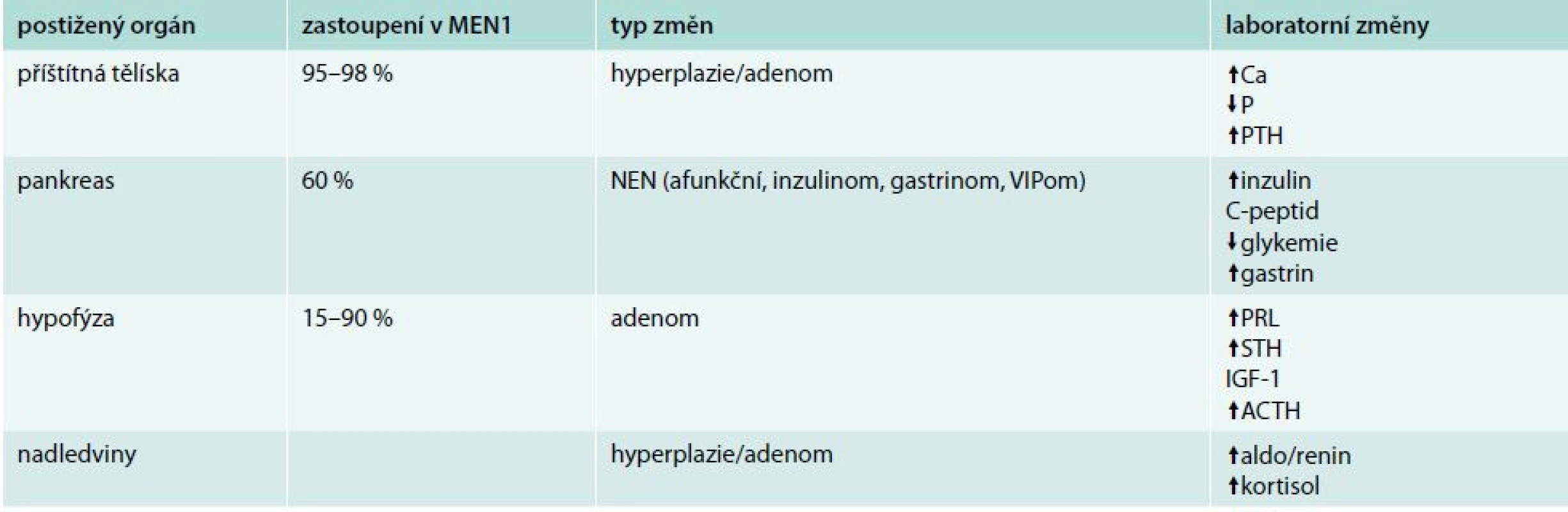
Vedle zobrazovacích metod je v diagnostice MEN1 důležité stanovení biomarkerů. Specifické biomarkery jsou odrazem hormonální aktivity konkrétních tumorů a podílejí se na symptomatologii. Nespecifické biomarkery využíváme jako signál přítomností tumorů i hormonálně neaktivních. Specifické biomarkery jsou uvedeny v tab. 1. Mezi nespecifické biomarkery řadíme chromogranin A (CgA), neuron-specifickou enolázu (NSE), α a β podjednotku HCG.
V diagnostice inzulinomu je dosud nepřekonán test s hladověním. V až 72 hod trvajícím testu se snažíme dosáhnout hypoglykemie a objektivizovat vysokou hladinu inzulinu a C-peptidu. Diferenciální diagnostika hypoglykemie je široká. Nutno pomyslet na předávkování perorálními antidiabetiky, inzulinem, haloperidolem či salicyláty, intoxikaci alkoholem, jaterní a ledvinnou nedostatečnost, dumping syndrom nebo gastrický bypass. Z endokrinních příčin nejčastěji způsobuje hypoglykemii addisonizmus. U onkologických pacientů může hypoglykemie doprovázet i jiné pokročilé malignity. Biochemická diagnostika může selhat zejména v případě, tvoří-li pNEN proinzulin. Tento uniká běžně používaným biochemickým metodám.
Větší problémy může působit interpretace hladiny gastrinu. U pacientů s gastrinomem je hladina gastrinu i 10krát elevovaná [9]. Zvýšená hladina gastrinu je běžná i u pacientů se sníženou kyselou žaludeční sekrecí (atrofická gastritida, terapie inhibitory protonové pumpy – PPI). Vysazení PPI přitom u pacientů se Zollingerovým-Ellisonovým syndromem (ZES) není téměř možné. Dobrou zkušenost máme se stanovením intragastrického pH během léčby. U pacientů s ZES většinou navzdory léčbě PPI zůstává pH nízké.
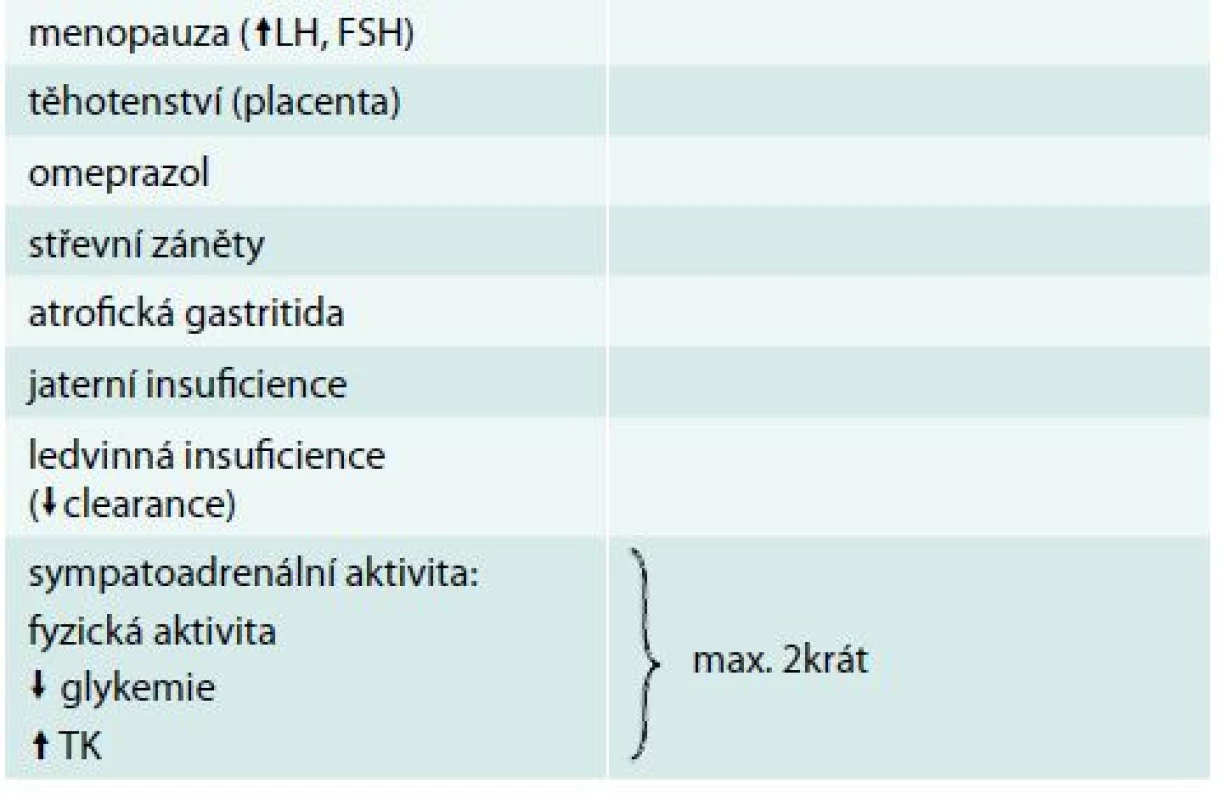
Chromogranin A (CgA) je nejběžněji používaným nespecifickým biomarkerem neuroendokrinních nádorů (NEN). Jedná se o kyselý hydrofilní glykoprotein složený ze 439 aminokyselin. Různé neuroendokrinní buňky tvoří CgA rozdílně. Nejlépe se hodí stanovení CgA v diagnostice pokročilých NEN zažívacího traktu včetně pankreatu k posouzení léčebné odezvy. Pacienti s rychlým poklesem hladiny CgA během léčby mají lepší medián přežití. Pro primodiagnostiku NEN je dnes považován za málo specifický a nevhodný [10]. Téměř jistě bude dobrým biomarkerem u pacientů s histochemicky prokázaným chromograninem v tumoru. Většina studií stanovuje senzitivitu CgA pro NEN 75 % a specificitu 70–85 %. Hladina CgA je zvýšena i u jiných onkologických i neonkologických stavů (tab. 2 a tab. 3).
Při chirurgické léčbě ložisek pankreatu je nutno počítat s případnými komplikacemi. Po operaci má pacient riziko vzniku diabetes mellitus, exokrinní nedostatečnosti, vzniku pankreatické píštěle nebo průjmů.
Srovnání morbidity a mortality chirurgie pankreatu a samotných pNEN je v indikaci operace zásadní. Mortalita i morbidita stoupá s rozsahem resekčního výkonu. Cílem je operovat pacienty, u nichž lze problém řešit efektivně včas indikovaným a co nejméně radikálním výkonem. Pozitivní zkušenosti máme s využitím radiofrekvenční ablace NEN pankreatu [11].
Mezi dobré kandidáty resekce NEN pankreatu patří pacienti s inzulinomem, gastrinomem, případně jinými vzácnými funkčními NEN, a dále též pacienti s afunkčním NEN pankreatu > 20 mm (G1, G2) bez neresekabilních metastáz. Konzervativní postup jako první krok u pacientů s MEN1 a nf-NEN pankreatu < 20 mm je mnoha autory považován za bezpečný. Z chirurgické léčby dále neprofitují pacienti s funkčním NEN pankreatu s mnohočetnými metastázami, u nichž operací nelze odstranit alespoň 70–90 % hormonálně aktivní tkáně, a pacienti s afunkčním NEN s mnohočetnými jaterními metastázami. Samozřejmě nelze chirurgicky léčit ložiska pankreatu u pacientů, jejichž celkový stav náročnou operaci neumožňuje.
Expanze hypofýzy
Incidence expanzí hypofýzy u MEN 1 je udávána s ještě větší variabilitou 15–90 % [5]. Nejčastěji se jedná o prolaktinomy (60 %), méně častá je akromegalie (< 25 %), Cushingova choroba (5 %) nebo se jedná o adenomy afunkční. Někdy lze pozorovat jen zvětšenou hypofýzu. Zejména u mladých pacientů s MEN1 předchází vzniku adenomu. Zobrazení magnetickou rezonancí (MRI) je metodou volby pro zobrazení hypofýzy [12]. Pokud MRI nelze z důvodu absolutní kontraindikace provést, je nutné jiné vyšetřovací metody považovat jen za orientační.
Nejčastější hormonálně aktivní adenomy hypofýzy, které nacházíme u MEN1, jsou prolaktinomy. Jejich léčba je téměř výhradně farmakologická [12]. Základem léčby ostatních funkčních hypofyzárních adenomů je endonazální transsfenoidální resekce. Z kraniotomie je dnes operováno naprosté minimum pacientů s rozsáhlými adenomy. Léčba akromegalie je individuálně volena u každého pacienta. Kromě neurochirurgické intervence využíváme léčbu Leksellovým gamanožem, zevní radioterapii a farmakoterapii. Léčba somatostatinovými analogy (oktreotid, lanreotid) a blokátory receptorů pro růstový hormon (pegvisomant) je efektivní. Navzdory vysokým nákladům je v řadě případů farmakoterapie jedinou léčebnou možností, jak snížit (normalizovat) hladinu růstového hormonu. Téma je mezi endokrinology bohatě diskutováno. Cushingova choroba nebo sekundární tyreotoxikóza jsou v rámci MEN1 vzácnější. V České republice jsou data dostupná zejména díky registru selárních tumorů (RESET) [13].
Hormonálně neaktivní adenomy hypofýzy mohou být klinicky němé, jindy působí hypopituitarizmus tlakem na hypofýzu nebo poruchu zorného pole při tlaku na optickou dráhu.
Další nádory jsou u MEN1 zastoupeny méně frekventně až vzácně. Jedná se zejména o adenom nadledvin, NEN zažívacího traktu, lipomy, fibrosarkomy a další. 20 % případů primárního hyperaldosteronizmu je v rámci MEN1 [2]. U pacientů s rezistentní hypertenzí, jejichž léčba vyžaduje multikombinaci antihypertenziv, nelze vyšetření nadledvin opominout.
Závěr
MEN1 je diagnostikován lékaři mnoha odborností a na nejrůznějších pracovištích. Kompletní diagnostika a léčba vyžaduje multidisciplinární spolupráci ve specializovaných centrech. Cílem je zachytit MEN1 v době, kdy lze radikální léčbou zajistit pacientovi co nejdelší přežití.
Doručeno do redakce 11. 8. 2015
Přijato po recenzi 25. 9. 2015
MUDr. Karel Starý
kstary@fnbrno.cz
Endokrinologické pracoviště Interní gastroenterologické kliniky LF MU a FN Brno
www.fnbrno.cz
Sources
1. Bendlová B, Dvořáková Š, Vlček P et al. Mnohočetná endokrinní neoplazie typ 1 – syndrom MEN 1. Klin Onkol 2009; 22(Suppl 1): 25–27.
2. Louthan O. Neuroendokrinní nádory – klinické pohledy. Grada: Praha 2006. ISBN 80–247–1162–1.
3. Thakker RV. Genetics of non-Gastro-Entero-Pancreatic (GEP) Neuroendocrine Tumors (NETs). In: Modlin IM, Oberg K A. Century of Advances in Neuroendocrine Tumor Biology and Treatment. Felsenstein C.C.C.P 2008.
4. Linhartová M, Hemmelová B, Starý K et al. Karcinom příštítného tělíska jako vzácná příčina primární hyperparatyreózy – kazuistika. In: Edukační sborník. XXXII. Brněnské onkologické dny.: Masarykův onkologický ústav v Brně: Brno 2008 : 414. ISBN 978–80–86793–11–5.
5. Brunová J, Bruna J. Klinická endokrinologie a zobrazovací diagnostika endokrinopatií. Maxdorf: Praha 2009. ISBN 978–80–7345–190–5.
6. Linhartová M, Neumann Č, Ničovský J et al. Použití gammanavigace při exploraci příštítných tělísek. In: Čáp J (ed). XXX. endokrinologické dny. Nucleus: Hradec Králové 2007. ISBN 978–80–87009–32–1.
7. Linhartová M, Mitáš L, Starý K et al. Výtěžnost peroperační ultrasonografie v chirurgii příštítných tělísek. Rozhledy v chirurgii 2012; 91(11): 614–619.
8. Milanetto AC, Lico V, Alaggio R et al. 38 Years of Experience in a Single Centre on Neuroendocrine Pancreatico-Duodenal Tumors in Multiple Endocrine Neoplasia Type 1 Syndrome. ENETS 2015, Barcelona. Abstract book: 59
9. de Herder W, Oberg K. Clinical and Biochemical Markers. In: Modlin IM, Oberg K A Century of Advances in Neuroendocrine Tumor Biology and Treatment: 304–307. Felsenstein C.C.C.P 2008.
10. Marotta V, Nuzzo V, Ferrara T et al. Limitation of Chromogranin A in clinical Practice. ENETS 2015, Barcelona. Abstract book: 140
11. Starý K, Procházka V, Hlavsa J et al. Radiofrekvenční ablace inzulinomu, popis případu. Somatuline Bulletin 2/2012, 4–5, EČ: MK ČR E 19104.
12. Šiprová H, Souček M. Akromegalie a medikamentózní léčba. Vnitř Lék 2015; 61(02): 157–160.
13. Hána V, Švancara J, Bandúrová Ľ et al. Registr selárních tumorů – RESET: Diagnostika a léčba akromegalie v České republice v 21. století. DMEV 2013; 16(4): 219–224.
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Internal Medicine

2015 Issue 10
-
All articles in this issue
- Incidentalom nadledviny
- Adrenální insuficience
- Štítná žláza a gravidita – souhrn důležitých poznatků
- Léčba hypotyreózy a hypertyreózy
- Subklinické tyreopatie
- Chronická lymfocytární tyreoiditida a karcinom štítné žlázy
- Funkční hypotalamická amenorea
- Syndrom polycystických ovarií
- Novinky v diagnostice a léčbě MEN1
- Akromegalie: současný pohled
- Systémová léčba glukokortikoidy: praktický pohled
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue
- Funkční hypotalamická amenorea
- Systémová léčba glukokortikoidy: praktický pohled
- Incidentalom nadledviny
- Adrenální insuficience
