Chronická tromboembolická plicní hypertenze
Chronic thromboembolic pulmonary hypertension
In recent years, we have witnessed a growing interest in diseases of pulmonary circulation. It is due to the development of specific drug therapy for pulmonary hypertension (PH), improving the availability and performance of endarterectomy techniques of pulmonary artery. This technique has been established as method of choice for patients with chronic thromboembolic pulmonary hypertension (CTEPH). However, the crucial issue is early indication of treatment, right diagnosis and determination of exact type of pulmonary hypertension. Modern therapeutic approaches provide better prognosis, quality of life and even possibility to cure the patients, especially suffering from CTEPH. This article discusses the issue of CTEPH.
Key words:
disease of the pulmonary circulation – endarterectomy – pulmonary hypertension – treatment indications
Authors:
Zdeněk Vavera
Authors‘ workplace:
I. interní kardioangiologická klinika LF UK a FN Hradec Králové, přednosta doc. MUDr. Josef Šťásek, Ph. D.
Published in:
Vnitř Lék 2015; 61(3): 228-235
Category:
Review
Overview
V posledních letech jsme svědky narůstajícího zájmu o onemocnění plicní cirkulace. Je to dáno jednak rozvojem na poli specifické farmakoterapie plicní hypertenze (PH), zlepšením její dostupnosti, a také zvládnutím techniky endarterektomie plicnice, jež se etablovala jako metoda první volby pro nemocné s chronickou tromboembolickou plicní hypertenzí (CTEPH). Klíčová je ale časná indikace léčby, a tedy časně stanovená diagnóza a určení typu plicní hypertenze. S moderními terapeutickými prostředky můžeme tak našim pacientům nabídnout kromě zlepšení prognózy a kvality života dokonce naději na úplné uzdravení, obzvláště nemocným s CTEPH. Následující text si klade za cíl upozornit na problematiku CTEPH.
Klíčová slova:
endarterektomie – indikace léčby – onemocnění plicní cirkulace – plicní hypertenze
Definice a klasifikace plicní hypertenze
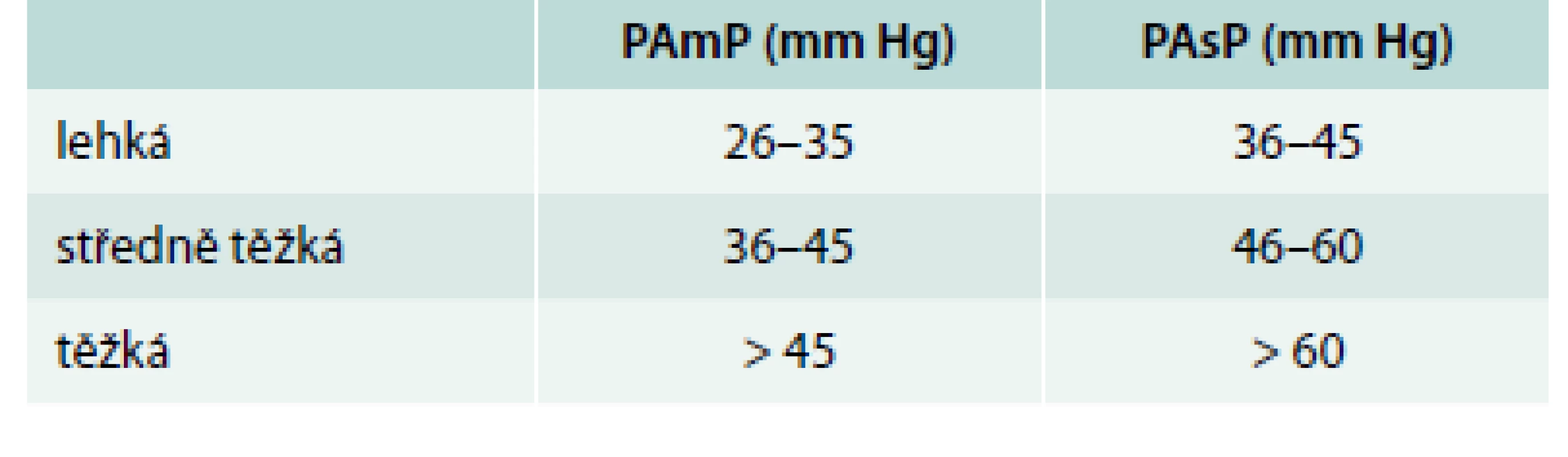
Za fyziologických okolností nepřevyšuje střední tlak v plicnici 20 mm Hg. Nejčastěji v důsledku onemocnění srdce, plic, plicních cév, ale i v důsledku některých onemocnění, která primárně nepostihují kardiovaskulární a respirační systém, dochází ke zvýšení tlaků v plicnici nad tuto hodnotu. Plicní hypertenze (PH) je pak definována hodnotou středního tlaku v plicnici (PAmP – pulmonary artery mean pressure) ≥ 25 mm Hg. Hodnoty 21–24 mm Hg tvoří šedou zónu se zatím nejasným patofyziologickým významem. Plicní hypertenzi můžeme členit dle různých úhlů pohledu. Patofyziologicky je klíčové odlišení prekapilární PH s tlakem v zaklínění ≤ 15 mm Hg a postkapilární PH při tlaku v zaklínění > 15 mm Hg. Klasifikaci podle tíže plicní hypertenze ukazuje tab. 1 [1,2]. V klinické klasifikaci dochází v reakci na nové poznatky o patofyziologii PH k periodickým změnám. Poslední, modifikovaná [3], vzešla z 5. světového sympozia o plicní hypertenzi (2013, Nice, Francie) (tab. 2).
![Klinická klasifikace plicní hypertenze [3]](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/d63c42fe96321d6cc9c1d08078b33ba5.png)
Incidence a patofyziologie chronické tromboembolické plicní hypertenze
Následující text se bude věnovat 4. skupině klinické klasifikace plicní hypertenze (PH) – chronické tromboembolické plicní hypertenzi. Ta je definována jako PAmP ≥ 25 mm Hg, PCWP ≤ 15 mm Hg (nebo neměřitelný PCWP – pulmonary capillary wedge pressure) a průkazem organizovaných trombů/embolů ve kmeni plicnice, nebo jejích větvích až po subsegmentární úroveň po nejméně 3 měsících prokazatelně účinné antikoagulační terapie. Má se za to, že nejvýznamnějším patofyziologickým mechanizmem vzniku, nebo přinejmenším spouštěčem dalších patofyziologických pochodů, je jedna nebo opakovaná plicní embolie (PE). Po překonání akutní PE jsou pacienti, kteří nemají jinou závažnou komorbiditu s nepříznivou prognózou, ohroženi právě rozvojem CTEPH (chronic thromboembolic pulmonary hypertension). Literární data o incidenci této chronické komplikace TEN (tromboembolická nemoc) nejsou jednoznačná a údaje se v jednotlivých pracích pohybují v rozmezí 0,5–9,1 % [4–10]. Předpokládá se, že CTEPH se vyvine asi u 3,8 % nemocných, kteří překonají symptomatickou PE. Spolehlivé stanovení incidence CTEPH je obtížné z několika důvodů – 1/2 až 2/3 pacientů s prokázanou CTEPH mají negativní anamnézu TEN [11–15] a 30 % CTEPH pacientů nemá v osobní anamnéze plicní embolii [16], což koresponduje s faktem, že 1/3 PE probíhá symptomaticky, že PE je nejčastější chybně, nebo opožděně diagnostikovaným onemocněním (PE tvoří až 4,5 % diagnostických omylů) [17] a téměř 1/2 nemocných není správně diagnostikována a léčena. Je také známo, že 1/3 až 1/2 pacientů s hlubokou žilní trombózou má segmentární výpadky na plicním scanu bez jakýchkoliv symptomů PE [18,19].
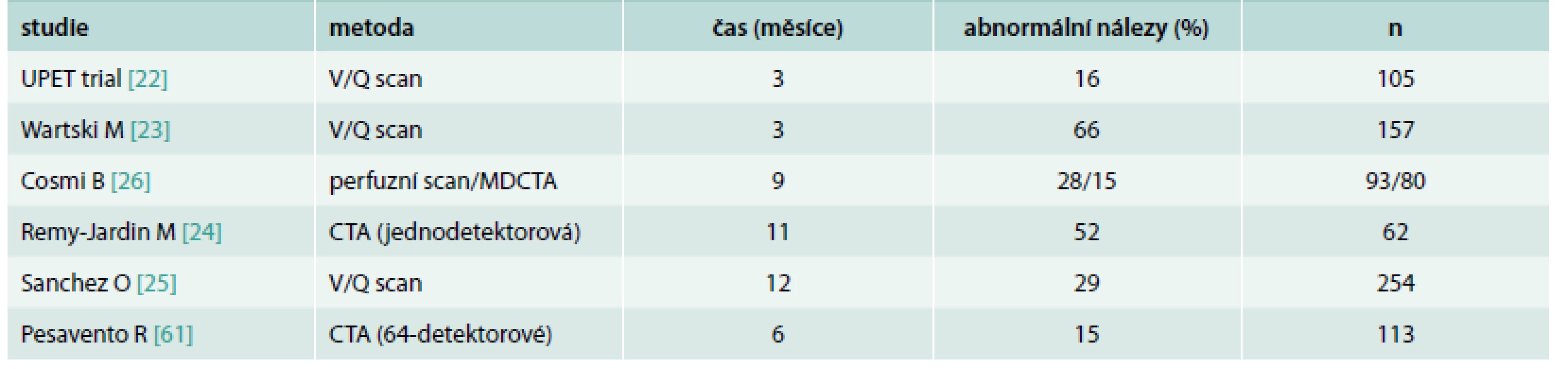
Tromboembolické hmoty v plicním řečišti podléhají endogenní (popřípadě farmakologické) fibrinolýze a v experimentu na zvířecím modelu dochází k jejich resorpci v průběhu 4–6 týdnů [20,21]. V klinických studiích zabývajících se vývojem nálezů na ventilačně perfuzním plicním scanu [22,23] a spirální CT angiografii (CTA) plicnice [24,61] je dobře dokumentovaný postupný ústup segmentárních výpadků na plicní scintigrafii až do dosažení „stabilní fáze“ reziduálních změn za přibližně 2 měsíce od akutní PE u 90 % pacientů [4] a perfuzní defekty jsou po 3 měsících účinné antikoagulační terapie nalézány u zhruba 2/3 pacientů [23], po 9–12 měsících u necelé 1/3 nemocných [25,26], tab. 3.
Reziduální tromboembolické hmoty podléhají fibrotizaci a v luminu větví plicních tepen vytvářejí síťky, proužky, stenózy nebo vedou k úplné obstrukci tepen [4]. V rozvoji CTEPH se předpokládá také vliv zatím neznámé genetické dispozice. PE je pravděpodobně spouštěčem následných morfologických a patofyziologických změn ve stěně plicních arterií, které jsou vystaveny zvýšenému smykovému napětí, ale i v částech plicního řečiště, které je distálně za stenotickými tepnami [27,28]. Jde o stejný typ arteriopatie, která bývá nalézána u plicní arteriální hypertenze (PAH) [29] zahrnující přítomnost hypertrofie hladké svaloviny tunica media plicních tepen, zesílení a fibritozaci tunica intima a také vznik plexiformních lézí. Plexiformní léze vznikají v plicních tepnách malého kalibru rekanalizací organizovaných tromboembolických hmot a aneuryzmatickým rozšířením těchto tepen. Lze je nalézt proximálně, ale i distálně od místa obstrukce jako důsledek zvýšeného smykového napětí a následné endoteliální proliferace [30]. Spolu se zvýšenou vazokonstrikcí muskulárních plicních tepen v rámci přítomné endoteliální dysfunkce vedou výše uvedené morfologické a funkční změny plicního řečiště ke zvýšení plicní vaskulární rezistence a přispívají k dalšímu hemodynamickému zhoršení. Na patofyziologii CTEPH se také podílí in-situ trombóza a možnost progrese embolu distálně do periferie plicních tepen. Vyloučit samozřejmě nelze ani podíl embolizace již parciálně organizovaného embolu, který je vůči endogenní i farmakologické fibrinolýze netečný. Současnou hypotézu o patofyziologii CTEPH ukazuje schéma 1. Zvýšená plicní vaskulární rezistence představuje chronickou a progredující tlakovou zátěž pro pravou srdeční komoru, jež je za fyziologických podmínek součástí „nízkotlakého“ malého oběhu. Její myokard reaguje kompenzační hypertrofií a následnou dilatací. Dilatuje však i anulus trikuspidální chlopně, což vede k sekundární trikuspidální regurgitaci. Tím se k tlakové zátěži pravé komory přidává ještě zátěž objemová, která hemodynamický stav, udržovaný za cenu kompenzačních mechanizmů, dále zhoršuje. Konečným důsledkem je pak selhání pravé komory a úmrtí pacienta. Známé rizikové faktory CTEPH shrnuje tab. 4.

![Známé rizikové faktory CTEPH [15,31,32]](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/40fd507a9a6b48dd0ae6bcae7f071f16.png)
Studie zabývající se výskytem tromfobilních stavů ukazují, že až 10 % pacientů s CTEPH může mít lupus anticoagulans, u 20 % nemocných jsou přítomny antifosfolipidové protilátky, lupus anticoagulans, či obojí. Hladina koagulačního faktoru VIII je zvýšená až u 39 % pacientů s CTEPH. Poruchy fibrinolýzy u těchto pacientů prokázány nebyly [33].
Prognóza chronické tromboembolické plicní hypertenze
V kontrastu s nejednoznačnými údaji o incidenci CTEPH vyznívají údaje o nepříznivém prognostickém významu tohoto onemocnění poměrně jasně. Přežití významně závisí na hodnotě středního tlaku v plicnici, výrazně horší je, pokud PAmP překoná hodnotu 30 mm Hg. Bez terapie mají tito nemocní s PAmP nad 30 mm Hg 5leté přežití 50 %, při PAmP nad 50 mm Hg přežívá 2 roky 20 % a 5 let jen necelých 10 % pacientů [34], 5leté přežití nemocných se středně těžkou plicní hypertenzí je 32 % [35]. Nepříznivou prognostickou známkou jsou projevy selhání PK a perikardiální výpotek.
Diagnostika chronické tromboembolické plicní hypertenze
Diagnostický algoritmus plicní hypertenze tak, jak jej uvádějí platná doporučení odborných společností (schéma 2), vylučuje CTEPH u pacientů s PH po vyloučení stavů spadajících do skupiny 2 a 3 klinické klasifikace PH. Metodou volby je zde provedení ventilačně-perfuzního plicního scanu, jehož negativní nález vylučuje chronický tromboembolizmus, segmentární výpadky perfuze při zachované ventilaci ve stejných oblastech pro tuto diagnózu naopak svědčí. Použít lze i angiografii plicnice použitím multidetektorové spirální CTA, či MR [36,37]. Chronickým tromboembolickým hmotám odpovídají konvexní defekty v náplni plicního řečiště, kompletně či parciálně obturující lumen tepny, dále zmenšení průměru tepny distálně za místem obstrukce, stenózy a poststenotické dilatace, intraluminární proužky a síťky, nespecifickými změnami jsou pak mozaikový typ perfuze, bronchopulmonální kolaterály, dilatace kmene plicnice a změny plicního parenchymu odpovídající proběhlému plicnímu infarktu [38].
![Schéma 2. Diagnostický algoritmus plicní hypertenze. Upraveno podle [1] pátrat](https://pl-master.mdcdn.cz/media/image/7300dccfe3c343032348352c4e56bd47.png?version=1537794609)
Pacienta s echokardiografickými známkami plicní hypertenze a nálezem ventilačně-perfuzního mismatch je nutno odeslat do specializovaného centra k další diagnostice.
Na základě lokalizace změn v plicnicovém řečišti rozlišuje chirurgická klasifikace CTEPH 4 typy postižení:
- typ I (centrálně umístěný čerstvý trombus)
- typ II (intimální ztluštění, fibrózní síťky a proužky od kmene po segmentární větve plicnice)
- typ III (okluze segmentárních a subsegmentárních větví) a
- typ IV (výhradně distální postižení) [39]
Pacienti s prokázanou CTEPH by měli být referováni do příslušných specializovaných center k doplnění potřebných vyšetření a k určení dalšího postupu. Základem je provedení pravostranné srdeční katetrizace s verifikací tíže PH a určením jejího typu. Nezbytnou součástí vyšetření je pak provedení klasické angiografie plicnice v několika projekcích [40]. Ta pomůže odlišit pacienty s převažujícím postižením proximálních částí plicního řečiště, a tedy pacientů operabilních (viz dále) od pacientů s postižením zejména distálních partií, nevhodných k operačnímu řešení, a pacienty se smíšenou formou postižení. Hodnocení operability je možné i na základě zobrazení spirální CTA plicnice [41].
Poměrně specifickým angiografickým nálezem u CTEPH jsou bronchopulmonální kolaterály – přirozeně se vyskytující, za normálních hemodynamických poměrů se nijak neuplatňující preformované spojky mezi plicním tepenným řečištěm a bronchiálními arteriemi systémového řečiště. Tyto spojky se v různém počtu vyskytují u 77–100 % nemocných s CTEPH a zkratový průtok těmito spojkami může činit až 30–36 % minutového výdeje levé srdeční komory [42,43]. Kromě klasické angiografie mohou být bronchopulmonální kolaterály zobrazeny také CTA či MR angiografií, jež je schopna neinvazivně stanovit i průtok kolaterálami.
Na CTEPH je samozřejmě nutno pomýšlet u pacientů s anamnézou TEN nebo PE. Tito nemocní by měli být před dimisí vyšetřeni echokardiograficky. Pakliže se zjistí přetrvávající plicní hypertenze, je nutné pacienta vyšetřit za 3–6 měsíců správně vedené antikoagulační terapie právě s ohledem na možnost rozvoje CTEPH.
Otázkou je potřeba screeningu CTEPH v populaci nemocných po PE. Dle současného konsenzu je účelné vyšetřit všechny symptomatické pacienty po PE, kteří měli známky přetížení pravé srdeční komory v době stanovení diagnózy akutní PE. Publikován byl screeningový algoritmus pro CTEPH na základě EKG kritérií pro hypertrofii a tlakové přetížení PK a stanovení hladin NT-proBNP, který s velmi vysokou negativní prediktivní hodnotou vyselektuje pacienty, kteří nemají CTEPH [44]. Jeho použití je však vzhledem k ceně echokardiografického vyšetření v České republice, která je prakticky shodná s cenou stanovení NT-proBNP, irelevantní, jelikož echokardiografie je schopna poskytnout podrobnější informace o příčině zvýšení NT-proBNP a dalších patologiích.
Terapie chronické tromboembolické plicní hypertenze
Základem terapie CTEPH je doživotní antikoagulační léčba s cílovým INR 2,0–3,0. Další léčebné modality jsou vázány na expertní centra. V rámci diagnostického procesu je nezbytné určit, zda jde o operabilní či k operaci nevhodný nález (viz výše). Endarterektomie plicnice (PEA – pulmonary endarterectomy) je totiž v terapii CTEPH metodou první volby. Indikováni jsou symptomatičtí nemocní (funkční třída NYHA II-IV) se subsegmentárním či proximálním postižením a plicní vaskulární rezistencí (PVR) > 250–300 dyn/s/cm-5 (3,5 Woodových jednotek), kteří nemají žádnou závažnou komorbiditu (kromě koronárního či chlopenního postižení, které může být řešeno v rámci PEA). Vzhledem k množství prováděných PEA a náročnosti výkonu je tato operace v České republice prováděna v jediném centru při VFN Praha s excelentními výsledky.
Operace se provádí v hluboké hypotermii (ochlazení pacienta na teplotu asi 17 °C), což umožní opakovanou zástavu oběhu na dobu několika desítek minut. Během nich je vypreparováno endarterium – organizovaná rezidua tromboembolických hmot od kmene až po subsegmentární větve plicnice. V průběhu ohřívání pacienta může být operační zákrok navíc doplněn o chirurgickou revaskularizaci myokardu, či chlopenní chirurgii. I v případě kombinovaných výkonů zůstává v rukou zkušeného chirurga operační mortalita velmi příznivá (kolem 4,5 %), po jednom, tří a pěti letech přežívá 94, 90, resp. 86 % nemocných. Pooperační průběh může být komplikován kromě neurologických, krvácivých a infekčních komplikací také závažným reperfuzním edémem plic. Po úspěšné PEA klesá PVR a PAmP, roste minutový srdeční výdej, zvyšuje se vzdálenost, kterou je pacient schopen ujít v 6minutovém testu chůze, zlepšuje se funkční třída NYHA, a zejména přežívání nemocných [45–47]. V optimálním případě dochází k plné restauraci hemodynamických poměrů v malém krevním oběhu. Limitací této metody je nemožnost ovlivnit obstrukci v distálnějších partiích plicního řečiště, pro chirurga technicky nepřístupných. U části pacientů (dle literárních údajů u 5–35 %) proto i po provedené PEA přetrvává reziduální PH [46,48,49], definovaná jako PVR > 300 dyn/s/cm-5 (3,75 Woodových jednotek) 6 měsíců po provedené PEA. I po úspěšné PEA je pacientům podávána doživotně antikoagulační terapie. Lékem volby jsou antagonisté vitaminu K. Nová perorální antikoagulancia nemají pro pacienty s CTEPH klinická data, navíc přinášejí riziko lékových interakcí, zejména v kombinaci a blokátory endotelinových receptorů a inhibitory fosfodiesterázy 5. Bohužel, zhruba 1/3 pacientů není pro PEA vhodných, nejčastěji pro chirurgickou nedosažitelnost lézí, diskrepanci mezi tíží PH a morfologickým obrazem, PVR > 1 500 dyn/s/cm-5 a komorbidity [16,45].
Další, nefarmakologickou, terapeutickou modalitou je možnost perkutánní transluminární angioplastiky plicních tepen (PTPA) na základě angiografie či lokalizace lézí pomocí optické koherenční tomografie (OCT) nebo intravaskulární ultrasonografie, kterými lze současně zhodnotit i efekt výkonu [50]. Dokumentován je příznivý efekt PTPA na PAmP, PVR i funkční třídu a test chůze na vzdálenost při 6-MWT [51]. Možnou komplikací je krvácení do plic a reperfuzní edém. PTPA je ale možno provádět postupně, a této komplikaci tak předejít. Tato metoda je však stále metodou experimentální a není alternativou PEA a je možné ji zvážit u lézí nedosažitelných pro PEA, případně u nemocných k PEA nevhodných.
Specifická farmakoterapie plicní hypertenze je indikována u symptomatických nemocných s inoperabilním nálezem (nevhodným pro PEA), pacientům s přetrvávající, symptomatickou PH po provedené PEA a operabilním pacientům v rámci přípravy před PEA, u nichž však nebyl pozorován zásadní příznivý vliv na hemodynamické a funkční parametry po operaci, ke které byli díky farmakoterapii pacienti navíc indikováni později [52].
Jedním z farmak, která byla pro CTEPH testována, je bosentan. Mechanizmem jeho účinku je duální blokáda receptorů pro endotelin (ETA i ETB) v hladkosvalových buňkách cév. Endotelin je jedním z nejsilnějších vazokonstrikčních působků. Blokáda uvedených receptorů vede k poklesu systémové i plicní vaskulární rezistence a zvýšení srdečního výdeje, bez zvýšení tepové frekvence. Navíc má antiproliferační a protizánětlivý účinek a omezuje fibrózu. Ve dvojitě slepé, randomizované, placebem kontrolované studii BENEFIT byl pacientům s inoperabilní CTEPH a pacientům s perzistentní PH po PEA podáván bosentan po dobu 16 týdnů. Vedl k signifikantnímu snížení PVR, avšak bez vlivu na funkční třídu NYHA a bez ovlivnění vzdálenosti při testu s 6minutovou chůzí a neovlivnil ani čas do klinického zhoršení [53].
Pacienti s CTEPH byli také zahrnuti do klinické randomizované, placebem kontrolované studie s iloprostem [54] (syntetický analog prostacyklinu s vazodilatačním účinkem na arterioly a venuly). Iloprost vedl ke zvýšení vzdálenosti při 6minutovém testu chůze u nemocných s primární plicní hypertenzí i ve skupině pacientů s plicní hypertenzí jiné etiologie, kterou ze 2/3 tvořili nemocní s CTEPH; analýza této podskupiny ale nebyla uvedena.
Ani sildenafil (inhibitor fosfodiesterázy 5, vedoucí k blokádě degradace vazodilatačně působícího cyklického guanozinmonofosfátu – cGMP) neprokázal ve dvojitě slepé, placebem kontrolované studii signifikantně pozitivní efekt na zátěžovou kapacitu při 6-MWT ani přes zlepšení hemodynamických parametrů a funkční třídy dle WHO [55].
Jedinou molekulou, která má schválenou terapeutickou indikaci pro inoperabilní CTEPH a reziduální PH po PEA, je riociguat. Patří mezi stimulátory solubilní guanylátgyklázy a má dvojí mechanizmus účinku – stimuluje solubilní guanylátcyklázu nezávisle na oxidu dusnatém a zvyšuje její citlivost pro oxid dusnatý [56]. Následné zvýšení hladin guanozinmonofosfátu v buňkách hladké svaloviny plicních tepen vede k vazodilataci, poklesu plicní vaskulární rezistence a zvýšení srdečního výdeje. Na experimentálních modelech je popsán také jeho antiproliferativní a antifibrotický efekt [57]. Podávání riociguatu pacientům s inoperabilní CTEPH, reziduální, nebo rekurentní PH po provedené PEA vedlo ve studii CHEST-1 a CHEST-2 nejen k signifikantnímu zvýšení funkční kapacity, vyjádřené ujitou vzdáleností při 6-MWT, ale také k signifikantnímu poklesu PVR, hladin NT-proBNP a funkční třídě dle stupnice Světové zdravotnické organizace (WHO) [58,59].
Poslední terapeutickou možností je provedení transplantace srdce a plic, nebo v dnešní době častěji jedné nebo obou plic. Po transplantaci plíce/plic ustoupí hypertrofie a dilatace PK, zlepší se její funkce a sníží se tíže trikuspidální regurgitace. Problémem je ale malý počet vyhovujících dárců, malý počet transplantací, riziko dysfunkce štěpu, reperfuzní edém a chronická rejekce v podobě obliterující bronchiolitidy. Pětileté přežití po transplantaci plic je mezi 40 a 60 %, v závislosti na důvodu transplantace. Medián přežití je 5,6 roku s lepším výhledem u pacientů se 2 transplantovanými plícemi, než s jednou. K provedení transplantace je nutná kompatibilita v krevní skupině a odpovídající velikost dárce a příjemce.
U významně symptomatických pacientů (refrakterní pravostranné srdeční selhání, synkopy) s těžkou plicní hypertenzí je možné také provedení atriální balonkové septostomie, a to při selhání jiné terapie, nebo jako most k další léčbě, zejména k transplantaci plic [60]. Po transseptální punkci se nafouknutým balónkem vytvoří defekt septa síní obvykle velikosti 5–8 mm. Vede ke zvýšení minutového srdečního výdeje, ale zároveň k systémové desaturaci, která by neměla přesáhnout 10 %. Septostomie je kontraindikována při tlaku v pravé síni > 20 mm Hg s klidové saturaci kyslíkem < 80 %.
Pacientům s projevy pravostranného srdečního selhání bývá podávána také podpůrná terapie, zahrnující zejména diuretika, vyzkoušet je možné i efekt digitalisu, zvláště při výskytu supraventrikulárních tachyarytmií. Dlouhodobá domácí oxygenoteraipe je indikována při poklesu parciálního tlaku kyslíku v tepenné krvi pod 8 kPa (< 60 mm Hg); je-li indikována, měl by ji pacient užívat nejméně 15 hod denně. Antikoagulační terapie byla zmíněna výše [1].
Z režimových opatření je nutno zmínit aerobní pohybové aktivity za účelem udržení kondice a svalové hmoty, včetně rehabilitace pod dohledem odborníka. Doporučována je vakcinace proti chřipce, v případě potřeby psychologická podpora.
MUDr. Zdeněk Vavera
vaverzde@fnhk.cz
I. interní kardioangiologická klinika LF UK a FN Hradec Králové
www.fnhk.cz
Doručeno do redakce 17. 12. 2014
Přijato po recenzi 4. 2. 2015
Sources
1. Galie N, Hoeper MM, Humbert M et al. Guidelines for the diagnosis and treatment of pulmonary hypertension: the Task Force for the Diagnosis and Treatment of Pulmonary Hypertension of the European Society of Cardiology (ESC) and the European Respiratory Society (ERS), endorsed by the International Society of Heart and Lung Transplantation (ISHLT). Eur Heart J 2009; 30 : 2493–2537.
2. Jansa P, Popelová J, Al-Hiti H et al. Chronická plicní hypertenze. Cor Vasa 2011; 53 : 169–182.
3. Simonneau G, Gatzoulis MA, Adatia A et al. Updated Clinical Classification of Pulmonary Hypertension. JACC 2013; 62: D34-D41.
4. Fedullo PF, Auger WR, Kerr KM et al. Chronic thromboembolic pulmonary hypertension. N Engl J Med 2001; 345 : 1465–1472.
5. Pengo V, Leasing AWA, Prins MH et al. Incidence of chronic thromboembolic pulmonary hypertension after pulmonary embolism. N Eng J Med 2004; 350 : 2257–2264.
6. Ribeiro A, Lindmarker P, Johnson H et al. Pulmonary embolism: one-year follow-up with echocardiography doppler and five-year survival analysis. Circ 1999; 99 : 1325–1330.
7. Becattini C, Angelli G, Pesavento R Incidence of Chronic Thromboembolic Pulmonary Hypertension After a First Episode of Pulmonary Embolism. Chest 2006; 130 : 172–175.
8. Miniati M, Monti S, Bottai M et al. Survival and Restoration of Pulmonary Perfusion in a Long-Term Follow-Up of Patients After Acute Pulmonary Embolism. Medicine 2006; 85 : 253–262.
9. Dentali F, Donadini M, Gianni M Incidence of chronic pulmonary hypertension in patients with previous pulmonary embolism. Thromb Res 2009; 124 : 256–258.
10. Martí D, Gómez V, Escobar C et al. Incidence of symptomatic and asymptomatic chronic thromboembolic pulmonary hypertension. Arch Bronconeumol 2010; 46 : 628–633.
11. Torbicki A, Perrier A, Konstantinides S et al. Guidelines on the diagnosis and management of acute pulmonary embolism: the Task Force for the Diagnosis and management of Acute Pulmonary Embolism of the European Society of Cardiology (ESC). Eur Heart J 2008; 29 : 2276–2315.
12. Peacock A, Simonneau G, Rubin L Controversies, uncertainies and future research on the treatment of chronic thromboembolic pulmonary hypertension. Proc Am Thorac Soc 2006; 3 : 608–614.
13. Lang IM Chronic thromboembolic pulmonary hypertension-not so rare after all. N Engl J Med 2004; 350 : 2236–2238.
14. Hoeper MM, Mayer E, Simonneau G et al. Chronic thromboembolic pulmonary hypertension. Circulation 2006; 113 : 2011–2020.
15. Lang I, Kerr K Risk factors for chronic thromboembolic pulmonary hypertension. Proc Am Thorac Soc 2006; 3 : 568–570.
16. Pepke-Zaba J, Delcroix M, Lang I et al. Chronic thromboembolic pulmonary hypertension (CTEPH): results from an international prospective registry. Circulation 2011; 124 : 1973–1981.
17. Schiff GD, Hasan O, Kim S et al. Diagnostic error in medicine. Arch Intern Med 2009; 169 : 1881–1887.
18. Meignan M, Rosso J, Gauthier H et al. Systematic lung scan reveal a high frequency of silent pulmonary embolism in patients with proximal deep venous thrombosis. Arch Intern Med 2000; 160 : 159–164.
19. Boc A, Vene N, Stalc M et al. Unprovoked proximal venous thrombosis is associated with an increased risk of asymptomatic pulmonary embolism. Thromb Res 2014; 133 : 1011–1015.
20. Tow DE, Wagner jr. HN Recovery of pulmonary arterial blood flow in patients with pulmonary embolism. N Engl J Med 1967; 276 : 1053–1059.
21. Walker RH, Jackson JA, Goodwin J Resolution of pulmonary embolism. BMJ 1970; 4 : 135–139.
22. The urokinase pulmonary embolism trial: a national cooperative study. Circulation 1973; 47: (2 Suppl.): II1-II108.
23. Wartski M, Collignon MA Incomplete Recovery of Lung Perfusion After 3 Months in Patients with Acute Pulmonary Embolism Treated with Antithrombotic Agents. J Nucl Med 2000; 41 : 1043–1048.
24. Remy-Jardin M, Louvegny S, Remy J et al. Acute Central Thromboembolic Disease: Posttherapeutic Follow-up with Spiral CT Angiography. Radiology 1997; 203 : 173–180.
25. Sanchez O, Helley D, Couchon S et al. Perfusion defects after pulmonary embolism: risk factors and clinical significance. J Thromb Haemost 2010; 8 : 1248–1255.
26. Cosmi B, Nijkeuter M, Valentino M et al. Residual emboli on lung perfusion scan or multidetector computed tomography after a first episode of acute pulmonary embolism. Intern Emerg Med 2011; 6 : 521–528.
27. Anderson EG, Simon G, Reid L Primary and thromboembolic pulmonary hypertension: a quantitative pathological study. J Pathol 1972; 110 : 273–293.
28. Moser KM, Bloor CM Pulmonary vascular lesions occurring in patients with chronic major vessel thromboembolic pulmonary hypertension. Chest 1993; 103 : 685–692.
29. Galie N, Kim NHS Pulmonary microvascular disease in chronic thromboembolic pulmonary hypertension. Proc Am Thorac Soc 2006; 3 : 571–576.
30. Ogata T, Iijima T Structure and pathogenesis of plexiform lesion in pulmonary hypertension. Chin Med J 1993; 106 : 45–48.
31. Bondermann D, Jakowitsch J, Adlbrecht C et al. Medical conditions increasing the risk of chronic thromboembolic pulmonary hypertension. Thromb Haemost 2005; 93 : 512–516.
32. Ignatescu M, Kostner K, Zorn G et al. Plasma Lp(a) levels are increased in patients with chronic thromboembolic pulmonary hypertension. Thromb Haemost 1998; 80 : 231–232.
33. Olman MA, Marsh JJ, Lang IM et al. Endogenous fibrinolytic system in chronic large-vessel thromboembolic pulmonary hypertension. Circulation 1992; 86 : 1241–1248.
34. Riedel M, Staněk V, Widimský J et al. Longterm follow up of patients with chronic pulmonary tromboembolism. Late prognosis and evolution of haemodynamic and respiratory data. Chest 1982; 81 : 151–158.
35. Lewczuk J, Piszko P, Jagas J et al. Prognostic factors in medically treated petients with chronic pulmonary embolism. Chest 2001; 119 : 818–823.
36. Ley S, Kauczor HU, Heussel CP et al. Value of contrast-enhanced MR angiography and helical CT angiography in chronic thromboembolic pulmonary hypertension. Eur Radiol 2003; 13 : 2365–2371.
37. Heinrich M, Gric A, Tscholl D et al. CT findings in patients with chronic thromboembolic pulmonary hypertension. Rontgenpraxis 2005; 55 : 222–228.
38. Wittram C, Kalra MK, Maher MM et al. Acute and Chronic Pulmonary Emboli: Angiography-CT Correlation. AJR 2006; 186: S421-S429.
39. Thistlethwaite PA, Mo M, Madani MM et al. Operative classification of thromboembolic disease determines outcome after pulmonary endarterectomy. J Thorac Cardiovasc Surg 2002; 124 : 1203–1211.
40. Auger WR, Kim NH, Kerr KM et al. Chronic thromboembolic pulmonary hypertension. Clin Chest Med 2007; 28 : 255–269.
41. Heinrich M, Uder M, Tscholl D et al. CT Scan Findings in Chronic Thromboembolic Pulmonary hypertension: Predictors of Hemodynamic Improvement After Pulmonary Thrombendarterectomy. Chest 2005; 127 : 1606–1613.
42. Endrys J, Hayat N, Cherian G et al. Comparison of bronchopulmonary collaterals and collateral blood flow in patiens with chronic thromboembolic and primary pulmonary hypertension. Heart 1997; 78 : 171–176.
43. Ley S, Kreitner KF, Morgenstern I et al. Bronchopulmonary Shunts in Patients with Chronic Thromboembolic Pulmonary Hypertension: Evaluation with Helical CT and MR paging. AJR 2002; 179 : 1209–1215.
44. Klok FA, Surie S, Kempf T et al. A simple non-invasive diagnostic algorithm for ruling out chronic thromboembolic pulmonary hypertension in patients after acute pulmonary embolism. Thromb Res 2011; 128 : 21–26.
45. Mayer E, Jenkins D, Lindner J et al. Surgical management and outcome of patients with chronic thromboembolic pulmonary hypertension: results from an international prospective registry. J Thorac Cardiovasc Surg 2011; 141 : 702–710.
46. Freed DH, Thomson BM, Berman M et al. Survival after pulmonary thromboendarterectomy: effect of residua pulmonary hypertension. J Thorac Cadiovasc Surg 2011; 141 : 383–387.
47. Simonneau G, Delcroix M, Lang I et al. Long-term outcome of patients with chronic thromboembolic pulmonary hypertension: results of an international prospective registry comparing operated versus non operated patients. Am J Respir Crit Care Med 2013; 187: A5635.
48. Condliffe R, Kiely DG, Gibbs JS et al. Improved outcomes in medically and surgically treated chronic thromboembolic pulmonary hypertension. Am J Respir Crit Care Med 2008; 177 : 1122–1127.
49. Thistlethwaite PA, Kemp A, Du L et al. Outcomes of pulmonary endarterectomy for treatment of extreme thromboembolic pulmonary hypertension. J Thorac Cardiovasc Surg 2006; 131 : 307–313.
50. Fukumoto Y, Shimokawa H Recent progress in the management of pulmonary hypertension. Circ J 2011; 75 : 1801–1810.
51. Sugimura K, Fukumoto Y, Satoh K et al. Percutaneous Transluminar Pulmonary Angioplasty Markedly Improves Pulmonary Hemodynamics and Long-Term Prognosis in Patients With Chronic Thromboembolic Pulmonary Hypertension. Circ J 2012; 76 : 485–488.
52. Jensen KW, Kerr KM, Fedullo PF et al. Pulmonary hypertensive medical therapy in chronic thromboembolic pulmonary hypertension before pulmonary thromboendarterectomy. Circulation 2009; 120 : 1248–1254.
53. Jais X, D’Armini AM, Jansa P et al. Bosentan for treatment of inoperable chronic thromboembolic pulmonary hypertension: BENEFIT (Bosentan Effects in iNopErable Forms of chronIc Thromboembolic pulmonary hypertension), a randomized, placebo controlled trial. J Am Coll Cardiol 2008; 52 : 2127–2134.
54. Olschewski H, Simonneau G, Galie N et al. Inhaled iloprost for severe pulmonary hypertension. N Engl J Med 2002; 347 : 322–329.
55. Suntharalingam J, Treacy CM, Doughty NJ et al. Long-term use of sildenafil in inoperable chronic thromboembolic pulmonary hypertension. Chest 2008; 134 : 229–236.
56. Grimminger F, Reimann G, Frey R et al. First acute haemodynamic study of soluble guanylate cyclase stimulator riociguat in pulmonary hypertension. Eur Respir J 2009; 33 : 785–792.
57. Lang M, Kojonazarov B, Tian X et al. The soluble guanylate cyklase stimulator riociguat ameliorates pulmonary hypertension induced by hypoxia and SU5416 in rats. PLoS One 2012; 7: e43433.
58. Ghofrani HA, D´Armini AM, Grimminger F et al. Riociguat for the treatment of Chronic Thromboembolic Pulmonary Hypertension. N Engl J Med 2013; 369 : 319–329.
59. Simonneau G, D’Armini AM, Ghofrani HA et al. Riociguat for the treatment of chronic thromboembolic pulmonary hypertension: a long-term extension study (CHEST-2). Eur Respir J 2014 Nov 13. doi: 10.1183/09031936.00087114
60. Rothman A, Sklansky MS, Lucas VW et al. Atrial septostomy as a bridge to lung transplantation in patients with severe pulmonary hypertension. Am J Cardiol 1999; 84 : 682–686.
61. Pesavento R, Filippi L, Pagnan A et al. Unexpectedly high recanalization rate in patients with pulmonary embolism treated with anticoagulants alone. Am J Respir Crit Care Med 2014; 189(10): 1277–1279.
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Internal Medicine

2015 Issue 3
-
All articles in this issue
- Neceliakální glutenová senzitivita – editorial
- Neceliakální glutenová senzitivita – editorial
- Naše zkušenosti s hormonální léčbou transsexuálních pacientů
- Má tělesná výška vliv na závažnost chronického žilního onemocnění na dolních končetinách?
- Zkušenosti s léčbou biosimilárními léky
- Najnovšie aspekty diagnostiky a terapie hyponatriémie
- Neceliakální glutenová senzitivita
- Chronická tromboembolická plicní hypertenze
- Nové doporučené postupy ESC pro diagnostiku a léčbu akutní plicní embolie
-
Syndróm vénovej panvovej kongescie – diagnóza a manažment
Odporúčanie Angiologickej sekcie Slovenskej lekárskej komory (2015) -
PET-CT dokumentovaná remise multicentrické formy Castlemanovy choroby po léčbě rituximabem
Popis případu a přehled literatury - Hypersenzitivní reakce po podání heparinu s aktivací heparinem indukované trombocytopenie po zahájení intermitentní hemodialýzy
- Vybrané právní aspekty povinné mlčenlivosti
-
Lehké hypoglykemie jsou v České republice u pacientů s diabetem 2. typu léčených inzulinovými analogy běžné a jejich výskyt pacienty znepokojuje
Výsledky průzkumu GAPP2TM (Global Attitudes of Patient and Physicians) - Hormonální léčba transsexuálních pacientů – editorial
- Nejnovější aspekty diagnostiky a terapie hyponatremie – editorial
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue
- Naše zkušenosti s hormonální léčbou transsexuálních pacientů
-
Syndróm vénovej panvovej kongescie – diagnóza a manažment
Odporúčanie Angiologickej sekcie Slovenskej lekárskej komory (2015) - Neceliakální glutenová senzitivita
- Najnovšie aspekty diagnostiky a terapie hyponatriémie
