Infuzní toxicita rituximabu u nemocných s chronickou lymfocytární leukemií
Rituximab infusion-related toxicity in patients with chronic lymphocytic leukemia
Background and Aims:
Rituximab in combination with chemotherapy is an effective treatment of patients (pts) with chronic lymphocytic leukemia (CLL). The most frequent adverse event of rituximab is infusion-related toxicity, e.g. cytokine-release syndrome that occurs usually during the first infusion. However, there is scarce data on feasibility and tolerability of rituximab infusions in CLL outside clinical trials. Therefore, we performed a single-center retrospective analysis of the frequency of rituximab infusion-related adverse events during the first - and the second line CLL treatment administered in the routine practice. We also analyzed its relation to parameters of tumor load and possible association with treatment efficacy. The safety of rapid infusion of rituximab in CLL pts was also evaluated.
Patients and Methods:
We analyzed 108 pts with CLL treated with rituximab-containing regimens between March 2005 and May 2011 at our institution. The most common first-line regimens (n = 66, 47 males, median age 63 years) were FCR (43 pts) and low-dose FCR (13 pts); 10 pts were treated by other protocols. Forty-two pts (32 males, median age, 65 years) underwent second line treatment: 18 pts rituximab-dexamethasone, 7 pts FCR, 7 pts low-dose FCR and 10 pts other regimens. Intravenous hydration (2 000 ml daily on days 0 and 1 of cycle), allopurinol 300–600 mg p. o. daily and premedication with methylprednisolone 80 mg i. v., acetaminophen 1 000 mg p. o. and bisulepine 1 mg i. v. were administered before rituximab infusion. Rituximab was given by fractionated infusion (100 mg for 2 hours, then if tolerated well, the rest of the dose with infusion rate escalation from 100 mg/hour up to 400 mg/hour) at the dose of 375 mg/m2 in the first cycle. Subsequent doses (500 mg/m2) were administered by rapid-infusion protocol.
Results:
Rituximab infusion-related toxicity occurred in 32 % pts (n = 21) during the first line treatment and 19% pts (n = 8) during the second line treatment. Adverse events were predominantly mild and NCI CTCAE grade III/IV occurred rarely (3% in the first line, 2% in the second line). Infusion toxicity manifested predominantly as rigors, chills, fever and hypotension. All patients with adverse events could finish rituximab infusion as initially planned on the same day. Treatment response analysis did not demonstrate statistically significant differences between patients with and without rituximab infusion toxicity. Patients who developed rituximab infusion toxicity had higher absolute lymphocyte count (first line, 87 vs 56 × 109/l, p = 0.21; second line, 101 vs 14 × 109/l, p = 0.043). At the median follow-up of 36 months, there were no statistically significant differences in PFS or OS in both cohorts.
Conclusions:
Rituximab infusion-related toxicity in pts with CLL is relatively frequent (32%). However, occurrence of infusion-related symptoms can be reduced by proper premedication and severe adverse events are uncommon. In our experience, all patients were able to receive the planned dose of rituximab. Subsequent doses of rituximab could be safely administered by rapid-infusion protocol. We did not find statistically significant association between rituximab infusion toxicity and effectiveness of treatment.
Key words:
chronic lymphocytic leukemia – infusion-related toxicity – rituximab
Authors:
Martin Šimkovič; Pavel Vodárek; Monika Motyčková; Pavel Žák; Lukáš Smolej
Authors‘ workplace:
IV. interní hematologická klinika LF UK a FN Hradec Králové, přednosta doc. MUDr. Pavel Žák, Ph. D.
Published in:
Vnitř Lék 2015; 61(7-8): 626-632
Category:
Original Contributions
Overview
Úvod:
Kombinace monoklonální antiCD20 protilátky rituximabu s chemoterapií je vysoce účinná v léčbě chronické lymfocytární leukemie (CLL). Hlavním nežádoucím účinkem rituximabu jsou infuzní reakce, např. syndrom uvolnění cytokinů (cytokine release syndrome – CRS), který zpravidla doprovází první podání rituximabu. Cílem naší retrospektivní analýzy bylo zhodnotit četnost výskytu infuzních reakcí v rutinní klinické praxi, jejich vztah k parametrům nádorové nálože a zjistit možnou spojitost infuzních reakcí s účinností léčby. Dále byla posouzena bezpečnost rychlé infuze s rituximabem u nemocných s CLL.
Charakteristika souboru:
Hodnoceno bylo 108 nemocných s CLL léčených chemoimunoterapií s rituximabem od května roku 2005 do března roku 2011 v našem centru. V rámci 1. linie (n = 66, 71 % mužů, věkový medián 63 let) byly použity tyto léčebné režimy: fludarabin, cyklofosfamid, rituximab – FCR (n = 43) a nízkodávkovaný FCR (n = 13); 10 nemocných bylo léčeno jinými protokoly. 42 nemocných (76 % mužů, věkový medián 65 let) podstoupilo 2. linii: rituximab-dexametazon (n = 18), FCR/nízkodávkované FCR (n = 14) a 10 nemocných jiný režim. Součástí premedikace před infuzí rituximabu byl metylprednisolon 80 mg i.v., paracetamol 1 000 mg p. o. a bisulepin 1 mg i. v., všichni nemocní měli nitrožilní hydrataci minimálně 2 000 ml/den a alopurinol 300–600 mg/den. V 1. cyklu byl rituximab podáván frakcionovaně v celkové dávce 375 mg/m2 a od 2. cyklu formou rychlé infuze v dávce 500 mg/m2.
Výsledky:
K rozvoji infuzní reakce po rituximabu došlo u 32 % nemocných v 1. linii a 19 % v 2. linii. Jednalo se převážně o mírné reakce a k závažné toxicitě (stupeň III/IV dle NCI CTCAE – National Cancer Institute – The Common Terminology Criteria for Adverse Events) došlo výjimečně (3 % nemocných v 1. linii a 2 % v 2. linii). Reakce se nejčastěji projevila třesavkou, zimnicí, dušností, horečkou či hypotenzí. U všech nemocných bylo možné dokončit infuzi rituximabu v plánované dávce ve stejný den. Hodnocení léčebné odezvy (overall response rate – ORR) neprokázalo statisticky významné rozdíly mezi nemocnými s reakcí či bez infuzní reakce. Nemocní s infuzní toxicitou měli vyšší absolutní počet lymfocytů (1. linie, 87 vs 56 × 109/l, p = 0,21; 2. linie, 101 vs 14 × 109/l, p = 0,043). Při mediánu sledování 36 měsíců nebyl prokázán statisticky významný rozdíl v PFS (doba přežití bez progrese – progression-free survival) a OS (celkové přežití – overall survival) mezi oběma skupinami.
Závěry:
Výskyt infuzních reakcí u nemocných s CLL léčených rituximabem je poměrně běžný (32 %), avšak při pečlivé premedikaci jsou reakce velmi dobře zvladatelné a těžká forma je vzácná. Potvrdili jsme velmi dobrou snášenlivost rychlé infuze rituximabu. Naše data neprokázala statisticky významnou souvislost mezi výskytem infuzních reakcí a efektem léčby.
Klíčová slova:
chronická lymfocytární leukemie – infuzní toxicita – rituximab
Úvod
Rituximab má v současnosti nezastupitelné místo v léčbě nehodgkinových lymfomů, chronické lymfocytární leukemie a autoimunitních chorob [1–7]. Jedná se o chimerickou lidskou/myší monoklonální protilátku namířenou proti znaku CD20, který je exprimován na povrchu normálních B-lymfocytů a s různou denzitou také na buňkách většiny maligních B lymfoproliferací [8]. Léčba rituximabem je dobře tolerována. Nejčastější komplikací v průběhu léčby rituximabem je rozvoj infuzní reakce. V drtivé většině případů se jedná o mírnou reakci, ale může dojít i k život ohrožujícím komplikacím [9]. U chronické lymfocytární leukemie jsou maligní lymfocyty přítomny také v obvodové krvi, proto se předpokládalo zvýšené riziko infuzní reakce oproti ostatním lymfoproliferacím [10]. To však nebylo později potvrzeno v rozsáhlých klinických studiích [11–13]. Klinické hodnocení léčebných přípravků se ovšem provádí za velmi přísných podmínek a často neodpovídá běžnému způsobu používání léku v praxi. Cílem naší retrospektivní analýzy bylo zhodnotit četnost výskytu infuzních reakcí v rutinní klinické praxi, jejich vztah k parametrům nádorové nálože (počet lymfocytů a velikost lymfadenopatie) a zjistit možnou spojitost infuzních reakcí s účinností léčby. Dále jsme chtěli posoudit snášenlivost rychlé 90minutové infuze s rituximabem u nemocných, u kterých se v předchozím cyklu nevyvinula infuzní reakci.
Soubor nemocných a metodika
Celkově bylo do retrospektivní studie zařazeno konsekutivních 108 nemocných s chronickou lymfocytární leukemií, kteří byli léčeni na IV. interní hematologické klinice FN Hradec Králové od března roku 2005 do května roku 2011. Analyzovaná data byla získána retrospektivně ze zdravotnické dokumentace (záznamy o aplikaci rituximabu v chorobopisu či ambulantní kartě nemocných). Léčebnou odezvu jsme hodnotili pomocí mezinárodních IWCLL (International Workshop on Chronic Lymphocytic Leukemia) kritérií [14]. Stupeň závažnosti nežádoucích účinků byl stanoven podle the National Cancer Institute Common Terminology Criteria for Adverse Events (NCI CTCAE) verze 4.0. Kritéria pro posuzování infuzní toxicity jsou uvedena v tab. 1. Velikost lymfadenopatie a sleziny byla hodnocena pomocí ultrasonografie břicha a periferních uzlin a RTG snímku hrudníku před každou léčebnou linií. Statistická analýza byla provedena pomocí programu MedCalc (MedCalc, Mariakerke, Belgie). K porovnání četností výskytu jsme použili Fisherův exaktní test. K porovnání kvantitativních dat s normálním rozložením hodnot (pouze porovnání lymfocytózy) byl použit Studentův t-test, pro ostatní data Mannův-Whitneův test. Kaplanovu-Maierovu metodu jsme použili ke konstrukci křivek přežití, rozdíl v přežití byl posouzen log-rank testem. K určení nezávislých prognostických faktorů doby do sledované události byla použita Coxova regresní analýza. Výsledky byly považovány za statisticky významné, pokud hodnota p byla nižší než 0,05.

Výsledky
Infuzní toxicita rituximabu byla hodnocena u 66 nemocných v 1. linii a 42 v 2. léčebné linii. Základní charakteristiky souboru nemocných jsou uvedeny v tab. 2. V rámci 1. linie léčby byl nejčastěji podán režim fludarabin, cyklofosfamid, rituximab (FCR, n = 43). V rámci 2. linie byli nemocní léčeni rituximabem s vysokodávkovaným dexametazonem (n = 18), FCR (n = 9), nízkodávkovaným FCR (n = 7), monoterapií rituximabem (n = 4), režimem R-CHOP – Rituximab + Cyclophosphamide + Hydroxydaunomycin (doxorubicin) + Oncovin (vincristine) + Prednisolone (n = 3) a rituximabem s chlorambucilem (n = 1). Součástí premedikace před infuzí rituximabu byl metylprednisolon 80 mg i. v., paracetamol 1 000 mg p. o. a bisulepin 1 mg i. v. Premedikace v tomto složení byla podávána před každou infuzí rituximabu, a to bez ohledu na výskyt toxicity rituximabu. Všichni nemocní měli nitrožilní hydrataci nejméně 2 000 ml/den a alopurinol 300–600 mg p. o. denně. V 1. cyklu byl rituximab podáván frakcionovaně v celkové dávce 375 mg/m2 (úvodní rychlost 50 mg/hod po dobu 120 min, poté zbývající část s postupným navyšováním rychlosti podávání à 30 min ze 100 mg/hod až do maximální rychlosti 400 mg/hod při dobré toleranci). Od 2. cyklu byl rituximab aplikován v dávce 500 mg/m2 u většiny nemocných formou rychlé infuze, tedy během 90 min. K rozvoji infuzní reakce došlo u 19 (32 %) pacientů v 1. linii léčby a 7 (19 %) pacientů v 2. linii (podrobněji v tab. 3). Jednalo se převážně o toxicitu stupně 2 dle CTCAE (stupeň III/IV u 4 % v 1. linii a 3 % v 2. linii). U žádného z nemocných nedošlo k úmrtí v důsledku infuzní toxicity rituximabu. U všech nemocných bylo možné dokončit infuzi rituximabu v plánované dávce. Většina infuzních reakcí (86 %) se objevila v 1. léčebném cyklu. Infuzní toxicita se projevila třesavkou, zimnicí, dušností, horečkou či hypotenzí.
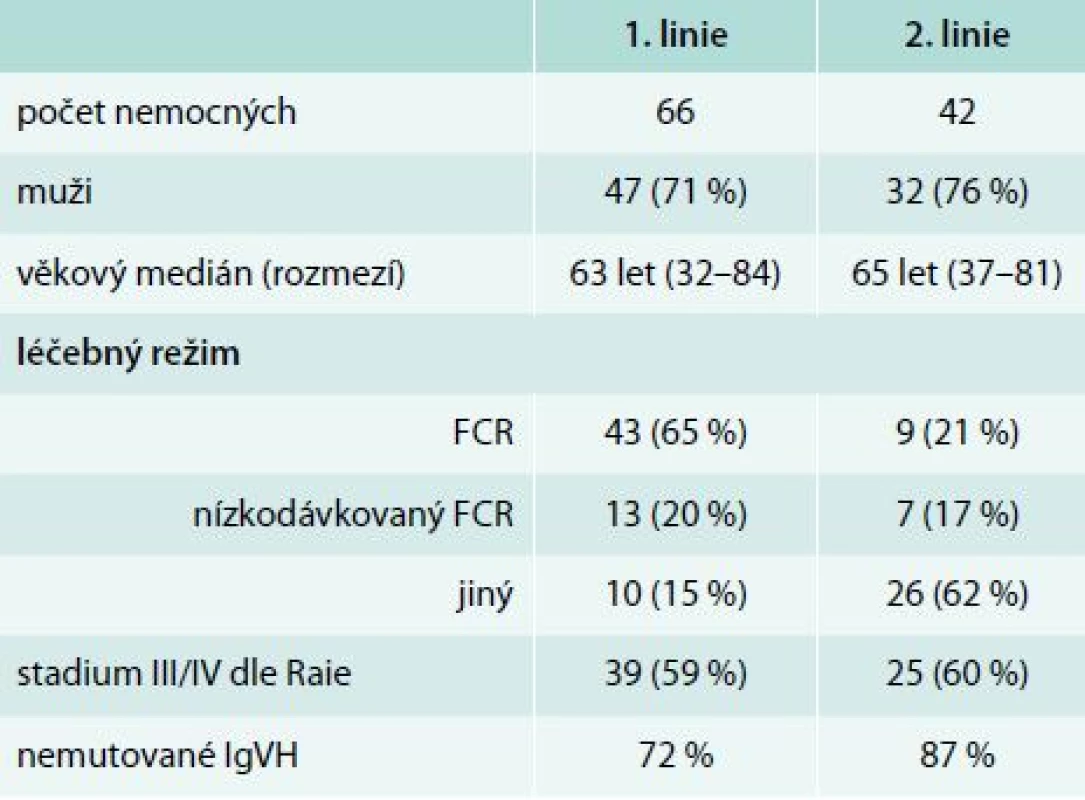
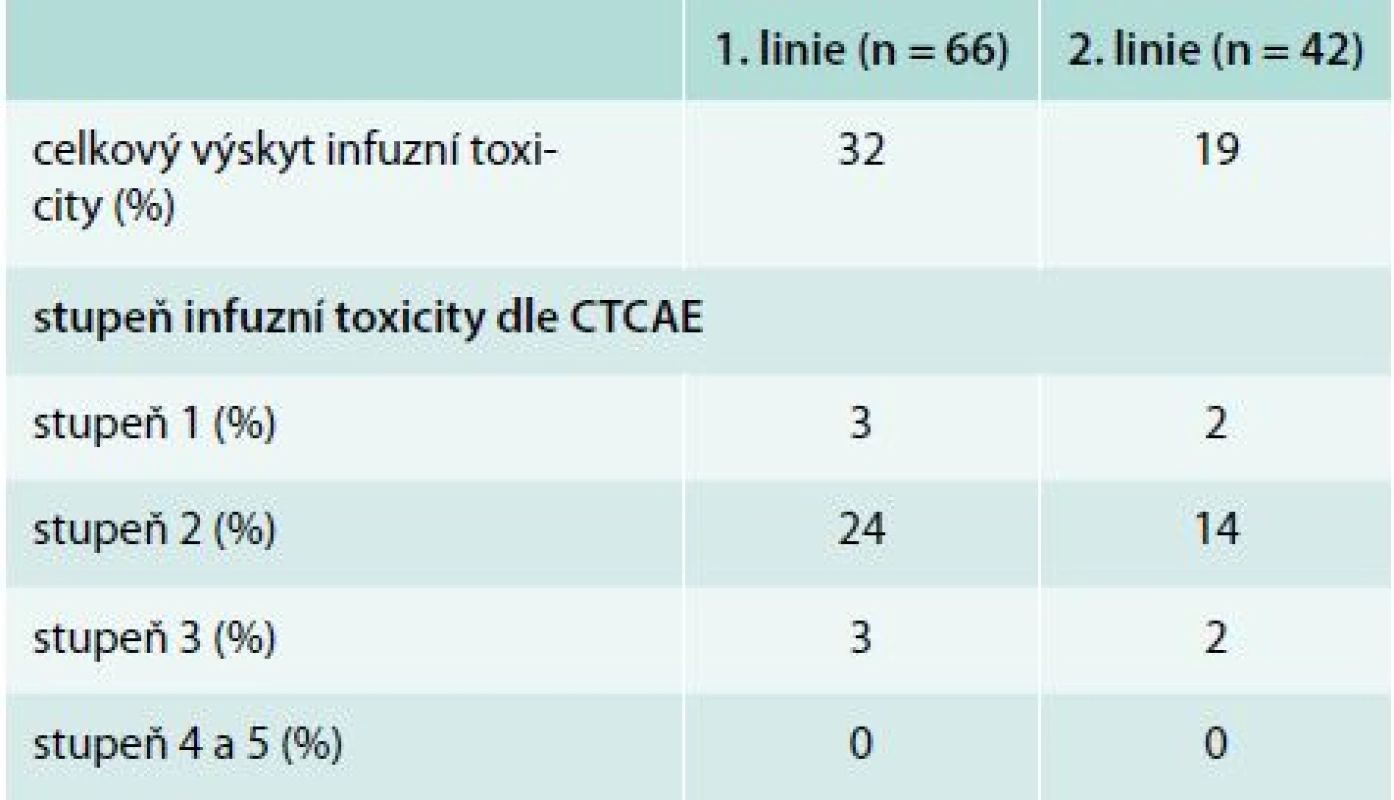
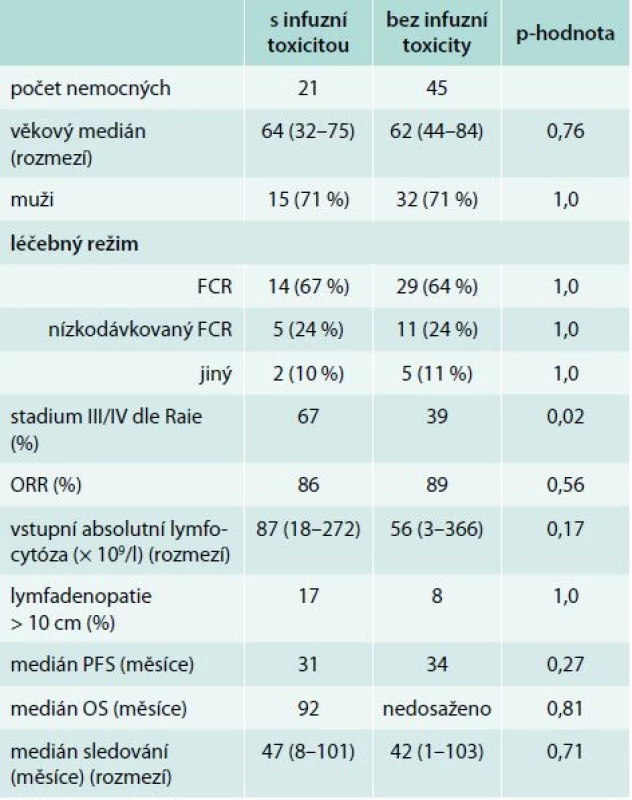
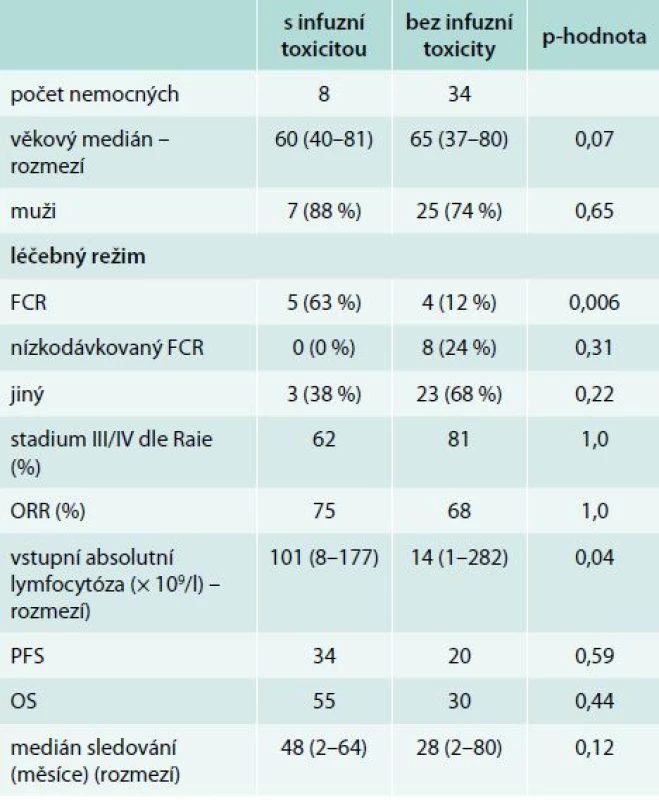
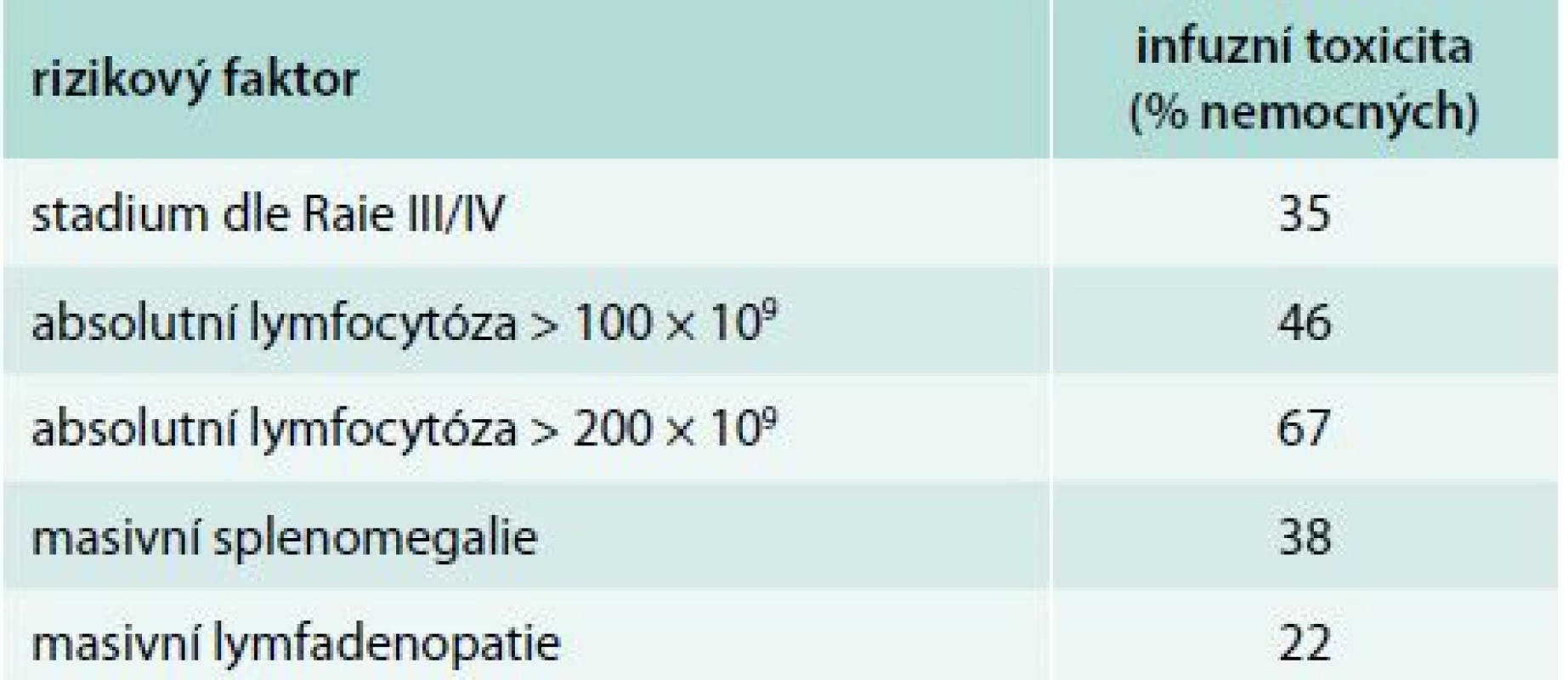
Porovnání souborů podle výskytu infuzní toxicity je uveden v tab. 4 a 5. Nemocní, kteří prodělali infuzní toxicitu rituximabu, měli vyšší vstupní hodnotu absolutního počtu lymfocytů (1. linie, medián 87 vs 56 × 109/l, p = 0,21; 2. linie, 101 vs 14 × 109/l, p = 0,043) a pokročilá klinická stadia (III/IV dle Raie) (graf 1). Ostatní rizikové faktory pro rozvoj infuzní toxicity rituximabu jsou shrnuty v tab. 6. Při mediánu sledování souboru 36 měsíců nebyl prokázán statisticky významný rozdíl v PFS a OS mezi oběma skupinami (graf 2–5).





Diskuse
Monoklonální protilátky dnes mají široké uplatnění v léčbě celé řady onemocnění. Jejich podávání je často spojeno s infuzními reakcemi, které se mohou projevit různými klinickými příznaky. Nejčastěji se jedná o tzv. standardní infuzní reakci (SIR). K té dochází během 30–120 minut v průběhu prvního podávání infuze [15]. Přesný patofyziologický mechanizmus vzniku SIR nebyl doposud objasněn, ale předpokládá se, že hlavní roli hraje interakce protilátky a antigenu s následným vyplavením cytokinů. Konkrétně dochází ke zvýšení tumor-nekrotizujícího faktoru α (TNFα), interleukinu 6 (IL6), interleukinu 8 (IL8) a interferonu γ (IFNγ) [16,17]. Jiným mechanizmem, jak může docházet k infuzním reakcím, je tvorba protilátek proti monoklonálním protilátkám. K tomu dochází zejména u myších monoklonálních protilátek, kdy se tvoří anti-myší protilátky (human anti-mouse antibodies – HAMA). Naopak v případě použití chimérických a humanizovaných monoklonálních protilátek je tvorba antichimerických (human antichimeric antibodies – HACA) a lidských antilidských protilátek (human anti-human antibodies – HAHA) zřetelně nižší [18]. Reakce SIR se může velmi podobat systémové hypersenzitivní reakci, ta je ovšem při použití monoklonálních protilátek mnohem vzácnější. Příkladem léčebného přípravku, jehož podání je spojeno s rizikem anafylaxe zprostředkované protilátkami IgE, je cetuximab [19].
Klinické projevy infuzní toxicity monoklonálních protilátek
- dušnost
- horečka, třesavka, zimnice
- zarudnutí a svědění kůže, kožní vyrážka
- pocit obtížného polykání, otok krku
- bolesti břicha, nevolnost, zvracení, průjem
- poruchy srdečního rytmu, arteriální hypertenze či hypotenze
Rituximab byl první monoklonální protilátkou, která byla v roce 1997 registrována pro léčbu hematologických malignit. V současnosti je indikován k léčbě většiny CD20 pozitivních lymfoproliferací. Po navázání rituximabu na antigen CD20 dochází k destrukci B-lymfocytů hned několika mechanizmy: cytotoxicitou závislou na komplementu (complement dependent cytotoxicity – CDC), buněčnou cytotoxicitou závislou na protilátce (antibody-dependent cellular cytotoxicity – ADCC) zajišťovanou po vazbě na Fc fragment a přímým navozením apoptózy [20]. Dalším efektem rituximabu zjištěným in vitro je přímá inhibice proliferace a potenciační efekt s některými cytostatiky (např. fludarabin) [21]. Stejně jako u ostatních monoklonálních protilátek je podávání rituximabu doprovázeno infuzními reakcemi. Výskyt infuzní toxicity antiCD20 protilátek v klinických studiích je shrnut v tab. 7. Lze shrnout, že závažné infuzní reakce rituximabu (stupeň ≥ 3) se vyskytují u méně než 10 % nemocných [18].
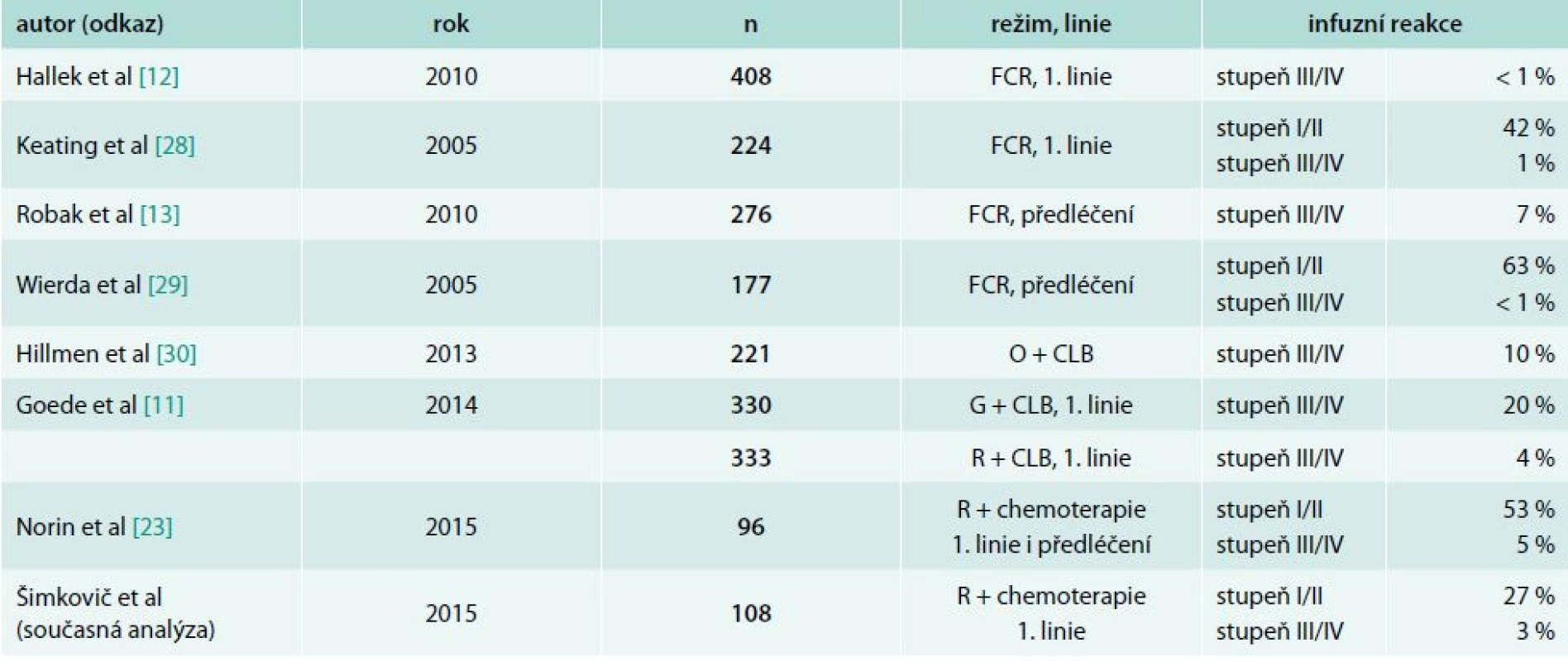
Nejtěžší forma infuzní toxicity rituximabu, která by vedla k úmrtí, je ojedinělá (0,04–0,07 % nemocných) [22]. Údaje o infuzní toxicitě rituximabu mimo klinické studie jsou však velmi omezené. U našeho souboru jsme pozorovali výskyt infuzní toxicity rituximabu u 32 % a 19 % nemocných v 1. a 2. léčebné linii. Jedná se o významně nižší počet nežádoucích reakcí, než byl pozorován v nedávno publikované observační studii švédských autorů [23] (tab. 7). Vysvětlení lze hledat v tom, že švédská studie byla provedena prospektivně, a tím byl zaručen záchyt i velmi mírných projevů infuzní toxicity. Naopak výskyt závažné infuzní toxicity (stupeň ≥ 3) byl u našeho souboru srovnatelný jak se souborem švédských autorů [23], tak i s rozsáhlými klinickými studiemi [11,12,24]. Ke snížení rizika závažné formy infuzní toxicity v průběhu léčby rituximabem máme na našem centru zavedenu celou řadu opatření. Většina vychází ze souhrnu údajů o přípravku (SPC) [25]. Zejména se jedná o následující opatření: zajištění dostatečné parenterální prehydratace; premedikace glukokortikoidem, antipyretikem a antihistaminikem; monitorace vitálních funkcí v průběhu infuze; okamžité přerušení aplikace rituximabu při těžší infuzní reakci a dodržení doporučené úvodní rychlosti podávání infuze s postupným navyšováním při dobré toleranci. Nad rámec výše uvedených doporučení se nám osvědčilo hospitalizovat všechny nemocné s CLL k podání první dávky rituximabu. Můžeme tak zajistit správnou prehydrataci, monitoraci nemocného a také upravit terapeutický plán podle aktuální tolerance léčby (např. rozdělit 1. dávku rituximabu do 2 dnů po úpravě klinického stavu a vyloučení rozvoje syndromu nádorového rozpadu). Léčba rituximabem je u nemocných s CLL velmi účinná a již po 1. infuzi dochází k rychlému snížení množství nádorových lymfocytů v obvodové krvi [26]. V souladu s předchozími pozorováními byla také u našeho souboru infuzní toxicita spojena zejména s první aplikací rituximabu (86 % případů infuzní reakce).
Rychlá 90minutová infuze rituximabu, která byla podávána od 2. léčebného cyklu u nemocných bez předchozí infuzní reakce, byla velmi dobře tolerována. Rychlé podání rituximabu je výhodné v tom, že přináší výraznou časovou úsporu při ambulantním podávání, šetří proto čas nemocného a snižuje zátěž personálu stacionáře. Dalo by se očekávat, že vyšší počet lymfocytů v periferní krvi bude spojen s častější a závažnější infuzní toxicitou rituximabu. To však nebylo prokázáno v předchozích pracích [9,23,27]. V naší analýze jsme v rámci 1. linie zaznamenali trend k vyššímu počtu lymfocytů u nemocných, kteří prodělali infuzní reakci. Častější infuzní toxicitu jsme pozorovali u nemocných s vyšší absolutní lymfocytózou v rámci 2. linie léčby. To lze ovšem vysvětlit tím, že zatímco v 1. linii je lymfocytóza přítomna u všech nemocných, ve 2. linii může být aktivita CLL omezena na progresi velikosti uzlin či rozvoj cytopenie v krevním obraze. K infuzní reakci při infuzi rituximabu došlo častěji u nemocných, kteří měli v době relapsu či progrese přítomny maligní lymfocyty v obvodové krvi. Samotné posouzení individuálního rizika rozvoje infuzní toxicity před zahájením léčby rituximabem u nemocných s CLL je velmi problematické. Z výše uvedeného vyplývá, že se nelze zcela řídit velikostí nádorové nálože. Při výskytu závažnější infuzní reakce je nutné pamatovat na zvýšené riziko rozvoje syndromu nádorového rozpadu a doplnit odpovídající laboratorní vyšetření (zejména se jedná o stanovení dusíkatých katabolitů, kalemie, fosfatemie a kalcemie). Problematika infuzní toxicity u nemocných s CLL je v současnosti velmi aktuální, a to díky nedávné registraci obinutuzumabu. Obinutuzumab je anti-CD20 monoklonální protilátka II. typu s vystupňovanou ADCC, přímou buněčnou smrtí (DCD). Na základě výsledků studie CLL11 je obinutuzumab určen v kombinaci s chlorambucilem pro léčbu 1. linie u nemocných s významnými přidruženými chorobami, kteří nemohou podstoupit léčbu režimem FCR. Ve srovnání s rituximabem vede obinutuzumab k vyššímu výskytu infuzní toxicity (infuzní reakce 66 % vs 38 %; toxicita stupně III/IV u 20 % vs 4 %) [11].
Je nutné také zmínit nevýhody naší analýzy. Jedná se o retrospektivní unicentrickou analýzu, a proto existuje riziko podhodnocení výskytu velmi mírných infuzních reakcí, které nemusely být zaznamenány ve zdrojové dokumentaci. Dále je nutné zdůraznit, že posuzování vztahu mezi infuzní toxicitou a léčebnými výsledky mohlo být ovlivněno odlišným zastoupením rizikových faktorů, stadiem onemocnění nebo rozdílným složením léčby u nemocných s reakcí či bez infuzní reakce. Multivariantní statistická analýza faktorů ovlivňujících PFS a OS nebyla doplňována s ohledem na nízký počet nemocných v jednotlivých podskupinách.
Závěr
Výskyt infuzních reakcí u nemocných s CLL léčených rituximabem je poměrně běžný (32 %), avšak při pečlivé premedikaci je velmi dobře zvladatelný a těžká forma je vzácná. Naprostá většina infuzních reakcí se rozvine během prvního podání rituximabu. Ověřili jsme velmi dobrou snášenlivost rychlé 90minutové infuze rituximabu u nemocných s CLL. Naše data neprokázala statisticky významnou souvislost mezi výskytem infuzních reakcí a efektem léčby.
Podpořeno grantem IGA MZ ČR NT/13412–4, programem PRVOUK P37/08 a RVO MZ ČR (FNHK, 00179906).
MUDr. Martin Šimkovič
simkovicm@gmail.com
IV. interní hematologická klinika LF UK a FN Hradec Králové
www.fnhk.cz
Doručeno do redakce 27. 2. 2015
Přijato po recenzi 1. 4. 2015
Sources
1. Coiffier B, Lepage E, Briere J et al. CHOP chemotherapy plus rituximab compared with CHOP alone in elderly patients with diffuse large-B-cell lymphoma. N Engl J Med 2002; 346(4): 235–242.
2. Marcus R, Imrie K, Belch A et al. CVP chemotherapy plus rituximab compared with CVP as first-line treatment for advanced follicular lymphoma. Blood 2005; 105(4): 1417–1423.
3. Pfreundschuh M, Trumper L, Osterborg A et al. CHOP-like chemotherapy plus rituximab versus CHOP-like chemotherapy alone in young patients with good-prognosis diffuse large-B-cell lymphoma: a randomised controlled trial by the MabThera International Trial (MInT) Group. Lancet Oncol 2006; 7(5): 379–391.
4. van Oers MH, Klasa R, Marcus RE et al. Rituximab maintenance improves clinical outcome of relapsed/resistant follicular non-Hodgkin lymphoma in patients both with and without rituximab during induction: results of a prospective randomized phase 3 intergroup trial. Blood 2006; 108(10): 3295–3301.
5. Gurcan HM, Keskin DB, Stern JN et al. A review of the current use of rituximab in autoimmune diseases. Int Immunopharmacol 2009; 9(1): 10–25.
6. Klener P. Cílená léčiva a jejich přínos pro terapii vnitřních chorob. Vnitř Lék 2013; 59(1): 5–12.
7. Panovská A, Doubek M. Chronická lymfocytární leukemia – diagnostika a léčba. Onkologie 2013; 7(3): 117–120. Dostupné z WWW: < http://www.onkologiecs.cz/pdfs/xon/2013/03/04.pdf>.
8. Papajík T, Kapitáňová Y. Rituximab – mechanismus účinku u nemocných s B-buněčnými lymfoproliferacemi. Acta medicinae 2012; 7 : 15–20.
9. Kimby E. Tolerability and safety of rituximab (MabThera). Cancer Treat Rev 2005; 31(6): 456–473.
10. Winkler U, Jensen M, Manzke O et al. Cytokine-release syndrome in patients with B-cell chronic lymphocytic leukemia and high lymphocyte counts after treatment with an anti-CD20 monoclonal antibody (rituximab, IDEC-C2B8). Blood 1999; 94(7): 2217–2224.
11. Goede V, Fischer K, Busch R et al. Obinutuzumab plus chlorambucil in patients with CLL and coexisting conditions. N Engl J Med 2014; 370(12): 1101–1110.
12. Hallek M, Fischer K, Fingerle-Rowson G et al. Addition of rituximab to fludarabine and cyclophosphamide in patients with chronic lymphocytic leukaemia: a randomised, open-label, phase 3 trial. Lancet 2010; 376(9747): 1164–1174.
13. Robak T, Dmoszynska A, Solal-Celigny P et al. Rituximab plus fludarabine and cyclophosphamide prolongs progression-free survival compared with fludarabine and cyclophosphamide alone in previously treated chronic lymphocytic leukemia. J Clin Oncol 2010; 28(10): 1756–1765.
14. Siegel RD, Castro KM, Eisenstein J et al. Quality improvement in the national cancer institute community cancer centers program: the quality oncology practice initiative experience. J Oncol Pract 2014; 11(2): e247-e254. Dostupné z DOI: <http://dx.doi.org/10.1200/JOP.2014.000703>.
15. Lenz HJ. Management and preparedness for infusion and hypersensitivity reactions. Oncologist 2007; 12(5): 601–609.
16. Byrd JC, Murphy T, Howard RS et al. Rituximab using a thrice weekly dosing schedule in B-cell chronic lymphocytic leukemia and small lymphocytic lymphoma demonstrates clinical activity and acceptable toxicity. J Clin Oncol 2001; 19(8): 2153–2164.
17. Wing MG, Moreau T, Greenwood J et al. Mechanism of first-dose cytokine-release syndrome by CAMPATH 1-H: involvement of CD16 (FcgammaRIII) and CD11a/CD18 (LFA-1) on NK cells. J Clin Invest 1996; 98(12): 2819–2826.
18. Grillo-Lopez AJ, White CA, Varns C et al. Overview of the clinical development of rituximab: first monoclonal antibody approved for the treatment of lymphoma. Semin Oncol 1999; 26(5 Suppl 14): 66–73.
19. Chung CH, Mirakhur B, Chan E et al. Cetuximab-induced anaphylaxis and IgE specific for galactose-alpha-1,3-galactose. N Engl J Med 2008; 3588(11): 1109–1117.
20. Johnson P, Glennie M. The mechanisms of action of rituximab in the elimination of tumor cells. Semin Oncol 2003; 30(1 Suppl 2): 3–8.
21. Alas S, Bonavida B, Emmanouilides C. Potentiation of fludarabine cytotoxicity on non-Hodgkin‘s lymphoma by pentoxifylline and rituximab. Anticancer Res 2000; 20(5A): 2961–2966.
22. Grillo-Lopez AJ, Hedrick E, Rashford M et al. Rituximab: ongoing and future clinical development. Semin Oncol 2002; 29(1 Suppl 2): 105–112.
23. Norin S, Bjorkstrand B, Rommel F et al. Severe infusion-related reactions are uncommon in rituximab-treated CLL patients in clinical practice: results from a Swedish national observational study. Leuk Res 2015; 39(1): 33–37.
24. Robak T, Lech-Maranda E, Robak P. Rituximab plus fludarabine and cyclophosphamide or other agents in chronic lymphocytic leukemia. Expert Rev Anticancer Ther 2010; 10(10): 1529–1543.
25. Mabthera 100 mg and 500 mg concentrate for solution for infusion (SPC). Dostupné z WWW: <https://www.medicines.org.uk/emc/medicine/2570> (accessed 23-FEB-2015).
26. Byrd JC, Waselenko JK, Maneatis TJ et al. Rituximab therapy in hematologic malignancy patients with circulating blood tumor cells: association with increased infusion-related side effects and rapid blood tumor clearance. J Clin Oncol 1999; 17(3): 791–795.
27. O‘Brien SM, Kantarjian H, Thomas DA et al. Rituximab dose-escalation trial in chronic lymphocytic leukemia. J Clin Oncol 2001; 19(8): 2165–2170.
28. Keating MJ, O‘Brien S, Albitar M et al. Early results of a chemoimmunotherapy regimen of fludarabine, cyclophosphamide, and rituximab as initial therapy for chronic lymphocytic leukemia. J Clin Oncol 2005; 23(18): 4079–4088.
29. Wierda W, O‘Brien S, Wen S et al. Chemoimmunotherapy with fludarabine, cyclophosphamide, and rituximab for relapsed and refractory chronic lymphocytic leukemia. J Clin Oncol 2005; 23(18): 4070–4078.
30. Hillmen P, Robak T, Janssens A et al.,Ofatumumab + Chlorambucil Versus Chlorambucil Alone In Patients With Untreated Chronic Lymphocytic Leukemia (CLL): Results Of The Phase III Study Complement 1 (OMB110911). Blood 2013; 122 : 528–528..
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Internal Medicine

2015 Issue 7-8
-
All articles in this issue
- Transplantace pankreatu: současný stav a výhledy do budoucna
- Tumory a transplantace jater
- Transplantace solidních orgánů v České republice
- Novinky v léčbě akutního nevarikózního krvácení do horní části gastrointestinálního traktu
- Domácí nutriční péče v České republice
- Vitamin D – stará látka s novými perspektivami
- Možnosti endoskopického řešení polypoidních a nepolypoidních lézí v kolon
- Obyčejná nemoc – apendicitida
- Platí „LDL-hypotéza“ i pro pacienty s diabetem?
- Snížení krevního tlaku – léčbou dalších rizikových faktorů
- Jak na dyslipidemii u pacientů s metabolickým syndromem
- Transplantace ledviny při inkompatibilitě krevní skupiny – úvodní zkušenosti programu
- Takotsubo (stresová) kardiomyopatie – co se změnilo? – editorial
- Rizikové faktory vzniku karcinomu štítné žlázy – editorial
- Takotsubo kardiomyopatie, klinické zkušenosti s onemocněním a jednoletá prognóza pacientů
- Infuzní toxicita rituximabu u nemocných s chronickou lymfocytární leukemií
- Kardiovaskulární účinky léčby GLP-1 agonisty se zaměřením na liraglutid
- Transkatétrová implantácia aortálnej chlopne – indikácie, priebeh intervencie a výsledky
- Hepatorenální syndrom – patofyziologie, diagnostika a léčba
- Rizikové faktory vzniku karcinomu štítné žlázy
-
Erektilná dysfunkcia ako prvý znak systémových cievnych chorôb a orgánovovaskulárnych artériových ischemických chorôb
Odporúčania a výzva Angiologickej sekcie Slovenskej lekárskej komory (2015)
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue
- Obyčejná nemoc – apendicitida
- Transkatétrová implantácia aortálnej chlopne – indikácie, priebeh intervencie a výsledky
- Hepatorenální syndrom – patofyziologie, diagnostika a léčba
-
Erektilná dysfunkcia ako prvý znak systémových cievnych chorôb a orgánovovaskulárnych artériových ischemických chorôb
Odporúčania a výzva Angiologickej sekcie Slovenskej lekárskej komory (2015)
