Transkatétrová implantácia aortálnej chlopne – indikácie, priebeh intervencie a výsledky
Transcatheter aortic valve implantation – diagnostic, procedure and outcomes
Transcatheter aortic valve implantation (TAVI) is an interventional method for the treatment of severe aortic stenosis. TAVI is indicated in patients who have been identified by the heart team as surgically inoperable or operable at very high risk. The advantage is minimal invasive approach with the absence of sternotomy and extracorporeal blood circulation. Interventional procedure does not allow direct visualization of the anatomical relations at the site of the final valve position (aortic anulus). For this reason it is essential to ensure appropriate view by high quality imaging methods. A standard method for the evaluation of the anatomical relations before TAVI is multidetector computed tomography (MDCT) with 3D reconstruction. In the future, the MDCT would be replaced by three-dimensional transesophageal echocardiography (3D TEE), which does not require ionizing radiation, there is no postcontrast nephropathy and hypersensitive reaction to iodine compared to MDCT. Furthermore, it provides direct measurements during the procedure and ensures easier and cheaper dispensarisation of the patients. A multicenter randomized PARTNER trial clearly demonstrated significant benefits of inoperable patients with severe aortic stenosis treated by TAVI. Recently published CoreValve US Pivotal randomized trial demonstrated higher efficiency and safety of TAVI in direct comparison with surgical treatment. The aim of this review is to provide current knowledge of TAVI, preparation of the patients before the intervention, the process of intervention, dispensarisation, as well as affecting the quality of patients life.
Key words:
aortic anulus – aortic valve – heart team – multidetector computed tomography (MDCT) – three-dimensional transesophageal echocardiography (3D TEE) – transcatheter aortic valve implantation (TAVI)
Authors:
Marián Kurečko; Gabriel Valočik; Marianna Vachalcová; Mariana Dvorožňáková
Authors‘ workplace:
Klinika kardiológie VUSCH, a. s., Košice, Slovenská republika, prednosta MUDr. Stanislav Juhás, CSc.
Published in:
Vnitř Lék 2015; 61(7-8): 641-648
Category:
Reviews
Overview
Transkatétrová implantácia aortálnej chlopne (Transcatheter Aortic Valve Implantation – TAVI) predstavuje intervenčnú metódu liečby závažnej aortálnej stenózy. TAVI je určená pre pacientov, ktorí boli tzv. srdcovým tímom (heart team) označení za chirurgicky inoperabilných resp. operabilných len pri veľmi vysokom operačnom riziku. Výhodou tohto terapeutického výkonu je miniinvazívnosť s absenciou sternotómie a potreby mimotelového krvného obehu. Intervenčná procedúra neumožňuje priamo (zrakovo) vizualizovať anatomické pomery v mieste implantácie (aortálny anulus). Z tohto dôvodu je nevyhnuté zabezpečiť presný obraz prostredníctvom kvalitného zobrazovacieho zariadenia. Štandardnou metódou posúdenia anatomických pomerov pred TAVI je multidetektorová počítačová tomografia (MDCT) s 3D rekonštrukciou. V budúcnosti by MDCT mohla byť nahradená trojrozmernou transezofageálnou echokardiografiou (3D TEE), ktorá na rozdiel od MDCT nie je zaťažená ionizačným žiarením, rizikom postkontrastnej nefropatie a hypersenzitívnej reakcie na jód. Navyše umožňuje usmerňovať intervenciu a zabezpečuje ľahšiu a lacnejšiu dispenzarizáciu pacienta. Multicentrická randomizovaná štúdia PARTNER jasne preukázala signifikantný prínos TAVI pre inoperabilných pacientov so závažnou aortálnou stenózou. Nedávno uverejnená CoreValve US Pivotal randomizovaná štúdia preukázala vyššiu efektivitu a bezpečnosť TAVI v priamom porovnaní s chirurgickou liečbou. Cieľom tohto prehľadového článku je sprostredkovať tie najaktuálnejšie informácie týkajúce sa TAVI, a to na úrovni predintervenčnej prípravy, priebehu intervencie, dispenzarizácie ako aj ovplyvnenia kvality života pacientov.
Kľúčové slová:
aortálna chlopňa – aortálny anulus – multidetektorová počítačová tomografia (MDCT) – srdcový tím – transkatétrová implantácia aortálnej chlopne (TAVI) – trojrozmerná transezofageálna echokardiografia (3D TEE)
Úvod
Po objavení sa symptómov asociovaných s aortálnou stenózou (AoS) je toto ochorenie spájané s vysokým rizikom úmrtia [1]. Aj keď chirurgická náhrada aortálnej chlopne zlepšuje symptomatológiu a prežívanie [2], observačné štúdie identifikovali podskupiny pacientov, ktorí majú vysoké operačné riziko resp. riziko úmrtia [3].
U týchto pacientov alternatívu predstavuje menej invazívny výkon – transkatétrová implantácia aortálnej chlopne (TAVI). Dostupné sú viaceré typy bioprotéz, najväčšie skúsenosti sú hlavne s dvoma: Sapien od výrobcu Edwards a CoreValve od výrobcu Medtronic. Protéza s natívnou chlopňou môže byť zavedená použitím retrográdnej alebo anterográdnej techniky [4]. Medzi retrográdne – arteriálne prístupy patria: transfemorálny, menej často transsubklaviálny, transaxiálny a transkarotický [5]. Pri nevyhovujúcich anatomických pomeroch ciev sú metódou voľby chirurgické prístupy. Pri transapikálnom sa využíva malá chirurgická incízia cez hrot ľavej komory [6], pri transaortálnom sa vykonáva minitorakotómia, napr. v 2. medzirebrovom priestore [7].
V prvom kroku je vykonaná balónová aortovalvuloplastika (BAV), ktorá zabezpečí ľahší prechod bioprotézy cez natívnu stenotickú chlopňu, následne je neexpandovaná protéza vhodne umiestnená v mieste natívnej chlopne. Pred samotným expandovaním chlopne je komora vysokofrekvenčne stimulovaná za účelom minimalizovania kardiálneho výdaja a predchádzania dyslokácie bioprotézy počas implantácie [8]. V ďalšom kroku dochádza k expandovaniu Edwards-Sapien bioprotézy balónikom, Medtronic-CoreValve protéza sa expanduje sama [9,10]. Následne je pôvodná aortálna chlopňa utlačená novou bioprotézou, ktorá ihneď preberie hemodynamickú úlohu pôvodnej aortálnej chlopne. Protéza je ukotvená v aortálnom anule a cípy pôvodnej chlopne sú pritlačené k stene aorty [11].
U všetkých pacientov dochádza k úplnému vymiznutiu alebo poklesu transaortálneho gradientu až k hodnotám minimálnej aortálnej stenózy a u väčšiny pacientov dochádza k zlepšeniu kvality života a poklesu funkčnej triedy NYHA (New York Heart Association) [12]. CoreValve US Pivotal randomizovaná štúdia preukázala vyššiu efektivitu a bezpečnosť TAVI v priamom porovnaní s chirurgickou liečbou [8].
Odporúčania pre transkatétrovú implantáciu aortálnej chlopne uvádza tab. 1.
![Odporúčania pre transkatétrovú implantáciu aortálnej chlopne [13]](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/a567a09ff8dcd453965670a14ba04e09.jpg)
Kontraindikácie pre transkatétrovú implantáciu aortálnej chlopne:
- absolútne organizačné
- chýbanie „heart team-u“ alebo kardiochirurgického oddelenia v nemocnici
- rozhodnutie „heart team-u“ o nevhodnosti TAVI postupu
- absolútne klinické
- očakávaná dĺžka života menej ako 1 rok
- vzhľadom na pridružené komorbidity neočakávaný prínos z TAVI
- iná závažná chlopňová chyba, ktorá ovplyvňuje symptómy pacienta a môže byť napravená len chirurgicky
- absolútne anatomické
- nevhodné rozmery aortálneho anulu (menej ako 18 mm alebo viac ako 29 mm)
- trombus v ľavej komore srdca
- aktívna endokarditída
- zvýšené riziko obštrukcie koronárneho ústia (asymetrická kalcifikácia chlopne, krátka vzdialenosť medzi anulom a koronárnym ústim, malé aortálne sinusy)
- pláty s mobilnými trombami v ascendentnej aorte alebo v oblúku aorty
- v prípade artériového prístupu: nevhodný vaskulárny prístup (rozmery, kalcifikácia a torzie ciev)
- relatívne kontraindikácie
- bikuspidálna chlopňa
- koronárna choroba srdca vyžadujúca revaskularizáciu
- hemodynamická nestabilita
- ejekčná frakcia ľavej komory pod 20 %
- pre transapikálny prístup: závažné pľúcne ochorenie, nevhodný prístup k apexu ľavej komory [13]
Štúdia Partner
Jedná sa o multicentrickú randomizovanú štúdiu, ktorá je základnou štúdiou zaoberajúcou sa transkatétrovou implantáciou aortálnej chlopne. Pri výkonoch bola použitá Edwards-Sapien bioprotéza. Nábor pacientov začal v máji roku 2007 a sledovanie pacientov aj s vyhodnocovaním výsledkov pokračuje dodnes. Štúdia prebieha v 2 kohortách [14].
Kohorta B štúdie PARTNER
Do kohorty B bolo zapojených 358 pacientov so závažnou AoS, ktorí boli kontraindikovaní srdcovým tímom (heart team) k chirurgickej náhrade aortálnej chlopne (SAVR). Pacienti boli rovnomerne rozdelení do 2 vetiev TAVI vs konzervatívny postup [15]. 82 % pacientov zaradených do konzervatívnej vetvy podstúpilo balónovú plastiku aortálnej chlopne (balloon aortic valvuloplasty – BAV) [16]. Výsledky 3-ročného sledovania tejto kohorty uvádza tab. 2.
![Výsledky 3-ročného sledovania kohorty B PARTNER štúdie [14]](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/0079420582426bb0cc64ab5ab533c502.jpg)
Celková mortalita aj kardiovaskulárna mortalita bola signifikantne vyššia v konzervatívnej vetve v porovnaní s TAVI vetvou. Cievne mozgové príhody (CMP) boli signifikantne častejšie v TAVI vetve, v prvých 30 dňoch prevažovali ischemické [17], v neskoršom období hemoragické príhody [18]. Avšak spoločný end point, celková mortalita a CMP vyšli opäť v prospech TAVI. Po 3 rokoch bolo do funkčnej skupiny NYHA I alebo II zaradených v TAVI vetve 71 % a v konzervatívnej vetve 50 % prežívajúcich pacientov.
V TAVI vetve medzi faktory, u ktorých sa preukázal signifikantný vzťah k 3-ročnej mortalite patria: STS score (Society of Thoracic Surgeons risk score), body mass index (BMI) > 26, chirurgická revaskularizácia myokardu (coronary artery bypass grafting – CABG), závažná mitrálna regurgitácia (mitral regurgitation – MR), CMP, tranzitórny ischemický atak (TIA), chronická obštrukčná choroba pľúc (CHOPCH) vyžadujúca oxygenoterapiu a periférna vaskulopatia.
V konzervatívnej vetve STS score nemalo signifikantný vplyv na 3-ročnú mortalitu.
V oboch vetvách bol podobne častý výskyt infarktu myokardu, renálneho zlyhania, infekčnej endokarditídy (IE) a potreby implantácie kardiostimulátora [14].
U pacientov, ktorí podstúpili BAV, bol zaznamenaný len 6 mesiacov trvajúci nesignifikantný trend k zlepšeniu [15].
Echokardiograficky bolo dokázané, že na bioprotéze nedochádza k zvýšeniu transvalvulárneho gradientu ani k opotrebovaniu chlopne [19]. Prítomnosť stredne závažného až závažného paravalvulárneho leaku sa vyskytla u 10 % pacientov. Rozdiel v kardiálnej aj celkovej mortalite medzi pacientmi s ľahkým alebo žiadnym paravalvulárnym leakom (PVL) resp. aortálnou regurgitáciou (AoR) a pacientmi so stredne závažným až závažným PVL resp. AoR bol v 3-ročnom sledovaní nesignifikantný. Negatívny vplyv PVL je pravdepodobne maskovaný prítomnosťou komorbidít.
Celková mortalita 54,1 % v TAVI skupine v 3-ročnom sledovaní naznačuje, že je potrebné sa pokúsiť identifikovať rizikovú populáciu, ktorá má minimálny alebo žiadny prínos z TAVI [14].
Kohorta A štúdie PARTNER
Do kohorty A bolo zapojených 699 pacientov so závažnou AoS s vysokým operačným rizikom. Pacienti boli rozdelení do 2 vetiev: 348 do TAVI vetvy a 351 do vetvy, ktorá podstúpia SAVR. Za vysoké operačné riziko je považované STS score > 10 % [20].
Výsledky 3-ročného sledovania uvádza tab. 3.
![Výsledky 3-ročného sledovania kohorty A štúdie PARTNER [20]](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/09607c5a90d1d7ae2ed7b103b67ae173.jpg)
Včasná 30-dňová mortalita poklesla na 5 % kvôli lepšiemu výberu pacientov, väčšej skúsenosti lekárov a vývoju techniky [21].
Podobná mortalita v oboch vetvách svedčí pre význam komorbidít v neskorej mortalite [22]. Za prediktory mortality v TAVI vetve boli určené BMI, fibrilácia predsiení (AFib), stredný tlakový gradient (mean pressure gradient – MPG), hepatálna insuficiencia, renálna insuficiencia (kreatinín – Cr ≥ 2). Prediktormi mortality v SAVR vetve boli CABG, implantovaný kardiostimulátor, stredne závažná až závažná MR a hepatálna insuficiencia. CMP, závažné krvácanie a STS score mali negatívny dopad na prognózu v oboch skupinách.
Pri porovnávaní jednotlivých podskupín pacientov mali vyšší prínos z TAVI ako zo SAVR ženy a pacienti, ktorí v minulosti nepodstúpili CABG [23]. Hemodynamická funkcia chlopne bola podobná v oboch vetvách. Postprocedurálne bol PVL častejší v TAVI vetve (stredne závažný – závažný), ale bez významných zmien v 3-ročnom sledovaní. Aj ľahká AoR alebo PVL boli asociované so zvýšenou mortalitou [24].
30-dňová mortalita bola v porovnání s transfemorálnou implantáciou vyššia u pacientov podstupujúcich transapikálnu implantáciu. Príčinou tohto výsledku môže byť vyšší výskyt komorbidít u týchto pacientov, potreba získania praxe implantačným tímom a malý počet hodnotených pacientov [20].
Percentuálny výskyt včasných komplikácií v oboch vetvách uvádza tab. 4.
![Percentuálny výskyt včasných komplikácií (30-dňové sledovanie) v kohorte A štúdie PARTNER [20]](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/c35602449cc53a1803562d26e63af0b1.jpg)
Práce nadväzujúce na štúdiu PARTNER
Len nedávno uverejnená randomizovaná štúdia s 5-ročným sledovaním pacientov po TAVI poukazuje na pretrvávajúci priaznivý hemodynamický efekt implantovanej bioprotézy bez známok jej štrukturálnych zmien [25].
Niektoré retrospektívne práce dokumentujú, že zvyšujúca sa skúsenosť implantačného týmu pri TAVI je spojená s kratšou dobou výkonu, nižším množstvom spotrebovanej kontrastnej látky, menším počtom komplikácií a kratšou dobou hospitalizácie [26,27].
Napriek tomu, že závažná bikuspidálna AoS je relatívnou kontraindikáciou k TAVI, väčšina kandidátov môže podstúpiť TAVI s použitím bežného inštrumentária. Retrospektívne práce dokumentujú efektivitu, bezpečnosť a akceptovateľné výsledky intervencie podobné ako u pacientov s AoS trojcípej chlopne [28,29].
CoreValve US Pivotal High Risk Trial
Štúdia s CoreValve US Pivotal High risk trial je prvá randomizovaná štúdia, ktorá pri sledovaní 1-ročného prežívania pacientov podstupujúcich TAVI alebo SAVR dokázala superioritu TAVI. Tento výsledok bol dosiahnutý nižším počtom CMP a štatisticky významnými zmenami funkcie aortálnej chlopne (plocha aortálnej chlopne a stredný tlakový gradient) [8]. Detailnejšie výstupy z 1-ročného sledovania tejto štúdie uvádza tab. 5 a tab. 6.
![CoreValve US Pivotal High Risk Trial – výsledky 1-ročného sledovania [10]](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/b1259d10cedb0c95c9b0a3b87e9d297b.jpg)
![CoreValve US Pivotal High Risk Trial – výskyt komplikácii v 1ročnom sledovaní [10]](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/a4c1d9534a58e1b51cd3a3de3da98566.jpg)
Úloha počítačovej tomografie pri TAVI
Multidetektorová počítačová tomografia (MDCT) hrá kľúčovú úlohu pri vyšetrovaní pacientov indikovaných na TAVI [30]. Sprostredkuje detailné anatomické zhodnotenie aortálneho koreňa a anulu, vhodnosti iliofemorálneho prístupu a definuje vhodný uhol implantácie. Pri všetkých implantačných prístupoch je presné meranie nevyhnutné. Na základe rozmerov sa vyberá vhodný prístup, inštrumentárium, typ aj veľkosť chlopne. Na rozdiel od SAVR, kde sa veľkosť chlopne určuje priamou vizualizáciou za použitia špeciálnych sond, pri TAVI sa musí implantačný tím spoliehať na presnosť meraní prostredníctvom zobrazovacích metód [31].
Optimálne umiestnenie transkatétrovej aortálnej protézy je rozhodujúce pre úspech procedúry. Cieľom je utlačiť pôvodné cípy aortálnej chlopne a implantovať protézu do natívneho anulu chlopne. Medzi najčastejšie riziká vysokej implantácie patria: poranenie aorty, paravalvulárna regurgitácia a periférna embolizácia [32]. Pri nízkej implantácií môže dôjsť k dysfunkcii mitrálnej chlopne, poruche atrioventrikulárneho prevodu, paravalvulárnej regurgitácii alebo embolizácii do ľavej komory [33]. Rizikom menšej protézy je embolizácia a paravalvulárna regurgitácia [34]. Pri väčšej protéze hrozí ruptúra aortálneho anulu resp. aorty [35].
Hodnotenie aortálneho anulu
Aortálny anulus je komplexná trojhranná štruktúra. Je tvorený troma najnižšími bodmi, tzv. „hinge points“, cípov aortálnej chlopne. Virtuálny prstenec, tzv. bazálny ring resp. prstenec, spájajúci tieto 3 body, je najdôležitejšou štruktúrou pre výber správnej veľkosti bioprotézy [36].
Merania rozmerov aortálneho anulu pred TAVI sa v minulosti vykonávali aortografiou a dvojrozmernou transtorakálnou alebo transezofegeálnou echokardiografiou (TTE, TEE). Nesúlad medzi výsledkami jednotlivých metodík je častý [37]. Najvýraznejším obmedzením týchto dvojrozmerných techník je fakt, že anulus má oválny a nie kruhovitý tvar [38]. Vzhľadom na to, že pomocou 2D TTE a TEE dokážeme merať len kratší rozmer tejto oválnej štruktúry, je celková nameraná veľkosť anulu v porovnaní s trojrozmernou (3D) CT rekonštrukciou menšia [39].
Meranie rozmerov aortálneho anulu pomocou CT vyžaduje vytvorenie obrazu, ktorý presne koreluje s bazálnym ringom aortálnej chlopne [40]. Ten je definovaný ako rovina tesne pod najnižšími bodmi aortálnych cípov. Vzhľadom na zložitú anatómiu aortálnej chlopne nie je jednoduché nastaviť plochu zobrazenia do presnej pozície bazálneho anulu. Rovina tohto anulu často nie je kolmá na výtokový trakt ľavej komory a pravý koronárny cíp zvykne byť uložený nižšie ako ostatné 2 cípy.
Na aortálnom anule sa meria jeho dlhší a kratší rozmer, plocha a od plochy odvodený priemer anulu a obvod [41].
Predbežné údaje uvádzajú, že vhodnejšie je merať rozmery anulu v systole. Plocha a z plochy odvodený priemer je väčší v systole ako v diastole [42]. Dĺžka obvodu prstenca je počas kardiálneho cyklu viac stabilná a tiež dochádza k menším zmenám v jeho geometrii [43].
Hodnotenie ostatných parametrov aortálneho koreňa
Okrem hodnotenia aortálneho anulu je potrebné zhodnotiť jeho vzdialenosť od koronárneho ústia (obr. 1), šírku aortálneho (Valsalvovho) sinusu, sinotubulárnej junkcie, ascendentnej aorty a výšku Valsalvovho sinusu. Tieto merania sú dôležité k predchádzaniu závažných komplikácií ako napr. oklúzia koronárneho ústia a poranenie koreňa aorty. Z tohto pohľadu sa za viac rizikové považujú Edwards-Sapien protézy, pri ktorých je odporúčaná minimálna vzdialenosť medzi koronárnym ústim a bazálnou rovinou aortálneho anulu 10–14 mm [44], obr. 2.
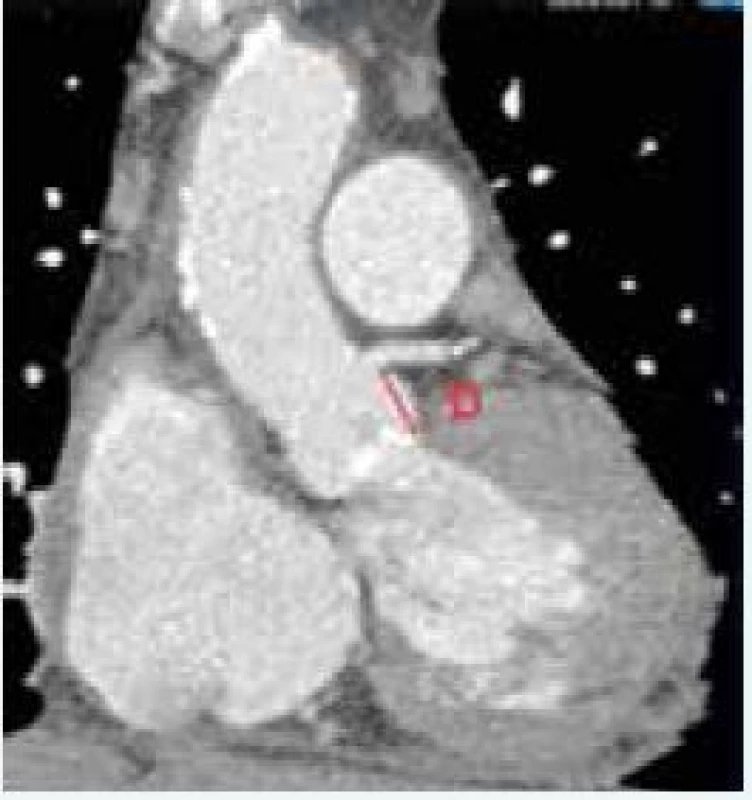
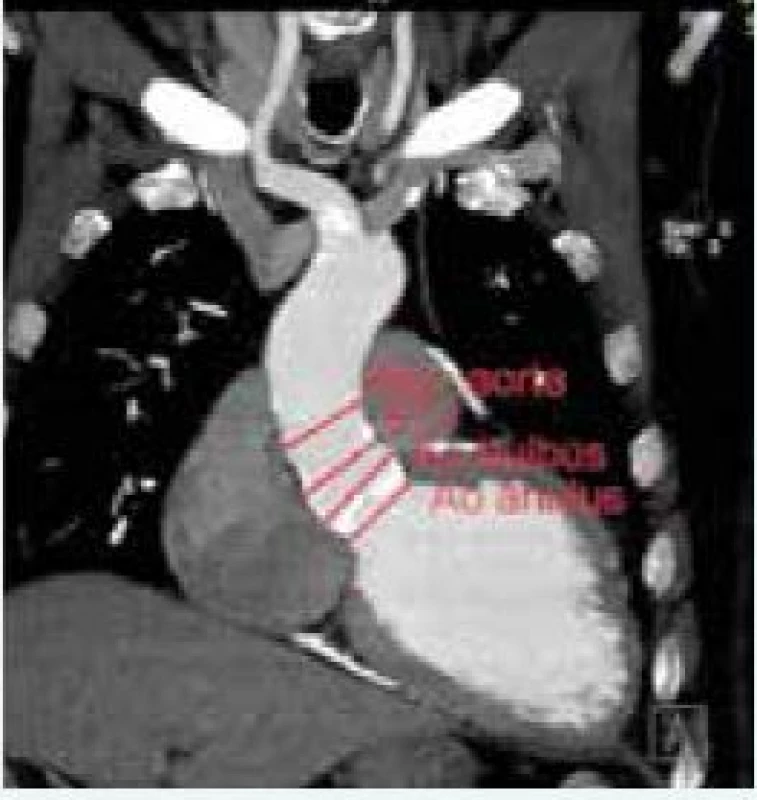
Dnes dostupné veľkosti protéz dovoľujú vykonať TAVI u pacientov s aortálny ringom 18–28 mm u Edwards-Sapien a 18–29 mm u Medtronic-CoreValve systému [45]. Zatiaľ čo Edwards-Sapien protézy sú 14–19 mm vysoké a nepresahujú aortálny sinus, samoexpandibilné Medtronic-CoreValve protézy sú 45–55 mm vysoké a po implantácií presahujú sinotubulárnu junkciu a siahajú až do ascendentnej aorty. Medtronic-CoreValve protéza vyžaduje minimálne 25 mm široký a 15 mm vysoký Valsalvov sinus, maximálny rozmer ascendentnej aorty nesmie presiahnuť 34 mm u chlopne veľkosti 23, 40 mm u chlopne veľkosti 26 a 43 mm u chlopne veľkosti 29 a 31 [46].
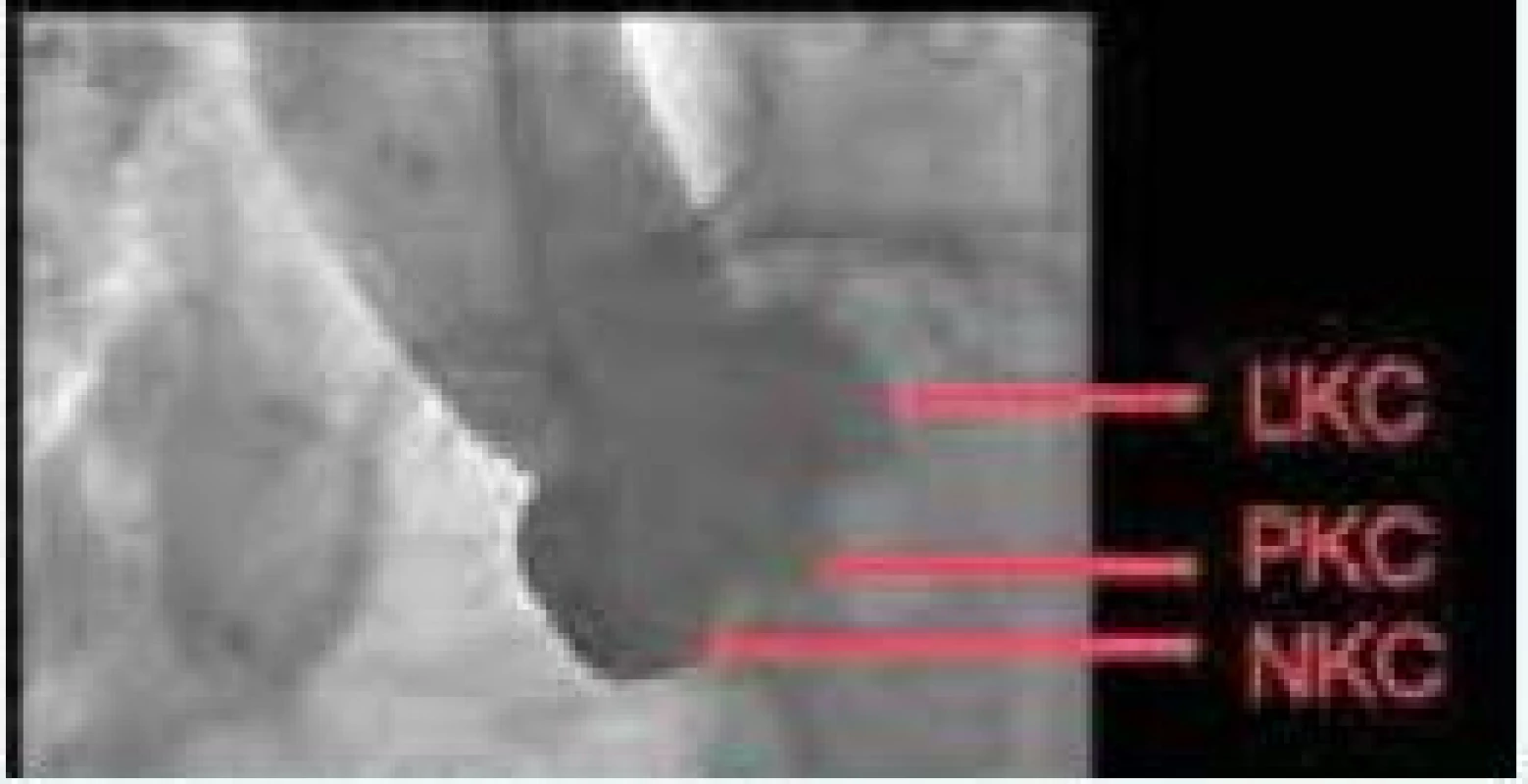
Určenie uhla skiaskopickej projekcie
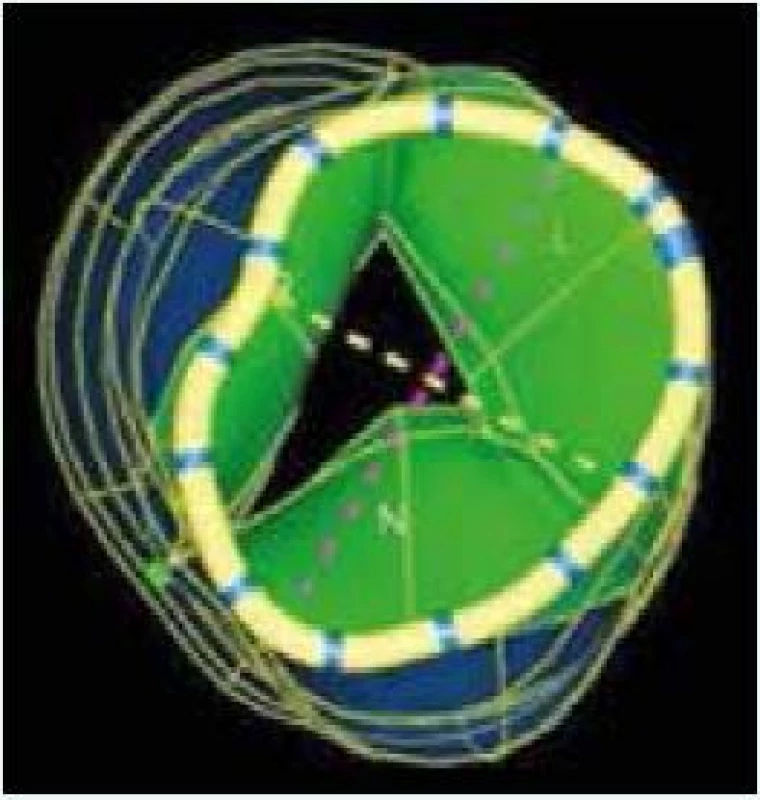
Počas implantácie je dôležité použiť skiaskopickú projekciu, ktorá poskytuje kolmý pohľad na rovinu aortálneho anulu (obr. 3). Prostredníctvom CT 3D zobrazenia dokážeme identifikovať vhodný uhol projekcie, ktorý zabezpečí kolmý pohľad na rovinu aortálnej chlopne [47]. Tento uhol projekcie korešponduje s uhlom C ramena, ktorý sa použije počas TAVI [48].
Posúdenie miery kalcifikácie aortálneho koreňa a chlopne
Prítomnosť chlopňových kalcifikátov môže byť užitočná pri bezpečnom uchytení protézy a pri predchádzaní jej dislokácie [49]. Na druhej strane nadmerná kalcifikácia môže kvôli nepravidelnému povrchu aortálneho koreňa brániť správnemu uloženiu protézy a môžu ostať medzery medzi protézou a natívnym aortálnym koreňom, ktoré vedú k vzniku postimplantačnej paravalvulárnej regurgitácie [50]. Závažnosť a lokalizácia kalcifikácie môže viesť k anulárnej ruptúre, dislokácii protézy a obštrukcii koronárneho ústia [51].
Ateroembolizmus z ascendentnej aorty, aortálneho oblúka a aortálnej chlopne je považovaný za najčastejšiu príčinu periprocedurálnej cievnej mozgovej príhody [44]. Znížiť riziko výskytu týchto komplikácii sa dá užívaním duálnej antiagregačnej liečby [52].
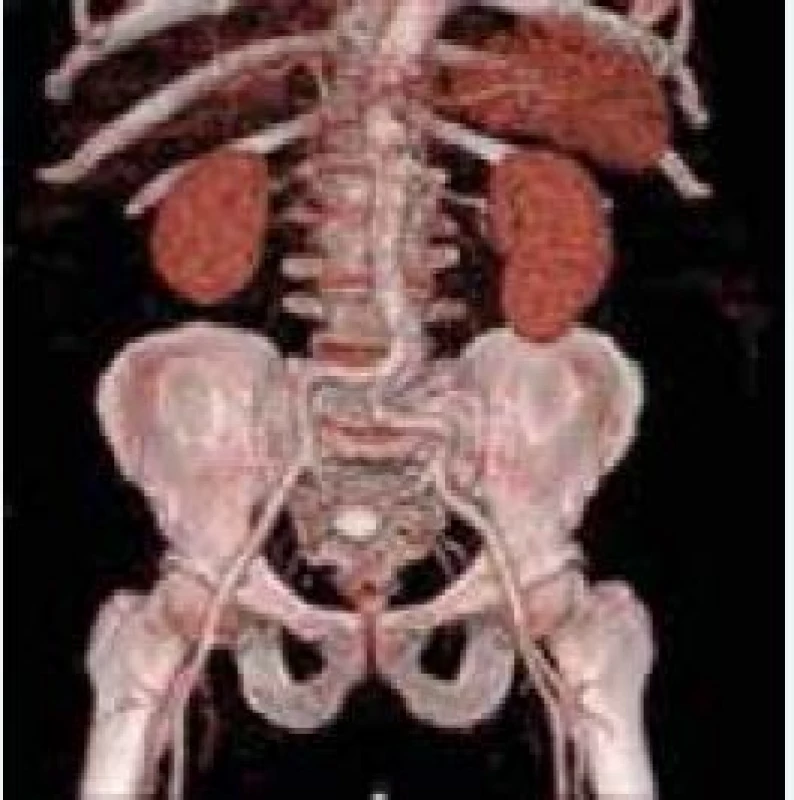
Hodnotenie vhodného prístupu
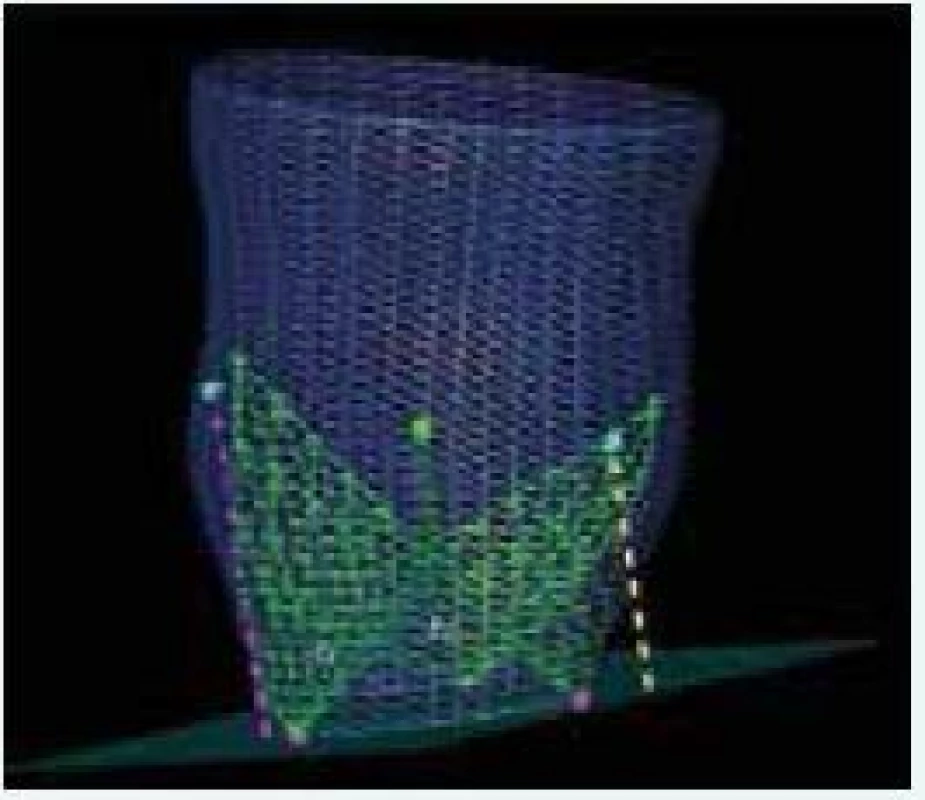
Relatívne veľké zavádzacie katétre sú spájané s častými vaskulárnymi komplikáciami a s obmedzenou dostupnosťou metódy pre pacientov s nevhodným alebo malým vaskulárnym prístupom. Dnes sa najčastejšie používajú 18 F katétre, dostupné sú už aj 14 F a existuje snaha o ich ďalšie zmenšovanie. V rámci prípravy na TAVI sa vykonáva 3D CT rekonštrukcia cievneho systému so zhodnotením minimálneho lúmenu, priebehu ciev, miery ich kalcifikácie, aterosklerotického postihnutia a rizika vzniku disekcie a iných komplikácií [53], obr. 4.
Pri transapikálnom prístupe sa lokalizuje apex ľavej komory a jeho premietnutie na hrudnú stenu, následne sa určí uhol, ktorý zvierajú os ľavej komory a ľavého výtokového traktu. Pri transaortálnom prístupe je potrebné určiť lokalizáciu ascendentnej aorty a jej projekciu na hrudnú stenu [54].
Využitie trojrozmernej echokardiografie pri hodnotení aortálneho koreňa
Presnosť zhodnotenia geometrie aortálneho koreňa pred TAVI hrá kľúčovú úlohu v bezkomplikačnom priebehu a v úspešnosti výkonu [55].
MDCT je preferovanou metódou hodnotenia geometrie aortálneho koreňa u kandidátov TAVI [56]. Medzi nedostatky tejto metódy patria: pôsobenie ionizačného žiarenia, riziko vzniku postkontrastnej nefropatie, relatívna kontraindikácia pri fibrilácií predsiení a pri hypersenzitivite na jód. Niektoré práce poukazujú, že 3D TEE by v budúcnosti mohla byť spoľahlivou alternatívou k MDCT vyšetreniu [57] , obr. 5.
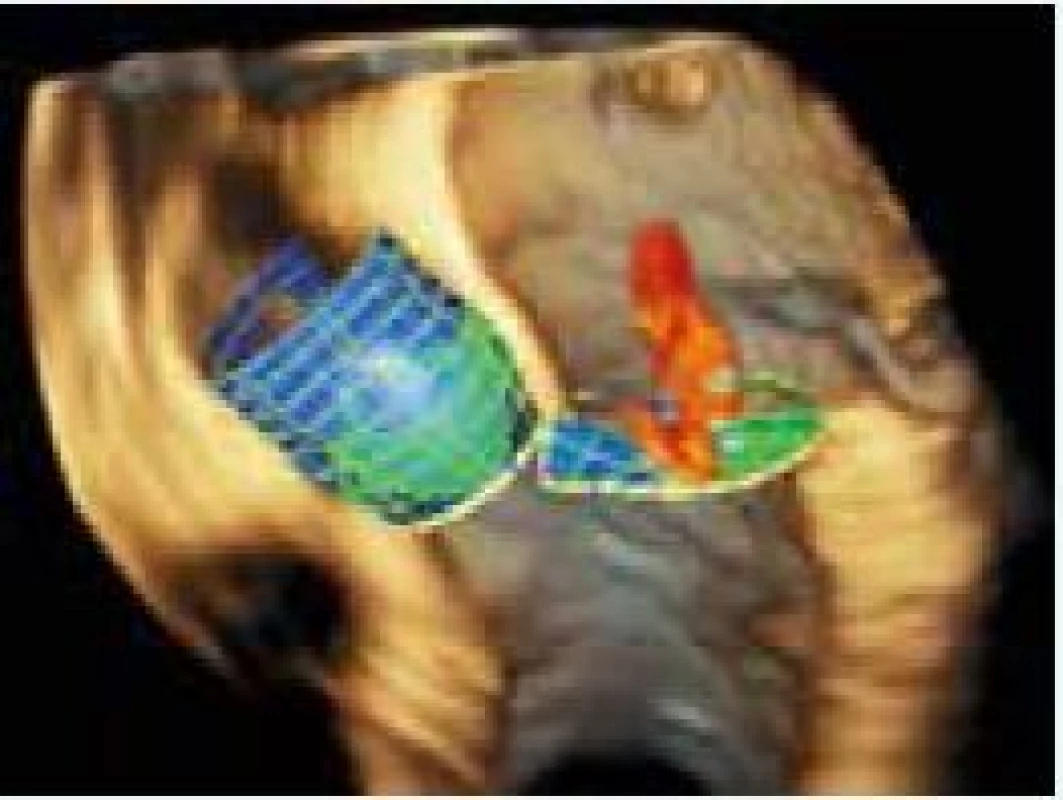
Na aortálnom koreni hodnotíme rozmery a plochu aortálneho anulu, plochu Valsalvovho sinusu, rozmery a plochu sinotubulárnej junkcie (STJ), vzdialenosť medzi aortálnym anulom a STJ a objem tohto priestoru, vzdialenosť ľavého a pravého koronárneho ústia od aortálneho anulu (obr. 6 a 7). Ich hodnoty sú pri vyšetrení 3D TEE mierne, ale signifikantne menšie oproti MDCT. Avšak získané hodnoty medzi jednotlivými zobrazovacími metodikami navzájom veľmi dobre korelujú. 3D TEE nám umožňuje hodnotenie ďalších parametrov aortálneho koreňa, ktorých význam pre TAVI zatiaľ nebol preskúmaný. Medzi tieto parametre patria: vzdialenosť komisúr od bazálneho ringu, vzájomná vzdialenosť jednotlivých komisúr, výška koaptácie cípov, efektívna výška cípov a dĺžka voľnej hrany cípov [57].
Záver
Podľa výsledkov kohorty B štúdie PARTNER predstavuje TAVI plnohodnotnú terapeutickú metódu u pacientov, ktorí boli srdcovým tímom označení za inoperabilných pre veľmi vysoké operačné riziko, a u pacientov, ktorí sú považovaní za operabilných, avšak pri vysokom operačnom riziku CoreValve US Pivotal High risk štúdia preukázala superioritu TAVI nad chirurgickou liečbou. Výsledky dlhodobejšieho sledovania sú potrebné za účelom validácie životnosti bioprotéz. Za zlatý štandard medzi diagnostickými metódami sa dnes považuje MDCT, avšak v budúcnosti nemôžeme vylúčiť jej nahradenie 3D TEE, ktorá nie je zaťažená ionizačným žiarenim, rizikom postkontrastnej nefropátie a hypersenzitivity na jód. Echokardiografia navyše umožňuje periprocedurálne usmerňovanie výkonu, jednoduchšiu a lacnejšiu dispenzarizáciu.
MUDr. Marián Kurečko
mkurecko@vusch.sk
Klinika kardiológie VUSCH, a.s., Košice
www.vusch.sk
Doručeno do redakce 3. 12. 2014
Přijato po recenzi 19. 3. 2015
Sources
1. Bach DS, Siao D, Girard SE et al. Evaluation of patients with severe symptomatic aortic stenosis who do not undergo aortic valve replacement: the role of subjectively overestimated operative risk. Circ Cardiovasc Qual Outcomes 2009; 2(6): 533–539.
2. O’Brien SM, Shahian DM, Filardo G et al. The Society of Thoracic Surgeons 2008 cardiac surgery risk models. 2. Isolated valve surgery. Ann Thorac Sur 2009; 88(Suppl 1): S23-S42.
3. Florath I, Albert A, Boening A et al. Aortic valve replacement in octogenarians: identification of high-risk patients. Eur J Cardiothorac Sur 2010; 37(6): 1304–1310.
4. Rodés-Cabau J, Webb JG, Cheung A et al. Transcatheter aortic valve implantation for the treatment of severe symptomatic aortic stenosis in patients at very high or prohibitive surgical risk: acute and late outcomes of the multicenter Canadian experience. J Am Coll Cardiol 2010; 55(11): 1080–1090.
5. Webb JG, Altwegg L, Boone RH et al. Transcatheter aortic valve implantation: impact on clinical and valve-related outcomes. Circulation 2009; 119(23): 3009–3016.
6. Svensson LG, Dewey T, Kapadia S et al. United States feasibility study of transcatheter insertion of a stented aortic valve by the left ventricular apex. Ann Thorac Sur 2008; 86(1): 46–54.
7. Bruschi G, DeMarco F, Botta L et al. Direct aortic access for transcatheter self-expanding aortic bioprosthetic valves implantation. Ann Thorac Sur 2012; 94(2): 497–503.
8. Barker CM, Reardon MJ. The CoreValve US Pivotal Trial. Semin Thoracic Surg 2014; 26(3): 179–186.
9. Thomas M, Schymik G, Walther T et al. Thirty-day results of the SAPIEN aortic Bioprosthesis European Outcome (SOURCE) Registry: a European registry of transcatheter aortic valve implantation using the Edwards SAPIEN valve. Circulation 2010; 122(1): 62–69.
10. Adams DH, Popma JJ, Reardon MJ et al. Transcatheter Aortic-Valve Replacement with a Self-Expanding Prosthesis. N Engl J Med 2014; 370(19): 1790–1798.
11. Grube E, Buellessfeld L, Mueller R et al. Progress and current status of percutaneous aortic valve replacement: results of three device generations of the CoreValve Revalving system. Circ Cardiovasc Interv 2008; 1(3): 167–175.
12. Leon MB, Piazza N, Nikolsky E et al. Standardized endpoint definitions for transcatheter aortic valve implantation clinical trials: a consensus report from the Valve Academic Research Consortium. Eur Heart J 2011; 32(2): 205–217.
13. Vahanian A, Baumgartner H, Bax J et al. ESC Guidelines on the Management of Valvular Heart Disease. Eur Heart J 2012; 33(19): 2451–2496.
14. Kapadia SR. Three-year outcomes of transcatheter aortic valve replacement (TAVR) in „inoperable“ patients with severe aortic stenosis. The PARTNER trial investigators. Transcatheter cardiovascular terapeutics conference. Miami, FL. October 24, 2012. Dostupné z WWW: <http://solaci.org/es/pdfs/tct2012/5_samir_kapadia.pdf>.
15. Leon MB, Craig R, Smith CR et al. Transcatheter aortic-valve implantation for aortic stenosis in patients who cannot undergo surgery. N Eng J Med 2010, 363(17): 1597–1607.
16. Makkar RR, Fontana GP, Jilaihawi H. Transcatheter aortic-valve replacement for inoperable severe aortic stenosis. N Eng J Med 2012; 366(18): 1696–1704. Erratum in N Engl J Med 2012; 367(9): 881.
17. Kahlert P, Knipp SC, Schlamann M et al. Silent and apparent cerebral ischemia after percutaneous transfemoral aortic valve implantation: a diffusion-weighted magnetic resonance imaging study. Circulation 2010; 121(7): 870–878.
18. Ghanem A, Muller A, Nähle CP et al. Risk and fate of cerebral embolism after transfemoral aortic valve implantation: a prospective pilot study with diffusionweighted magnetic resonance imaging. J Am Coll Cardiol 2010; 55(14): 1427–1432.
19. Clavel MA, Webb JG, Pibarot P et al. Comparison of the hemodynamic performance of percutaneous and surgical bioprostheses for the treatment of severe aortic stenosis. J Am Coll Cardiol 2009; 53(20): 1883–1891.
20. Smith CR, Leon MB, Mack MJ et al. Transcatheter versus surgical aortic-valve replacement in high-risk patients. N Eng J Med; 2011; 364(23): 2187–2198.
21. Tamburino C, Capodanno D, Ramondo A et al. Incidence and predictors of early and late mortality after transcatheter aortic valve implantation in 663 patients with severe aortic stenosis. Circulation 2011; 123(3): 299–308.
22. Kodali SK, Williams MR, Smith CR et al. Two-year outcomes after transcatheter or surgical aortic-valve replacement. N Eng J Med 2012; 366(18): 1686–1695.
23. Williams M, Kodali SK, Hahn RT et al. Sex-related differences in outcomes following transcatheter or surgical aortic valve replacement in patients with severe aortic stenosis: Insights From The PARTNER Trial (Placement of Aortic Transcatheter Valve). J Am Coll Cardiol 2014; 63(15): 1522–1528.
24. Vinod HT. Three-year outcomes after transcatheter or surgical aortic valve replacement in high-risk patients with severe aortic stenosis. American college of cardiology scientific session. [online]. 11.3.2013 [cit. 25.11.2014]. Dostupné z: <http://clinicaltrialresults.org/Slides/ACC%202013/Thourani_PARTNER%20Cohort%20A_ACC%202013.ppt>.
25. Kapadia SR, Leon MB, Makkar RR et al. 5-year outcomes of transcatheter aortic valve replacement compared with standard treatment for patients with inoperable aortic stenosis (PARTNER 1): a randomised controlled trial. Lancet 2015; 385(9986): 2485–2491. Dostupné z: <http://www.thelancet.com/journals/lancet/article/PIIS0140–6736(15)60290–2/fulltext>.
26. Kala P, Němec P, Malík P et al. The role of learning curve on the results of aortic valve implantation for severe aortic stenosis. Vnitř Lék 2014; 60(4): 316–321.
27. Gurvitch R, Tay EL, Wijesinghe N et al. Transcatheter Aortic Valve implantation: Lessons From the Learning Curve of the First 270 High-Risk Patients. Catheter Cardiovasc Interv 2011, 78(7): 977–984.
28. Himbert D, Pontnau F, Messika-Zeitoun D et al. Feasibility and outcomes of transcatheter aortic valve implantation in high-risk patients with stenotic bicuspid aortic valves. Am J Cardiol 2012; 110(6): 877–883.
29. Hayashida K, Bouvier E, Lefevre T et al. Transcatheter aortic valve implantation for patients with severe bicuspid aortic valve stenosis. Circ Cardiovasc Interv 2013; 6(3): 284–291.
30. Achenbach S, Delgado V, Hausleiter J et al. SCCT expert consensus document on computed tomography imaging before transcatheter aortic valve implantation (TAVI)/replacement (TAVR). J Cardiovasc Comput Tomogr 2012; 6(6): 366–380.
31. Leipsic J, Gurvitch R, LaBounty TM et al. Multidetector computed tomography in transcatheter aortic valve implantation. JACC Cardiovasc Imaging 2011; 4(4): 416–429.
32. Al Ali AM, Altwegg L, Horlick EM et al. Prevention and management of transcatheter balloon-expandable aortic valve malposition. Catheter Cardiovasc Interv 2008; 72(4): 573–578.
33. Tuzcu EM. Transcatheter aortic valve replacement malposition and embolization: innovation brings solutions also new challenges. Catheter Cardiovasc Interv 2008; 72(4): 579–580.
34. Sinning JM, Hammerstingl C, Vasa-Nicotera M et al. Aortic regurgitation index defines severity of peri-prosthetic regurgitation and predicts outcome in patients after transcatheter aortic valve implantation. J Am Coll Cardiol 2012; 59(13): 1134–1141.
35. Gilard M, Eltchaninoff H, Iung B et al. Registry of transcatheter aortic-valve implantation in high-risk patients. N Eng J Med 2012; 366(18): 1705–1715.
36. Piazza N, de Jaegere P, Schultz C et al. Anatomy of the aortic valvar complex and its implications for transcatheter implantation of the aortic valve. Circ Cardiovasc Interv 2008; 1(1): 74–81.
37. Altiok E, Koos R, Schroder J et al. Comparison of two-dimensional and three-dimensional imaging techniques for measurement of aortic annulus diameters before transcatheter aortic valve implantation. Heart 2011; 97(19): 1578–1584.
38. Ng AC, Delgado V, van der Kley F et al. Comparison of aortic root dimensions and geometries before and after transcatheter aortic valve implantation by 2 - and 3-dimensional transesophageal echocardiography and multislice computed tomography. Circ Cardiovasc Imaging 2010; 3(1): 94–102.
39. Willson AB, Webb JG, LaBounty TM et al. 3-dimensional aortic annular assessment by multidetector computed tomography predicts moderate or severe paravalvular regurgitation after transcatheter aortic valve replacement: implications for sizing of transcatheter heart valves. J Am Coll Cardiol 2012; 59(14): 1287–1294.
40. Piazza N, Lange R. Imaging of valvular heart disease: I can see clearly now. Anatomy of aortic valve. [online]. 2010. Dostupné z WWW: <http://org.crsti.dliv2010.s3.amazonaws.com/pdfs/034_Ovality_of_the_aortic_valve_annulus.pdf>.
41. Jilaihawi H, Kashif M, Fontana G et al. Cross-sectional computed tomographic assessment improves accuracy of aortic annular sizing for transcatheter aortic valve replacement and reduces the incidence of paravalvular aortic regurgitation. J Am Coll Cardiol 2012; 59(14): 1275–1286.
42. Toggweiler S, Gurvitch R, Leipsic J et al. Percutaneous aortic valve replacement: vascular outcomes with a fully percutaneous procedure. J Am Coll Cardiol 2012; 59(2): 113–118.
43. Hamdan A, Guetta V, Konen E et al. Deformation dynamics and mechanical properties of the aortic annulus by 4-dimensional computed tomography: insights into the functional anatomy of the aortic valve complex and implications for transcatheter aortic valve therapy. J Am Coll Cardiol 2012; 59(2): 119–127.
44. Masson JB, Kovac J, Schuler G et al. Transcatheter aortic valve implantation: review of the nature, management, and avoidance of procedural complications. JACC Cardiovasc Interv 2009; 2(9): 811–820.
45. Willson AB, Webb JG, Gurvitch R et al. Structural integrity of balloon-expandable stents after transcatheter aortic valve replacement: assessment by multidetector computed tomography. JACC Cardiovasc Interv 2012; 5(5): 525–532.
46. Kasel AM, Cassese S, Bleiziffer S et al. Standardized imaging for aortis annular Sizing: Implications for transcatheter valve selection. JACC Cardiovasc Img 2013; 6(2): 249–262.
47. Gurvitch R, Wood DA, Leipsic J et al. Multislice computed tomography for prediction of optimal angiographic deployment projections during transcatheter aortic valve implantation. JACC Cardiovasc Interv 2010; 3(11): 1157–1165.
48. Arnold M, Achenbach S, Pfeiffer I et al. A method to determine suitable fluoroscopic projections for transcatheter aortic valve implantation by computed tomography. J Cardiovasc Comput Tomogr 2012; 6(6): 422–428.
49. Van Mieghem NM, Schultz CJ, van der Boon RM et al. Incidence, timing, and predictors of valve dislodgement during TAVI with the medtronic corevalve system. Catheter Cardiovasc Interv 2012; 79(5): 726–732.
50. John D, Buellesfeld L, Yuecel S et al. Correlation of device landing zone calcification and acute procedural success in patients undergoing transcatheter aortic valve implantations with the self-expanding CoreValve prosthesis. JACC Cardiovasc Interv 2010; 3(2): 233–243.
51. Geisbusch S, Bleiziffer S, Mazzitelli D et al. Incidence and management of CoreValve dislocation during transcatheter aortic valve implantation. Circ Cardiovas Interv 2010; 3(6): 531–536.
52. Ussia GP, Scarabelli M, Mulé M et al. Dual antiplatelet therapy versus aspirin alone in patients undergoing transcatheter aortic valve implantation. Am J Cardiol 2011; 108(12): 1772–1776.
53. Hayashida K, Lefévre T, Chevalier B et al. Transfemoral aortic valve implantation new criteria to predict vascular complications. JACC Cardiovasc Interv 2011; 4(8): 851–858.
54. Walther T, Falk V, Kempfert J et al. Transapical minimally invasive aortic valve implantation: the initial 50 patients. Eur J Cardiothorac Sur 2008; 33(6): 983–988.
55. Pibarot P, Dumesnil JG. Improving assessment of aortic stenosis. J Am Coll Cardiol 2012; 60(3): 169–180.
56. Pontone G, Andreini D, Bartorelli AL et al. Feasibility and accuracy of a comprehensive multidetector computed tomography acquisition for patients referred for balloon-expandable transcatheter aortic valve implantation. Am Heart J 2012; 161(6): 1106–1113.
57. Schoenhagen P, Tuzcu EM, Kapadia SR et al. Threedimensional imaging of the aortic valve and aortic root with computed tomography: new standards in an era of transcatheter valve repair/implantation. Eur Heart J 2009; 30(17): 2079–2086.
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Internal Medicine

2015 Issue 7-8
-
All articles in this issue
- Transplantace pankreatu: současný stav a výhledy do budoucna
- Tumory a transplantace jater
- Transplantace solidních orgánů v České republice
- Novinky v léčbě akutního nevarikózního krvácení do horní části gastrointestinálního traktu
- Domácí nutriční péče v České republice
- Vitamin D – stará látka s novými perspektivami
- Možnosti endoskopického řešení polypoidních a nepolypoidních lézí v kolon
- Obyčejná nemoc – apendicitida
- Platí „LDL-hypotéza“ i pro pacienty s diabetem?
- Snížení krevního tlaku – léčbou dalších rizikových faktorů
- Jak na dyslipidemii u pacientů s metabolickým syndromem
- Transplantace ledviny při inkompatibilitě krevní skupiny – úvodní zkušenosti programu
- Takotsubo (stresová) kardiomyopatie – co se změnilo? – editorial
- Rizikové faktory vzniku karcinomu štítné žlázy – editorial
- Takotsubo kardiomyopatie, klinické zkušenosti s onemocněním a jednoletá prognóza pacientů
- Infuzní toxicita rituximabu u nemocných s chronickou lymfocytární leukemií
- Kardiovaskulární účinky léčby GLP-1 agonisty se zaměřením na liraglutid
- Transkatétrová implantácia aortálnej chlopne – indikácie, priebeh intervencie a výsledky
- Hepatorenální syndrom – patofyziologie, diagnostika a léčba
- Rizikové faktory vzniku karcinomu štítné žlázy
-
Erektilná dysfunkcia ako prvý znak systémových cievnych chorôb a orgánovovaskulárnych artériových ischemických chorôb
Odporúčania a výzva Angiologickej sekcie Slovenskej lekárskej komory (2015)
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue
- Obyčejná nemoc – apendicitida
- Transkatétrová implantácia aortálnej chlopne – indikácie, priebeh intervencie a výsledky
- Hepatorenální syndrom – patofyziologie, diagnostika a léčba
-
Erektilná dysfunkcia ako prvý znak systémových cievnych chorôb a orgánovovaskulárnych artériových ischemických chorôb
Odporúčania a výzva Angiologickej sekcie Slovenskej lekárskej komory (2015)
