Osteoartróza jako součást metabolického syndromu?
Osteoarthritis as part of metabolic syndrome?
Osteoarthritis (OA) is the most frequent joint disease, whereas etiopathogenesis of OA is not entirely clarified. It is a heterogeneous disorder and genetic as well as biomechanical, endocrine and inflammatory effects may be involved in its origin. The author examines the problems concerning relationships between the metabolic syndrome and OA, and states that the prevalence of metabolic syndrome in patients with OA is higher than in those without OA (59 % vs 23 %). It remains problematic that one of the main components of metabolic syndrome is obesity which in itself is a risk factor for arthrosis development in the weight-bearing joints, not for OA in the hands. After adjustment for BMI the relationships between the metabolic syndrome and OA are less expressed. Over the last decade evidence has been gained about adipose tissue being the source of numerous cytokines and adipokines which may cause inflammation of low-activity synovial tissue, sometimes also called “meta-inflammation.” The most data was gathered on leptin, resistin, adiponectin and visfatin. Mostly there were serum levels of these adiponectins assessed and the results were sometimes inconsistent. Two studies have been published this year presenting a histological and immunohistochemical evaluation of the fat stored in 2 tissues right in the joints of patients with metabolic syndrome and OA, and the fat on an experimental OA model, concluding that the secretion activity of the potentially pro-inflammatory adipokines through adipocytes may differ in the synovial membrane, infrapatellar fat body and in abdominal fat. It is evident that the components of metabolic syndrome and OA can share a common pathological process which is an “adipose tissue associated inflammation.” The changed secretion profile of pro-inflammatory adipokines is present in obese individuals, an older population and postmenopausal women, the populations at high risk for both metabolic syndrome and OA. Significant mechanical loads may stimulate OA of the knee joints in obese patients, however not of the hands, and further differences between arthrosis of the knee joints and the hands. The adipose tissue induced inflammation is the common pathological mechanism for both metabolic syndrome and OA and it may account for some of the variations.
Key words:
adiponectins – metabolic syndrome – osteoarthritis
Authors:
Karel Pavelka
Authors‘ workplace:
Revmatologický ústav, Praha
Published in:
Vnitř Lék 2017; 63(10): 707-711
Category:
Reviews
Overview
Osteoartróza (OA) je nejčastější kloubní onemocnění, přičemž etiopatogeneze OA není zcela jasně popsána. Jde o heterogenní onemocnění a na jejím vzniku se mohou podílet jak vlivy genetické, tak biomechanické, endokrinní a zánětlivé. Autor se věnuje problematice vzájemných vztahů metabolického syndromu a OA, přičemž uvádí, že prevalence metabolického syndromu je u nemocných s OA vyšší než u nemocných bez OA (59 % vs 23 %). Problémem zůstává, že jednou z hlavních komponent metabolického syndromu je obezita, která je sama o sobě rizikovým faktorem vzniku artrózy u váhonosných kloubů, nikoliv u OA rukou. Po adjustaci na BMI jsou většinou vztahy mezi metabolickým syndromem a OA méně vyjádřeny. V poslední dekádě byla získána evidence o tom, že tuková tkáň je zdrojem řady cytokinů a adipokinů, které mohou vyvolávat zánět synoviální tkáně nízké aktivity, někdy nazývaný jako „meta-inflammation“. Nejvíce dat bylo získáno o leptinu, rezistinu, adiponektinu a visfatinu. Většinou byly hodnoceny sérové hladiny těchto adiponektinů a výsledky byly někdy nekonzistentní. V letošním roce byly publikovány 2 práce, které hodnotily histologicky a imunohistochemicky tuk deponovaný ve 2 tkáních přímo v kloubech u nemocných s metabolickým syndromem a OA a na experimentálním modelu OA, a dospěly k závěru, že sekreční aktivita potenciálně prozánětlivých adipokinů adipocyty může být odlišná v synoviální membráně, infrapatelárním tukovém tělese a abdominálním tuku. Je evidentní, že komponenty metabolického syndromu a OA mohou sdílet společný patologický proces, kterým je s „tukovou tkání asociovaný zánět“. Změněný profil sekrece prozánětlivých adipokinů je přítomen u obézních, starší populace a postmenopauzálních žen, což jsou populace vysoce rizikové jak pro metabolický syndrom, tak pro OA. Výrazná mechanická zátěž může vyvolávat vznik OA kolenních kloubů u obézních nemocných, nikoliv však u OA rukou, a také další rozdíly mezi artrózou kolenních kloubů a rukou. Tukovou tkání indukovaný zánět je společným patologickým mechanizmem u metabolického syndromu i OA a může část z těchto variabilit vysvětlovat.
Klíčová slova:
adiponektiny – metabolický syndrom – osteoartróza
Úvod
Osteoartróza (OA) je nejčastější kloubní onemocnění: studie prokázaly, že celoživotní riziko získat symptomatickou OA kolenních kloubů je 45%, kyčelních kloubů 25% a kloubů rukou 40% (obr. 1) [1]. OA je také významným faktorem zvýšené morbidity a mortality svých nositelů, a to především při lokalizaci na kolenních kloubech [2]. Etiopatogeneze OA není zcela objasněna, protože jde evidentně o komplexní, multifaktoriální proces, při kterém se mohou uplatňovat jak faktory genetické, tak faktory získané, mezi které patří vlivy biomechanické, zánětlivé, endokrinní a metabolické. Již před 30 lety Altman et al popsali OA nikoliv jako jednotnou nemoc, ale jako heterogenní skupinu onemocnění, která vedou ke kloubním příznakům a symptomům [3].
OA jsme byli zvyklí klasifikovat dle různých kritérií: podle lokalizace (gonartróza, koxartróza, rizartróza atd), podle počtu postižených kloubů (monoartróza, polyartróza, generalizovaná osteoartróza), podle RTG obrazu (erozivní, atrofická, hypertrofická), podle stadia (I.–IV. dle Kellgrena-Lawrence), rychlosti progrese (pomalu a rychle progredující), podle intenzity symptomů (kompenzovaná, dekompenzovaná) a samozřejmě na tzv. OA primární či idiopatickou a sekundární OA, pokud bylo známo onemocnění, které mohlo vést ke vzniku OA. Nověji navrhuje Appleton [4] dělit OA podle klinického fenotypu OA následovně:
- posttraumatická OA
- na věku závislá OA (senilní OA)
- vrozená (genetickou OA)
- OA zánětlivá
- ve vztahu, tzv. senzitizaci bolesti
- při metabolickém syndromu [5]
Metabolický syndrom u OA – epidemiologická data
Metabolický syndrom postihuje až 25 % světové populace, a proto jsou vztahy mezi OA a metabolickým syndromem předmětem intenzivního studia.
Metabolický syndrom se skládá ze 4 základních elementů: centrální obezity, dyslipidemie, hypertenze a inzulinové rezistence, a je příčinou zvýšeného kardiovaskulárního rizika [6]. Řada studií prokázala, že prevalence metabolického syndromu je vyšší u nemocných s OA než bez OA (59 % vs 23 %) a že se OA objevuje v mladších věkových skupinách (45–65 let) [7]. V oblasti artrologie je důležitý především výskyt centrální obezity, která má vztah k BMI, což je známý rizikový faktor OA. Obezita může zvyšovat riziko vzniku OA nebo zhoršovat její průběh v zásadě dvojím způsobem. První je faktor mechanický, protože dochází k přetěžování především váhonosných kloubů a ke zvýšenému opotřebování (tzv. wear and tear teorie). Obézní lidé se také méně pohybují, a mají horší stav svalstva. Redukce váhy je průkazně účinná terapeutická intervence především u OA kolenních kloubů [8]. Nicméně zvýšená incidence OA při obezitě u kloubů, které nejsou váhonosné (např. ruce), jasně indikuje, že jsou přítomny ještě další faktory. Lze považovat za prakticky prokázané, že tuková tkáň může produkovat některé působky a vyvolávat systémové zánětlivé prostředí, které v kloubech vyvolává zánět nízké intenzity (low grade intenzity), který ale může vést k destrukci kloubu. Rozklíčit základní otázku, jak důležitý je vliv obezity v oblasti biomechanické nebo metabolické, je však stále nedořešeným problémem.
Řada studií prokázala silný a konzistentní vztah mezi metabolickým syndromem a OA [9], a to především před adjustací výsledků. Po adjustaci na přítomnost obezity (BMI) se tato asociace zeslabila nebo úplně ztratila [10]. Nicméně v některých studiích zůstávala pozitivní asociace mezi určitou komponentou metabolického syndromu a OA, např. hypertenzí [11].
Jedna z novějších prací, která studovala vztahy mezi metabolickým syndromem a OA, byla publikována v letošním roce [12]. Studie je významná v několika aspektech. Za prvé sledovala vztah mezi metabolickým syndromem a jednotlivými jeho komponentami a incidentní radiografickou OA kolenních kloubů. Za druhé šlo o studii, která pacienty sledovala dlouhodobě, zatímco většina podobných studií byla tzv. cross-over. Byli vyhodnoceni pacienti zařazení do tzv. Framinghamské studie, ve které byli sledováni pro výskyt OA v letech 1992–1995 a 2002–2005. Incidentní OA byla definována, pokud nebyla radiografická OA bazálně přítomna a při sledování se vyvinula OA Kellgren-Lawrence 2 a byla klasifikována jako incidentní symptomatická OA. Po vyloučení prevalentní OA byl sledován vztah mezi metabolickým syndromem a vznikem incidentní a symptomatické OA po adjustaci na iniciální BMI. Bylo zařazeno celkem 991 subjektů s průměrným věkem 54 let. Výskyt metabolického syndromu byl 26,7 % u mužů a 22,9 % u žen. Metabolický syndrom a většina jeho komponent byly asociovány s incidentní OA, ale po adjustaci na BMI se staly téměř všechny asociace nevýznamné s výjimkou diastolické hypertenze, a to u mužů i žen.
Možný mechanizmus vzniku metabolické OA
Osteoartróza je principiálně degenerativní kloubní onemocnění s dominantním postižením hyalinní kloubní chrupavky, nicméně zánět je v osteoartrotických kloubech často přítomen. O tom svědčí jednak prosté klinické pozorování kloubního otoku, přítomnost výpotku či histologický nález synovialitidy při operačních zákrocích. Zánět je na rozdíl od revmatoidní artritidy méně intenzivní, nikdy netvoří agresivní panus a při vyšetření výpotku je často označen za nezánětlivý, protože počet leukocytů dosahuje hodnot do 1 000 leukocytů/μl. Za mechanizmus vzniku zánětu je často označováno uvolňování mikroskopických částí extracelulární matrix chrupavky a jejich fagocytóza. Někdy se dává do souvislosti se vznikem zánětu přítomnost krystalů v kloubu. Za posledních 20 let byla získána řada zásadních poznatků, které pohled na OA jako převážně degenerativní onemocnění z opotřebení chrupavky (wear and tear) modifikovaly (tab. 1).

Relativně novou hypotézou je vznik zánětu vlivem zánětlivých působků vznikajících v tukové tkáni. Někteří autoři hovoří a tzv. metabolickém zánětu (meta-inflammation). Nyní se považuje za prokázané, že tuková tkáň je zdrojem četných mediátorů a cytokinů, které vytvářejí systémové prozánětlivé prostředí, které může přímo poškozovat kloubní chrupavku [13]. Bílá tuková tkáň produkuje adipokiny, jako je leptin, rezistin, chemerin, visfatin, adiponektin a další, ale také prozánětlivé cytokiny jako je IL6, IL1 a TNFα [14]. Mnoho autorů zkoumalo vztah mezi hsCRP a strukturálními změnami u OA kyčlí a kolenních kloubů, ale evidence není konzistentní. Vyšší hladiny hsCRP jsou pravděpodobně asociovány více se symptomatickou než radiografickou OA [15]. Genetická variace CRP genu byla také asociována s vyššími hladinami CRP a zvýšeným rizikem závažné osteoartrózy rukou, ale nikoliv kyčlí a kolenních kloubů [16].
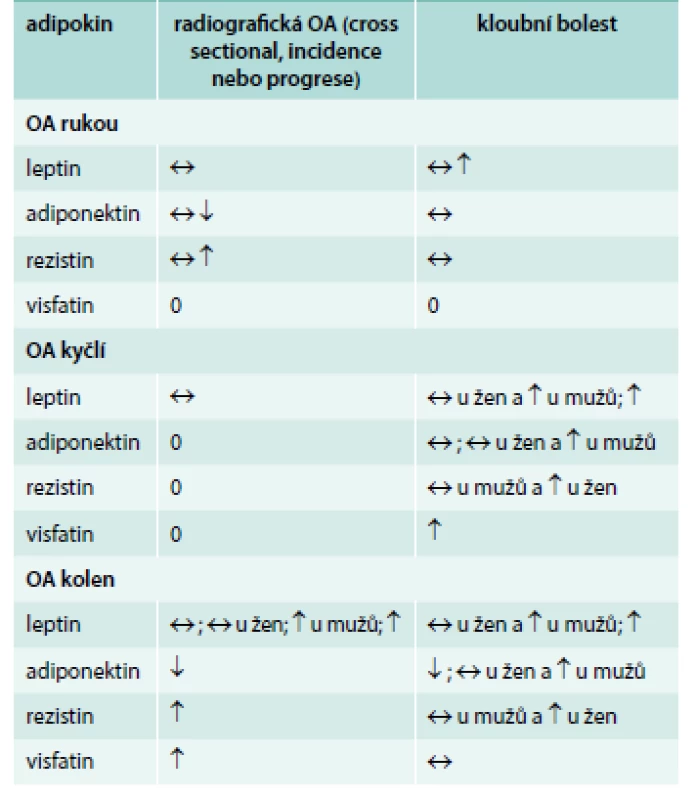
Systémové koncentrace potenciálně prozánětlivých adipokinů byly asociovány s obezitou a ukládáním viscerálního tuku. Vztahy mezi sérovými hladinami adipokinů a RTG a symptomatickou OA byly zkoumány v řadě studií a v přehledné práci je vyhodnotili Kluzek et al (tab. 2) [13]. Nejdůležitějšími adipokiny jsou leptin, adiponektin, rezistin a visfatin. Např. leptin byl asociován s redukovanou šířkou chrupavky, symptomatickou radiografickou OA a dále s projevy OA na zobrazení magnetickou rezonancí (MRI), jako jsou defekty kostní dřeně, osteofyty, synovitida a kloubní výpotek [17]. Bowman et al nedávno prokázali, že téměř polovina asociace mezi BMI a OA kolene může být vysvětlena u starší populace hladinami leptinu [18]. V naší vlastní práci jsme nalezli vyšší hladiny adiponektinu u pacientů se závažnější, tzv. erozivní osteoartrózou rukou než u nemocných s běžnou neerozivní OA [19].
Mechanizmus, jakým adipokiny zvyšují sekreci enzymů degradujících chrupavku, byl zkoumán na řadě zvířecích experimentálních modelů OA. Výsledky těchto studií však musí být interpretovány s opatrností, protože zvířecí OA, ať již navozená traumatem či chemicky, není identická s humánní OA. Bylo např. zjištěno, že adipokiny zvyšují mobilizaci neutrofilů, cytotoxických lymfocytů, aktivaci makrofágů a mechanizmů vrozené imunity. Jeden z klíčových enzymů této skupiny byl na experimentálním modelu OA blokován statiny [20].
Tuková tkáň se vyskytuje v lidském organizmu v různé formě. Rozdíly byly pozorovány mezi abdominální viscerální tukovou tkání a podkožní tukovou tkání. Abdominální tuk je více korelován s obezitou asociovanými komorbiditami, jako je diabetes mellitus, a s metabolickým syndromem, ale také více s prozánětlivými adipokiny se vztahem k destrukci chrupavky než subkutánní tuk [21]. Tento fakt vyžaduje další výzkum, ale opět naznačuje možné společné etiopatogenetické faktory mezi metabolickým syndromem a OA.
Velmi významná práce, která se zabývala regionálními rozdíly v tukové tkáni v kloubním prostředí u nemocných s OA, byla publikována v letošním roce [22]. Důležité je, že používala histologické vzorky humánního původu získané při operační náhradě kolenního kloubu. Předmětem srovnání byly histologické nálezy v synoviální membráně, v níž je bílá tuková tkáň přítomna jednak ve vrstvě intimy pod synoviocyty a jednak v infrapatelárním tukovém tělese. Oba typy tukové tkáně byly různě ovlivněny pacientovým BMI. Na rozdíl štíhlých pacientů byly adipocyty u obézních pacientů v tukovém tělese větší a synoviální membrána těchto pacientů vykazovala vyšší stupeň fibrózy, větší infiltraci makrofágy a vyšší expresi TLR4 genu. Adiponektin a PPARγ byly v synovialis exprimovány v nižších hladinách u obézních než u štíhlých pacientů. Dále byla zjištěna vyšší exprese CD45+ krvetvorných buněk, CD45+, CD14+ celkových makrofágů a CD+, CD206+, M2 typu makrofágů v obou typech tukové tkáně. V závěru této práce vyslovují autoři hypotézu, že v kloubech jsou přítomny 2 rozdílné typy tukové tkáně a vidí v tom podporu pro hypotézu o metabolickém původu OA u pacientů s obezitou třídy II. a III.
Zcela odlišné poznatky však získala Barboza et al ve výtečné experimentální práci [23]. Tým pracoval s etablovaným myším modelem obezity indukované dietou s vysokým obsahem tuků. Histologicky, imunohistochemicky a pomocí specializovaného MRI se zkoumaly vzorky tukové tkáně z infrapatelárního tukového tělesa. Hodnoceny byly exprese prozánětlivých cytokinů, infiltrace makrofágy a M1 polarizace před degenerací chrupavky. Zjistilo se však, že tuková tkáň v infrapatelárním tukovém tělese nevytváří podobný obraz metabolického zánětu u časné OA jako abdominální tuková tkáň. Autoři se domnívají, že intraartikulární adipocyty jsou předmětem odlišné prostorovo-časové regulace, která může být ovlivňována mechanickými tlaky.
Závěr
Stále zůstává otevřená otázka, zda mají jednotlivé komponenty metabolického syndromu při vzniku OA specifický efekt, jak schematicky znázorňuje tab. 3. Nicméně je evidentní, že komponenty metabolického syndromu a symptomatické OA jsou asociovány s vyšším kardiovaskulárním rizikem a sdílejí společný proces „tukovou tkání asociovaný zánět“ [14]. Alterovaný proces sekrece prozánětlivých adipokinů je přítomen u obézních, obecně u seniorů a u postmenopauzálních žen, přičemž tyto populace představují vysoce rizikovou populaci jak pro metabolický syndrom, tak pro OA.

Bylo by asi mírně předčasné uvádět metabolický syndrom jako pátý příznak (komponentu) metabolického syndromu. Nicméně koncept systémového subklinického zánětu indukovaného tukovou tkání (meta-inflammation) jako jednu z příčin OA je zajímavý, je podložen řadou experimentálních nálezů a určitě zasluhuje další výzkum.
Závěrem můžeme s potěšením konstatovat, že problematika adipokinů a osteoartrózy byla a stále je společným vědeckým projektem kliniky jubilanta prof. MUDr. Štěpána Svačiny, DrSc., a Revmatologického ústavu v Praze.
Podpořeno projektem (Ministerstva zdravotnictví) koncepčního rozvoje výzkumné organizace 023728 (Revmatologický ústav).
prof. MUDr. Karel Pavelka, DrSc.
pavelka@revma.cz
Revmatologický ústav,
Praha
www.revma.cz
Doručeno do redakce 10. 8. 2017
Přijato po recenzi 27. 9. 2017
Sources
1. Qin J, Barbour KE, Murphy LB et al. Lifetime risk of symptomatic hand osteoarthritis. Arthritis Rheum 2017; 69(6): 1204–1212. Dostupné z DOI: <http://dx.doi.org/10.1002/art.40097>.
2. Xie F, Kovic B, Xuejing J et al. Economic and humanistic burden of OA: a systematic review of large sample studies. Pharmacoeconomics 2016; 34(11): 1087–1100.
3. Altman R, Asch E, Bloch D et al. Development of criteria for classification and reporting of osteoarthritis: classification of osteoarthritis of the knee. Arthritis Rheum 1986; 29(8): 1039–1049.
4. Appleton CT, Hawker GA, Hill CL et al. Weighing in the Framingham Osteoarthritis study: Measuring biomechanical and metabolic contributions to osteoarthritis. Arthritis Rheumatology 2017; 69(6): 1127–1130. Dostupné z DOI: <http://dx.doi.org/10.1002/art.40089>.
5. Bijlsma H, Berenbaum F, Lefebr FP. Osteoarthritis an update with relevance for clinical practice. Lancet 2011; 377(9783): 2115–2126. Dostupné z DOI: <http://dx.doi.org/10.1016/S0140–6736(11)60243–2>.
6. Svačina Š. Obezitologie a teorie metabolického syndromu. Triton: Praha 2013. ISBN 978–80–7387–678–4.
7. Puenpatom RA, Victor TW. Increased prevalence of metabolic syndrome in individuals with osteoarthritis.an analysis of NHANES III, data. Postgrad Med 2009; 121(6): 9–20. Dostupné z DOI: <http://dx.doi.org/10.3810/pgm.2009.11.2073>.
8. Christensen R, Bartels EM, Astrup A et al. Effect of weight reduction in obese patients with knee OA: a systematic review and meta-analysis. Ann Rheum Dis 2007; 66(4): 433–439.
9. Buchholz AL, Niesen MC, Gausden EB et al. Metabolic activity of osteoarthritis knees correlates with BMI. Knee. 2010; 17(2): 161–166. Dostupné z DOI: <http://dx.doi.org/10.1016/j.knee.2009.07.012>.
10. Visser AW, De Mutsert R, Cessie S et al. The relative contribution of mechanical stress and systemic processes in different types of osteoarthritis NEO study. Ann Rheum Dis 2015; 74(10): 1842–1847. Dostupné z DOI: <http://dx.doi.org/10.1136/annrheumdis-2013–205012>.
11. Monira Hussain S, Wang Y, Cicuttini FM et al. Incidence of total knee and hip replacement for osteoarthritis in relation to the metabolic syndrome and its components: a prospective cohort study. Semin Arthritis Rheum 2014; 43(4): 429–436. Dostupné z DOI: <http://dx.doi.org/.1016/j.semarthrit.2013.07.013>.
12. Niu J, Clancy M, Aliabadi P et al. Metabolic syndrome, its components and knee osteoarthritis. Arthritis Rheum 2017; 69(6): 1194–1203. Dostupné z DOI: <http://dx.doi.org/10.1002/art.40087>.
13. Jin X, Begurie JR, Zhang W et al. Circulating C reactive protein in osteoarthritis: a systematic review and metaanalysis. Ann Rheum Dis 2015; 74(4): 703–710. Dostupné z DOI: <http://dx.doi.org/10.1136/annrheumdis-2013–204494>.
14. Kluzek S, Newton JL, Arden NK. Is osteoarthritis a metabolic disorder? Br Med Bull 2015; 115(1): 111–121. Dostupné z DOI: <http://dx.doi.org/10.1093/bmb/ldv028>.
15. Engtsrom G, Gerhardson de Verdier M, Rollof J et al. C-reactive protein, metabolic syndrome and incidence of severe hip and knee osteoarthritis. A population based cohort study. Osteoarthritis Cartilage 2009; 17(2): 168–173. Dostupné z DOI: <http://dx.doi.org/10.1016/j.joca.2008.07.003>.
16. Bos SD, Suchiman HE, Kloppwenburg M et al. Allelic variation at the C-reactive protein gene associates to both hand osteoarthritis severity and serum high sensitive C reactive protein levels in the GARP study. Ann Rheum Dis 2008; 67(6): 877–879.
17. Yusuf E, Ioan-Fascinay A, Bijsterbosch J et al. Association between leptin, adiponectin and resistin and long term progression of hand OA. Ann Rheum Dis 2011; 70(7): 1282–1284. Dostupné z DOI: <http://dx.doi.org/10.1136/ard.2010.146282>.
18. Fowler-Brown A, Kim DH, Shi I et al. The mediating effect of leptin on the relationship between body weight and knee osteoarthritis in older adults. Arthritis Rheumatol 2015; 67(1): 169–175. Dostupné z DOI: <http://dx.doi.org/10.1002/art.38913>.
19. Filková M, Lišková M, Hulejová H et al. Increased serum adiponectin levels in female patients with erosive compared with non-erosive osteoarthritis. Ann Rheum Dis 2009; 68(2): 295–296. Dostupné z DOI: <http://dx.doi.org/10.1136/ard.2008.095737>.
20. Aktas E, Sener E, Gocun PU. Mechanically induced experimental knee osteoarthritis benefits from anti-inflammatory and immunomodulatory properties of simvastatin via inhibition of matrix metalloproetinase-3. J Orhop Traumatol 2011; 12(3): 145–151. Dostupné z DOI: <http://dx.doi.org/10.1007/s10195–011–0154-y>.
21. Visser AV, Ioan-Fascinay A, de Mutsert R et al. Adiposity and hand osteoarthritis: the study Netherlands epidemiology and obesity study. Arthrit Res Ther 2014; 16(1): R19. Dostupné z DOI: <http://dx.doi.org/10.1186/ar4447>.
22. Harasymowicz NS, Clement ND, Azfer A et al. Regional differences between perisynovial and infrapatellar adipose tissue depots and their response to class III obesity in patients with osteoarthritis. Arthritis Rheumatol 2017; 69(7): 1396–1406. Dostupné z DOI: <http://dx.doi.org/10.1002/art.40102>.
23. Barboza E, Hudson J, Wan-Pin CH et al. Profibrotic infrapatellar fat pad remodelling without M1 macrophage polarization proceeds knee osteoarthritis in mice with diet-induced obesity. Arthritis Rheumatology 2017; 69(6): 1221–1232. Dostupné z DOI: <http://dx.doi.org/10.1002/art.40056>.
24. Courties A, Sellam J, Berenbaum F. Metabolic syndrome-associated osteoarthritis. Curr Opin Rheumatol 2017; 29(2): 214–222. Dostupné z DOI: <http://doi: 10.1097/BOR.0000000000000373>.
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Internal Medicine

2017 Issue 10
-
All articles in this issue
- Adherence k léčbě non-vitamin K perorálními antikoagulancii u nevalvulární fibrilace síní: přehled literatury
- Chirurgická léčba aneuryzmatu aortálního kořene: srovnání Bentallovy operace a reimplantace aortální chlopně podle Davida
- Strategie léčby diabetu 2. typu při selhání léčby metforminem používané českými lékaři nebo v České republice
- Problematika sekundárnej osteoporózy pri deficite rastového hormónu v dospelosti
- Lze zlepšit komplianci pacientů k dlouhodobé terapii statiny?
- COSYREL – účinná fixní kombinace pro léčbu hypertenze, stabilní ICHS a srdečního selhání
- Přínos nových inhibitorů angiogeneze (bevacizumab a aflibercept) pro léčbu mnohočetné angiomatózy: kazuistika
- Endokrinní orbitopatie: aktuální pohled klinického endokrinologa
- Rychlejší aspart (Faster Insulin Aspart) – nový prandiální inzulinový analog
- Adaptační změny po střevní resekci
- Osteoartróza jako součást metabolického syndromu?
- Metabolický syndrom a postavení polypilu v prevenci jeho komplikací
- Diabetes mellitus a poruchy kognice z pohledu diabetologa
- Nové možnosti ovlivnění progrese diabetického onemocnění ledvin
- Pohybová aktivita – svatý grál moderní medicíny?
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue
- COSYREL – účinná fixní kombinace pro léčbu hypertenze, stabilní ICHS a srdečního selhání
- Chirurgická léčba aneuryzmatu aortálního kořene: srovnání Bentallovy operace a reimplantace aortální chlopně podle Davida
- Pohybová aktivita – svatý grál moderní medicíny?
- Endokrinní orbitopatie: aktuální pohled klinického endokrinologa
