Nové trendy v monitorování a léčbě ANCA asociovaných vaskulitid
Novel trends in monitoring and therapy of ANCA associated vasculitides
Vasculitides with positivity of autoantibodies to neutrophil leukocytes cytoplasm (ANCA, AAV) belong to primary vasculitides involving small and less commonly medium size blood vessels. Three different clinical types of AAV can be distinguished: granulomatosis with polyangiitis, eosinophilic granulomatosis with polyangiitis and microscopic polyangiitis. Since these autoantibodies seem to be weak activity biomarkers of AAV new molecules and factors start to come up, e.g. neutrophil extracellular traps NET, several T-lymphocyte subpopulations and different immunoglobulins classes of ANCA. In modern biological therapy rituximab is widely used, for refractory cases intravenous immunoglobulins and antithymocyte globulin are recommended. The data from clinical trials with alemtuzumab are controversial, but avacopan selective inhibitor of C5a receptor and inhibitor of B-lymphocyte activation factor belimumab are promise for future.
Key words:
biologicals – biomarkers – eosinophilic granulomatosis with polyangiitis – granulomatosis with polyangiitis – microscopic polyangiitis
Authors:
Radim Bečvář
Authors‘ workplace:
Revmatologický ústav a Revmatologická klinika 1. LF UK, Praha
Published in:
Vnitř Lék 2018; 64(2): 164-168
Category:
Reviews
Overview
Vaskulitidy s pozitivitou autoprotilátek proti cytoplazmě neutrofilních leukocytů (ANCA, AAV) patří mezi primární vaskulitidy postihující tepny malého méně často středního kalibru. Klinicky lze rozlišovat 3 základní typy AAV: granulomatóza s polyangiitidou, eozinofilní granulomatóza s polyangiitidou a mikroskopická polyangiitida. Tyto autoprotilátky jsou považovány za špatné biomarkery aktivity AAV. Proto se začínají objevovat nové molekuly a faktory, jako jsou extracelulární sítě na neutrofily NET, některé subpopulace T-lymfocytů a některé třídy imunoglobulinů ANCA protilátek. V moderní léčbě se z biologických preparátů nejvíce uplatňuje rituximab, u refrakterních případů pak intravenózní imunoglobuliny a antithymocytární globulin. Výsledky klinických studií (klinických hodnocení) s alemtuzumabem jsou zatím sporné, selektivní inhibitor receptoru pro C5a avacopan a antagonista aktivačního faktoru B-lymfocytů belimumab jsou příslibem do budoucnosti.
Klíčová slova:
biologické léky – biomarkery – eozinofilní granulomatóza s polyangiitidou – granulomatóza s polyangiitidou – mikroskopická polyangiitida
Úvod
Vaskulitidy s pozitivitou autoprotilátek proti cytoplazmě neutrofilních leukocytů (antineutrophil cytoplasmic antibodies – ANCA), neboli ANCA asociované vaskulitidy (AAV) patří mezi primární vaskulitidy postihující tepny malého méně často středního kalibru [1]. Klinicky lze rozlišovat 3 základní typy AAV: granulomatóza s polyangiitidou (dříve Wegenerova granulomatóza – GPA/ granulomatosis with polyangiitis), eozinofilní granulomatóza s polyangiitidou (dříve Churgův-Straussové syndrom – EGPA/ eosinophilic granulomatosis with polyangiitis) a mikroskopická polyangiitida (MPA/microscopic polyangiitis), tab. 1 [2]. ANCA protilátky se také mohou vyskytnout u jiných primárních vaskulitid např. při polyarteritis nodosa.
Granulomatóza s polyangiitidou
GPA je systémové onemocnění charakterizované nekrózami, tvorbou granulomů a vaskulitidou horních a dolních dýchacích cest, nekrotizující glomerulonefritidou se srpky a systémovou vaskulitidou postihující tepny malého a méně často středního kalibru [3].
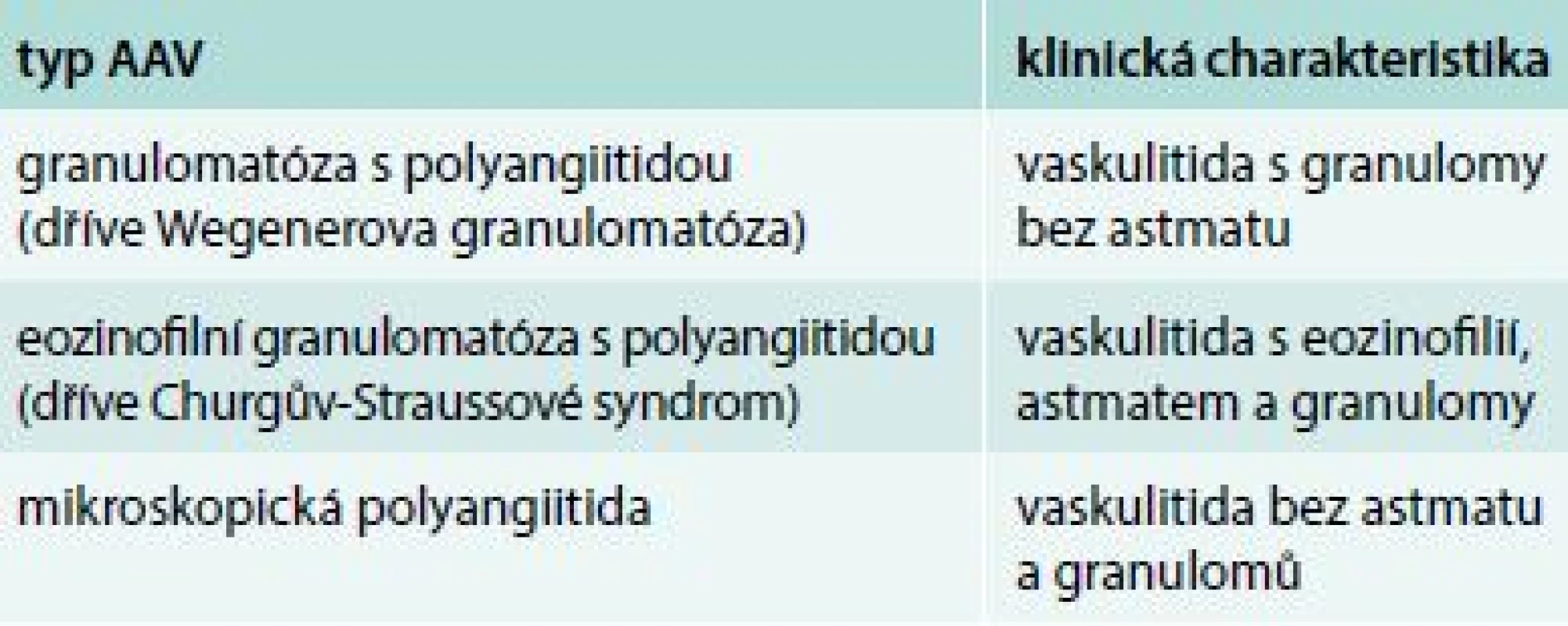
V patogenezi se uplatňuje geneticky podmíněná nebo získaná nerovnováha proteáza/antiproteáza – u GPA se jedná o proteinázu 3 (PR-3). Proti tomuto enzymu se tvoří ANCA protilátky s cytoplazmatickým typem imunofluorescence (cANCA), obr. 1. Z faktorů zevního prostředí může určitou roli hrát hypersenzitivita na blíže neurčený alergen zejména inhalované substance. Z infekčních agens se často jedná o Staphylococcus aureus a Parvovirus B19. Expozice sloučeninám křemíku je obvykle asociována s rychle progredující glomerulonefritidou. Nápadná je souvislost GPA s různými typy malignit [4].
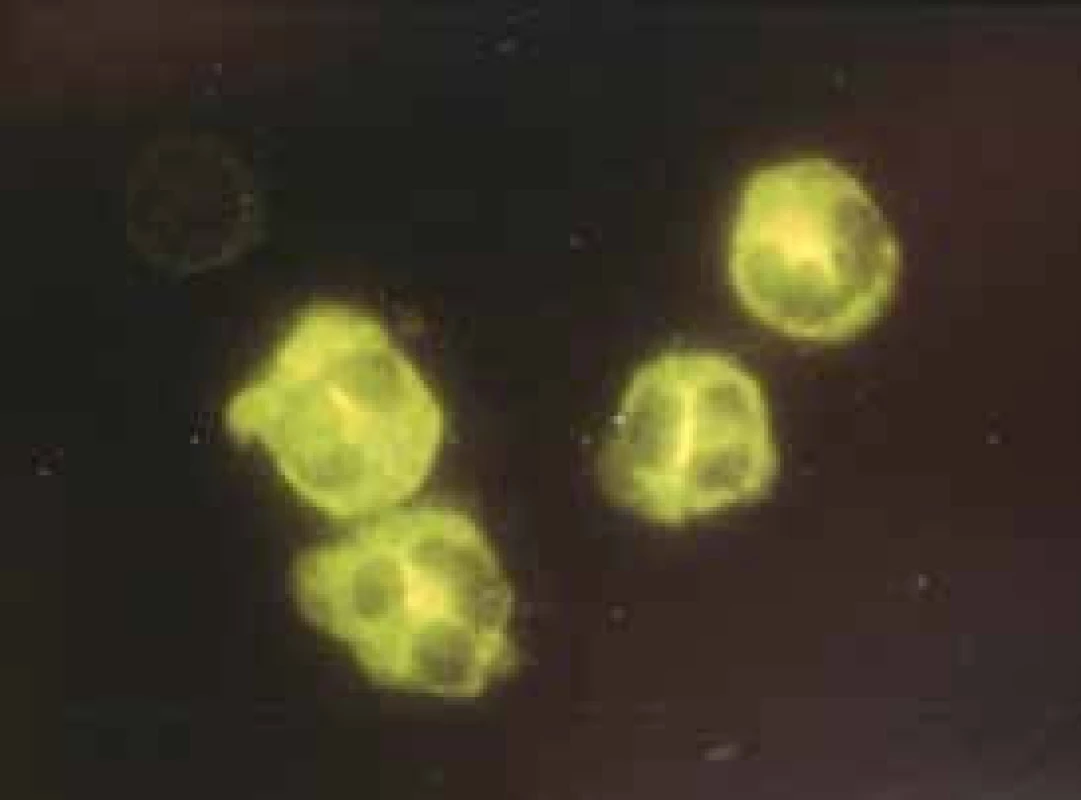
Na začátku nemoci jsou obvyklé nespecifické příznaky – myalgie, artralgie nebo artritida. Postižení horních dýchacích cest nekrotizujícími granulomy se může projevit epistaxí, chronickou rýmou, chronickou sinusitidou až destrukcí nosních chrupavek se vznikem tzv. sedlovitého nosu (obr. 2), či recidivujícími záněty středouší. Příznaky postižení plic jsou často nespecifické: kašel, bolesti na hrudi, někdy pleurálního charakteru. Postižení ledvin se zpočátku projevuje jen mikroskopickou hematurií a malou proteinurií. Tento nález však může během několika týdnů progredovat do selhání ledvin vyžadujícího dialyzační léčbu. U více než 90 % nemocných se vyskytují protilátky ANCA proti PR-3 [3].
Eozinofilní granulomatóza s polyangiitidou
EGPA je nekrotizující vaskulitida s astmatem, periferní eozinofilií, extravaskulárními nekrotizujícími granulomy a s eozinofilními infiltráty ve stěně cév a perivaskulární tkáni [5].
Patogeneze EGPA není známa, nejčastěji se zmiňují genetické determinanty HLA-DRB1*04 *07 a HLA-DRB4. Nepochybná je role cytokinů secernovaných Th2 lymfocyty – prozánětlivých interleukinů (IL) 4, 5 a 13. K vnějším patogenetickým faktorům patří podobně jako u GPA různé alergeny, infekční agens, očkování, léky a křemičitý prach [6].
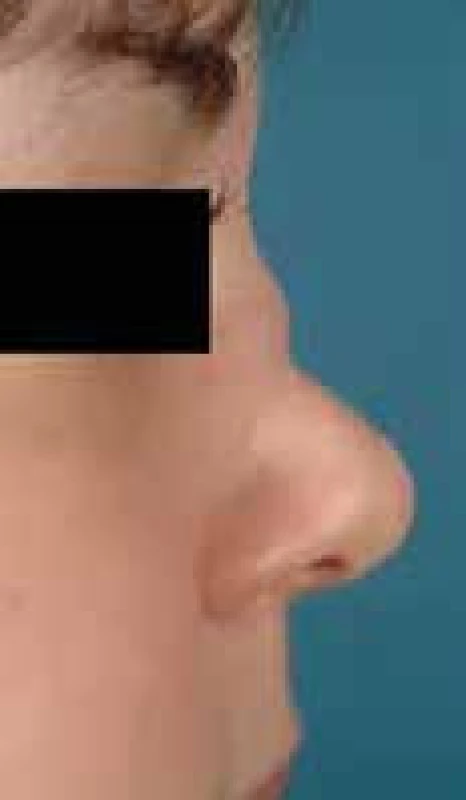
Nemoc se obvykle projeví nejdříve postižením respiračního traktu nejčastěji ve formě asthma bronchiale. U části nemocných bývají v anamnéze pylové nebo potravinové alergie. Na radiogramu hrudníku nalézáme infiltráty prchavého či migrujícího charakteru a pleurální výpotek obsahující značné množství eozinofilů. Dále bývají postiženy: srdce (myokard a endokard), kůže, střevo, svaly a nervová tkáň. Mononeuritidy se popisují až u dvou třetin případů, méně časté je postižení CNS. Postižení ledvin bývá pod obrazem fokálně segmentální glomerulonefritidy. Typickým laboratorním nálezem je přítomnost autoprotilátek ANCA. Zjišťován bývá cytoplazmatický a perinukleární typ imunofluorescence (pANCA), ale protilátky proti myeloperoxidáze (MPO) jsou častější nazývané podle perinukleárního typu imunofluorescence pANCA (obr. 3) [5].
Mikroskopická polyangiitida
MPA je vaskulitida malých cév s fokálně segmentální nekrotizující glomerulonefritidou bez tvorby granulomů v dýchacích cestách [7]. Je k dispozici řada důkazů, že v patogenezi MPA hrají podobně jako u EGPA významnou roli protilátky anti MPO, se méně často prokazují proti elastáze a dalším enzymům. Na počátku nemoci jsou aktivovány prozánětlivé cytokiny, jako jsou interleukin 1 a TNFα a poté se tvoří protilátky ANCA a ukládají se depozita na bazálních membránách glomerulů [8].
V popředí klinického obrazu bývá glomerulonefritida projevující se mikroskopickou hematurií a malou proteinurií. Hypertenze je přítomna asi u 20–30 % nemocných. Postižení plic se manifestuje krvácením do plic, může se vyvinout intersticiální fibróza. Kožní léze zahrnují od makul až po ulcerace na dolních končetinách. Asi jedna třetina nemocných trpí periferní neuropatií nejčastěji mononeuritis multiplex. Asi u 50 % nemocných se objeví bolesti a krvácení z vředů v tenkém a tlustém střevě. Oční projevy zahrnují zánět očních víček, iridocyklitidu, skleritidu a retinální vaskulitidu [7].
Potenciální biomarkery a prediktory ANCA asociovaných vaskulitid
Protilátky ANCA jsou obecně považovány za špatné biomarkery aktivity AAV, ale jsou vhodným prediktory vzplanutí renálních a plicních projevů. Opakovaně bylo zjištěno, že nemocní s pozitivitou protilátek proti PR-3 reagují lépe na rituximab (RTX) než na cyklofosfamid (CFA). Novějším biomarkerem renální vaskulitidy je molekula CD163 solubilní v moči, která by v budoucnu mohla omezit nutnost renální biopsie. Hlubší poznání poruch aktivace neutrofilních leukocytů vedlo k určení nových biomarkerů, jako jsou cirkulující mikročástice a extracelulární sítě na neutrofily (neutrophil extracellular traps – NET). Jedná se o chromatinová filamenta s navázanými enzymy z cytoplazmatických granulí neutrofilů [9]. NET jsou selektivními nositeli antigenů pANCA a zachycené neutrofily se stávají fyziologickým substrátem pro průkaz protilátek ANCA u pacientů s AAV [10]. Naproti tomu polští autoři zkoumali výskyt NET u pacientů s EGPA a zjistili, že jejich sérum může indukovat tvorbu NET bez ohledu na přítomnost protilátek ANCA na rozdíl od jiných vaskulitid. Tvorba NET spolu s počtem eozinofilů může mít u EGPA zásadní význam [11].
Dalším studovaným potenciálním markerem byla molekula CD55 u nemocných AAV s pozitivitou protilátek proti MPO [12]. Autoři zjistili zvýšenou expresi tohoto markeru na neutrofilech, což může být nezávislým ukazatelem v souvislosti s aktivitou onemocnění. Může chránit neutrofily před působením AAV alternativní cestou aktivace komplementu. Aktivované neutrofily uvolňují více MPO a lyzosomu, a tím zesilují zánětlivou reakci. CD55 by se tak mohl stát potenciálním terapeutickým cílem.
V patogeneze GPA se také uplatňují některé subsety T-lymfocytů. Prospektivní studie na velké kohortě nemocných prokázala, že se jedná o lymfocyty Th17 a T regulační buňky jako možné supresory zánětlivého procesu [13]. Tyto dva subsety z periferní krve by mohly sloužit jako buněčné biomarkery aktivity nemoci, zejména k monitorování účinků imunosupresivní terapie.
Dříve již byly zjištěny u nemocných AAV protilátky ANCA třídy IgM, ale jejich výskyt a význam nebyl zcela objasněn. Skupina amerických autorů [14] na 2 skupinách pacientů s GPA a MPA ukázala, že u GPA je přítomnost IgM PR3 přechodná, ale může se znovu objevit a u skupiny s MPA titry tohoto imunoglobulinu souvisely se závažností nemoci. Zvýšené hodnoty se objevovaly při akutní respirační manifestaci AAV a mohou svědčit pro souvislost mezi infekčním podnětem a aktivitou AAV.
Konvenční syntetické chorobu modifikující léky
Několik desetiletí se užívají v léčbě AAV syntetické chorobu modifikující léky s různým mechanizmem účinku (tab. 2) [15]. Nejčastěji se užívají kortikosteroidy (KS), cyklofosfamid (CFA), metotrexát (MTX) [16] a azatioprin (AZA), méně často cyklosporin A a mykofenolát mofetil (MMF) [17]. Indukční léčba AAV pomocí KS a CFA navodí remisi u více než 90 % nemocných, u 60 % dialyzovaných nemocných může být vzhledem k alespoň částečnému návratu renální funkce dialyzační léčba ukončena. AAV mají značný sklon k relapsům (až 50 % nemocných), takže u většiny je nutno podávat dlouhodobě udržovací léčbu – AZA a nízké dávky KS. Sklon k relapsům je výrazně vyšší u pacientů s GPA než u MPA [18].
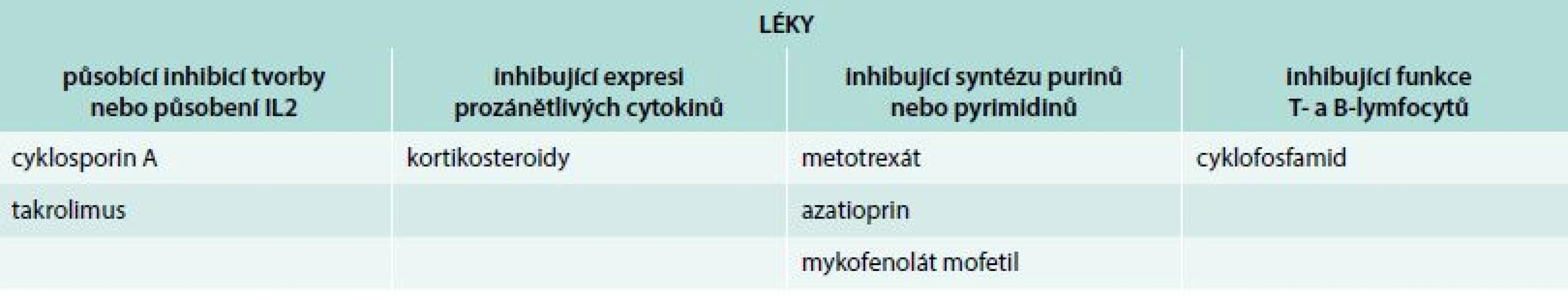
Nové přístupy v léčbě AAV – biologická léčba
V posledních letech se stále častěji podávají v léčbě AAV biologické preparáty. Některé jsou známé z léčby častých zánětlivých revmatických onemocnění, hematologických, gastroenterologických a kožních chorob. Ovlivňují imunopatologické děje na různé úrovni a některé jsou ve fázi klinického zkoušení (tab. 3).
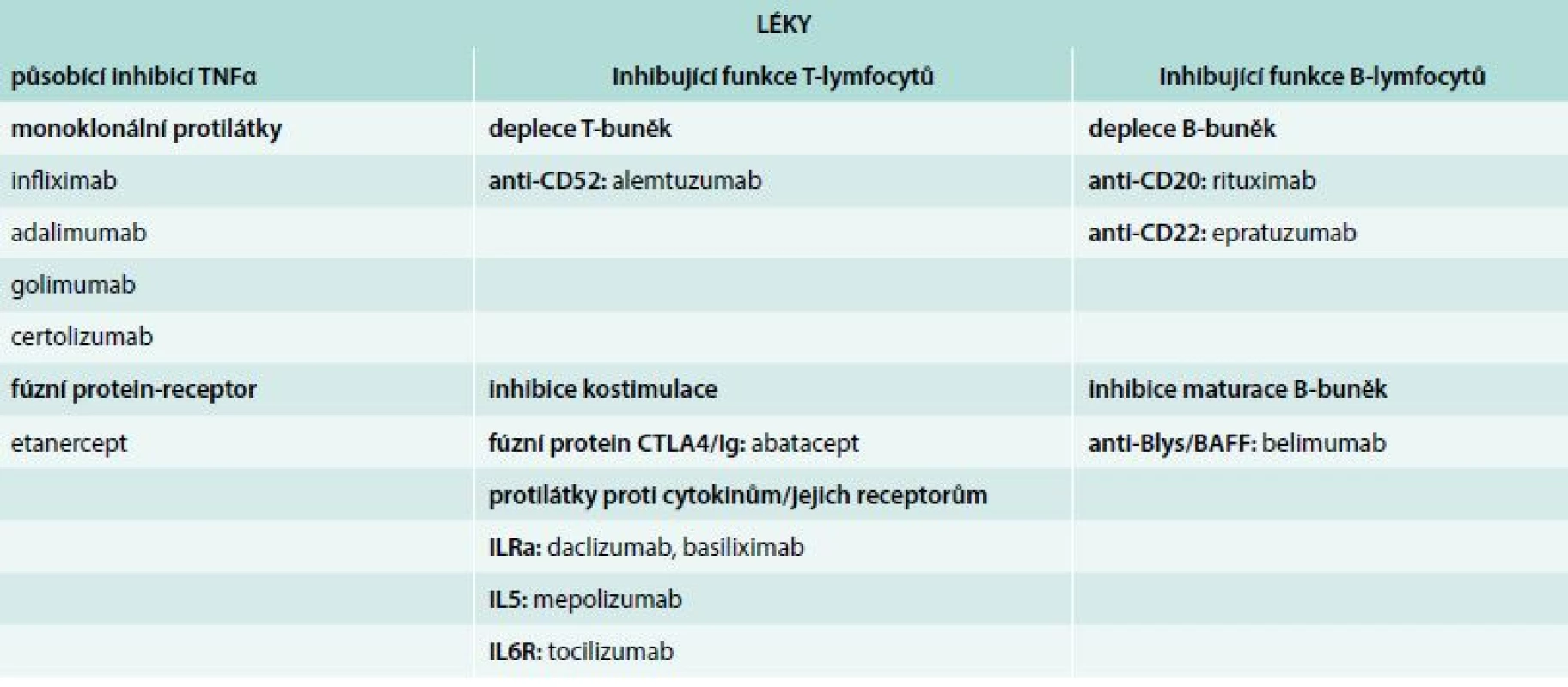
Kromě dlouhodobě užívaných biologických léků se u refrakterních nemocných používají intravenózní imunoglobuliny, se kterými proběhla malá otevřená klinická studie (klinické hodnocení) a antithymocytární globulin, který byl aplikován velmi závažným případům, ale měl mnoho relapsů a infekčních komplikací [19]. Blokátory faktoru nekrózy tumorů α (TNFα) se vesměs neosvědčily. Infliximab nebyl účinnější než CFA a KH s etanerceptem WGET u nemocných s GPA bylo předčasně ukončeno pro zvýšený výskyt malignit [20].
Rituximab
Jednoznačně nejnadějněji se jeví rituximab (RTX), monoklonální protilátka, která vyvolává selektivní depleci subpopulace B-lymfocytů CD20. Nyní jsou k dispozici výsledky retrospektivních i randomizovaných klinických studií/klinických hodnocení (RITUXVAS – Rituximab Versus Cyclophosphamide in ANCA-Associated Vasculitis, RAVE – Rituximab in ANCA-Associated Vasculitis) v indukční léčbě. Velmi dobré zkušenosti byly dosaženy i v udržovací terapii, jak dokládají výsledky studie MAINRITSAN (Rituximab Versus Azathioprine for Maintenance in ANCA-Associated Vasculitis). Tím získal RTX standardních postavení v terapii AAV a byl schválen americkou FDA (Food and Drug Administration) v této indikaci. Ve studii RITUXVAS byl porovnán účinek podávání RTX s intravenózním CFA s následným podáním AZA u nemocných s nově zjištěnou renální AAV. Mezi pacienty léčenými RTX a klasickými syntetickými imunosupresivy nebyl rozdíl v navození remise ani ve výskytu vedlejších nežádoucích účinků [21]. Ve studii RAVE byl sledován účinek RTX ve srovnání s podáváním perorálního CFA u pacientů s generalizovanou AAV. Terapie byla v obou větvích stejně účinná v navození remise, ale leukopenie byla častější po CFA. U relabující AAV byla léčba RTX účinnější [22]. Udržovací terapie AAV pomocí RTX byla cílem studie MAINRITSAN. Byli do ní zařazeni nemocní s GPA a MPA po navození remise léčbou CFA a účinek RTX byl srovnáván s AZA. Po dobu 28 měsíců došlo k relapsu ve skupině s RTX u 5,2 % nemocných, kdežto s AZA 25,4 %. Nežádoucí účinky byly velmi mírné a přechodného charakteru [23].
Alemtuzumab
Monoklonální protilátka alemtuzumab, která vyvolává depleci T-lymfocytů CD22, byla podávána refrakterním nemocným s AAV. Léčba alemtuzumabem měla na počátku velmi dobrou účinnost, ale po 6 měsících se objevovaly však časté relapsy a jako komplikace oportunní infekce [24].
Avacopan
Avacopan (CCX168), selektivní inhibitor receptoru pro C5a, je novým preparátem zkoušeným v terapii AAV. Dvojitě zaslepené placebem kontrolované klinické studie ukázaly, že může účinně nahradit kortikosteroidy podávané ve vysokých dávkách [25].
Belimumab
Belimumab, monoklonální protilátka blokující aktivační faktor B-lymfocytů, je dalším kandidátem budoucí léčby AAV. V současnosti probíhá vyhodnocení výsledků klinické studie fáze II a III [26].
Závěr
Jelikož protilátky ANCA jsou považovány za špatné biomarkery aktivity AAV, začínají se objevovat nové molekuly, jako jsou extracelulární sítě pro neutrofilní leukocyty, některé subpopulace T-lymfocytů a některé třídy imunoglobulinů ANCA protilátek.
V moderní léčbě se z biologických preparátů nejvíce uplatňuje RTX, u refrakterních případů pak intravenózní imunoglobuliny a antithymocytární globulin. Výsledky klinických studií s alemtuzumabem jsou zatím sporné, kdežto avacopan a belimumab mohou být příslibem do budoucna.
Doručeno do redakce 22. 9. 2017
Přijato po recenzi 19. 11. 2017
doc. MUDr. Radim Bečvář, CSc.
Revmatologický ústav a Revmatologická klinika 1. LF UK, Praha
Sources
1. Bečvář R, Tesař V, Rychlík I. Vaskulitidy v klinické praxi – diagnostika a terapie. Medprint: Praha 1994 : 90–102.
2. Ansell BM (ed), Bacon PA, Lie JT et al. The vasculitides. Science and practice. Springer 1996, 267–269. ISBN-10 : 0412641402. ISBN-13 : 978–0412641404.
3. Hoffman GS, Kerr GS, Leavitt RY et al. Wegener granulomatosis: an analysis of 158 patients. Ann Intern Med 1992; 116(6): 488–498.
4. Cockwell P, Savage CO. Wegener’s granulomatosis. Pathogenesis. In: Hoffman GS, Weyand CM (eds). Inflammatory diseases of blood vessels. Marcel Dekker: New York 2002 : 365–380. ISBN 978–0824702694.
5. Bečvář R. Eozinofilní granulomatóza s polyangiitidou. In: Pavelka K et al (ed) Revmatologie. Maxdorf: Praha 2012 : 408–410. ISBN 978–80–7345–295–7.
6. Specks U. Churg-Strauss syndrome. In: Ball GV, Louis Bridges S Jret al (eds) Vasculitis. 2nd ed. New York: Oxford University Press 2008 : 429–438. ISBN 978–0198570196.
7. Bečvář R. Mikroskopická polyangiitida. In: Pavelka K et al. Revmatologie. 2nd ed. Galén: Praha 2010 : 67–68. ISBN 978–80–7262–688–5.
8. Heeringa P, Jennette JC et al. Microscopic polyangiitis: Pathogenesis. In: Hoffman GS, Weyand CM (eds). Inflammatory diseases of blood vessels. Marcel Dekker: New York 2002 : 339–354. ISBN 978–0824702694.
9. Brogan P, Eleftheriou D. Vasculitis update: pathogenesis and biomarkers. Pediatr Nephrol 2018; 33(2): 187–198. Dostupné z DOI: <http://dx.doi.org/10.1007/s00467–017–3597–4>.
10. Panda R, Krieger T, Hopf L al. Neutrophil extracellular traps contain selected antigens of anti-neutrophil cytoplasmic antibodies. Front Immunol 2017; 8 : 439. Dostupné z DOI: <http://dx.doi.org/10.3389/fimmu.2017.00439>.
11. Natorska J, Ząbczyk M, Siudut J et al. Neutrophil extracellular traps formation in patients with eosinophilic granulomatosis with polyangiitis: association with eosinophilic inflammation. Clin Exp Rheumatol 2017; 35(1 Suppl 103): S27-S32.
12. Zhou XL, Zheng MJ, Shuai ZW et al. The significances of peripheral neutrophils CD(55) and myeloperoxidase expression in patients with myeloperoxidase-specific anti-neutrophil cytoplasmic antibody associated vasculitis. Zhonghua Nei Ke Za Zhi 2017; 56(6): 427–432. Dostupné z DOI: <http://dx.doi.org/10.3760/cma.j.issn.0578–1426.2017.06.008>.
13. Szczeklik W, Jakieła B, Wawrzycka-Adamczyk K. Skewing toward Treg and Th2 responses is a characteristic feature of sustained remission in ANCA-positive granulomatosis with polyangiitis. Eur J Immunol 2017; 47(4): 724–733. Dostupné z DOI: <http://dx.doi.org/10.1002/eji.201646810>.
14. Clain JM, Hummel AM, Stone JH et al. Immunoglobulin (Ig)M antibodies to proteinase 3 in granulomatosis with polyangiitis and microscopic polyangiitis. Clin Exp Immunol 2017; 188(1): 174–181. Dostupné z DOI: <http://dx.doi.org/10.1111/cei.12925>.
15. Bečvář R. Moderní terapie ANCA pozitivních vaskulitid. Acta medicinae 2013; 2(5): 76–79.
16. Faurschou M, Westman K, Rasmussen N et al. [European Vasculitis Study Group]. Brief report: Long-term outcome of a randomized clinical trial comparing methotrexate to cyclophosphamide for remission induction in early systemic antineutrophil cytoplasmic antibody-associated vasculitis. Arthritis Rheum 2012; 64(10): 3472–3477. Dostupné z DOI: <http://dx.doi.org/10.1002/art.34547>.
17. Hu W, Liu C, Xie H et al. Mycophenolate mofetil versus cyclophosphamide for inducing remission of ANCA vasculitis with moderate renal involvement. Nephrol Dial Transplant 2008; 23(4): 1307–1312. Dostupné z DOI: <http://dx.doi.org/10.1093/ndt/gfm780>.
18. Pepper RJ, Chanouzas D, Tarzi, R et al. [European Vasculitis Study (EUVAS) investigators] Intravenous cyclophosphamide and plasmapheresis in dialysis-dependent ANCA-associated vasculitis. Clin J Am Soc Nephrol 2013; 8(2): 219–224. Dostupné z DOI: <http://dx.doi.org/10.2215/CJN.03680412>. Erratum in Clin J Am Soc Nephrol 2013; 8(4): 701. Caisian A.
19. Smith RM, Jones RB, Jayne DR. Progress in treatment of ANCA-associated vasculitis. Arthritis Res Ther 2012; 4(2): 210. Dostupné z DOI: <http://dx.doi.org/10.1186/ar3797>.
20. Stone J, Uhlfelder M, Hellmann D et al. Etanercept with conventional treatment in Wegener’s granulomatosis: A six month open-label trial to evaluate safety. Arthritis Rheum 2001; 44(5): 1149–1154. Dostupné z DOI: <http://dx.doi.org/10.1002/1529–0131(200105)44 : 5<1149::AID-ANR197>3.0.CO;2-F>.
21. Jones RB, Tervaert JW, Hauser T et al. [European Vasculitis Study Group[. Rituximab versus cyclophosphamide in ANCA-associated renal vasculitis. N Eng J Med 2010; 363(3): 211–220. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMoa0909169>.
22. Stone JH, Merkel PA, Spiera R et al. Rituximab versus cyclophosphamide forANCA-associated vasculitis. N Eng J Med 2010; 363(3): 221–232. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMoa0909905>.
23. Luqmani R. Maintenance of remission in ANCA-associate vasculitis. Nat Rev Rheumatol 2013; 9(2): 127–132. Dostupné z DOI: <http://dx.doi.org/10.1038/nrrheum.2012.188>.
24. Walsh M, Chaudhry A, Jayne D. Long-term follow-up of relapsing/refractory anti-neutrophil cytoplasm antibody associated vasculitis treated with the lymphocyte depleting antibody alemtuzumab (CAMPATH-1H). Ann Rheum Dis 2008; 67(9): 1322–1327. Dostupné z DOI: <http://dx.doi.org/10.1136/ard.2007.081661>.
25. Jayne RWD, Bruchfeld AN, Harper L et al. [CLEAR Study Group]. Randomized trial of C5a receptor inhibitor Avacopan in ANCA-associated vasculitis. J Am Soc Nephrol 28(9): 2756–2767. Dostupné z DOI: <https://doi.org/10.1681/ASN.2016111179>.
26. Lenert A, Lenert P. Current and emerging treatment options for ANCA-associated vasculitis: potential role of belimumab and other BAFF/APRIL targeting agents. Drug Des Devel Ther 2015; 9 : 333–347. Dostupné z DOI: <http://dx.doi.org/10.2147/DDDT.S67264>.
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Internal Medicine

2018 Issue 2
-
All articles in this issue
- Revmatoidní artritida
- Axiální spondylartritida
- Využitie MRI vyšetrenia pri diagnostike axiálnej spondylartritídy
- Biologická léčba psoriatické artritidy
- Život ohrožující projevy systémového lupusu a antifosfolipidového syndromu ve vnitřním lékařství
- Systémová sklerodermie v roce 2017
- Idiopatické zánětlivé myopatie
- Nové trendy v monitorování a léčbě ANCA asociovaných vaskulitid
- Difuzní alveolární hemoragie – akutní, život ohrožující stav v revmatologii
- Polymyalgia rheumatica
- Léčba k cíli u dnavé artritidy
- Nutraceutika v terapii gonartrózy: pohled ortopeda
- Osteoporóza a kvalita kostní hmoty
- Léčba chronické bolesti u zánětlivých revmatických onemocnění
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue
- Axiální spondylartritida
- Využitie MRI vyšetrenia pri diagnostike axiálnej spondylartritídy
- Idiopatické zánětlivé myopatie
- Difuzní alveolární hemoragie – akutní, život ohrožující stav v revmatologii
