Vyšetřování vrozených trombofilních stavů: kdy, koho, na co, anebo vůbec?
Investigation of congenital thrombophilic conditions: when, in whom, focusing on what or not at all?
Venous thromboembolism is a multifactorial disease. Inherited thrombophilia is linked with increased risk of VTE and we know about them more than 50 years. Through a robust thrombophilia work-up in the end of millenium, the criteria for testing have significantly gone down. It is associated with increased amount of information about clinical consequence of testing. We discuss current recommendations not only in the literature, but also in our clinic.
Key words:
criteria for testing – thrombophilia – venous thromboembolism
Authors:
Petr Dulíček
; Eva Ivanová; Zuzana Fiedlerová
Authors‘ workplace:
IV. interní hematologická klinika LF UK a FN Hradec Králové
Published in:
Vnitř Lék 2018; 64(5): 559-563
Category:
Overview
Venózní tromboembolizmus je multifaktoriální onemocnění. Jednou z příčin mohou být i vrozené trombofilní stavy, o kterých víme více než 50 let. Přes robustní vyšetřování na přelomu milénia se indikační kritéria významně zredukovala. To souvisí se stoupajícím množstvím informací o odpovědi na zásadní otázku, zda-li má testování klinické konsekvence, čili dojde-li ke změně v managementu péče o pacienta. V článku přinášíme současná moderní doporučení nejen ve světě, ale i na našem pracovišti.
Klíčová slova:
indikace k vyšetření – trombofilní stavy – venózní tromboembolizmus
Úvod
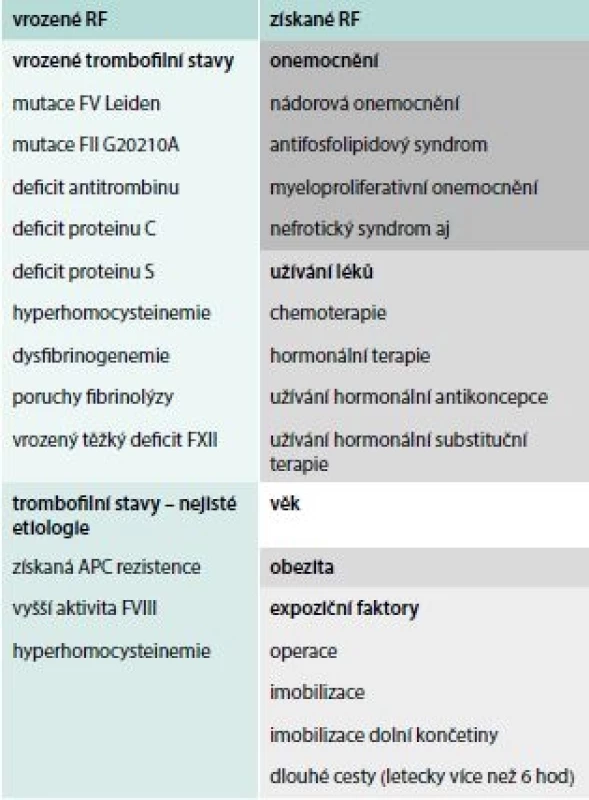
Venózní tromboembolizmus (VTE) představuje významný zdravotnický a sociálně ekonomický problém. Incidence VTE v populaci se udává 1/1 000, ale závisí na věku [1]. VTE je onemocnění multifaktoriální. Rizikové faktory pro vznik VTE můžeme rozdělit na vrozené a získané, tak jak je ukázáno v tab. 1 (uvedeny jen ty nejdůležitější). Riziko VTE lze vyčíslit jako relativní riziko (RR) nebo absolutní riziko (AR). To nás zajímá daleko více, protože vypovídá o skutečném riziku VTE za rok na jasně definovaný počet jedinců.
![Relativní riziko první epizody VTE
u některých vrozených trombofilií. Upraveno
podle [12–15]](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image_pdf/b47c2782644294d9b26bf082b6147fe2.jpeg)
![Relativní riziko rekurence žilního
tromboembolizmu po první atace VTE.
Upraveno podle [16–18]](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image_pdf/b4cc7c35605fc1eab07ce7d04bec898b.jpeg)
Některé rizikové faktory mají příčinu jak vrozenou, tak získanou, ev. neznámou. Sem lze zařadit např. hyperhomocysteinemii, vysokou aktivitu faktoru VIII (FVIII), přítomnost rezistence na aktivovaný protein C (APC-R) bez mutace FV Leiden.
Vrozené trombofilní stavy
Definice
Jak lze trombofilní stav tedy definovat? Přestože dosud neexistuje jediná mezinárodně uznávaná definice, trombofilii lze definovat jako stav, který má tendenci ke vzniku VTE a který může být geneticky podmíněn, může být získaný, či obojí. Na této definici se shodla skupina expertů WHO. Stanovení definice trombofilního stavu je významné pro stanovení indikačních kritérií pro vyšetření. To má jak medicínský, tak ekonomický význam.
Z historie
Z historického pohledu je zajímavé, že o vrozené pohotovosti ke krvácení se ví velmi dlouhou dobu, ale o vrozeném sklonu k VTE se dlouho nevědělo. První popis se objevil v roce 1965, kdy Egeberg [2] popsal kongenitální deficit antitrombinu III (AT). Tento zájem je dále akcelerován v 80. letech 20. století, Griffin et al [3] popsali kongenitální deficit proteinu C a Schwarz [4] s Compem [5] deficit proteinu S. Zásadním zlomem v zájmu o trombofilní stavy byl v roce 1993 Dahlbäckův objev rezistence na aktivovaný protein C (APC-R) [6]. V roce 1994 Bertina z Leidenu zjistil, že za tuto rezistenci na aktivovaný protein C je zodpovědná mutace FV, označovaná dle místa objevu jako mutace Leidenská [7]. Poslední popsanou mutací, která predisponuje jedince k VTE, je mutace protrombinová – FII 20210a, popsaná v roce 1996 Poortem [8]. Ostatní vrozené trombofilní stavy jsou vzácnější.
Právě objevení těchto mutací spustilo vlnu poměrně robustního vyšetřování trombofilních stavů v 2. polovině 90. let minulého století. Vzhledem k vysoké prevalenci se poměrně brzy poznal jejich skutečný klinický význam, a to vedlo k redukci vyšetřování.
Doporučení pro testování trombofilních stavů
Jak je vidět, doporučení pro testování prodělalo a prodělává vývoj. Zvažuje se následující:
- koho vyšetřit:
- zdali preventivně před rizikovou situací, např. před náhradou kyčelního kloubu (TEP), před nasazením kombinované hormonální antikoncepce, před graviditou aj
- po prodělané VTE: vzhledem k věku, k okolnostem vzniku, k místu postižení
- asymptomatické jedince s pozitivní rodinnou anamnézou VTE či již průkazem vrozeného trombofilního stavu
- kdy vyšetřit:
- ihned před zahájením léčby
- během léčby
- po skončení léčby
- co vyšetřit
Z hlediska metodiky vyšetření, prevalence trombofilie, tíže trombofilie a nákladů na vyšetření se jednotlivé trombofilní stavy se navzájem liší:
- z hlediska klinické významnosti:
- frekvencí výskytu v populaci – četné: mutace FV Leiden a mutace FII 20210a nebo méně četné: deficity přirozených inhibitorů koagulace: AT, proteinu C a S
- svojí trombofilností, tedy mírou pohotovosti k rozvoji VTE a mírou rizika rekurence VTE; pro délku antikoagulační terapie je důležitá znalost rizika rekurence VTE
- z hlediska etiopatogeneze
- mutace FV Leiden a FII20210a jsou způsobeny bodovou mutací v genu a vedou k tzv. „získání funkce“
- u inhibitorů serinových proteáz naopak dochází ke „ztrátě funkce“; jsou způsobeny desítkami různých genetických mutací
Dále se o jednotlivých trombofilních stavech zmíníme jen krátce, protož o nich bylo již mnoho popsáno i v našem písemnictví [9–11].
Jak již bylo uvedeno, doporučení o vyšetření podléhají vývoji. V 2. polovině 90. let minulého století a počátkem tohoto milénia jsme postupovali dle následujícího, tehdy doporučovaného postupu. Na trombofilní stav v plném rozsahu (mutace FV Leiden, mutace FII20210a, AT, PC, PS, antifosfolipidový syndrom) byli vyšetřeni všichni jedinci splňující následující kritéria:
- VTE pod 50 let věku (jak spontánní VTE, tak VTE v rizikové situaci)
- jedinci s rekurentními VTE příhodami
- jedinci s VTE v neobvyklé lokalizaci: v portální, slezinné, renální, dolní duté žíle apod
- jedinci s rekurentními záněty povrchových žil bez přítomnosti varixů
- jedinci s pozitivní rodinnou anamnézou výskytu VTE před 50. rokem věku – v každém případě se jednalo o objektivně prokázanou trombotickou příhodu (zobrazovací metodou)
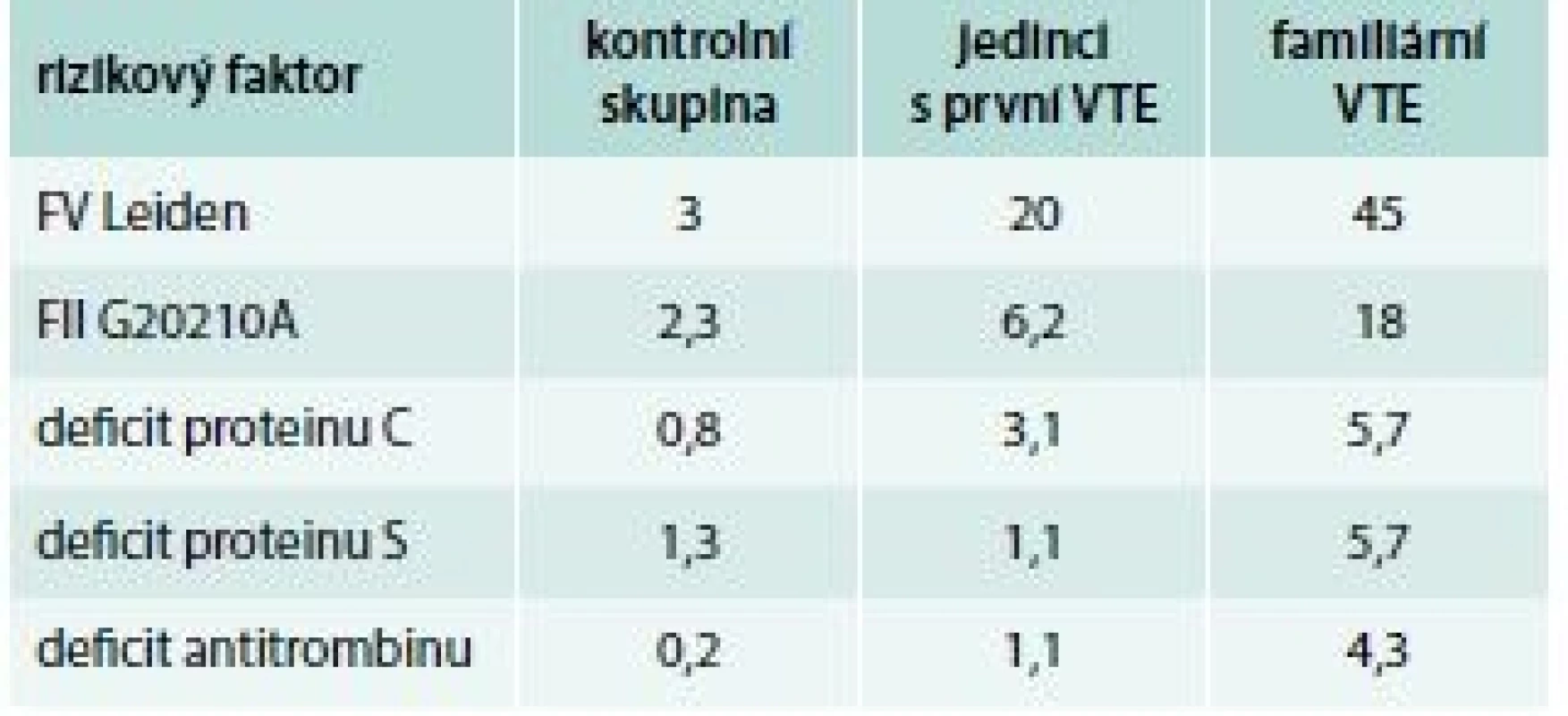
Když jsme zhodnotili výsledky při tomto přístupu (bez posledního bodu), došli jsme k následujícím závěrům [19]. Ve skupině 325 jedinců s trombózou (125 mužů, 200 žen) průměrného věku 42 let v době vyšetření a průměrným věkem první VTE 33,5 let jsme došli k výsledkům, které jsou uvedeny v tab. 5.
Kombinovaný trombofilní stav se objevuje v 8,9 %, zejména FV Leiden + FII 20210a a FV Leiden + APS. Recidivující příhodu mělo 29,5 % jedinců.
Samozřejmě na samostatný článek by byla diskuse a úvaha o klinickém přínosu těchto výsledků a ekonomické zátěži.
Současná doporučení
Dnešní doporučení jsou velmi variabilní, od úplného ústupu, nicméně ale převládá snaha o vytipování jedinců, u kterých má testování klinický význam při ještě akceptovatelných nákladech. To ale není vůbec jednoduché, protože nelze očekávat žádné multicentrické studie, navíc také zvyky a náklady se v jednotlivých zemích značně liší.
Před vlastním testováním je nutno zvážit a vědět následující:
- jak výsledky změní strategii antikoagulační terapie
- vliv terapie a komorbidit na výsledky vyšetření
- vliv na pokrevní příbuzné
- přání jedince („ujištění o příčině VTE“ nebo naopak „strach“ z pozitivního výsledku)
- nejsou žádné indikace k preventivnímu vyšetřování vrozené trombofilie
- nutno vyšetřovat jen mutace, které mají jasně prokázaný vztah k VTE (ne např. mutaci MTHFR C677T aj [20,21]
V každém případě je nutno poučit:
- o výsledku vyšetření trombofilních stavů, vysvětlení příznaků žilního tromboembolizmu
- nosičky trombofilních stavů musí být informovány o riziku trombózy ve spojení s hormonální antikoncepcí (zejména kombinovanou), graviditou a substituční léčbou estrogeny [22]
Při hodnocení výsledků je nutná znalost následujících faktů
- termín odběru vzorků v časovém vztahu k výskytu VTE
- současná medikace (včetně ev. přetrvávání vlivu hormonální antikoncepce)
- metodika vyšetření
V případě funkčních vyšetření musíme počítat s tím, že k definitivnímu stanovení diagnózy vrozeného trombofilního stavu bude nutno vyšetření zopakovat.
Redukce indikace k vyšetření je patrná již počátkem nového století [23] a zejména v práci Baglina z roku 2010 [24].
V současnosti lze najít mnoho doporučení [25–29] se závěrem o klesajícím významu vyšetření, nicméně se snahou vytipovat ty, kteří z toho budou mít využití. Na našem pracovišti se snažíme vyšetření také redukovat a zejména individualizovat, takže naše současná doporučení jsou následující:
- VTE < 45. rokem věku – spontánně, v rizikové situaci – NE
- recidivující VTE (1. VTE do 45–50 let věku) – individuálně
- familiární výskyt VTE s výskytem první příhody do 45 let věku – individuálně dle VTE
- žilní trombóza v neobvyklé lokalizaci (portální žíla, jaterní, CNS aj) – individuálně, včetně vyšetření JAK-2-kinázy a vyloučení PNH (paroxyzmální noční hemoglobinurie)
- recidivující povrchové flebitidy (> 5 příhod) – systém proteinu C, PS, PC, APC-R
- recidivují aborty: tři v I. trimestru APS, dva ve II. trimestru, porod mrtvého plodu (individuálně)
Z úplně recentních doporučení jsou zajímavá doporučení z Mayo Clinic [30] a publikace Connorse (schéma) [31]. Dle Pruthiho [30] platí následující:
- vyšetření trombofilního stavu není indikováno u:
- záchytu v populaci
- VTE v rizikové situaci
- pacienta na antikoagulační terapii v terapeutické dávce
- pacienta s arteriální trombózou
- pacienta, u kterého je plánována dlouhodobá antikoagulační terapie
- k upřesnění profylaxe ve vysoce rizikové situaci
- trombofilní testování je rozumné a vhodné u:
- u jedinců s VTE < 50 let věku
- VTE u prvních pokrevních příbuzných
- rekurentní VTE
![Schéma. Doporučení dle Mayo Clinic. Upraveno podle [30]](https://pl-master.mdcdn.cz/media/image_pdf/0574babbf62bb7f82420077b6933afbb.jpeg?version=1536237358)
U koho hledat přítomnost vrozené trombofilie:
- trombóza do 50. roku věku, zejména v přítomnosti slabého rizikového faktoru (menší chirurgický výkon, hormonální antikoncepce, imobilizace) nebo u idiopatické VTE
- silně pozitivní rodinná anamnéza VTE (první pokrevní příbuzní s VTE v mladším věku – do 50. roku věku)
- rekurentní VTE příhody, zvláště v mladém věku
Při pečlivém prostudování je vidět, že doporučení se v určitých situacích neshodují, někdy jsou dokonce protichůdná.
K čemu vlastně je testování vzhledem k léčbě:
- léčba akutní VTE: NE
- sekundární prevence po prodělané VTE – délka trvání OAT?
- primární prevence příbuzných?
Záleží značně na osobním hodnocení a úhlu pohledu.
Pro testování svědčí:
- deficit AT – substituce v akutní fázi
- APS, mutace v homozygotní formě
- deficit PC, PS, AT
- zajištění rizikových situací pro příbuzné (profylaxe v šestinedělí)
- „lepší“ ohodnocení trombofilnosti
Proti testování svědčí:
- ne (DOACS)
- není cost benefitní
- - vychází se z RA
- stres a obavy pro klienta
- poskytnutí DNA
Jaké jsou nejčastější omyly u nás v České republice?
- vyšetření z preventivních důvodů (před nasazením hormonální antikoncepce aj)
- neselektivní vyšetřování
- vyšetřování mutací (např. MTHFR C677T aj), které prokazatelně nejsou trombofilní
- špatná interpretace výsledků (přeceňování významu průkazu trombofilního znaku, či uklidnění při jejich negativitě)
Shrnutí
V současnosti nelze dát jednoznačné doporučení kdo, kdy a na co by měl být testován. Také v jednotlivých zemích a odborných společnostech se doporučení liší. Záleží též na ceně vyšetření, která je v jednotlivých částech světa dost rozdílná. Testování se dnes doporučuje spíše individuálně, dle klinické situace se vybírají patřičné testy. Na prvním místě musí být vždy otázku přínosu pro nemocného, není potřeba za každou cenu získat výsledek mutace, která je velmi frekventní v populaci a s relativním rizikem VTE. To nemá vůbec žádný smysl. Na čem se doporučení shodují, je netestovat pacienty s VTE v rizikové situaci (až na výjimky). Stále platí, že není důkaz o tom, že by průkaz trombofilního stavu měl vliv na přežití či na riziko vzniku posttrombotického syndromu.
Závěr
Venózní tromboembolizmus představuje závažné onemocnění většinou multifaktoriální etiologie. Vrozené a získané trombofilní stavy jsou dobře identifikovatelnými rizikovými situacemi pro VTE. Testování na vrozené trombofilie má však smysl provádět jedině tehdy, pokud má vliv na strategii péče o nemocného či jeho první pokrevní příbuzné. Nelze přeceňovat význam jeho stanovení pro posouzení míry trombofilnosti jedince, protože stejně důležitá je znalost anamnézy a zhodnocení všech dalších rizikových faktorů pro VTE.
Proto bychom měli čím dále více testovat selektivně a individuálně, tedy méně často, než je tomu u nás dosud.
doc. MUDr. Petr Dulíček, Ph.D.
IV. interní hematologická klinika LF UK a FN Hradec Králové
Doručeno do redakce 11. 12. 2017
Přijato po recenzi 17. 3. 2018
Sources
- Nordsrtöm M, Lindblad B, Bergvist D et al. A prospective study of the incidence of deep vein thrombosis with a defined urban population. J Intern Med 1992; 232(2): 155–160.
- Egeberg O. Inherited antithrombin deficiency causing thrombophilia. Thromb Diath Haemorrh 1965; 13 : 516–530.
- Griffin JH, Evatt B, Zimmerman TS et al. Deficiency of protein C in congenital thrombotic disease. J Clin Invest 1981; 68(5): 1370–1373.
- Schwarz HP, Fisher M, Hapmeier P et al. Plasma protein S deficiency in familial thrombotic disease. Blood 1984; 64(6): 1297–1300.
- Comp PC, Nixon RR, Cooper MR et al. Familial protein S deficiency is associated with recurrent thrombosis. J Clin Invest 1984; 74(6): 2082. Dostupné z DOI: <http://dx.doi.org/10.1172/JCI111632>.
- Dahlbäck B, Carlsson M, Svensson PJ. Familial thrombophilia due to a previously unrecognized mechanism characterized by poor anticoagulant response to activated protein C; prediction of a cofactor to activated protein C. Proc Natl Scad Sci USA 1993; 90(3): 1004–1008.
- Bertina RM, Koeleman BPC, Koster T et al. Mutation in blood coagulation factor V associated with resistance to activated protein C. Nature 1994; 369(6475): 64–67. Dostupné z DOI: <http://dx.doi.org/10.1038/369064a0>.
- Poort SR, Rosendaal FR, Reitsma PH et al. A common genetic variation in the 3´-untraslated region of the prothrombin gene is associated with elevated plasma prothrombin levels and an in venous thrombosis and an increase in venous thrombosis. Blood 1996; 88(10): 3698–3703.
- Poul H, Kessler P. Trombofilní stavy: význam pro prevenci a léčbu žilního tromboembolizmu. Vnitř Lék 2009; 55(3): 242–252.
- Čingerová L, Kučeráková M. Thrombophilia. Vnitř Lék 2016; 62(12): 985–989.
- Chrobák L, Dulíček P. Thrombophilia states. Vnitř Lék 1998; 44(8): 481–486.
- Koster T, Rosendaal FR, de Ronde H et al. Venous thrombosis due to poor anticoagulant response to activated protein C: Leiden Thrombophilia Study. Lancet 1993; 342(8886–8887): 1503–1506.
- Martinelli I, Mannucci PM, De Stefano V et al. Different risks of thrombosis in four coagulation defects associated with inherited thrombophilia: a study of 150 families. Blood 1998; 92(7): 2353–2358.
- Simioni P, Sanson BJ, Prandoni P et al. Incidence of venous thromboembolism in families with inherited thrombophilia. Tromb Haemost 1999; 81(2): 198–202.
- Middeldorp S, Henkens CM, Koopman MM et al. The incidence of venous thromboembolism in family members of patients with factor V Leiden mutation and venous thrombosis. Ann Intern Med 1998; 128(1): 15–20.
- Christiaens L. Idiopathic venous thromboembolic disease. Risk factors for recurrence in 2006. Arch Mal Coeur Vaiss 2007; 100(2): 133–138.
- Linnemann B, Zgouras D, Schindewolf M et al. Impact of sex and traditional cardiovascular risk factors on the risk of recurrent venous thromboembolism: results from the German MAISTHRO Registry. Blood Coagul Fibrinolysis 2008; 19(2): 159–165. Dostupné z DOI: <http://dx.doi.org/10.1097/MBC.0b013e3282f54558>.
- Dalen JE. Should patients with venous thromboembolism be screened for thrombophilia? Am J Med 2008; 121(6): 458–463. Dostupné z DOI: <http://dx.doi.org/10.1016/j.amjmed.2007.10.042>.
- Dulíček P, Malý J, Pešavová L. Prevalence of inherited thrombophilia in young thrombosis patients from the East Bohemian region. Blood Coagul Fibrinolysis 2002; 13(6): 569–573.
- Den Heijer M, Lewington S, Clarke R. Homocysteine, MTHFR and risk of venous thrombosis: a meta-analysis of published epidemiological studies. J Thromb Haemost 2005; 3(2): 292–299. Dostupné z DOI: <http://dx.doi.org/10.1111/j.1538–7836.2005.01141.x>.
- Bezemer ID, Doggen CJ, Vos HL et al. No association between the common MTHFR 677C->T polymorphism and venous thrombosis: results from the MEGA study. Arch Intern Med 2007; 167(5): 497–501. Dostupné z DOI: <http://dx.doi.org/10.1001/archinte.167.5.497>.
- Croles FN, Nasserinejad K, Duvekot JJ et al. Pregnancy, thrombophilia, and the risk of a first venous thrombosis: systematic review and bayesian meta-analysis. BMJ 2017; 359: j4452. Dostupné z DOI: <http://dx.doi.org/10.1136/bmj.j4452.10.1136/bmj.j4452>.
- Wu O, Robertson L, Twaddle S et al. Screening for thrombophilia in high-risk situations: a meta-analysis and cost-effectiveness analysis. Br J Haematol 2005; 131(1): 80–90. Dostupné z DOI: <http://dx.doi.org/10.1111/j.1365–2141.2005.05715.x>.
- Baglin T, Gray E, Greaves M et al. Clinical guidelines for testing for heritable thrombophilia. Br J Haematol 2010; 149(2): 209–220. Dostupné z DOI: <http://dx.doi.org/10.1111/j.1365–2141.2009.08022.x>.
- Berse B, Lynch JA, Bowen S et al. In Reference to: “Cost and Utility of Thrombophilia Testing”. J Hosp Med 2017; 12(9): 783. Dostupné z DOI: <http://dx.doi.org/10.12788/jhm.2818>.
- Cox N, Johnson SA, Vasquez S. Patterns and Appropriateness of Thrombophilia Testing in an Academic Medical Center. J Hosp Med 2017; 12(9): 705–709. Dostupné z DOI: <http://dx.doi.org/10.12788/jhm.2804>.
- Colucci G, Tsakiris DA. Thrombophilia Screening: Universal, Selected, or Neither? Clin Appl Thromb Hemost 2017; 23(8): 893–899.Dostupné z DOI: <http://dx.doi.org/10.1177/1076029616683803>.
- Middeldorp S. Inherited thrombophilia: a double-edged sword. Hematology Am Soc Hematol Educ Program 2016; 2016(1): 1–9. Dostupné z DOI: <http://dx.doi.org/10.1182/asheducation-2016.1.1>.
- Linnemann B. Testing for thrombophilia in patients with venous thromboembolism – why and whom to test? Dtsch Med wochenschr 2016; 141(20): 1432–1435. Dostupné z DOI: <http://dx.doi.org/10.1055/s-0042–114094>.
- Pruthi RK. Optima utilization of thrombophilia testing. Int J Lab Hematol 2017; 39(Suppl 1): S104-S110. Dostupné z DOI: <http://dx.doi.org/10.1111/ijlh.12672>.
- Connors JM. Thrombophilia testing and Venous Thrombosis. N Engl J Med 2017; 377(12): 1177–1187. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMra1700365>.
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Internal Medicine

2018 Issue 5
-
All articles in this issue
- Diferenciální diagnostika anémií
- Hemoglobinopatie
- Vzácné anémie ze skupiny vrozených syndromů selhání kostní dřeně
- Aplastická anémie
- Paroxyzmální noční hemoglobinurie
- Autoimunitní hemolytická anémie
- Granulocytopenie
- Diagnostika a léčba imunitní trombocytopenie
- Transplantace hematopoetických kmenových buněk v léčbě nemaligních onemocnění krvetvorby
- Diagnostika poruch hemostázy
- Vrozené a získané krvácivé stavy
- Vyšetřování vrozených trombofilních stavů: kdy, koho, na co, anebo vůbec?
- Antitrombotika dnes
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue
- Autoimunitní hemolytická anémie
- Diferenciální diagnostika anémií
- Vrozené a získané krvácivé stavy
- Hemoglobinopatie
