Skotský model dávkování vankomycinu a monitorování jeho hladin zlepšuje účinnost i bezpečnost léčby vankomycinem
The Scottish model of vancomycin dosing and therapeutic drug monitoring improves both efficacy and safety of vancomycin therapy
Objective: Vancomycin therapeutic drug monitoring (TDM) is recommended for better treatment efficacy and safety. The Scottish Antimicrobial Prescribing Group model recommends weight-based loading dose, next 3–4 doses based on creatinine clearance and maintenance doses according to trough concentrations. Methods: Retrospective cohort study of all adult patients treated with vancomycin before and after introducing the guideline in a large Czech hospital in 2015 compares the success rate in achieving recommended trough concentrations (10–20 mg/l) during first measurement and efficiency of maintaining these concentrations subsequently. Assessment of vancomycin related nephrotoxicity is included. Results: In 2014, 74/163 (45.4 %) patients achieved recommended concentrations in the first measurement, compared to 101/160 (63.1 %) patients in 2016 (χ2; p = 0.001). Recommended trough concentrations in more than half of subsequent measurements were detected in 51/105 patients (48.6 %) in 2014 and in 80/117 patients (68.4 %) in 2016. Not a single level in subsequent measurements within the range was detected in 28 (26.7 %) cases in 2014 and in 10 (8.5 %) cases in 2016 (Mann-Whitney; p = 0.026). There was no difference in nephropathy occurrence (χ2; p = 0.286). Conclusion: The adopted Scottish model of vancomycin TDM resulted in very significantly higher achievement of recommended trough concentrations during first measurements and significantly more effective maintenance of subsequent concentrations, without increased nephrotoxicity. Key words: guideline – therapeutic drug monitoring – vancomycin
Authors:
Kristýna Zahálková 1; Aleš Chrdle 1,5; Olga Dvořáčková 2; Marie Kašparová 3; Magdalena Horníková 4; Václav Chmelík 1
Authors‘ workplace:
Infekční oddělení Nemocnice České Budějovice, a. s.
1; Ústav laboratorní diagnostiky a veřejného zdraví Zdravotně sociální fakulty Jihočeské univerzity v Českých Budějovicích
2; Laboratoř klinické chemie, hematologie a imunologie Nemocnice České Budějovice, a. s.
3; Pracoviště bakteriologie Laboratoře lékařské mikrobiologie Nemocnice České Budějovice, a. s.
4; Tropical and Infectious Disease Unit, Royal Liverpool University Hospital, Liverpool, Velká Británie
5
Published in:
Vnitř Lék 2018; 64(7-8): 717-724
Category:
Original Contributions
Overview
Východisko: Terapeutické monitorování hladin vankomycinu má zásadní význam pro úspěšnost a bezpečnost léčby. Doporučený postup dávkování a monitorování hladin vankomycinu podle Scottish Antimicrobial Prescribing Group určuje velikost úvodní dávky podle tělesné hmotnosti, další 3–4 dávky podle clearance kreatininu a následné dávkování se upravuje podle naměřených údolních hladin. Metody: Retrospektivní kohortová studie všech dospělých pacientů léčených vankomycinem před a po převzetí doporučeného postupu v roce 2015 porovnává rychlost dosažení doporučených hladin (10–20 mg/l) při prvním měření a úspěšnost jejich udržení v následných měřeních, spolu s výskytem nefropatie. Výsledky: Při prvním odběru dosáhlo doporučených hladin 74/163 pacientů (45,4 %) v roce 2014 a 101/160 pacientů (63,1 %) v roce 2016 (χ2; p = 0,001). Více než polovinu následných hladin mělo v doporučených mezích 51/105 pacientů (48,6 %) v roce 2014 a 80/117 (68,4 %) v roce 2016, zatímco ani jednou nedosáhlo doporučené hladiny 28 (26,7 %) pacientů v roce 2014 a 10 (8,5 %) pacientů v roce 2016 (Mann-Whitney; p = 0,026). Výskyt nefropatie nebyl rozdílný (χ2; p = 0,286). Závěry: Převzatý skotský postup dávkování vankomycinu vedl velmi významně častěji k doporučeným hladinám vankomycinu při prvním měření a významně častěji i v dalších měřených hodnotách, aniž by došlo k vyššímu výskytu nefropatie. Klíčová slova: doporučený postup – terapeutické monitorování hladin – vankomycin
Úvod
Vankomycin je tricyklické glykopeptidové antibiotikum izolované z produktů aktinomycet, Amycolatopsis orientalis, s účinkem na grampozitivní mikroorganizmy včetně meticilin-rezistentních stafylokoků (MRSA) a enterokoků, které je v klinickém použití již od roku 1954 [1]. Jedná se o antibiotikum s úzkým terapeutickým rozmezím. Na straně jedné při poddávkování hrozí selhání léčby a rozvoj rezistentních kmenů, na straně druhé ohrožuje pacienta rizikem rozvoje nefrotoxicity a ototoxicity [2]. Rizikovými faktory vzniku nežádoucích účinků jsou zejména dlouhodobě vysoké plazmatické koncentrace, současné podávání nefrotoxických léků a doba léčby nad 3 týdny.
Zásadní význam pro úspěšnost a bezpečnost léčby při úzkém terapeutickém rozmezí má terapeutické monitorování lékových hladin (Therapeutic Drug Monitoring – TDM) [3]. Účinnost vankomycinu je závislá na poměru plochy pod koncentrační křivkou (AUC – Area Under the Curve) k minimální inhibiční koncentraci (MIC – Minimum Inhibitory Concentration) pro daný mikroorganizmus. AUC odráží míru systémové expozice léčiva.
Antimikrobní účinek vankomycinu je tedy více časově závislý, a nikoli koncentračně závislý. Vankomycin lze podávat buď intermitentně, nebo v kontinuální infuzi. Účinnost i bezpečnost obou těchto dvou způsobů podání u těžkých sepsí je srovnatelná [4]. Při intermitentním podávání je možné jako surogátní parametr AUC použít údolní hladiny [5]. Stanovení vrcholové (peakové) koncentrace má v běžné praxi malý význam vzhledem k uvedeným farmakokinetickým a farmakodynamickým vlastnostem vankomycinu [6].
V posledních dekádách bylo zjištěno, že dříve doporučované rozmezí pro údolní koncentrace 5–10 mg/l nemusí vést k dostatečné penetraci vankomycinu do cílových tkání a usmrcení odolnějších bakteriálních kmenů [7]. U pacientů s bakteriemií způsobenou MRSA a údolní koncentrací vankomycinu < 10 mg/l je např. 16krát větší pravděpodobnost klinického selhání léčby [8]. Údolní sérová koncentrace vankomycinu by měla být proto udržována dle doporučení Americké společnosti pro infekční nemoci (Infectious Disease Society of America – IDSA) mezi 10 a 20 mg/l. U závažných infekcí jsou vhodnější hladiny mezi 15–20 mg/l [9]. Rychlé dosažení doporučených hladin už při prvních dávkových intervalech a jejich správná interpretace s ohledem na klinickou diagnózu minimalizuje riziko selhání léčby [10]. Vzhledem k tomu, že se vankomycin často používá u nestabilních pacientů s těžkým průběhem sepse, je žádoucí rychlý nástup účinku. Australská studie ukazuje, že o mortalitě pacientů léčených vankomycinem výrazně rozhoduje rychlost dosažení účinných lékových hladin v prvních dnech léčby [8].
V Nemocnici České Budějovice, a. s., byl v polovině roku 2015 zaveden doporučený postup pro dávkování a monitorování vankomycinu (DP) vycházející ze skotského modelu dávkování (Scottish Antimicrobial Prescribing Group) zohledňujícího nové studie a trendy v léčbě vankomycinem [11,12]. Úvodní dávka je v tomto modelu stanovena dle hmotnosti pacienta, neboť distribučním prostorem vankomycinu je zejména extracelulární tekutina. Velikost následných dávek a dávkovací interval závisí především na vylučovací funkci ledvin, a proto se další 2–3 dávky stanoví dle vypočtené eGF (eGF – estimated glomerular filtration) či skutečně zjištěné hodnoty clearance kreatininu. Účinnost léčby vankomycinem závisí na celkové expozici vankomycinu (AUC). Přestože údolní hladina nekoreluje vždy těsně s AUC, resp. s AUC/MIC [13,14], je údolní koncentrace vankomycinu v séru doporučována jako vhodný alternativní parametr pro stanovení optimálního dávkování [15]. První údolní hladina se odebírá obvykle před 4., nejpozději před 5. dávkou, ale u nestabilních pacientů mohou ošetřující lékaři vyšetřit hladiny i dříve. Podle DP se údolní hladiny odebírají 0–2 hod před další plánovanou dávkou, a protože se hladina vankomycinu vyšetřuje 24 hod denně ve statimovém režimu, výsledek je k dispozici do 1 hod od dodání do laboratoře, a tak lze dávkování upravit ihned (tab. 1 a tab. 2).
![Doporučený postup dávkování vankomycinu v Nemocnici České Budějovice, a.s. Upraveno podle [12]](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image_pdf/c7e2a37fac5a0799d11af726c98f5a74.jpeg)
![Doporučený postup stanovení následných
dávek vankomycinu dle údolních hladin
u dialyzovaných pacientů. Upraveno podle [12]](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image_pdf/805bc4b5b59ac503b383decce6d6100d.jpeg)
Chronická dialýza 3krát týdně: Úvodní dávka se určí podle tělesné
hmotnosti. Vyšetření údolní hladiny se provádí před zahájením dialýzy,
podle hladiny se upraví dávka podávaná po dialýze.
Stanovení hladin vankomycinu je prováděno z krevního séra, stabilita v krevním séru po centrifugaci je při laboratorní teplotě 8 hod, při teplotě 4–8 °C až 48 hod. Vzorky zamražené na -20 °C lze uchovávat po dobu 6 měsíců. U nestabilních pacientů (a všech pacientů v intenzivní péči) se doporučuje monitorovat hladiny vankomycinu společně s funkcí ledvin denně nebo obden, u stabilních pacientů nejméně 2krát týdně.
Tento DP je k dispozici ošetřujícím lékařům na nemocničním intranetu. Při antibiotických konzultacích a konziliích jsou ošetřující lékaři před zahájením léčby vankomycinem na tento DP odkazováni. Z tohoto modelu také vychází doporučený postup a kalkulačka k výpočtu dávkování vankomycinu na webu Společnosti infekčního lékařství České lékařské společnosti J. E. Purkyně (www.infekce.cz/zprava17–06.htm).
Cílem tohoto článku je popsat samotnou praxi monitorování vankomycinu v Nemocnici České Budějovice, a.s., a zhodnotit vliv zavedení doporučeného postupu na míru úspěšnosti při dosažení a udržení terapeutických hladin a současně zmapovat riziko nefrotoxicity při celkově vyšší expozici vankomycinu.
Metodika
Předkládáme retrospektivní kohortovou analýzu všech dospělých pacientů léčených vankomycinem v roce 2014 (poslední celý rok před zavedením DP) a v roce 2016 (první celý rok po zavedení DP).
Ve skupině pacientů z roku 2016 jsme vyřadili pacienty, kteří měli hladiny nabírané před i po podání jakožto zástupný ukazatel nedodržení DP (který doporučuje pouze monitorování údolních hladin před podáním antibiotika). U těchto pacientů jsme předpokládali, že ošetřující lékaři postupovali podle původních schémat, nikoli podle doporučeného postupu.
Z elektronické zdravotní dokumentace byla získána klinická data pacientů, den antibiotické terapie, stanovené hladiny vankomycinu a hodnoty kreatininu v séru. Hladiny vankomycinu byly stanoveny na analyzátoru ADVIA Centaur XP (Siemens, Německo) kompetitivní imunoanalytickou metodou využívající přímé chemiluminiscence (CLIA) v nepřetržitém provozu.
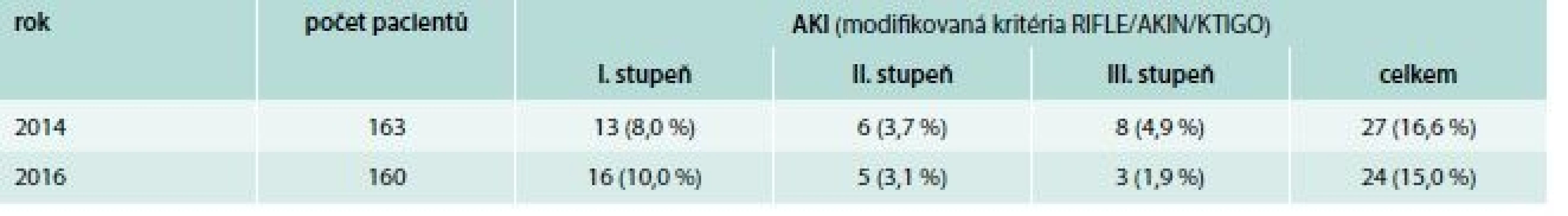
Pro hodnocení nefrotoxicity jsme použili modifikovaná kritéria akutního poškození ledvin (RIFLE/AKIN/KTIGO) [16,17] se stratifikací stupeň 1 při vzestupu sérového kreatininu o 50–99 %, stupeň 2 při vzestupu kreatininu o 100–199 % a stupeň 3 při vzestupu kreatininu o 200 % a více, současně stupeň 3 vždy při vzestupu kreatininu nad 354 µmol/l. Časové kritérium procentuálního vzestupu koncentrace kreatininu bylo i s vědomím snížené specifičnosti zpřísněno z definovaných 7 dnů na celkovou dobu léčby vankomycinem plus 1 měsíc po léčbě pro vyšší záchytnost rozvoje nefropatie. Kritérium vzestupu koncentrace kreatininu o 26 µmol/l za 48 hod stejně jako kritérium poklesu diurézy během 6 hod nebyly použity pro jejich irelevanci v daném kontextu. Do analýzy bezpečnosti byli zařazeni všichni léčení dospělí pacienti, tedy i pacienti s různým stupněm chronické renální insuficience před zahájením léčby vankomycinem. Pacienti v chronickém hemodialyzačním programu byli z hodnocení nefrotoxicity vyřazeni.
Porovnány byly kohorty 2014 a 2016 v parametru úspěšnosti dosažení účinné hladiny při prvním měření hladiny vankomycinu a v parametru úspěšnosti udržení hladin v doporučených mezích v následných měřeních. V hodnocení bezpečnosti byl mezi skupinami srovnáván podíl pacientů, u nichž došlo ke zhoršení renálních funkcí. Takto získaná data byla statisticky zpracována, k porovnání byly použity testy χ2 a Mannův-Whitneyův, za statisticky významné byly považovány dosažené hodnoty p < 0,05.
S ohledem na retrospektivní zpracování anonymizovaných dat etická komise nepožadovala informovaný souhlas pacientů.
Výsledky
Celkový počet pacientů a odebraných lékových hladin
V roce 2014 bylo vyšetřeno 754 hladin vankomycinu (z toho 440 hladin před podáním a 314 hladin po podání) u 163 léčených pacientů. V roce 2016 bylo naměřeno 1 099 hladin před podáním vankomycinu a 112 hladin po podání u 228 pacientů. Po vyřazení pacientů s měřenými vrcholovými hladinami, a tudíž předpokládaným nedodržením DP (68 pacientů, tj. 29,8 % z celkové populace pacientů roku 2016), zůstalo v kohortě roku 2016 celkem 160 pacientů, u kterých bylo vyšetřeno celkem 707 údolních hladin (tab. 3).
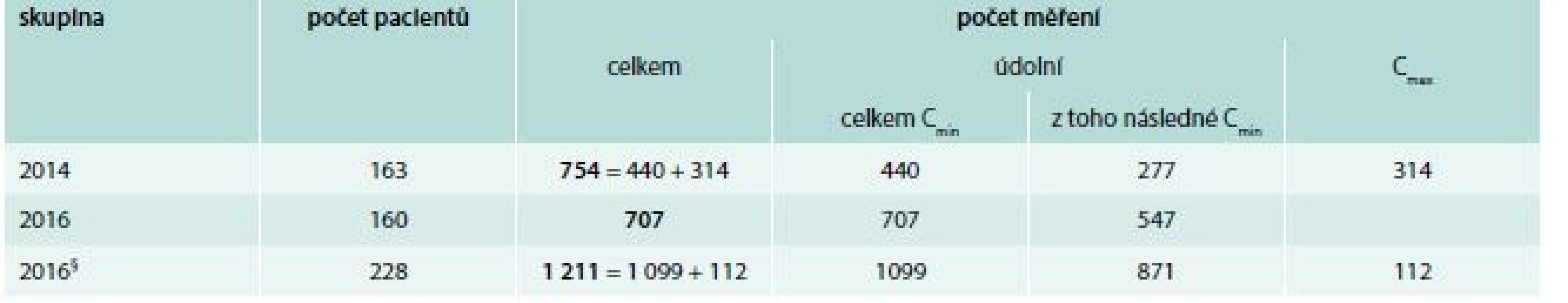
První měřená hladina vankomycinu
Úspěšně dosažené terapeutické hladiny při prvním odběru jsme zaznamenali v roce 2014 u 74 (45,4 %) pacientů (tab. 4). U 69 (42,3 %) pacientů byla první hladina nízká (< 10 mg/l), u 20 (12,3 %) pacientů byla vysoká (> 20 mg/l). U kohorty roku 2016 jsme zaznamenali první hladinu v doporučených mezích u 101 pacientů (63 %). Nízkou hladinu mělo 38 (23,8 %) pacientů, zatímco vysokou hladinu mělo 21 (13,1 %) pacientů. Rozdíl mezi těmito kohortami byl statisticky vysoce významný (χ2 test, p = 0,001), graf 1.
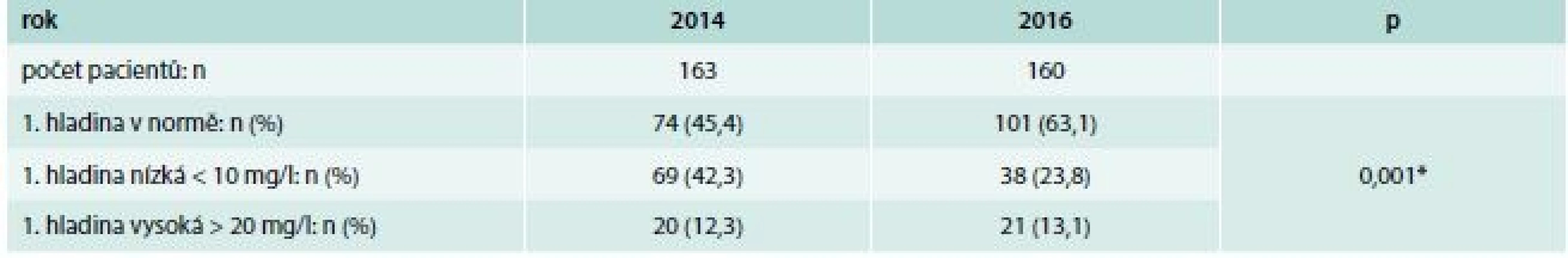

Následné hladiny vankomycinu
Výrazný posun jsme také zaznamenali při hodnocení následných naměřených údolních hladin vankomycinu v průběhu další léčby (tab. 5, grafy 2–4). V roce 2014 nemělo 26,7 % pacientů ani jedno měření v doporučeném rozmezí, oproti tomu více než polovinu následných naměřených hodnot mělo v doporučeném rozmezí 48,5 % (51 ze 105) pacientů. V kohortě roku 2016 pouze 8,5 % pacientů nedosáhlo v žádné z následných hodnot terapeutických hladin, a více než polovinu následných hodnot mělo v doporučeném rozmezí 68,4 % pacientů (80 ze 117). Podíly následných údolních hladin vankomycinu v doporučených mezích se u srovnávaných kohort roku 2014 a roku 2016 statisticky významně liší (test Mannův-Whitneyův; p = 0,026).




Nefrotoxicita
Součástí studie bylo hodnocení nefrotoxicity vankomycinu. V roce 2016 nedošlo ke statisticky významnému zvýšení incidence akutního ledvinného selhání (celkem 16,5 % pacientů v roce 2014, 15,0 % pacientů v roce 2016; χ2 test: p = 0,286), naopak byl pozorovaný trend k nižšímu stupni poškození ledvin (tab. 6)
Diskuse
Po zavedení DP bylo díky zavedení nasycovací dávky podle tělesné hmotnosti dosaženo doporučené hladiny vankomycinu již při 1. měření u většího podílu pacientů. I při následných měřeních byly doporučené údolní hladiny udrženy ve větší míře.
Při bližším pohledu na graf 4 je v levé čtvrtině grafu (nejnižší kvartil) patrné velmi výrazné zlepšení podílu následných hladin v doporučeném rozmezí u dolního kvartilu pacientů kohorty roku 2016 oproti dolnímu kvartilu kohorty roku 2014. Dolní kvartil kohorty roku 2014 nedosáhl terapeutických hladin dokonce ani jednou, zatímco nejnižší kvartil kohorty roku 2016 měl úspěšnost udržení doporučených hladin srovnatelnou s druhým kvartilem kohorty roku 2014.
Další výrazné zlepšení je patrné i ve 2. kvartilu v kohortě v roce 2016, tito pacienti dosahovali doporučené hodnoty u 50–80 % měřených hladin, zatímco 2. kvartil kohorty roku 2014 dosahoval doporučených údolních hodnot v 1–50 % měření.
3. a především 4. kvartil obou kohort dosahovaly doporučených hladin vankomycinu ve většině, ne-li ve všech měřených hodnotách – i před zavedením DP byla doporučená hladina v roce 2014 udržena vždy u 34,3 % pacientů, v roce 2016 to bylo 34,2 % pacientů, neboť zlepšení již stoprocentní úspěšnosti nebylo možné.
Tato práce nezohledňuje behaviorální a organizační překážky při implementaci nových postupů do běžné klinické praxe. Odráží však aktuální realitu ve velké české nemocnici a vysokou úspěšnost zavedení DP jako nástroje, díky kterému se vankomycin stal mnohem předvídatelnějším, a tudíž lépe použitelným lékem.
U pacientů, u kterých nebylo dosaženo doporučených hodnot údolních hladin, je nutné využít farmakokinetické modelování ve spolupráci s klinickým farmakologem či farmaceutem [18]. Na druhé straně se ale mohlo jednat o situace, v nichž ošetřující lékař neuměl či nechtěl použít DP [19].
Prokazatelné nedodržení DP v roce 2016 (odebírání lékových hladin před i po podání dávky) bylo zjištěno u 68 pacientů (29,8 % z celkového počtu). Tito pacienti byli ze studie vyřazeni. Další zhodnocení míry využití DP mezi lékaři je obtížné, ale přesto dosahujeme přijatelných výsledků s možností jejich dalšího zlepšení při zlepšující se adherenci k DP ošetřujícími lékaři.
Dalším příznivým faktorem bylo zavedení nepřetržitého statimového režimu stanovení hladin vankomycinu v biochemické laboratoři, protože dává možnost ošetřujícímu lékaři ihned reagovat na stanovenou údolní hladinu, a tím se neprodlužuje doba působení nesprávně nastaveného dávkování o další dávkovací interval.
Kohorty tvořili všichni dospělí pacienti léčení nitrožilně vankomycinem, bez zohlednění indikace pro podání vankomycinu či délky léčby a celkového klinického stavu. Nezjišťovali jsme závažnost či lokalizaci infekce a ani komorbidity pacientů. Určité procento mírně supraterapeutických hladin tedy mohlo být udržováno záměrně u pacientů v kritickém stavu.
V roce 2014 biochemická laboratoř vydávala výsledek hladin vankomycinu s komentářem uvádějícím doporučené údolní hladiny dle aktuálního znění Souhrnu charakteristik léčivého přípravku (SPC – summary of product characteristic), tedy 5–10 mg/l [3], ačkoli tou dobou již byla několik let publikována nová doporučení o cílových údolních hladinách 10–20 mg/l. Nezkoumali jsme, nakolik se jednotliví lékaři řídili v roce 2014 podle staršího doporučení dle SPC, které bylo uvedeno v komentáři vydaných výsledků.
Vyšší údolní hladiny vankomycinu v roce 2016 nevedly ke statisticky významnému zvýšení incidence akutního ledvinného selhání, naopak zde byl trend k mírnějšímu stupni poškození ledvin. Užití dalších nefrotoxických léků a věk pacientů v této studii nebyly zohledněny.
Dávkování vankomycinu a monitorování jeho hladin nepodléhá jednotné praxi. K dávkování se dá přistupovat dle SPC, podle tabulek a výpočtových vzorců či podle farmakokinetického modelování. První způsob dávkování podle SPC je neuspokojivý; na druhé straně nejsofistikovanější způsob, tedy farmakokinetické modelování, je časově náročný a na řadě pracovišť nedostupný. Proto i přes své zjevné nevýhody se jako nejpragmatičtější pro každodenní klinickou praxi jeví využití tabulek a výpočtových vzorců pro velkou část pacientů s vědomím toho, že u menší části pacientů tento způsob nemusí postačovat a je zapotřebí farmakokinetické modelování.
Závěr
V roce 2016 dosahovali pacienti léčení vankomycinem podle doporučeného postupu TDM vankomycinu v Nemocnici České Budějovice, a. s., velmi významně častěji doporučených terapeutických hladin již při prvním měření hladin vankomycinu (tedy obvykle před 3.–5. dávkou), a také v dalších naměřených hodnotách se hladina vankomycinu držela významně častěji v terapeutických mezích.
Nově zavedený modifikovaný skotský model dávkování a monitorování hladin vankomycinu je jednoduchý a pomáhá k lepšímu dosažení terapeutických hladin v úvodu léčby i jejich udržení v jejím dalším průběhu. Současně tento model nevede k častějšímu zhoršení renálních funkcí.
Poděkování celému týmu Scottish Antimicrobial Prescribing Group za jejich neúnavnou snahu o lepší používání antibiotik a svolení s převzetím a adaptací doporučeného postupu.
Seznam použitých zkratek
AKIN – akutní selhání ledvin/Acute Kidney Injury
AUC – plocha pod křivkou/Area Under The Curve
CLIA – chemiluminicenční imunoanalýza
DP – doporučený postup
eGF – vypočítaná (odhadovaná) glomerulární filtrace / Estimated Glomerular Filtration
IDSA – Infecious Diseases Society of America
KTIGO –Doporučený postup při akutním selhání ledvin / Kidney Disease: Improving Global Outcomes
MIC – minimální inhibiční koncentrace / Minimum Inhibitory Concentration
MRSA – meticilin-rezistentní Staphylococcus aureus
RIFLE – kritéria akutního postižení ledvin / Risk, Injury, Failure, Loss, End-stage kidney
SAPG – Scottish Antimicrobial Prescribing Group
SPC – souhrn údajů o přípravku / Summary of Product Characteristic
TDM – terapeutické monitorování lékových hladin / Therapeutic Drug Monitoring
MUDr. Kristýna Zahálková
Infekční oddělení Nemocnice České Budějovice, a.s., České Budějovice
Doručeno do redakce 19. 11. 2017
Přijato po recenzi 12. 2. 2018
Sources
1. Martínková J. Současný náhled na vankomycin v léčbě infekcí vyvolaných stafylokokem rezistentním na methicilin (MRSA). Klini Mikrobiol Inf Lék 2015; 21(1): 16–23. 2. Sinha RA, Haikal A, Hammoud KA et al. Vancomycin and the Risk of AKI: A Systematic Review and Meta-Analysis. Clin J Am Soc Nephrol 2016; 11(12): 2132–2140. Dostupné z DOI: . 3. Kacířová I, Grundmann M. TDM antibiotik v klinické praxi. Kardiol Rev Int Med 2015; 17(1): 57–64. 4. Štěpán M, Chytra M, Pelnář P et al. Kontinuální versus intermitentní podání vankomycinu u grampozitivních infekcí rezistentních na beta-laktamová antibiotika u nemocných v intenzivní péči. Anest intenziv Med 2009; 20(6): 309–316. 5. Brown ML, Hutchison AM, McAtee AM et al. Allometric versus consensus guideline dosing in achieving target vancomycin trough concentrations. Am J Health Syst Pharm 2017; 74(14):1067–1075. Dostupné z DOI: . 6. Tongsai S, Koomanachai P. The safety and efficacy of high versus low vancomycin trough levels in the treatment of patients with infections caused by methicillin-resistant Staphylococcus aureus: a meta-analysis. BMC Research Notes 2016; 9(1): 455. Dostupné z DOI: . 7. Kacířová I, Grundmann M. Terapeutické monitorování vankomycinu v rutinní klinické praxi. Vnitř Lék 2014; 60(10): 846–851. 8. Holmes NE, Turnidge JD, Munckhof WJ et al. Vancomycin AUC/MIC Ratio and 30-Day Mortality in Patients with Staphylococcus aureus Bacteremia. Antimicrob Agents Chemother 2013; 57(4): 1654–1663. Dostupné z DOI: . 9. Liu C, Bayer A, Cosgrove SE et al. Clinical practice guidelines by the Infectious Diseases Society of America for the treatment of methicillin-resistant Staphylococcus aureus infections in adults and children. Clin Infect Dis 2011; 52(3): e18-e55. Dostupné z DOI: . 10. Bakke V, Sporsem H, Von der Lippe E et al. Vancomycin levels are frequently subtherapeutic in critically ill patients: a prospective observational study. Acta Anaesthesiol Scand 2017; 61(6): 627–635. Dostupné z DOI: . 11. Scottish Antimicrobial Prescribing Group Guidance. Dostupné z WWW: . 12. Chrdle A, Horníková M, Pešková M. Doporučený postup parenterálního dávkování vankomycinu v Nemocnici České Budějovice. Nemocnice České Budějovice, a.s. NCB_SOP_L_13_008_A, verze 1.7.2015. 13. Ploessl C, White C, Manasco K. Correlation of a Vancomycin Pharmacokinetic Model and Trough Serum Concentrations in Pediatric Patients. Pediatr Infect Dis J 2015; 34(10): e244-e247. Dostupné z DOI: . 14. Kishk OA, Lardieri AB, Heil EL et al. Vancomycin AUC/MIC and Corresponding Troughs in a Pediatric Population. J Pediatr Pharmacol Ther 2017; 22(1): 41–47. Dostupné z DOI: . 15. Rybak MJ, Lomaestro BM, Rotschafer JC et al. Therapeutic monitoring of vancomycin in adults summary of consensus recommendations from the American Society of Health-System Pharmacists, the Infectious Diseases Society of America, and the Society of Infectious Diseases Pharmacists. Pharmacotherapy 2009; 29(11): 1275–1279. 16. Sutton JD, Mynatt RP, Kaye KS et al. Nephrotoxicity Comparison of Two Commercially Available Generic Vancomycin Products. Antimicrob Agents Chemother 2015; 59(9): 5470–5474. Dostupné z DOI: . 17. Pereira M, Rodrigues N, Godinho I et al. Acute kidney injury in patients with severe sepsis or septic shock: a comparison between the “Risk, Injury, Failure, Loss of kidney function, End-stage kidney disease” (RIFLE), Acute Kidney Injury Network (AKIN) and Kidney Disease: Improving Global Outcomes (KDIGO) classifications. Clin Kidney J 2017; 10(3): 332–340. Dostupné z DOI: . 18. Suchánková H, Machačová M, Herodesová T. Terapeutické monitorování vankomycinu v klinické praxi. Klin Farmakol Farm 2016; 30(2): 4–8. 19. Bond SE, Crowther SP, Adhikari S et al. Design and Implementation of a Novel Web-Based E-Learning Tool for Education of Health Professionals on the Antibiotic Vancomycin. J Med Internet Res 2017; 19(3): e93. Dostupné z DOI: .
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Internal Medicine

2018 Issue 7-8
-
All articles in this issue
- Skotský model dávkování vankomycinu a monitorování jeho hladin zlepšuje účinnost i bezpečnost léčby vankomycinem
- Mezenchymální kmenové buňky a léčba diabetu 1. typu
- Jak diagnostikovat sarkoidózu srdce?
- Budúcnosť farmakologickej liečby nealkoholovej steatoheptitídy z pohľadu kľúčových patofyziologických mechanizmov
- Nízkosacharidová strava v léčbě diabetes mellitus
- Kontroverze v léčbě dny
- Funkce endotelu, její vztah k arteriální hypertenzi a možnosti její modulace
- Srdeční postižení u suicidální intoxikace oxidem uhelnatým s rysy toxické i stresové kardiomyopatie: kazuistika
- Spironolakton v léčbě hypertenze: opomíjená molekula
- Trimeresurus albolabris (štrkáčovec bieloústy) – hlásenie uhryznutia: kazuistika
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue
- Nízkosacharidová strava v léčbě diabetes mellitus
- Spironolakton v léčbě hypertenze: opomíjená molekula
- Mezenchymální kmenové buňky a léčba diabetu 1. typu
- Kontroverze v léčbě dny
