Anafylaktické příznaky a anafylaktický šok
Anaphylactic symptoms and anaphylactic shock
Anaphylactic symptoms and anaphylactic shock are serious, rapidly developing and potentially fatal systemic reactions occurring after contact with the trigger, followed by release of a number of substances that affect vascular permeability, smooth muscle tone of blood vessels and bronchi with activation of the systemic inflammatory cascade. From a pathophysiological point of view, it can be an IgE-mediated immune response followed by massive release of biologically active mediators from mast cells and basophils (IgE dependent). If the mastocyt/basophil is degranulated via a direct IgE-free pathway, it is non-allergic (non-IgE dependent, anaphylactoid anaphylaxis). The diagnosis of anaphylaxis is determined on the basis of clinical criteria, taking into account the need to initiate therapy in a life-threatening condition without delay. Adrenaline is the first-line drug in the treatment of anaphylaxis and there is no contraindication to its use. Early provision of venous intake is essential for the patient to develop hypotension.
Keywords:
Adverse events – IgE dependent anaphylaxis – non IgE dependent anaphylaxis – management of anaphylaxis
Authors:
Irena Krčmová; Jakub Novosad
Authors‘ workplace:
Ústav klinické imunologie a alergologie LF UK a FN Hradec Králové
Published in:
Vnitř Lék 2019; 65(2): 149-156
Category:
Overview
Anafylaktické příznaky a anafylaktický šok jsou závažné, rychle se rozvíjející a potencionálně fatální systémové reakce vznikající po kontaktu se spouštěčem s následným uvolněním řady substancí, které ovlivňují cévní permeabilitu, tonus hladkého svalstva cév a bronchů s aktivací systémové zánětlivé kaskády. Z hlediska patofyziologického se může jednat o imunologickou reakci, zprostředkovanou protilátkami typu IgE a následným masivním uvolněním biologicky aktivních mediátorů z mastocytů a bazofilů (IgE dependentní). Pokud je mastocyt/bazofil degranulován cestou přímou bez účasti IgE protilátek, jedná se o anafylaxi nealergickou (non IgE dependentní, starší název anafylaktoidní). Diagnóza anafylaxe je stanovena na podkladě klinických kritérií s ohledem na nutnost neprodleně zahájit terapii při život ohrožujícím stavu. Lékem první volby je v léčbě anafylaxe adrenalin, pro jeho podání neexistuje žádná kontraindikace. Včasné zajištění žilního vstupu je u pacienta zásadní, než se plně rozvine hypotenze.
Klíčová slova:
anafylaxe – IgE dependentní anafylaxe – léčba anafylaxe – non IgE dependentní anafylax
Úvod
Anafylaxe je těžká, život ohrožující generalizovaná nebo systémová hypersenzitivní reakce s rychlým nástupem klinických projevů, která může zapříčinit úmrtí. Její nejtěžší formou je anafylaktický šok. Z hlediska patofyziologického můžeme anafylaxi dělit na IgE mediovanou a non IgE mediovanou, v akutním stavu jsou však léčebné postupy zcela identické. U IgE mediované anafylaxe stoupá riziko s délkou a frekvencí expozice alergizujícím látkám, u druhého typu je vznik závažného stavu více nepředvídatelný. Anafylaxe patří z hlediska klasifikace šoků do skupiny šoků distribučních, při nichž dochází ke generalizované vazodilataci, úniku tekutin extravazálně se systémovou hypoperfuzí, hypoxií a k dysfunkci životně důležitých orgánů. Přesto má anafylaxe při rychlé a kvalitní léčebné péči ze všech typů šokových situací nejlepší prognózu [1,2].
Epidemiologie
Přesný výskyt a prevalence anafylaxe v Evropě je obtížné stanovit pro řadu faktorů. Současná definice anafylaxe je popisná a je obtížné ji užít v epidemiologických studiích [4]. Kódy Mezinárodní klasifikace nemocí (dle WHO – předchozí ICD-9 a současné ICD-10) se zaměřují pouze na anafylaktický šok a nezahrnují celou řadu spouštěčů. V datových systémech tak pravděpodobně nebudou zaznamenány všechny případy či budou uvedeny pod jinými alergickými diagnózami. Anafylaxe může mít neočekávaný nástup, může se lišit v závažnosti, ale může taktéž spontánně vymizet. Z uvedených důvodů je pravděpodobně anafylaxe poddiagnostikována a data jsou hlášena nedostatečně [3].
Výsledky 10 evropských studií uvádějí incidenci mezi 1,5–7,9 na 100 000 osob/rok. Studie z Velké Británie ukazují nárůst hospitalizací pro anafylaxi během posledních 2 desetiletí. Na základě 3 evropských populačních studií se prevalence odhaduje na 0,3 %, celkově je míra úmrtnosti na anafylaxi nízká, pod 0,001 % [4].
Mezi klíčové spouštěče anafylaxí patří potraviny, léky, bodavý hmyz; bohužel až ve 20 % není příčina jasně identifikována. Spouštěče anafylaxe se liší dle věku a pohlaví, jsou rozdíly dle geografických faktorů či stravovacích zvyklostí. Např. potraviny jsou nejčastější příčinou anafylaxe u dětí, zejména u dětských astmatiků s alergickou vazbou na pyl. Hmyzí jedy a léky vyvolávají anafylaxi častěji u dospělých než u dětí. Ve srovnání s dospělými muži mají ženy vyšší frekvenci anafylaxe a konkrétně vyšší vazbu na rostlinné alergeny v potravinách a na nesteroidní protizánětlivé léky. Léky jsou nejčastější příčinou anafylaxe u hospitalizovaných pacientů, za anafylaktické příznaky v průběhu anestezie jsou často odpovědny neuromuskulární blokátory, zejména u žen [3].
Nejčastější příčiny anafylaktické reakce
Výčet spouštěcích příčin, které mohou vyvolat anafylaxi zprostředkovanou IgE, je široký a u některých z nich lze vyvolat taktéž reakci nezávislou na IgE protilátkách. Jmenujeme nejčastější zástupce:
- potraviny (ořechy, burské oříšky, ryby, měkkýši, mléčné a vaječné bílkoviny)
- β-laktamová antibiotika (v konjugátu s proteiny)
- jedy (blanokřídlý hmyz : včela, čmelák, vosa, sršeň)
- latex, dezinfekční látka etylenoxid (v konjugátu s proteiny)
- alergenové extrakty, vakcíny vyvinuté na základě ptačích zárodků
- inzulin, ACTH, parathormon, vazopresin, chymotrypsin, streptokináza, protamin
- heterologní séra
- seminální tekutina
Příčiny non-IgE mediovaných reakcí jsou jak ve svém spektru, tak v patogenetických mechanizmech rozličné. Uvádíme typy reakcí s příklady častých podnětů:
- přímé uvolnění mediátorů anafylaxe (opiáty, protamin, myorelaxancia, tiopental, lokální anestetika, radiokontrastní látky, manitol, dextrany)
- aktivace komplementu (aplikace krevních derivátů pacientovi s deficitem IgA, hemodialýza)
- modulace metabolizmu kyseliny arachidonové (kyselina acetylsalicylová, nesteroidní antirevmatika – nástup akutních příznaků je postupnější, asi do 30–60 min)
- ostatní (fyzická zátěž, chlad, idiopatická anafylaxe) [5–7]
Etiopatogeneze anafylaxe
IgE mediovaná anafylaxe
Mohutné uvolnění mediátorů z mastocytů a bazofilů je způsobeno imunologickou reakcí zprostředkovanou IgE při opakované expozici senzibilizovaných buněk. K aktivaci a degranulaci mastocytů a bazofilů dochází přes vysokoafinní receptor pro IgE – Fcε-RI. Multivalentní alergeny různého původu jsou schopny vazby na imunoglobuliny IgE, jež jsou navázány na receptory pro Fc fragment molekul imunoglobulinů (Fcε-RI). Vazbou alergenu na specifické IgE protilátky dochází k agregaci a přemostění sousedních receptorů. Přes transmembránový receptor je uskutečněn přenos signálu do buňky, což vede k okamžité degranulaci mastocytů a bazofilů s uvolněním preformovaných mediátorů a cytokinů do tkání (u bazofilů s převahou do krevního oběhu). Tyto změny jsou spojeny s přesunem kalcia z nitrobuněčných zásob. Uvolnění kalcia urychluje degranulaci a současně aktivuje transkripční faktory v jádře buňky. Dochází k nové tvorbě mediátorů, cytokinů s následnou exocytózou těchto látek do tkání.
Granula buněk obsahují zejména histamin – biogenní amin, který způsobuje bronchokonstrikci, zvýšenou sekreci hlenu v dýchacích cestách, vazodilataci a zvýšenou permeabilitu stěn venul. V časné fázi je uvolňován zejména mastocyty, následně více bazofily. Dalšími významnými preformovanými mediátory anafylaxe v mastocytových granulích je skupina proteázy (tryptáza, chymáza, katepsin G, karboxypeptidáza A, kininogenáza), z nichž zejména tryptáza má významnou úlohu. Existují 2 formy tryptázy – α a β, z nichž α-tryptáza je secernována konstitučně a β-tryptáza pouze při degranulaci mastocytů. V průběhu anafylaxe hodnota sérové β-tryptázy vrcholí do 60–90 min a přetrvává 6–12 hod po epizodě, což bývá využíváno v diagnostice. Tryptáza má řadu biologických účinků, některé se překrývají s účinky histaminu. Tryptáza je schopna inaktivovat vazoaktivní intestinální peptid (VIP), který má bronchodilatační účinek. Zvyšuje expresi adhezivních molekul a působí chemotakticky na eozinofily. Z řady proteáz je třeba jmenovat též kininogenázu, která napomáhá tvorbě vazoaktivního bradykininu. Bazické proteoglykany (heparin, chondroitinsulfát), které tvoří součást obsahu granul, mají schopnost stabilizace uvedených proteáz.
Přemostění IgE na povrchu mastocytů vede k aktivaci fosfolipázy A2, která se soustřeďuje na jaderné membráně. Fosfolipáza A2 je schopna uvolnit z membránových fosfolipidů kyselinu arachidonovou, která je dále metabolizována cyklooxygenázovou a 5-lipoxygenázovou cestou. Při metabolizaci cyklooxygenázou je hlavním produktem u mastocytů PGD2, který působí bronchokonstrikčně, podílí se na cévní permeabilitě a vazodilataci, je schopen přímé aktivace eozinofilů. Metabolizací kyseliny arachidonové 5-lipoxygenázovou cestou jsou produkty u mastocytů a eozinofilů leukotrieny. Leukotrien B4, zvyšuje expresi adhezivních molekul na leukocytech. Cysteinyl-leukotrieny LTC4, LTD4 a LTE4 odpovídají za prolongovanou bronchokonstrikci, nárůst kapilární permeability, působí chemotakticky pro eozinofily a neutrofily. Dalším produktem, který vzniká při metabolizaci kyseliny arachidonové je faktor aktivující destičky (PAF) s obdobnými účinky předchozích metabolitů. K syntéze nově tvořených mediátorů dochází během několika minut po aktivaci buněk.
Rozvoj anafylaxe podporuje řada cytokinů produkovaných mastocyty a bazofily, jež patří převážně do spektra Th2 cytokinové odpovědi. Interleukiny 4 a 13 podporují tvorbu IgE protilátek. Interleukin 5 působí jako proliferační pro eozinofily – IL5. Je uvolňován faktor stimulující tvorbu granulocytů a monocytů (GM-CSF). TNFα zvyšuje expresi adhezivních molekul na endotelu a umožňuje vycestování eozinofilů a neutrofilů mimo cévní řečiště.
Z kaskádovitého účinku výše uvedených mediátorů je zřejmé, že mají bezprostřední klinický efekt – způsobují bronchokonstrikci, laryngální edém, kontrakce hladké svaloviny, zvýšenou permeabilitu cév a vazodilataci vedoucí k poklesu krevního tlaku se všemi důsledky.
Určitou roli sehrávají i faktory neurogenní [7,8].
Non IgE mediovaná anafylaxe
Aktivace komplementu a koagulačního systému může být příčinou reakce, při které vznikají tzv. anafylatoxiny C3a a C5a, které jsou schopny degranulovat mastocyty a bazofily. Současně se u nich předpokládá přímý účinek na specifické buněčné receptory s kontrakcí hladkých svalů a zvýšené cévní permeability. Typickým příkladem v praxi je substituční léčba intravenózními imunoglobuliny u pacientů s přítomností protilátek IgG proti IgA. Je uváděno, že až polovina nemocných s deficitem IgA tyto protilátky má. Bývají přítomny u polytransfundovaných pacientů. Nemusí se jednat pouze o IgG protilátky, terapeutické podání imunoglobulinů může být provázeno rizikem vzniku již preformovaných imunitních komplexů nebo agregátů molekuly IgG, které jsou schopny aktivace komplementu.
Aktivace komplementu může být spuštěna působením dialyzační membrány (kupramoniová celulóza). Tento materiál přímo uvolňuje C3a a C5a fragment a způsobí degranulaci bazofilů a mastocytů. Vývojově starší vysoce ionizující radiokontrastní látky jsou schopny měnit konformaci C3 a C4 a aktivovat komplementový systém. Účinek těchto látek je však kombinovaný, neboť díky své vysoké osmolalitě jsou též řazeny mezi přímé histaminoliberátory.
Některé terapeutické a diagnostické látky jsou schopny přímo působit na mastocyty/bazofily a okamžitě je degranulovat. Stav může nastat již při prvním podání farmaka. Přesný mechanizmus není znám, uvažuje se o vlivu vysoké nebo nízké osmolality látky. Mezi tuto skupinu jsou řazeny opiáty, RTG-kontrastní látky, myorelaxancia, dextran a jiné plazmatické expandery.
Kyselina acetylsalicylová a nesteroidní antirevmatika jsou schopny vyvolat u disponovaných jedinců systémovou reakci. Etiologicky se uvažuje o modulaci metabolizmu kyseliny arachidonové se snížením aktivity cyklooxygenázy a převážením 5-lipoxygenázové cesty s tvorbou cysteinyl-leukotrienů. K této skupině léků lze pravděpodobně přiřadit i potravinářské konzervační látky (benzoáty) a barviva (tartrazin), které však raritně způsobují systémovou anafylaxi.
Pokud i přes komplexní vyšetření není příčina a mechanizmus anafylaxe u pacienta objasněn, hovoříme o tzv. idiopatické anafylaxi. Někteří jedinci s neurčenou příčinou anafylaxe neodpovídají ani na dlouhodobé podávání perorálních kortikosteroidů ve vysokých dávkách. Jedná se o maligní typ idiopatické anafylaxe, která je stanovena jako diagnóza vylučovací. Jsou diskutovány možné patofyziologické cesty – autoimunita vůči IgE, nekontrolovaná degranulace buněk, porucha regulace histaminu. Lze očekávat, že se nebude jednat o jeden typ onemocnění [6–8].
Klinická manifestace a diagnostika anafylaxe
Podmínkou úspěšného zvládnutí reakce je rychlé a správné stanovení diagnózy. Anafylaxe nemá u akutního pacienta jasný diagnostický test s definovanou výpovědní hodnotou, diagnóza anafylaxe je čistě klinická. V tab. 1 jsou uvedeny systémy, ve kterých se anafylaktické příznaky projevují [7,9,10].
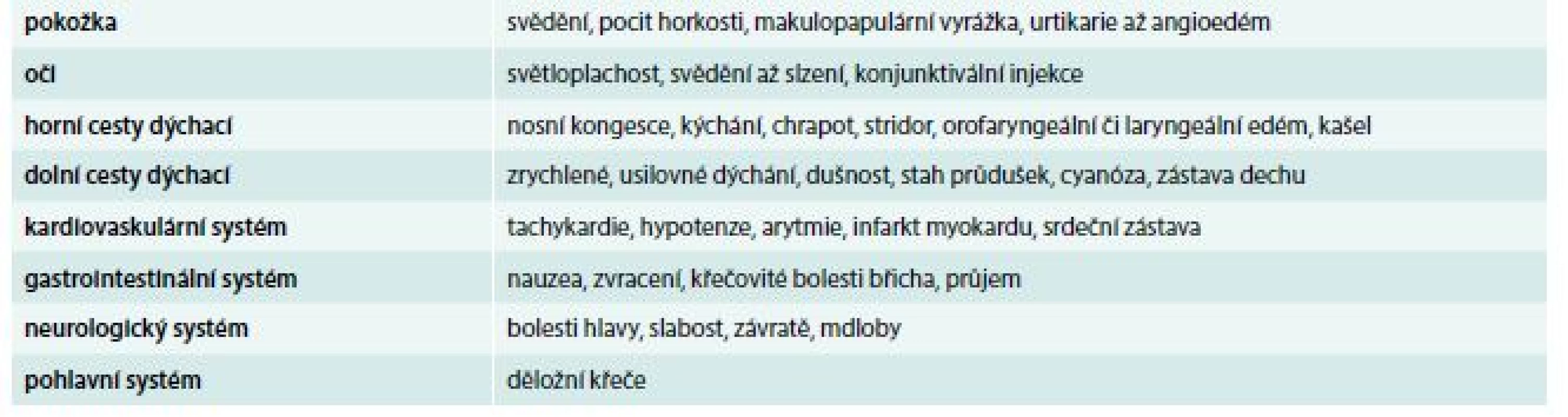
Příznaky anafylaxe se rozvíjejí v průběhu vteřin až minut. Některé reakce však nastávají až s odstupem 30 min i déle. Přibližně ve 20 % případů jsou popisovány opožděné nebo bifázické reakce s příznaky, které se objeví 8–12 hod po úvodní atace. Nelze vyloučit i následné příznaky s delším časovým odstupem v rozmezí 24–72 hod. Nástup anafylaxe začíná často kožními příznaky, následuje nauzea, usilovné dýchání, tíha na hrudi, bolesti břicha. Je nutné stále hodnotit stav vědomí, jehož zhoršení může signalizovat mozkovou hypoxii. Z hlediska vitálních funkcí jsou nejzávažnější respirační projevy (chrapot, stridor, kašel, pískoty, zrychlené a zkrácené dýchání) a kardiovaskulární příznaky (nástup hypotenze, tachykardie, srdečních arytmií). Smrt při anafylaxi nastává na podkladě generalizované obstrukce dýchacích cest a oběhového selhání [11].
Arteriální hypotenze je definována uvedenými hodnotami:
- dospělí: pokles systolického krevního tlaku (STK) < 90 mm Hg nebo pokles STK o 30 %
- děti: 1 měsíc až 1 rok: pokles STK < 70 mm Hg, 1 rok až 10 let: pokles STK < 70 mm Hg + (2 × věk), 10 let až 17 let: pokles STK < 90 mm Hg
Arteriální hypotenzi v diagnostice odpovídá klinická manifestace celkové hypotonie, synkopy (či mdlobám), inkontinence [12].
Anafylaxe je vysoce pravděpodobná, pokud je splněno jakékoliv z následujících 3 kritérií. Upraveno podle [1]
- akutní nástup příznaků (několik minut až několik hodin) s kožními, slizničními projevy nebo obojí (např. generalizovaná kopřivka, pruritus, erytém, otok rtů, jazyka, uvuly) a nejméně jeden z následujících:
- a) respirační příznaky – např. dyspnoe, pískoty při bronchospazmu, stridor, snížené hodnoty PEF (Peak Expiratory Flow), hypoxemie
- b) snížení hodnot TK nebo s hypotenzí související příznaky – např. hypotonie (kolapsový stav) synkopa, inkontinence
- dva nebo více z následujících příznaků, které se objeví rychle po expozici pro pacienta uvažovaným alergenem (několik minut až několik hodin):
- a) kožní a slizniční příznaky – např. generalizovaná kopřivka, pruritus, erytém, otok rtů, jazyka, uvuly
- b) respirační příznaky – např. dyspnoe, pískoty při bronchospazmu, stridor, snížené hodnoty PEF, hypoxemie
- c) snížení hodnot TK nebo s hypotenzí související příznaky – např. hypotonie (kolapsový stav) synkopa, inkontinence,
- d) gastrointestinální příznaky – např. křečovité bolesti břicha, zvracení
- snížená hodnota TK po expozici pro pacienta známému alergenu (několik minut až několik hodin):
- a) kojenci a děti: nízký STK (specifický pro věk) nebo pokles STK o více než 30 %
- b) dospělí: STK < 90 mm Hg nebo snížení o výše než 30 % výchozí hodnoty STK pacienta
V akutním stavu směřujeme k rychlému terapeutickému řešení. Až následně bychom měli detailně rozebrat veškeré příčiny, včetně seznamu potravin, informace o bodnutí hmyzem a požití léků před akutní příhodou. Existují určité rizikové faktory a okolnosti pro rozvoj anafylaxe, které jsou pro konkrétního pacienta specifické. Souběžné nekontrolované astma je významným rizikovým faktorem anafylaxe až fatální anafylaxe [13,14]. Choroby žírných buněk (syndrom aktivace mastocytů, mastocytóza), zvýšené koncentrace sérové tryptázy, kardiovaskulární onemocnění jsou taktéž spojeny se zvýšeným rizikem těžké anafylaxe [15–17].
Specifický faktor představují alergeny. Pacienti s alergií na arašídy a stromové ořechy jsou vystaveni zvýšenému riziku závažných příznaků. U pacientů s alergií na hmyzí jed se vyskytuje závažný průběh anafylaxe u starších osob, zejména s kardiovaskulárními onemocněními. Mezi rizikové faktory je uváděna léčba β-adrenergními blokátory nebo inhibitory angiotenzinkonvertujícího enzymu (ACE) [18,19].
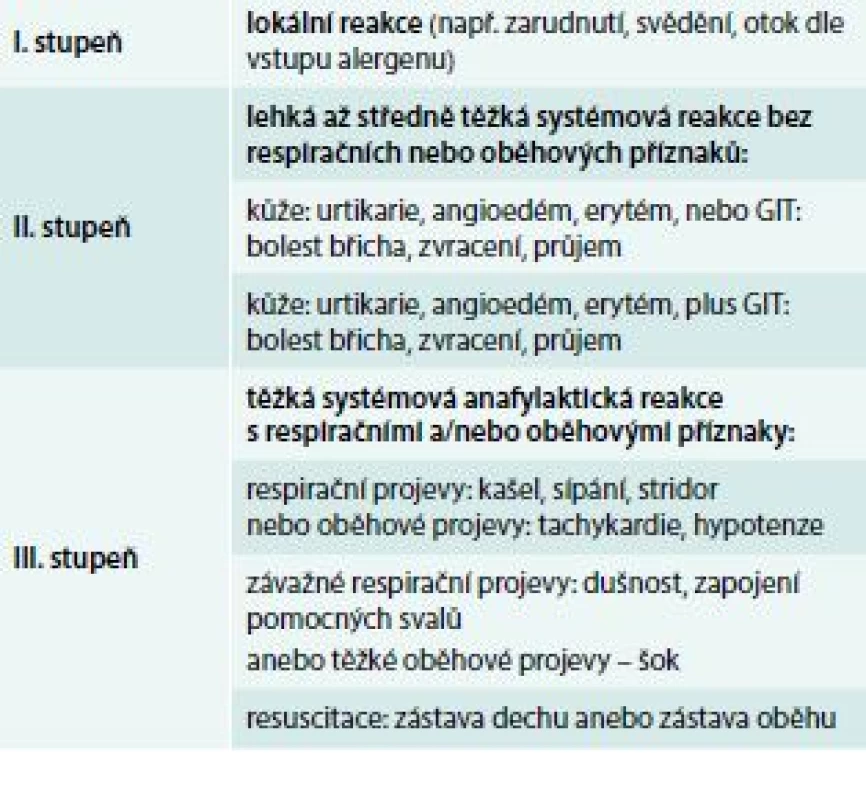
Pro klinický popis a léčbu anafylaxe je vhodné klasifikovat její tíži. Jednoduché a recentní dělení je uvedeno v tab. 2 [20]. V 1. stupni jsou zařazeny reakce lokální, nesystémové, ve 2. stupni reakce závažnější, systémové, ale bez respiračních nebo oběhových projevů. Ve 3. stupni jsou těžké reakce s postižením dechu anebo oběhu. Adrenalin jako lék první volby je zásadní aplikovat ve stupni 2. a 3. [2].
Přídatným diagnostickým postupem je laboratorní diagnostika anafylaxe
Hlavním mediátorem anafylaxe, uvolňujícím se při degranulaci žírných buněk a bazofilů a hlavní měrou se podílejícím na klinické symptomatologii anafylaxe, je histamin. Nabízelo by se tudíž stanovení histaminu v séru pacienta. Histamin však podléhá rychlé metabolizaci, hladina histaminu v plazmě narůstá do 5–10 min po začátku anafylaxe a rychle klesá po již 30–60 min. Déle setrvávají jeho metabolity (metylhistamin) v moči, je uváděno až do 24 hod po nástupu ataky. Toto vyšetření se rutinně neprovádí.
Test, který je dostupný a někdy diagnosticky přínosný, je stanovení tryptázy v séru. Tryptáza je mediátor uvolňovaný z mastocytů. Tryptáza je vyšetřována pomocí fluoroimunoanalýzy a rozmezí u zdravých osob je uváděno mezi 5,6–13,5 μg/l. Provedení 2 odběrů – při reakci a s odstupem 24 hod či později – zvyšuje při diagnostických rozpacích senzitivitu vyšetření [2,7,21].
Diferenciální diagnostika anafylaxe
Anafylaktický šok bychom měli však odlišit od jiných cirkulačních kolapsů. Nejčastěji bývá anafylaxe zaměňována s vazovagální synkopou, která je taktéž provázena hypotenzí. Její další příznaky jsou odlišné – chybí kopřivka, bývá sklon k bradykardii spíše než k tachykardii. Hyperventilace sice může vyvolat pocit dušnosti spojený s paresteziemi, není však přítomen bronchospazmus či jiné typické respirační projevy. Pokožka je chladná a bledá. Stav obvykle spontánně odeznívá ve vodorovné poloze s postupnou normalizací krevního tlaku.
Pokud vznikne krátké bezvědomí bez kožních příznaků, měli bychom uvažovat zejména v dětském věku o aspiraci cizího tělesa. U dospělých pacientů přichází v úvahu spíše infarkt myokardu, arytmie s náhlým hemodynamickým kolapsem či plicní embolizace.
Okamžité neurologické symptomy až s dramatickým nástupem bezvědomí mohou vzniknout při intravenózní aplikaci suspenzních preparátů, kdy dochází k mikroembolizaci do CNS. Rychlý vznik příznaků tak může imitovat anafylaxi.
Méně dramatická, ale s možnou záměnou za reakci IgE zprostředkovanou, může být Jarish-Herzheimerova reakce při intenzivní léčbě antibiotiky. Dochází ke vzniku výrazných exantémů v důsledku masivního uvolnění endotoxinů usmrcených bakterií. V následném osudu pacienta pak mohou být zbytečně vyloučena např. β-laktamová antibiotika z jeho terapie.
Napodobovat příznaky anafylaxe mohou ataky pocitu tepla a zčervenání. Anamnéza by vždy měla obsahovat současnou farmakoterapii pacienta. Některé léky a požité látky (jako niacin, nikotin, katecholaminy, ACE inhibitory, vankomycin, alkohol) mohou indukovat erytém.
Z dalších příčin provázených pocity horkosti a erytémem jsou gastrointestinální a tyreoidální tumory, karcinoid, feochromocytom, hyperglykemie, postmenopauzální návaly horkosti. Laboratorní analýza by měla být nápomocná ve zjištění kauzality.
Výrazným erytémem se mohou prezentovat též postprandiální syndromy, z nichž nejznámější je reakce způsobena glutamanem sodným („syndrom čínských restaurací“). Obdobné příznaky mohou nastat po požití látek s vyšším obsahem sulfitů.
Kožní projevy mohou nastupovat u cholinergní urtikarie, která se rozvíjí při vzestupu tělesné teploty zejména s vazbou na fyzickou zátěž a vzrušení. Systémová mastocytóza, kterou charakterizuje proliferace mastocytů v různých orgánech, je též provázena kožními příznaky. Projevy u této choroby nebývají osamoceny. Pacient trpí gastrointestinálním postižením a často nečekaně nastupující anafylaxí až s oběhovým selháním.
V rámci diferenciální diagnostiky přichází v úvahu taktéž hereditární angioedém, pro který jsou symptomy kožní (typické nesvědivé otoky) a slizniční (otok laryngu) s postižením břišních orgánů a imitací náhlé příhody břišní. Klinické projevy mohou být izolované, méně častý je výskyt více příznaků. Otok laryngu bývá vzácný, ale asfyxie se podílí na mortalitě až ve 30 %. Nežádoucí vedlejší účinky podobné projevům hereditárního angioedému mohou mít inhibitory angiotenzinkonvertujícího enzymu (ACE) s incidencí do 0,2 % [7].
Léčba anafylaxe
Lékařská ambulantní (terénní) pomoc spočívá v zajištění základních životně důležitých funkcí (ABC – Airway, Breathing, Circulation). Tak jako u jiných akutních stavů je zásadní zajištění průchodných dýchacích cest a zajištění oběhu, aplikaci farmak (viz níže), kyslíku, a v případě potřeby i pokračování resuscitačních postupů. Pacient je transportován na jednotku intenzivní péče nebo oddělení ARO nejbližší nemocnice. I po rychlém zvládnutí šokového stavu je nutno pacienta nejméně na 24 hod hospitalizovat pro možnost rizika pozdní reakce.
Způsob léčby není závislý vyvolávající příčině, ale na akutním stavu pacienta. Dle doporučení EAACI jsou léčebné postupy rozděleny do 3 postupných úrovní, v klinické praxi při akutním stavu se určitě úrovně léčby rychle prolínají [1].
Léčebná intervence 1. linie
Adrenalin je lékem první volby v léčbě anafylaxe a neexistuje žádná kontraindikace podání adrenalinu u anafylaxe. Jakmile je anafylaxe diagnostikována (anamnéza, klinická symptomatologie), je správně dávkovaná nitrosvalová aplikace adrenalinu zásadní včasnou léčbou. Lék by měl být podán včasně vždy i u pacientů s klinickými rysy anafylaktických příznaků, neboť nelze nikdy vyloučit rychlou progresi do systémové anafylaxe [10,22,23].
Adrenalin je silným stimulátorem α-adrenergních i β-adrenergních receptorů sympatiku.
Adrenalin působí na receptory α1, čímž navodí periferní vazokonstrikci, omezí rozvoj hypotenze a sníží slizniční edém. Adrenalin zvyšuje krevní tlak přímým působením na myokard (receptory β1) se zvýšením rychlosti a síly srdečních kontrakcí (účinek inotropní a chronotropní), čímž se omezí rozvoj hypotenze. Důležitým účinkem adrenalinu s působením na receptory β2 je dilatace hladkých svalů, což je výhodné zejména u bronchospazmu s navozením bronchodilatace. Adrenalin snižuje uvolňování zánětlivých mediátorů.
Přínosy léčby převyšují vždy rizika, lék by měl být aplikován i u pacientů seniorského věku a u pacientů s již existujícím kardiovaskulárním onemocněním.
Adrenalin by měl být podán intramuskulární injekcí do střední oblasti laterálního stehna. Bezpečnostní profil intramuskulárního adrenalinu je vynikající, přesto mohou pacienti zaznamenat přechodnou bledost, palpitace a bolesti hlavy [2,22,24].
Intramuskulární adrenalin (1 mg/ml) by měl být podáván v dávce 0,01 ml/kg tělesné hmotnosti do maximální jednorázové celkové dávky 0,5 ml. Při použití autoinjektorů s obsahem adrenalinu by pacienti s hmotností mezi 7,5–25 kg měli dostat 0,15 mg dávku, pacienti s hmotností nad 25 kg by již měli mít aplikovanou dávku 0,3 mg. Dávka se může opakovat po nejméně 5minutovém intervalu v závislosti na klinickém stavu, pulzové frekvenci a výši krevního tlaku.
Infuzní aplikace adrenalinu by měla být omezena na pacienty, kteří nemohou být stabilizováni opakovanými dávkami intramuskulárního adrenalinu. Zejména při rozvoji respiračních nebo oběhových symptomů (laryngospazmus, arteriální hypotenze – šok) je nezbytné podat adrenalinu intravaskulárně bolusově 5–50 μg (50 μg = 0,5 ml 1 : 10 000) i. v. Další titrace dávky jsou aplikovány dle účinku v kontinuálním i.v. podání. Intravenózní adrenalin u pacientů může způsobit život ohrožující hypertenzi, ischemii myokardu a arytmie. Pacienti by měli být důsledně monitorováni.
Použití subkutánního nebo inhalovaného adrenalinu v léčbě anafylaxe se v současné době nedoporučuje, kromě jedné výjimky. Jedná se o laryngeální edém se stridorem, v tomto případě kromě intramuskulárního adrenalinu lze užít i nebulizovaný adrenalin (2–5 ml, 1 mg/ml) [1,25].
Léčebná intervence 2. linie
Druhá léčebná intervence spočívá v odstranění spouštěče (pokud vůbec lze).
Včasné zajištění žilního vstupu je u pacienta zásadní, než se plně rozvine hypotenze. Agresivní infuzní terapie (krystaloidní roztoky, 10–20 ml/kg) je důležitá zejména u nemocných při přetrvávající arteriální hypotenzi nereagující na podávání katecholaminů. Kyslík s vysokým průtokem by měl být aplikován maskou u všech pacientů s anafylaxí.
Inhalační β2-agonisté s krátkodobým účinkem (např. salbutamol) mohou být podávány inhalačně k úlevě od příznaků bronchokonstrikce [1,14]. β2-agonisté stimulují β receptory sympatiku s následnou bronchodilatací. Nejúčinnější je inhalační podání aerosolových forem pomocí nástavců. Aplikujeme 4 dávky, pokud není terapeutická odezva, dávky po několika minutách opakujeme. V rámci nemocničního léčení je výhodné podávat salbutamol v inhalaci přes nebulizér v dávce 2,5–3 mg naředěno ve 3 ml fyziologického roztoku. Při malé odpovídavosti na léčbu β2-mimetiky byly v předchozích doporučeních uváděny v terapii metylxantiny, v současných doporučeních tato léková skupina z terapeutických intervencí mizí.
Důležitá je poloha pacienta. Pacienti s anafylaxí by měli být polohováni dle jejich klinických příznaků:
- s projevem dechové tísně je preferenční pozice vsedě,
- při cirkulační nestabilitě je vhodná ležící poloha se zvýšenými dolními končetinami k zachování krevního objem,
- pokud je přítomna gravidita, je preferována částečná poloha na levé straně se zvýšenými dolními končetinami,
- pokud je pacient v bezvědomí, je obvykle zvolena stabilizovaná poloha. Pacient s probíhající anafylaxí by se měl vyhnout náhlému přechodu do vzpřímené polohy [1,7,24].
Léčebná intervence 3. linie
Systémová antihistaminika se běžně používají při anafylaxi, ale jejich účinky byly dokumentovány pouze ve zmírnění kožních příznaků. Kombinace systémových H1 a H2 antihistaminik může přinést další výhody nad systémovými H1 antihistaminikami. Nástup účinku antihistaminik je ve srovnání s adrenalinem pomalejší a jsou indikovány v dnešní době zejména proti rozvoji urtikarie. V našich podmínkách nejčastěji užívaným antihistaminikem je promethazin (Promethazin) nebo bisuleptin (Dithiaden). Dithiaden se podává dospělým v dávce 1 mg, tj. 2 ml pomalu intravenózně a v případě potřeby lze dávku navýšit až do 8 mg/24 hod. Dávka pro děti od 2 do 6 let je 0,5 mg (max. 3 mg/24 hod), děti od 7 do 14 let dostanou 1 mg (max. 6 mg/24 hod). Existují kazuistická sdělení o intravenózním podání antihistaminika s rizikovým nárůstem hypotenze, což může to souviset s rychlostí podávání [1,26].
Aplikace kortikosteroidů má význam až pro léčbu pozdní fáze anafylaxe. Předpokládá se, že mohou omezit prodloužení příznaků anafylaktické reakce (zejména bifazické reakce). Zejména jsou indikovány u pacientů s bronchiálním astmatem.
Účinek systémové aplikace kortikosteroidů začíná působit až po 4–6 hod po podání. Vzhledem k tomu, že v počátku šoku nejsme plně schopni rozpoznat další vývoj, je doporučeno je podat hned po aplikaci adrenalinu a antihistaminik. Iniciální intravenózní dávka je 1–2 mg/kg váhy metylprednisolonu i. v. à 6 hod (či Prednison 50 mg p. o. à 6 hod) nebo ekvivalent jiného kortikosteroidu (metylprednisolon 125 mg i. v. = Prednison 50 mg p. o.).
Kortikosteroidy snižují exsudaci plazmy, sekreci hlenu, snižují infiltraci tkání eozinofily, zvyšují vnímavost beta receptorů hladkých svalů dýchacích cest. Následně omezují progresi alergického zánětu.
Při léčbě pacientů s anafylaxí, kteří nereagují na adrenalin, zejména u pacientů na léčbě betablokátory, může být užitečné podání glukagonu. Dávkování glukagonu je uváděno 1–5 mg v infuzi na 5 min (děti 20–30 μg/kg do max. dávky 1 mg), v kontinuální infuzi 5–15 μg/min. Při progresi hypotenze jsou v léčbě nezbytné vazopresory (noradrenalin v infuzi 0,05–0,1 μg/kg/min, vasopressin 2–10 IU i. v. až do léčebného efektu – tj. střední arteriální tlak nad 60 mm Hg) [27].
V případě, že se podařilo zvládnout šokový stav a nemocný je stabilizován, musí být zajištěna na dobu minimálně 24 hod jeho observace na lůžkovém oddělení.
Následná péče
Před propuštěním z lékařské péče je nutno nemocného poučit a vybavit jej léky první pomoci včetně písemného návodu. Každý rizikový pacient by měl být vybaven tzv. protišokovým balíčkem, jehož součástí je adrenalin v autoinjektoru, kortikoid, antihistaminikum a inhalační β2-sympatomimetikum (tab. 3). Preskripce adrenalinu v autoinjektoru dnes již není vázána na alergologa/imunologa, lék je zcela bez preskripčního omezení. Bohužel, z hlediska legislativních omezení, není možné autoinjektory s adrenalinem umístit volně do školních zařízení, jak je laickou veřejností občas požadováno.

Autoinjektorem s adrenalinem mají být vybaveni pacienti, kteří již anafylaxi prodělali nebo jsou ve vysokém riziku vzniku anafylaxe. Ve vysokém riziku jsou zejména pacienti s nestabilním a/nebo těžkým astmatem a současně s klinicky významnou potravinovou alergií (s výjimkou orálního alergického syndromu), zejména se senzibilizací na proanafylaktické potravinové komponenty.
Autoinjektor s obsahem 0,15 mg je určen pro děti vážící 7,5–25 kg, pacienti s hmotností nad 25 kg by měli užít autoinjektor s obsahem 0,3 mg. Pro použití autoinjektoru s obsahem adrenalinu 0,5 mg nejsou k dispozici dostatečná data – měl by být doporučován dospělým pacientům s obezitou (BMI nad 30,0 kg/m2), u dospělých pacientů s anamnézou velmi závažné (až fatální) anafylaxe a u dospělých pacientů, u kterých byla u předchozí anafylaxe potřeba opakovaného použití dávky 0,3 mg [1,2,22,25].
Ač je plná dávka adrenalinu z autoinjektoru podána již během 3 s, přesto je doporučováno v místě intramuskulární aplikace (laterální strana stehenní) ponechat jehlu po dobu 10 s a následně místo vpichu adrenalinu masírovat [2,22]. Pacient by měl být o použití autoinjektoru řádně poučen, včetně praktického nácviku (edukační materiály, trenažér a zápis o nácviku do dokumentace). V České republice máme v současnosti k dispozici 2 typy adrenalinových autoinjektorů, Epipen a Emerade. Obsluha každého z nich se v detailech liší. Exspirační doba autoinjektorů je 18 měsíců a celoživotně je nezbytné dbát na jejich exspiraci vzhledem k degradaci adrenalinu.
S injekcí adrenalinu podáváme perorálně (u malých dětí možno rektálně) glukokortikoidy (např. 2 tbl Prednisonu 20 mg, event. Rectodelt čípek à 100 mg) a antihistaminikum. Rychlejší účinek má sublinguální aplikace v kapičkové formě. V případě vzniku astmatické dušnosti je nutná inhalace 4 dávek β2-sympatomimetika (Ecosal Inhaler, Ventolin Inhaler N apod.). Nemocného v šoku je nutno uložit do Trendelenburgovy polohy se záklonem hlavy, uvolnit dýchací cesty a popřípadě zahájit kardiopulmonální resuscitaci [2,7].
Za určitých podmínek nemusí jedna aplikovaná dávka adrenalinu v autoinjektoru zajistit dostatečný účinek. Proto EMA (European Medicines Agency) a SÚKL doporučují předpis dvou balení adrenalinového autoinjektoru, které by měl mít pacient vždy u sebe.
Toto doporučení upřesňuje Evropská akademie alergologie a klinické imunologie (EAACI) a uvádí situace vhodné k vybavení pacienta druhým autoinjektorem:
- předchozí téměř fatální anafylaxe
- předchozí užití více než jedné dávky adrenalinu
- pokud je dávka v jednom autoinjektoru příliš nízká z důvodu vyšší tělesné hmotnosti pacienta
- současná přítomnost nestabilního nebo středně těžkého až těžkého perzistujícího astmatu a klinicky významné potravinové alergie (s výjimkou orálního alergického syndromu)
- současná přítomnost onemocnění žírných buněk nebo zvýšení bazální hladiny tryptázy
- obtížná dostupnost lékařské péče, např. z geografických nebo jazykových důvodů
Uvedené doporučení je v souhlasu s doporučením České společnosti alergologie a klinické imunologie. V klinické praxi převažují pacienti s jedním autoinjektorem, pokud anafylaktické příznaky nebyly významně závažné. Rozhodnutí je vždy na ošetřujícím lékaři.
Možnosti prevence anafylaxe
K následné diagnostice a péči je důležité doporučit nemocného k alergologickému vyšetření. Soubor preventivních opatření obsahuje anamnestický rozbor před podáním farmak, eliminaci kontaktu s anafylaktogenními látkami, imunoprofylaxi (antihistaminika, u potravinové alergie perorální kromony) a u hmyzí alergie specifickou alergenovou imunoterapii. U anafylaktických reakcí, vyvolaných hmyzím jedem, je alergenová imunoterapie kauzálním postupem vitální indikací. Terapeutickou efektivitu prokázala pouze injekční forma standardizovaných alergenových vakcín, podávaná po dobu 3–5 let, i déle. Tento léčebný postup je prováděn na specializovaných pracovištích oboru alergologie a klinické imunologie. Účinnost alergenové imunoterapie hmyzím jedem je vysoká, u vos více než 90% a u včel v 75–80 % [28]. V oblasti potravinové alergie je schválena v USA orální alergenová imunoterapie v indikaci těžkých alergických reakcí na burské ořechy, v EU není zatím povolena [29].
Závěr
Anafylaxe je život ohrožující, urgentně nastupující, stav s často nepředvídatelným vznikem. Ve srovnání s obdobnými šokovými situacemi má dobrou prognózu, která závisí na rychlosti a kvalitě léčebné péče. Lékem první volby je včasně intramuskulárně podaný adrenalin, u anafylaxe neexistuje žádná kontraindikace jeho podání. Mezi chyby, které mohou stav pacienta v anafylaxi zhoršit, je dlouhý rozbor anamnézy a podcenění prvních symptomů, zbytečná laboratorní vyšetření, chyby ve farmakoterapii a nezajištění přístupu do oběhu.
V osudu rizikového pacienta bývá nedostatkem opomenutí následné péče a vybavení nemocného protišokovým balíčkem, který musí obsahovat adrenalinový autoinjektor, perorální (nebo u malých dětí rektální) kortikosteroid, perorální antihistaminikum, inhalační aerosolové β2-mimetikum a návod k použití. S odstupem několika týdnů po příhodě je indikováno vyšetření pacienta u specialisty oboru alergologie a klinická imunologie.
Podpořeno Univerzitou Karlovou, Lékařskou fakultou v Hradci Králové. Projekt č. PROGRES Q40/10.
prim. MUDr. Irena Krčmová, CSc.
Ústav klinické imunologie a alergologie LF UK a FN Hradec Králové
Doručeno do redakce 22. 11. 2018
Přijato po recenzi 26. 11. 2018
Sources
-
Muraro A, Roberts, G, Worm M et al. Anaphylaxis: guidelines from European Academy of Allergy and Clinical Immunology. Allergy 2014; 69(8): 1026–1045. Dostupné z DOI: <http://doi: 10.1111/all.12437>.
-
Petrů V. Chyby a omyly v diagnostice a léčbě anafylaxe. Postgrad Med 2017; 19(3): 285–290.
-
Tanno LK, Ganem F, Demoly P et al. Undernotification of anaphylaxis deaths in Brazil due to difficult coding under the ICD-10. Allergy 2012; 67(6): 783–789. Dostupné z DOI: <http://dx.doi.org/10.1111/j.1398–9995.2012.02829.x>.
-
Panesar SS, Nwaru B, Hickstein L et al. The epidemiology of anaphylaxis in Europe: protocol for a systematic review. Clin Transl Allergy 2013; 3(1): 9. Dostupné z DOI: <http://dx.doi.org/10.1186/2045–7022–3-9>.
-
Worm A, Moneret-Vautrin AM, Scherer K et al. First European data from the network of severe allergic reaction (NORA). Allergy 2014; 69(10): 1397–1404. Dostupné z DOI: <http://dx.doi.org/10.1111/all.12475>.
-
Finkelman F, Khodoun M, Strait R. Human IgE-independent systemic anaphylaxis. J Allergy Clin Immunol 2016; 137(6): 1674–1680. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jaci.2016.02.015>.
-
Petrů V, Krčmová I. Anafylaktická reakce. Maxdorf Jessenius: Praha 2006 : 3–95. ISBN 80–7345–099–2.
-
Krejsek J, Andrýs C, Krčmová I. Imunologie člověka. Garamon: Hradec Králové: 2016 : 213–221. ISBN 978–80–86472–74–4.
-
Mehr S, Liew WK, Tey D et al. Clinical predictors for biphasic reactions in children presenting with anaphylaxis. Clin Exp Allergy 2009; 39(9): 1390–1396. Dostupné z DOI: <http://dx.doi.org/10.1111/j.1365–2222.2009.03276.x>.
-
Park HJ, Kim SH. Factors associated with shock in anaphylaxis. Am J Emerg Med 2012; 30(9): 1674–1678. Dostupné z DOI: <http://dx.doi.org/10.1016/j.ajem.2012.01.015>.
-
Simons FER, Clark S, Camargo CA Jr. Anaphylaxis in the community: learning from the survivors. J Allergy Clin Immunol 2009; 124(2): 301–306. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jaci.2009.03.050>.
-
Soar J, Perkins GD, Abbas G et al. European Resuscitation Council Guidelines for Resuscitation 2010 Section 8. Cardiac arrest in special circumstances: electrolyte abnormalities, poisoning, drowning, accidental hypothermia, hyperthermia, asthma, anaphylaxis, cardiac surgery, trauma, pregnancy, electrocution. Resuscitation 2010; 81(10): 1400–1433. Dostupné z DOI: <http://dx.doi.org/10.1016/j.resuscitation.2010.08.015>.
-
Bock SA, Munoz-Furlong A, Sampson HA. Further fatalities caused by anaphylactic reactions to food, 2001–2006. J Allergy Clin Immunol 2007; 119(4): 1016–1018. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jaci.2006.12.622>.
-
Pumphrey RS. Lessons for management of anaphylaxis from a study of fatal reactions. Clin Exp Allergy 2000; 30(8): 1144–1150.
-
Braganza SC, Acworth JP, McKinnon DR et al. Paediatric emergency department anaphylaxis: different patterns from adults. Arch Dis Child 2006; 91(2): 159–163. Dostupné z DOI: <http://dx.doi.org/10.1136/adc.2004.069914>.
-
Calvani M, Cardinale F, Martelli A et al. Risk factors for severe pediatric food anaphylaxis in Italy. Pediatr Allergy Immunol 2011; 22(8): 813–819. Dostupné z DOI: <http://dx.doi.org/10.1111/j.1399–3038.2011.01200.x>.
-
Gonzalez-Perez A, Aponte Z, Vidaurre CF et al. Anaphylaxis epidemiology in patients with and patients without asthma: a United Kingdom databas review. J Allergy Clin Immunol 2010; 125(5): 1098–1104. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jaci.2010.02.009>.
-
Hamilton MJ, Hornick JL, Akin C et al. Mast cell activation syndrome: a newly recognized disorder with systemic clinical manifestations. J Allergy Clin Immunol 2011; 128(1): 147–152. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jaci.2011.04.037>.
-
Moneret-Vautrin DA. Drugs as risk factors of food anaphylaxis in adults. Facteurs de risque d’anaphylaxie alimentaire severe Role confirme de certaines classes de medicaments. Med Sci (Paris) 2010; 26(8–9): 719–723. Dostupné z DOI: <http://dx.doi.org/10.1051/medsci/2010268–9719>.
-
Niggemann B, Beyer K. Time for a new grading system for allergic reaction? Allergy 2016; 71(2): 135–136. Dostupné z DOI: <http://dx.doi.org/10.1111/all.12765>.
-
De Schryver S, Halbrich M, Clarke A et al. Tryptase levels in children presenting with anaphylaxis. Temporal trends and associated factors. J Allergy Clin Immunol 2016; 137(4): 1138–1142. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jaci.2015.09.001>.
-
Noimark L, Wales J, Du Toit G et al. The use of adrenaline autoinjectors by children and teenagers. Clin Exp Allergy 2012; 42(2): 284–292. Dostupné z DOI: <http://doi: 10.1111/j.1365–2222.2011.03912.x>.
-
Lieberman P. The 10-second rule and other myths about epinephrine and autoinjectors. Ann Allergy Asthma Immunol 2011; 107(3): 189–190. Dostupné z DOI: <http://doi 10.1016/j.anai.2011.07.007>.
-
Simons FER, Gu X, Simons KJ. Epinephrine absorption in adults: intramuscular versus subcutaneous injection. J Allergy Clin Immunol 2001; 108(5): 871–873. Dostupné z DOI: <http:// 10.1067/mai.2001.119409>.
-
Simons F, Ardusso L, Bilo M et al. 2012 Update: World Allergy Organization guidelines for the assessment and management of anaphylaxis. Curr Opin Allergy Clin Immunol 2012; 12(4): 389–399. Dostupné z DOI: <http://dx.doi.org/10.1097/ACI.0b013e328355b7e4>.
-
Lin RY, Curry A, Pesola GR et al. Improved outcomes outcomes in patients with acute allergic syndromes who are treated with combined H1 and H2 antagonists. Ann Emerg Med 2000; 36(5): 462–468. Dostupné z DOI: <http://dx.doi.org/10.1067/mem.2000.109445>.
-
Thomas M. Best evidence topic report. Glucagon infusion in refractory anaphylactic shock in patients on beta-blockers. Emerg Med J 2005; 22(4): 272–273. Dostupné z DOI: <http://dx.doi.org/10.1136/emj.2005.023507>.
-
Váchová M., Panzner P. Diagnostika alergie na Hymenopter. Alergie 2017; 19(3): 173–180.
-
Gagné C. Peanut OIT Therapy Sees Success, Boosting Hope for FDA Approval. Allergic Living: Food Allergy News 2018. Dostupné z WWW: <https://www.allergicliving.com/2018/02/20/peanut-oit-therapy-sees-success-boosting-hope-for-fda-approval/>.
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Internal Medicine

2019 Issue 2
-
All articles in this issue
- Zánět obranný a poškozující: základní charakteristiky
- Cytokiny rodiny IL1 u chronických zánětlivých procesů
- Heterogenita lymfocytov ako ústredných operačných jednotiek imunitného systému
- Mikrobiota, imunita a imunologicky mediované choroby
- Primární imunodeficience u dospělých
- Sekundární imunodeficience jako následek chronických onemocnění
- Léčba humorálních imunodeficiencí
- Nežádoucí účinky imunoglobulinové léčby
- Současné trendy v imunosupresivní léčbě
- Co dnes znamená alergologie pro internu a naopak
- Anafylaktické příznaky a anafylaktický šok
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue
- Anafylaktické příznaky a anafylaktický šok
- Nežádoucí účinky imunoglobulinové léčby
- Současné trendy v imunosupresivní léčbě
- Primární imunodeficience u dospělých
