Cytokiny rodiny IL1 u chronických zánětlivých procesů
IL-1 family cytokines in chronic inflammatory disorders
IL-1 family represent a group of structurally related cytokines with prevailing pro-inflammatory (IL-1α, IL-1β, IL-18, IL-33, IL-36α, IL-36β a IL-37γ) or anti-inflammatory (IL-1Ra, IL-36Ra, IL-38, IL-37) effects. They are involved not only in defense mechanisms and physiological modulation of homeostatic processes, but also in the imunopathogenesis of many diseases including rheumatoid arthritis, inflammatory bowel disease, autoimmune and auto-inflammatory diseases. Recently, advances in biologic therapy enabled blocking of IL-1α, IL-1β, IL-18, and IL-33 with new monoclonal antibodies, soluble receptors, or recombinant binding proteins.
Keywords:
Cytokines – inflammation – interleukin 1
Authors:
Ilja Stříž
Authors‘ workplace:
Pracoviště klinické a transplantační imunologie IKEM, Praha
Published in:
Vnitř Lék 2019; 65(2): 81-85
Category:
Overview
Rodina IL1 představuje skupinu strukturálně příbuzných cytokinů s prozánětlivými (IL1α, IL1β, IL18, IL33, IL36α, IL36β a IL36γ) nebo protizánětlivými (IL1Ra, IL36Ra, IL38, IL37) účinky. Tyto cytokiny se účastní nejen obranných mechanizmů a fyziologické modulace homeostatických dějů, ale i imunopatogeneze řady onemocnění včetně revmatoidní artritidy, nespecifických střevních zánětů, autoimunitních či autoinflamatorních onemocnění. Současné pokroky v oblasti biologické léčby nám umožňují blokování IL1α, IL1β, IL18, a IL33 pomocí monoklonálních protilátek, solubilních receptorů nebo rekombinantních vazebných proteinů.
Klíčová slova:
cytokiny – interleukin – – zánět
Úvod
Veškeré imunitní reakce jsou velmi přísně regulovány prostřednictvím přímých mezibuněčných interakcí nebo solubilních faktorů, mezi kterými zaujímají klíčové místo cytokiny, nízkomolekulární proteiny se schopností specifické vazby na receptorové struktury na cílových buňkách. V patogenetických mechanizmech řady onemocnění se uplatní dysregulace cytokinové rovnováhy, která je zcela zásadní pro zachování homeostázy a k obraně proti vnějším či vnitřním nežádoucím podnětům. Proto jsou také cytokiny studovány jako důležité terapeutické cíle imunomodulačních zásahů [1]. I když v současnosti ještě neexistuje zcela jednotná nomenklatura cytokinů a člení se převážně podle jejich převažující funkce v obranných mechanizmech, s pokrokem molekulární charakterizace se čím dál častěji začínáme setkávat s členěním založeným na strukturální podobnosti a tyto skupiny cytokinů jsou pak nazývány rodinami. Pod označení rodina IL1 řadíme celkem 11 strukturálně podobných cytokinů, které se vyznačují se širokým spektrem lokálních i systémových účinků, kterými stimulují či inhibují reakce v rámci přirozené i adaptivní imunitní odpovědi (schéma 1). Některé cytokiny z rodiny IL1 vyžadují k dosažení aktivní formy enzymatické opracování, v případě IL1β a IL18 se jedná o kaspázu 1, u některých dalších se může jednat o účinek proteáz. Podle délky původní neopracované molekuly se člení zástupci rodiny IL1 do tří podrodin (schéma 2). Do podrodiny IL1 patří IL1α, IL1β a IL33, do podrodiny IL18 řadíme IL18 a IL37 a do podrodiny IL36 počítáme IL36α, IL36β. IL36γ a IL38 [2]. Na regulaci účinku těchto cytokinů se podílí také přítomnost jejich solubilních antagonistů v cirkulaci a exprese nefunkčních receptorů, které nepřenášejí signál. Není pochyb o tom, že právě cytokiny rodiny IL1 hrají klíčovou úlohu nejen v obranných mechanizmech, ale i imunopatogeneze řady chorob.


Podrodina IL1 a receptorový antagonista IL1 (IL1Ra)
IL1α a IL1β jsou charakteristické prozánětlivé cytokiny s řadou lokálních i systémových účinků, které jsou dány skutečností, že se jejich společný receptor [3] vyskytuje na povrchu většiny buněk lidského těla. I když jsou účinky obou těchto cytokinů víceméně totožné, liší se zásadně mechanizmem uvolnění z buňky. Zatímco IL1α se uvolňuje z cytoplazmy převážně během nekrotické smrti buňky a slouží jako tzv. alarmin signalizující nebezpečí, IL1β se vyskytuje v cytoplazmě ve formě inaktivního prekurzoru (proIL1) a získává svou biologickou aktivitu opracováním pomocí kaspázy 1 v inflamasomu. Nejdůležitější funkcí prozánětlivých cytokinů včetně IL1α a IL1β je regulace přísunu zánětlivých buněk do ložiska poškození pomocí indukce adhezivních molekul na povrchu endotelu a tvorby chemokinů, které svým gradientem vyznačují cestu, kam mají buňky migrovat. Ze systémových účinků je nutno zmínit zejména zvýšení tělesné teploty účinkem na přední jádra hypotalamu a indukci proteinů akutní fáze v játrech [4].
Účinek IL1α a IL1β může být kompetitivně tlumen pomocí IL1 receptorového antagonisty (IL1Ra), který má schopnost se též vázat na jejich receptor (schéma 3), ale neumožňuje následnou receptorovou signalizaci. IL1Ra se vyskytuje v cirkulaci v relativně vysokých koncentracích a zřejmě brání nadměrnému systémovému účinku při náhlé lokální nadprodukci IL1α a IL1β, jejichž hladiny jsou u zdravých osob velmi nízké.

Dalším cytokinem podrodiny IL1 je IL33, jehož tvorba je vázána zejména na slizniční kompartmenty, v nichž se podílí na indukci Th2 lymfocytů a jejich cytokinů IL4, IL5 a IL13, kterými aktivuje efektorové buňky alergického zánětu nebo obranu proti parazitárním infekcím [5]. V porovnání s IL1β je přímý prozánětlivý účinek IL33 relativně nízký [6].
Podrodina IL18 (IL18, IL37)
Interleukin 18 (IL18) je prozánětlivý cytokin, původně popsaný jako tzv. IFNγ-indukující faktor, který se podílí na polarizaci k tvorbě Th1 cytokinů, nicméně záhy se ukázalo, že jeho prozánětlivé účinky jsou mnohem komplexnější [7]. Obdobně jako IL1β vyžaduje i IL18 proteolytické opracování do aktivní formy pomocí kaspázy 1 nebo granzymu B. Výskyt receptorů pro IL18 není tak abundantní jako v případě IL1R, nicméně jej nalezneme na řadě imunitních buněk a lze jej pomocí prozánětlivé stimulace indukovat i na buňkách mimo rámec imunitního systému.
Účinek IL18 může být blokován tzv. IL18 vážícím proteinem (IL18BP/Binding Protein), který zabrání vazbě cytokinu k receptoru, bylo však také zjištěno, že tvorba IL18BP nádorovými buňkami může být jedním z mechanizmů, kterými se nádor snaží uniknout imunitnímu dohledu [8].
IL37 je strukturálně podobný IL18 a váže se na společnou α-podjednotku receptoru (schéma 4). Účinek IL37 je protizánětlivý, založený na signalizaci Smad 3a potlačení transkripčního faktoru NFκB [9], který reguluje tvorbu řady prozánětlivých cytokinů.

Podrodina IL36 (IL36α, IL36β, IL36γ, IL36Ra a IL38)
IL36 (α, β, γ) představuje v rámci této podrodiny prozánětlivé cytokiny vedoucí k aktivaci transkripčních faktorů NFκB a AP1 s fosforylací MAPK. K tvorbě IL36 dochází jak na sliznicích a buňkách parenchymu, tak i v imunitních buňkách, zejména makrofázích a T-lymfocytech [10]. Vlivem IL36 dochází v mononukleárních fagocytech k indukci prozánětlivých cytokinů (včetně IL1β) a změnám fenotypu.
Účinky IL36 jsou kompetitivně inhibovány pomocí IL36 receptorového antagonisty (IL36Ra), který je strukturálně podobný IL36γ [11], nicméně jeho vazba na receptor není spojena s aktivací buňky.
Také IL38 má schopnost inhibovat IL36 kompeticí o společný receptor, a navíc může i přímo inhibovat tvorbu některých cytokinů v makrofázích potlačením signalizace JNK/AP1 [12].
Cytokiny rodiny IL1 u chronických zánětlivých stavů
Revmatoidní artritida a systémová onemocnění pojiva
Již od 80. let minulého století je známo, že v kloubech pacientů s revmatoidní artritidou (RA) dochází k lokální nadprodukci IL1 a dokonce i periferní monocyty těchto nemocných mají zvýšenou kapacitu spontánně tvořit tento cytokin [13]. V patogenetických mechanizmech se může uplatnit také snížená kapacita synoviální tkáně produkovat IL1Ra [14]. Současně s IL1β lze u pacientů s RA zjistit lokální indukci IL18 [15] a IL33 [16]. Také IL36α byl prokázán ve zvýšené míře jak v synovii, tak i v séru pacientů s RA, současně však zřejmě dochází i ke kompenzatorní elevaci IL36 inhibujících cytokinů IL36Ra a IL38 [17]. Dalším protizánětlivým cytokinem indukovaným u pacientů s RA je IL37 [18]. Systémový lupus erythematodes (SLE) je spojen se zvýšenými sérovými hladinami IL1β, které však nedosahují koncentrací naměřených u jiných chronických zánětlivých onemocnění, např. revmatoidní artritidy. U pacientů se SLE jsou současně zvýšeny sérové hladiny IL18 i IL18BP [19], dochází i k zvýšené produkci protizánětlivých cytokinů IL37 [20] a IL38. Také u Sjögrenova syndromu byla v séru zjištěna elevace IL18, IL18BP a IL37 [21]. IL36α byl ve zvýšené hladině prokázán v séru a slinách těchto pacientů, lokálně dochází i ke kompenzační indukci IL38 [22].
Autoinflamatorní onemocnění
Autoinflamatorní onemocnění jsou stavy nadměrné zánětlivé odpovědi provázené zpravidla horečkami s výsevem exantému, často s únavou a artralgiemi či myalgiemi. Řada těchto chorob, které se manifestují převážně již v dětském věku, je podmíněna dysregulací některé ze signalizačních drah souvisejících s tvorbou cytokinů rodiny IL1 [23]. Nejznámějším zástupcem těchto onemocnění je familiární středozemní horečka (Familial Mediterranean Fever – FMF), u které mutace genu pro kryopyrin (NLRP3) vede k nadměrné aktivitě kaspázy 1 a nadprodukci IL1β, dalšími chorobami jsou Muckleův-Wellsův syndrom nebo multisystémové zánětlivé onemocnění novorozeneckého věku (Neonatal Onset Multisystem Inflammatory Disease – NOMID). Kromě nadměrné tvorby IL1β může vést k autoinflamatornímu onemocnění s výraznou kožní manifestací a febriliemi také defekt tvorby IL1Ra (DIRA) [24]. V případě syndromu aktivovaných makrofágů (MAS) má zřejmě klíčovou úlohu nadprodukce IL18 [25]. K autoinflamatornímu onemocnění vede také mutace genu kódujícího IL36Ra, DITRA (Deficiency of Interleukin Thirty-six-Receptor Antagonist) [26].
Nespecifické střevní záněty
IL1β se významně uplatní i v patogeneze nespecifických střevních zánětů (IBD), ať již se jedná o přímý prozánětlivý účinek nebo podíl na diferenciaci Th17 lymfocytů [27]. U Crohnovy choroby je tento cytokin tvořen mononukleárními buňkami v lamina propria současně s TNFα, k nadprodukci IL1β však dochází i při aktivní ulcerózní kolitidě [28], při které vykazuje zřejmě i přímý účinek na střevní motilitu. Lokální nadprodukce IL1 je kompenzována zvýšenými sérovými hladinami IL1Ra [29]. Pacienti s IBD mají vyšší hladiny IL18 i IL18BP oproti zdravým osobám, nicméně elevace IL18BP není zřejmě dostatečná k inhibici IL18, zejména u pacientů s Crohnovou chorobou [30]. Zvýšená exprese IL33 ve střevní sliznici pacientů s IBD [31] souvisí spíše s jeho funkcí hlásit poškození tkáně při zánětu než jako vyvolávající činitel [32]. Ve sliznici pacientů s IBD, zejména u ulcerózní kolitidy, je také možno ve střevní sliznici prokázat také mRNA pro IL36α a IL36γ, ale ne IL36β [33]. Ve zvýšené míře je u IBD tvořen také IL37, jeho hlavním zdrojem jsou cirkulující B-lymfocyty, NK-buňky a monocyty [34].
Terapeutické ovlivnění cytokinů rodiny IL1
Prozánětlivé cytokiny včetně některých zástupců rodiny IL1 se v poslední době stávají i atraktivním cílem řízeného terapeutického zásahu pomocí tzv. biologické léčby (tab) [35]. K současnému blokování IL1α i IL1β se zatím nejčastěji používá rekombinantní IL1Ra, anakinra. Tato léčba je dobře tolerována a prokázala svou účinnost u revmatoidní artritidy, autoinflamatorních chorob, dny nebo těžkých kolitid, u chronické granulomatózní choroby [36]. Protizánětlivý efekt anakinry s poklesem CRP byl popsán u pacientů s dekompenzovaným srdečním selháním [37] a lepší přežití bylo zjištěno u septických pacientů se syndromem aktivovaných makrofágů [38]. S ohledem na krátký poločas anakinry v cirkulaci vyžadující každodenní subkutánní aplikaci se naděje vkládají do monoklonálních protilátek anti-IL1.
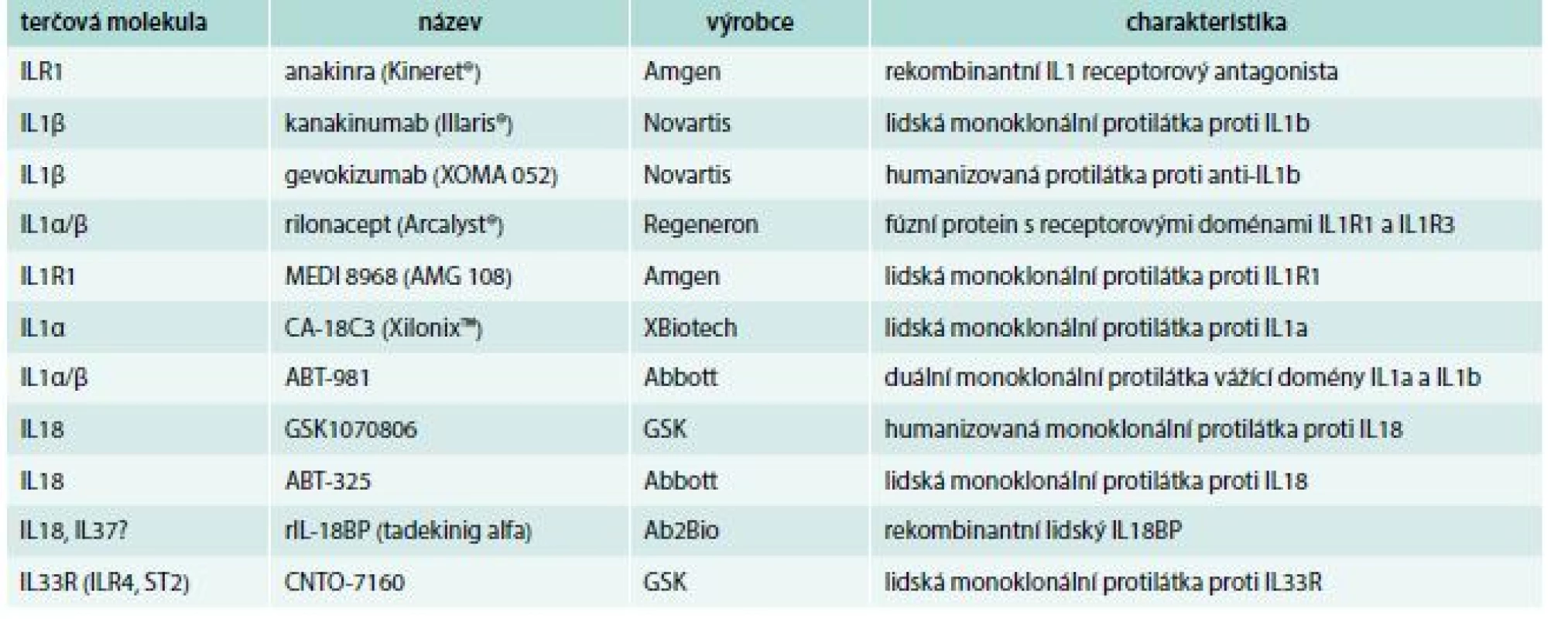
Kanakinumab je lidská monoklonální protilátka blokující výhradně IL1β (ne IL1α) [39]. Tato protilátka vykázala bezpečnost i účinnost u revmatických nemocnění [40] i dalších indikací vyžadujících blokování IL1.
Humanizovaná monoklonální protilátka, gevokizumab má založený účinek na ovlivnění elektrostatického potenciálu, který je nezbytný pro vazbu IL1β k receptoru (IL1R1) [41].
Rilonacept je fúzní protein obsahující vazebné receptorové domény IL1R1 a IL1R3 navázané na Fc část lidského IgG1, zajišťující oddálenou eliminaci z cirkulace [42]. V klinických studiích je dále lidská monoklonální protilátka MEDI 8968 proti IL1R1 (ClinicalTrials.gov) a dvoudoménová monoklonální protilátka ABT-981, která váže současně IL1α i IL1β [43].
U pacientů s pokročilým nemalobuněčným karcinomem plic je testována monoklonální protilátka proti IL1α, CA-18C3 (XilonixTM) [44].
K potlačení účinků IL18 jsou testovány dvě monoklonální protilátky, GSK1070806 [45] a ABT-325 [46] a rovněž rekombinantní IL18BP, tadekinig alfa [47]. Klinické studie probíhají také s monoklonální protilátkou CNTO-7160 proti IL33R (IL1R4, ST2), zatím bez publikovaných dat (ClinicalTrials.gov).
Závěr
S ohledem na terapeutický potenciál u chronických zánětlivých onemocnění, jsou cytokiny rodiny IL1 stále ještě ve stínu TNFα a IL6, nicméně jejich příznivý bezpečnostní profil a zejména účinnost u některých vymezených diagnóz, např. autoinflamatorních stavů, z nich dělá nové atraktivní cíle, jejichž blokování by mělo být nadále v klinické praxi testováno.
prof. MUDr. Ilja Stříž, CSc.
Pracoviště klinické a transplantační imunologie IKEM, Praha
Doručeno do redakce 30. 8. 2018
Přijato po recenzi 26. 11. 2018
Sources
-
Striz I, Brabcova E, Kolesar L et al. Cytokine networking of innate immunity cells: a potential target of therapy. Clin Sci (Lond) 2014; 126(9): 593–612. Dostupné z DOI: <http://dx.doi.org/10.1042/CS20130497>.
-
van de Veerdonk FL, Netea MG. New Insights in the Immunobiology of IL-1 Family Members. Frontiers in immunology 2013; 4 : 167. Dostupné z DOI: <http://dx.doi.org/10.3389/fimmu.2013.00167>.
-
Thomas C, Bazan JF, Garcia KC. Structure of the activating IL-1 receptor signaling complex. Nat Struct Mol Biol 2012; 19(4): 455–457. Dostupné z DOI: <http://dx.doi.org/10.1038/nsmb.2260>.
-
Dinarello CA. Overview of the IL-1 family in innate inflammation and acquired immunity. Immunol Rev 2018; 281(1): 8–27.Dostupné z DOI: <http://dx.doi.org/10.1111/imr.12621>.
-
Schmitz J, Owyang A, Oldham E et al. IL-33, an interleukin-1-like cytokine that signals via the IL-1 receptor-related protein ST2 and induces T helper type 2-associated cytokines. Immunity 2005; 23(5): 479–490. Dostupné z DOI: <http://dx.doi.org/10.1016/j.immuni.2005.09.015>.
-
Brabcova E, Kolesar L, Thorburn E et al. Chemokines induced in human respiratory epithelial cells by IL-1 family of cytokines. Folia Biol (Praha) 2014; 60(4): 180–186.
-
Hoshino T, Wiltrout RH, Young HA. IL-18 is a potent coinducer of IL-13 in NK and T cells: a new potential role for IL-18 in modulating the immune response. J Immunol 1999; 162(9): 5070–5077.
-
Fujita K, Ewing CM, Isaacs WB et al. Immunomodulatory IL-18 binding protein is produced by prostate cancer cells and its levels in urine and serum correlate with tumor status. Int J Cancer 2011; 129(2): 424–432. Dostupné z DOI: <http://dx.doi.org/10.1002/ijc.25705>.
-
Xie Y, Li Y, Cai X et al. Interleukin-37 suppresses ICAM-1 expression in parallel with NF-kappaB down-regulation following TLR2 activation of human coronary artery endothelial cells. Int Immunopharmacol 2016; 38 : 26–30. Dostupné z DOI: <http://dx.doi.org/10.1016/j.intimp.2016.05.003>.
-
Gabay C, Towne JE. Regulation and function of interleukin-36 cytokines in homeostasis and pathological conditions. J Leukoc Biol 2015; 97(4): 645–652. Dostupné z DOI: <http://dx.doi.org/10.1189/jlb.3RI1014–495R>.
-
Gunther S, Sundberg EJ. Molecular determinants of agonist and antagonist signaling through the IL-36 receptor. J Immunol 2014; 193(2): 921–930. Dostupné z DOI: <http://dx.doi.org/10.4049/jimmunol.1400538>.
-
Mora J, Schlemmer A, Wittig I et al. Interleukin-38 is released from apoptotic cells to limit inflammatory macrophage responses. J Mol Cell Biol 2016. pii: mjw006. Dostupné z DOI: <http://dx.doi.org/10.1093/jmcb/mjw006>.
-
Danis VA, March LM, Nelson DS et al. Interleukin-1 secretion by peripheral blood monocytes and synovial macrophages from patients with rheumatoid arthritis. Journal Rheumatol1987; 14(1): 33–39.
-
Firestein GS, Boyle DL, Yu C et al. Synovial interleukin-1 receptor antagonist and interleukin-1 balance in rheumatoid arthritis. Arthritis Rheum 1994; 37(5): 644–652.
-
Joosten LA, Radstake TR, Lubberts E et al. Association of interleukin-18 expression with enhanced levels of both interleukin-1beta and tumor necrosis factor alpha in knee synovial tissue of patients with rheumatoid arthritis. Arthritis Rheum 2003; 48(2): 339–347. Dostupné z DOI: <http://dx.doi.org/10.1002/art.10814>.
-
Matsuyama Y, Okazaki H, Hoshino M et al. Sustained elevation of interleukin-33 in sera and synovial fluids from patients with rheumatoid arthritis non-responsive to anti-tumor necrosis factor: possible association with persistent IL-1beta signaling and a poor clinical response. Rheumatol Int 2012; 32(5): 1397–1401. Dostupné z DOI: <http://dx.doi.org/10.1007/s00296–011–1854–6>.
-
Boutet MA, Bart G, Penhoat M et al. Distinct expression of interleukin (IL)-36alpha, beta and gamma, their antagonist IL-36Ra and IL-38 in psoriasis, rheumatoid arthritis and Crohn‘s disease. Clin Exp Immunol 2016; 184(2): 159–173. Dostupné z DOI: <http://dx.doi.org/10.1111/cei.12761>.
-
Xia L, Shen H, Lu J. Elevated serum and synovial fluid levels of interleukin-37 in patients with rheumatoid arthritis: Attenuated the production of inflammatory cytokines. Cytokine 2015; 76(2): 553–557. Dostupné z DOI: <http://dx.doi.org/10.1016/j.cyto.2015.06.005>.
-
Italiani P, Manca ML, Angelotti F et al. IL-1 family cytokines and soluble receptors in systemic lupus erythematosus. Arthritis Res Ther 2018; 20(1): 27. Dostupné z DOI: <http://dx.doi.org/10.1186/s13075–018–1525-z>.
-
Wu GC, Li HM, Wang JB et al. Elevated plasma interleukin-37 levels in systemic lupus erythematosus patients. Lupus 2016; 25(12): 1377–1380. Dostupné z DOI: <http://dx.doi.org/10.1177/0961203316646462>.
-
Liuqing W, Liping X, Hui S et al. Elevated IL-37, IL-18 and IL-18BP serum concentrations in patients with primary Sjogren‘s syndrome. J Investig Med 2017; 65(3): 717–721. Dostupné z DOI: <http://dx.doi.org/10.1136/jim-2016–000301>.
-
Ciccia F, Accardo-Palumbo A, Alessandro R et al. Interleukin-36alpha axis is modulated in patients with primary Sjogren‘s syndrome. Clin Exp Immunol 2015; 181(2): 230–238. Dostupné z DOI: <http://dx.doi.org/10.1111/cei.12644>.
-
de Jesus AA, Goldbach-Mansky R. Genetically defined autoinflammatory diseases. Oral Dis 2016; 22(7): 591–604. Dostupné z DOI: <http://dx.doi.org/10.1111/odi.12448>.
-
Tauber M, Bal E, Pei XY et al. IL36RN Mutations Affect Protein Expression and Function: A Basis for Genotype-Phenotype Correlation in Pustular Diseases. J Invest Dermatol 2016; 136(9): 1811–1819. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jid.2016.04.038>.
-
Shimizu M, Nakagishi Y, Inoue N et al. Interleukin-18 for predicting the development of macrophage activation syndrome in systemic juvenile idiopathic arthritis. Clin Immunol 2015; 160(2): 277–281. Dostupné z DOI: <http://dx.doi.org/10.1016/j.clim.2015.06.005>.
-
Marrakchi S, Guigue P, Renshaw BR et al. Interleukin-36-receptor antagonist deficiency and generalized pustular psoriasis. N Engl J Med 2011; 365(7): 620–628. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMoa1013068>.
-
Abraham C, Cho JH Inflammatory bowel disease. N Engl J Med 2009; 361(21): 2066–2078. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMra0804647>.
-
Casellas F, Papo M, Guarner F et al. Intracolonic release in vivo of interleukin-1 beta in chronic ulcerative colitis. Clin Sci (Lond) 1995; 89(5): 521–526.
-
Ludwiczek O, Vannier E, Borggraefe I et al. Imbalance between interleukin-1 agonists and antagonists: relationship to severity of inflammatory bowel disease. Clin Exp Immunol 2004; 138(2): 323–329.
-
Ludwiczek O, Kaser A, Novick D et al. Elevated systemic levels of free interleukin-18 (IL-18) in patients with Crohn‘s disease. Eur Cytokine Netw 2005; 16(1): 27–33.
-
Nunes T, Bernardazzi C, de Souza HS. Interleukin-33 and inflammatory bowel diseases: lessons from human studies. Mediators Inflamm 2014; 2014 : 423957. Dostupné z DOI: <http://dx.doi.org/10.1155/2014/423957>.
-
Hodzic Z, Schill EM, Bolock AM et al. IL-33 and the intestine: The good, the bad, and the inflammatory. Cytokine 2017; 100(10): 1–10. Dostupné z DOI: <http://dx.doi.org/10.1016/j.cyto.2017.06.017>.
-
Nishida A, Hidaka K, Kanda T et al. Increased Expression of Interleukin-36, a Member of the Interleukin-1 Cytokine Family, in Inflammatory Bowel Disease. Inflamm Bowel Dis 2016; 22(2): 303–314. Dostupné z DOI: <http://dx.doi.org/10.1097/MIB.0000000000000654>.
-
Fonseca-Camarillo G, Furuzawa-Carballeda J, Yamamoto-Furusho JK. Interleukin 35 (IL-35) and IL-37: Intestinal and peripheral expression by T and B regulatory cells in patients with Inflammatory Bowel Disease. Cytokine 2015; 75(2): 389–402. Dostupné z DOI: <http://dx.doi.org/10.1016/j.cyto.2015.04.009>.
-
Striz I. Cytokines of the IL-1 family: recognized targets in chronic inflammation underrated in organ transplantations. Clin Sci (Lond) 2017; 131(17): 2241–2256. Dostupné z DOI: <http://dx.doi.org/10.1042/CS20170098>.
-
Dinarello CA, Simon A, van der Meer JW. Treating inflammation by blocking interleukin-1 in a broad spectrum of diseases. Nat Rev Drug Discov 2012; 11(8): 633–652. <http://dx.doi.org/10.1038/nrd3800>.
-
Van Tassell BW, Abouzaki NA, Oddi Erdle C et al. Interleukin-1 Blockade in Acute Decompensated Heart Failure: A Randomized, Double-Blinded, Placebo-Controlled Pilot Study. J Cardiovasc Pharmacol 2016; 67(6): 544–551. Dostupné z DOI: <http://dx.doi.org/10.1097/FJC.0000000000000378>.
-
Shakoory B, Carcillo JA, Chatham WW et al. Interleukin-1 receptor blockade is associated with reduced mortality in sepsis patients with features of macrophage activation syndrome reanalysis of a prior phase iii trials. Crit Care Med 2016; 44(2): 275–281. Dostupné z DOI: <http://dx.doi.org/10.1097/CCM.0000000000001402>.
-
Dinarello CA. An expanding role for interleukin-1 blockade from gout to cancer. Mol Med 2014; 20(Suppl 1): S43-S58. Dostupné z DOI: <http://dx.doi.org/10.2119/molmed.2014.00232>.
-
Ruperto N, Brunner HI, Quartier P et al. Two randomized trials of canakinumab in systemic juvenile idiopathic arthritis. N Engl J Med 2012; 367(25): 2396–2406. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMoa1205099>.
-
Issafras H, Corbin JA, Goldfine ID et al. Detailed mechanistic analysis of gevokizumab, an allosteric anti-IL-1beta antibody with differential receptor-modulating properties. J Pharmacol Exp Ther 2014; 348(1): 202–215. Dostupné z DOI: <http://dx.doi.org/10.1124/jpet.113.205443>.
-
Ilowite NT, Prather K, Lokhnygina Y et al. Randomized, double-blind, placebo-controlled trial of the efficacy and safety of rilonacept in the treatment of systemic juvenile idiopathic arthritis. Arthritis Rheumatol 2014; 66(9): 2570–2579. Dostupné z DOI: <http://dx.doi.org/10.1002/art.38699>.
-
Kosloski MP, Goss S, Wang SX et al. Pharmacokinetics and Tolerability of a Dual Variable Domain Immunoglobulin ABT-981 Against IL-1alpha and IL-1beta in Healthy Subjects and Patients With Osteoarthritis of the Knee. J Clin Pharmacol 2016; 56(12): 1582–1590. Dostupné z DOI: <http://dx.doi.org/10.1002/jcph.764>.
-
Hong DS, Janku F, Naing A et al. Xilonix, a novel true human antibody targeting the inflammatory cytokine interleukin-1 alpha, in non-small cell lung cancer. Invest New Drugs 2015; 33(3): 621–631. Dostupné z DOI: <http://dx.doi.org/10.1007/s10637–015–0226–6>.
-
Mistry P, Reid J, Pouliquen I et al. Safety, tolerability, pharmacokinetics, and pharmacodynamics of single-dose antiinterleukin-18 mAb GSK1070806 in healthy and obese subjects. Int J Clin Pharmacol Ther2014; 52(10): 867–879. Dostupné z DOI: <http://dx.doi.org/10.5414/CP202087>.
-
Argiriadi MA, Xiang T, Wu C et al. Unusual water-mediated antigenic recognition of the proinflammatory cytokine interleukin-18. J Biol Chem 2009; 284(36): 24478–24489. <http://dx.doi.org/10.1074/jbc.M109.023887>.
-
Tak PP, Bacchi M, Bertolino M. Pharmacokinetics of IL-18 binding protein in healthy volunteers and subjects with rheumatoid arthritis or plaque psoriasis. Eur J Drug Metab Pharmacokinet 2006; 31(2): 109–116. Dostupné z DOI: <http://dx.doi.org/10.1007/BF03191127>.
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Internal Medicine

2019 Issue 2
-
All articles in this issue
- Zánět obranný a poškozující: základní charakteristiky
- Cytokiny rodiny IL1 u chronických zánětlivých procesů
- Heterogenita lymfocytov ako ústredných operačných jednotiek imunitného systému
- Mikrobiota, imunita a imunologicky mediované choroby
- Primární imunodeficience u dospělých
- Sekundární imunodeficience jako následek chronických onemocnění
- Léčba humorálních imunodeficiencí
- Nežádoucí účinky imunoglobulinové léčby
- Současné trendy v imunosupresivní léčbě
- Co dnes znamená alergologie pro internu a naopak
- Anafylaktické příznaky a anafylaktický šok
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue
- Anafylaktické příznaky a anafylaktický šok
- Nežádoucí účinky imunoglobulinové léčby
- Současné trendy v imunosupresivní léčbě
- Primární imunodeficience u dospělých
