Mikrobiota, imunita a imunologicky mediované choroby
Microbiota, immunity and immunologically-mediated diseases
Each individual is colonized by broad spectrum of microbes. Recent surge of interest in microbiota across all fields of medicine was motivated by an increasing body of knowledge on how commensals influence human health. This is most notable in the gut, where most microbes reside, but microbes colonizing other niches, such as oral cavity or skin, may influence health as well. Microbiota fundamentally influences the immune system development and its perturbation, i.e. dysbiosis, is associated with many inflammatory, autoimmune and neoplastic diseases. Microbiota forms a symbiotic relationship with the host – maintaining balanced and efficient immune response and protects from colonization by pathogens. Modern medicine may benefit greatly by adopting these ideas for therapeutic or prophylactic purposes. These may include manipulation with microbiota by diet, changes in lifestyle or directly by probiotics or fecal microbiota transfer.
Keywords:
inflammation – Microbiome – mucosal immunity – probiotics
Authors:
Helena Tlaskalová Hogenová 1,2; Zuzana Jirásková Zákostelská 1; Jitka Petanová 2; Miloslav Kverka 1,3
Authors‘ workplace:
Mikrobiologický ústav AVČR, v. v. i., Praha
1; Ústav imunologie a mikrobiologie 1. LF UK a VFN v Praze
2; Ústav experimentální medicíny AVČR, v. v. i., Praha
3
Published in:
Vnitř Lék 2019; 65(2): 98-107
Category:
Overview
Každý jedinec žije v úzkém společenství s mikroorganizmy, které osidlují všechny epitelové povrchy sliznic a kůže. Stále rostoucí množství nových poznatků o významu komenzálních mikrobů pro zdraví vyvolává velký zájem o mikrobiotu napříč lékařskými obory. Mikrobiota, zejména střevní, hraje klíčovou roli ve vývoji a fungování řady fyziologických mechanizmů, zejména imunitních. Mikrobiota vytváří s hostitelem symbiotický vztah: podmiňuje imunologickou rovnováhu, umožňuje efektivní imunitní reakce a brání kolonizaci patogenními mikroorganizmy. Alterace vzájemného vztahu mikrobioty a hostitele (dysbióza) vede k vývoji zánětlivých, autoimunitních i nádorových chorob. Pro medicínu budoucnosti se nyní otevírají nové možnosti: ovlivnit složení a funkci mikrobioty i její interakce nejen změnou životního stylu a způsobu stravování, ale i přímo, probiotiky nebo přenosem fekální mikrobioty.
Klíčová slova:
probiotika – slizniční imunita – střevo – zánět
Úvod
S každým jedincem je neoddělitelně spojeno určité společenství mikroorganizmů, které se v závislosti na prostředí vyvíjí a tvoří tak s hostitelem jeden celistvý „superorganizmus“. Všechny povrchy našeho těla, které jsou v kontaktu s prostředím (epitelové povrchy sliznic a kůže) jsou osídleny mikroorganizmy, které představují tzv. normální mikrobiotu (dříve nazývaná mikroflóra). Kromě bakterií obsahuje naše mikrobiota i viry, plísně a parazity a největší množství mikrobů je přítomno v trávicím traktu. Přestože ústní dutina (včetně jazyka, zubů a parodontu) je domovem řady mikrobů, zdaleka největší množství jich však žije v tlustém střevě (1012 v gramu obsahu). Naše střevní mikrobiota představuje komplexní ekosystém s ohromnou diverzitou. Skládá se z více než 1 000 druhů bakterií, počet všech jejich genů (mikrobiom) převyšuje více než 100krát počet genů v lidském genomu [1,2].
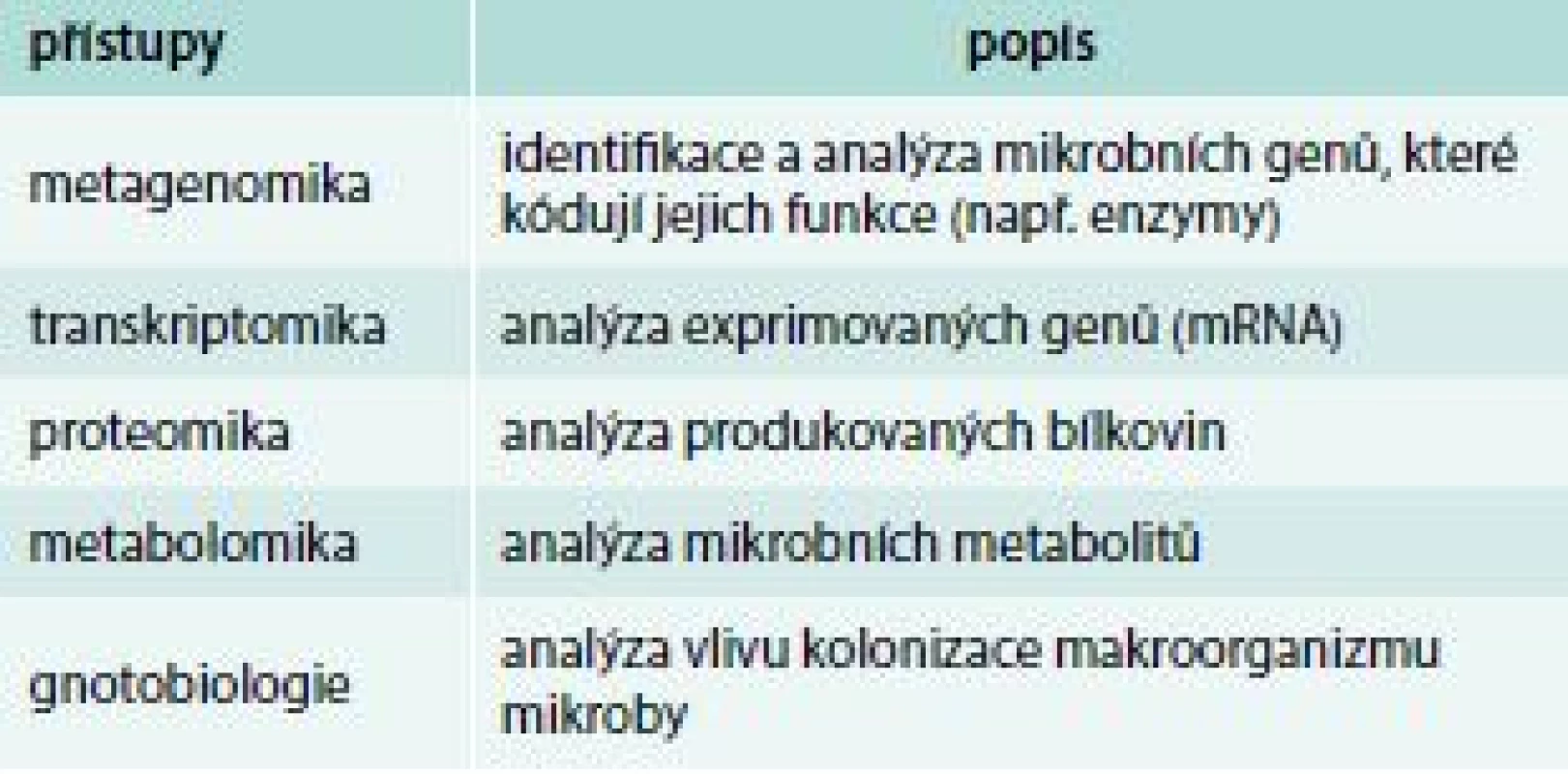
Pro studium složení mikrobioty byly po dlouhá léta používány pouze mikroskopické, kultivační a biochemické postupy. S pokroky v molekulární biologii a bioinformatice a po úspěšném přečtení lidského genomu se řada světových laboratoří zapojila do analýzy složek lidské mikrobioty. Tyto nové metody spočívají v sekvenaci některého specificky mikrobního genu, např. genu pro bakteriální 16S rRNA. Ten je obvykle složen jak z evolučně stabilních úseků DNA, které umožňují nasednutí primerů, tak z úseků variabilních, které umožňují identifikovat konkrétního mikroba porovnáním této sekvence s rozsáhlou databází mikrobních sekvencí. Intenzivně se dnes pracuje nejen na analýzách složení mikrobiomu (metagenomika), ale současným hlavním směrem výzkumu jsou přístupy, které analyzují aktivitu mikrobioty a mechanizmy jejího působení na hostitele (metabolomika, transkriptomika, proteomika), tab. 1. Využití molekulárně-biologických metod přineslo a přináší řadu nových, stále však velmi limitovaných poznatků o mikrobiotě a jejich funkcích. Bylo např. zjištěno, že zhruba 70 % mikrobní komunity lidského střeva je tvořeno bakteriemi, které se dosud nedají klasickými mikrobiologickými metodami kultivovat. Rozšířily se poznatky o složení mikrobioty, o hlavních bakteriálních skupinách v lidském střevě, o jejich změnách v průběhu prvních týdnů a měsíců života i o dalších rysech mikrobioty. Navíc už základní srovnávací studie přinesly překvapující zjištění, že každý z nás má jedinečné složení mikrobioty (složením naší mikrobioty se individuálně výrazně lišíme) a že složení hlavních bakteriálních populací se stabilizuje po prvních 2–3 letech života, během nichž se složení mikrobioty mění a vyvíjí. V průběhu celého dalšího života pak zůstává složení hlavních bakteriálních druhů (přibližně dvě třetiny mikrobioty) poměrně stabilní. Současný zájem medicinských oborů o úlohu mikrobioty ve vývoji zdravého jedince vyplývá jednak z nálezů změn jejího složení u různých chorob a jednak z možnosti manipulace s ní [3].
Při studiu biologického významu mikrobioty a důsledků bakteriální kolonizace jsou nepostradatelným metodickým nástrojem gnotobiotická (tzn. bezmikrobní či cíleně kolonizovaná) experimentální zvířata. Ta jsou odchovávána náročnou technologií ve sterilním prostředí (tj. bez mikrobioty) v izolátorech pro bezmikrobní chov. Zde se mohou kontrolovaně osidlovat definovanými kmeny mikrobů a lze sledovat vliv této kolonizace na fyziologický vývoj i na vznik patologických změn ve zvířecích modelech lidských onemocnění [4,5]. Zvířecí modely navíc umožňují studium účasti etiopatogenetických faktorů v časných fázích vývoje chorob, což u pacientů není možné kvůli časovému odstupu mezi indukcí a symptomy choroby.
Kromě dlouho známé úlohy střevních bakterií při zpracování nedegradovatelných polysacharidů bylo zjištěno, že komenzální bakterie hrají významnou úlohu v mnoha fyziologických procesech. Po osazení bezmikrobních zvířat určitým kmenem střevních bakterií u nich dochází k významným změnám exprese široké škály genů, z nichž řada se uplatňuje např. v metabolizmu. Těsné soužití mikrobioty a lidí je výsledkem dlouhodobého vývoje a vzájemné adaptace obou neoddělitelných složek, které určují naši schopnost přizpůsobit se prostředí, ve kterém žijeme, i bránit se vývoji nemocí. Nejcitlivějším obdobím pro ovlivnění vývoje jedince mikrobiotou je perinatální, a to zejména časné postnatální období, v jehož průběhu dochází k postupnému osidlování jeho slizničních i kožních povrchů. Využití možnosti bojovat proti patogenním mikroorganizmům vedlo v poslední době k nadužívání antibiotik s následnou alterací mikrobioty [6].
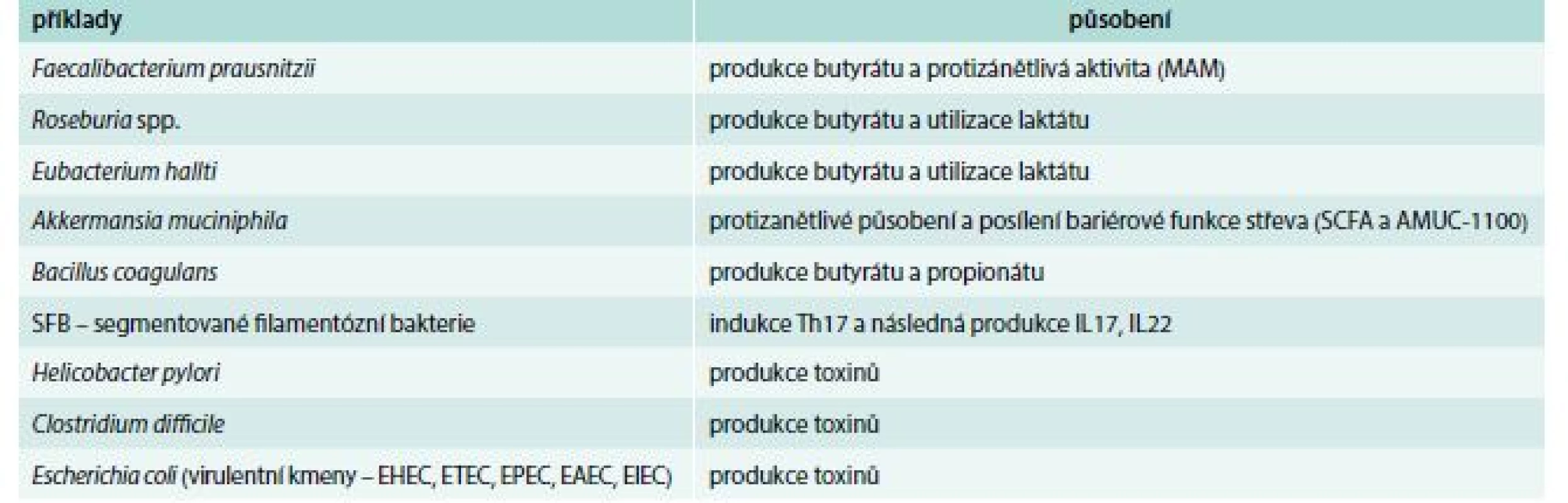
Rostoucí zájem o význam mikrobioty pro zdraví a možnosti využití molekulárně biologických metod vedl k nálezům charakteristických změn složení mikrobioty u pacientů s různými chorobami [3,7]. Tyto změny struktury střevní komunity jsou nazvány dysbióza a jsou v současnosti nacházeny nejen u chorob trávicího traktu, ale i u dalších chorob, např. metabolických, psychiatrických a nádorových. Dysbióza je doprovázena také změnami funkce mikrobioty, které způsobují poruchu fyziologické a imunologické rovnováhy mezi mikroby a hostitelem [8]. Charakteristickými rysy dysbiózy jsou ztráta různorodosti (snížení diverzity), zvýšený výskyt potenciálně patogenních bakterií (patobiontů) nebo naopak chybění prospěšných bakterií (tab. 2). Ve vztahu k lidským chorobám však zůstává otevřena zcela zásadní otázka, zda je dysbióza příčinou, asociací nebo důsledkem patologického stavu [9].
Nejdůležitější poznatky o vztahu mikrobioty, imunity a imunologicky mediovaných chorob se týkají mikrobioty střevní (analýza vzorků stolice nebo střevního obsahu), proto se o ostatních lokalitách mikrobioty zmíníme jen okrajově.
Mikrobiom a imunita
Sliznice pokrývají většinu tělesných povrchů (asi 300 m2) a kromě svých specifických funkcí (trávení potravy a absorpce živin, výměna plynů atd) zajišťují ochranu jedince a interakci organizmu s prostředím. Tyto funkce jsou z velké části zajišťovány buňkami imunitního systému, který tvoří vzájemně propojenou síť buněk. Kromě leukocytů do této sítě řadíme i buňky epitelové, které se významným způsobem podílejí na imunitní odpovědi. Imunitní systém sliznic pak zajišťuje ochranu před infekcemi, udržuje bariérovou funkci sliznic (schéma 1) a zprostředkovává toleranci neškodných antigenů a komenzálních mikrobů [10].

Neobvyklá šíře účinků mikrobioty na organizmus hostitele je způsobena částečně přímo, produkcí bioaktivních molekul, a částečně nepřímo, modulací buněčné a humorální odpovědi imunitního systému hostitele. Tyto mechanizmy jsou obvykle zprostředkovány buňkami střevního epitelu a leukocyty. Imunitní systém má ve vztahu k mikrobům nelehkou úlohu. Vzhledem k masivní kolonizaci kůže a sliznic organizmu musí jednak tlumit imunitní odpověď proti mikrobům komenzálním a současně spustit rychlou ochrannou odpověď proti mikrobům patogenním. Pokud dojde k porušení této rovnováhy, vzniknou onemocnění zánětlivá, autoimunitní anebo infekční.
Interakce hostitele s mikroby obvykle začíná na povrchu epitelových buněk: molekulární vzory daného mikroba (Microbe Associated Molecular Pattern – MAMP; např. lipopolysacharid, peptidoglykan, flagelin) jsou rozpoznány příslušnými receptory (Pattern Recognition Receptors – PRR) [11]. I poměrně malý rozdíl ve struktuře povrchu mikroba, např. přítomnost některých faktorů virulence, může rozhodovat o spuštění, či naopak tlumení této reakce [12]. Rozdíl v reakci na komenzální a patogenní mikroby však nemusí být dán jen jejich odlišnou strukturou, ale jejich chováním. Buňky střevního epitelu totiž mají na svém povrchu celou škálu PRR, které jsou schopny rozpoznat MAMP na mikrobech komenzálních i patogenních. Selektivita vůči patogenům je zajištěna tak, že se tyto receptory nacházejí zejména na bazolaterální membráně, takže reagují vůči invazivním patogenům [13]. Během zánětu pak mohou některé uvolněné cytokiny (např. IFNγ a TNFα) zvýšit propustnost střevního epitelu, a tím zhoršit probíhající zánět [14,15]. Některé mikroby mohou dokonce selektivně degradovat či blokovat prozánětlivé cytokiny, které se při jejich rozpoznání uvolní, a tím tlumit reakci slizniční imunity nejen proti sobě, ale i proti dalším mikrobům [16]. Naopak produkce prozánětlivých cytokinů a jejich uvolnění do střevního lumen může některé mikroby stimulovat k intenzivnější tvorbě faktorů virulence [17].
Aktivace epitelových buněk spouští následně celou kaskádu mechanizmů, které vedou k produkci cytokinů, indukci autofagie a produkci antimikrobních peptidů. Tím dochází nejen ke změnám mikrobního prostředí v lumen střeva [18], ale i ke změnám imunitní reakce ve střevní stěně. Je zajímavé, že některé cytokiny indukované mikrobními komponentami mají selektivní antibiotický účinek a naopak antimikrobní peptidy mají i účinky imunomodulační, čímž se do určité míry smazává hranice mezi nimi [19]. Ve zdravé střevní sliznici epitelové buňky aktivně tlumí imunitní odpověď proti mikrobním komponentám. Pod vlivem cytokinového prostředí se ve střevní sliznici aktivují dendritické buňky (Dendritic Cells – DC), které aktivně prohledávají okolní prostředí a přenášejí mikroby do lymfatických uzlin. Zde se následně rozvíjí adaptivní imunitní odpověď. Prostředí ve střevní sliznici dále ovlivňuje přirozené lymfoidní buňky (ILC), které pomocí některých cytokinů integrují signál mezi mikroby a adaptivní imunitou. Např. IL22 produkovaný ILC3 je nejen důležitý pro tvorbu sekrečního IgA plazmocyty a selekci relevantního repertoáru T buněk, ale i pro posílení střevní bariéry produkcí antimikrobních peptidů RegIIIβ a RegIIIγ [20].
Metabolity produkované střevními mikroby (např. mastné kyseliny s krátkým řetězcem, SCFA) ovlivňují maturaci a aktivitu T-buněk, a tím mohou regulovat imunitní systém hostitele [21]. Pod vlivem propionátu střevní regulační T-buňky (Treg) nejenže intenzivně proliferují, ale zároveň produkují velké množství regulačního cytokinu IL10 a tlumí proliferaci ostatních efektorových lymfocytů. Tento účinek je zprostředkovaný interakcí propionátu s receptorem GPCR43, který je ve zvýšené míře exprimovaný na povrchu střevních Treg a který ovlivňuje intracelulární signalizaci pomocí G-proteinů [22]. Regulační buňky jsou pak nezbytné k regulaci zánětu nejen ve střevě, ale i ve zbytku organizmu. Obdobné regulační účinky na imunitní systém má i butyrát, ale nikoli acetát. Jelikož mikrobiom a složení potravy ovlivňují poměr mezi jednotlivými SCFA v lumen střeva, ovlivňují tak i aktivitu střevních Treg.
Th17 patří mezi běžné buňky střevní sliznice a pomocí cytokinů (IL17A, IL17F, IL22) chrání střevo před infekcí zejména extracelulárními bakteriemi či houbami. Toho je docíleno jednak zvýšením tvorby antimikrobních peptidů, posílením integrity těsných spojů mezi epiteliemi, chemotaxí granulocytů a stimulací T - i B-buněčné odpovědi [23]. I tato významná skupina lymfocytů je významně ovlivněna mikroby a jejich produkty (schéma 2). U experimentálních zvířat bylo zjištěno, že přítomnost segmentované filamentózní bakterie (nekultivovatelný mikrob patřící do rodiny Clostrideacae) v komplexní mikrobiotě indukuje tvorbu Th17 buněk ve střevní sliznici. Tento mechanizmus je závislý na produkci sérového amyloidu A epitelovými buňkami a vede k vyšší zánětlivé pohotovosti imunitního systému hostitele [24].

Sekreční IgA (SIgA) produkovaný plazmocyty představuje jeden z nejvýznamnějších humorálních faktorů, který chrání sliznice. Ve vlastní indukci tvorby SIgA se tak podílí kooperace mezi epiteliemi, DC a ILC. Většina repertoáru SIgA je namířena proti mikrobiotě, v níž specificky cílí na mikroby, které mají prozánětlivý potenciál [25]. Tento mechanizmus je regulován specializovanými Treg v germinálních centrech Peyerových plaků, tzv. folikulární regulační T-lymfocyty (Tfr). Pokud je tento mechanizmus narušený, dochází ke snížení diverzity střevní mikrobioty [26]. Nejvíce bývá postižen kmen Firmicutes, který obsahuje známé producenty SCFA, a tím se může snižování diverzity střevního mikrobiomu a porucha regulace imunitního systému dále prohlubovat.
Střevní mikrobiota a vybrané choroby
Střevní mikroby hrají významnou úlohu v patogenezi řady chronických, multigenních chorob, které jsou zprostředkovány imunitními mechanizmy. Jsou to především choroby zánětlivé, autoimunitní, jejichž incidence v posledních desetiletích intenzivně stoupá.
Výzkum etiopatogeneze těchto chorob odhalil, že faktory prostředí hrají významnější roli, než se předpokládalo, a na vzniku choroby se podílejí více než faktory genetické [27]. Původní hypotéza o infekční etiologii autoimunitních chorob (indukovaných především mechanizmem podobnosti autoantigenů s infekčními složkami – tzv. molekulární mimikry) se v posledních letech přetransformovala do hypotézy o účasti komenzálních mikroorganizmů v patogenezi autoimunitních a nádorových chorob [28,29]. Tento nový pohled byl umožněn zejména díky novým technikám, které umožnily sekvenaci mikrobiomu pacientů a prokázaly různé stupně dysbiózy u autoimunních chorob [30,31]. Studium patogeneze lidských zánětlivých nemocí s využitím zvířecích modelů lidských chorob v gnotobiotických (tzn. bezmikrobních nebo cíleně kolonizovaných) podmínkách ukázalo, jak zásadní roli v regulaci imunitních procesů hostitele i ve vývoji imunologicky mediovaných chorob mikrobiota hraje. V tomto směru mělo naše pracoviště výhodu možnosti pracovat s těmito unikátními zvířecími modely již od začátku 60. let minulého století, a to v Gnotobiologické laboratoři, kterou založil prof. MUDr. Jaroslav Šterzl [4,32–35].
Revmatická onemocnění
Existuje vzájemný vztah mezi gastrointestinálním traktem a chorobami postihujícími klouby. Schopnost střevních patogenů (např. Salmonella, Shigella) vyvolat zánětlivou reakci v kloubech (tzv. reaktivní artritida) je známá poměrně dlouho. Potenciální účast střeva v patogenních mechanizmech některých revmatických chorob byla nedávno podpořena nálezem zvýšené střevní propustnosti a gastrointestinálních symptomů u pacientů s juvenilní idiopatickou artritidou a nálezem častějšího výskytu artritidy u pacientů trpících idiopatickými záněty střev (Inflammatory Bowel Disease – IBD). Navíc byla nalezena střevní dysbióza u pacientů s revmatickými onemocněními [36]. Gnotobiotické experimenty se zvířecími modely ankylozující spondylitidy a revmatoidní artritidy jasně ukázaly, že absence mikrobů výrazně tlumí vznik zánětu. Kolonizace bezmikrobních myší komenzálním kmenem bakterií, segmentovanými filamentózními bakteriemi (SFB), měla za následek indukci a proliferaci subpopulace Th17 buněk spojenou s klinickými příznaky a zvýšením produkce autoprotilátek [37].
Velkou pozornost vyvolala nedávno vydaná publikace ukazující, že střevní komenzální bakterie Enterococcus galinarum je schopná proniknout střevní bariérou zvířecích modelů i lidí a vyvolat zánět s tvorbou autoprotilátek. Vakcinace tímto kmenem pak ochránila před vznikem autoimunitního onemocnění [38].
Diabetes mellitus 1. typu
Diabetes mellitus 1. typu (DM1T) se rozvíjí v důsledku autoimunitní destrukce buněk produkujících inzulin v Langerhansových ostrůvcích pankreatu. DM1T je považován za důsledek aberantní imunitní odpovědi u geneticky predisponovaných jedinců, obdobně jako je tomu u jiných autoimunitních onemocnění. Rychlý nárůst výskytu DM1T v rozvinutých zemích během posledních desetiletí ukazuje na úlohu faktorů z prostředí. Mezi nejdůležitější faktory ovlivňující DM1T patří mikrobiální a potravinové komponenty, ale také faktory vnitřní – funkčnost slizniční bariéry a imunity [39]. V posledních letech je intenzivně studována úloha mikrobioty v patogenezi DM1T [31,40,41].
Faktory ovlivňující vznik a vývoj diabetu i jiných autoimunitních onemocnění je obtížná zejména kvůli jejich komplexitě a kvůli časové prodlevě mezi indukcí a projevy klinických symptomů onemocnění. Proto mají při studiu patogeneze své významné místo experimentální modely lidských chorob. Bylo zjištěno, že u 2 nejlépe zavedených zvířecích modelů – spontánně se rozvíjejícího autoimunitního diabetu u specifického kmene potkanů (biobreeding diabetes prone) a myší kmene NOD – ovlivňuje výskyt diabetu kvalita zvěřinců. V prostředí zvěřinců bez patogenů nebo po dekontaminaci antibiotiky je pozorován vysoký výskyt diabetu. Výskyt infekce včetně parazitárních a podávání bakteriálních složek výrazně výskyt diabetu snižují. Významná účast mikrobioty a faktorů přirozené imunity v patogenezi diabetu byla popsána v pokusech s využitím bezmikrobních NOD myší [42,43].
Průběh DM1T u těchto zvířecích modelů je ovlivněn také složkami potravy. U diabetických potkanů a myší NOD podporují vznik diabetu rostlinné bílkoviny. Zjistili jsme, že bezlepková strava snižuje incidenci diabetu u NOD myší [44]. Mechanizmy, kterými některé diety ovlivňují diabetes, však nejsou dosud objasněny a není vyloučeno, že působení je mediováno změnami mikrobioty.
Nemoci neurologické a psychiatrické
K nejčastějším a nejzávažnějším neurologickým chorobám patří roztroušená skleróza (RS), což je autoimunitní demyelinizační onemocnění, které postihuje především mladé lidi a vede k jejich invaliditě. U pacientů a jejich příbuzných byla popsána porucha funkce střevní bariéry se zvýšenou střevní propustností. Na základě morfologických a imunologických nálezů v mozku pacientů byla při studiu etiopatogeneze RS věnována velká pozornost infekci virem Epsteina-Barrové. Úvaha o potenciální účasti bakterií v patogenezi RS se objevila po nálezech bakteriálního peptidoglykanu v dendritických buňkách a makrofázích mozku zemřelých pacientů, ale nikoliv kontrolních jedinců. Porovnáním sekvencí hlavních autoantigenů centrálního nervového systému se sekvencemi antigenů lidských bakterií a virů bylo zjištěno, že existuje strukturální podobnost těchto encefalitogenních peptidů s celou řadou peptidů přítomných v mikroorganizmech, a to hlavně střevních bakterií. I u této nemoci podobně jako u dalších autoimunit je tedy teorie molekulární podobnosti epitopů mikrobiálních s epitopy autoantigenů obecně přijímána.
Demyelinizace může být experimentálně indukována imunizací myší antigenními molekulami centrálního nervového systému (experimentální autoimunní encefalomyelitida). Tento zvířecí model je neocenitelný při objasňování patogeneze tohoto onemocnění i pro zkoušení nových terapeutických přístupů. Úloha složek mikrobioty, které jsou schopné aktivovat autoreaktivní T-buňky, byla pomocí tohoto experimentálního modelu potvrzena i tím, že v bezmikrobních podmínkách se choroba nevyvinula [45].
V poslední době se intenzivně studuje účast střevní mikrobioty i u psychiatrických chorob. Osa střevo-mozek je obousměrný komunikační systém, pomocí něhož mozek ovlivňuje gastrointestinální systém a podněty ze zažívacího traktu působí na centrální nervový systém. V této komunikaci jsou zapojeny neurální, imunologické a endokrinní mechanizmy a výraznou roli v ní hraje mikrobiota, která ovlivňuje vývoj a aktivací imunitních buněk reguluje některé funkce centrálního nervového systému [46,47].
Idiopatické střevní záněty
Idiopatické střevní záněty IBD, Crohnova choroba a ulcerózní kolitida, jsou chronická zánětlivá onemocnění trávicího traktu, která mají často i extraintestinální příznaky. Patogeneze není dosud plně objasněna, předpokládá se, že je podmíněna poruchou střevní bariéry a defektem imunoregulačních mechanizmů slizniční imunity, které jsou asociovány s aberantní imunologickou reaktivitou proti složkám vlastní střevní mikrobioty (schéma 3). Převaha tvorby prozánětlivých cytokinů pak vede k vývoji zánětu s poškozením střevní sliznice [48,49].

Hypotézy o existenci specifických mikroorganizmů zodpovědných za vznik střevního zánětu (např. listerie, mykobakterie) byly v poslední době nahrazeny představou, že zánět je důsledkem porušené interakce hostitele s dysbiotickou mikrobiotou [8]. Dysbióza u IBD je charakterizována snížením mikrobní diverzity a snížením výskytu některých druhů z kmene Firmicutes (např. Roseburia hominis a Faecalibacterium prausnitzii) a naopak zvýšeným zastoupením kmene Bacteroidetes se současným nárůstem bakterií kmene Fusobacteria a bakterií z čeledi Enterobacteriacae (např. adherentní a invasivní Escherichia coli u pacientů s Crohnovou chorobou). Pacienti s ulcerózní kolitidou mají snížené množství protizánětlivě působící bakterie Faecalibacterium prausnitzii, která produkuje mastné kyseliny s krátkým řetězcem (SCFA) a další protizánětlivé faktory [50]. Tato bakterie působí protizánětlivě tak, že blokuje centrální zánětlivou kaskádu vedoucí k aktivaci NFκB, a tím snižuje místní produkci prozánětlivých cytokinů IFNγ, IL12 a indukuje produkci regulačního cytokinu IL10.
Výsledky analýz provedených na velkých souborech pacientů nelze zatím jednoznačně uzavřít zejména kvůli metodickým rozdílům mezi jednotlivými studiemi. Velkou roli hraje i výběr kontrolních, zdravých jedinců, protože ani otázka charakterizace (standardizace) mikrobiomu zdravých lidí nebyla doposud zcela vyřešena [9].
Zvířecí modely střevních zánětů, které využívají gnotobiotické techniky, umožnily sledovat účast definovaných mikrobů a jejich směsí v patogenetických mechanizmech IBD. Ve zvířecích modelech IBD bylo jasně prokázáno, že přítomnost komenzálních mikrobů je nezbytná pro plný rozvoj lokálních i systémových zánětlivých změn [51,52]. Složení mikrobioty ovlivňuje intenzitu zánětu, některé bakterie mají známou prozánětlivou aktivitu: např. segmentovaná filamentózní bakterie (SFB) indukuje u zvířat střevní zánět, ale pouze pokud je součástí bakteriální komunity obsahující i další členy mikrobioty [53].
Celiakie
Celiakie je chronická, imunologicky mediovaná choroba vyvolaná u geneticky predisponovaných jedinců požíváním lepku (glutenu). Tato choroba postihuje přibližně 1 % evropské populace. Nemoc je charakterizovaná atrofií a zvýšenou celularitou sliznice tenkého střeva, hlavní roli v patogenezi hrají T-buňky. Autoimunitní charakter této choroby dosvědčuje přítomnost autoimunitních mechanizmů namířených proti několika autoantigenům, včetně diagnosticky nejdůležitějšího autoantigenu, tj. tkáňové transglutamináze [54].
Při srovnání se zdravými jedinci byla jak u pacientů s aktivní celiakií, tak u pacientů léčených a dodržujících bezlepkovou dietu popsána existence střevní dysbiózy [55,56]. I když se jednotlivé studie lišily velikostí studovaných kohort, věkem pacientů a použitými metodami, většina studií potvrdila u pacientů s celiakií snížené množství laktobacilů a bifidobakterií a zvýšený výskyt gramnegativních bakterií, především proteobakterií [57]. Obecně je také přijímáno, že bezlepková dieta má vliv na složení střevní mikrobioty a to, že vede k redukci výskytu jak potenciálně patogenních bakterií, tak bifidobakterií. Zdá se, že mikrobiota hraje roli i v klinické manifestaci nemoci, pacienti s gastrointestinálními symptomy mají jiné složení mikrobioty nejen při srovnání s kontrolami, ale i při srovnání s pacienty trpícími herpetiformní dermatitidou.
Je zajímavé, že některé komenzální bakterie jako Escherichia coli zvyšují aktivaci buněk přirozené imunity gliadinem, zatímco např. některé bifidobakterie naopak buňky přirozené imunity inhibují. Nedávno bylo prokázáno, že lidské střevní bakterie ovlivňují imunogenicitu glutenových peptidů a mohou tak zvyšovat riziko autoimunitní odpovědi na tento protein u geneticky predisponovaných jedinců [58]. V experimentálním modelu celiakie bylo ukázáno, že dysbióza modifikuje střevní propustnost a zvyšuje průnik gliadinových fragmentů střevní sliznicí [59].
Nádory
Obrovský zájem onkologů o mikrobiotu u nádorových chorob nedávno vyvolalo zjištění, že mikrobiota do značné míry ovlivňuje i účinnost moderní protinádorové imunoterapie tzv. „checkpoint“ inhibitory [60]. Vzhledem ke svým imunomodulačním schopnostem ale může mikrobiota významně ovlivňovat i citlivost jedince ke vzniku nádoru (karcinogenezi). Toto je nejlépe dokumentováno v patogenezi kolorektálního karcinomu, na níž se mikrobiota podílí hned několika mechanizmy.
Kolorektální karcinom (Colorectal Cancer – CRC) je maligní nádor původem z epitelových buněk střeva. CRC je v současnosti druhý nejčastější maligní nádor v Evropě. Přestože se ve většině případů jedná o sporadickou chorobu, existuje řada faktorů, které riziko jeho výskytu výrazně zvyšují. Jedním z nich je chronický zánět při IBD, který přispívá k iniciaci, progresi i diseminaci nádoru. A tak všechny faktory, které se uplatňují v patogenezi chronického zánětu v tlustém střevě při IBD (viz výše) také přispívají ke vzniku CRC. Kromě poškození střevní bariéry s následným chronickým zánětem mohou mikroby spouštět proces karcinogeneze ve střevním epitelu produkcí genotoxických látek. Podobně jako u IBD je průvodním znakem CRC dysbióza [61]. Pro pacienty s CRC je typický celkový pokles diverzity střevní mikrobioty a častější přítomnost mikrobů rodů Fusobacterium a Porphyromonas v lumen střeva. Ovlivněním proliferace, diferenciace, apoptózy a angiogeneze mohou komponenty a metabolity mikrobů karcinogenezi jak podporovat, tak tlumit. Některé mikroby, tzv. genotoxické komenzální bakterie, mohou měnit mikroprostředí, snižovat pH, měnit redox potenciál. Podobně jako při chronickém zánětu tak ve střevní tkáni vzniká oxidativní stres, který způsobí chromosomální nestabilitu, a tak přímo indukuje vznik CRC. Mezi tyto potenciálně karcinogenní bakterie patří Fusobacterium nucleatum, enterooxigenní Bacillus fragilis, genotoxická psk+ Escherichia coli a bakterie, které vykazují adhezivní invazivní fenotyp (adherentní-invazivní Escherichia coli) [62].
Většina zvířecích modelů kolorektálního karcinomu je postavena na indukci zánětu a současném podávání karcinogenu. Experimenty provedené s využitím gnotobiotických modelů prokázaly, že pro vznik zánětu s následným vývojem nádoru je potřebná přítomnost mikrobioty [63,64].
Působení mikrobů v patogenezi CRC je do značné míry dané přítomností vhodného substrátu, a tak není překvapením, že některé složky potravy incidenci CRC značně ovlivňují. Např. potrava s vysokým obsahem vlákniny riziko CRC snižuje a vysoká konzumace masa velkých domestikovaných zvířat (hovězí, vepřové, skopové a kůzlečí) naopak riziko CRC zvyšuje, zejména pokud bylo předem chemicky ošetřeno (uzením, solením či konzervačními látkami). Efekty stravy na vznik CRC se dají vysvětlit tím, že složení stravy ovlivňuje složení mikrobioty nejvýrazněji [65].
Mikrobiota v dutině ústní
Dutina ústní je významným místem pro vstup cizorodých látek do organizmu, ale ty jsou zde obvykle rychle rozpoznány slizničním imunitním systémem. Je tak zajištěno posouzení infekčních i neinfekčních podnětů, včetně jednotlivých složek potravy. Nedílnou součástí spolupracující s přirozenou imunitou jsou tzv. přirozené bariéry. Ty tvoří ochrannou mechanickou, chemickou i bakteriální zábranu proti vstupu a šíření patogenních látek. Obrana proti patogenním bakteriálním kmenům je v dutině ústní tvořena i lokálními komenzálními bakteriemi zároveň se slinami, především jejich antibakteriálními součástmi (lyzozym, laktoferin) a dále i samotným imunitním systémem. Složení ústní mikrobioty se mění v průběhu celého našeho života. Koncem intrauterinního vývoje a záhy po narození je možné nalézt bakterii Lactobacillus acidophillus. V období prořezávání mléčné dentice se objevují další bakteriální kmeny. V období adolescence pak dosahuje složení orální mikrobioty největší pestrosti. Převládajícími kmeny jsou Firmicutes (Streptococcus), Bacteroidetes (Prevotella), Proteobacteria (Haemophillus, Fusobacteria, Actinobacteria), fakultativní a striktní anaerobní kmeny (Veilonella, Spirocheta). V pozdějším věku se snižuje zastoupení bakterií, které mají kariogenní účinek. Jejich přítomnost klesá spolu se ztrátou dentice. Četnost jednotlivých bakteriálních kmenů je rozdílná i lokálně, v místech nepoškozené sliznice převažují Bacteroidetes a především řád Bacteroidales, v místech ulcerací Porphyromonadaceae a Veillonellaceae.
Onemocnění lokalizovaná v dutině ústní jsou také spojena s dysbiózou. Jsou popsány bakterie, které se významně podílejí na vzniku zubního kazu, poškození závěsného aparátu zubu, nebo kmeny přispívající k onemocnění sliznice dutiny ústní [66]. Kariogenní působení je popsáno u bakterií Streptococcus mutans a Streptococcus sanguis. Zvýšené zastoupení Parvimonas micra, Porphyromonas endodontalis, Treponema maltophilum a druhu Bacteroidales je spojeno s chronickou parodontitidou. V zubním plaku bývá přítomná i Pseudomonas aeruginosa. Zánět dásní, poškození parodontálních ligament a destrukce kosti je zesílena přítomností Porphyromonas gingivalis v zubním plaku [67]. Agresivní forma parodontitidy je dávána do souvislosti s bakterií Aggregatibacter actinomycetemcomitans. Záněty a porušení sliznic dutiny ústní často vedou k sekundárním recidivujícím mykotickým infekcím (Candida sp.). Herpetické infekce (Herpes simlex virus) jsou naopak jednou z možných příčin vzniku lézí na sliznici. Snížené zastoupení Streptococcus salivarius a převažující zastoupení Acinetobacter johnsonii je zjišťováno u pacientů s recidivující aftózní stomatitidou [68]. Orální dysbióza se podílí i na průběhu systémových onemocnění, jako jsou Crohnova choroba, ulcerózní kolitida, revmatoidní artritida. Je popsán podíl lokálního zánětu dutiny ústní na exacerbaci aterosklerotických změn. Orální mikrobiota má proto význam nejen lokální, ale i systémový. Fyziologické udržení komenzálních kmenů v převaze nad patogenními kmeny působí nejen proti lokálnímu zánětu, ale ovlivňuje i celkový stav organizmu.
Kožní mikrobiota a asociované kožní choroby
Kůže je nejvíc exponovaným orgánem našeho těla. Tvoří přirozenou bariéru organizmu a denně je vystavována velkému množství stimulů z vnějšího prostředí, kterým musí odolávat. Kromě samotné mechanické bariéry a imunitního systému kůže se na obraně proti vnějším vlivům podílí také kožní mikrobiota. Kožní mikrobiota je hlavní součástí fyziologické obrany kůže a úzce interaguje s přirozeným imunitním systémem [69,70]. Společně působí jako bariéra proti invazi patogenních mikrobů a proti přemnožení oportunních patogenů na povrchu kůže. Dalšími mechanizmy, kterými mikrobiota přímo ovlivňuje hostitele, patří rozklad potu a kožního mazu, produkce mikrobicidních látek a hlavně udržování přirozené homeostázy kůže, jež je velice důležitá pro prevenci vzniku kožních onemocnění [69].
Složení kožní mikrobioty každého člověka je závislé na mnoha faktorech, např. na demografických údajích (věk, pohlaví, etnikum, hormonální nastavení jedince), genetickém pozadí jedince (exprese lidských leukocytárních antigenů/Human Leucocyte Antigens – HLA), chování jedince (užívání antibiotik, návyky osobní hygieny, používání kosmetiky), faktorech životního prostředí (teplota, vlhkost, ultrafialové záření), způsobu porodu, délce kojení atd [71]. Dále je složení mikrobioty ovlivněno především vlastnostmi kůže: její vlhkostí či suchostí, umístěním mazových a potních žláz a také kontaminací z okolních sliznic. Nejhustší osídlení kožních mikroorganizmů na lidské kůži je v uzavřených oblastech (podpaží, meziprstní prostory, perineum). Nejméně početné pak na zádech, v záhybech ucha, mezi prsty u nohy. Kožní mikrobiota je nejvíce zastoupena těmito 4 kmeny Actinobacteria, zastoupené převážně rodem Propionibacterium a Corynebacterium, Firmicutes zastoupené převážně rodem Staphylococcus, Proteobacteria a Bacteroidetes. Na místech pokrytých mazem (záda či zevní zvukovod) dominují lipofilní rody jako např. Propionibacterium, zatímco vlhká místa kůže jsou osídlována převážně rody Staphyloccocus a Corynebacterium [72]. Největší zastoupení hub rodu Malassezia nalezneme na trupu a pažích, zatímco na nohách, jež jsou nejčastějším místem infekcí, je složení hub mnohem různorodější. Kromě hub rodu Malassezia zde nalezneme také houby rodu Aspergillus, Cryptococcus, Rhodotorula, Epicoccum a další [73].
V poslední době dochází k nárůstu kožních onemocnění asociovaných s dysbiózou, k níž u zdravého jedince může dojít např. nešetrnou lokální léčbou, detergenty, antibiotiky či kosmetikou [70]. Projevy kožních chorob jsou také často vázány na určitou část těla – určité bakteriální složení. Např. psoriáza je častěji na loktech a kolenou, atopická dermatitida u dospělých na vnitřní straně předloktí. Proto se současné studie zaměřují na porovnávání bakteriálních populací v místě kožního onemocnění a doufají, že nalezené změny v bakteriálních populacích povedou v budoucnu k přesnější diagnóze a léčbě kožních onemocnění [74].
Psoriáza, chronické zánětlivé onemocnění kůže, může být vyvolána nebo zhoršena specifickými patogeny, včetně bakterií (Staphylococcus aureus a Streptococcus pyogenes), viry (lidským papilomavirem a endogenními retroviry) a houbami (Malassezia a Candida albicans) [75]. V experimentálním myším modelu psoriázy jsme ukázali, že bezmikrobní myši vykazují daleko mírnější projevy kožního zánětu ve srovnání s myšmi konvenčně osídlenými. Také konvenční myši ovlivněné širokospektrou kombinací antibiotik vykazovaly výrazně nižší popisované parametry kožního zánětu a měly utlumenou aktivaci Th17 imunitní odpovědi, která hraje významnou úlohu v patogenezi tohoto onemocnění [76].
Projevy akné jsou již dlouho asociovány se zvýšeným výskytem Propionibacterium acnes [77]. Ačkoliv doposud nebyl u rosacey (dermatóza příbuzná akné) popsán žádný specifický patogen, její výskyt je asociován se zvýšeným výskytem Streptococcus epidermis a Chlamydophila pneumoniae v lézích [78]. Kolonizace Staphylococcus aureus je typická pro zánětlivá ložiska u atopické dermatitidy a množství této bakterie v lézích přímo koreluje se závažností onemocnění [79]. Pacienti s atopickou dermatitidou mají porušenou expresi antimikrobiálních proteinů v atopických lézích, což pravděpodobně vede k přemnožení patogenních bakterií [80]. Ačkoliv příčiny vzniku nežádoucích kožních projevů různého typu, které často doprovázejí aplikaci biologické léčby, nebyly doposud objasněny, domníváme se, že mikrobiota může v těchto patologických mechanizmech hrát významnou úlohu [75,81].
Možnosti ovlivnění mikrobioty
Nálezy dysbiózy u řady chorob vedly ke zvýšenému zájmu o možnost jejího ovlivnění. Nejdůležitějším faktorem regulujícím střevní mikrobiotu je složení stravy [65]. V poslední době je však velká pozornost věnovaná možnosti ovlivnit mikrobiotu přímo, tj. podáváním probiotických bakterií. Podle definice Food and Agriculture Organization (FAO) jsou probiotika živé mikroorganizmy, které pokud jsou podány v dostatečném množství, vykazují zdraví prospěšné účinky. Probiotické bakterie jsou přítomné v některých potravinách (jogurty, sýry atd), potravinových doplňcích nebo v lékové podobě. Jako probiotika slouží především bakterie mléčného kvašení (laktobacily, bifidobakterie), ale i jiné druhy bakterií (enterokoky, některé kmeny Escherichia coli) a kvasinky [82]. Prebiotika jsou většinou sacharidy (např. inulin), které podporují množení prospěšných bakterií (laktobacilů a bifidobakterií) ve střevě [83]. Podobné účinky má i mateřské mléko, které obsahuje velké množství prebiotických sacharidů. Synbiotika obsahují jak probiotika, tak prebiotika. Mechanizmus účinku jednotlivých probiotických bakterií je velmi široký, některé mají účinky imunostimulační a jiné vykazují účinky protizánětlivé, inhibiční (tab. 2). Navíc může být určitý mechanizmus v některých případech prospěšný a v jiných škodlivý. Například indukce Th17 může chránit před infekcí a zhoršovat tíži chronického zánětu. Pro jednotlivé nemoci by se tedy měla využívat určitá funkčně definovaná probiotika. Malá pozornost je dosud věnována analýze mechanizmu účinku jednotlivých probiotických kmenů a izolátů jednoho druhu, které se mohou značně lišit ve svých imunomodulačních účincích. Z některých nálezů vyplývá, že i lyzáty nebo definované komponenty probiotických bakterií mohou nahradit živé bakterie [84]. Existuje jen málo klinických studií, které jasně prokázaly léčebné účinky podávání probiotik u různých chorob. Zdá se, že probiotika mají účinky především preventivní. Terapeutické efekty byly popsány vzácně, např. u průjmů při antibiotické léčbě, pouchitidě, rotavirových průjmů, dráždivém tračníku a ulcerózní kolitidě. Existují studie, které ukazují na možnost využití tzv. příští generace prospěšných bakterií, které se zatím nedaří připravit průmyslově ve větším množství (např. Akkermansia muciniphila) [85]. Nejnovějším směrem ve využití probiotických bakterií k léčbě chorob je možnost přípravy a aplikace rekombinantních kmenů bakterií, které produkují biologicky aktivní molekuly, např. cytokiny s protizánětlivým účinkem.
Vzhledem k častému neúspěchu antibiotické léčby u infekce Clostridium difficile se k léčbě těchto závažných stavů začal úspěšně používat přenos střevní mikrobioty (tzv. fekální transplantace) od zdravých dárců [86]. V současnosti jsou publikovány první zkušenosti o využití fekální transplantace i u řady jiných chorob. U pacientů s ulcerózní kolitidou byla po fekální transplantaci prokázána změna složení mikrobioty, u pacientů s diabetem 2. typu bylo popsáno zlepšení některých parametrů, probíhají pokusy s léčbou obezity i psychických chorob. Nedávno byla publikována studie, ve které byly po přenosu stolice zdravých jedinců sníženy projevy autizmu. Terapeutická účinnost však u těchto chorob nebyla zatím jednoznačně prokázána, je však možné předpokládat, že se v této oblasti dočkáme zajímavých nálezů [87].
Závěr
Výrazné pokroky v molekulární a buněčné biologii umožňují podrobný rozbor složení mikrobioty a současně přinášejí v řadě fyziologických funkcí nové pohledy na její úlohu. Patologické stavy jsou doprovázeny výraznými změnami složení mikrobioty (dysbióza). Analýza účasti slizničního imunitního systému a mikrobioty v patogenezi chronických chorob využívající in vitro a in vivo přístupy včetně gnotobiologických a geneticky manipulovaných zvířecích modelů umožňuje nové pohledy na vznik a průběh těchto nemocí. Nevyřešenou zásadní otázkou však zůstává, zda pozorované změny v mikrobiotě jsou u jednotlivých chorob spojeny s vývojem nemoci kauzálně nebo jde o důsledek či asociaci.
Helena Tlaskalová-Hogenová je podporována grantem AZV (17–11275S), Zuzana Jirásková Zákostelská je podporována granty AZV (15–29336A, 15–30782A a 18–09–00493) a grantem GAČR (17–11275S), Jitka Petanová je podporována granty AZV 15–29336A a PQ25/1. LF, Miloslav Kverka je podporován granty AZV (15–28064A, 17–31248A a 18–05–00394) a granty GAČR (16–06326S a 17–09869S). Práce vznikla v rámci programu Akademie věd ČR Strategie AV21 Potraviny pro budoucnost.
MUDr. Miloslav Kverka, Ph.D.
Mikrobiologický ústav AV ČR, v.v.i., Praha
Doručeno do redakce 20. 5. 2018
Přijato po recenzi 26. 11. 2018
Literatura
Následující seznam citované literatury obsahuje pouze recentní položky. Úplný seznam literatury je k dispozici na www.vnitrnilekarstvi.eu.
Sources
3. Young VB. The role of the microbiome in human health and disease: an introduction for clinicians. BMJ 2017; 356: j831. Dostupné z DOI: <http://dx.doi.org/10.1136/bmj.j831>.
4. Tlaskalova-Hogenova H, Kverka M, Verdu EF et al. Chapter 8 – Gnotobiology and the Study of Complex Interactions between the Intestinal Microbiota, Probiotics, and the Host. In: Mestecky J, Strober W, Russell MW et al (eds). Mucosal Immunology (4th ed). Academic Press: Boston 2015 : 109–133. ISBN 978–0124158474.
6. Blaser MJ. Antibiotic use and its consequences for the normal microbiome. Science 2016; 352(6285): 544–545. Dostupné z DOI: <http://dx.doi.org/10.1126/science.aad9358>.
7. Gilbert JA, Blaser MJ, Caporaso JG et al. Current understanding of the human microbiome. Nat Med 2018; 24(4): 392–400. Dostupné z DOI: <http://dx.doi.org/10.1038/nm.4517>.
8. Butto LF, Schaubeck M, Haller D. Mechanisms of Microbe-Host Interaction in Crohn‘s Disease: Dysbiosis vs. Pathobiont Selection. Front Immunol 2015; 6 : 555. Dostupné z DOI: <http://dx.doi.org/10.3389/fimmu.2015.00555>.
9. Kverka M, Tlaskalova-Hogenova H. Intestinal Microbiota: Facts and Fiction. Dig Dis 2017; 35(1–2): 139–147. Dostupné z DOI: <http://dx.doi.org/10.1159/000449095>.
20. Alexander KL, Targan SR, Elson CO. Microbiota activation and regulation of innate and adaptive immunity. Immunol Rev 2014; 260(1): 206–220. Dostupné z DOI: <http://dx.doi.org/10.1111/imr.12180>.
21. Belkaid Y, Hand TW. Role of the microbiota in immunity and inflammation. Cell 2014; 157(1): 121–141. Dostupné z DOI: <http://dx.doi.org/10.1016/j.cell.2014.03.011>.
22. Smith PM, Howitt MR, Panikov N et al. The microbial metabolites, short-chain fatty acids, regulate colonic Treg cell homeostasis. Science 2013; 341(6145): 569–573. Dostupné z DOI: <http://dx.doi.org/10.1126/science.1241165>.
23. Weaver CT, Elson CO, Fouser LA et al. The Th17 pathway and inflammatory diseases of the intestines, lungs, and skin. Annu Rev Pathol 2013; 8 : 477–512. Dostupné z DOI: <http://dx.doi.org/10.1146/annurev-pathol-011110–130318>.
25. Palm NW, de Zoete MR, Cullen TW et al. Immunoglobulin A coating identifies colitogenic bacteria in inflammatory bowel disease. Cell 2014; 158(5): 1000–1010. Dostupné z DOI: <http://dx.doi.org/10.1016/j.cell.2014.08.006>.
26. Kawamoto S, Maruya M, Kato LM et al. Foxp3(+) T cells regulate immunoglobulin a selection and facilitate diversification of bacterial species responsible for immune homeostasis. Immunity 2014; 41(1): 152–165. Dostupné z DOI: <http://dx.doi.org/10.1016/j.immuni.2014.05.016>.
29. Marietta EV, Murray JA, Luckey DH et al. Suppression of Inflammatory Arthritis by Human Gut-Derived Prevotella histicola in Humanized Mice. Arthritis Rheumatol 2016; 68(12): 2878–2888. Dostupné z DOI: <http://dx.doi.org/10.1002/art.39785>.
30. Li B, Selmi C, Tang R et al. The microbiome and autoimmunity: a paradigm from the gut-liver axis. Cell Mol Immunol 2018; 15(6):595–609. Dostupné z DOI: <http://dx.doi.org/10.1038/cmi.2018.7>.
31. Opazo MC, Ortega-Rocha EM, Coronado-Arrazola I et al. Intestinal Microbiota Influences Non-intestinal Related Autoimmune Diseases. Front Microbiol 2018; 9 : 432. Dostupné z DOI: <http://dx.doi.org/10.3389/fmicb.2018.00432>.
36. Zhong D, Wu C, Zeng X et al. The role of gut microbiota in the pathogenesis of rheumatic diseases. Clin Rheumatol 2018; 37(1): 25–34. Dostupné z DOI: <http://dx.doi.org/10.1007/s10067–017–3821–4>.
38. Manfredo Vieira S, Hiltensperger M, Kumar V et al. Translocation of a gut pathobiont drives autoimmunity in mice and humans. Science 2018; 359(6380): 1156–1161. Dostupné z DOI: <http://dx.doi.org/10.1126/science.aar7201>.
39. Xiao L, Van‘t Land B, van de Worp W et al. Early-Life Nutritional Factors and Mucosal Immunity in the Development of Autoimmune Diabetes. Front Immunol 2017; 8 : 1219. Dostupné z DOI: <http://dx.doi.org/10.3389/fimmu.2017.01219>.
40. Paun A, Yau C, Danska JS. The Influence of the Microbiome on Type 1 Diabetes. J Immunol 2017; 198(2): 590–595. Dostupné z DOI: <http://dx.doi.org/.10.4049/jimmunol.1601519.
41. Hu Y, Wong FS, Wen L. Antibiotics, gut microbiota, environment in early life and type 1 diabetes. Pharmacol Res 2017; 119 : 219–226. Dostupné z DOI: <http://dx.doi.org/10.1016/j.phrs.2017.01.034
43. Burrows MP, Volchkov P, Kobayashi KS et al. Microbiota regulates type 1 diabetes through Toll-like receptors. Proc Natl Acad Sci USA 2015; 112(32): 9973–9977. Dostupné z DOI: <http://dx.doi.org/10.1073/pnas.1508740112>.
45. Wekerle H. Brain Autoimmunity and Intestinal Microbiota: 100 Trillion Game Changers. Trends Immunol 2017; 38(7): 483–497. Dostupné z DOI: <http://dx.doi.org/10.1016/j.it.2017.03.008>.
47. Fung TC, Olson CA, Hsiao EY. Interactions between the microbiota, immune and nervous systems in health and disease. Nat Neurosci 2017; 20(2): 145–155. Dostupné z DOI: <http://dx.doi.org/10.1038/nn.4476>.
48. Lukáš M. Etiologie a patogeneze idiopatických střevních zánětů. Vnitř Lék 2014; 60(7–8): 640–644.
49. de Souza HS. Etiopathogenesis of inflammatory bowel disease: today and tomorrow. Curr Opin Gastroenterol 2017; 33(4): 222–229. Dostupné z DOI: <http://dx.doi.org/10.1097/MOG.0000000000000364>.
54. Green PH, Lebwohl B, Greywoode R. Celiac disease. J Allergy Clin Immunol 2015; 135(5): 1099–1106.quiz 1107. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jaci.2015.01.044>.
55. Verdu EF, Galipeau HJ, Jabri B. Novel players in coeliac disease pathogenesis: role of the gut microbiota. Nat Rev Gastroenterol Hepatol 2015; 12(9): 497–506. Dostupné z DOI: <http://dx.doi.org/10.1038/nrgastro.2015.90>.
56. Cukrowska B, Sowinska A, Bierla JB et al. Intestinal epithelium, intraepithelial lymphocytes and the gut microbiota – Key players in the pathogenesis of celiac disease. World J Gastroenterol 2017; 23(42): 7505–7518. Dostupné z DOI: <http://dx.doi.org/10.3748/wjg.v23.i42.7505>.
57. Cenit MC, Olivares M, Codoner-Franch P et al. Intestinal Microbiota and Celiac Disease: Cause, Consequence or Co-Evolution? Nutrients 2015; 7(8): 6900–6923. Dostupné z DOI: <http://dx.doi.org/10.3390/nu7085314>.
58. Caminero A, Galipeau HJ, McCarville JL et al. Duodenal Bacteria From Patients With Celiac Disease and Healthy Subjects Distinctly Affect Gluten Breakdown and Immunogenicity. Gastroenterology 2016; 151(4): 670–683. Dostupné z DOI: <http://dx.doi.org/10.1053/j.gastro.2016.06.041>.
60. Zitvogel L, Ma Y, Raoult D et al. The microbiome in cancer immunotherapy: Diagnostic tools and therapeutic strategies. Science 2018; 359(6382): 1366–1370. Dostupné z DOI: <http://dx.doi.org/10.1126/science.aar6918>.
61. Tilg H, Adolph TE, Gerner RR et al. The Intestinal Microbiota in Colorectal Cancer. Cancer Cell 2018; 33(6): 954–964. Dostupné z DOI: <http://dx.doi.org/10.1016/j.ccell.2018.03.004>.
62. Allen-Vercoe E, Jobin C. Fusobacterium and Enterobacteriaceae: important players for CRC? Immunol Lett 2014; 162(2 Pt A): 54–61. Dostupné z DOI: <http://dx.doi.org/10.1016/j.imlet.2014.05.014>.
63. Klimesova K, Kverka M, Zakostelska Z et al. Altered gut microbiota promotes colitis-associated cancer in IL-1 receptor-associated kinase M-deficient mice. Inflamm Bowel Dis 2013; 19(6): 1266–1277. Dostupné z DOI: <http://dx.doi.org/10.1097/MIB.0b013e318281330a>.
64. Tlaskalova-Hogenova H, Vannucci L, Klimesova K et al. Microbiome and colorectal carcinoma: insights from germ-free and conventional animal models. Cancer J 2014; 20(3): 217–224. Dostupné z DOI: <http://dx.doi.org/10.1097/PPO.0000000000000052>.
65. David LA, Maurice CF, Carmody RN et al. Diet rapidly and reproducibly alters the human gut microbiome. Nature 2014; 505(7484): 559–563. Dostupné z DOI: <http://dx.doi.org/10.1038/nature12820>.
67. Costalonga M, Herzberg MC. The oral microbiome and the immunobiology of periodontal disease and caries. Immunol Lett 2014; 162(2 Pt A): 22–38. Dostupné z DOI: <http://dx.doi.org/10.1016/j.imlet.2014.08.017>.
68. Kim YJ, Choi YS, Baek KJ et al. Mucosal and salivary microbiota associated with recurrent aphthous stomatitis. BMC Microbiol 2016; 16(Suppl 1): 57. Dostupné z DOI: <http://dx.doi.org/10.1186/s12866–016–0673-z>.
69. Belkaid Y, Segre JA. Dialogue between skin microbiota and immunity. Science 2014; 346(6212): 954–959. Dostupné z DOI: <http://dx.doi.org/10.1126/science.1260144>.
70. Sanford JA, Gallo RL. Functions of the skin microbiota in health and disease. Semin Immunol 2013; 25(5): 370–377. Dostupné z DOI: <http://dx.doi.org/10.1016/j.smim.2013.09.005>.
73. Findley K, Oh J, Yang J et al. Topographic diversity of fungal and bacterial communities in human skin. Nature 2013; 498(7454): 367–370. Dostupné z DOI: <http://dx.doi.org/10.1038/nature12171>.
74. Zeeuwen PL, Kleerebezem M, Timmerman HM et al. Microbiome and skin diseases. Curr Opin Allergy Clin Immunol 2013; 13(5): 514–520. Dostupné z DOI: <http://dx.doi.org/10.1097/ACI.0b013e328364ebeb>.
75. Fry L, Baker BS, Powles AV et al. Is chronic plaque psoriasis triggered by microbiota in the skin? Br J Dermatol 2013; 169(1): 47–52. Dostupné z DOI: <http://dx.doi.org/10.1111/bjd.12322>.
76. Zakostelska Z, Malkova J, Klimesova K et al. Intestinal Microbiota Promotes Psoriasis-Like Skin Inflammation by Enhancing Th17 Response. PLoS One 2016; 11(7): e0159539. Dostupné z DOI: <http://dx.doi.org/10.1371/journal.pone.0159539>.
77. Fitz-Gibbon S, Tomida S, Chiu BH et al. Propionibacterium acnes strain populations in the human skin microbiome associated with acne. J Invest Dermatol 2013; 133(9): 2152–2160. Dostupné z DOI: <http://dx.doi.org/10.1038/jid.2013.21>.
78. Holmes AD. Potential role of microorganisms in the pathogenesis of rosacea. J Am Acad Dermatol 2013; 69(6): 1025–1032. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jaad.2013.08.006>.
79. Wollina U. Microbiome in atopic dermatitis. Clin Cosmet Investig Dermatol 2017; 10 : 51–56. Dostupné z DOI: <http://dx.doi.org/10.2147/CCID.S130013>.
82. Reid G. Probiotics: definition, scope and mechanisms of action. Best Pract Res Clin Gastroenterol 2016; 30(1): 17–25. Dostupné z DOI <http://dx.doi.org/10.1016/j.bpg.2015.12.001>.
83. Petschow B, Dore J, Hibberd P et al. Probiotics, prebiotics, and the host microbiome: the science of translation. Ann NY Acad Sci 2013; 1306 : 1–17. Dostupné z DOI: <http://dx.doi.org/10.1111/nyas.12303>.
85. Cani PD, de Vos WM. Next-Generation Beneficial Microbes: The Case of Akkermansia muciniphila. Front Microbiol 2017; 8 : 1765. Dostupné z DOI: <http://dx.doi.org/10.3389/fmicb.2017.01765>.
86. van Nood E, Vrieze A, Nieuwdorp M et al. Duodenal infusion of donor feces for recurrent Clostridium difficile. N Engl J Med 2013; 368(5): 407–415. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMoa1205037>.
87. Cammarota G, Ianiro G, Tilg H et al. European consensus conference on faecal microbiota transplantation in clinical practice. Gut 2017; 66(4): 569–580. Dostupné z DOI: <http://dx.doi.org/10.1136/gutjnl-2016–313017>.
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Internal Medicine

2019 Issue 2
-
All articles in this issue
- Zánět obranný a poškozující: základní charakteristiky
- Cytokiny rodiny IL1 u chronických zánětlivých procesů
- Heterogenita lymfocytov ako ústredných operačných jednotiek imunitného systému
- Mikrobiota, imunita a imunologicky mediované choroby
- Primární imunodeficience u dospělých
- Sekundární imunodeficience jako následek chronických onemocnění
- Léčba humorálních imunodeficiencí
- Nežádoucí účinky imunoglobulinové léčby
- Současné trendy v imunosupresivní léčbě
- Co dnes znamená alergologie pro internu a naopak
- Anafylaktické příznaky a anafylaktický šok
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue
- Anafylaktické příznaky a anafylaktický šok
- Nežádoucí účinky imunoglobulinové léčby
- Současné trendy v imunosupresivní léčbě
- Primární imunodeficience u dospělých
