Syndrom akutní dechové tísně
Acute respiratory distress syndrome
Acute respiratory distress syndrome (ARDS) is a type of acute diffuse lung injury associated with a predisposing risk factor, characterized by inflammation leading to increased pulmonary vascular permeability and loss of aerated lung tissue. The hallmarks of the clinical syndrome are hypoxemia and bilateral radiographic opacities, associated with several physiological derangements including: increased pulmonary venous admixture, increased physiological dead space, and decreased respiratory system compliance. No pharmacologic treatments aimed at the underlying pathology have been shown to be effective, and the management remains supportive. Lung-protective mechanical ventilation remains the key supportive intervention in ARDS patients, although extracorporeal lung support may extend its role in the near future.
Keywords:
ARDS – corticosteroid – mechanical ventilation – muscle relaxants – prone position
:
Vlasta Dostálová; Pavel Dostál
:
Vnitř Lék 2019; 65(3): 193-203
:
Syndrom akutní dechové tísně (acute respiratory distress syndrome – ARDS) je akutní difuzní plicní poškození asociované s predisponujícími rizikovými faktory, charakterizované zánětem vedoucím ke zvýšené kapilární permeabilitě a ztrátě vzdušné plicní tkáně. Klíčovými klinickými rysy jsou hypoxemie a bilaterální plicní infiltráty (opacity) asociované se závažnými fyziologickými změnami: zvýšením plicní venózní příměsi, zvýšením mrtvého prostoru a snížením poddajnosti respiračního systému. V současné době nemáme k dispozici žádnou klinicky dostupnou metodu terapie ARDS. Péče o nemocné s ARDS je založena na identifikaci a léčbě příčiny ARDS, vhodném použití metod orgánové podpory a obecných rutinních preventivních postupech používaných v intenzivní péči. Přes dominantní úlohu umělé plicní ventilace dochází v posledních letech prudkému rozvoji metod mimotělní plicní podpory.
Klíčová slova:
ARDS – ECMO – pronační poloha – svalová relaxace – umělá plicní ventilace
Úvod
Syndrom akutní dechové tísně (acute respiratory distress syndrome – ARDS), také v minulosti nazývaný jako syndrom dechové tísně dospělých, nekardiální plicní edém, posttraumatická plicní nedostatečnost, syndrom plicního kapilárního leaku, šoková plíce, DaNang nebo vietnamská plíce, je klinický syndrom náhle vzniklého zánětlivého postižení plic různé etiologie, jehož důsledkem jsou funkční a strukturální změny plicní tkáně, vedoucí k závažné až katastrofické poruše oxygenační funkce plic.
Termín ARDS (adult respiratory distress syndrom) byl prvně použit Ashbaughem et al v roce 1968, kdy byla popsána série 12 nemocných s plicním postižením podobným tzv. infant respirátory distress syndrome [1]. Typickým nálezem byly bilaterální plicní infiltráty, intersticiální a alevolární edém s tvorbou tzv. hyalinních membrán při histologickém vyšetření plic a snížení plicní poddajnosti [1]. Smrtnost v popsaném souboru činila 58 %.
Názory na patofyziologii ARDS, diagnostická kritéria, možnosti prevence a terapeutické intervence prodělaly za poslední období bouřlivý vývoj.
Současný konceptuální model považuje ARDS za akutní difuzní plicní poškození asociované s predisponujícími rizikovými faktory, charakterizované zánětem vedoucím ke zvýšené kapilární permeabilitě a ztrátě vzdušné plicní tkáně. Klíčovými klinickými rysy jsou hypoxemie a bilaterální plicní infiltráty spojené se závažnými fyziologickými změnami: zvýšením plicní venózní příměsi, zvýšením mrtvého prostoru a snížením poddajnosti respiračního systému. Morfologické znaky zahrnují v akutní fázi plicní edém, zánět, hyalinní membrány a alveolární hemoragie, tj. známky tzv. difuzního alveolárního poškození (diffuse alveolar damage – DAD) [2].
Dnes je obecně přijímáno, že ARDS nelze považovat za nozologickou jednotku, neboť vzhledem k různé etiologii závažné plicní dysfunkce, rozdílům v patofyziologii vzniku plicní dysfunkce a existenci více variant morfologického charakteru plicních změn jsou v rámci tohoto syndromu léčeni nemocní jak s diametrálně odlišnou odpovědí na některé léčebné postupy, tak také prognózou.
Význam syndromu ARDS tak z klinického hlediska spočívá především v možnosti identifikovat nemocné s vysokými rizikem smrti a včasně u nich indikovat odpovídající podpůrné metody, jejichž cílem je poskytnout čas do odeznění plicní dysfunkce nebo omezit nežádoucí účinky podpůrných postupů, především umělé plicní ventilace (UPV).
Výskyt a prognóza ARDS
Recentní tuzemské údaje o výskytu ARDS nejsou k dispozici. Novější zahraniční data ukazují na výskyt až 7 případů na 100 000 obyvatel za rok [3]. Přes významný vývoj intenzivní medicíny je nadále rozvoj ARDS spojen s vysokou smrtností, která je obvykle udávána v rozmezí 40–60 %, přestože byly v rámci pro účely klinických studií selektovaných populací publikovány i soubory nemocných se smrtností v pásmu 15–30 % [2–4]. V nedávno publikované studii DACAPO z Německa byla nemocniční smrtnost v souboru 1 225 nemocných s ARDS 29,5 % [5]. Smrtnost nemocných s velmi těžkými formami ARDS v kontrolní skupině studie EOLIA, u kterých byla předpokládána smrtnost asi 60 %, činila 46 % [6]. Nejvýznamnějšími faktory ovlivňujícími prognózu nemocných jsou věk, předchozí onemocnění, imunodeprese, charakter příčiny akutního plicního poškození, počet a typ selhávajících orgánů, bezvědomí, stupeň poruchy výměny plynů po 24 hodinách umělé plicní ventilace, hodnota tzv. simplified acute physiology score (SAPS) [3,4] a místo péče s vyšším rizikem smrti v neuniverzitních nemocnicích [7].
Etiologie
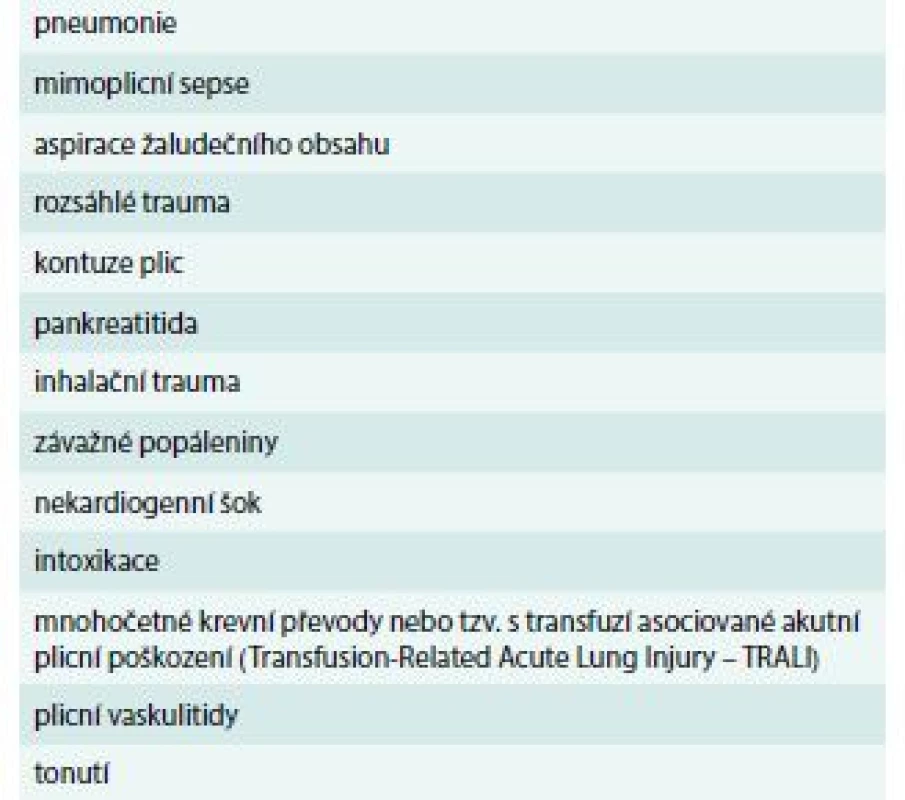
Za příčinu ARDS je v tradičním vnímání považovaná dysregulovaná zánětlivá odpověď organizmu na působení definovaných inzultů. V minulosti byly tyto inzulty děleny na mimoplicní a plicní, způsobující direktní respektive indirektní plicní poškození, současná definice hovoří vzhledem k jejich možnému překryvu v klinické praxi o tzv. rizikových faktorech. Identifikace takového rizikového faktoru je významná jak z pohledu splnění diagnostických kritérií ARDS, tak především pro léčbu etiologie syndromu (tab. 1) [2].
Diagnostická kritéria
Pro současnou klinickou praxi je významná tzv. americko-evropská konsenzuální konference z roku 1994, která definovala diagnostická kritéria ARDS a lehčí formy tohoto syndromu, tzv. akutní plicní poškození (Acute Lung Injury – ALI) [4]. Tato diagnostická kritéria, přes řadu nedostatků, zůstávají v povědomí odborné veřejnosti.
V roce 2012 byla publikována tzv. berlínská definice ARDS, která zavádí termíny mírný, střední a těžký ARDS (tab. 2), termín ALI již nedoporučuje používat [2]. Stupně závažnosti dle této definice lépe korelují s prognózu nemocných. Nově tato definice nepřipouští možnost stanovit diagnózu ARDS bez použití distenzní plicní podpory ve formě kontinuálního přetlaku v dýchacích cestách (Continuous Positive Airway Pressure – CPAP) nebo neinvazivní ventilace pro mírný ARDS nebo invazivní umělé plicní ventilace s hodnotou pozitivního endexspiračního tlaku (Positive End Exspiratory Pressure – PEEP) na úrovni alespoň 5 cm H2O pro střední a těžký ARDS [2].

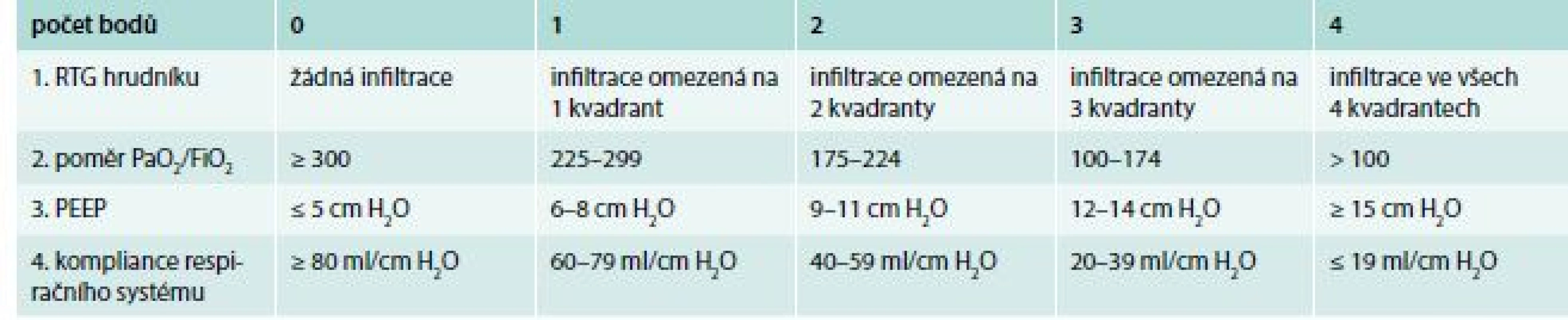
Na některých pracovištích je pro posouzení závažnosti ARDS používáno tzv. lung injury severity score [8], nazývané také Murray score (tab. 3). Použití tohoto skóre může být součástí indikačních kritérií pro zvážení použití metod mimotělní plicní podpory. Předností tohoto skóre je zvýraznění prognostického významu morfologického rozsahu plicních změn a stupně redukce plicní poddajnosti.
Patofyziologická charakteristika ALI/ARDS
Podrobný popis patogeneze a patofyziologie ARDS přesahuje rámec tohoto sdělení, v tuzemském písemnictví je tato problematika detailně zpracována v nedávno vydané monografii Jana Mácy a kolektivu autorů s názvem ARDS [100].
ARDS je svou povahou převážně restriktivní plicní onemocnění, vzniklé v důsledku zvýšené permeability alveolokapilární membrány při difuzním alveolárním anebo endoteliálním poškození zánětlivé povahy [2,4]. Důsledkem zvýšené permeability endotelu, epitelu alveolů a terminálních bronchiolů s porušením funkce surfaktantového systému je zmnožení extravaskulární plicní vody s intersticiálním a alveolárním edémem. Maximum morfologických změn (edému a alveolárního kolapsu) je obvykle lokalizováno do oblastí plic s nejnižším transpulmonálním tlakovým gradientem, tj. v tzv. dependentních plicích [9]. Výše uvedená distribuce morfologických změn se typicky vyskytuje u pacientů s tzv. extrapulmonálním ARDS [10]. U primárně plicních příčin ARDS často nemá distribuce infiltrátů v plicích uvedený ventrodorzální charakter [11].
Při alveolárním edému a kolapsu dochází k poklesu funkční reziduální kapacity (Functional Residual Capacity – FRC), u ventilovaných nemocných je místo FRC používán termín endexspirační plicní objem (End-Expiratory Lung Volume – EELV), klesá i celková plicní kapacita [12]. Tento fenomén byl v 80. letech minulého století popsán L. Gattinonim jako tzv. baby lung [13]. Ventilace tzv. normální velikosti dechového objemu (v minulosti až 10–15 ml/kg predikované tělesné hmotnosti) je proto spojena s nepřiměřeným zvýšením regionální ventilace ve zbylých vzdušných plicních oblastech. Důsledkem jsou velké změny objemu alveolů v průběhu dechového cyklu, což významně zvyšuje riziko poškození způsobené nadměrnými endinspiračními plicními objemy (tzv. volutrauma) [14].
Z funkčního hlediska se některé plicní oblasti nemocných s ARDS chovají při inflaci plíce jako trvale vzdušné (tzv. healthy units), jiné jako trvale nevzdušné (tzv. nonrecruitable units) a v některých oblastech dochází po zvýšení tlaku v dýchacích cestách k jejich skokovému provzdušnění (tzv. recruitable units) [15]. Na základě výsledků experimentálních studií se předpokládá, že za určitých okolností je možné vysokými dlouhodobě působícími tlaky přesunout rozhraní tekutiny a vzduchu z malých dýchacích cest do alveolárního prostoru a provzdušnit tyto plicní jednotky, některými autory je ale tato možnost zpochybňována [16]. Dalším mechanizmem vzniku nevzdušnosti plicní tkáně je vznik kompresních atelektáz v důsledku snížení transpulmonálního tlakového gradientu, narušení funkce surfaktantového systému a zvýšení intersticiálního tkáňového tlaku v plicích [17].
I u nemocných s ARDS může především v dependentních plicních oblastech docházet v průběhu dechového cyklu k cyklickému kolapsu dýchacích cest [18,19]. Hypoventilované plicní sklípky v těchto oblastech dostávají snížené množství „čerstvé“ směsi plynů. Důsledkem je vznik resorpčních atelektáz, rychlost jejich vzniku stoupá při použití vyšších koncentrací kyslíku [20].
Zvrat kompresních a resorpčních atelektáz je možný zvýšením tlaku v dýchacích cestách. Fenomén provzdušnění do té doby nevzdušných plicních oblastí je označován jako tzv. recruitment [17].
Vzhledem k dysfunkci surfaktantového systému a zvýšenému intersticiálnímu tlaku, který je určen především hodnotou pleurálního tlaku a hydrostatického tlaku v plicní tkáni, tj. množstvím extravaskulární vody a výškou plicního parenchymu [12,15], jsou alveoly a malé dýchací cesty i po provzdušnění nestabilní. Proto je nutné udržet po celou dobu dechového cyklu, a tedy i v době exspiria, nezbytný transpulmonální tlakový gradient, v průběhu konvenční UPV nejčastěji aplikací PEEP [15,17].
Dochází-li v průběhu dechového cyklu v inspiriu k otevření, provzdušnění určité plicní jednotky a v exspiriu k jejímu kolapsu, označujeme tento jev jako tzv. dechový recruitment [17]. Předpokládá se, že tento fenomén je spojen s rizikem poškození především malých dýchacích cest v průběhu ventilace pozitivním přetlakem [18,19].
Z pohledu taktiky UPV je důležitá tzv. recruitabilita plic. Rozlišení provzdušnitelných a neprovzdušnitelných jednotek je možné pouze testováním.
Obecně platí, že recruitabilita stoupá se závažností ARDS. Recruitabita se pohybuje v časné fázi ARDS od 0 % do asi 60 % objemu plicní tkáně, medián je udáván přibližně 10–12 %. Na PEEP 5 cm H2O je u nemocných s mírným ARDS udávána recruitabilta 5 % (2–12 %), se středním ARDS 12 % (7–18 %) a s těžkým ARDS 23 % (12–30 %) [20,21]. Některé fenotypy ARDS mají recruitabilitu minimální a použití vysokého tlaku v dýchacích cestách může vést ke zvýšení pravolevého plicního zkratu redistribucí průtoku krve do neventilovaných oblastí. Nejnižší recruitabilitu mají nemocní s lobárním charakterem postižení, středně postižení nemocní s vícečetnými infiltráty (tzv. patchy infiltrates) a naopak nemocní s těžkým ARDS s difuzním charakterem plicního postižení [22].
Posuzování tíže ARDS pouze na základě míry alterace poměru PaO2/FiO2 může být zavádějící, protože zanedbává vliv rozsahu strukturálních plicních změn vyjádřených stupněm redukce plicní poddajnosti. Navíc je až u 20–30 % nemocných s ARDS popisováno otevřené foramen ovale se současným nitrosrdečním pravolevým zkratem [23].
Nehomogenity plicního parenchymu, tzv. stress raisers, vedou k amplifikaci mechanických sil, které zatěžují plicní struktury při inflaci. Snížení jejich výskytu, např. vhodnou aplikací PEEP, snižuje pravděpodobně riziko poškození plic umělou plicní ventilací [20,21,24].
Snížení plicního objemu s relativní hyperinflací vzdušných plicních oblastí v průběhu dechového cyklu je hlavní příčinou snížení statické plicní poddajnosti [13,15]. Prakticky vždy u nemocných s ARDS extrapulmonální etiologie a i části nemocných s plicní etiologií ARDS dochází také k významné redukci poddajnosti hrudní stěny [10,11]. U nemocných s ARDS bylo opakovaně prokázáno i zvýšení rezistence respiračního systému [25].
Přítomnost nevzdušných nebo výrazně hypoventilovaných plicních oblastí je hlavní příčinou hypoxemie u nemocných s ARDS [4]. U nemocných s významným plicním zkratem stoupá vliv změn obsahu kyslíku ve smíšené žilní krvi na obsah kyslíku v arteriální krvi [26].
Rozvoj ARDS je provázen také zhoršením eliminace CO2 v důsledku zvýšení velikosti mrtvého prostoru [4]. Umělá plicní ventilace a použití PEEP mohou být spojeny s dalším zhoršením poměru mezi velikostí mrtvého prostoru a dechovým objemem (zvýšením tlaku v dýchacích cestách může dojít ke zvětšení objemu té části plic, která je ventilována, ale není perfundována) [4,26].
Udržení spontánní dechové aktivity je při zajištění ventilační podpory nemocných s ARDS považováno za velmi významné, nevede-li ke zhoršení oxygenace [22]. Ke zhoršení oxygenace dochází u některých nemocných s patologickým dechovým vzorem buď při krátké době inspiria nebo u nemocných s usilovným aktivním exspiriem, v obou případech klesá EELV. U nejtěžších forem ARDS je obvykle nutná řízená ventilace, usilovné spontánní dýchání je potenciálně spojeno i s rizikem zhoršení plicního poškození [27,28].
Vývoj ARDS je z časového hlediska tradičně členěn do akutní, subakutní a pozdní fáze [4]. Výše popsané patofyziologické změny jsou typické pro akutní fázi ARDS. V subakutní fázi dochází k přestavbě plicního parenchymu a uplatnění reparačních dějů, jejichž výsledkem je obnovení strukturální integrity nebo rozvoj plicní fibrózy v různém poměru [29]. Při nepříznivém vývoji a převaze fibrotických dějů dále klesá plicní poddajnost, přetrvává porucha oxygenační funkce plic. PEEP je v této fázi méně efektivní [4]. Vzhledem k porušení plicního pojivového skeletu dále stoupá riziko plicního poškození způsobeného umělou plicní ventilací [12,15].
V pozdní fázi onemocnění přetrvává výrazná porucha oxygenační funkce plic, spojená často s velmi nízkou poddajností plic. Z morfologického hlediska vznikají pseudocysty, pseudoemfyzém, pneumatokély (v konsolidovaných oblastech plic), bronchodysplazie nebo jiné známky barotraumatu [15].
Z hlediska přístupu k umělé plicní ventilaci je některými autory považováno za důležité rozlišení na ARDS vznikající v důsledku primárně plicního nebo mimoplicního onemocnění [10,30]. U nemocných s ARDS vznikajícím působením mimoplicních příčin se tradičně předpokládá, že pokles poddajnosti plic je doprovázen také poklesem poddajnosti/zvýšením elastance hrudní stěny v důsledku edému hrudní stěny anebo zvýšení nitrobřišního tlaku [4,10,17]. Elastance hrudní stěny může představovat i více než 50 % elastance respiračního systému, tj. i více než 50 % tlaku nezbytného k udržení respiračního systému v rozepnutém stavu může být spotřebováno na rozepnutí hrudní stěny [10]. Pro přesné stanovení elastance plic a elastance hrudní stěny je nezbytná znalost pleurálního tlaku. V klinické praxi se jako ukazatel pleurálního tlaku používá měření tzv. jícnového tlaku pomocí balonkového jícnového katétru. V reálné praxi je nutné očekávat změny vlastností hrudní stěny i u nemocných s primárně plicním inzultem.
Terapie nemocných s ARDS
V současné době nemáme k dispozici žádnou klinicky dostupnou metodu terapie ARDS. Péče o nemocné s ARDS je založena na identifikaci a léčbě příčiny ARDS, vhodném použití metod orgánové podpory a obecných rutinních preventivních postupech používaných v intenzivní péči.
Terapie inzultu vedoucího k rozvoji ARDS
Identifikace, kontrola a eliminace inzultu vedoucího k ARDS je základním předpokladem úspěšné léčby. V řadě případů je příčina zřejmá a v době rozvoje ARDS může být již kontrolována (např. při traumatu), v jiných případech je okamžitá kontrola vyvolávajícího inzultu obtížná až nemožná (např. při akutní pankreatitidě). Zvláště u nemocných bez zjevných mimoplicních inzultů je nutné věnovat maximální pozornost vyloučení plicní manifestace vaskulitid a dalších systémových onemocnění pojiva a akutních exacerbací chronických intersticiálních plicních procesů.
Přístrojové metody podpory oxygenace a ventilace
Vysokoprůtoková nosní oxygenoterapie
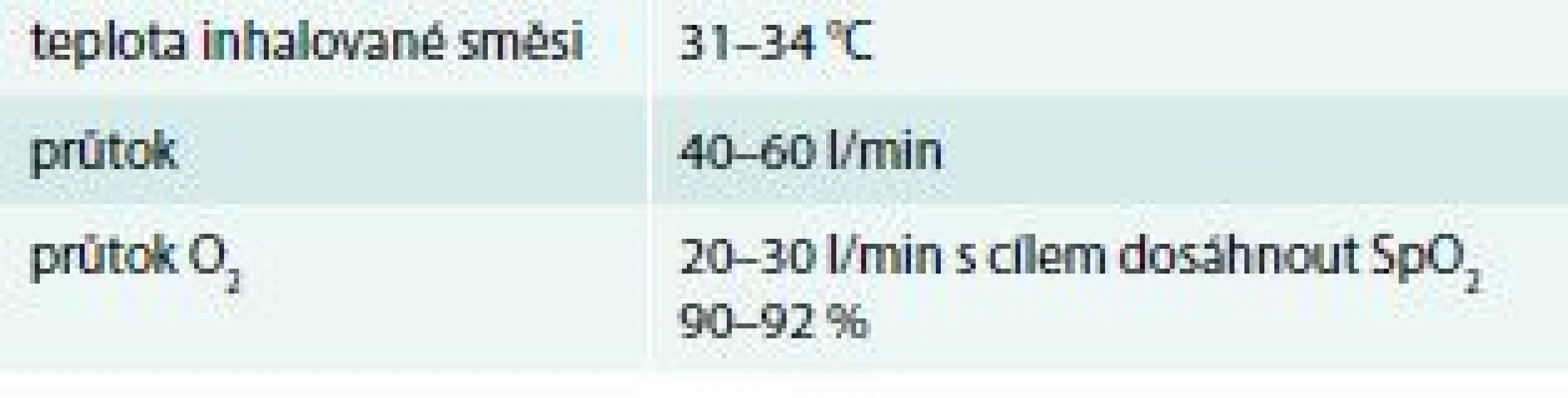
Vysokoprůtoková nosní oxygenoterapie (High Flow Nasal Oxygen – HFNO) je v současnosti považována za metodu volby při podpoře nemocných s lehkým ARDS, kteří nevyžadují invazivní umělou plicní ventilaci z jiné indikace [31], přestože tento závěr není bezvýhradně akceptován [32]. Předností HFNO je ve srovnání s neinvazivní ventilaci lepší tolerance a v některých studiích je pozorována i nižší smrtnost [31,32]. Obvyklé výchozí nastavení HFNO v této indikaci na pracovišti autorů je uvedeno v tab. 4.
Neinvazivní přetlaková ventilace
Předností neinvazivní přetlakové ventilace (NIPPV) je lepší podpora eliminace CO2 ve srovnání s HFNO, nevýhodou obecně horší tolerance. Tradičně je NIPPV určena pouze pro nemocné s lehkou formou ARDS nebo imunodeficitem [33], použití NIPPV u nemocných s PaO2/FiO2 < 150 mm Hg je ve srovnání s invazivní ventilací spojeno se zvýšenou smrtností [34]. Riziko selhání NIPPV v této indikaci je vysoké a pohybuje se až kolem 50 % [34].
Recentní práce ukázala, že riziko selhání NIPPV je nižší při použití helmy než celoobličejové masky [35]. Absence časné klinické odpovědi na NIPPV je důvodem k časné konverzi na invazivní plicní ventilaci, prodlužování NIPPV v této situaci je spojeno s vyšším rizikem smrti [33].
Konvenční invazivní přetlaková ventilace
Konvenční přetlaková invazivní ventilace je metodou volby v iniciálním zajištění nemocných se středním a těžkým ARDS a u nemocných, u kterých se ARDS rozvíjí v rámci syndromu multiorgánové dysfunkce. Vzhledem k riziku zhoršení plicního poškození při nevhodně vedené přetlakové ventilaci byla navržena řada tzv. protektivních ventilačních strategií, jejichž cílem je minimalizovat rozsah tohoto poškození. Všem protektivním postupům je společná redukce velikosti dechového objemu, limitace inspiračního plató tlaku, existence určitého doporučení pro volbu PEEP a snaha o použití tzv. netoxických hodnot inspirační frakce kyslíku. Hlavní zásady jsou uvedeny v následujícím textu.
Kontrola velikosti dechového objemu a inspiračního plató tlaku
Je doporučeno použít velikost dechového objemu asi 6 ml/kg tzv. predikované tělesné hmotnosti (tab. 5) a zajistit případnou další redukci dechového objemu tak, aby bylo dosaženo inspiračního plató tlaku < 30 cm H2O [36,37]. Na pracovišti autorů je preferován limit 27 cm H2O, který lépe garantuje nepřítomnost tzv. dechové hyperinflace [38]. Recentní analýzy ukazují, že více než velikost dechového objemu ovlivňuje riziko umělé plicní ventilace hodnota tzv. driving pressure [39], která odpovídá gradientu mezi endinispiračním a endexspiračním tlakem. Hodnoty driving pressure > 12–15 cm H2O jsou spojeny s významně vyšším rizikem smrti [39,40].
![Přehled vybraných údajů z protokolu ARMA studie. Upraveno podle [36]](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/e5d0971fd66c67e3becd1e444e367070.jpeg)
SpO2 – saturace hemoglobinu stanovená pulzní oxymetrií
Vysoké dechové objemy nebo tlaky mohou být také důsledkem intermitentní interference s ventilátorem. Zvlášť rizikové je tzv. dvojité triggerování [41].
Blíží-li se inspirační plató tlaku limitu inspiračního tlaku, je dále velikost dechového objemu redukována až na 4 ml/kg predikované tělesné hmotnosti.
Použití dechového objemu asi 3–5 ml/kg predikované hmotnosti je označováno jako tzv. ultraprotektivní ventilace [42]. Použití takto nízkých dechových objemů vyžaduje vždy minimalizaci instrumentálního mrtvého prostoru (použitím aktivního zvlhčování) a kontrolu produkce CO2 aktivní kontrolou tělesné teploty. Snížení dechových objemu na ≤ 4 ml/kg predikované tělesné hmotnosti již u většiny nemocných vyžaduje použití mimotělní eliminace CO2.
U nemocných s nízkou poddajností hrudní stěny je obvykle nutné limit inspiračního plató tlaku 27 cm H2O překročit, bezpečnou hranici inspiračního tlaku nelze u těchto nemocných bez rozšířeného monitorování mechanických vlastností hrudní stěny, obvykle pomocí měření jícnového tlaku, spolehlivě stanovit.
Tolerance mírné hyperkapnie, respirační acidózy a hypoxemie
Mírná hyperkapnie (PaCO2 < 65 mm Hg; pH > 7,2) je většinou nemocných krátkodobě dobře tolerována [43]. Respirační acidóza může mít z krátkodobého hlediska protektivní protizánětlivé účinky, z dlouhodobého hlediska ale zvyšuje riziko plicní infekce [43]. Za hraniční hodnoty PaCO2 jsou v akutní fázi považovány hodnoty PaCO2 70–80 mm Hg, především pro vliv akutní hyperkapnie na plicní hypertenzi [43,44]. Při rozvoji akutního cor pulmonale by měla být hodnota PaCO2 účinně kontrolována i za cenu použití mimotělních metod plicní podpory [44].
Cílová tenze kyslíku v arteriální krvi a hodnota SaO2 je předmětem kontroverze, především pro obavu z možného vztahu mezi dlouhodobou expozicí hypoxemii a rozvojem kognitivní dysfunkce, na opačném pólu obava z kyslíkové toxicity při hyperoxii [45]. Na některých pracovištích je v různé podobě používána koncepce tzv. permisivní hypoxemie, tj. tolerance subnormálních hodnot SaO2/PaO2 s cílem omezit riziko kyslíkové plicní toxicity při expozici plic vysokým inspiračním frakcím kyslíku. U nemocných s těžkým ARDS je obvykle za cílovou hodnotu SpO2 považována hodnota asi 88–92 %, recentní práce bezpečnost tohoto postupu podporují [46], krátkodobě může být nezbytná tolerance i hodnot nižších.
Nastavení vhodné úrovně PEEP
Volba PEEP je dlouhodobě předmětem kontroverze [21,48]. Střetávají se zde koncepce unifikovaného nastavení hodnoty PEEP dle stupně oxygenační plicní dysfunkce a koncepce individualizace nastavení PEEP. Příkladem unifikovaného přístupu je doporučená kombinace hodnot PaO2/FiO2 používaná v originálním protokolu [36] studie ARMA (tab. 5), nebo volba PEEP dle klasifikace ARDS (do 10 cm H2O pro mírný, 10 cm H2O pro střední a 15 cm H2O pro těžký ARDS) [21]. Individualizované postupy volí PEEP dle vlivu na mechanické vlastnosti respiračního systému, homogenitu distribuce ventilace, rozsah dechového recruitmentu a hyperinflace, transpulmonální tlak, endexspirační plicní objemu a jejich vzájemné kombinace, vliv na oxygenaci je považován za méně významný [21,47]. Prvním krokem při individualizované volbě PEEP je posouzení recruitability [48,49] s pomocí zobrazovacích metody (CT a s určitými omezeními elektrické impedanční tomografie (Electrical Impedance Tomography – EIT) nebo ultrasonografické vyšetření plic) nebo metod založených na sledování mechanických vlastností plic, transpulmonálního tlaku nebo změn EELV [49,50]. Po stanovení recruitability je rozhodnuto o dalším postupu – při minimální recruitabilitě je použita nízká hodnota PEEP, která se pohybuje od 5 do 10 cm H2O u nemocných bez snížené poddajnosti hrudní stěny. Při zjištění významné recruitability je jedním z nejjednodušších možných postupů tzv. dekrementální titrace PEEP bez nebo s provedením otevíracího manévru [50]. Podle současných názorů je cílem nastavením ventilátoru dosáhnout akceptovatelných hodnot oxygenace a eliminace CO2 při co nejnižší zátěži plic mechanickou energií [21]. Výsledky tzv. ART studie ukazují, že nevhodně vedená snaha o maximalizaci plicní vzdušnosti může být spojena se zvýšením rizika smrti [51].
U nemocných s těžkým ARDS je vhodné přímé měření transpulmonálního tlaku [52,53]. PEEP je nastavován tak, aby bylo v závislosti na stupni plicní dysfunkce dosaženo určité, vždy alespoň mírně pozitivní hodnoty exspiračního transpulmonálního tlaku [52,53]. Maximální bezpečný inspirační transpulmonální tlak je kontroverzní, za relativně bezpečné lze i u nemocných s plicní patologií považovat hodnoty < 10 cm H2O, za limitní cca 15 cm H2O, vysoce rizikové > 20 cm H2O [53,54].
Volba ventilačního režimu, minimalizace dyssynchronie s ventilátorem
V současné době lze považovat použití tlakových a objemových ventilačních režimů za ekvivalentní, přestože každý má určité teoretické a praktické přednosti a naopak nevýhody [37].
U nemocných s mírnými až středně těžkými formami ARDS je považováno za výhodné udržení spontánní dechové aktivity [26,37].
Zvážení použití pronační polohy u nemocných s těžkými formami ARDS
Pronační poloha snižuje riziko plicního poškození umělou plicní ventilací, ovlivňuje funkční reziduální kapacitu, distribuci ventilace a perfuze s výměnou plynů v plicích a může příznivě ovlivnit klinický výsledek léčby [55]. V současné době je rutinní použití pronační polohy doporučeno pro nemocné s poměrem PaO2/FiO2 ≤ 100–150 mm Hg [55,56].
Nekonvenční ventilace u nemocných s akutním plicním selháním
Z metod nekonvenční ventilace přichází u nemocných s ARDS v současnosti v úvahu pouze vysokofrekvenční oscilační ventilace.
Vysokofrekvenční oscilační ventilace (High-Frequency Oscillatory Ventilation – HFOV), která má pevné místo v neonatologii a je používána řadou pediatrických pracovišť při léčbě ARDS, pronikla postupně i do péče o dospělé nemocné. V roce 2013 byly ale publikovány 2 prospektivní randomizované studie srovnávající konvenční protektivní umělou plicní ventilaci s HFOV v časné fázi ARDS, obě studie neprokázaly zlepšení klinického výsledku ve skupině nemocných ventilovaných HFOV [57,58].
V současné době je vzhledem k rozporuplnému hodnocení významu HFOV u nemocných s ARDS obtížné stanovit přesné místo této techniky v algoritmu péče.
Mimotělní metody plicní podpory
Cílem mimotělní plicní podpory (ExtraCorporeal Lung Support – ECLS) je buď mimotělní eliminací oxidu uhličitého (ExtraCorporeal CO2 Removal – ECCO2R) snížit požadavky na minutovou ventilaci, a umožnit tak protektivní nebo ultraprotektiní plicní ventilaci, nebo plně nahradit plicní funkce. V této situaci je využívána mimotělní membránová oxygenace (ExtraCorporeal Membrane Oxygenation – ECMO) v periferním venovenózním zapojení (VV ECMO) u nemocných bez selhání srdce a ve venoarteriálním zapojení (VA ECMO) u nemocných se současným selháním srdce a plic. Podrobnější informace o jednotlivých metodách přesahují rámec tohoto sdělení. V současné době trvají kontroverze o indikačních kritériích pro jednotlivé metody vzhledem k nejasnému poměru přínosu a rizika těchto metod mimo extrémní skupiny nemocných s ARDS. V oblasti ECCO2R máme nyní k dispozici studie hodnotící především proveditelnost metody nebo její efekt na vybrané patofyziologické parametry. Ve studii XTRAVENT bylo použití ultraprotektivní ventilace v kombinaci s bezpumpovou venoarteriální eliminací CO2 spojeno s kratší délkou umělé plicní ventilace ve skupině nemocných s poměrem PaO2/FiO2 ≤ 150 mm Hg, smrtnost nebyla ovlivněna [59]. Použití ECMO bylo hodnoceno ve studii CESAR, bylo zjištěno lepší přežití nemocných randomizovaných do centra využívajícího při léčbě ECMO [60]. V recentně publikované studii EOLIA [6] byli nemocní s těžkým ARDS randomizováni do skupin ECMO a konzervativní terapie při některé ze 3 indikací:
- poměr PaO2/FiO2 < 50 mm Hg déle než 3 hod
- PaO2/FiO2 < 80 mm Hg déle než 6 hod
- arteriální pH < 7,25 a současně PaCO2 ≥ 60 mm Hg déle než 6 hod
K 60. dni zemřelo ve skupině ECMO 35 % a v kontrolní skupině 46 % pacientů: relativní riziko (RR) 0,76; 95% interval spolehlivosti (CI) 0,55–1,04; P = 0,09. Ve studii byl možný crossover při refrakterní hypoxemii, který mohl přispět k absenci statistické signifikance. Ke crossoveru došlo v průměru za 6,5 ± 9,7 dne od randomizace u 35 nemocných (28 %) v kontrolní skupině, smrtnost těchto nemocných byla 57 %. Největší přínos použití ECMO byl pozorován ve skupině nemocných indikovaných pro splnění hyperkapnického kritéria.
Neventilační a farmakologické intervence
Farmakologické intervence u nemocných s ARDS mají, s výjimkou svalové relaxace, nejistý přínos. V následujícím výčtu jsou uvedeny vybrané klinicky dostupné postupy.
Restriktivní tekutinová strategie
V současné době je na základě výsledků studie FACTT [61] doporučen po fázi iniciální tekutinové resuscitace restriktivní přístup k podávání tekutin.
U nemocných s hypoproteinemií bylo pozorováno zlepšení oxygenační funkce plic při navození negativní tekutinové bilance po podání albuminu a furosemidu v časné fázi ARDS, vliv na klinický výsledek nebyl zjištěn [62].
Kortikoidy
Podání vysokých dávek kortikoidů u nemocných s ARDS není doporučeno. Trvá kontroverze o místě kortikoidů jak v oblasti prevence rozvoje sepse a ARDS v některých indikacích, jako je např. těžká komunitní pneumonie [63], tak i o jejich místě v časné i pozdní fázi ARDS [64]. Použití kortikoidů není obvykle rutinně doporučeno. Výjimkou jsou japonská doporučení pro péči o nemocné s ARDS, která uvádějí podávání metylprednisolonu v dávce 1–2 mg/kg/den [65] vzhledem k potenciálu zvýšit počet dní bez umělé plicní ventilace.
Specifická nutriční podpora
Časná enterální výživa je doporučena jako metoda volby u nemocných s ARDS [66]. Použití specifických nutrietů (ω-3 mastné kyseliny) je považováno za nadějné, chybí ale přesvědčivý průkaz vlivu na klinický výsledek [67].
Svalová relaxancia
Použití svalových relaxancií by mělo být zváženo v iniciální fázi péče u nemocných s těžkým ARDS [68]. Použití cisatracuria v průběhu prvních 48 hod umělé plicní ventilace u nemocných s poměrem PaO2/FiO2 < 150 mm Hg na objemové ventilaci bylo spojeno s redukcí smrtnosti [69]. Obecně je předpokládán příznivý efekt redukcí generovaných transpulmonálních tlaků eliminací interferencí s ventilátorem [68], je ale také možný přímý antiinflamatorní efekt cisatracuria [70].
Inhalační aplikace oxidu dusnatého
Inhalačně podávaný oxid dusnatý (NO) umožňuje selektivní plicní vazodilatací krátkodobé zlepšení oxygenace a ve vyšších dávkách i snížení tlaku v plicnici. Použití inhalační aplikace NO není spojeno s příznivým ovlivněním prognózy [71], nemocní takto léčení mají vyšší riziko selhání ledvin [71].
Další potenciálně dostupné farmakologické postupy
V současné době nelze ani další potenciální dostupné farmakologické intervence, jako je použití faktoru stimulujícího kolonie granulocytů a makrofágů (GM-CSF) [72], prostaglandinu E1 [73–75], použití statinů [76–78], ketokonazolu [80], lisofyllinu [80], aktivovaného proteinu C (APC) [81,82], N-acetylcysteinu [83,84], nitrožilní aplikace β2-agonistů [86,87] a exogenního sufraktantu [88–91], považovat za standardní léčebné postupy.
Ostatní nefarmakologické postupy
Mezi nefarmakologické postupy lze zařadit již uvedené použití pronační polohy, které bylo diskutováno výše, a kontrolu tělesné teploty. Kontrola tělesné teploty u nemocných s ARDS je kontroverzní. Snížení tělesné teploty je spojeno s nižší produkcí CO2, a tedy i s nižší potřebnou minutovou ventilací a velikostí dechového objemu [92]. Mírná hypotermie má také antiinflamatorní efekt a v experimentálních modelech snižuje rozsah poškození plic při adverzní umělé plicní ventilaci [93,94]. Přínos udržení normotermie nebo přímo hypotermie nebyl ale ve větších klinických studiích u nemocných s ARDS zkoumán, publikace se omezují na jednotlivce nebo retrospektivní soubory nemocných [95–97].
Prevence ARDS
Při péči o nemocné s rizikem rozvoje ARDS je, mimo včasnou identifikaci ARDS, zdůrazňován význam potenciálních preventivních postupů, které zahrnují dodržování zásad protektivní plicní ventilace, prevenci aspirace, správné a včasné řešení příčiny stavu, omezení přetížení tekutinami, použití restriktivní transfuzní strategie a pravidelné hodnocení připravenosti nemocných k extubaci. Farmakologické preventivní postupy nejsou podle současných poznatků vhodné k rutinnímu klinickému použití [98,99].
doc. MUDr. Pavel Dostál, Ph.D., MBA
Klinika anesteziologie, resuscitace a intenzivní medicíny LF UK a FN Hradec Králové
Doručeno do redakce 4. 6. 2018
Přijato po recenzi 28. 1. 2019
Sources
-
Ashbaugh DG, Bigelow DB, Petty TL et al. Acute respiratory distress in adults. Lancet 1967; 2(7511): 319–323.
-
Ranieri VM, Rubenfeld GD, Thompson BT et al. [ARDS Definition Task Force]. Acute respiratory distress syndrome: the Berlin Definition. JAMA 2012; 307(23): 2526–2533. Dostupné z DOI: <http://dx.doi.org/10.1001/jama.2012.5669>.
-
Villar J, Blanco J, Kacmarek RM. Current incidence and outcome of the acute respiratory distress syndrome. Curr Opin Crit Care 2016; 22(1): 1–6. Dostupné z DOI: <http://dx.doi.org/10.1097/MCC.0000000000000266>.
-
Bernard GR, Artigas A, Brigham KL et al. The American-European Consensus Conference on ARDS. Am J Respir Crit Care Med 1994; 149(3 Pt 1): 818–824. Dostupné z DOI: <http://dx.doi.org/10.1164/ajrccm.149.3.7509706>.
-
Dodoo-Schittko F, Brandstetter S, Brandl M et al. German-wide prospective DACAPO cohort of survivors of the acute respiratory distress syndrome (ARDS): a cohort profile. BMJ Open 2018; 8(4): e019342. Dostupné z DOI: <http://dx.doi.org/10.1136/bmjopen-2017–019342>.
-
Combes A, Hajage D, Capellier G et al. [EOLIA Trial Group, REVA, and ECMONet]. Extracorporeal Membrane Oxygenation for Severe Acute Respiratory Distress Syndrome. N Engl J Med 2018; 378(21): 1965–1975. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMoa1800385>.
-
Raymondos K, Dirks T, Quintel M et al. Outcome of acute respiratory distress syndrome in university and non-university hospitals in Germany. Critical Care 2017; 21(1):122. Dostupné z DOI: <http://dx.doi.org/10.1186/s13054–017–1687–0>.
-
Murray JF, Matthay MA, Luce JM et al. An expanded definition of the adult respiratory distress syndrome. Am Rev Respir Dis 1988; 138(3): 720–723. Dostupné z DOI: <http://dx.doi.org/10.1164/ajrccm/138.3.720>.
-
Gattinoni L, Pelosi P, Crotti S et al. Effects of positive end-expiratory pressure on regional distribution of tidal volume and recruitment in adult respiratory distress syndrome. Am J Respir Crit Care Med 1995; 151(6): 1807–1814. Dostupné z DOI: <http://dx.doi.org/10.1164/ajrccm.151.6.7767524>.
-
Gattinoni L, Pelosi P, Suter PM et al. Acute respiratory distress syndrome caused by pulmonary and extrapulmonary disease. Different syndromes? Am J Respir Crit Care Med 1998; 158(1): 3–11. Dostupné z DOI: <http://dx.doi.org/10.1164/ajrccm.158.1.9708031>.
-
Goodman LR, Fumagalli R, Tagliabue P et al. Adult respiratory distress syndrome due to pulmonary and extrapulmonary causes: CT, clinical, and functional correlations. Radiology 1999; 213(2): 545–552. Dostupné z DOI: <http://dx.doi.org/10.1148/radiology.213.2.r99nv42545>.
-
Gattinoni L, Pesenti A, Avalli L et al. Pressure-volume curve of total respiratory system in acute respiratory failure. Am Rev Respir Dis 1987; 136(3): 730–736. Dostupné z DOI: <http://dx.doi.org/10.1164/ajrccm/136.3.730>.
-
Gattinoni L, Pesenti A. The concept of “baby lung”. Intensive Care Med 2005; 31(6): 776–784. Dostupné z DOI: <http://dx.doi.org/10.1007/s00134–005–2627-z>.
-
Corbridge TC, Wood LD H, Crawford GP et al. Adverse effects of large tidal volume ventilation and low PEEP in canine acid aspiration. Am Rev Respir Dis 1990; 142(2): 311–315. Dostupné z DOI: <http://dx.doi.org/10.1164/ajrccm/142.2.311>.
-
Gattinoni L, Bombino M, Pelosi P et al. Lung structure and function in different stages of the adult respiratory distress syndrome. JAMA 1994; 271(22): 1772–1779.
-
Martynowicz MA, Walters BJ, Hubmayr RD. Mechanisms of recruitment in oleic acid-injured lungs. J ApplI Physiol 2001; 90(5): 1744–1753. Dostupné z DOI: <http://dx.doi.org/10.1152/jappl.2001.90.5.1744>.
-
Marini JJ, Amato MB. Lung recruitment during ARDS. In: Marini JJ, Evans TW (eds). Acute lung injury. Springer: New York 1997 : 236–257. ISBN 978–3-642–60733–2.
-
D‘Angelo E, Pecchiari M, Baraggia P et al. Low-volume ventilation causes peripheral ariway injury and increased airway resistance in normal rabbits. J Appl Physiol 2002; 92(3): 949–956. Dostupné z DOI: <http://dx.doi.org/10.1152/japplphysiol.00776.2001>.
-
Muscedere JG, Mullen JB, Can K et al. Tidal ventilation at low airway pressures can augment lung injury. Am J Respir Crit Care Med 1994; 149(5): 1327–1334. Dostupné z DOI: <http://dx.doi.org/10.1164/ajrccm.149.5.8173774>.
-
Santos C, Ferrer M, Roca J et al. Pulmonary gas exchange response to oxygen breathing in acute lung injury. Am J Respir Crit Care Med 2000; 161(1): 26–31.Dostupné z DOI: <http://dx.doi.org/10.1164/ajrccm.161.1.9902084>.
-
Gattinoni L, Collino F, Maiolo G et al. Positive end-expiratory pressure: how to set it at the individual level. Ann Transl Med 2017; 5(14): 288. Dostupné z DOI: <http://dx.doi.org/10.21037/atm.2017.06.64>.
-
Puybasset L, Cluzel P, Gusman P et al. Regional distribution of gas and tissue in acute respiratory distress syndrome. I. Consequences for lung morphology. Intensive Care Med 2000; 26(7): 857.
-
Mekontso Dessap A, Boissier F, Leon R et al. Prevalence and prognosis of shunting across patent foramen ovale during acute respiratory distress syndrome. Crit Care Med 2010; 38(9): 1786–1792. Dostupné z DOI: <http://dx.doi.org/10.1097/CCM.0b013e3181eaa9c8>.
-
Gattinoni L, Tonetti T, Quintel M. Regional physiology of ARDS. Critical Care 2017; 21(Suppl 3): S312. Dostupné z DOI: <http://dx.doi.org/10.1186/s13054–017–1905–9>.
-
Koutsoukou A, Armaganidis A, Stavrakaki-Kallergi C et al. Expiratory flow limitation and intrinsic positive end-expiratory pressure at zero positive end-expiratory pressure in patients with adult respiratory distress syndrome. Am J Respir Crit Care Med 2000; 161(5): 1590–1596. Dostupné z DOI: <http://dx.doi.org/10.1164/ajrccm.161.5.9904109>.
-
Putensen C, Mutz NJ, Putensen-Himmer G et al. Spontaneous breathing during ventilatory support improves ventilation-perfusion distributions in patients with acute respiratory distress syndrome. Am J Respir Crit Care Med 1999; 159(4 Pt 19 : 1241–1248. Dostupné z DOI: <http://dx.doi.org/10.1164/ajrccm.159.4.9806077>.
-
Güldner A, Pelosi P, Gama de Abreu M. Spontaneous breathing in mild and moderate versus severe acute respiratory distress syndrome. Curr Opin Crit Care 2014; 20(1): 69–76. Dostupné z DOI: <http://dx.doi.org/10.1097/MCC.0000000000000055>.
-
Yoshida T, Uchiyama A, Matsuura N et al. Spontaneous breathing during lung-protective ventilation in an experimental acute lung injury model: high transpulmonary pressure associated with strong spontaneous breathing effort may worsen lung injury. Crit Care Med 2012; 40(5): 1578–1585. Dostupné z DOI: <http://dx.doi.org/10.1097/CCM.0b013e3182451c40>.
-
Tomashefski JF Jr. Pulmonary pathology of acute respiratory distress syndrome. Clin Chest Med 2000; 21(3): 435–466.
-
Rocker GM. Acute respiratory distress syndrome: Different syndromes, different therapies? Crit Care Med 2001; 29(1): 202–219.
-
Frat JP, Thille AW, Mercat A et al. [FLORALI Study Group; REVA Network]. High-flow oxygen through nasal cannula in acute hypoxemic respiratory failure. N Engl J Med 2015; 372(23): 2185–2196. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMoa1503326>.
-
Leeies M, Flynn E, Turgeon AF et al. High-flow oxygen via nasal cannulae in patients with acute hypoxemic respiratory failure: a systematic review and meta-analysis. Syst Rev 2017; 6(1): 202. Dostupné z DOI: <http://dx.doi.org/10.1186/s13643–017–0593–5>.
-
Rochwerg B, Brochard L, Elliott MW et al. Official ERS/ATS clinical practice guidelines: noninvasive ventilation for acute respiratory failure. Eur Respir J 2017; 50(2): 1602426. Dostupné z DOI: <http://dx.doi.org/10.1183/13993003.02426–2016>.
-
Bellani G, Laffey JG, Pham T et al. LUNG SAFE Investigators, ESICM Trials Group. Noninvasive Ventilation of Patients with Acute Respiratory Distress Syndrome. Insights from the LUNG SAFE Study. Am J Respir Crit Care Med 2017; 195(1): 67–77. Dostupné z DOI: <http://dx.doi.org/10.1164/rccm.201606–1306OC>.
-
Patel BK, Wolfe KS, Pohlman AS et al. Effect of Noninvasive Ventilation Delivered by Helmet vs Face Mask on the Rate of Endotracheal Intubation in Patients with Acute Respiratory Distress Syndrome: A Randomized Clinical Trial. JAMA 2016; 315(22): 2435–2441. Dostupné z DOI: <http://dx.doi.org/10.1001/jama.2016.6338>.
-
Brower RG, Matthay MA, Morris A et al. [Acute Respiratory Distress Syndrome Network]. Ventilation with lower tidal volumes as compared with traditional tidal volumes for acute lung injury and the acute respiratory distress syndrome. N Engl J Med 2000; 342(18): 1301–1308. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJM200005043421801>.
-
Fan E, Del Sorbo L, Goligher EC et al. An Official American Thoracic Society/European Society of Intensive Care Medicine/Society of Critical Care Medicine Clinical practice guideline: mechanical ventilation in adult patients with acute respiratory distress syndrome. Am J Respir Crit Care Med 2017; 195(9): 1253–1263. Dostupné z DOI: <http://dx.doi.org/10.1164/rccm.201703–0548ST>. Erratum in Erratum: An Official American Thoracic Society/European Society of Intensive Care Medicine/Society of Critical Care Medicine Clinical Practice Guideline: Mechanical Ventilation in Adult Patients with Acute Respiratory Distress Syndrome. [Am J Respir Crit Care Med. 2017]
-
Terragni PP, Rosboch G, Tealdi A et al. Tidal hyperinflation during low tidal volume ventilation in acute respiratory distress syndrome. Am J Respir Crit Care Med 2007; 175(2): 160–166. Dostupné z DOI: <http://dx.doi.org/10.1164/rccm.200607–915OC>.
-
Amato MB, Meade MO, Slutsky AS et al. Driving pressure and survival in the acute respiratory distress syndrome. N Engl J Med 2015; 372(8): 747–755. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMsa1410639>.
-
Guérin C, Papazian L, Reignier J et al. investigators of the Acurasys and Proseva trials. Effect of driving pressure on mortality in ARDS patients during lung protective mechanical ventilation in two randomized controlled trials. Crit Care 2016; 20(1): 384. Dostupné z DOI: <http://dx.doi.org/10.1186/s13054–016–1556–2>.
-
Beitler JR, Sands SA, Loring SH et al. Quantifying unintended exposure to high tidal volumes from breath stacking dyssynchrony in ARDS: the BREATHE criteria. Intensive Care Med 2016; 42(9): 1427–1436. Dostupné z DOI: <http://dx.doi.org/10.1007/s00134–016–4423–3>.
-
Schmidt M, Jaber S, Zogheib E et al. Feasibility and safety of low-flow extracorporeal CO2 removal managed with a renal replacement platform to enhance lung-protective ventilation of patients with mild-to-moderate ARDS. Crit Care 2018; 22(1): 122. Dostupné z DOI: <http://dx.doi.org/10.1186/s13054–018–2038–5>.
-
Contreras M, Masterson C, Laffey JG. Permissive hypercapnia: what to remember. Curr Opin Anaesthesiol 2015; 28(1): 26–37. Dostupné z DOI: <http://dx.doi.org/10.1097/ACO.0000000000000151>.
-
Barnes T, Zochios V, Parhar K. Re-examining Permissive Hypercapnia in ARDS: A Narrative Review. Chest 2018; 154(1): 185–195. Dostupné z DOI: <http://dx.doi.org/10.1016/j.chest.2017.11.010>.
-
He HW, Liu DW. Permissive hypoxemia/conservative oxygenation strategy: Dr. Jekyll or Mr. Hyde? J Thorac Dis 2016; 8(5): 748–750. Dostupné z DOI: <http://dx.doi.org/10.21037/jtd.2016.03.58>.
-
Panwar R, Hardie M, Bellomo R et al. Conservative versus Liberal Oxygenation Targets for Mechanically Ventilated Patients. A Pilot Multicenter Randomized Controlled Trial. Am J Respir Crit Care Med 2016; 193(1): 43–51. Dostupné z DOI: <http://dx.doi.org/10.1164/rccm.201505–1019OC>.
-
Sahetya SK, Goligher EC, Brower RG. Fifty Years of Research in ARDS. Setting Positive End-Expiratory Pressure in Acute Respiratory Distress Syndrome. Am J Respir Crit Care Med 2017; 195(11): 1429–1438. Dostupné z DOI: <http://dx.doi.org/10.1164/rccm.201610–2035CI>.
-
Berngard SC, Beitler JR, Malhotra A. Personalizing mechanical ventilation for acute respiratory distress syndrome. J Thorac Dis 2016; 8(3): E172-E174. Dostupné z DOI: <http://dx.doi.org/10.21037/jtd.2016.02.57>.
-
Eronia N, Mauri T, Maffezzini E et al. Bedside selection of positive end-expiratory pressure by electrical impedance tomography in hypoxemic patients: a feasibility study. Ann Intensive Care 2017; 7(1): 76. Dostupné z DOI: <http://dx.doi.org/10.1186/s13613–017–0299–9>.
-
Bohm HS, Vauquez de Anda GF, Lachman B. The open lung concept. In: Vincent JL (ed). Yearbook of intensive care and emergency medicine. Springer: Berlin 1998 : 430–440. ISBN 13 : 978–3-540–63798–1.
-
Cavalcanti AB, Suzamura ÉA, Laranjeira LN et al. Effect of lung recruitment and titrated Positive End-Expiratory Pressure (PEEP) vs low PEEP on mortality in patients with acute respiratory distress syndrome – A randomized clinical trial. JAMA 2017; 318(14): 1335–1345. Dostupné z DOI: <http://dx.doi.org/10.1001/jama.2017.14171>.
-
Talmor D, Sarge T, Malhotra A et al. Mechanical Ventilation Guided by Esophageal Pressure in Acute Lung Injury. N Engl J Med 2008; 359(20): 2095–2104. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMoa0708638>.
-
Grieco DL, Chen L, Brochard L. Transpulmonary pressure: importance and limits. Ann Transl Med 2017; 5(14): 285. Dostupné z DOI: <http://dx.doi.org/10.21037/atm.2017.07.22>.
-
Gattinoni L, Marini JJ, Collino F et al. The future of mechanical ventilation: lessons from the present and the past. Critical Care 2017; 21(1): 183. Dostupné z DOI: <http://dx.doi.org/10.1186/s13054–017–1750-x>.
-
Guerin C, Baboi L, Richard JC. Mechanisms of the effects of prone positioning in acute respiratory distress syndrome. Intensive Care Med 2014; 40(11): 1634–1642. Dostupné z DOI: <http://dx.doi.org/10.1007/s00134–014–3500–8>.
-
Claesson J, Freundlich M, Gunnarsson I et al. Scandinavian Society of Anaesthesiology and Intensive Care Medicine. Scandinavian clinical practice guideline on mechanical ventilation in adults with the acute respiratory distress syndrome. Acta Anaesthesiol Scand 2015; 59(3): 286–297. Dostupné z DOI: <http://dx.doi.org/10.1111/aas.12449>.
-
Ferguson ND, Cook DJ, Guyatt GH et al. [OSCILLATE Trial Investigators. Canadian Critical Care Trials Group]. High-frequency oscillation in early acute respiratory distress syndrome. N Engl J Med 2013; 368(9): 795–805. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMoa1215554>.
-
Young D, Lamb SE, Shah S et al. [OSCAR Study Group]. High-frequency oscillation for acute respiratory distress syndrome. N Engl J Med 2013; 368(9): 806–813. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMoa1215716
-
Bein T, Weber-Carstens S, Goldmann A et al. Lower tidal volume strategy (≈3 ml/kg) combined with extracorporeal CO2 removal versus ‘conventional’ protective ventilation (6 ml/kg) in severe ARDS. Intensive Care Med 2013; 39(5): 847. Dostupné z DOI: <http://dx.doi.org/10.1007/s00134–012–2787–6>.
-
Peek GJ, Mugford M, Tiruvoipati R et al. [CESAR trial collaboration]. Efficacy and economic assessment of conventional ventilatory support versus extracorporeal membrane oxygenation for severe adult respiratory failure (CESAR): a multicentre randomised controlled trial. Lancet 2009; 374(9698): 1351–1363. Dostupné z DOI: <http://dx.doi.org/10.1016/S0140–6736(09)61069–2>.
-
Wiedemann HP, Wheeler AP, Bernard GR et al. [National Heart, Lung, and Blood Institute Acute Respiratory Distress Syndrome (ARDS) Clinical Trials Network]. Comparison of two fluid-management strategies in acute lung injury. N Engl J Med 2006; 354(24): 2564–2575. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMoa062200>.
-
Uhlig C, Silva PL, Deckert S et al. Albumin versus crystalloid solutions in patients with the acute respiratory distress syndrome: a systematic review and meta-analysis. Critical Care 2014; 18(1): R10. Dostupné z DOI: <http://dx.doi.org/10.1186/cc13187>.
-
Bi J, Yang J, Wang Y et al. Efficacy and Safety of Adjunctive Corticosteroids Therapy for Severe Community-Acquired Pneumonia in Adults: An Updated Systematic Review and Meta-Analysis. PLoS One 2016; 11(11): e0165942
-
Ruan SY, Lin HH, Huang CT et al. Exploring the heterogeneity of effects of corticosteroids on acute respiratory distress syndrome: a systematic review and meta-analysis. Critical Care 2014; 18(2): R63. Dostupné z DOI: <http://dx.doi.org/10.1186/cc13819>.
-
Hashimoto S, Sanui M, Egi M et al. The clinical practice guideline for the management of ARDS in Japan. J Intensive Care 2017; 5 : 50. Dostupné z DOI: <http://dx.doi.org/10.1186/s40560–017–0222–3>.
-
Stapleton RD, Suratt BT. Obesity and nutrition in ARDS. Clin Chest Med 2014; 35(4): 655–671. Dostupné z DOI: <http://dx.doi.org/10.1016/j.ccm.2014.08.005>.
-
Sabater J, Masclans JR, Sacanell J et al. Effects of an omega-3 fatty acid-enriched lipid emulsion on eicosanoid synthesis in acute respiratory distress syndrome (ARDS): A prospective, randomized, double-blind, parallel group study. Nutr Metab (Lond) 2011; 8(1): 22. Dostupné z DOI: <http://dx.doi.org/10.1186/1743–7075–8-22>.
-
Chiumello D, Brochard L, Marini JJ et al. Respiratory support in patients with acute respiratory distress syndrome: an expert opinion. Critical Care 2017; 21(1): 240. Dostupné z DOI: <http://dx.doi.org/10.1186/s13054–017–1820–0>.
-
Papazian L, Forel JM, Gacouin A et al. ACURASYS Study Investigators. Neuromuscular blockers in early acute respiratory distress syndrome. N Engl J Med 2010; 363(2): 1107–1116. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMoa1005372>.
-
Fanelli V, Morita Y, Cappello P et al. Neuromuscular Blocking Agent Cisatracurium Attenuates Lung Injury by Inhibition of Nicotinic Acetylcholine Receptor-α1. Anesthesiology 2016; 124(1): 132–140. Dostupné z DOI: <http://dx.doi.org/10.1097/ALN.0000000000000907>.
-
Adhikari NK, Burns KE, Friedrich JO et al. Effect of nitric oxide on oxygenation and mortality in acute lung injury: systematic review and meta-analysis. BMJ 2007; 334(7597): 779. Dostupné z DOI: <http://dx.doi.org/10.1136/bmj.39139.716794.55>.
-
Paine R, Standiford TJ, Dechert RE et al. A randomized trial of recombinant human granulocyte-macrophage colony stimulating factor for patients with acute lung injury. Crit Care Med 2012; 40(1): 90–97. Dostupné z DOI: <http://dx.doi.org/10.1097/CCM.0b013e31822d7bf0>.
-
Eierman DF, Yagami M, Erme SM et al. Endogenously opsonized particles divert prostanoid action from lethal to protective in models of experimental endotoxemia. Proc Natl Acad Sci USA 1995; 92(7): 2815–2819. Erratum in Proc Natl Acad Sci USA 1995; 92(22): 10441.
-
Rossetti RG, Brathwaite K, Zurier RB. Suppression of acute inflammation with liposome associated prostaglandin E1. Prostaglandins 1994; 48(3): 187–195.
-
Vincent JL, Brase R, Santman F et al. A multi-centre, double-blind, placebo-controlled study of liposomal prostaglandin E1 (TLC C-53) in patients with acute respiratory distress syndrome. Intensive Care Med 2001; 27(10): 1578–1583. Dostupné z DOI: <http://dx.doi.org/10.1007/s001340101077>.
-
Craig TR, Duffy MJ, Shyamsundar M et al. A randomized clinical trial of hydroxymethylglutaryl-coenzyme a reductase inhibition for acute lung injury (The HARP Study). Am J Respir Crit Care Med 2011; 183(5): 620–626. Dostupné z DOI: <http://dx.doi.org/10.1164/rccm.201003–0423OC>. Erratum in Am J Respir Crit Care Med 2014; 190(10): 1199–1200.
-
McAuley DF, Laffey JG, O‘Kane CM et al. Simvastatin in the acute respiratory distress syndrome. N Engl J Med 2014; 371(18): 1695–1703. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMoa1403285>. Erratum in Simvastatin in the Acute Respiratory Distress Syndrome. [N Engl J Med. 2016].
-
Truwit JD, Bernard GR, Steingrub J et al. [National Heart L, Blood Institute ACTN]. Rosuvastatin for sepsis-associated acute respiratory distress syndrome. N Engl J Med 2014; 370(23): 2191–2200. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMoa1401520>.
-
[ARDS Network]. Ketoconazole for early treatment of acute lung injury and acute respiratory distress syndrome: a randomized controlled trial. The ARDS Network. JAMA 2000; 283(15): 1995–2002. Erratum in JAMA 2200; 284(20): 2597. JAMA 2000; 284(19): 2450. JAMA 2001; 286(13): 1578.
-
Bursten SL, Federighi D, Wald J et al. Lisofylline causes rapid and prolonged suppression of serum levels of free fatty acids. J Pharmacol Exp Ther 1998; 284(1): 337–345.
-
Cornet AD, Groeneveld AB, Hofstra JJ et al. Recombinant human activated protein C in the treatment of acute respiratory distress syndrome: a randomized clinical trial. PLoS One 2014; 9(3): e90983. Dostupné z DOI: <http://dx.doi.org/10.1371/journal.pone.0090983>.
-
Liu KD, Levitt J, Zhuo H et al. Randomized clinical trial of activated protein C for the treatment of acute lung injury. Am J Respir Crit Care Med 2008; 178(6): 618–623. Dostupné z DOI: <http://dx.doi.org/10.1164/rccm.200803–419OC>.
-
Jepsen S, Herlevsen P, Knudsen P et al. Antioxidant treatment with N-acetylcysteine during adult respiratory distress syndrome: a prospective, randomized, placebo-controlled study. Crit Care Med 1992; 20(7): 918–923.
-
Suter PM, Domenighetti G, Schaller MD et al. N-acetylcysteine enhances recovery from acute lung injury in man. A randomized, double-blind, placebo-controlled clinical study. Chest 1994; 105(1): 190–194.
-
Matthay MA, Brower RG, Carson S et al. Randomized, placebo-controlled clinical trial of an aerosolized beta-2 agonist for treatment of acute lung injury. Am J Respir Crit Care Med 2011; 184(5): 561–568. Dostupné z DOI: <http://dx.doi.org/10.1164/rccm.201012–2090OC>.
-
Gao Smith F, Perkins GD, Gates S et al. Effect of intravenous beta-2 agonist treatment on clinical outcomes in acute respiratory distress syndrome (BALTI-2): a multicentre, randomised controlled trial. Lancet 2012; 379(9812): 229–235. Dostupné z DOI: <http://dx.doi.org/10.1016/S0140–6736(11)61623–1>.
-
Perkins GD, McAuley DF, Thickett DR et al. The beta-agonist lung injury trial (BALTI): a randomized placebo-controlled clinical trial. Am J Respir Crit Care Med 2006; 173(3): 281–287. Dostupné z DOI: <http://dx.doi.org/10.1164/rccm.200508–1302OC>.
-
Spragg RG, Taut FJ, Lewis JF et al. Recombinant surfactant protein C-based surfactant for patients with severe direct lung injury. Am J Respir Crit Care Med 2011; 183(8): 1055–1061. Dostupné z DOI: <http://dx.doi.org/10.1164/rccm.201009–1424OC>.
-
Tsangaris I, Galiatsou E, Kostanti E et al. The effect of exogenous surfactant in patients with lung contusions and acute lung injury. Intensive Care Med 2007; 33(5): 851. Dostupné z DOI: <http://dx.doi.org/10.1007/s00134–007–0597-z>.
-
Weg JG, Balk RA, Tharratt RS et al. Safety and potential efficacy of an aerosolized surfactant in human sepsis-induced adult respiratory distress syndrome. JAMA 1994; 272(18): 1433–1438.
-
Willson DF, Truwit JD, Conaway MR et al. The adult calfactant in acute respiratory distress syndrome trial. Chest 2015; 148(2): 356–364. Dostupné z DOI: <http://dx.doi.org/10.1378/chest.14–1139>.
-
Duan M, Berra L, Kumar A et al. Use of hypothermia to allow low-tidal-volume ventilation in a patient with ARDS. Respir Care 2011; 56(12): 1956–1958. Dostupné z DOI: <http://dx.doi.org/10.4187/respcare.01211>.
-
Dostál P, Šenkeřík M, Pařízková R et al. Mild hypothermia attenuates changes in respiratory system mechanics and modifies cytokine concentration in bronchoalveolar lavage fluid during low lung volume ventilation. Physiol Res 2010; 59(6): 937–944.
-
Aslami H, Kuipers MT, Beurskens CJ et al. Mild hypothermia reduces ventilator-induced lung injury, irrespective of reducing respiratory rate. Transl Res 2012; 159(2): 110–117. Dostupné z DOI: <http://dx.doi.org/10.1016/j.trsl.2011.10.005>.
-
Hayek AJ, White HD, Ghamande S et al. Is Therapeutic Hypothermia for Acute Respiratory Distress Syndrome the Future? J Intensive Care Med 2017; 32(7): 460–464. Dostupné z DOI: <http://dx.doi.org/10.1177/0885066617701117>.
-
Dhillon G, Gopal PB, Kamat AS et al. Induced hypothermia for trauma-related ARDS. Indian J Crit Care Med 2015; 19(6): 353–355. Dostupné z DOI: <http://dx.doi.org/10.4103/0972–5229.158278>.
-
Karnatovskaia LV, Festic E, Freeman WD et al. Effect of therapeutic hypothermia on gas exchange and respiratory mechanics: a retrospective cohort study. Ther Hypothermia Temp Manag 2014; 4(2): 88–95. Dostupné z DOI: <http://dx.doi.org/10.1089/ther.2014.0004>.
-
Beitler JR, Schoenfeld DA, Thompson BT. Preventing ARDS: Progress, Promise, and Pitfalls. Chest 2014; 146(4): 1102–1113. Dostupné z DOI: <http://dx.doi.org/10.1378/chest.14–0555>.
-
Festic E, Kor DJ, Gajic O. Prevention of ARDS. Curr Opin Crit Care 2015; 21(1): 82–90. Dostupné z DOI: <http://dx.doi.org/10.1097/MCC.0000000000000174>. Máca J et al. ARDS v klinické praxi. Maxdorf; Praha 2015. ISBN 978-80-7345-447-0.
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Internal Medicine

2019 Issue 3
-
All articles in this issue
- An unstable patient in first contact with a doctor in hospital: how to recognize the risk?
- Diagnosing hypovolemia and hypervolemia: from clinical examination to modern methods
- Importance of ultrasound examination in diagnosing acute conditions
- Intravenous fluid therapy in acutely ill patients for non-intensivists
- Acute respiratory distress syndrome
- Initial antibiotic treatment of serious bacterial infections
- Hemorrhagic shock and treatment of severe bleeding
- Nutrition in the acute phase of illness
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue
- Hemorrhagic shock and treatment of severe bleeding
- Intravenous fluid therapy in acutely ill patients for non-intensivists
- Acute respiratory distress syndrome
- Diagnosing hypovolemia and hypervolemia: from clinical examination to modern methods
