Změny farmakokinetiky léčiv u obézních pacientů
Obesity-associated changes in drug pharmacokinetics
Pharmacokinetics of drugs in obese patients can be affected by changes in drug distribution and/or changes in elimination functions. Drug dosing based on patient‘s weight or body surface area may not be satisfactory in terms of safety or efficacy, especially for patients with a higher degree of obesity. However, current knowledge about most drugs does not provide sufficient guidance for dose adjustment in this group of patients. This article provides an overview of factors influencing changes in pharmacokinetics of drugs in obese, including some examples (eg. analgesics, antibiotics, anticoagulants and others). Due to different changes in pharmacokinetics, which cannot always be estimated from the physical and chemical properties of drug molecular structure, it is important to assess pharmacokinetic properties of a particular drug rather than looking for general rules for the most appropriate dosing. In case of drugs with a narrow therapeutic index (aminoglycoside antibiotics and vancomycin, anticonvulsants, immunosuppressants, lithium, digoxin and theophylline), it is always advisable to measure drug plasma levels and use therapeutic drug monitoring.
Keywords:
dosing – pharmacokinetics – obesity – volume of distribution – dose adjustments – clearance
Authors:
Alena Pilková; Jan Miroslav Hartinger
Authors‘ workplace:
Farmakologický ústav 1. lékařské fakulty Univerzity Karlovy, Praha
; Oddělení klinické farmakologie a farmacie, Všeobecná fakultní nemocnice v Praze
Published in:
Vnitř Lék 2020; 66(8): 465-471
Category:
Main Topic
Overview
Farmakokinetika léčiv může být u obézních pacientů ovlivněna jak změnami distribuce léčiv, tak změnami v eliminačních funkcích. Dávkování léčiv založené na hmotnosti nebo tělesném povrchu pacienta tak nemusí být zejména pro pacienty s vyšším stupněm obezity vyhovující z hlediska bezpečnosti či účinnosti. Dosavadní poznatky však pro většinu léčiv neposkytují dostatečná vodítka k úpravě dávky u této skupiny pacientů. Následující text podává přehled o faktorech ovlivňujících změnu pohybu léčiva v organismu u obézních a uvádí některé konkrétní příklady léčiv (např. analgetika, antibiotika, antikoagulancia a další). Vzhledem k rozdílným změnám ve farmakokinetice u různých léčiv, které nelze vždy odhadnout podle fyzikálně/chemických vlastností jejich molekul, je spíše než hledání obecných pravidel pro posouzení nejvhodnějšího dávkování vhodné seznámit se s konkrétním léčivem a jeho farmakokinetikou. V případech léčiv s úzkým terapeutickým indexem (aminoglykosidová antibiotika a vankomycin, antiepileptika, imunosupresiva, lithium, digoxin a teofylin) je však vhodné využít možnosti měření plazmatických hladin a terapeutického monitorování léčiv.
Klíčová slova:
dávkování léčiv – farmakokinetika – obezita – distribuční objem – úpravy dávek – clearance
Obezita je definována jako nadbytek tukové tkáně v organismu (1) charakterizovaný množstvím tuku u mužů nad 25 %, u žen nad 30 % celkové tělesné hmotnosti. Podle body mass indexu (BMI) pak klasifikujeme obezitu do tří stupňů – 1. (BMI 30–34,9 kg/m2 ), 2. (BMI 35–39,9 kg/m2 ) a 3. stupeň (BMI ≥40 kg/m2 ). Základním faktorem pro vznik obezity je vyšší energetický příjem ve srovnání s výdejem, uplatňuje se zvýšené množství a nevhodné složení stravy, snížení fyzické aktivity, genetické a metabolické faktory, dále faktory endokrinní a psychologické (2).
Farmakokinetika léčiv je u obézních pacientů přirozeně ovlivněna. Mnoho dávkovacích schémat je založeno na dávkách podle váhy, předpokládá „běžné“ tělesné složení a lineární vztah mezi eliminační kapacitou organismu a celkovou tělesnou hmotností. Tento způsob dávkování lze zpravidla použít i u pacientů s nižšími stupni obezity, nicméně u pacientů s obezitou 3. stupně je jeho využití problematické. Paradoxy, ke kterým při dávkování léčiv docházíme, lze ilustrovat třeba na příkladu tak běžného léku, jako je paracetamol. Terapeutická dávka je 10–15mg/kg (3). Běžně se uvádí, že pacienti s váhou nad 50 kg při užití jedné 500mg tablety (tj. < 10mg/kg) nedosahují efektivních hladin pro analgetický účinek. Stejně tak při váze pacienta nad 100 kg při omezení max. jednotlivé dávky na 1000mg nemůžeme dosáhnout terapeutického dávkování, pravděpodobně však nebudeme riskovat hepatotoxicitu při zvyšování dávek na 10mg/kg u pacienta s vyšším stupněm obezity. Obézní pacienti tak mohou být tímto lékem poddávkováni (4, 5). Farmakokinetické studie, které by bezpečně určily způsob úpravy dávek u těchto pacientů, jsou však pro většinu léčiv nedostatečné. Tento text se zabývá změnami farmakokinetiky u obézních pacientů a snaží se uvádět konkrétní příklady, u kterých můžeme na základě dostupných údajů tyto změny charakterizovat.
Farmakokinetiku léčiva, tedy jeho pohyb v organismu, lze rozdělit na absorpci, distribuci, metabolismus a eliminaci. Pro matematický popis farmakokinetických dějů zavádíme pojmy distribuční objem (Vd) a clearance (CL). Vzhledem k tomu, že oba tyto primární farmakokinetické parametry jsou v zásadě nezávislé a mohou být obezitou do různé míry ovlivněny, nastává řada různých možností, jak může být farmakokinetika konkrétního léčiva u obézních pacientů odlišná od neobézních. Z praktických důvodů odvozujeme u obézních pacientů různé dávkovací hmotnosti, podle kterých na základě dostupných údajů o změně farmakokinetiky dané léčivo dávkujeme buď podle TBW (total body weight, celková tělesná hmotnost), nebo ABW (adjusted body weight, upravená tělesná hmotnost pro léčiva, která se omezeně distribuují do tukové tkáně). Pro úplnost uvádíme rovněž IBW (ideal body weight, ideální tělesná hmotnost), což je hodnota odvozená podle různých vzorců (nejčastěji dle Devina, viz Tab. 1) a původně byla určena k odhadu vztahu mezi tělesnou hmotností a mortalitou. Jelikož výpočet IBW vychází z tělesné výšky, bude jeho využití problematické u pacientů s extrémními odchylkami tělesného vzrůstu (především pro pacienty malého vzrůstu) (6). Porovnání vývoje TBW, ABW a IBW při vzrůstající hmotnosti u muže vysokého 175 cm znázorňuje graf 1. Jak již bylo uvedeno Vd a CL mohou být ovlivněny obezitou do různé míry, proto může rovněž nastat situace, kdy dávkujeme jednotlivou/nasycovací dávku podle jiné hmotnosti než dávky udržovací.

Samotné využití IBW pro dávkování léčiv je většinou nevhodné, protože v tomto případě dva pacienti o stejné výšce vždy dostanou stejnou dávku léčiva, nehledě na hmotnost (7). Význam IBW však tkví v odvozování ABW, která je charakterizována jako IBW a určité procento z rozdílu TBW a IBW. Toto procento se může u jednotlivých léčiv lišit, nejčastěji se však udává 40 % (ABW0,4). Dalším deskriptorem upravené tělesné hmotnosti je tukuprostá váha (lean body weight, LBW), která využívá výšky, váhy, pohlaví a BMI ke stanovení hmotnosti, která zahrnuje extracelulární tekutinu, kostní a svalovou tkáň a vitální orgány. Nejnovější modifikace výpočtu z roku 2005 je uvedena v Tab. 1 (7).
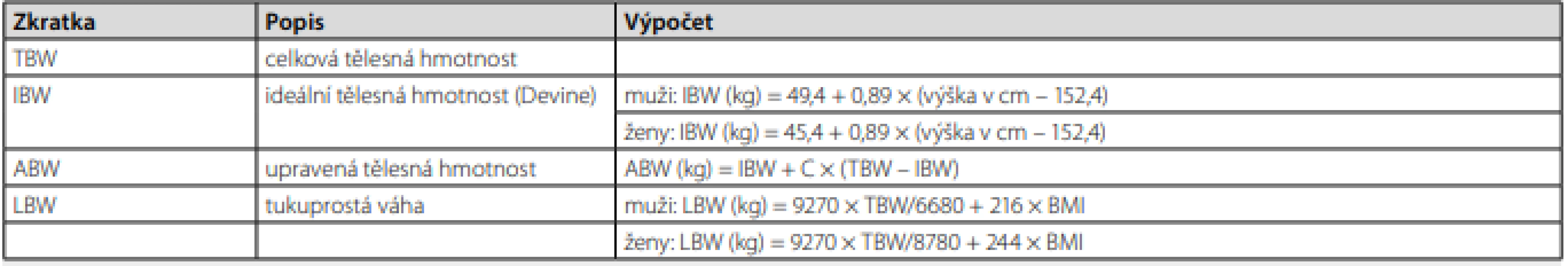
Tělesné složení u obézních pacientů lze kromě využití váhy a výšky posoudit přesněji pomocí měření tělesných kompartmentů metodami bioelektrické impedance, hydrodenzitometrie či duální rentgenové absorpciometrie. Tyto metody by jistě pomohly zpřesnit představu o změnách distribuce léčiva na základě tělesného složení obézních pacientů, doposud však nejsou rutinně využívány ke sledování farmakokinetiky léčiv a publikované studie o vlivu obezity na změny farmakokinetiky tak zpravidla vyvozují závěry na základě BMI nebo výše uvedených dávkovacích hmotností.
Změny farmakokinetiky na úrovni absorpce
Absorpce perorálních léčiv je u obézních pacientů relativně málo ovlivněna (1), při přidružených chorobách, jako je diabetes mellitus, však může docházet k opožděnému vyprazdňování žaludku a tedy k pozdějšímu nástupu účinku např. analgetik (8). Pro stručnost zde neuvádíme rozsáhlou problematiku změn absorpce léčiv po bariatrických výkonech.
Při podání intramuskulárních injekcí obézním pacientům může dojít k aplikaci léku do tukové tkáně místo do svalu. V případě pacientů s BMI > 30 kg/m2 je i. m. aplikace do aplikace do gluteální oblasti v podstatě nemožná a dochází vždy k s.c. podání (9, 10). U některých léků může aplikace do méně prokrvené tukové tkáně vést k pomalejšímu uvolňování a stabilnějším hladinám. Klinická praxe podání depotních antipsychotik svědčí pro jejich adekvátní účinnost i přes pravděpodobné s.c. podání, popsána byla např. srovnatelná účinnost depotního aripiprazolu u obézních a neobézních pacientů (11). Naopak v případě vakcinace proti HBV vede podání do podkožního tuku ke slabší imunitní odpovědi a vyšší četnosti lokálních reakcí. Je doporučeno podávat tyto vakcíny do deltoidního svalu, nicméně i zde se u obézních pacientů kumuluje velké množství tuku a při použití standardně dlouhých jehel není možné vakcínu do svalu podat. Další faktory, které ovlivňují množství tuku nad svalovou tkání, jsou věk (větší množství u starších pacientů) a pohlaví (u žen je větší poměr tuku ke svalové tkáni než u mužů) (12, 13).
Změny farmakokinetiky na úrovni distribuce – role distribučního objemu (Vd)
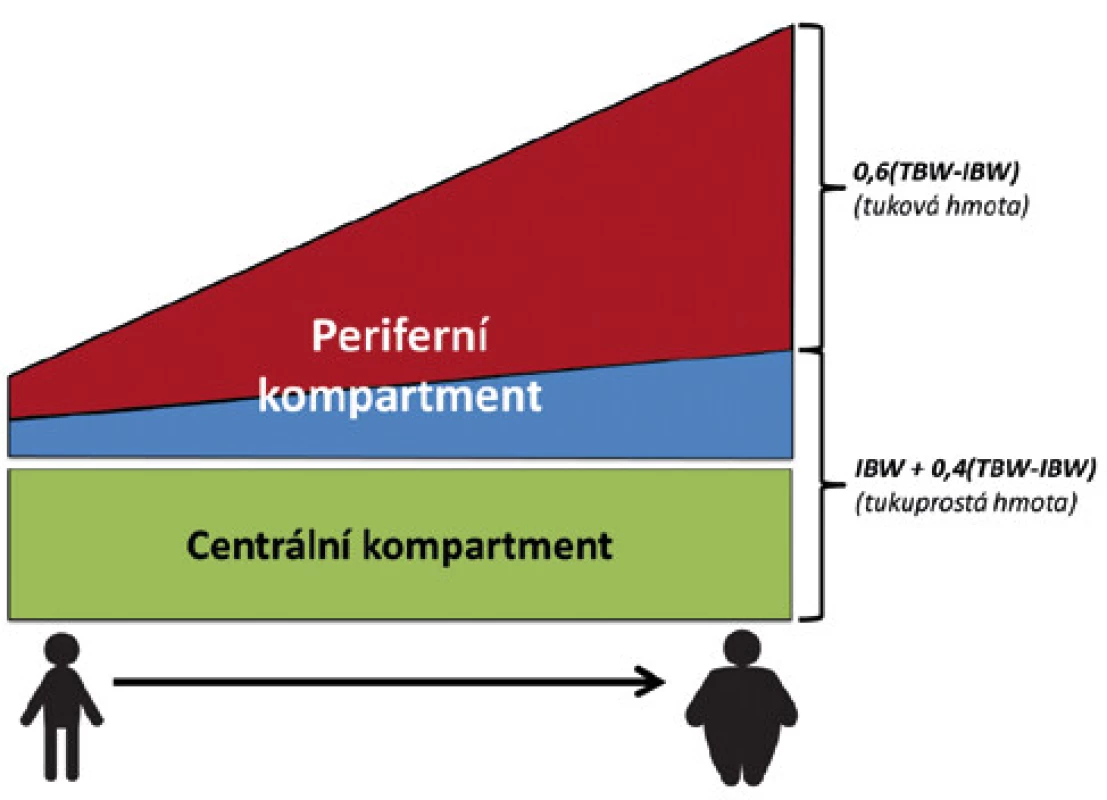
Distribuční objem léčiva (Vd) je fiktivní objem, ve kterém by bylo třeba léčivo rozpustit, aby bylo dosaženo stejné koncentrace, jako je koncentrace změřená v plazmě. Poskytuje nám obraz rozsahu distribuce léčiva do extravaskulární ho prostoru. Léčiva s významnou distribucí mimo krevní oběh mají větší Vd, jeho hodnota však neposkytuje přesnou informaci o skutečných místech, kde se léčivo koncentruje. Tento nedostatek komplikuje odhad správného dávkování u obézních pacientů. Prostupnost léčiv různými tkáněmi se může dle vlastností léčiva lišit, a rozdílné plazmatické koncentrace léčiva se nemusí promítnout do rozdílu ve tkáňové koncentraci (7, 14). Tuková tkáň u neobézního člověka tvoří cca 20 % tělesné váhy (15). Přestože s nárůstem tělesné hmotnosti stoupá jak množství tuku, tak tukuprosté tkáně, je tento vzestup pro tukovou tkáň výraznější a obézní jedinci mají tedy relativně vyšší množství tuku a relativně menší množství tukuprosté tkáně vzhledem k celkové tělesné hmotnosti (viz Obr. 1. a Graf 2). Je však vždy třeba mít na paměti, že při nárůstu hmotnosti stoupá do určité míry rovněž velikost hydrofilního kompartmentu (16). Vd může být stanoven jako absolutní hodnota bez korekce na váhu, případně vyjádřen jako Vd/TBW nebo Vd/IBW. Posouzení těchto korigovaných hodnot pak může vést k odhadu distribuce do nadbytečné váhy. V praxi se zdá, že pro středně až významně lipofilní léčiva je vhodným parametrem pro odhad Vd deskriptor zahrnující tukovou tkáň (TBW, ABW, BMI) (7).

Distribuce je dále ovlivněna krevním průtokem tkáněmi a vazbou na plazmatické bílkoviny. Perfuze tkání může být u obézních jedinců snížena a krevní průtok je ovlivněn také kardiovaskulárními změnami (7). U pacientů s obezitou 3. stupně bylo popsáno snížení krevního průtoku v přepočtu na gram tukové tkáně ve srovnání s pacienty s nižšími stupni obezity nebo neobézními. S tíží obezity koreluje i redukce srdečního výdeje (1). Při pomalejším průtoku krve tkání lze očekávat delší dobu do dosažení rovnováhy koncentrací léčiva mezi krví a tkání, prodlouží se tedy distribuční fáze – to může vést k problémům např. při interpretaci plazmatických hladin léčiv (pokud je hladina nabraná příliš brzy po podání léku). Obezita pravděpodobně nemá vliv na vazbu léčiv na albumin, data ohledně vazby na α1 kyselé glykoproteiny jsou nejednoznačná (1, 7, 17).
Např. Hollenstein et al. zjistili v jednodávkové studii, že u obézních subjektů dochází k pomalejší distribuci ciprofloxacinu do intersticiální tekutiny. Při dávce vztažené k TBW bylo po jednorázovém i.v. podání dosaženo obdobných koncentrací v měkkých tkáních jako u neobézních, zatímco plazmatické koncentrace byly signifikantně vyšší (14). Ciprofloxacin má krátký poločas a při dávkování 2× denně dochází k vyloučení téměř celé dávky v jednom dávkovacím intervalu. Nelze tedy mluvit o ustáleném stavu a riziko kumulace (při normálních renálních funkcích) je malé. Na základě zmíněné studie lze říci, že relativní Vd/kg je u obézních sice menší, nicméně vzhledem k pomalejší distribuci do tkání je větší část léčiva vyloučena přímo z krve, aniž by tak došlo k jeho distribuci do intersticiální tekutiny. Dávkování na TBW tedy může zajistit adekvátní efekt ve tkáních, otázkou je však bezpečnost léčby, jelikož zvýšená plazmatická koncentrace může zvýšit riziko nežádoucích účinků, zejména neurologických, kardiálních a gastrointestinálních. Dostupná doporučení tedy navrhují dávku na horní hranici dávkovacího rozmezí (400 mg à 8 h)(18).
Navíc lze předpokládat, a podporují to i výzkumy klidového energetického výdeje obézních pacientů, že množství tukové a netukové tkáně může být u různých obézních pacientů výrazně rozdílné (19). V případě, že pacient je plně soběstačný a schopen delší chůze, lze předpokládat velkou hmotu svalové tkáně. U takového pacienta budou např. při standardním dávkování nižší hladiny digoxinu a bude déle trvat, než se ustálí (déle budou stoupat), protože digoxin se váže extenzivně právě na svalovou tkáň a jeho Vd koreluje lépe s IBW či LBW než s TBW (20, 21). Naopak pokud je pacient upoután na lůžko, není schopen vertikalizace a pro obezitu ztratil sebeobslužnost, lze předpokládat, že ztratil velké množství svalové tkáně, a proto i distribuční objem pro digoxin u něj bude daleko menší. Skutečnost, že obézní pacienti mohou mít i při stejných antropometrických hodnotách výrazně rozdílné tělesné složení, může částečně vysvětlovat vyšší variabilitu plazmatických hladin některých léčiv u obézních pacientů (22).
Změny Vd u obézních jsou důležité především pro stanovení nasycovací dávky, což bude mít největší význam u léčiv podávaných v akutní situaci. Mezi léčiva, u kterých je vhodné z tohoto důvodu nasycovací dávku upravit, patří např. fenytoin – vysoce lipofilní látka s velkou afinitou k tukové tkáni, v níž se kumuluje a vytváří depo. Je doporučeno nasycovací dávku určit jako IBW + 1,33 × (TBW‑IBW), tedy z dávkovací hmotnosti, která přesahuje TBW (23). Podání nasycovací dávky zohledňující TBW se využívá např. u bolusových dávek benzodiazepinů podávaných v anesteziologii (24). Americká asociace klinické onkologie doporučuje pro stanovení dávky chemoterapie, s výjimkou vybraných léčiv (karboplatina, bleomycin, vinkristin), využít pro výpočet tělesného povrchu (BSA) TBW, zejména v režimech s kurativním záměrem (25). Z TBW odvozujeme též úvodní dávku vankomycinu (s doporučením zvážit zastropování na max. 2,5g) (18), zatímco pro aminoglykosidová antibiotika amikacin a gentamicin využíváme ABW0,4 (1). Příkladem léčiva, jehož dávku je vhodné odvodit z IBW, je theofylin, u nějž nedochází k distribuci do tukové tkáně (1, 3).
Vd nekoreluje vždy s mírou lipofility léčiva (1, 15, 26). Kromě výše uvedeného digoxinu, kde dávka koreluje spíše s množstvím svalové tkáně než s TBW, je dalším příkladem např. takrolimus. Dávkování dle TBW u obézních pacientů po transplantaci ledviny může vést k překročení doporučené plazmatické koncentrace. Přestože se jedná o vysoce lipofilní léčivo, ve velké míře se váže na erytrocyty a relativně vysoká koncentrace tedy zůstává i v krevním oběhu (27).
Změny farmakokinetiky na úrovni eliminace – role clearance (CL)
Přestože by se mohlo zdát, že obezita ovlivňuje především distribuční objem a nikoliv clearance, není tomu tak. Clearance je farmakokinetický parametr popisující množství krve očištěné od léčiva za jednotku času. Jedná se o klíčový parametr pro stanovení udržovací dávky. Závisí především na krevním průtoku eliminačními orgány a schopností orgánu eliminovat léčivo. Clearance většiny léčiv je zprostředkována játry a ledvinami. Tuková tkáň samotná se na metabolismu ani exkreci léčiv většinou nepodílí (15), ale obezita je spojována s nealkoholickou steatózou jater (NAFDL, až 20 % případů) a nealkoholickou steatohepatitidou (NASH, až 50 % případů). Tuková infiltrace může přispět k ovlivnění aktivity enzymů I. a II. fáze metabolismu léčiv (tedy oxidace a konjugace) (16) a rovněž může snížit průtok krve játry (7), což by mohlo ovlivnit clearance léčiv s vysokým extrakčním koeficientem. Na druhou stranu díky zvýšenému objemu krve a zvýšenému srdečnímu výdeji se nemusí tento efekt projevit (16). Dále se předpokládá, že játra tvoří relativně konstantní podíl tukuprosté váhy (26). Jejich objem tedy bude u obézních zvětšen, ale nikoliv proporčně k celkové tělesné hmotnosti. Tyto změny jsou rovněž závislé na době trvání obezity, v časných fázích se uplatní spíše vzestup obejmu krve a srdečního výdeje s udržením nebo zvýšením clearance, zatímco v pozdějších fázích se projeví efekt NAFLD/NASH a clearance se sníží (28). Hodnocení dopadu těchto změn v konkrétní klinické situaci je obtížné, protože výsledky běžně dostupných biochemických vyšetření nekorelují se schopností jater metabolizovat léčiva a nelze tedy jednoduše ověřit funkční stav jater (1). Léčiva mohou být enzymaticky nejen eliminována, ale rovněž aktivována, případně vznikají metabolity zodpovědné za vedlejší účinky léčiv. Navíc enzymy I. a II. fáze metabolismu mohou být ovlivněny rozdílnou měrou, stejně jako transportní proteiny, které hrají rovněž v eliminaci některých léčiv výraznou roli. Z uvedeného vyplývá, že je třeba se vždy seznámit s konkrétním léčivem a jeho metabolismem, abychom byli schopni se v konkrétní situaci zorientovat.
Pokud jde o enzymy I. fáze metabolismu, bylo popsáno signifikantní zvýšení aktivity CYP2E1 závislé na vzrůstající hmotnosti. Tento isoenzym je zodpovědný za metabolismus pouze cca 5 % léčiv, mezi léčiva se zdokumentovanými změnami metabolismu u obézních patří např. inhalační anestetika sevofluran a enfluran (16). Dále byla ve studiích popsána tendence ke snížení aktivity CYP3A4 a možné zvýšení clearance léčiv metabolizovaných enzymy CYP1A2, CYP2C9, CYP2C19 a CYP2D6, i když ve většině případů nebyly výsledky statisticky významné a v úvahu je třeba vzít také další faktory, jako nikotinismus ovlivňující CYP1A2 nebo genetický polymorfismus ovlivňující aktivitu CYP2C9, CYP2C19 a CYP2D6 (16). Větší význam má zvýšená aktivita enzymů II. fáze metabolismu – glukuronidace a sulfatace v závislosti na vzestupu TBW (7, 29), případně snížená eliminace vzniklých glukuronidů (popsána např. pro morfin) (30).
Co se týče vlivu obezity na funkci ledvin, dochází u obézních ke zvětšení hmoty ledvin a zvýšení renálního průtoku. Dochází ke glomerulární hyperfiltraci a byl popsán trend k vyšší hodnotě eGFR, podobně jako v časných stádiích diabetické nefropatie. Pravděpodobně je zvýšena též tubulární sekrece, o vlivu obezity na tubulární reabsorpci není dostatek údajů (16). Při delším trvání obezity se může rozvinout naopak chronická renální insuficience (28). Donedávna běžně využívaná rovnice k výpočtu clearance kreatininu dle Cockrofta a Gaulta (CG) je obecně považována za nepřesnou mj. z důvodu nadhodnocování clearance u obézních pacientů při využití TBW. Referenční výpočet není definován (28), ale jako racionální se jeví ve výpočtech dle CG využít místo celkové tělesné váhy LBW, nebo ABW0,4, protože produkce kreatininu je odrazem funkce svalové hmoty, která je hlavní komponentou tukuprosté hmotnosti (26). Dle studie Anastasia et al. glomerulární filtrace a průtok krevní plazmy ledvinami korelují u jedinců s obezitou 3. stupně lépe s výškou než s tělesným povrchem, což odpovídá předpokladu, že výška je odrazem LBW (31). Graf 3 znázorňuje srovnání výpočtu CLCr podle CG a eGFR podle novější rovnice dle CKD‑EPI u pacienta s konkrétními antropomorfickými parametry (běloch, 175 cm vysoký, hladina sérového kreatininu 90 µmol/L). Je patrné, že pokud je výpočet dle CKD‑EPI normalizován na BSA a pro výpočet dle CG použita ABW0,4, výsledky se výrazně podobají, což odpovídá předpokladu, že ledviny i svaly jsou součástí tukuprosté váhy a tedy i výpočet clearance kreatininu by měl tuto skutečnost zohlednit. V souboru více než 2000 pacientů s různým stupněm obezity nejlépe koreloval s měřenou clearance kreatininu právě výpočet dle CG s využitím ABW0,4 (32).

Eliminační poločas (T1/2)
Eliminační poločas (T1/2) závisí přímo úměrně na Vd a nepřímo úměrně na CL. Jelikož u obézních jedinců může docházet ke změnám T1/2 na podkladě změn obou těchto parametrů, nelze ze samotné změny T1/2 jednoduše odvodit změny eliminačních funkcí. (7). Praktické využití T1/2 spočívá v posouzení doby do dosažení ustáleného stavu a doby do vyloučení léčiva při přerušení jeho podávání (při stabilním dávkování po 4× T1/2). Prodloužení T1/2 se může projevit např. prodloužením doby, po kterou dochází k postupnému rozvoji efektu léčiva a rovněž doby, po kterou se nejpravděpodobněji mohou objevit nebo odeznít nežádoucí účinky. Při zkrácení T1/2 předpokládáme větší kolísání hladiny léčiva a pro vyrovnaný účinek je třeba častěji dávkovat, naopak prodloužení T1/2 vede k vyrovnanějšímu účinku léku v průběhu dávkovacího intervalu.
Konkrétní příklady změny farmakokinetiky
Analgetika
Primární cestou eliminace paracetamolu jsou konjugační reakce (glukuronidace a sulfatace). Bylo popsáno zvětšení Vd a zvýšení CL u obézních. Po perorálním podání byla u obézních subjektů nižší maxi ‑ mální koncentrace (Cmax) a doba do jejího dosažení byla delší. Eliminační T1/2 se však nelišil (33, 34). Vyšší clearance, kterou pacienti musejí mít, aby udrželi stejný poločas při větším Vd, je úměrná LBW a urychluje se jak konjugace, tak i minoritní cesta eliminace přes CYP2E1, kterou vznikají hepatotoxické produkty. V podstatě to znamená, že aby bylo dosaženo podobných hladin paracetamolu, museli bychom obézním pacientům podávat vyšší dávky, nicméně ty by zároveň byly i toxičtější (5). Farmakokinetická studie, která porovnávala farmakokinetiku ibupro ‑ fenu u obézních a neobézních subjektů, rovněž prokázala zvýšení Vd i CL a nezměněný T1/2. Cmax byla opět signifikantně snížena, avšak maximální koncentrace bylo dosaženo za stejný čas. Tyto údaje nasvědčují potřebě vyšší dávky při nezměněném dávkovacím intervalu (35), v praxi však bude navyšování dávky u obézních limitováno potenciální gastrotoxicitou. U obou těchto analgetik tedy lze očekávat nižší efektivitu léčby při toxicitou vynuceném snížení dávek na kg tělesné hmotnosti.
U morfinu, který se rovněž eliminuje především konjugací s kys. glukuronovou, sice nebyly zaznamenány rozdíly v efektivitě glukuronidace a konverze na hlavní metabolity M3G a M6G probíhala u obézních podobně jako u neobézních, nicméně eliminace glukuronidů byla výrazně snížena. Z toho důvodu je při kontinuálním podání morfinu vyšší hladina morfin-6-glukuronidu, který se může podílet na analgetické odpovědi a sedaci, ale rovněž morfin-3-glukuronidu, který má neurotoxický potenciál (30, 36). Ve studii sledující analgetickou odpověď na jednorázově podanou dávku morfinu nebyly zaznamenány rozdíly mezi pacienty s různým stupněm obezity a neobézními (37). Výpovědní hodnotu dostupných studií však snižuje velká interindividuální variabilita v klinické odpovědi na léčbu, která významně snižuje možnost zaznamenat rozdíl při srovnání malých skupin pacientů. Z důvodu častého výskytu syndromu obstrukční spánkové apnoe (OSA) u obézních je doporučeno využít tzv. opioid‑sparing přístupu (38), tj. kombinace opiátů s neopioidními analgetiky umožňující snížení dávky opioidu.
Antibiotická terapie
U obézních může v důsledku změn farmakokinetiky docházet při antibiotické terapii k poddávkování a selhání terapie. Určení optimální dávky je vzhledem k nedostatku informací pro mnohá léčiva problematické, mj. i z důvodu limitované použitelnosti běžných metod pro odhad GFR (viz výše). I o běžných antibioticích (ATB), jako jsou peniciliny, klaritromycin, co‑trimoxazol, nebo klindamycin, je k dispozici relativně málo informací. Popsána byla nižší úspěšnost eradikace H. pylori u obézních pacientů při použití fixní dávky klaritromycinu a amoxicilinu stejně jako nižší úspěšnost léčby celulitidy u obézních pacientů léčených co‑trimoxazolem nebo klindamycinem na dolní hranici doporučených terapeutických dávek (39, 40). Specifická doporučení pro úpravy dávky makrolidových antibiotik nebo co‑trimoxazolu u obézních však nejsou k dispozici. Z farmakokinetické studie u pacientů s osteomyelitidou vyplývá, že je vhodné využít vyšších doporučených denních dávek klindamycinu (18, 41).
V předchozím textu byl již zmíněn vliv obezity na dávkování ciprofloxacinu nebo aminoglykosidových antibiotik. Z penicilinových ATB je nejvíce údajů o podání obézním pacientům u piperacilin/ tazobaktamu, kde dochází ke zvýšení Vd i CL. Vzhledem k účinku závislému na čase, po který toto ATB překračuje minimální inhibiční koncentraci (MIC), bylo některými autory doporučeno podávat piperacilin/tazobaktam formou prodloužených infuzí pro prodloužení času nad MIC (18, 42). Pro další penicilinová antibiotika nejsou k dispozici žádná data a ke zvážení je volba horní hranice doporučených dávek (18). U cefazolinu bylo zjištěno, že Vd koreluje s TBW a LBW a s rostoucí hmotností klesá tkáňová penetrace tohoto antibiotika (18). Pokud jde o profylaktické podání cefazolinu, v některých menších retrospektivních studiích se sice neprokázal signifikantně vyšší výskyt pooperačních infekcí u obézních při podání dávky 2 g, dle doporučení vytvořených ve spolupráci několika amerických odborných společností z roku 2013 (43) je však na základě farmakokinetických studií navrženo podat v antibiotické profylaxi u chirurgických výkonů pacientům s váhou nad 120 kg zvýšenou dávku 3 g (18, 44). Navýšení dávky karbapenemů u obézních pacientů není nutné, na základě dostupných studií může být vhodným postupem prodloužení infuze v případě meropenemu.
Vyšší dávky imipenemu jsou zejména u pacientů s renální insuficiencí spojeny s rizikem křečí (18).
Kolistin je vhodné dávkovat dle IBW, při dávkách vypočtených na základě TBW byl zaznamenán vyšší výskyt nefrotoxicity. Standardní dávkování linezolidu 600mg 2× denně může vést u obézních pacientů k poddávkování, dávky 600 mg 3× denně jsou však spojeny s vyšším rizikem trombocytopenie (18). Vd a CL vankomycinu u obézních vzrůstá s TBW, vzestup Vd však není proporcionální mezi pacienty s různým stupněm obezity. Na základě retrospektivní studie bylo odvozeno, že pro pacienty s BMI 30–39 kg/m2 může být dosaženo optimální údolní koncentrace při dávce 30mg/kg TBW/den, u pacientů s BMI ≥ 40 kg/m2 při celkové dávce 20–25mg/kg TBW/den. Meng et al. doporučují u obézních pacientů s normálními renálními funkcemi nasycovací dávku 20–25mg/kg TBW s další úpravou dávek dle metod terapeutického monitorování léčiv (TDM) (18).
Antiagregace a antikoagulace
K dispozici není dostatek dat pro posouzení změn farmakokinetiky nízkodávkové kyseliny acetylsalicylové u pacientů s BMI ≥ 40 kg/m2 , nicméně na základě zjištění, že vyšší tělesná hmotnost je asociována s rychlejším destičkovým obratem, může být vhodné zvážit podávání 100 mg 2× denně, přičemž z důvodu nižší biodostupnosti by neměly být podávány LP s enterosolventní úpravou (28, 45). Obezita ≥ 2. stupně, obzvláště u pacientů s genotypem pomalého či středně rychlého metabolizátora CYP2C19, může být spojena s nižší tvorbou aktivních metabolitů u klopidogrelu, méně významný je tento efekt u prasugrelu, tělesná hmotnost ovlivňuje také hladiny tikagreloru a jeho aktivního metabolitu, v současné době však není k dispozici dostatek dat prokazujících nutnost změny dávkování P2Y12 inhibitorů u obézních. Obezita je spojena s prodloužením doby nutné k dosažení terapeutického INR při zahájení warfarinizace a s nutností podávání vyšších udržovacích dávek warfarinu, pravděpodobně z důvodu zvýšených Vd i CL (28, 46, 47). V případě závažného krvácení u obézního warfarinizovaného pacienta je třeba podat dostatečné dávky koagulačních faktorů (35–50 mg/kg) (28).
Celosvětově roste počet obézních pacientů užívajících nová perorální antikoagulancia (NOAC), přičemž zejména pro skupinu pacientů s BMI > 40 kg/m2 nemáme k dispozici dostatek dat. Ve farmakokinetických studiích byla pozorována negativní korelace Cmax a plochy pod křivkou (AUC) apixabanu s TBW a BMI, pravděpodobně klinicky nevýznamná, a negativní korelace TBW s plazmatickou koncentrací dabigatranu (se signifikantním zvyšováním Vd při váze nad 80 kg). AUC a Cmax rivaroxabanu se dle dostupných studií významně nemění u pacientů s hmotností nad 120 kg. Dosavadní zkušenosti sice nenasvědčují tomu, že léčba NOAC u obézních je spojena s horšími výsledky, přesto je v současné době zejména ve skupině pacientů s BMI > 40 kg/m2 doporučeno upřednostnit warfarin, a při volbě NOAC sledovat antikoagulační efekt pomocí odpovídajících laboratorních vyšetření (anti‑Xa, dTT, příp. plazmatické hladiny léčiv) (28, 48).
Dávkování nízkomolekulárních heparinů (LMWH) a fondaparinuxu (Arixtra®) v terapeutických indikacích je založeno na TBW, v případě nadroparinu (Fraxiparine®) a fondaparinuxu se zastropováním dávky u pacientů nad 100 kg. Není však bezpečně potvrzeno, že při zastropování dávky nedochází u pacientů s obezitou ≥ 2. stupně ke snížení efektivity léčby a u této skupiny pacientů je tedy vhodné monitorování účinku pomocí anti‑Xa. Profylaktické podání LMWH a fondaparinuxu je založeno na fixních dávkách a vzhledem k negativní korelaci mezi AUC, anti‑Xa a tělesnou hmotností nemusí být u obézních pacientů dosaženo odpovídající odpovědi. Nejvíce dokladů pro úpravy dávky u pacientů s vyššími stupni obezity máme k dispozici pro enoxaparin (Clexane®), u nějž byla prokázána efektivita i bezpečnost při zvýšené profylaktické dávce 2× denně 40 mg pro pacienty s BMI ≥ 40 kg/m2 . Pro ostatní LMWH není dostatek informací, ke zvážení je upřednost ‑ nění enoxaparinu ve výše uvedeném dávkování, případně empirické navýšení dávky LMWH o 25–30 % (28, 49).
Benzodiazepiny
Oxazepam a lorazepam jsou léčiva, která se (v případě, že nejde o předávkování) primárně metabolizují opět glukuronidací. U obou byla popsána signifikantně zvýšená CL u obézních ve srovnání s neobézními subjekty a zároveň i větší Vd. Při normalizaci obou parametrů na kg tělesné hmotnosti byly však hodnoty srovnatelné s neobézními pacienty a z toho důvodu byl i stejný T1/2 (29). Při dávkách, které nejsou normalizovány na TBW, tedy dosahujeme nižších hladin. Zde samozřejmě musíme přihlédnout rovněž k rizikovosti těchto látek u pacientů s OSA. Naopak u alprazolamu a diazepamu byl pro obézní pacienty popsán výrazně větší Vd a nezměněná CL. Důsledkem je prodloužení eliminačního poločasu až na dvojnásobek (17, 50). Při jednorázovém podání bude tedy nutné k dosažení stejného efektu podání větší dávky a účinek léčiva bude přetrvávat delší dobu. Při opakovaném podávání bude delší dobu trvat dosažení ustáleného stavu. To je důležité především u diazepamu, který má poločas u obézních až 4 dny a dlouhodobě působící aktivní metabolity – nežádoucí účinky léčby (zmatenost, sedace, somnolence, pády) se tak mohou při opakovaném podávání rozvinout po delší době a souvislost se zahájením terapie diazepamem může tedy být méně zřejmá.
Závěr
Přes narůstající prevalenci obezity není v současné době k dispozici mnoho údajů pro stanovení optimální dávky u řady běžně užívaných léčiv. Je třeba si uvědomit, že spíše než hledat obecná pravidla, je pro posouzení nejvhodnějšího dávkování vhodné seznámit se s konkrétním léčivem a jeho farmakokinetikou. Situace je často rozdílná u jednorázového podání a při opakovaném dávkování. U řady léčiv se následně orientujeme především dle klinické odpovědi (hodnoty krevního tlaku a tepové frekvence, glykemie, lipidogram, koagulační parametry atd.), v případech léčiv s úzkým terapeutickým indexem (aminoglykosidová antibiotika a vankomycin, antiepileptika, imunosupresiva, lithium, digoxin a teofylin) je však vždy vhodné využít možnosti měření plazmatických hladin a terapeutického monitorování léčiv.
Tento text vznikl za podpory grantu Karlovy univerzity Progres Q25.
Seznam zkratek
ABW – upravená tělesná hmotnost
ATB – antibiotika
AUC – plocha pod křivkou
BMI – body mass index
BSA – tělesný povrch
CG – Cockroft a Gault
CKD‑EPI – Chronic Kidney Disease Epidemiology Collaboration
CL – clearance
Cmax – maximální koncentrace
dTT – diluční trombinový čas
eGFR – odhadovaná glomerulární filtrace
IBW – ideální tělesná hmotnost
INR – mezinárodní normalizovaný poměr
LBW – tukuprostá tělesná hmotnost
LMWH – nízkomolekulární hepariny
NAFLD – nealkoholická steatóza jater
NASH – nealkoholická steatohepatitida
NOAC – nová perorální antikoagulancia
TBW – celková tělesná hmotnost
T1/2 – eliminační poločas
Vd – distribuční objem
KORESPONDENČNÍ ADRESA AUTORA:
PharmDr. Alena Pilková,
alena.pilkova@vfn.cz
Oddělení klinické farmakologie a farmacie,
VFN v Praze,
Na Bojišti 1,
128 08 Praha 2
Cit. zkr: Vnitř Lék 2020; 66(8): 465–471
Článek přijat redakcí: 28. 8. 2020
Článek přijat po recenzích: 3. 11. 2020
Sources
1. Cheymol G. Effects of obesity on pharmacokinetics implications for drug therapy. Clin Pharmacokinet, 2000; 39(3): 215–231.
2. Kunešová M. Obezita – etiopatogeneze, diagnostika a léčba. Interní medicína pro pra ‑ xi, 2004; 9.
3. Platná SPC uváděných přípravků.
4. Hakim M, Anderson BJ, Walia H, et al. Acetaminophen pharmacokinetics in severely obe ‑ se adolescents and young adults. Paediatr Anaesth, 2019; 29(1): 20–26.
5. van Rongen A, Välitalo PAJ, Peeters MYM, et al. Morbidly Obese Patients Exhibit Increased CY ‑ P2E1-Mediated Oxidation of Acetaminophen. Clinical Pharmacokinetics, 2016; 55(7): 833–847.
6. Duffull SB, Dooley MJ, Green B, Poole SG, Kirkpatrick CM. A standard weight descriptor for dose adjustment in the obese patient. Clin Pharmacokinet, 2004; 43(15): 1167–1178.
7. Hanley MJ, Abernethy DR, Greenblatt DJ. Effect of obesity on the pharmacokinetics of drugs in humans. Clin Pharmacokinet, 2010; 49(2): 71–87.
8. Heading RC, Nimmo J, Prescott LF, Tothill P. The dependence of paracetamol absorpti ‑ on on the rate of gastric emptying. Br J Pharmacol, 1973; 47(2): 415–421.
9. Chan VO, Colville J, Persaud T, Buckley O, Hamilton S, Torreggiani WC. Intramuscular in ‑ jections into the buttocks: are they truly intramuscular? Eur J Radiol, 2006; 58(3): 480–484.
10. Cockshott WP, Thompson GT, Howlett LJ, Seeley ET. Intramuscular or Intralipomatous Injections? New England Journal of Medicine, 1982; 307(6): 356–358.
11. De Hert M, Eramo A, Landsberg W, Kostic D, Tsai L‑F, Baker RA. Efficacy and safety of ari ‑ piprazole once‑monthly in obese and nonobese patients with schizophrenia: a post hoc analysis. Neuropsychiatric disease and treatment, 2015; 11 : 1299–1306.
12. Poland GA, Borrud A, Jacobson RM et al. Determination of deltoid fat pad thickness. Implications for needle length in adult immunization. Jama, 1997; 277(21): 1709–1711.
13. Cook IF, Williamson M, Pond D. Definition of needle length required for intramuscular deltoid injection in elderly adults: an ultrasonographic study. Vaccine, 2006; 24(7): 937–940.
14. Hollenstein UM, Brunner M, Schmid R, Müller M. Soft tissue concentrations of cipro ‑ floxacin in obese and lean subjects following weight‑adjusted dosing. International Jour ‑ nal of Obesity, 2001; 25(3): 354–358.
15. Bickel MH. Factors affecting the storage of drugs and other xenobiotics in adipose tissue. In: Advances in Drug Research. Testa, B, Meyer, UA (Eds.) 1994; 55–86.
16. Brill MJ, Diepstraten J, van Rongen A, van Kralingen S, van den Anker JN, Knibbe CA. Impact of obesity on drug metabolism and elimination in adults and children. Clin Pharmacokinet, 2012; 51(5): 277–304.
17. Abernethy DR, Greenblatt DJ, Divoll M, Smith RB, Shader RI. The Influence of Obesi ‑ ty on the Pharmacokinetics of Oral Alprazolam and Triazolam. Clinical Pharmacokinetics, 1984; 9(2): 177–183.
18. Meng L, Mui E, Holubar MK, Deresinski SC. Comprehensive Guidance for Antibiotic Dosing in Obese Adults. Pharmacotherapy, 2017; 37(11): 1415–1431.
19. Bernstein RS, Thornton JC, Yang MU, et al. Prediction of the resting metabolic rate in obese patients. Am J Clin Nutr, 1983; 37(4): 595–602.
20. Abernethy DR, Greenblatt DJ, Smith TW. Digoxin disposition in obesity: clinical pharmacokinetic investigation. Am Heart J, 1981; 102(4): 740–744.
21. Lee LS, Chan LN. Evaluation of a sex‑based difference in the pharmacokinetics of digoxin. Pharmacotherapy, 2006; 26(1): 44–50.
22. Conway JM, Eberly LE, Collins JF et al. Factors in Variability of Serial Gabapentin Concentrations in Elderly Patients with Epilepsy. Pharmacotherapy, 2017; 37(10): 1197–1203.
23. Abernethy DR, Greenblatt DJ. Phenytoin disposition in obesity. Determination of loading dose. Arch Neurol, 1985; 42(5): 468–471.
24. Casati A, Putzu M. Anesthesia in the obese patient: pharmacokinetic considerations. J Clin Anesth, 2005; 17(2): 134–145.
25. Griggs JJ, Mangu PB, Anderson H, et al. Appropriate Chemotherapy Dosing for Obese Adult Patients With Cancer: American Society of Clinical Oncology Clinical Practice Guideline. Journal of Clinical Oncology, 2012; 30(13): 1553–1561.
26. Morgan DJ, Bray KM. Lean body mass as a predictor of drug dosage. Implications for drug therapy. Clin Pharmacokinet, 1994; 26(4): 292–307.
27. Andrews LM, de Winter BC, Tang JT, et al. Overweight Kidney Transplant Recipients Are at Risk of Being Overdosed Following Standard Bodyweight‑Based Tacrolimus Starting Dose. Transplant Direct, 2017; 3(2), e129.
28. Rocca B, Fox KAA, Ajjan RA, et al. Antithrombotic therapy and body mass: an expert position paper of the ESC Working Group on Thrombosis. Eur Heart J, 2018; 39(19):1672–1686f.
29. Abernethy DR, Greenblatt DJ, Divoll M, Shader RI. Enhanced glucuronide conjugation of drugs in obesity: studies of lorazepam, oxazepam, and acetaminophen. J Lab Clin Med, 1983; 101(6): 873–880.
30. de Hoogd S, Välitalo PAJ, Dahan A, et al. Influence of Morbid Obesity on the Pharmacokinetics of Morphine, Morphine-3-Glucuronide, and Morphine-6-Glucuronide. Clinical pharmacokinetics, 2017; 56(12): 1577–1587.
31. Anastasio P, Spitali L, Frangiosa A, et al. Glomerular filtration rate in severely overweight normotensive humans. Am J Kidney Dis, 2000; 35(6): 1144–1148.
32. Winter MA, Guhr KN, Berg GM. Impact of various body weights and serum creatinine concentrations on the bias and accuracy of the Cockcroft‑Gault equation. Pharmacothe ‑ rapy, 2012; 32(7): 604–612.
33. Abernethy DR, Divoll M, Greenblatt DJ, Ameer B. Obesity, sex, and acetaminophen disposition. Clin Pharmacol Ther, 1982; 31(6): 783–790.
34. Lee WH, Kramer WG, Granville GE. The effect of obesity on acetaminophen pharmacokinetics in man. J Clin Pharmacol, 1981; 21(7): 284–287.
35. Abernethy DR, Greenblatt DJ. Ibuprofen disposition in obese individuals. Arthritis Rheum, 1985; 28(10): 1117–1121.
36. Andersen G, Christrup L, Sjøgren P. Relationships Among Morphine Metabolism, Pain and Side Effects During Long‑Term Treatment: An Update. Journal of Pain and Symptom Management, 2003; 25(1): 74–91.
37. Patanwala AE, Holmes KL, Erstad BL. Analgesic response to morphine in obese and morbidly obese patients in the emergency department. Emerg Med J, 2014; 31(2): 139–142.
38. Schug SA, Raymann A. Postoperative pain management of the obese patient. Best Pract Res Clin Anaesthesiol, 2011; 25(1): 73–81.
39. Halilovic J, Heintz BH, Brown J. Risk factors for clinical failure in patients hospitalized with cellulitis and cutaneous abscess. J Infect, 2012; 65(2): 128–134.
40. Janson B, Thursky K. Dosing of antibiotics in obesity. Curr Opin Infect Dis, 2012; 25(6): 634–649.
41. Bouazza N, Pestre V, Jullien V, et al. Population pharmacokinetics of clindamycin orally and intravenously administered in patients with osteomyelitis. Br J Clin Pharmacol, 2012; 74(6): 971–977.
42. Al‑Dorzi HM, Al Harbi SA, Arabi YM. Antibiotic therapy of pneumonia in the obese pa ‑ tient: dosing and delivery. Curr Opin Infect Dis, 2014; 27(2): 165–173.
43. Bratzler DW, Dellinger EP, Olsen KM et al. Clinical practice guidelines for antimicrobial prophylaxis in surgery. Am J Health Syst Pharm, 2013; 70(3): 195–283.
44. Hussain Z, Curtain C, Mirkazemi C, Gadd K, Peterson GM, Zaidi STR. Prophylactic Cefazolin Dosing and Surgical Site Infections: Does the Dose Matter in Obese Patients? Obes Surg, 2019; 29(1): 159–165.
45. Hartinger J. Klinické aspekty aspirinové rezistence. (Remedia, 2017) 182–186
46. Tellor KB, Nguyen SN, Bultas AC, Armbruster AL, Greenwald NA, Yancey AM. Evaluation of the impact of body mass index on warfarin requirements in hospitalized patients. Ther Adv Cardiovasc Dis, 2018; 12(8): 207–216.
47. Wallace JL, Reaves AB, Tolley EA, et al. Comparison of initial warfarin response in obese patients versus non‑obese patients. J Thromb Thrombolysis, 2013; 36(1): 96–101.
48. Kido K, Lee JC, Hellwig T, Gulseth MP. Use of Direct Oral Anticoagulants in Morbidly Obese Patients. Pharmacotherapy, 2020; 40(1): 72–83.
49. Vandiver JW, Ritz LI, Lalama JT. Chemical prophylaxis to prevent venous thrombo ‑ embolism in morbid obesity: literature review and dosing recommendations. J Thromb Thrombolysis, 2016; 41(3): 475–481.
50. Abernethy DR, Greenblatt DJ, Divoll M, Shader RI. Prolonged accumulation of diaze ‑ pam in obesity. J Clin Pharmacol, 1983; 23(8–9): 369–376.
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Internal Medicine

2020 Issue 8
-
All articles in this issue
- Obesity-associated changes in drug pharmacokinetics
- Bariatry – surgical therapy of the severe obesity
- Contemporary state and perspectives of obesity pharmacotherapy
- Physical activity in the treatment of obesity in practice
- How to treat arterial hypertension in obese patients?
- Vitamin D supplementation as an important factor in COVID-19 prevention and treatment: what evidence do we have?
- Antiplatelet therapy in secondary prevention of non‑embolic ischaemic stroke
- Age‑related myocardial remodeling: myth or reality?
- Fixed-dose combination of rosuvastatin and ezetimibe
- Influence of ageism on guideline adeherence in seniors with atrial fibrillation in the local practise of private cardiology clinic among years 2012 a 2017
- Acute infections, venous thrombosis, and recommended thromboprophylaxis
- Hypogonadismus obézních mužů
- Dialysis patient in internal medicine inpatient ward
- Infliximab pharmacokinetics monitoring in inflammatory bowel disease
- Heparin induced thrombocytopenia and up to date options of treatment – review of literature
- Rare manifestation of CMV infection – circular stenosis of the stomach
- Danger of the sea‑complications After Scorpion Fish Attack
- Dissection of ascending aorta, a diagnosis needs to remember about it
- Prof. Jiří Šonka a obezitologie
- Molekula erdostein společnosti Recipharm byla s pozitivním výsledkem testována jako součást léčby pacientů s COVID-19
- Antioxidační a bronchoprotektivní účinek erdosteinu
- Zkrácená informace o přípravku ERDOMED
- K 100. výročí narození prof. MUDr. Jiřího Šonky, DrSc.
- 2020: rok, kdy ambulantní internisté vzali budoucnost do svých rukou. Konečně!
- Programy kvality Q‑OSTEOPORÓZA a Q‑DYSLIPIDEMIE – cesta k dlouhodobé stabilitě v oboru
- 110. výročí narození primáře Kadeřábka
- The role of metabolic syndrome in the induction of chronic pancreatitis after a first attack of acute pancreatitis – multicenter trial
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue
- Dialysis patient in internal medicine inpatient ward
- Obesity-associated changes in drug pharmacokinetics
- Heparin induced thrombocytopenia and up to date options of treatment – review of literature
- Danger of the sea‑complications After Scorpion Fish Attack
