Fatálna koincidencia inaparentnej SARS‑CoV-2 infekcie a liekovej toxicity v teréne imunosupresie u 33-ročnej ženy
Fatal coincidence of inapparent SARS‑CoV-2 infection and drug toxicity in the field of immunosuppression in a 33-year old woman
The COVID-19 pandemic represents a wide-ranging form of involvement from asymptomatic through mild respiratory form to bilateral bronchopneumonia with acute respiratory and multiorgan fatal failure. Patients with comorbidities (obesity, cardiovascular diseases, diabetes mellitus) are particularly at risk of a more severe course of infection. We present a 33-year old lean patient with a medical history of ulcerative colitis on immunosuppressive treatment with Azathioprine, after unsuccessful in vitro fertilization one week before the onset of symptoms, admitted to hospital for two-week-long cough with sore throat with fever ap to 40°C. CT confirmed bilateral bronchopneumonia without etiological detection of the infectious agent. Three PCR tests (two of nasopharyngeal swabs and one of bronchoalveolar lavage (BAL)) were negative for COVID-19, including antigen and antibody tests. Complex parenteral ATB treatment with high-flow nasal oxygen therapy was ineffective, and artificial lung ventilation was indicated for acute respiratory failure. After 4 days antifungal treatment of Fluconazole, condition of patient progressed to hepatic and multiorgan failure and the patient died on day 14 of hospitalization. Post-mortem histological examination revealed the presence of coronavirus in the cells of lung parenchyma. The case recalls that even young patients with immunosuppressive treatment are at risk for the critical course of COVID-19 disease. The negativity of the tests was due to the capture of the patient only after the second week of infection, at the time of the diagnostic window between the positive PCR test and the formation of antibodies. The persistent effect of immunosuppression was most likely the reason for the lack of antibody response.
Keywords:
bilateral bronchopneumonia – COVID-19 – PCR test – respiratory failure.
Authors:
Xénia Faktorová 1; Lucia Horniaková 1; Jozef Sedlačko 1; Alena Havranová 2; Peter Martanovič 3; Petra Malíková 3; Martina Jakabovičová 1; Zuzana Urkovičová 1; Mária Szántová 1
Authors‘ workplace:
III. interná klinika LFUK a UN, Bratislava
1; I. rádiologická klinika LFUK, SZU a UN, Bratislava
2; Pracovisko patologickej anatómie ÚDZS, Nemocnica Antolská, Bratislava
3
Published in:
Vnitř Lék 2021; 67(1): 51-56
Category:
Case Reports
Overview
Pandémia COVID-19 predstavuje širokorozmernú formu postihnutia od asymptomatickej cez ľahkú respiračnú formu až po bilaterálnu bronchopneumóniu s akútnym respiračným a multiorgánovým fatálnym zlyhaním. Rizikom ťažšieho priebehu infekcie sú ohrození najmä pacienti s komorbiditami (obezita, kardiovaskulárne ochorenia, diabetes mellitus). Uvádzame popis 33-ročnej štíhlej pacientky s anamnézou ulceróznej kolitídy na imunosupresívnej liečbe Azatioprinom, po neúspešnej in vitro fertilizácii týždeň pred objavením symptómov, prijatej do nemocnice pre dva týždne trvajúci kašeľ s bolesťami hrdla a febrilitami do 40 °C. Na CT sa potvrdila bilaterálna bronchopneumónia bez etiologického záchytu infekčného agens. Tri PCR testy (dva zo sterov z nosohltana a jeden z bronchoalveolárnej laváže (BAL) boli negatívne na COVID-19 vrátane dvoch antigénových a protilátkových testov. Komplexná parenterálna ATB liečba s vysokopretlakovou oxygenoterapiou boli neefektívne a pre akútne respiračné zlyhanie bola indikovaná umelá pľúcna ventilácia. Po 4 dňoch antimykotickej liečby Fluconazolom došlo ku progresii hepatálneho a multiorgánového zlyhania a na 14. deň hospitalizácie pacientka exitovala. Histologické vyšetrenie post mortem preukázalo prítomnosť koronavírusu v bunkách pľúcneho parenchýmu. Kazuistika pripomína, že aj mladí pacienti s imunosupresívnou liečbou sú rizikoví pre kritický priebeh ochorenia COVID-19. Negativita testov bola dôsledkom zachytenia pacientky až po druhom týždni infekcie, teda v čase diagnostického okna medzi pozitívnym PCR testom a vytvorením protilátok. Pretrvávajúci efekt imunosupresie bol najpravdepodobnejším dôvodom chýbajúcej protilátkovej odpovede.
Klíčová slova:
bilaterálna bronchopneumónia – COVID-19 – PCR test – respiračné zlyhanie.
Úvod
Ochorenie COVID-19, ktorého pôvodcom je koronavírus ťažkého akútneho respiračného syndrómu (SARS‑CoV-2), sa dnes rozrástlo do rozmerov globálnej pandémie so signifikantným dopadom na verejné zdravotníctvo i celú ľudskú spoločnosť (1). Podľa údajov ECDC je ku 3. 12. 2020 celosvetovo potvrdených 64 miliónov prípadov ochorenia a takmer 1 500 000 úmrtí (2). Infekcia COVID-19 postihuje v rozličnej miere respiračný systém s prejavmi suchého kašľa, dušnosti, febrilít a hypoxémie spolu s abnormálnymi nálezmi na zobrazovacích vyšetreniach. Napriek tomu, že väčšina infikovaných má len mierny klinický priebeh ochorenia, u nezanedbateľnej časti pacientov (5–10 %) dochádza od počiatočných príznakov k rapídnemu zhoršeniu celkového stavu v zmysle pneumónie a syndrómu akútnej respiračnej tiesne (ARDS) (3). Títo pacienti majú výrazne zníženú nádej na prežitie a často vyžadujú intenzívnu medicínsku starostlivosť, pričom mortalita je približne 20× vyššia než u pacientov s nezávažným priebehom ochorenia (4).
Zlatým štandardom pre potvrdenie ochorenia COVID-19 je polymerázová reťazová reakcia v reálnom čase (RT‑PCR). Pre deklarovanú výťažnosť je zásadný správny odber materiálu z nosohltana či respiračných sekrétov z dolných dýchacích ciest v správnom čase. Štúdia porovnávajúca výťažnosť odberov z rôznych miest na súbore 205 pacientov s COVID-19 preukázala najvyššiu pozitivitu vo vzorkách z bronchoalveolárnej laváže (93 %), spúta (72 %) a nosa (63 %), kým pri výtere z nosohltana bola len 32 % (5). Podobné zistenia uvádzajú aj ďalší autori. PCR pozitivita bola najčastejšie zachytená v prvých 14-tich dňoch trvania infekcie, pričom v odberoch z orofaryngu bola záchytnosť po viac ako 8 dňoch od začiatku symptómov už len minimálna (6). Tiež v prípade nedostatočnej vírusovej nálože boli pozorované falošne ne ‑ gatívne výsledky RT‑PCR testov a to i pri vysoko suspektných nálezoch zobrazovacích vyšetrení, najmä počítačovej tomografie (CT) (1).
Sérologické (protilátkové) testy v akútnej fáze ochorenia nemajú význam, ich senzitivita je v prvom týždni ochorenia veľmi nízka (38,3 %), až v druhom týždni stúpa na 89,6 % (7). Pre vstup do bunky využíva nový koronavírus ACE-2 receptor (angiotenzín konvertujúci enzým 2), exprimovaný na epitelových bunkách pľúc, tenkého čreva a endotelu. Po vstupe vírusu do bunky sa jeho genóm uvoľní do cytoplazmy a ná ‑ sledne dochádza ku replikácii vírusu.
Na základe metaanalýzy 61 štúdií na súbore 59 254 pacientov najčastejšie symptómy boli: horúčka (82 %), kašeľ (61 %), myalgie a únava (36 %), dušnosť (26 %) a cefalea (12 %), bolesti hrdla (10 %) a tráviace ťažkosti (9 %) (8). Relatívne častá bola i anosmia a dysgeuzia (9). Závažný priebeh choroby musí zahŕňať jedno z troch kritérií: dychová frekvencia >30/min., saturácia hemoglobínu kyslíkom <93% alebo pomer PaO2 : FiO2 < 300 mmHg (10).
Kritický priebeh ochorenia je definovaný závažnou pneumóniou s respiračným zlyhaním a potrebou umelej pľúcnej ventilácie, šokom alebo iným typom orgánového zlyhania, vyžadujúcim starostlivosť na JIS (10). V rozsiahlej štúdii zahŕňajúcej 72 000 chorých malo mierne až stredne závažný priebeh 80,9 % chorých, závažný priebeh 13,8 % a kritický priebeh 4,7 % pacientov (8). Najčastejšími komplikáciami boli ARDS (3,4 %), septický šok (1,1 %) a akútne renálne zlyhanie (0,5 %). Ku vzniku komplikácií dochádza najčastejšie v druhom týždni choroby. Medián do objavenia dušnosti bol 8 dní a medián do započatia umelej pľúcnej ventilácie 10,5 dňa (11).
V laboratórnom obraze býva zväčša normálny počet leukocytov pri miernej lymfopénii s relatívnou neutrofíliou a mierne zvýšeným CRP (20–40 mg/l). V prípade vyšších hodnôt CRP a leukocytózy s významnou lymfopéniou je riziko horšej prognózy. Elevácia D‑diméru, vzostup CRP a prokalcitonínu sú prítomné u pacientov so závažným a kritickým priebehom. U pacientov s komplikovaným priebehom býva zvýšená laktátdehydrogenáza (LDH), pri hepatálnom poškodení zvýšené aminotransferázy, pri myokardiálnom poškodení vzostup kreatínkinázy (CK) a troponínu, pri renálnom zlyhaní vzostup kreatinínu a urey.
Popis prípadu
33-ročná pacientka s dvojročnou anamnézou ulceróznej kolitídy na imunosupresívnej liečbe Azatioprinom v kombinácii s Mesalazínom a polypmi cholecysty, po neúspešnom pokuse o in vitro fertilizáciu týždeň pred objavením prvých symptómov, bola prijatá do nemocnice pre dva týždne trvajúci kašeľ, bolesti hrdla, subfebrility až febrility do 40 stupňov Celzia. V predchorobí, približne 3 týždne pred hospitalizáciou, pacientka absolvovala pracovnú cestu do Slovinska, nevedela uviesť kontakt s pozitívnou osobou na COVID-19. Predhospitalizačne užívala Azitromycín (3 dni) a Cefuroxim (4 dni) na odporučenie obvodného lekára.
Vo vstupnom fyzikálnom vyšetrení dominovala celková slabosť, hypotenzia (TK 90/60 mmHg), sínusová tachykardia (pulz 105/min), febrility (38 stupňov Celzia), saturácia O2 : 96%. Auskultačne bolo dýchanie vezikulárne, bez vedľajších dychových fenoménov. Vstupný antigénový aj protilátkový rýchlotest na COVID-19 boli negatívne, taktiež ster z nosohltanu (PCR) bol negatívny a pacientka bola uložená na štandardné interné lôžko. Laboratórne pri prijatí sme zaznamenali vysokú hladinu CRP (149 mg/l) a D‑diméru (10,6 mg/l) s mierne pozitívnym prokalcitonínom (0,67 ng/ml), 2–3-násobok aminotransferáz (AST 1,51 μkat/l; ALT 0,95 μkat/l), cholestatické enzýmy boli v medziach normy, bilirubín na hornej hranici normy (21,7 μmol/l). V krvnom obraze dominovala leukopénia (2,61 × 109 /l) s miernou lymfopéniou (0,38 × 109 /l = 14,6%), anémia ľahkého stupňa (Hb 110 g/l) a ľahká trombocytopénia (110 × 109 /l).
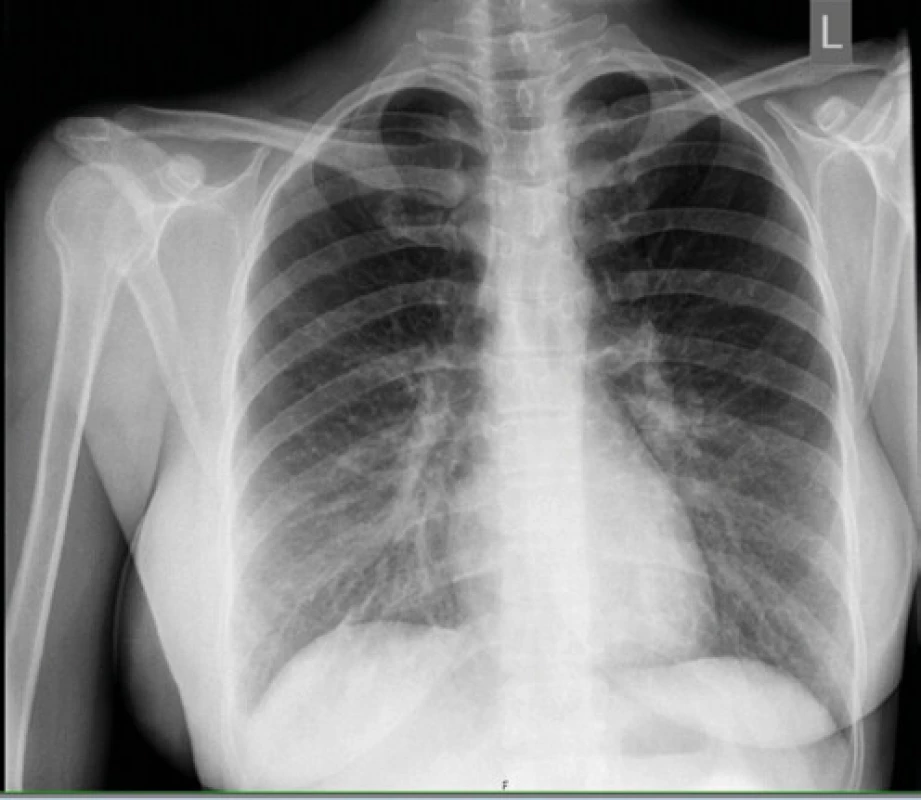
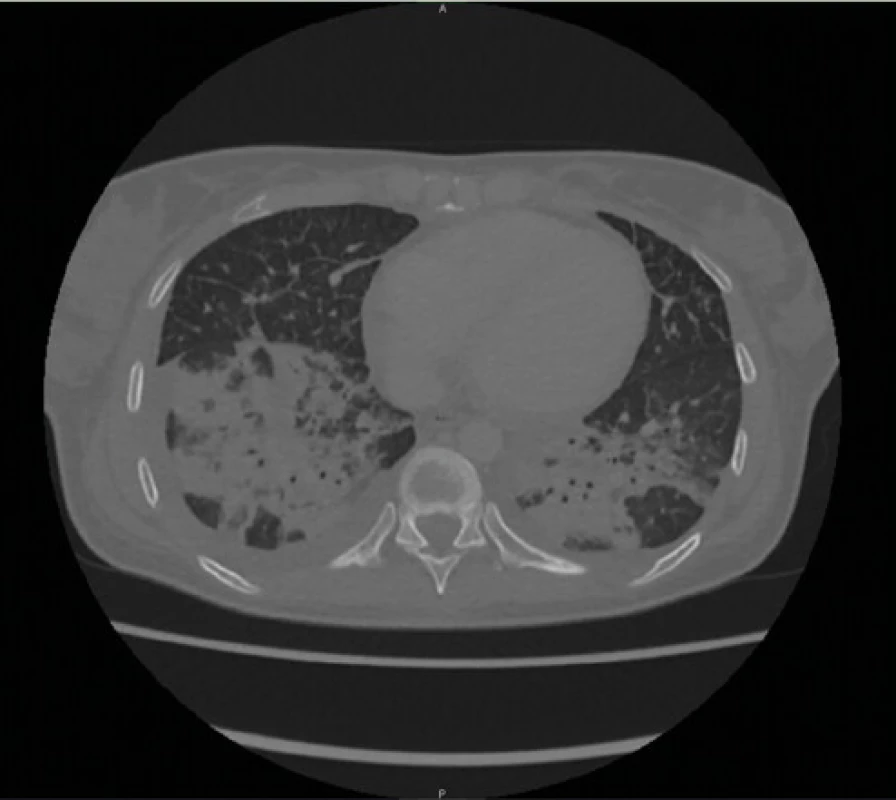
RTG snímka hrudníka pri prijatí bola negatívna až na akcentovanú bronchovaskulárnu kresbu v dolnom pľúcnom poli bilaterálne (Obr. 1), taktiež RTG snímka prínosových dutín bola v norme. Sérologické vyšetrenia (RS, Adenovírus, Vírusy chrípky A, B, Chlamýdia a Mykoplazma pneumoniae) boli negatívne. Kultivačné vyšetrenia z nosa a moču potvrdili Candidu albicans, tampón tonzíl bol negatívny. U pacientky bola započatá empirická parenterálna antibiotická liečba (Cefuroxim) v kombinácii s antimykotikom podľa citlivosti (Fluconazol). V priebehu štyroch dní u pacientky progredovala slabosť a pridružila sa dušnosť. V liečbe sme pridali parenterálne bronchodilatanciá, systémové kortikoidy (Dexametazón 4 mg), oxygenoterapiu, so zmenou ATB na Moxifloxacín a Meropenem. V laboratórnom obraze sme zaznamenali progresiu CRP (233 mg/l), prokalcitonínu (2,8 ng/ml), 10-násobok transamináz a 4-násobný vzostup cholestatických enzýmov (AST 6,91 μkat/l; ALT 2,70 μkat/l, GMT 3,59 μkat/l; ALP 2,44 μkat/l). V krvnom obraze sa prehĺbila leukopénia (1,32 × 109 /l) s progresiou lymfopénie (0,18 × 109 /l=6,9%), anémie na stredne ťažkú (hemoglobín 91 g/l) a trombocytopénie na ťažký stupeň (39 × 109 /l). CT hrudníka realizované na 5. deň hospitalizácie zobrazilo nehomogénne opacity až splývajúce konsolidácie rozmerov 88 × 72 × 60 mm (LL × AP × CC) vpravo v dolnom až strednom pľúcnom poli dorzálne a v menšom rozsahu aj v dorzálnom úseku dolného pľúcneho poľa vľavo s malým fluidotoraxom a akcentáciou retikulárnej intersticiálnej kresby pri bilaterálnej pleuropneumónii, ľahkú hepatosplenomegáliu a malé množstvo tekutiny perikardiálne až mediastinálne (Obr. 2). Opakovane realizované antigénový, protilátkový rýchlotest na COVID-19 ako aj ster z nosohltanu na PCR na 5. deň hospitalizácie boli negatívne. S pretrvávajúcou úvahou o možnej infekcii SARS‑CoV-2 (napriek opakovane negatívnym PCR testom) bol konzultovaný pneumológ, ktorý realizoval bronchoalveolárnu laváž (BAL) opäť s negatívnym výsledkom PCR na SARS‑CoV-2.
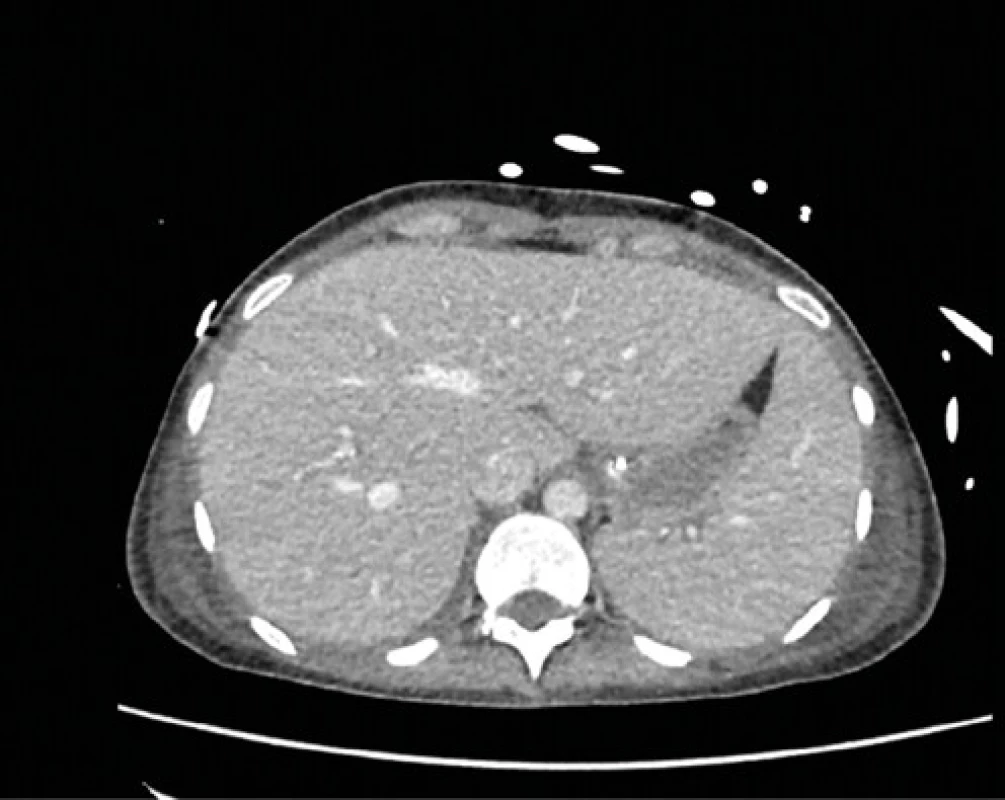
Aj napriek liečbe došlo u pacientky ku progresii dyspnoe s desaturáciou, bez efektu vysoko prietokovej ventilácie, čo vyžiadalo jej preklad na KAIM. Pre nedostatočný efekt neinvazívnej ventilácie bola pacientka na 7. deň hospitalizácie zaintubovaná, napojená na umelú pľúcnu ventiláciu s potrebou vazopresorickej podpory cirkulácie (Noradrenalín/Dopamín). Na 8. deň hospitalizácie sme na EKG zaznamenali AV‑blok 2. stupňa (Wenckebach), bez sprievodnej bradykardie. Zvýšený NT‑proBNP spolu s nálezom tekutiny perikardiálne až mediastinálne a intermitentným AV‑blokom 2. stupňa poukazovali i na kardiálne postihnutie. Kontrolné CT hrudníka s odstupom 3 dní odhalilo progresiu bronchopneumónie centrálne perihilózne, obojstranného fluidotoraxu, ascitu, edém cholecysty a črevných kľučiek (Obr. 3). Na odporučenie infektológa sa antibiotická liečba od 8. dňa hospitalizácie potencovala Linezolidom, ktorý bol pre progresiu pancytopénie na 4. deň z liečby detrahovaný a iniciovala sa liečba Vankomycínom. Pre nález Acinetobacter baumanii v materiáli z BAL sa k ATB terapii pridal Colimycín.
V ďalšom priebehu u pacientky progredovali zápalové parametre (CRP 341 mg/l; prokalcitonín 362,35 ng/ml; IL-6 : 22169 ng/l), hyperbilirubinémia (bilirubín celkový 134 μmol/l) a pancytopénia na ťažký stupeň (Leu: 0,69 × 109 /l; lymf: 0,39 × 109 /l; Hb: 76 g/l; Tr: 20 × 109 /l), čo si vyžiadalo opakovanú substitúciu granulocytovým rastovým faktorom, transfúziami erymás a trombocytárnych koncentrátov. V priebehu celej hospitalizácie u pacientky pretrvávali febrility nad 38 stupňov Celzia s potrebou antipyretickej liečby neprekračujúc odporúčané dávky Paracetamolu (1000 mg/24 hod.). Na odporúčanie imunológa bol podávaný intravenózny imunoglobulín a imunostimulanciá (lyofilizovaný dialyzát leukocytov).
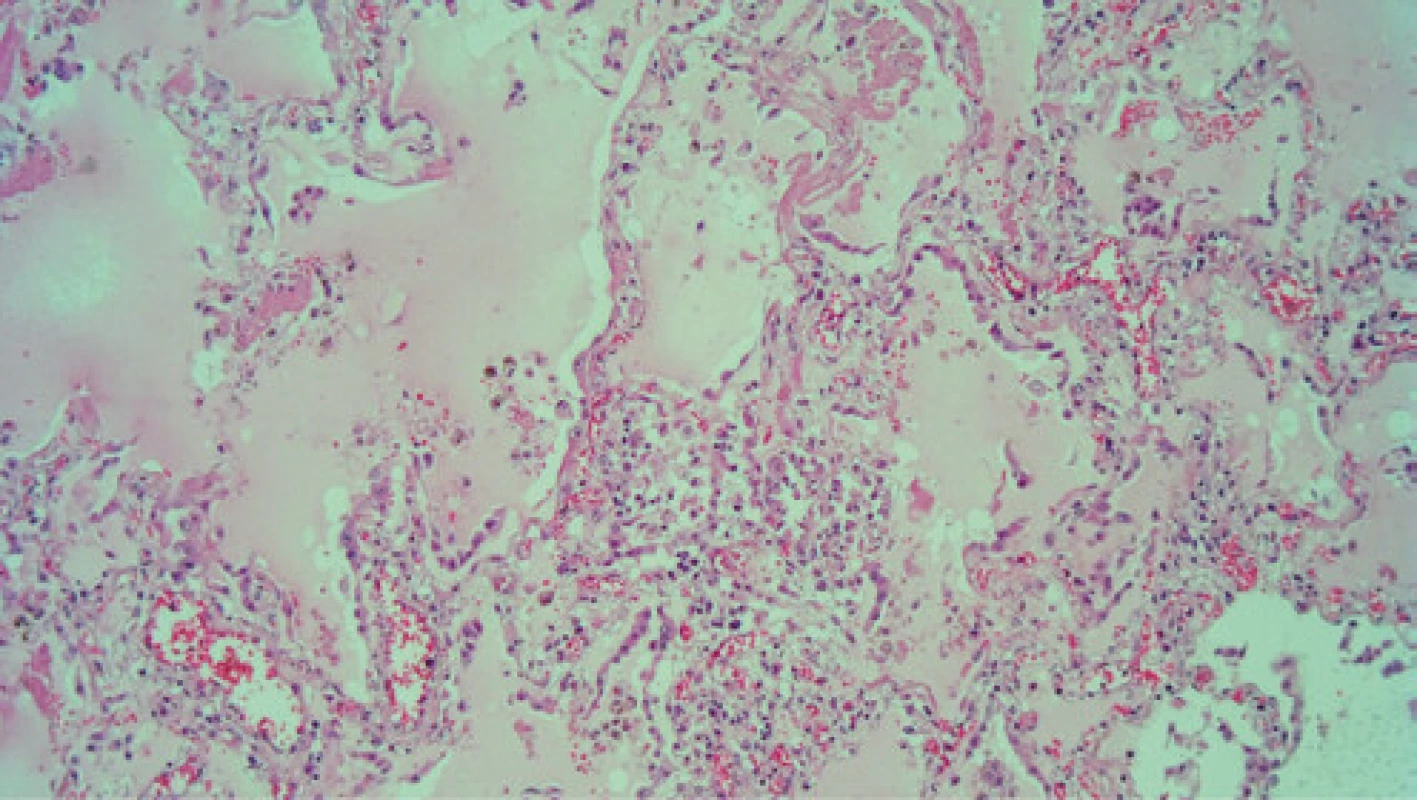
Po 14 dňoch hospitalizácie a multidisciplinárnej intenzívnej komplexnej liečby vrátane vazopresorickej podpory a UPV dochádza u pacientky k exitu na respiračné zlyhanie pri bilaterálnej bronchopneumónii a septicko‑toxický šok. Histologické vyšetrenie post mortem preukázalo pozitivitu SARS‑CoV-2 v pľúcnom parenchýme. (Obr. 4 a 5). Napriek tomu pacientka nebola zdrojom infekcie pre ostatných pacientov ani zdravotnícky personál, s ktorým bola v kontakte. U pacientky boli celkovo realizované 3 PCR testy – dva zo sterov z nosohltana a jeden z BAL, dva antigénové a dva protilátkové testy, všetky s negatívnym výsledkom na SARS‑CoV-2.
Diskusia
Kazuistika nás upozorňuje na to, že i mladí jedinci s normálnou hmotnosťou môžu byť v čase pandémie COVID-19 ohrození fatálnym rizikom pri spolupôsobení ďalších rizikových faktorov, ako sú napr. pridružené ochorenia alebo imunosupresia. V našom prípade išlo o mladú štíhlu pacientku s miernou formou ulceróznej kolitídy v štádiu remisie na chronickej imunosupresívnej liečbe Azatioprinom.
U pacientky sa kumulovalo viacero zdanlivo, z pohľadu mladého človeka, nevýznamných faktorov: imunosupresia, in vitro fertilizácia, hektický životný štýl (práca v logistike). Pacientka mala pozitívnu cestovateľskú anamnézu (Slovinsko) zhruba týždeň pred začiatkom ochorenia. Infekcia vírusom SARS‑Cov-2 potencovaná imunosupresívnou liečbou bola symptomatická, avšak ani opakovanými PCR testami sa ju nepodarilo potvrdiť. PCR testy realizované po dvoch týždňoch trvania choroby boli zrejme vykonané v čase diagnostického okna, kedy sa nezistila prítomnosť vírusu, antigénu ani protilátok. Imunosupresia sa podieľala na prehĺbení závažnosti infekcie. Lymfopénia, vysoké hodnoty CRP, D‑diméru, zvýšený prokalcitonín a stredná aktivita transamináz už v čase prijatia do nemocnice poukazovali na indície rozvíjajúcej sa ťažkej formy infekcie SARS‑CoV-2. Vzhľadom na negatívny RTG nález hrudníka ako i sérologický, antigénový a PCR test infektológ nepredpokladal COVID-19 a pacientku odporučil na internú kliniku. Keďže PCR test na SARS‑CoV-2 i protilátkový a antigénový test boli negatívne, v prvé 3 dni hospitalizácie sa pokračovalo v liečbe Azatioprinom v redukovanej dávke 25mg denne. Pre perzistenciu febrilného stavu sa na 4.deň Azatioprin detrahoval z liečby. Azatioprin má dokumentované nežiadúce účinky v zmysle cytopénie, ktorú pacientka mala, s významnou progresiou v terminálnych fázach choroby. Pancytopénia indukovaná Azatioprinom bola u našej pacientky potencovaná myelotoxickým účinkom Linezolidu ako i supresiou vírusovou infekciou SARS‑CoV-2.
Ďalším z agravujúcich faktorov bola in vitro fertilizácia (IVF) týž ‑ deň pred objavením sa prvých symptómov. V príprave pred IVF bola pacientka zaťažená vysokými dávkami kombinácie estrogénov a gestagénov (Estradiol 3 mg 5 dní, pokračujúc 6 mg denne p. o. a Progesteron 2× 400 mg vaginálne), ktoré z nášho pohľadu boli príčinou mierne zvýšených aminotransferáz už pri prijatí pacientky do nemocnice. U disponovaných jedincov nie je zriedkavosťou hepatotoxické poškodenie pečene indukované estrogénmi a gestagénmi.
Nepriaznivým faktom bola u pacientky reakcia na Fluconazol v zmysle pravdepodobnej hepatotoxicity (DILI). Tento bol podávaný prvých 5 dní v dennej dávke 200 mg s pokračovaním 400 mg denne parenterálnou formou. Na 7. deň liečby Fluconazolom došlo u pacientky ku 10-násobnému vzostupu hodnôt aminotransferáz a 4-násobnému vzostupu GMT a bilirubínu s objavením ascitu. I keď je hepatálna toxicita po podaní Fluconazolu zriedkavá, občas sa s ňou v klinickej praxi stretneme a je dokladovaná i v Liver‑Tox databáze a vo viacerých kazuistikách.
Podľa Šanghajských autorov sa hepatálna dysfunkcia vyskytuje u viac ako 1/3 pacientov s ochorením COVID-19, je spojená s dlhšou dobou hospitalizácie a viaceré štúdie preukazujú ťažší priebeh. K podobným záverom dospela i metaanalýza štúdií pacientov s COVID-19, ktorá zistila abnormality hepatálnych testov – vzostup AST u 33,3% a ALT u 24,1% prípadov. Viaceré štúdie popísali koreláciu medzi závažnosťou COVID-19 a stupňom hepatálnej dysfunkcie (11–15). Šanghajská štúdia popísala u pacientov s hepatálnou dysfunkciou častejšie prítomné vysoké febrility, vyššie hladiny CRP i prokalcitonínu (16), čo sme pozorovali i u našej pacientky. Doposiaľ len jedna štúdia popísala akútne hepatálne zlyhanie pri COVID-19 (17). Avšak najčastejšou príčinou smrti pri COVID-19 je respiračné zlyhanie a sepsa. Jedným z prejavov sepsy je i hypoxické poškodenie pečene a vzostup hepatálnych parametrov so zlyhaním jej funkcií pri prebiehajúcej cytokínovej búrke, čo dokladovali extrémne vysoké hodnoty CRP, prokalcitonínu a v terminálnej fáze i IL-6.
U našej pacientky sa zhoršenie progresie hepatálneho zlyhania prisudzovalo do rámca multiorgánového zlyhania. Niektoré kazuistiky preukázali koreláciu medzi lymfopéniou (lymf: < 1,1 × 109 /l) a poškodením pečene (18). Lymfopénia sa pozorovala u 63 %–70,3 % pacientov a významná lymfopénia predikovala fatálny priebeh (19). Mierna lymfopénia prítomná už od začiatku hospitalizácie sa u našej pacientky s priebehom ochorenia prehlbovala a predikovala ťažký priebeh spolu s vysokým vstupným CRP aj D‑dimérom. Markerom komplikovaného priebehu je i zvýšená hodnota LDH, ktorá bola vyšetrená v 10. deň hospitalizácie a vysoký IL-6, ktorý dosiahol preterminálne extrémne hodnoty.
Imunosuprimovaní pacienti, pacienti po transplantáciách a s vybranými komorbiditami (obezita, diabetes mellitus) sú ohrození rizikom ťažkého priebehu infekcie COVID-19. Podľa SECURE‑IBD databázy bolo infekciou COVID-19 postihnutých 326 pacientov z 32 krajín s maximom (108 pacientov) v USA, z toho 189 pacientov malo Crohnovu chorobu a 135 ulceróznu kolitídu (20). Z uvedeného počtu, 61% pacientov bolo hospitalizovaných, 7 % si vyžiadalo UPV a 9 % zomrelo. Medzinárodná organizácia pre IBD vydala detailné odporúčanie ohľadom liečby IBD v čase pandémie COVID-19, podľa ktorej sa pri potvrdení infekcie COVID-19 má prerušiť imunosupresívna aj biologická liečba. Včasné prerušenie imunosupresívnej liečby už pri suspekcii na COVID-19 neprinieslo v našom prípade úspech.
Imunosuprimovaní pacienti, pacienti po transplantáciách a s vybranými komorbiditami (obezita, diabetes mellitus) sú ohrození rizikom ťažkého priebehu infekcie COVID-19. Podľa SECURE‑IBD databázy bolo infekciou COVID-19 postihnutých 326 pacientov z 32 krajín s maximom (108 pacientov) v USA, z toho 189 pacientov malo Crohnovu chorobu a 135 ulceróznu kolitídu (20). Z uvedeného počtu, 61% pacientov bolo hospi ‑ talizovaných, 7 % si vyžiadalo UPV a 9 % zomrelo. Medzinárodná organizácia pre IBD vydala detailné odporúčanie ohľadom liečby IBD v čase pandémie COVID-19, podľa ktorej sa pri potvrdení infekcie COVID-19 má prerušiť imunosupresívna aj biologická liečba. Včasné prerušenie imunosupresívnej liečby už pri suspekcii na COVID-19 neprinieslo v našom prípade úspech.
Naša pacientka nemala potvrdenú COVID-19 infekciu v priebehu celej hospitalizácie napriek opakovane realizovaným odberom na PCR. Príčin nezistenia COVID-19 infekcie môže byť niekoľko. Nekvalitne odobraný materiál z nosa, avšak proti tomu tvrdeniu je odber z bronchoalveolárnej laváže realizovaný špecialistom – pneumológom. Porucha imunitných funkcií v autoimunitnom teréne pri súčasnej imunosupresii a snaha vírusu uniknúť imunitnej kontrole boli zrejme príčinou nezistenia vírusu. Pacientka sa dostala do nemocnice až po dvoch týždňoch trvania symptómov, kedy je PCR test už zväčša negatívny a protilátkový test v čase prijatia do nemocnice ešte nedetekoval protilátky, prišla teda v okne medzi PCR reaktivitou a vytvorením protilátok. Imunosupresívny účinok Azatrioprinu pretrvávajúci i po jeho vysadení bol najpravdepodobnejším dôvodom nepriekazných protilátkových testov. V literatúre sme našli 2 popísané prípady s opakovane negatívnymi PCR testami, bez zjavného vysvetlenia u 32-ročného muža z Číny a 62-ročného Japonca (10, 21). Tieto prípady nie sú ojedinelé. V podobných prípadoch, ak pretrváva klinická suspekcia na COVID-19, je potrebné k pacientovi pristupovať s ochrannými pomôckami a opakovane odoberať materiál a po 2. týždni trvania ochorenia uprednostniť sérologické testy. U našej pacientky, zrejme z dôvodu pretrvávajúceho efektu imunosupresie, protilátková odpoveď nebola priekazná.
Záver
Uvedená kazuistika je námetom na zamyslenie a zvýšenie ostražitosti pri kumulácii rizikových faktorov aj v prípade mladých osôb s ochorením COVID-19. Imunosupresia môže byť príčinou negatívnych sérologických testov. Myelotoxický vplyv Azatioprinu potencovaný Linezolidom prispeli ku skresleniu klinického i laboratórneho obrazu. Estrogénovo‑gestagénová príprava pred in vitro fertilizáciou zrejme indukovala hepatotoxické poškodenie, prítomné pri prijatí pacientky. Okrem vírusovej infekcie sa na agravácii priebehu ochorenia podieľal Fluconazol hepatotoxickým efektom, ktorý z aspektu vývoja klinického obrazu považujeme za veľmi pravdepodobný. V neposlednom rade, často diskutovaným problémom je tiež kvalita odberu materiálu. Pri dlhšie trvajúcej infekcii (nad 10 dní) a opakovane negatívnych PCR testoch je vhodnejšie použiť sérologický (protilátkový) test.
Nemenej zásadnou je informácia verejnosti, a zvlášť pacientov s akoukoľvek imunosupresiou, či onkologickou liečbou, o zvýšenom riziku a možnom ťažšom priebehu prípadnej infekcie COVID-19. Dôležitá je osobná ostražitosť s dodržaním sociálneho dištancu, resp. maximalizácia preventívnych opatrení. Podhodnocovanie závažnosti priebehu COVID-19 v dobe pandémie a znižovanie opatrnosti u mladých ľudí je významným rizikovým faktorom nepriaznivého priebehu aj s možným fatálnym dopadom.
KORESPONDENČNÍ ADRESA AUTORA:
MUDr. Xénia Faktorová,
III. interná klinika LFUK a UN Bratislava,
Limbova 5,
833 05 Bratislava
Cit. zkr: Vnitř Lék 2021; 67(1): 51–56
Článek přijat redakcí: 7. 12. 2020
Článek přijat po recenzích: 21. 1. 2021
Sources
1. Hani C, Trieu NH, Saab I et al. COVID-19 pneumonia: A review of typical CT findings and differential diagnosis. Diagnostic and Interventional Imaging 2020; 101(5): 263-268. .
2. COVID -19 Situation Dashboard. European Centre for Disease Prevention and Control. [cit. 2020-12-03].< https://www.ecdc.europa.eu/en/covid-19-pandemic
3. Raghu G, Wilson KC. COVID-19 interstitial pneumonia: monitoring the clinical course in survivors. The Lancet Respiratory Medicine 2020; 8(9): 839-842. .
4. Feng Z, Yu Q, Yao S et al. Early prediction of disease progression in COVID-19 pneumonia patients with chest CT and clinical characteristics. Nat Commun 2020; 11 : 4968. .
5. Wang W, Xu Y, Gao R et al. Detection of SARS‑CoV-2 in Different Types of Clinical Specimens. JAMA 2020; 323(18): 1843-1844. .
6. Yang Y, Yang M, Shen C et al. Evaluating the accuracy of different respiratory specimens in the laboratory diagnosis and monitoring the viral shedding of 2019-nCoV infections. medRxiv 2020. .
7. Zhao J, Yuan Q, Wang H et al. Antibody Responses to SARS‑CoV-2 in Patients with Novel Coronavirus Disease 2019. Clin Infect Dis 2020; 71(16): 2027–2043. .
8. Borges do Nascimento IJ, Cacic N, Abdulazeem HM et al. Novel Coronavirus Infection (COVID-19) in Humans: A Scoping Review and Meta‑Analysis. J Clin Med 2020; 9(4): 941. .
9. Lechien JR, Chiesa‑Estomba CM, De Siati DR et al. Olfactory and gustatory dysfuncti ‑ ons as a clinical presentation of mild‑to‑moderate forms of the coronavirus disease (COVID-19): a multicenter European study. Eur Arch Otorhinolaryngol 2020; 277(8): 2251–2261. .
10. Chen LD, Li H, Ye YM et al. A COVID-19 patient with multiple negative results for PCR assays outside Wuhan, China: a case report. BMC Infectious Diseases 2020; 20(517). .
11. Huang C, Wang Y, Li X et al. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China. Lancet 2020; 395 : 497–506. .
12. Zhang W, Du RH, Li B et al. Molecular and serological investigation of 2019-nCoV infected patients: implication of multiple shedding routes. Emerg Microbes Infect 2020; 9(1): 386–389. .
13. Zhang C, Shi L, Wang FS. Liver injury in COVID-19: management and challen ‑ ges. Lancet Gastroenterol Hepatol 2020; 5(5): 428–430. .
14. Li L, Li S, Xu M et al. Risk factors related to hepatic injury in patients with corona virus disease 2019. medRxiv 2020. .
15. Guan WJ, Ni ZY, Hu Y et al. Clinical Characteristics of Coronavirus Disease 2019 in China. N Engl J Med 2020; 382 : 1708–1720. .
16. Fan Z, Chen L, Li J et al. Clinical Features of COVID-19-Related Liver Functional Abnormality. Clinical Gastroenterology and Hepatology 2020; 18(7): 1561–1566. .
17. Wander P, Epstein M, Bernstein D. COVID-19 Presenting as Acute Hepatitis. Am J Gast ‑ roenterol 2020; 115(6): 941–942. .
18. Alqahtani SA, Schattenberg JM. Liver Injury in COVID-19: The current evidence. UEG Journal 2020; 8(5): 509–519. .
19. Wölfel R, Corman VM, Guggemos W et al. Virological assessment of hospitalized patients with COVID-2019. Nature 2020; 581 : 465–469. .
20. Cha M H, Regueiro M, Sandhu DS. Gastrointestinal and hepatic manifestation of COVID-19: A comprehensive review. World J Gastroenterol 2020; 26(19): 2323–2332. .
21. Kanamoto M, Tobe M, Takazawa T et al. COVID-19 with repeated positive test results for SARS‑CoV-2 by PCR and then negative test results twice during intensive care: a case report. Journal of Medical Case Reports 2020; 14(191). .
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Internal Medicine

2021 Issue 1
-
All articles in this issue
- Co může internista udělat pro svého pacienta po ischemické cévní mozkové příhodě
- Dlouhodobá EKG monitorace
- Patentní foramen ovale z pohledu intervenční kardiologie
- Následná péče po prodělaném covidu-19 a její úskalí
- Včasná a souběžná terapie dyslipidemie a hypertenze: kdy ji začít a jak udržet dlouhodobě dobrou adherenci pacientů?
- EMPEROR reduced – empagliflozin u nemocných se srdečním selháním se sníženou ejekční frakcí
- Kdy ukončit léčbu hepatitidy B?
- Fatálna koincidencia inaparentnej SARS‑CoV-2 infekcie a liekovej toxicity v teréne imunosupresie u 33-ročnej ženy
- Překryvný syndrom SLE – ANCA asociovaná vaskulitida
- Diagnostické hospitalizácie pred zaradením pacienta na čakaciu listinu pre transplantáciu obličky
- Komplexní interdisciplinární pohled na návrat ke sportu po prodělání infekce covid-19
- Úskalí řešení problémů polymedikace
- Taxánmi‑indukovaná polyneuropatia – aktuálne možnosti predikcie a manažmentu
- Horečka nejasného původu
- Nutriční podpora v časné fázi kritického stavu – zaostřeno na množství energie a bílkovin
- Kompetence pacienta a informovaný souhlas
- Internista a pacient po ischemické CMP
- Komentáře k analýze složení směsi flavonoidů v tabletách Diozen 500 mg metodou UHPLC
- Prof. MUDr. Jiří Vítovec, CSc., FESC, má jubileum
- Jubileum prof. MUDr. Vlastimila Ščudly, CSc.
- Je autoimunitní pankreatitida rizikovým faktorem adenokarcinomu pankreatu?
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue
- Horečka nejasného původu
- Dlouhodobá EKG monitorace
- Následná péče po prodělaném covidu-19 a její úskalí
- Překryvný syndrom SLE – ANCA asociovaná vaskulitida
