Podkožní krvácení při hypotyreóze indukované pembrolizumabem
Pembrolizumab-induced hypothyreosis and subcutaneous bleeding
Pembrolizumab belongs to so called immune checkpoint inhibitors. Frequent adverse event of this therapy is hypothyroidism. The authors present a case report of patient treated with pembrolizumab for non-small cell lung carcinoma, in whom severe hypothyroidism followed quite rapidly after transient phase of subclinical hyperthyroidism – at this time point new and spontaneous onset of large subcutaneous hematomas was observed. Acquired von Willebrand syndrome, acquired hemophilia A, dysfibrinogenemia, activation of fibrinolysis and thrombocytopathy were all actively ruled out in hematological differential diagnosis. Concomittantly, laboratory markers of secondary autoimmune disease and myositis were excluded. Despite continuous pembrolizumab treatment, there were no other bleeding complications seen after intensification of endocrine substitution therapy with thyroid hormones. Causal relationship between subcutaneous hematomas and severe drug-induced hypothyroidism is established per exclusionem.
Keywords:
hematomas – Hypothyroidism – pembrolizumab
Authors:
Pavel Polák 1,3,4; Jana Špeldová 2; Monika Bratová 2; Jiřina Zavřelová 1,3; Miroslav Penka 1
Authors‘ workplace:
Oddělení klinické hematologie, Fakultní nemocnice Brno
1; Klinika nemocí plicních a tuberkulózy, Fakultní nemocnice Brno
2; Katedra laboratorních metod, Lékařská fakulta Masarykovy univerzity Brno
3; Interní hematologická a onkologická klinika, Fakultní nemocnice Brno
4
Published in:
Vnitř Lék 2021; 67(3): 175-179
Category:
Case reports
Overview
Pembrolizumab patří mezi inhibitory imunitních kontrolních bodů protinádorové imunity (immune checkpoint inhibitors). Porucha funkce štítné žlázy představuje častý nežádoucí účinek této léčby. Autoři předkládají kazuistiku pacienta léčeného pembrolizumabem pro nemalobuněčný karcinom plic, u nějž došlo po přechodné fázi subklinické hypertyreózy k poměrně rychlému rozvoji těžké hypotyreózy – a v té době i ke spontánnímu vzniku rozsáhlých podkožních hematomů. V rámci hematologické diferenciální diagnostiky byly cíleně vyloučeny: von Willebrandův syndrom, získaná hemofilie A, dysfibrinogenemie, aktivovaná fibrinolýza a trombocytopatie. Současně byly vyloučeny laboratorní projevy přidruženého autoimunitního onemocnění a myozitidy. Po intenzifikaci substituční terapie levothyroxinem nebyly navzdory pokračování léčby pembrolizumabem zaznamenány nové krvácivé komplikace. Souvislost podkožních hematomů s těžkou polékovou hypotyreózou se nabízí per exclusionem.
Klíčová slova:
hematomy – hypotyreóza – pembrolizumab
Úvod
Inhibitory imunitních kontrolních bodů protinádorové imunity (immune checkpoint inhibitors, ICI) jsou revolučními přípravky v léčbě maligních onemocnění. Používají se například k léčbě metastazujícího maligního melanomu, nemalobuněčného karcinomu plic a renálního karcinomu, pokud exprimují protein programované smrti-1 (programmed death-1, PD-1) a/nebo antigen 4 cytotoxických T-lymfocytů (CTLA4). Zjednodušeně řečeno oslabují svou vazbou na uvedené povrchové buněčné receptory inhibičně působící signály pro T-lymfocyty, čímž umožňují jejich aktivní zapojení v protinádorových imunitních mechanismech. Jako první byl na trh uveden inhibitor antigenu-4 cytotoxických T-lymfocytů ipilimumab (Yervoy®), následovali nivolumab (Opdivo®) a pembrolizumab (Keytruda®). Nežádoucí účinky této léčby jsou časté a většinou jsou zprostředkovány imunitními mechanismy. Ze širokého spektra pozorovaných nežádoucích účinků se mohou vyskytovat endokrinní poruchy (diabetes mellitus 1. typu, hypofyzitida, hypotyreóza, izolovaná adrenální insuficience), gastrointestinální nežádoucí účinky (poměrně častá je kolitida, dále byly popsány hepatitida, cholestáza, akutní jaterní selhání), dermatologické projevy (psoriáza, vitiligo, pemphigoid), neurologické poruchy (myasthenia gravis, syndrom Guillaina-Barrého, nekrotizující encefalopatie, encefalitida, periferní neuropatie), plicní (fibrotizující pneumonie, pneumonitida, sarkoidóza), revmatologické projevy (séronegativní synovitida, artritida, dermatomyozitida, polymyalgia rheumatica), oční projevy (uveitida, orbitocelulitida, myozitida okohybných svalů, uveitida) a hematologická toxicita (pancytopenie, neutropenie, aplastická anémie, trombocytopenie) (1, 2).
Autoři předkládají kazuistiku pacienta se spontánními krvácivými projevy během promptního rozvoje tyreopatie při léčbě pembrolizumabem.
Popis případu
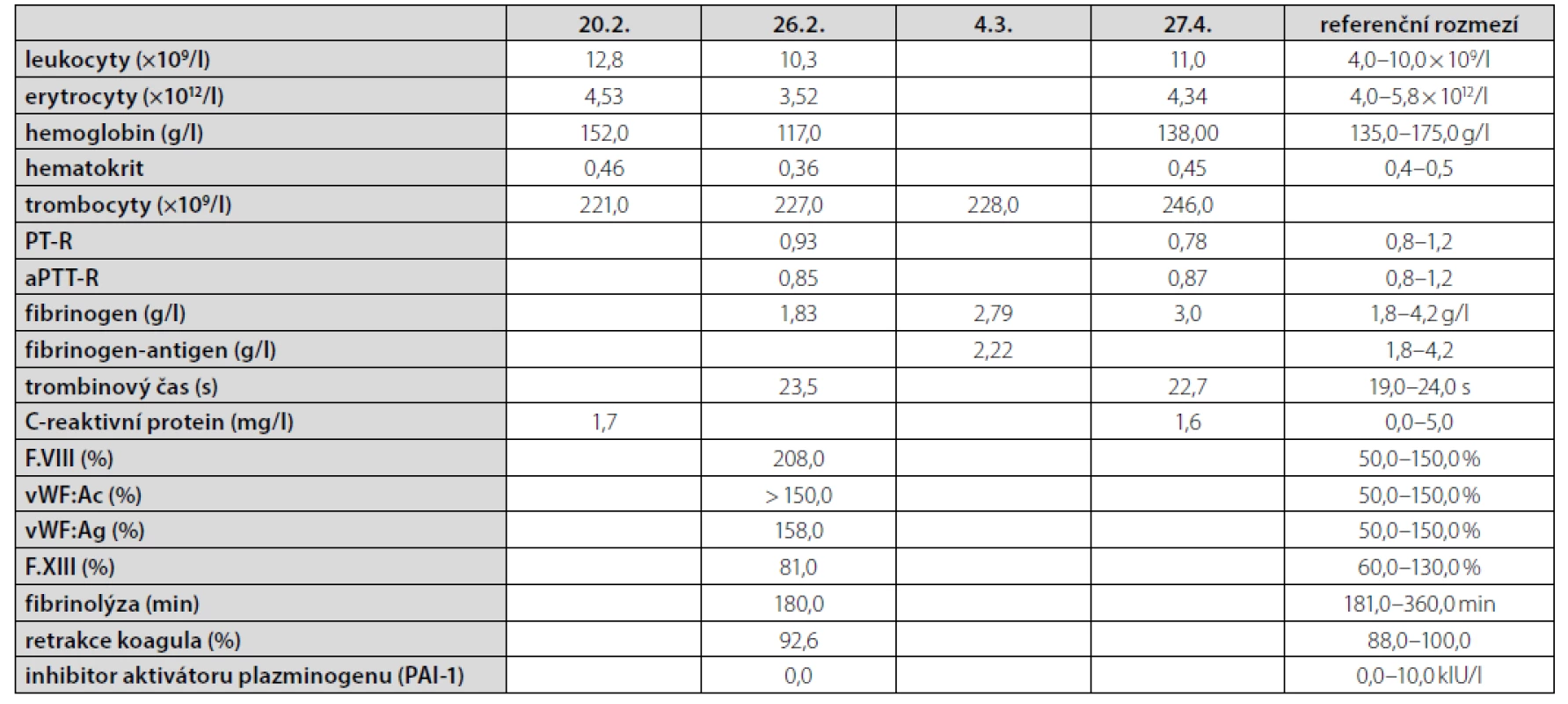
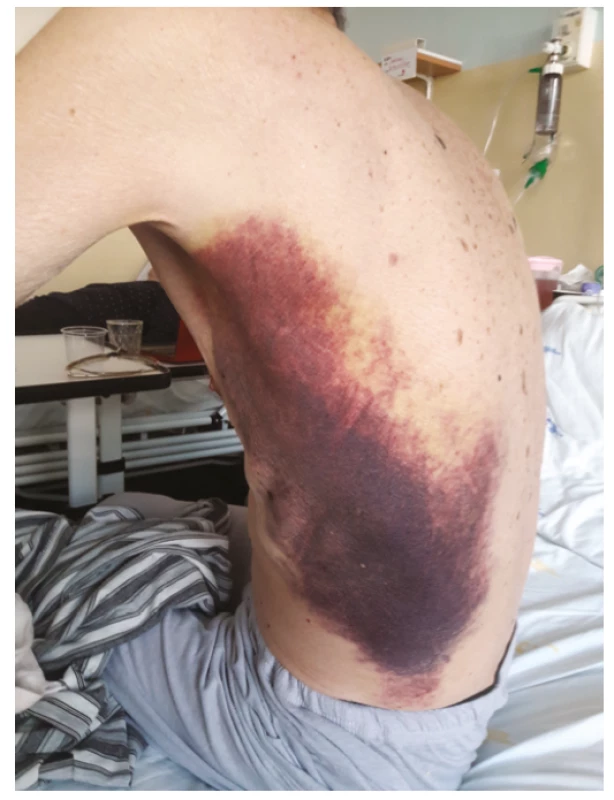
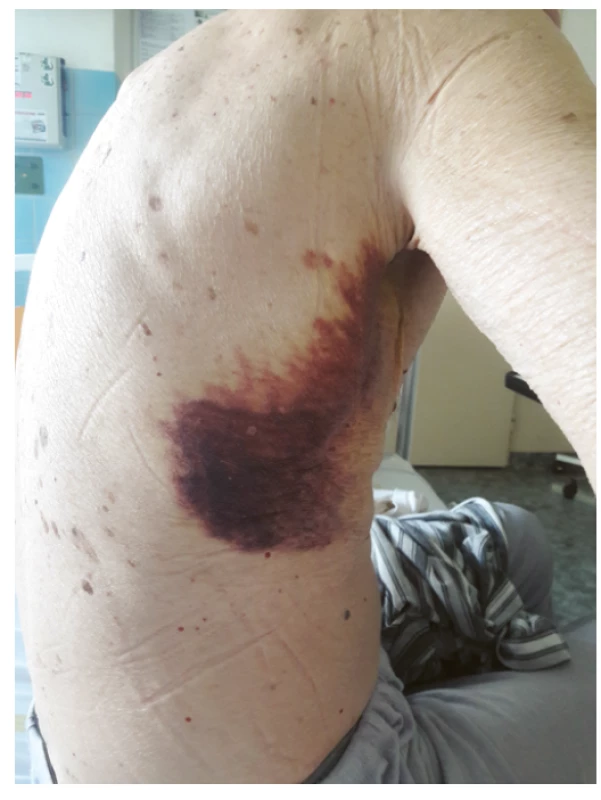
Muži ve věku 78 let byl v dubnu 2019 diagnostikován nízce diferencovaný nemalobuněčný skvamózní karcinom dolního laloku pravé plíce s vysokou expresí ligandy-1 receptoru programované smrti (PD-L1) dosahující 80 % při současné nepřítomnosti receptoru pro endoteliální růstový faktor (EGFR, endothelial growth factor receptor) a kinázy podobné receptoru pro aktivin (activin receptor-like kinase, ALK). V době stanovení diagnózy bylo onemocnění klasifikováno jako T4N1M1a, klinické stadium IVa vzhledem k vícečetným plicním metastázám, performance status 1, nebyly známky diseminace tumoru do oblasti centrálního nervového systému, do skeletu či do orgánů dutiny břišní. Z vedlejších nálezů na stagingovém vyšetření počítačovou tomografií (CT) stojí za zmínku přítomnost vícečetných hypodenzních ložisek v jaterním parenchymu charakteru cyst (bez vývoje v čase) a nekompletní trombotický uzávěr portolienálního povodí nejasného stáří. V předchorobí se jednalo o silného fumatora (50 balíčkoroků), necelý rok léčeného pro chronickou obstrukční plicní chorobu stadia 3C s těžkým emfyzémem plic kombinací inhalačního ipratropia, formoterolu a perorálních theophylinů. Pacient dosud netrpěl žádnou jinou interní komorbiditou, nikdy v předchorobí nebyl sledován ani léčen pro porušenou funkci štítné žlázy a neprodělal žádnou operaci, anamnesticky nebyly indicie pro poruchu hemostázy, ať již ve smyslu krvácivosti či tromboembolické nemoci. Od 22. 7. 2019 byla zahájena systémová imunoterapie nádorového onemocnění pembrolizumabem (Keytruda®). Krátce před aplikací první dávky pembrolizumabu proběhla ještě laboratorní kontrola parametrů štítné žlázy s normálním nálezem (Tab. 1). Po aplikaci šesti dávek pembrolizumabu byla zjištěna subklinická hypertyreóza (téměř kompletní suprese tyreostimulačního hormonu (TSH) při fyziologické koncentraci volného tetraiodtyroninu, fT4), což však nepředstavovalo kontraindikaci další terapie, nebyla indikována ani hormonální léčba. V odstupu dalších dvou měsíců a po dalších třech aplikacích přípravku Keytruda® byla dne 20. 2. 2020 zjištěna naopak excesivně zvýšená koncentrace TSH v séru při fyziologické koncentraci fT4, což odpovídalo přechodu do subklinické hypotyreózy, a proto byla zahájena hormonální substituční terapie levothyroxinem v jedné denní dávce 50 μg. Dne 22. 2. došlo ke spontánnímu vzniku rozsáhlých plošných podkožních hematomů charakteru sufuzí na obou stranách hrudníku (Obr. 1, Obr. 2). Klinickému vyšetření dominovala kachexie (hmotnost 51 kg, výška 171 cm, body mass index 24,3 kg/m2 – a to navzdory udávanému váhovému přírůstku 4 kg za poslední 4 měsíce), bledší kolorit atrofické křehčí pokožky, s výjimkou uvedených hematomů zcela bez jiných krvácivých projevů, bez klinických známek trombózy na dolních končetinách, bez hmatné strumy, lymfadenopatie či hepato-spleno-megalie, nebyly klinické známky probíhajícího infektu. V krevním obraze byla jen hraniční leukocytóza s mírnou relativní i absolutní neutrofilií, mírná makrocytární normochromní anémie a nově zjištěná mírná hypofibrinogenemie 1,83 g/l; počet trombocytů byl setrvale v referenčním rozmezí (Tab. 1). Byly fyziologické hodnoty základních koagulačních časů (protrombinový čas, aktivovaný parciální tromboplastinový čas, trombinový čas), renálních parametrů, aktivita aminotransferáz i koncentrace C-reaktivního proteinu v séru. V rámci diferenciální diagnostiky spontánně vzniklých krvácivých projevů byl vyloučen kvantitativní deficit koagulačních faktorů VIII, XIII a von Willebrandova faktoru, byla normální fibrinolýza, aktivita inhibitoru plazminogenu (PAI) a retrakce koagula a nebyl zjištěn deficit antitrombinu ani porucha agregace trombocytů po expozici adenozindifosfátu (ADP), kolagenu, epinefrinu a ristocetinu. Dále byly sérologicky vyloučeny virové hepatitidy B a C a nákaza lidským virem imunitní nedostatečnosti (HIV), nebyly prokázány autoprotilátky (ANA, anti-dsDNA, anti-ssDNA, anti-ENA, anti-Ro, revmatoidní faktor, protilátky proti thyreoglobulinu), nebyly laboratorní známky rhabdomyolýzy (normální aktivita kreatinkinázy a myoglobinu). Byla zjištěna mírná hypoproteinemie (57,2 g/l) a hypoalbuminemie, což odpovídalo klinickému stavu malnutrice. Močový sediment neprokázal hematurii. Pro exacerbaci bronchospazmu byly přechodně podávány kortikoidy parenterálně (24.–25. 2. v dávce 80 mg methylprednisolonu s přechodem na 20 mg prednisonu denně), jež mohly příznivě ovlivnit další klinický vývoj, potažmo hemostázu, svým imunitně-modulačním účinkem. Během dalších dnů a týdnů byla zaznamenána pozvolná regrese sufuzí na hrudníku s reziduálními hyperpigmentacemi, bez rozvoje nových krvácivých projevů, a proto bylo pokračováno v onkologické léčbě pembrolizumabem (desátý cyklus podán se zpožděním 7 dnů oproti původnímu plánu), která byla nadále velmi dobře tolerována.
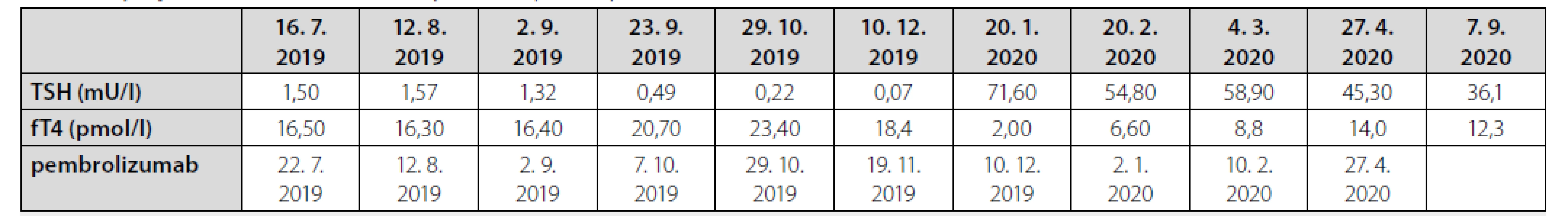
referenční meze: TSH 0,27–4,20 mU/l; fT4 12,0–22,0 pmol/l
Diskuze
Pembrolizumab (Keytruda®) je monoklonální protilátka proti receptoru programované buněčné smrti PD-1, jež může vykazovat četné nežádoucí účinky, které se mohou vyskytovat izolovaně, ale i v kombinaci (1, 2). Mezi nejčastější endokrinopatie při této léčbě se řadí právě dysfunkce štítné žlázy, jež se v některých studiích vyskytuje ve více než 80 % případů během prvních dvou měsíců léčby, přičemž častěji jsou tyto komplikace zaznamenány u pacientů s anamnézou tyreopatie (3, 4).
Američtí autoři popsali v souboru 93 pacientů s pokročilým onkologickým onemocněním léčených pembrolizumabem dysfunkci štítné žlázy ve 13 případech, z toho se 7x jednalo o autoimunitní tyreoiditidu a 3x o nově vzniklou hypotyreózu. Medián rozvoje poruchy funkce štítné žlázy byl 6 týdnů. Protilátky proti tyreoperoxidáze byly přítomny u čtyř jedinců, v sedmi případech bylo patologicky zvýšené vychytávání 18-fluorodeoxyglukózy na pozitronové emisní tomografii. Úprava funkce štítné žlázy do normy byla zaznamenána v polovině případů. Tato studie potvrdila, že porucha funkce štítné žlázy je u onkologických pacientů léčených pembrolizumabem častá a že se nejčastěji manifestuje jako reverzibilní destruktivní tyreoiditida anebo hypotyreóza (5).
Hematologické nežádoucí účinky jsou v literatuře referovány spíše výjimečně – např. kazuisticky popsané možnosti rozvoje autoimunitní hemolytické anémie při léčbě pembrolizumabem (6, 7), imunitní trombocytopenie (8, 9) anebo aplázie červené řady (10).
Obdobně byla jen zcela raritně zaznamenána tromboembolická komplikace u pacienta léčeného pembrolizumabem, na jejímž vzniku se s největší možností podílela právě terapie (10). Patofyziologicky se zde pravděpodobně uplatňuje komplexní aktivace mechanismů zánětu po stimulaci T-lymfocytární odpovědi vlivem pembrolizumabu, což potencuje již tak protrombogenní terén při onkologickém onemocnění a případně i chemoterapii (11). Francouzští autoři popsali Raynaudův fenomén a pozitivní průkaz tzv. antifosfolipidových protilátek u pacienta léčeného pembrolizumabem pro maligní melanom (12). Jelikož se však antifosfolipidový syndrom primárně manifestuje především tromboembolickými komplikacemi, nebyla v prezentovaném případě shledána klinická indikace k vyšetření panelu antifosfolipidových protilátek. Z krvácivých projevů byly u pacientů léčených pembrolizumabem kazuisticky popsány hemorhagická gastritida (13), intraalveolární plicní krvácení (14) a masivní hemoptýza (15), ve všech případech lze však přímý vliv léčby na krvácivé komplikace rozporovat, neboť se mohlo jednat o prostou komplikaci základního onemocnění a celkového stavu nemocných.
Dysfunkce štítné žlázy může mít dalekosáhlé a komplexní hemostazeologické důsledky v oblasti aktivity jednotlivých koagulačních faktorů (nejčastěji je zmiňován kvantitativní deficit von Willebrandova faktoru a získaná hemofilie A), aktivity fibrinolytického systému a počtu a funkce trombocytů, klinicky manifestní poruchy jsou však spíše raritní. Autoři se všeobecně shodují, že při hypertyreóze a subklinické hypotyreóze je aktivita koagulačního systému spíše vyšší, čili působí protrombogenně, zatímco při manifestní hypotyreóze byly zaznamenány spíše hypokoagulační abnormality. Dostupnými laboratorními metodami však nemusí být příčina poruchy hemostázy při poruše funkce štítné žlázy jednoznačně objasněna (16–20). Do komplexní mozaiky informací by mohla přispět i zobrazovací vyšetření štítné žlázy, jež však nebyla v daném případě provedena.
V prezentovaném případě byl cíleně vyloučen kvantitativní deficit koagulačního faktoru VIII (vyloučena získaná hemofilie A), kvantitativní deficit von Willebrandova faktoru (vyloučen von Willebrandův syndrom), kvantitativní deficit koagulačního faktoru XIII nezbytného pro adekvátní pevnost vznikajícího koagula, a navíc nebyly laboratorní známky aktivované fibrinolýzy ani porušené funkce trombocytů. Hypofibrinogenemie mírného stupně v době rozvoje plošných podkožních hematomů byla v tomto případě s největší pravděpodobností konzumpční s rychlou úpravou do fyziologických mezí během následujících šesti dnů – zaznamenaná minimální fibrinogenemie byla jen mírně pod dolní referenční mezí, čili hemostaticky ještě s rezervou suficientní. Normální trombinový čas a normální koncentrace antigenu fibrinogenu současně svědčily proti případné dysfibrinogenémii. Při zevrubném studování případu se nabízí časová koincidence spontánního vzniku rozsáhlých sufuzí a nápadného poměrně prudkého zvratu z původní subklinické hypertyreózy do těžké hypotyreózy v klinicky predisponovaném terénu malnutrice a atrofického podkoží. Pro tuto hypotézu per exclusionem navíc nepřímo svědčí i absence jakýchkoli dalších krvácivých projevů během následujícího 6měsíčního sledování a podávání pembrolizumabu, kdy došlo k pozvolnému poklesu koncentrace tyreostimulačního hormonu na polovinu. Nutno zdůraznit, že první podrobnější hemostazeologické vyšetření proběhlo až čtyři dny po rozvoji krvácivých projevů, čímž je limitováno posuzování vývoje jednotlivých parametrů v čase. Nicméně krvácivé projevy vedly k oddálení podání dalšího cyklu pembrolizumabu, a proto je třeba tyto klinické komplikace hodnotit jako závažné, i když přímý vztah k léčivu je méně pravděpodobný.
Závěr
Prezentovaný případ dokládá nutnost komplexní diferenciální diagnostiky a cílené vylučování jednotlivých možností při komplikacích nově dostupných léčebných modalit. Krvácivé projevy u hypotyreózy jsou v literatuře popisovány spíše obecně či kazuisticky, jednoznačné potvrzení kauzální souvislosti mezi nimi však nemusí být vždy možné, a proto bude jejich řešení vždy mezioborové. Přesto lze doporučit preventivní podrobnější hemostazeologický screening v případě záchytu výrazné oscilace koncentrací hormonů štítné žlázy u pacientů léčených ICI, současně dbát na adekvátní nutriční podporu a na šetrné zacházení s léčivy indukujícími trombocytopatii (např. nesteroidní antiflogistika a metamizol). V daném případě byla vzhledem k charakteru krvácivých projevů cíleně vyloučena především získaná hemofilie (mohla by představovat bezprostřední ohrožení na životě), trombocytopatie a porucha na úrovni fibrinolytického systému. Pacienti léčení ICI by měli být poučeni o nutnosti časné konzultace lékaře při rozvoji krvácivých projevů.
Podpořeno MZ ČR – RVO (FNBr, 65269705)
KORESPONDENČNÍ ADRESA AUTORA:
MUDr. Pavel Polák, Ph.D.
Oddělení klinické hematologie, Fakultní nemocnice Brno
Jihlavská 20, 625 00 Brno
Článek přijat redakcí: 16. 12. 2020
Článek přijat po recenzích: 31. 3. 2021
Sources
1. Si X, Song P, Ni J et al. Management of immune checkpoint inhibitor-related adverse events: a review of case reports. Thoracic Cancer 2020; 11 : 498–504.
2. Presotto EM, Rastrelli G, Desideri I et al. Endocrine toxicity in cancer patients treated with nivolumab or pembrolizumab: results of a large multicentre study. J Endocrinol Invest 2020; 43 (3): 337–345.
3. Girotra M, Hansen A, Farooki A et al. The current understanding of the endocrine effects from immune checkpoint inhibitors and recommendations for management. JNCI Cancer Spectrum 2018; 2(3): 1–9.
4. Olsson-Brown A, Lord R, Sacco J, et al. Two distinct clinical patterns of checkpoint inhibitor - induced thyroid dysfunction. Endocrine Connections 2020; 9 : 318–325.
5. Delivanis DA, Gustafson MP, Bornschlegl S et al. Pembrolizumab-induced thyroiditis: comprehensive clinical review and insights into underlying involved mechanisms. J Clin Endocrinol Metab 2017; 102(8): 2770–2780.
6. Williams H, Aitchison R. Pembrolizumab-induced autoimmune haemolytic anaemia and cholangitis. BMJ Case Rep 2019; 12(12): pii:e232505.
7. Johnstone P, Khan O. Pembrolizumab-associated autoimmune haemolytic anaemia. BMJ Case Rep 2019; 12(10): pii:e229064.
8. Berger M, Amini-Adlé M, Crumbach L et al. A case of immune thrombocytopenia induced by pembrolizumab in a metastatic melanoma patient with a history of immune - -mediated pure red cell aplasia. Eur J Cancer 2019; 112 : 94–97.
9. Le Roy A, Kempf E, Ackermann F et al. Two cases of immune thrombocytopenia associated with pembrolizumab. Eur J Cancer 2016; 54 : 172–174.
10. Isoda A, Miyyazawa Y, Tahara K et al. Pembrolizumab-induced pure red cell aplasia successfully treated with intravenous immunoglobulin. Intern Med 2020; 59(16): 2041–2045. doi: 10.2169/internalmedicine .4467–4520.
11. Kunimasa K, Nishino K, Kimura M et al. Pembrolizumab-induced acute thrombosis. Medicine (Baltimore) 2018; 97(20): e10772.
12. Huang AC, Postow MA, Orlowki RJ et al. T-cell invigoration to tumour burden ratio associated with anti-PD-1 response. Nature 2017; 545 : 60–65.
13. Sanchez A, Montaudie H, Bory P et al. Antiphospholipid syndrome following pembrolizumab treatment of stage IIIB unresectable melanoma. JAMA Dermatol. 2018; 154(11): 1354–1356. doi:10.1001/jamadermatol.2018.2770.
14. Rao BB, Robertson S, Philpott J. Checkpoint inibitor-induced hemorrhagic gastritis with pembrolizumab. Am J Gastroenterol 2019; 114 (2): 196. doi:10.1038/s41395-018-0366-3.
15. Sugano T, Seike M, Noro R et al. A case of interstitial lung disease with alveolar hemorhage induced by pembrolizumab. Onco Targets Ther 2018; 17(11): 5879–5883.
16. Artal-Cortés A, Felices-Lobera P, Márquez-Medina D. Massive hemoptysis after the first administration of pembrolizumab in a strongly positive, centrally located NSCLC. J Thorac Oncol 2018; 13(5): e76–e77.
17. Elbers LPB, Fliers E, Cannegieter SC. The influence of thyroid function on the coagulation system and its clinical consequences. J Thromb Haemost 2018; 16(4): 634–645.
18. Franchini M, Montagnana M, Manzato F et al. Thyroid dysfunction and hemostasis: an issue still unresolved. Semin Thromb Hemost 2009; 35(3): 288–294.
19. Soni S, Singh G, Yasir S et al. An unusual presentation of hypohyroidism. Thyroid 2005; 15(3): 289–291.
20. Federici AB. Acquired von Willebrand syndrome associated with hypothyroidism: a mild bleeding disorder to be further investigated. Semin Thromb Hemost 2011; 37(1): 35–40.
21. Kyriakakis N, Lynch J, Ajjan R et al. The effects of pituitary and thyroid disorders on haemostasis: potential clinical implications. Clinical Endocrinology 2016; 84 : 473–484.
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Internal Medicine

2021 Issue 3
-
All articles in this issue
- Nezapomínáme na možnost biologické terapie hypercholesterolemie pomocí PCSK9-inhibitorů?
- Co nového přináší aktualizace CEAP klasifikace chronického žilního onemocnění z roku 2020?
- Možnosti léčby myelodysplastického syndromu v roce 2021
- Léčba tří pacientů s Erdheimovou-Chesterovou chorobou kladribinem, případně kombinací kladribinu a cyklofosfamidu a přehled léčby této nemoci
- Rivaroxaban v léčbě a prevenci recidivy žilního tromboembolismu u dětí
- Postavení moxonidinu v léčbě hypertenze
- Podkožní krvácení při hypotyreóze indukované pembrolizumabem
- Vericiguat u nemocných se srdečním selháním a sníženou ejekčí frakcí – studie VICTORIA
- Komentáře k analýze složení směsi flavonoidů v tabletách Diozen 500 mg metodou UHPLC
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue
- Co nového přináší aktualizace CEAP klasifikace chronického žilního onemocnění z roku 2020?
- Vericiguat u nemocných se srdečním selháním a sníženou ejekčí frakcí – studie VICTORIA
- Postavení moxonidinu v léčbě hypertenze
- Možnosti léčby myelodysplastického syndromu v roce 2021
