Léčba tří pacientů s Erdheimovou-Chesterovou chorobou kladribinem, případně kombinací kladribinu a cyklofosfamidu a přehled léčby této nemoci
Therapy of 3 patients with Erdhiem-Chester disease with cladribin or cladribin in combination with cyclophosphamide. Case report and review of the therapy
Three adult patients with confirmed Erdheim-Chester disease (ECD) are followed at our department. Cladribine in monotherapy or in combination with cyclophosphamide were used for first line therapy. The median number of cycles of cladribine or cladribine and cyclophosphamide was 7 (range 6–8). In two cases complete response was achieved, in one case this therapy achieved no response. The duration of response is in one case 11 years, in second case the follow up is too short for evaluation of response duration. In case of no-response to cladribine and cyclophosphamide stabilisation of disease was achieved with anakinra. The tolerance was good without any toxicity grade II and higher. Cladribin and cyclophosphamide is one option for treatment of Erdheim-Chester disease.
Keywords:
Erdheim-Chester disease – kladribin – anakinra
Authors:
Zdeněk Král 1; Zdeněk Řehák 2; Marta Krejčí 1; Renata Koukalová 2; Sabina Ševčíková 3; Luděk Pour 1; Martin Krejčí 1; Martin Štork 1; Viera Sandecká 1; Zdeněk Adam 1
Authors‘ workplace:
Interní hematologická a onkologická klinika, LF MU a FN Brno
1; Oddělení nukleární medicíny, Masarykův onkologický ústav Brno
2; Ústav patologické fyziologie, LF MU a FN Brno
3
Published in:
Vnitř Lék 2021; 67(3): 157-164
Category:
Review Articles
Overview
V letech 2008–2020 jsme léčili celkem 3 pacienty s Erdheimovou-Chesterovou chorobou (ECD) kombinací kladribinu a cyklofosfamidu anebo kladribinem v monoterapii. Medián počtu podaných cyklů byl 7 (rozmezí 6–8). Efekt léčby byl hodnocen pomocí FDG-PET/CT zobrazení a klinických příznaků. Ve dvou případech vedla tato léčba k remisi. V jednom případě nebylo léčebné odpovědi kladribinem a cyklofosfamidem dosaženo. Léčebná odpověď na uvedenou léčbu trvá v jednom případě 11 let, ve druhém případě nelze délku léčebné odpovědi hodnotit pro krátký čas od ukončení léčby. V jednom případě, kdy se efekt kladribinu a cyklofosfamidu nedostavil, se podařilo nemocného již roky stabilizovat podáváním kineretu. Léčba byla dobře tolerována bez jakékoliv toxicity stupně II a vyšší. Naše zkušenosti potvrzují účinnost kladribinu a cyklofosfamidu u této choroby.
Klíčová slova:
Erdheimova-Chesterova choroba – kladribin – anakinra
Úvod
Erdheimova-Chesterova choroba (Erdheim-Chester disease – ECD) je systémová nemoc, jejímž morfologickým podkladem je ložiskové nahromadění histiocytů, které střádají lipidy, a proto má jejich cytoplazma v mikroskopu bledý či pěnitý vzhled. Pěnité histiocyty však nejsou výlučným znakem ECD. Nalézáme je i u jiných histiocytárních chorob, zejména těch kožních ze skupiny juvenilního xantogranulomu. Pěnité buňky se objevují také jako reakce na poškození vaziva (nekrobiotický xantogranulom u paraproteinemie), při dyslipidemiích, v okolí chronického hnisavého zánětu (tzv. prozánětlivý pseudoxantom) a v ně - kterých vleklých infekčních ložiscích. Tyto pěnité histiocyty však mohou nabývat různých vlastností a způsobovat odlišné klinické příznaky, a proto existuje více jednotek, které se řadí do skupiny nemocí skupiny juvenilního xantogranulomu. Erdheimova-Chesterova choroba je nejzávažnější z nich. Za méně závažný pak lze považovat nekrobiotický xantogranulom či xantoma planum, případně juvenilní xantogranulom. Podkladem nemoci je sice klonální proliferace pěnitých histiocytárních buněk (foamy cells), ale četné klinické projevy jsou způsobeny mediátory zánětu, které tyto patologické buňky ve zvýšené míře uvolňují. Tyto mediátory zánětu stimulují další proliferaci a akumulaci patologických buněk, neboli stimulují progresi nemoci.
Proto Julien Haroche píše, že „ECD je typ nemoci, u níž za zánětem je ukryta neoplazie“ (1).
Léčebného efektu zde proto dosahují jak zásahy cílené na tlumení imunitní odpovědi, tak léky působící cytostaticky. A protože v současné době byly popsány některé mutace v regulačních mechanismech, je u těchto pacientů efektivní léčba těmito cílenými preparáty. Kvůli vzácnosti nemoci nebyly léčebné alternativy porovnávány v rámci srovnávacích klinických studií, ale obraz o této nemoci si tvoříme z popisu jednotlivých pacientů či menších sérií pacientů (2).
Soubor pacientů
Na Interní hematologické a onkologické klinice jsme v letech 2008–2020 léčili 3 pacienty s ECD. Jednalo se o 2 muže ve věku 44 a 56 let a jednu ženu ve věku 49 let. Oba dva muži měli několik let před stanovením této diagnózy diagnostikovaný diabetes insipidus a měli i snížené hodnoty dalších hormonů produkovaných hypofýzou. Poslední pacientka neměla diagnostikovanou žádnou endokrinologickou poruchu. Všichni tři pacienti měli různě intenzivně vyjádřené systémové zánětlivé projevy – kolísavé horečky, první pacient jen na hranici subfebrilie a febrilie, druhý pacient měl kolísavé horečky se špičkami až 39 °C, třetí pacientka měla jen subfebrilie nepřesahující 38 °C. Vybrané vstupní laboratorní ukazatele všech těchto tří pacientů přináší tabulka 1.
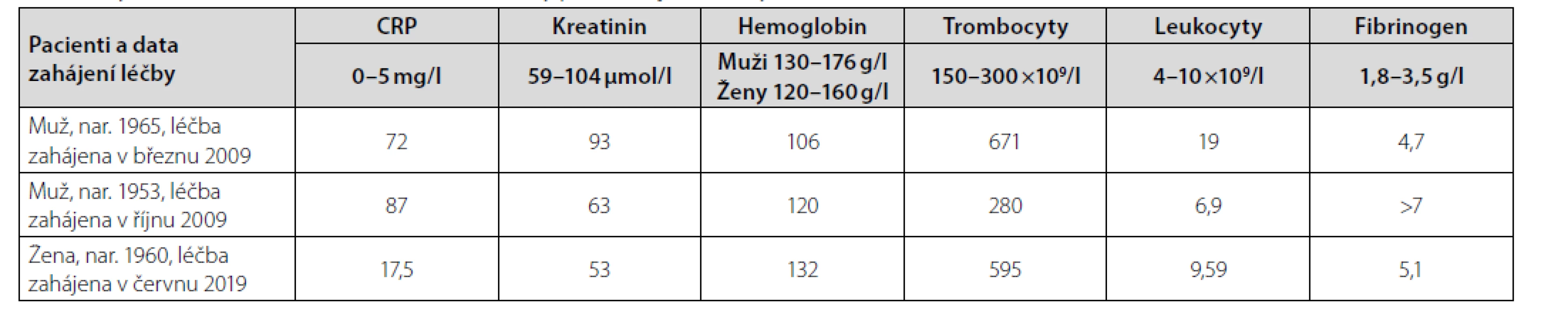
První pacient, u něhož jsme tuto nemoc diagnostikovali, byl narozen v roce 1965, diabetes insipidus byl u něj rozpoznán v roce 2004 (39 let věku). V roce 2008 se u něj objevila porucha hybnosti a řeči a na provedeném MR mozku bylo zjištěno několik ložisek v CNS. Stěžoval si také na velkou únavu (fatigue) a subferbilie. Diagnóza ECD byla překvapivě zjištěna z necílené trepanobiopsie lopaty kosti kyčelní. V březnu roku 2009 byla zahájena léčba kladribinem (Litak) 5 mg/m2 ve formě podkožních injekcí 5 dní po sobě. Ve formě monoterapie byl kladribin podáván po tři cykly a následně jsme podávali další tři cykly kladribinu vždy s infuzí cyklofosfamidu 300 mg také 5 dní po sobě, poslední cyklus byl zahájen 30. 7. 2010. Celkem dostal tento pacient 6 cyklů kladribinu.
Efekt léčby by posuzován dle změn na FDG-PET/CT vyšetření, které bylo provedeno před zahájením léčby, po jejím ukončení, a pak byl touto metodou sledován. Po ukončení léčby nedošlo k vymizení ložisek patologické akumulace FDG, takže v tomto prvním případě byla léčba kladribinem neúčinná, jak dokumentuje Obr 1. Následovala pak léčba anakinrou, při níž odezněly zánětlivé symptomy (subfebrilie i fatigue) a při CT hodnocení došlo k mírnému zmenšení retroperitoneální fibrózy při léčně anakinrou. V pozdějších letech byl pokud o odebrání další tkáně na analýzu mutace genu BRAF V600E, ale nepodařilo se získat dostatek materiálu pro analýzu.
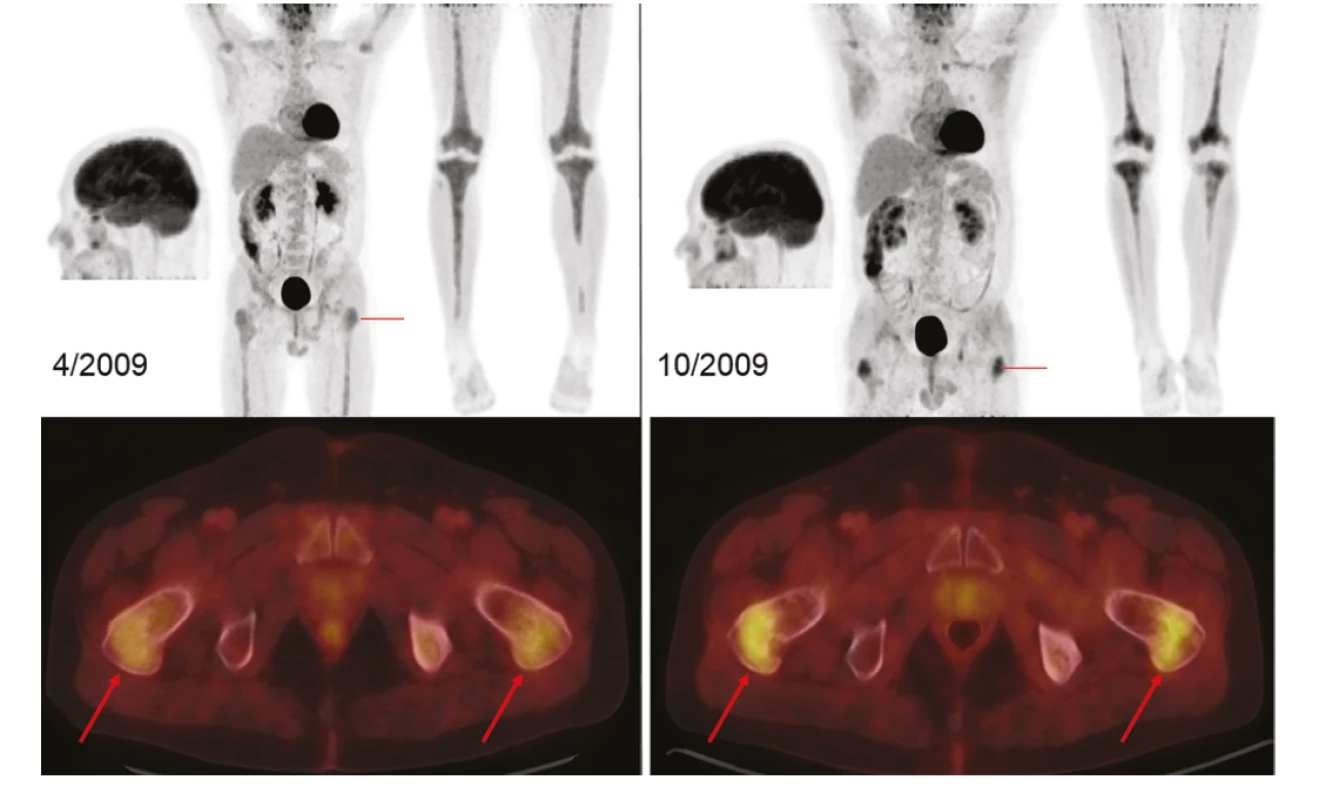
Druhý pacient, narozený v roce 1953, byl taktéž před tím, než se dostal na naše pracoviště, sledován od roku 2005 pro diabetes insipidus a celkový hypopituarismus. Na naši ambulanci se dostavil v červnu 2009. Důvodem byly dlouhodobé kolísavé horečky a stěhovavé bolesti v dolních končetinách. V laboratorním vyšetření byla vysoká hodnota CRP. Na FDG-PET/CT vyšetření, provedeném v srpnu 2008, byla vysoká akumulace radiofarmaka ve skeletu a ve femurech proximálně i distálně, ve střední části femuru nebyla zvýšená akumulace FDG. Zvýšená akumulace FDG byla dále v oblasti tibií a fokálně v obou humerech. U tohoto pacienta necílená trepanobiopsie z pánve nebyla úspěšná a ortoped odebral cíleně vzorek kostní tkáně z místa s vysokou akumulací FDG ve stehenní kosti pro histologické vyšetření, které pak stanovilo diagnózu. Léčba kladribinem byla zahájena v říjnu 2009. Kladribin byl podáván 5 mg/m2 podkožně 5 dní po sobě a k tomu cyklofosfamid 300 mg v infuzi také 5 dní po sobě. Pouze v šestém cyklu byla provedena redukce dávky a kladribin a cyklofosfamid podáván jen 3 dny po sobě. Poslední sedmý cyklus byl podán 12. 6. 2010. Kontrolní FDG-PET/CT po ukončení léčby prokázalo kompletní vymizení zvýšené akumulace FDG v ložiscích, jak dokumentuje Obr 2. Při FDG-PET/CT kontrolách byla v roce 2017 objevena mírná akumulace FDG v Th11 (SUVmax 4,2) bez CT korelátu, která až do roku 2020 zůstala stabilně zvýšená, SUVmax 4,12, po celou dobu bez CT korelátu. Poslední FDG-PET/CT bylo 23. ledna roku 2020, akumulace FDG zůstává v Th 11 beze změny a bez korelátu CT obrazu a bez jakýchkoliv klinických potíží. U tohoto pacienta trvá remise nemoci po léčbě kladribinem v kombinaci s cyklofosfamidem již více než 11 let.
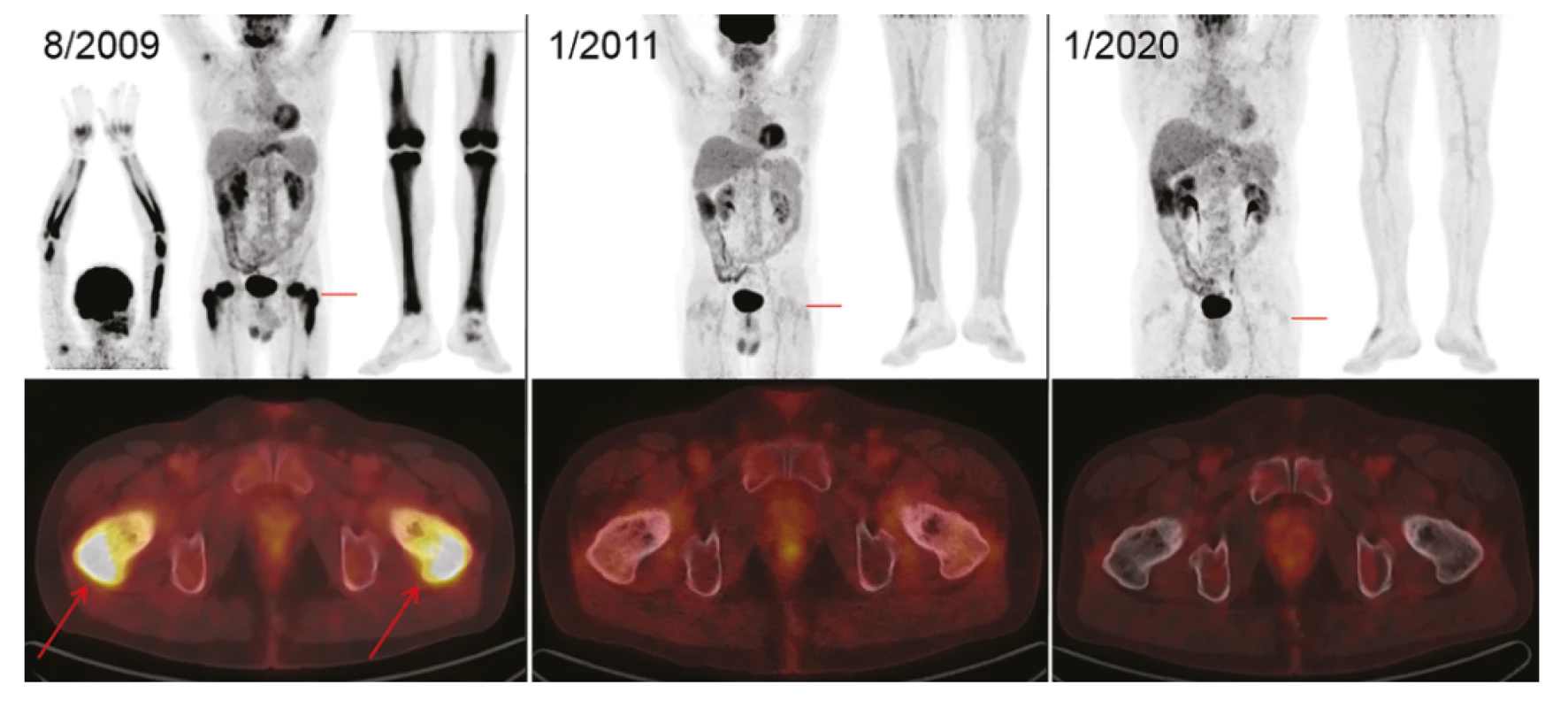
Třetí pacientku přivedly bolesti v oblasti kolenou k ortopedům. Ti našli patologickou strukturu skeletu, provedli biopsii a prokázali Erdheimovu-Chesterovu chorobu. V tomto případě byla již vyšetřena mutace BRAF V600E a byla negativní. Z klinických příznaků byly přítomny subfebrilie a noční pocení. Léčba byla zahájena v červnu 2009. Pacientka dostala kladribin v monoterapii celkem 6 cyklů, a protože dle FDG-PET/ CT nebyla odpověď kompletní, dostala ještě dva cykly v kombinaci s cyklofosfamidem. Poslední cyklus této léčby byl podán v říjnu 2020. Na prvním FDG-PET/CT před léčbou byla zobrazeno mnoho patologických akumulací, v maxile, v retroperitoneu okolo aorty, v infiltrátu podél vnitřních ilických cév, v distální části obou femurů a v proximální části a distální části obou tibií. Další zobrazení, provedené po ukončení léčby koncem října 2020, popisuje regresi akumulace FDG ve všech oblastech s dříve patologicky zvýšenou akumulací.
Diskuze
Erdheimova-Chesterova nemoc je velmi vzácné onemocnění – pro něž nebyla publikována léčebná doporučení založená na analýze klinických studií. Informace o léčbě této nemoci lze získat pouze z popisu jednotlivých pacientů či malých souborů nemocných, léčených některým ze způsobů, který má potenciál působit na patologické buňky, které jsou podkladem této nemoci. Postupem času se objevovaly nové a nové léky, které byly postupně u této nemoci testovány, čímž postupně přibývá informací o léčbě této nemoci a přibývá léků, které pacientům mohou pomoci. Následující text sumarizuje ve stručném přehledu publikované, ale i naše zkušenosti s léčbou ECD s cílem pomoci lékařům, kteří stojí před otázkou: „Jak léčit pacienta s touto nemocí?“
Cytotoxická chemoterapie a kortikoidy
Před poznáním účinku interferonu alfa a posléze anakinry byly testovány různé chemoterapeutické režimy, včetně vinka alkaloidů, antracyklinů a cyklofosfamidu. Byly sice popsány určité úspěchy, ale přesto se léčba alkylačními cytostatiky a antracykliny neukázala zásadně přínosnou a není dnes doporučována (3–7). Vysokodávkovaná chemoterapie byla testována, ale také se nestala průlomovou terapií (8, 9). Kortikosteroidy mohou zmenšit edém třeba při závažném exoftalmu, ale nejsou účinnou monoterapií.
Velký problémem je ovlivnění infiltrátů v CNS. Obecně se soudilo, že cytostatická léčba zde není zásadním přínosem. Ale v posledních letech se objevily publikace čínských autorů, kteří popisují zlepšení po cytosin-arabinosidu. Podávali 500 mg/m2 infuze ve 12hodinových intervalech 3 dny po sobě (10, 11). Účinnost této léčby nebyla potvrzena dalšími autory. Pro případy Langerhansovy histiocytózy je však léčba středně vysokými dávkami cytosin-arabinosidu akceptovaný léčebný postup. Bylo by přínosné ověřit defektivu této léčby i v Evropě.
Radioterapie a chirurgie
Radioterapie byla také často používána. Při použití u pacientů s CNS postižením bylo dosaženo jen krátkodobé paliace a nemoc po pár měsících dále progredovala (12).
Častěji byla radioterapie použita u xantogranulomových onemocnění lokalizovaných v orbitě či na víčkách. Zde je o použití radioterapie poměrně dosti literatury. Od radioterapie se očekávala inhibice proliferace histiocytů. Ale léčebná odpověď se liší případ od případu a většinou je dosahováno pouze dočasné stabilizace (13). Často byla radioterapie používána pro xantogranulomová ložiska lokalizovaná v okolí očního bulbu. Není žádný konsenzus na tom, kolik Gy je správná dávka. V citovaných publikacích je nejčastěji použitá dávka 10–35 Gy na ložiska xantogranulomu. Někdy je preferováno ozáření svazkem elektronů, protože jejich průnik je omezen do kůže a podkoží a neohrožuje tak oční bulbus a jeho nerv. Tato léčba ale mívá jen parciální efekt, zmenšení, nikoliv vymizení (14). Publikované informace lze zřejmě shrnout do konstatování, že radioterapie na xantogranulomové infiltráty v CNS má jen minimální, v jiných lokalizacích má jen parciální a dočasný efekt, takže není léčbou volby, ale lze ji použít. A s výhodou lze použít ozáření svazkem elektronů (15–19). Chirurgie má své místo pouze ve zmenšení patologických hmot při orbitálním postižení a dále pro léčbu intrakraniálního postižení.
Kladribin
Kladribin (2-chlorodeoxyadenosin) je toxický nejen pro klidové lymfocyty, ale také pro buňky odvozené od monocytů, tedy také pro Langerhansovy buňky a fagocytující histiocytární buňky, mezi něž patří buňky Erdheimovy-Chesterovy nemoci (20). Kladribin je považován za lék volby nejen pro histiocytózu z Langerhansových buněk, ale i pro Rosai-Dorfmanovu nemoc, která se někdy překrývá se znaky ECD (21). Účinnost kladribinu u ECD byla potvrzena vícero publikacemi (22–29), a proto účinek kladribinu u ECD lze považovat za dostatečně ověřený. Největší popsaný soubor obsahuje 21 pacientů s ECD, kteří byli léčeni kladribinem. U 9 pacientů byl použit jako lék první linie a u 12 pacientů byl použit až jako lék další linie. Medián podaných cyklů byl 2,5 (1–6). Léčebné odpovědi bylo dosaženo v 52 %, z toho v 6 % šlo o kompletní léčebnou odpověď. U 18 % z nich byla nemoc hodnocena jako stabilní a 30 % nemocných na léčbě progredovalo. Medián délky léčebné odpovědi byl 9 měsíců (6–129 měsíců) (30).
Naše zkušenost s léčbou tří pacientů odpovídá publikovaným zkušenostem, u dvou ze tří pacientů bylo dosaženo výborné léčebné odpovědi dle PET/CT hodnocení, v jednom případě (druhý pacient ze souboru) je dlouhodobá (10 let) a u třetí pacientky z našeho souboru zatím lze pouze říci, že léčebná odpověď byla dosažena, ale zatím nelze hodnotit délku léčebné odpovědi.
Interferon-alfa
Zpráva o účinnosti interferonu alfa se poprvé objevila v roce 2001 (31) a další 2005 (32). A po zveřejnění těchto popisů prvních úspěšně léčených pacientů se začaly v literatuře objevovat další podobné zprávy (33–35).
Největší soubor nemocných s ECD léčených interferonem alfa obsahoval 53 nemocných. Autoři této studie popisují delší přežití než při použití jiných, do roku 2011 dostupných léčebných postupů (36).
Optimální dávka interferonu nebyla testována, ale převážně byla použita dávka 3 mil. jednotek 3× týdně. Pouze autoři jedné studie tvrdili, že v 8 případech neúčinnosti 3 mil. jednotek 3x týdně pomohlo navýšení dávky na 9 mil. jednotek 3x týdně. V současnosti již ale klasický interferon alfa není dostupný, místo něj lze použít pegylovaný interferon alfa v dávce 135 případně 185 mikrogramů 1x týdně (37–40).
V současnosti již interferon alfa není tak často používán, jak tomu bylo na přelomu tisíciletí, kdy byl součástí léčby četných chorob (mnohočetný myelom, chronická myeloidní leukemie), u nichž se již dnes nepoužívá. Účinnost u ECD je jistě dostatečně prokázána. Ale víme, že léčba interferonem alfa u četných lidí vyvolává závažné nežádoucí účinky, a u mnohých pacientů byly tyto nežádoucí účinky důvodem k ukončení léčby. V případě ECD se však tento lék považuje dodnes za indikovaný. Jeho dostupnost je však omezená.
Anakinra – antagonista receptoru Il-1
Jeden z důležitých účinků interferonu alfa je stimulace tvorby antagonisty receptoru pro interleukin-1, a tedy potlačení účinku interleukinu - 1. Proto Aouba testoval léčbu pomocí rekombinantního antagonisty receptoru interleukinu-1 jménem anakinra. Léčil anakinrou dva pacienty a pozoroval vymizení teploty a dalších B-symptomů a také vymizení bolestí kostí a vymizení xantelesmat na víčku. Aouba popsal parciální regresi retroperitoneální fibrózy. Laboratorními důsledky léčby bylo snížení hladiny CRP a IL-6 (41).
V roce 2010 to byla první publikace popisující efekt této léčby a následovaly další. Redukce nádorové populace a snížení hladin proinflamatorních cytokinů bylo pozorováno u pacientů léčených anakinrou v dávce 1–2 mg/kg/den. Léčba byla velmi dobře tolerována a byla účinná ve stejném rozsahu, jak popsal Aouba. Vymizely bolesti kostí a B-symptomy. Bylo popsáno také zlepšení kardiální formy ECD. Zlepšení mozkového postižení však v průběhu léčby anakinrou zaznamenáno nebylo (42–49).
Anakinra dosahuje léčebné odpovědi asi u 50 % léčených (50).
V jedné publikaci však dávku anakinry zdvojnásobili a uvádějí vyšší počet léčebných odpovědí (51). Z citované literatury je zřejmé, že anakinra je ze skupiny anti-cytokinové léčby nejúčinnější a nejčastěji používanou léčbou. Počet léčebných odpovědí se pohybuje od 22–55 %. Při vysazení však hrozí obnovení aktivity nemoci. Dle současných znalostí se domníváme, že lze jednoznačně upřednostnit anakinru před interferonem alfa u pacientů bez postižení CNS, protože anakinra je podstatně lépe tolerována. Nicméně přínos anakinry není v cytotoxickém působení na maligní histiocytární buňky, ale v blokádě důsledků nadměrné aktivity interleukinu-1. Proto při analýze relativně velkého souboru 12 pacientů s ECD s mediánem aplikace 22 měsíců bylo konstatováno, že pozitivní účinek léčby anakinrou se projevuje dominantně zmírněním či odstraněním symptomů nemoci, které jsou způsobeny zřejmě interleukinem-1, zatímco vliv anakinry na maligní infiltraci je velmi variabilní, ale obvykle nedochází vlivem léčby k vymizení aktivity ložisek při FDGPET/ CT zobrazení. Proto Cohen (2016) doporučil v případě infiltrace srdce či CNS zahájit léčbu interferonem alfa nebo BRAF inhibitory (49). Na našem pracovišti tuto léčbu podáváme prvnímu pacientovi z popsaného souboru již léta a viděli jsme, že v průběhu léčby anakinrou ustupovaly fibrotické změny, vymizely B-symptomy ale dle opakovaných FDG-PET/CT kontrol zůstávaly osteosklerotické změny skeletu, hlavně v dolních končetinách, ale v průběhu pětileté léčby se i signifikantně snížila míra akumulace FDG. Anakinra tedy inhibuje projevy nemoci, které jsou způsobené nadprodukcí prozánětlivých cytokinů, a v našem případě vedla také ke snížení akumulace FDG v patologických ložiscích.
Anti-TNF protilátky
Celkem 4 pacienti s kardiální formou ECD byli léčeni infliximabem, anti-TNF protilátkou a byl popsán pozitivní efekt (52, 53). V malé sérii pacientů byly hodnoceny protilátky proti TNF-alfa: infliximab i etanercept a pak anakinra. Autoři konstatovali, že z těchto tří léků pouze léčba anakinrou vedla k léčebné odpovědi při lokalizaci nemoci v kostech, srdci a v plicích. U pacientů dostávajících infliximab nebo etanercept nebyla pozorována léčebná odpověď. Autoři uvádějí, že anakinru je možno považovat za léčbu volby u pacientů, kteří nejsou kandidáty pro cílenou léčbu nebo chemoterapii kladribinem nebo interferonem alfa, a hlavně pro ty, u nichž ECD nepostihuje CNS (54). Jejich konstatování je v protikladu s tím, co uvádí Cohen, který popsal efekt léčby anti-TNF monoklonální protilátkou (55). O další monoklonální anti-TNF protilátce, adalimumabu, píší další autoři. Použili adalimumab a metylprednisolon a popisují zlepšení (56).
Imatinib
Imatinib mesylát byl použit s úspěchem u jiných histiocytóz a byl testován i u ECD. První publikace na toto téma popsala příznivý účinek imatinibu, ale pozitivní účinek nebyl potvrzen v dalších publikacích. Proto se domníváme, že imatinib lze otestovat v léčbě další linie, pokud předchozí léčba selže (57–59) a pokud je imatinib dostupný.
BRAF a MEK cílené terapie
Mutace BRAF-V600E byla poprvé rozpoznána u melanomu a byla vyvinuta léčba, která na tuto mutaci cílí. Na melanom, který je známý svojí chemorezistencí, byl tak poprvé nalezen účinný lék, vemurafenib. V roce 2012 byla poprvé popsána přítomnost mutace genu BRAFV600E u histiocytózy z Langerhansových buněk a následně u Erdheimovy-Chesterovy nemoci (60). O rok později, 2013 se objevila první zpráva o účinné léčbě pacientů s ECD vemurafenibem (61), o dva roky později pak další (62). Po několika letech byly však u ECD rozpoznány další mutace, hlavně mutace MAPK signální cesty (MAP2K1, KRAS a NRAS) (63, 64). Proto byly současně testovány léky ze skupiny MEK inhibitorů (například trametinib a cobimetinib). Účinnost této kombinované cílené léčby potvrdily četné popisy případů či malých sérií pacientů. Celková léčebná odpověď kolísá od 43 % do 100 % (65–71).
V současnosti jsou však jen dvě studie s větším počtem pacientů. První byla studie VE Basket Trial, obsahující kohortu 22 pacientů s ECD a s prokázanou mutací BRAFV600E, kteří dostávali Vemurafenib 960 mg 2x denně. V této skupině bylo dosaženo 54 % léčebných odpovědí, zatím kompletní jen u 4,5 %. Medián sledování byl krátký, jen 26 měsíců, a proto nebylo dosaženo mediánu trvání léčebné odpovědi. Tato studie byla podkladem pro schválení tohoto léku pro pacienty s ECD s uvedenou mutací agenturou FDA v roce 2017 (72, 73).
Největší studií je LOVE STUDY, do níž bylo zařazeno celkem 54 pacientů. U dvaceti pacientů v remisi ECD, dosažené těmito léky, byla léčba přerušena. U 75 % z nich došlo k relapsu v mediánu 6 měsíců a u 10 z nich bylo nutno obnovit léčbu (74). Uvedená cílená léčba má jednoznačně největší počet léčebných odpovědí v případě ložisek v CNS, přesahující 50 % kompletních remisí. A jak již bylo v předchozím textu řečeno, postižení CNS je špatně ovlivnitelné jak interferonem alfa, tak také anakinrou (75).
Ačkoliv v literatuře je hodně publikací prokazujících účinnost vemurafenibu při léčbě BRAFV600E-pozitivní ECD, začínají se objevovat publikaci o dalším BRAF inhibitoru, dabrafenibu. Zkušenosti u pacientů s melanomem potvrdily větší léčebný efekt bez zvýšené toxicity a lepší pronikání dabrafenibu do CNS ve srovnání s vemurafenibem (76). Ačkoliv v literatuře je hodně publikací prokazujících účinnost vemurafenibu při léčbě BRAFV600E-pozitivní ECD, začínají se objevovat práce preferující dabrafenib v této indikaci (77).
Nejčastější nežádoucí účinky této léčby jsou kožní komplikace typu fotosenzitivity, keratosis pilaris, spinocelulární karcinom, kožní raš s eozinofilií a systémovými symptomy (DRESS).
Při použití MEK inhibitorů je často pozorováno akné (53 %), nevolnost (27 %) a/nebo rabdomyolýza (27 %) (74).
Autoři z Kalifornie použili BRAF a MEK inhibitory k léčbě 10 pacientů s ECD. MEK inhibitor trametinib podali 5 pacientům, vemurafenib podali 4 pacientům, dabrafenib 2 pacientům a cobimetinib 2 pacientům. Jeden pacient dostal kombinaci vemurafenib a trametinib a jeden dabrafenib a cobimetinib. Zjistili, že u pacientů s ECD mají tyto léky velmi četné nežádoucí účinky, takže byly nutné redukce a medián podávané dávky se pohyboval na 25 % z dávky doporučené. Nejčastějším nežádoucím účinkem byl kožní raš a bolesti kloubů. U dvou pacientů se vyvinula uveitida s nutností ukončit léčbu, u dalších se rozvinula renální insuficience, kardiální selhání a hypertenze. Autoři proto doporučují v případě ECD léčbu zahajovat nižšími dávkami, než jsou doporučované pro jiné diagnózy, a spekulují o navozených změnách farmakokinetiky touto nemocí, které zvyšují toxicitu léčby (78).
V případě, že se na BRAF a MEK inhibitorech rozvinula intenzivní zánětlivá reakce, byla s úspěchem použita anakinra (79).
Z pohledu roku 2020 se jeví, že BRAF a MEK inhibitory nemají potenciál navodit kompletní a dlouhotrvající remisi. Julien Haroche proto v roce 2019 považoval BRAF a MEK inhibitory za léčbu druhé linie po selhání linie první (anakinra či interferon alfa či kladribin), nebo při intoleranci těchto léků. Pouze u život ohrožujících případů ECD při závažném poškození CNS považuje za vhodné podat v první linii BRAF a MEK inhibitory (2, 80), samozřejmě jen v případech prokázané mutace signální cesty BRAFV600E.
Sledování a délka léčby
Základní informaci o aktivitě nemoci přináší FDG-PET/CT vyšetření, proto se zpočátku doporučuje jeho provádění v 3–6měsíčních intervalech, chceme-li znát léčebnou odpověď a dle ní buď pokračovat, či změnit léčebný postup. Na našem pracovišti se tohoto doporučení držíme. Toto základní vyšetření se pak doplňuje zobrazením cíleným na nejvíce postižené orgány, ložiska v myokardu odhalí speciální MR vyšetření myokardu. FDG-PET/CT zobrazovací vyšetření je zcela zásadní, protože nemoc nemá žádný laboratorní marker aktivity, vyjma zvýšené hodnoty CRP, která se při úspěšné léčbě normalizuje. Vývoj fibrózy v oblasti retroperitonea a velkých cév dokumentuje klasické CT zobrazení (81–83). V námi popsaných třech případech bylo FDG-PET/ CT zásadním vyšetřením vedoucím ke stanovení diagnózy, protože dle FDG-PET/CT byla provedena cílená biopsie, ale je použito také pro vyhodnocení léčebné odpovědi (84).
Závěr
Erdheimova-Chesterova nemoc je vzácná histiocytóza, jejímž podkladem jsou pěnité histiocyty akumulované do patologických ložisek kdekoliv v organismu. Lékaři by si na možnost této choroby měli vzpomenout u pacientů s bolestmi kostí a s laboratorními projevy zánětu. FDG-PET/CT vyšetření, ale i scintigrafie skeletu může toto podezření a vysokou jistotou potvrdit. K definitivní diagnóze je třeba histologie z nejvíce FDG avidního kostního ložiska.
O existenci ECD by měli hlavně vědět neurologové, ortopedi či kožní lékaři, protože k nim přicházejí pacienti s příznaky této nemoc nejčastěji. Pokud tito lékaři správně nasměrují diagnostické kroky a podaří se jim získat reprezentativní vzorek pro histologické vyšetření, s překvapením zjistí, že podkladem nemoci je buňka z hemopoetické tkáně, a pošlou pacienta k hematologovi.
Hematologovi pak nezbývá nic jiného, než v literatuře zjistit možnosti léčby této nemoci, a protože žádný z nových léků u nás není pro ECD registrován a kvůli vzácnosti nemoci ani v budoucnu nebude, je nutné požádat revizní lékaře o schválení úhrady těchto léků. V době dostupnosti nových cílených léků typu vemurafenibu, dabrafenibu, trametinibu a cobimetinibu je nutno požadovat po patolozích průkaz v textu popsaných mutací, aby byl podklad pro žádost plátci zdravotní péče o tyto léky na paragraf 16. Tento článek by mohl sloužit jako teoretické zdůvodnění zmíněné léčby.
Z našeho pohledu je kladribin zatím stále lékem první volby, který je u těchto pacientů bez poškození krvetvorné tkáně výborně tolerován, na rozdíl od jeho klasické indikace, kterou je vlasatobuněčná leukemie, tedy choroba s poškozenou kostní dření, kde se po jeho podání občas prohlubuje cytopenie. To se v případě podání kladribinu pacientům s histiocytárními chorobami, jako je Erdheimova-Chesterova jednotka nebo histiocytóza z Langerhansových buněk, neděje.
Text napsán v rámci institucionální podpory MOÚ
KORESPONDENČNÍ ADRESA AUTORA:
prof. MUDr. Zdeněk Adam, CSc.
Interní hematologická a onkologická klinika, LF MU a FN Brno
Jihlavská 20, 625 00 Brno
Článek přijat redakcí: 6. 1. 2021
Článek přijat po recenzích: 21. 4. 2021
Sources
1. Haroche J, Cohen-Aubart F, Rollins BJ. Histiocytoses: emerging neoplasia behind inflammation. Lancet Oncol 2017; 18(2): e113–e125.
2. Papo M, Emile JF, Maciel TT et al. Erdheim-Chester Disease: a Concise Review. Curr Rheumatol Rep 2019; 21(12): 66. doi: 10.1007/s11926-019-0865-2.
3. Jendro MC, Zeidler H, Rosenthal H et al. Improvement of Erdheim-Chester disease in two patients by sequential treatment with vinblastine and mycophenolate mofetil. Clin Rheumatol 2004; 23 (1): 52–56.
4. Broccoli A, Stefoni V, Faccioli L et al. Bilateral orbital Erdheim-Chester disease treated with 12 weekly administrations of VNCOP-B chemotherapy: a case report and a review of literature. Rheumatol Int 2012; 32(7): 2209–2213.
5. Jeon IS, Lee SS, Lee MK. Chemotherapy and interferon-alpha treatment of Erdheim - -Chester disease. Pediatr Blood Cancer 2010; 55(4): 745–747.
6. Bourke SC, Nicholson AG, Gibson GJ. Erdheim-Chester disease: pulmonary infiltration responding to cyclophosphamide and prednisolone. Thorax 2003; 58(11): 1004–1005.
7. Yano S, Kobayashi K, Kato K et al. A case of Erdheim-Chester disease effectively treated by cyclophosphamide and prednisolone. Nihon Kokyuki Gakkai Zasshi 2007; 45(1): 43–48.
8. Gaspar N, Boudou P, Haroche J et al. High-dose chemotherapy followed by autologous hematopoietic stem cell transplantation for adult histiocytic disorders with central nervous system involvement. Haematologica 2006; 91(8): 1121–1125.
9. Boissel N, Wechsler B, Leblond V. Treatment of refractory Erdheim-Chester disease with double autologous hematopoietic stem-cell transplantation. Ann Intern Med 2001; 135(9): 844–845.
10. Cao XX, Niu N, Sun J et al. Efficacy of intermediate-dose cytarabine in central nervous system-relapsed wild-type BRAF Erdheim-Chester disease. Ann Hematol 2018; 97(1): 185–187.
11. Wang JN, Qiu Y, Niu N et al. Successful treatment of central nervous system involved Erdheim-Chester disease by intermediate-dose cytarabine as first-line therapy. Acta Oncol 2019 : 1–4. doi: 10.1080/0284186X.2019.1670355.
12. Mascalchi M, Nencini P, Nistri M et al. Failure of radiation therapy for brain involvement in Erdheim Chester disease. J Neurooncol 2002; 59(2): 169–172.
13. Katsunori M, Yasushi N, Masahiro H. Radiotherapy for Erdheim–Chester disease. Int J Clin Oncol 2007; 12 : 238–241.
14. Chicas Sett R, Pons Llanas O, Celada Álvarez F. A case report of recurrent adult-onset xanthogranuloma: is the radiotherapy a treatment option? Int Cancer Conf J 2015; 5 (2): 77–81.
15. Blomstrand L, Thor A, Hagberg H. Erdheim-Chester disease presenting as periodontal disease: Experience of treatment with cladribine, interferon-a, local radiotherapy and anakinra. Acta Oncol 2016; 55(2): 248–250.
16. Matsui K, Nagata Y, Hiraoka M. Radiotherapy for Erdheim-Chester disease. Int J Clin Oncol. 2007; 12(3): 238–241.
17. Miller R, Villá S, Kamer S et al. Palliative treatment of Erdheim–Chester disease with radiotherapy: a rare cancer network study. Radiother Oncol 2006; 80 : 323–326.
18. Sivak-Callcot J, Rootman J, Rasmussen S et al. Adult xanthogranulomatous disease of the orbit and ocular adnexa: new inmunohistochemical findings and clinical review. Br J Ophthalmol 2006; 90 : 602–608.
19. Veyssier-Belot C, Cacoub P, Caparros-Lefebvre D et al. Erdheim–Chester disease. Clinical and radiologic characteristics of 59 cases. Medicine 2001; 75 : 157–169.
20. Singh V, Prajeeth CK,Gudi V et al. 2-Chlorodeoxyadenosine (cladribine) induces apoptosis in human monocyte-derived dendritic cells. Clin Exp Immunol 2013; 173(2): 288–297.
21. Goyal G, Ravindran A, Young JR et al. Mayo Clinic Histiocytosis Working Group. Clinicopathological features,treatment approaches, and outcomes in Rosai-Dorfman disease. Haematologica. 2019 Apr 19. pii: haematol .2019.219626. doi: 0.3324/haematol.2019.219626.
22. Adam Z, Řehák Z, Koukalová R et al. PET-CT dokumentovaná kompletní 4letá remise Erdheimovy-Chesterovy nemoci po léčbě kladribinem. Vnitřní lék 2014; 60(5–6) 499–511.
23. Azadeh N, Tazelaar HD, Gotway MB et al. Erdheim Chester Disease treated successfully with cladribine. Respir Med Case Rep 2016; 18 : 37–40.
24. Myra C, Sloper L, Tighe PJ et al. Treatment of Erdheim-Chester disease with cladribine: a rational approach. Br J Ophthalmol 2004; 88(6): 844–847.
25. Perić P, Antić B, Knezević-Usaj S et al. Successful treatment with cladribine of Erdheim - -Chester disease with orbital and central nervous system involvement developing after treatment of Langerhans cell histiocytosis. Vojnosanit Pregl 2016; 73(1): 83–87.
26. Rajendra B, Duncan A, Parslew R et al. Successful treatment of central nervous system juvenile xanthogranulomatosis with cladribine. Pediatr Blood Cancer 2009; 52(3): 413–415.
27. Sheidow TG, Nicolle DA, Heathcote JG. Erdheim-Chester disease: two cases of¨orbital involvement. Eye (Lond) 2000; 14(Pt 4): 606–612.
28. Sutton L, Sutton S, Sutton M. Treatment of necrobiotic xanthogranuloma with 2-chlorodeoxyadenosine. Skinmed 2013; 11(2): 121–123.
29. Tamura S, Kawamoto K, Miyoshi H et al. Cladribine treatment for Erdheim-Chester disease involving the central nervous system and concomitant polycythemia vera: A case report. J Clin Exp Hematop 2018; 58(4): 161–165.
30. Goyal G, Shah MV, Call TG et al. Clinical and Radiologic Responses to Cladribine for the Treatment of Erdheim-Chester Disease. JAMA Oncol 2017; 3(9): 1253–1256.
31. Esmaeli B, Ahmadi A, Tang R et al. Interferon therapy for orbital infiltration secondary to Erdheim-Chester disease. Am J Ophthalmol 2001; 132(6): 945–947.
32. Braiteh F, Boxrud C, Esmaeli B et al. Successful treatment of Erdheim-Chester disease, a non-Langerhans-cell histiocytosis, with interferon-alpha. Blood 2005; 106(9): 2992–2994.
33. Suzuki HI, Hosoya N, Miyagawa K et al. Erdheim-Chester disease: multisystem involvement and management with interferon-alpha. Leuk Res 2010; 34(1): e21–e24.
34. Haroche J, Amoura Z, Trad SG et al. Variability in the efficacy of interferon-alpha in Erdheim - Chester disease by patient and site of involvement: results in eight patients. Arthritis Rheum 2006; 54(10): 3330–3336.
35. Hervier B, Arnaud L, Charlotte F et al. Treatment of Erdheim-Chester Disease with long - term high-dose interferon-α. Semin Arthritis Rheum 2012; 41(6): 1–7.
36. Arnaud L, Hervier B, Neel A et al. CNS involvement and treatment with interferon - are independent prognostic factors in Erdheim-Chester disease: a multicenter survival analysis of 53 patients. Blood 2011; 117(10): 2778–2782.
37. Diamond Elm, Dagna L, Hyman D et al. Consensus guidelines for the diagnosis and clinical mamagement of Erdheim Chester disease. Blood 2014; 124(4): 483–492.
38. Bulycheva EN, Baykov VV, Zaraĭskiĭ MI et al. Rare form of Erdheim-chester disease presenting with isolated central skeletal lesions treated with a combination of alfa-interferon and zoledronic Acid. Case Rep Hematol 2015; 2015 : 876752. doi: 10.1155/2015/876752.
39. Suzuki HI, Hosoya N, Miyagawa K et al. Erdheim-Chester disease: multisystem involvement and management with interferon-alpha. Leuk Res 2010; 34(1): e21–e24.
40. Tezol O, Citak EC, Ayhan YS et al. Effective High-dose Interferon-α Therapy in a 13-Year - Old Girl With Erdheim-Chester Disease. J Pediatr Hematol Oncol 2019. doi: 10.1097/ MPH.0000000000001538.
41. Aouba A, Georgin-Lavialle S, Pagnoux C et al. Rationale and efficacy of interleukin-1 targeting in Erdheim-Chester disease. Blood 2010; 116(20): 4070–4076.
42. Podestà MA, Graziani G, Reggiani F et al. Improvement of Erdheim-Chester disease-related renal failure after treatment with anakinra. Kidney Res Clin Pract 2014; 33(3): 165–167.
43. Szturz P, Adam Z, Rehák Z et al. Xanthelasma palpebrarum responding to interleukin-1 blockade. Intern Med J 2014; 44(6): 617–618.
44. Darstein F, Kirschey S, Heckl S et al. Successful treatment of Erdheim-Chester disease with combination of interleukin-1-targeting drugs and high-dose glucocorticoids. Intern Med J 2014; 44(1): 90–92.
45. Courcoul A, Vignot E, Chapurlat R. Successful treatment of Erdheim-Chester disease by interleukin-1 receptor antagonist protein. Joint Bone Spine 2014; 81(2): 175–177.
46. Killu AM, Liang JJ, Jaffe AS. Erdheim-Chester disease with cardiac involvement successfully treated with anakinra. Int J Cardiol 2013; 167(5): e115–117.
47. Aubert O, Aouba A, Deshayes S et al. Favorable radiological outcome of skeletal Erdheim - Chester disease involvement with anakinra. Joint Bone Spine 2013; 80(2): 206–207.
48. Tran TA, Pariente D, Lecron JC et al. Treatment of pediatric Erdheim-Chester disease with interleukin-1-targeting drugs. Arthritis Rheum 2011; 63(12): 4031–4032.
49. Cohen-Aubart F, Maksud P, Saadoun D et al. Variability in the efficacy of the IL1 receptor antagonist anakinra for treating Erdheim-Chester disease. Blood 2016; 127(11): 1509–1512.
50. Goyal G, Shah MV, Call TG et al. Efficacy of biological agents in the treatment of Erdheim - Chester disease. Br J Haematol. 2018; 183 : 520–524.
51. Franconieri F, Deshayes S, de Boysson H et al. Superior efficacy and similar safety of double dose anakinra in Erdheim-Chester disease after single dose treatment. Oncoimmunology 2018; 7(8): e1450712. doi: 10.1080/2162402X.2018.1450712.
52. Dagna L, Corti A, Langheim S et al. Tumor necrosis factor α as a master regulator of inflammation in Erdheim-Chester disease: rationale for the treatment of patients with infliximab. J Clin Oncol 2012; 30(28): e286–e290.
53. Ferrero E, Belloni D, Corti A et al. TNF-alpha in Erdheim-Chester disease pericardial effusion promotes endothelial leakage in vitro and is neutralized by infliximab. Rheumatology (Oxford). 2014; 53(1): 198–200.
54. Goyal G, Shah MV, Call TG et al. Efficacy of biological agents in the treatment of Erdheim - Chester disease. Br J Haematol 2018; 183(3): 520–524.
55. Cohen-Aubart F, Maksud P, Emile J-F et al. Efficacy of infliximab in the treatment of Erdheim-Chester disease. Ann Rheum Dis 2018; 77 : 1387–1390.
56. Jia X, Ning X, Bai Q et al. Combination of adalimumab with lower dose of methylprednisolone in Erdheim-Chester disease with systemic involvement. Acta Oncol. 2017; 56(5): 753–756.
57. Haroche J, Amoura Z, Charlotte F et al. Imatinib mesylate for platelet-derived growth factor receptor-beta-positive Erdheim-Chester histiocytosis. Blood 2008; 111(11): 5413–5415.
58. Montella L, Insabato L, Palmieri G. Imatinib mesylate for cerebral Langerhans’-cell histiocytosis. N Engl J Med 2004; 351(10): 1034–1035.
59. Utikal J, Ugurel S, Kurzen H et al. Imatinib as a treatment option for systemic non-Langerhans cell histiocytoses. Arch Dermatol 2007; 143(6): 736–740.
60. Haroche J, Charlotte F, Arnaud L et al. High prevalence of BRAF V600E mutations inErdheim - Chester disease but not in other non-Langerhans cell histiocytoses. Blood 2012; 27; 120(13): 2700–2703.
61. Haroche J, Cohen-Aubart F, Emile JF et al. Dramatic efficacy of vemurafenib in both multisystemic and refractory Erdheim-Chester disease and Langerhans cell histiocytosis harboring the BRAF V600E mutation. Blood 2013; 121(9): 1495–1500.
62. Hyman DM, Puzanov I, Subbiah V et al. Vemurafenib in multiple nonmelanoma cancers with BRAF V600 mutations. N Engl J Med 2015; 373 : 726–736.
63. Diamond EL, Durham BH, Haroche J et al. Diverse and targetable kinase alterations drive histiocytic neoplasms. Cancer Discov 2016; 6 : 154–165.
64. Emile J-F, Diamond EL, Hélias-Rodzewicz Z et al. Recurrent RAS and PIK3CA mutations in Erdheim-Chester disease. Blood 2014; 124 : 3016–3019.
65. Cohen-Aubart F, Emile JF, Maksud P et al. Marked efficacy of vemurafenib in suprasellar Erdheim-Chester disease. Neurology 2014; 83(14): 1294–1296.
66. Diamond EL, Durham BH, Ulaner GA et al. Efficacy of MEK inhibition in patients with histiocytic neoplasms. Nature 2019; 567 : 521–524.
67. Euskirchen P, Haroche J, Emile JF et al. Complete remission of critical neurohistiocytosis by vemurafenib. Neurol Neuroimmunol Neuroinflamm 2015; 2(2): e78.
68. Franconieri F, Martin-Silva N, de Boyssson H et al. A. Superior efficacy and tolerance of reduced doses of vemurafenib plus anakinra in Erdheim-Chester disease: Towards the paradigm of combined targeting and immune therapies. Acta Oncol Acta Oncol. 2016; 55(7): 930–930.
69. Haroche J, Cohen-Aubart F, Emile JF et al. Reproducible and sustained efficacy of targeted therapy with vemurafenib in patients with BRAF(V600E)-mutated Erdheim-Chester disease. J Clin Oncol 2015; 33(5): 411–4118.
70. Schirmer JH, Thorns C, Moosig F et al. Treatment failure by canakinumab in a patient with progressive multisystemic Erdheim-Chester disease refractory to anakinra: successful use of vemurafenib. Rheumatology (Oxford) 2015; 54(10): 1932–1934.
71. Tzoulis C, Schwarzlmüller T, Gjerde IO et al. Excellent response of intramedullary Erdheim - Chester disease to vemurafenib: a case report. BMC Res Notes 2015; 8 : 171.
72. Oneal PA, Kwitkowski V, Luo L e al. FDA Approval Summary: Vemurafenib for the Treatment of Patients with Erdheim-Chester Disease with the BRAFV600 Mutation. Oncologist. 2018; 23(12): 1520–1524.
73. Diamond EL, Subbiah V, Lockhart AC et al. Vemurafenib for BRAF V600-mutant Erdheim-Chester disease and Langerhans cell histiocytosis: analysis of data from the histology-independent, phase 2, open-label VE-BASKET study. JAMA Oncol. 2018; 4 : 384–388.
74. Cohen Aubart F, Emile J-F, Carrat F et al. Targeted therapies in 54 patients with Erdheim - Chester disease, including follow-up after interruption (the LOVE study). Blood 2017; 130 : 1377–1380.
75. Bhatia A, Hatzoglou V, Ulaner G et al. Neurologic and oncologic features of Erdheim - -Chester disease: a 30-patient series. Neuro Oncol 2020 Jan 17. pii: noaa008. doi: 10.1093/ neuonc/noaa008.
76. Grob JJ, Amonkar MM, Karaszewska B. Comparison of dabrafenib and trametinib combination therapy with vemurafenib monotherapy on health-related quality of life in patients with unresectable or metastatic cutaneous BRAF Val600-mutation-positive melanoma (COMBI-v): results of a phase 3, open-label, randomised trial. Lancet Oncol 2015; 16(13): 1389–1398.
77. Al Bayati A, Plate T, Al Bayati M et al. Dabrafenib and Trametinib Treatment for Erdheim - Chester Disease With Brain Stem Involvement. Mayo Clin Proc Innov Qual Outcomes. 2018; 2(3): 303–308.
78. Sanders IM, Goodman A, Kurzrock R. Real word toxicity experience with BRAF/MEK inhibitors in pacients with Erdheim-Chester disease. The Oncologist 2019; 24 : 1–5.
79. Campochiaro C, Cavalli G, Farina N et al. Efficacy and improved tolerability of combination therapy with interleukin-1 blockade and MAPK pathway inhibitors for the treatment of Erdheim-Chesterdisease. Ann Rheum Dis. 2019 Dec 9. pii: annrheumdis-2019-216610. doi: 10.1136/annrheumdis-2019-216610
80. Fernández-Eulate G, Muñoz-Lopetegi A, Ruiz I et al. Vemurafenib as first-line therapy in BRAF-V600E-mutant Erdheim-Chester disease with CNS involvement. BMJ Case Rep 2019; 12(11). pii: e228280. doi: 10.1136/bcr-2018-228280.
81. Van Keerberghen CA, Harrouk A, Leone L. A new role for fluorine-18-fluorodeoxyglucose positron-emission tomography/computed tomography in Erdheim-Chester disease. World J Nucl Med. 2019; 18(2): 201–203.
82. Akin EA, Osman M, Ellenbogen AL. FDG PET/CT Findings of Erdheim-Chester Disease: Radiologic Response to a Novel Treatment Regimen. Clin Nucl Med. 2018; 43(5): 337–340.
83. Young JR, Johnson GB, Murphy RC et al. (18)F-FDG PET/CT in Erdheim-Chester Disease: Imaging Findings and Potential BRAF Mutation Biomarker. J Nucl Med. 2018; 59(5): 774–779.
84. Rehák Z, Koukalová R, Vašina J et al. 18F-FDG PET/CT obraz Erdheimovy-Chesterovy nemoci – přehled českých pacientů. Nukl. Med. 20; 7 : 50–56.
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Internal Medicine

2021 Issue 3
-
All articles in this issue
- Nezapomínáme na možnost biologické terapie hypercholesterolemie pomocí PCSK9-inhibitorů?
- Co nového přináší aktualizace CEAP klasifikace chronického žilního onemocnění z roku 2020?
- Možnosti léčby myelodysplastického syndromu v roce 2021
- Léčba tří pacientů s Erdheimovou-Chesterovou chorobou kladribinem, případně kombinací kladribinu a cyklofosfamidu a přehled léčby této nemoci
- Rivaroxaban v léčbě a prevenci recidivy žilního tromboembolismu u dětí
- Postavení moxonidinu v léčbě hypertenze
- Podkožní krvácení při hypotyreóze indukované pembrolizumabem
- Vericiguat u nemocných se srdečním selháním a sníženou ejekčí frakcí – studie VICTORIA
- Komentáře k analýze složení směsi flavonoidů v tabletách Diozen 500 mg metodou UHPLC
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue
- Co nového přináší aktualizace CEAP klasifikace chronického žilního onemocnění z roku 2020?
- Vericiguat u nemocných se srdečním selháním a sníženou ejekčí frakcí – studie VICTORIA
- Postavení moxonidinu v léčbě hypertenze
- Možnosti léčby myelodysplastického syndromu v roce 2021
