Možnosti léčby myelodysplastického syndromu v roce 2021
Treatment strategies for myelodysplastic syndrome in 2021
The heterogeneous nature of myelodysplastic syndrome (MDS) brings a very variable prognosis of patients with the need for individualized treatment. The prognosis and treatment depend on the conventional determination of IPSS (International Prognostic Scoring System) and its revised form IPSS-R, which divides patients into lower and higher risk groups. Treatment of patients with lower risk of MDS include the improvement of cytopenia, especially anemia. The goal of treatment in patients with higher risk of MDS is delaying disease progression and improve patient survival. The only curative method for therapy of MDS is allogeneic hematopoietic stem cell transplantation (HSCT), howewer it is rarely applicable due to the age and comorbidities of patients.
Keywords:
azacitidin – erythropoiesis-stimulating agents – myelodysplastic syndromes – lenalidomide – treatment
Authors:
Petra Bělohlávková
Authors‘ workplace:
IV. interní hematologická klinika, LF UK a FN Hradec Králové
Published in:
Vnitř Lék 2021; 67(3): 150-155
Category:
Review Articles
Overview
Heterogenní povaha myelodysplastického syndromu (MDS) s sebou přináší velmi variabilní chování onemocnění s nutností individualizované léčby. Prognóza a léčba pacientů závisí na stanoveném IPSS (International Prognostic Scoring System) a jeho revidované formy IPSS-R, které nám MDS pacienty rozdělí do skupiny nižšího a vyššího rizika. Cílem léčby pacientů nižšího rizika je ovlivnění cytopenie, především anémie. U nemocných vyššího rizika MDS se léčbou snažíme oddálit progresi onemocnění a zlepšit přežití nemocných. Alogenní transplantace krvetvorných kmenových buněk (HSCT) představuje jedinou kurativní metodu léčby MDS, avšak vzhledem k věku a komorbiditám pacientů je proveditelná velmi zřídka.
Klíčová slova:
azacitidin – erytropoezu-stimulující preparáty – myelodysplastický syndrom – léčba – lenalidomid
Úvod
Myelodysplastický syndrom (MDS) je získané klonální onemocnění krvetvorby vycházející z poškozené hematopoetické kmenové buňky, které vede k neefektivní hematopoéze, jejímž důsledkem je rozvoj periferní cytopenie. MDS je především onemocnění starších osob s mediánem věku při stanovení diagnózy 70 let. Pouze desetina případů se vyskytuje u osob mladších 50 let. Ve věku nad 70 let je incidence MDS 20 až 40 nových případů na 100 000 obyvatel ročně. Ve většině případů onemocnění vzniká primárně, avšak 10–20 % případů se rozvine jako sekundární forma po předchozí expozici rizikovým faktorům (cytostatická či radioterapeutická léčba, opakovaný kontakt s chemikáliemi – organická rozpouštědla, benzen, pesticidy). Tato sekundární forma MDS je často doprovázena nepříznivým cytogenetickým nálezem s výrazně horší prognózou nemocných (1).
Morfologické vyšetření nátěrů periferní krve a kostní dřeně spolu s cytogenetickým vyšetřením zůstávají klíčovými kameny pro stanovení diagnózy MDS. Velký rozvoj v posledních letech zaznamenává výzkum na poli molekulární genetiky se snahou lépe pochopit složitou patogenezi onemocnění a zhodnotit prognostický význam přítomnosti mutací (např. EZH2, ASXL1, RUNX1, nRAS, TP53 atd.). Určení podtypu MDS v současné době vychází z WHO klasifikace z roku 2016 (Tab. 1), ve které je poprvé zahrnuta i přítomnost molekulární změny – SF3B1 (2).
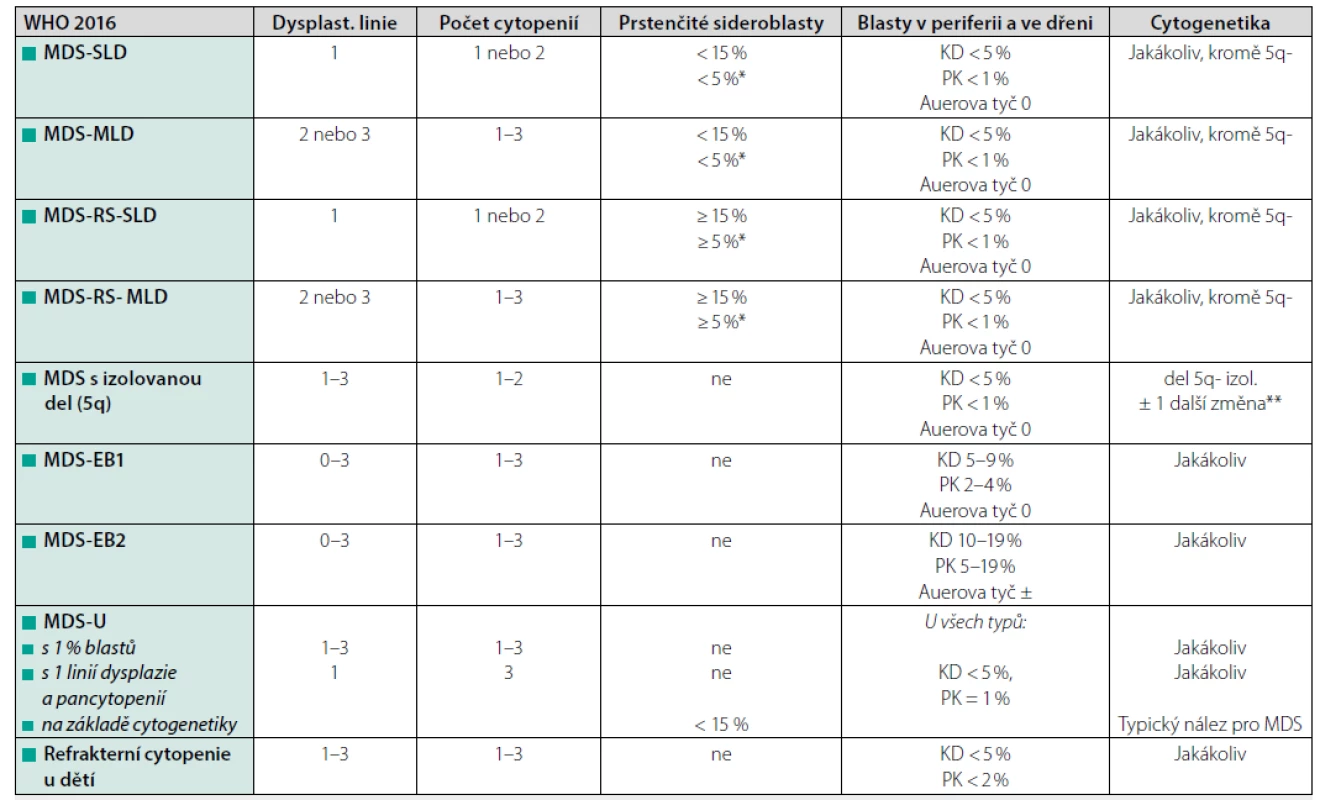
Vysvětlivky: SLD – jednoliniová dysplazie, MLD – multilineární dysplazie, RS – prstenčité sideroblasty, EB – exces blastů, MDS-U – neklasifikovatelný subtyp MDS;
*pozitivita SF3B1 mutace, **nepřítomna-7 nebo del(7q)
Ke stanovení rizika pacienta s následným výběrem vhodné léčby používáme mezinárodní prognostický skórovací systém (IPSS), který je založen na počtu cytopenií, počtu blastů ve dřeni a cytogenetickém nálezu. Podle zjištěných rizik pacienty dělíme na kategorii nižšího rizika (IPSS nízké a střední-1) a vyššího rizika (IPSS střední-2 a vysoké). V roce 2012 byla publikována revidovaná verze tohoto skórovacího systému (IPSS-R), ve které je podrobněji rozčleněna hloubka cytopenie, počet blastů a přítomný cytogenetický nález (Tab. 2) (3). Ačkoliv je většina léků schválena na základě IPSS, mělo by být v současné době již preferováno použití IPSS-R. Za pacienty nízkého rizika podle této klasifikace považujeme všechny nemocné s hodnotou ≤ 3,5 bodu (zahrnuje IPSS-R velmi nízké, nízké a některé pacienty středního rizika). Skupinu pacientů vysokého rizika tvoří nemocní s IPSS-R ≥ 4,0 bodu (IPSS-R vysoké a velmi vysoké riziko, zbývající pacienti středního rizika). Některé nejasnosti o intenzitě léčby s sebou přináší především skupina pacientů IPSS-R středního rizika, kde by měly být v léčebném postupu zohledněny další faktory (věk, komorbidity pacienta, cytogenetické a mutační nálezy) (4, 5).
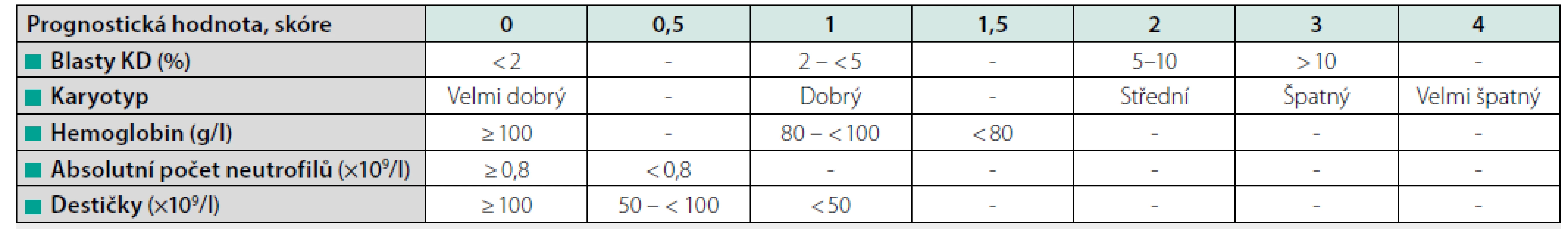
špatný: 3 abnormality nebo změny chromozomu 7; velmi špatný: > 3 abnormality
Dvě třetiny MDS pacientů spadají do skupiny nízkého rizika (IPSS-R ≤ 3,5 bodu) a medián přežití se zde pohybuje mezi 3 až 8 lety. Hlavním léčebným cílem u této skupiny pacientů je ovlivnění symptomů anémie, prevence komplikací (infekce, krvácení) a ovlivnění častého přetížení železem. Asi třetina těchto pacientů je již v době diagnózy závislá na transfuzích a během trvání choroby trpí anémií až 90 % pacientů. U pacientů vysokého rizika je vysoké riziko progrese choroby do akutní myeloidní leukemie (AML) s mediánem přežití mezi 0,5 až 1 rokem. Z tohoto důvodu u pacientů mladších 65 let bez významných komorbidit by měla být vždy zvážena možnost provedení alogenní transplantace krvetvorných buněk (HSCT). Léčba azacitidinem představuje standardní léčebnou možnost pro ostatní pacienty vysokého rizika. Při jejím selhání jsou naše léčebné možnosti omezeny pouze na paliativní a podpůrnou léčbu nebo množnost zařazení do případné studie (4, 5). Schéma léčebného postupu u MDS pacientů na základě prognostických rizik a dalších faktorů dokumentuje obrázek 1.
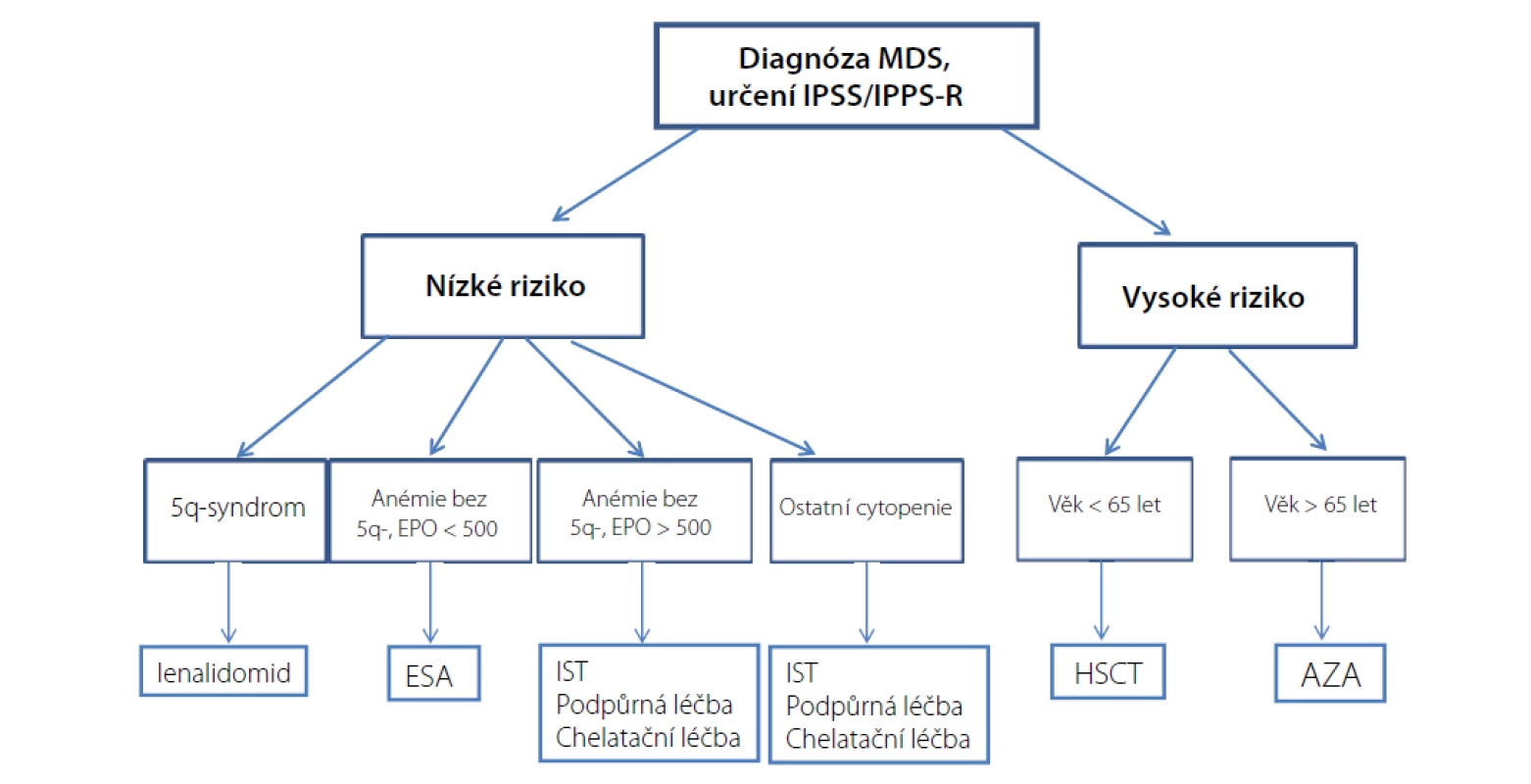
Léčba
1. Možnosti léčby MDS nízkého rizika
Observace a podpůrná léčba
U části nemocných při stanovení diagnózy MDS může být přítomna jen lehká, asymptomatická cytopenie. Tito nemocní jsou pravidelně sledováni s kontrolami krevního obrazu a při výraznější změně parametrů je nutné přehodnocení stavu choroby. Součástí podpůrné léčby jsou převody červených krvinek dle hodnoty hemoglobinu a klinického stavu pacienta, avšak při hodnotě hemoglobinu < 80 g/l je již zpravidla podání transfuzí indikováno. Podávání krevních destiček je indikováno při velmi těžké trombocytopenii (trombocyty < 10 × 109/l) nebo při výskytu krvácivých projevů s hodnotou destiček < 20 × 109/l tisíc. V některých případech jsou podávány krevní destičky podpůrně před plánovanými chirurgickými či stomatologickými výkony.
Součástí podpůrné léčby je i léčba antiinfekční. Profylaktické podávání antibiotik (chinolony, cotrimoxazol) a antimykotik (fluconazol) je doporučeno při velmi těžké neutropenii s absolutní hodnotou neutrofilů (ANC) pod 0,5 × 109/l nebo při současné imunosupresivní léčbě. V případě rozvoje infekce je u pacientů indikováno rychlé zahájení protiinfekční terapie a vždy je nutno pomýšlet i na méně obvyklé oportunní původce infekcí.
Léčba anémie
Léčba erytropoezu-stimulujícími preparáty (ESA) by měla být zvážena u anemických pacientů s hladinou endogenního erytropoetinu (EPO) v séru < 500 IU/l. V léčbě můžeme použít rekombinantní erytropoetin v dávce 30–60 kU/týdně nebo darbopoetin 150–300 μg/týdně. Léčebná odpověď je závislá na endogenní hladině EPO a tíži transfuzní závislosti. Při vhodném výběru pacienta a endogenní hladině EPO < 200 IU/l bývá léčebné odpovědi dosaženo asi u 50–70 % pacientů během 3 měsíců (M). Medián trvání léčebné odpovědi se však pohybuje pouze mezi 15–18 M. Pokud do 8 týdnů není přítomen žádný léčebný efekt, můžeme léčbu ovlivnit přidáním G-CSF (granulocyty kolonie stimulující faktor) v dávce 300 μg/l/týdně ve 2–3 dílčích dávkách a/nebo zdvojnásobením dávky EPO (6).
Léčba erytropoetiny je velmi málo účinná u pacientů MDS s delecí dlouhého raménka 5. chromozomu, označovaného jako MDS 5q-syndrom. Na základě proběhlých studií bylo prokázáno, že tito nemocní dobře odpovídají na imunomodulační léčbu lenalidomidem. Doporučená dávka je 10 mg p. o. jednou denně po dobu 21 dnů v opakovaných 28denních cyklech s týdenní pauzou (7, 8). Léčba by neměla být zahájena při hodnotě trombocytů < 25 × 109/l a/nebo neutrofilů < 0,5 × 109/l, neboť nebyla při těchto hodnotách testována. Nutná je také úprava dávkování dle renálních funkcí. Současně je nutné zhodnocení individuálního tromboembolického rizika pacienta s případným zahájením podávání LMWH. Erytrocytární odpovědi bývá dosaženo u 70–80 % pacientů a dosažení transfuzní nezávislosti je přítomno v 60–70 % případů. U pacientů, kteří nedostatečně odpovídají na léčbu lenalidomidem, je možné ji potenciovat přidáním nízké dávky kortikoidů.
Někteří anemičtí MDS pacienti bez přítomnosti delece 5 q mohou rovněž odpovědět na léčbu lenalidomidem. Ve studii se jednalo pouze o 26 % pacientů, a proto lenalidomid není pro tuto indikaci (9).
Léčba trombocytopenie
Významná trombocytopenie pod 50 × 109/l se vyskytuje asi u 30 % pacientů nízkého rizika a bohužel je často léčbou velmi obtížně ovlivnitelná. V případě přítomnosti cytopenie v dalších řadách může být účinné zahájení imunosupresivní léčby.
U pacientů s MDS a trombocytopenií proběhly studie s užitím preparátů aktivujících trombopoetinový receptor (tzv. TPO agonisté), které jsou již běžně používány u imunitní formy trombocytopenie (romiplostim, eltrombopag). Ve studii s romiplostimem při prvním hodnocení výsledků byl u 15 % pacientů pozorován vzestup počtu blastů, a proto byla studie předčasně ukončena. Dlouhodobé sledování pacientů na léčbě romiplostimem i eltrombopagem však neprokázalo zvýšené riziko progrese do AML, ale tyto preparáty zatím nebyly do léčby schváleny (4, 5, 10).
Chelatační léčba
I přes léčebné snahy ovlivnit anémii část nemocných zůstává transfuzně dependentních. U těchto nemocných je nutné zvážení chelatační léčby. Indikací jejího zahájení je podání minimálně 20 TU erytrocytů s hodnotou ferritinu > 1 000 μg/l a očekávaným přežitím pacienta déle než 1 rok. V praxi nejčastěji používáme přípravek deferasirox (DFX) s denní dávkou 14 mg/kg/den (maxim. 21 mg/kg/den) (11, 12). U nemocných jsou po zahájení léčby nutné pravidelné kontroly jaterních a renálních funkcí. Nejčastěji se setkáváme se zhoršením renálních funkcí, a proto při nárůstu hladiny kreatininu o ≥ 33 % oproti vstupní hodnotě je nutné snížení dávky DFX. V případě, že i přes snížení dávky hodnota kreatininu nadále stoupá, je nutné přerušení léčby. DFX je kontraindikován u pacientů s výrazně zhoršenou funkcí ledvin (clearence kreatininu < 60 ml/min). Cílová hladina ferritinu při chelatační léčbě je u MDS pacientů < 1 000 μg/l. U malé skupiny chelatovaných pacientů (10–15 %) se můžeme setkat s hematologickým zlepšením parametrů v krevním obraze a snížením potřeby transfuzí.
Imunosupresivní léčba
Zvážení imunosupresivní léčby je vhodné u nemocných s významnou pancytopenií vyžadující substituční léčbu a pacientů, kteří současně nejsou kandidáty HSCT. Byla publikována řada prediktivních faktorů odpovědi, jako věk < 65 let, normální karyotyp, kratší závislost na transfuzích, ženské pohlaví, hypoplastická forma MDS či přítomnost PNH klonu, avšak v nejnověji publikované studii nebyl žádný tento prediktivní faktor potvrzen. Léčebné odpovědi jsou velmi variabilní (16–67 %) (4, 5, 13). V léčbě je užíván antithymocytární globulin (ATG) v dávce 3,75 mg/kg/den po dobu 5 dnů (králičí) nebo 40 mg/kg/den po dobu 4 dnů (koňský) v kombinaci s prednisonem 1–2 mg/kg/den 14 dní nebo cyklosporinem A (CyA) s iniciální dávkou 3–5 mg/kg/den. U některých fragilnějších nemocných je tato léčba riziková, a proto může být zahájena pouze léčba cyklosporinem A. Zvýšit efekt léčby může u některých nemocných přidání metylprednisolonu (0,5–1 mg/kg/den), avšak dlouhodobá kortikoterapie není preferována. Zahájení imunosupresivní léčby je doporučeno u pacientů < 65 let, s normálním karyotypem, bez nálezu zmnožení blastů v kostní dřeni z důvodu minimalizace rizika progrese MDS do vyšších stadií.
Alogenní transplantace krvetvorných kmenových buněk (HSCT)
HSCT nepředstavuje první léčebnou metodou pro pacienty s IPSS nízké/střední-1, avšak může být zvážena u mladších pacientů při selhání první linie léčby. Jedná se především o pacienty s těžkou trombocytopenií vyžadující substituční léčbu, IPSS-R střední riziko a přítomností nepříznivého karyotypu nebo nepříznivé mutace TP53 (14).
2. Možnosti léčby MDS vysokého rizika
Léčba hypometylačními látkami
K léčbě pacientů vysokého rizika máme v ČR k dispozici pouze jediný preparát ze skupiny hypometylačních látek – azacitidin (AZA), v zahraničí je ještě užíván decitabin. Přesný mechanismus účinku AZA není znám, ale hlavní roli hraje kombinace přímého cytotoxického vlivu inhibicí proteosyntézy a ovlivnění metylace některých genů. Tento preparát je rovněž indikován pro pacienty s chronickou myelomonocytární leukemií (CMML) s hodnotou blastů ve dřeni 10–29 % a akutní myeloidní leukemií (AML) s blasty do 30 % (4, 5, 15). Doporučená zahajovací dávka pro 1. léčebný cyklus je 75 mg/m2 podávaných 7 dnů aplikovaná podkožně, nejčastěji používáme režim 5-2-2, tedy pondělí až pátek s vynecháním víkendové aplikace, pak dokončení cyklu v pondělí a úterý. Jednotlivé cykly se opakují po 28 dnech a probíhají ambulantně. Součástí léčby je podpůrná antiemetická a antiinfekční profylaxe dle zhodnocení individuálního rizika, ale tolerance léčby je uspokojivá.
Po 6 cyklech léčby je nutné u pacienta zhodnotit dosaženou léčebnou odpověď na základě nálezu v kostní dřeni a parametrů v krevním obraze. Pouze v případě progrese choroby se léčba AZA ukončuje, při všech ostatních nálezech je indikováno pokračování léčby. Bylo prokázáno, že léčba AZA vede ke zlepšení parametrů v krevním obraze, k prodloužení přežití nemocných a oddálení progrese do AML. Celkovou léčebnou odpověď dosáhne asi 50 % pacientů a medián trvání této odpovědi se pohybuje kolem 12 M. Predikce léčebné odpovědi zahrnuje celkový stav pacienta, karyotyp, počet blastů v periferní krvi a transfuzní závislost. Zahájení léčby AZA by mělo být však zváženo u všech pacientů, kteří nejsou směřováni up-front k HSCT, u nichž nejsou přítomny závažné kontraindikace (velmi špatný celkový stav, jiná aktivní malignita). Naše léčebné možnosti po selhání AZA jsou velmi omezené (zvážení HSCT, zařazení do studie, paliativní léčba) a medián přežití pacientů po selhání AZA se pohybuje kolem 6 M (4, 5).
Alogenní transplantace krvetvornými kmenovými buňkami (HSCT)
HSCT představuje jedinou kurativní metodu léčby MDS a je indikována u pacientů IPSS střední-2/vysoké riziko a IPSS-R vysoké/velmi vysoké s věkem pacienta ≤ 65 (70) let. Zhodnotit se musí celkový stav a komorbidity pacienta, stav základní choroby, dostupnost dárce. V neposlední řadě je důležité přihlédnutí k rodinnému zázemí a přání pacienta. Při počtu blastů ve dřeni < 10 % je možné přímé provedení HSCT, v případě vyššího počtu blastů (≥ 10 %) je před vlastní transplantací nutná jejich redukce chemoterapií nebo podáním AZA s cílem snížit riziko relapsu choroby (14). Velké analýzy výsledků HSCT udávají celkové přežití mezi 30–52 %, výskyt peritransplantační mortality ve třech letech je 10 až 50 %. Rizikové faktory pro relaps MDS představují vyšší věk, pokročilé onemocnění, těžká fibróza ve dřeni, nepříznivý karyotyp a přítomnost některých somatických mutací (ASXL1, RUNX1 a TP53). Stále se hledají metody, jak zlepšit výsledky HSCT, které zahrnují vhodný výběr pacienta a dárce, správné načasování transplantace a přípravného režimu, optimální imunosupresivní léčbu. Jednou z cest je např. preventivní podávání AZA po HSCT, které je zatím možné pouze ve studiích.
3. Nové perspektivy léčby MDS
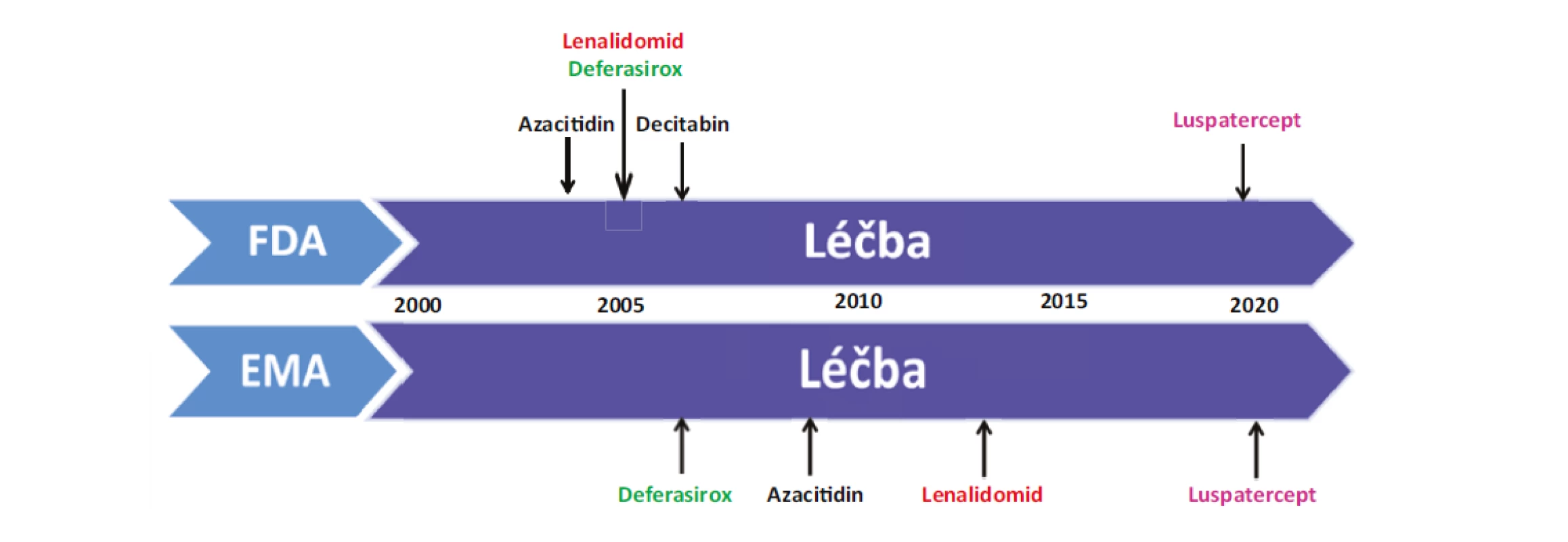
Ačkoliv v posledních letech byl zaznamenán značný pokrok v léčbě MDS a máme k dispozici nové léky pro léčbu MDS nízkého i vysokého rizika, dosažená léčebná odpověď není stále uspokojující (Obr. 2). Nadále probíhá celá řada studií a po dlouhé době máme k dispozici nový preparát luspatercept (Reblozyl), který byl schválen FDA a EMA v dubnu 2020 pro léčbu anemických MDS pacientů s prstenčitými sideroblasty (RS), kteří selhali na léčbě ESA a jsou nadále transfuzně dependentní. Luspatercept je první inhibitor dráhy TGF-β (transforming growth factor-β), který vede ke stimulaci pozdní fáze erytroidní diferenciace a reguluje zlepšení diferenciace a vyzrávání erytrocytárních prekurzorů nezávislé na EPO. Preparát je již nově schválen v ČR, avšak nemá úhradu a jeho použití je tedy možné po schválení úhrady na § 16 podle zákona č. 48/1997 Sb., v platném znění.
FDA: US Food and Drug Administration; EMA: European Medicines Agency
Ve studii fáze III (MEDALIST) u pacientů refrakterních na ESA nebo s vysokým endogenním EPO bylo léčbou dosaženo ve 38 % případů transfuzní nezávislosti a 53 % pacientů mělo zlepšení hematologických parametrů. Léčba se podává podkožně à 3 týdny, doporučená zahajovací dávka je 1 mg/kg/s. c. s možným postupným zvýšením až na 1,75 mg/kg dle léčebné odpovědi. Nejlépe ve studiích odpovídali pacienti s nálezem prstenčitých sideroblastů či mutací SF3B1 a toto se promítlo do schválené indikace (16, 17).
K dalším preparátům, jejichž efekt je prověřován u MDS anemických pacientů nízkého rizika, patří imetelstat, který je inhibitorem telomeráz. K dispozici máme průběžné výsledky studií fáze II a III, ve kterých byl popsán efekt léčby u 37 % pacientů. Tento preparát je podáván v dávce 7,5 mg/kg/i.v. každé 4 týdny (18, 19).
Roxadustat je perorálně podávaný inhibitor prolylhydroxylázy indukovatelné hypoxií (HIF-PHI), který je více studován v léčbě anémie u chronického onemocnění ledvin. Roxadustat ovlivňuje erytropoézu prostřednictvím zvyšování endogenních hladin EPO stabilizací HIF a zlepšením regulace železa prostřednictvím hepcidinu. U MDS máme k dispozici pilotní výsledky studie, podle kterých 38 % pacientů dosáhlo transfuzní nezávislosti a 58 % pacientů mělo ≥ 50 % redukci počtu transfuzí. Preparát je užíván perorálně a v této studii byly zkoušeny zahajovací dávky 1,5; 2,0 nebo 2,5 mg/kg s následnou titrací podle léčebné odpovědi (20, 21).
První linii léčby pro pacienty vysokého rizika představuje AZA, avšak celková léčebná odpověď a délka trvání této odpovědi je stále velmi neuspokojivá s nepříznivou prognózou. Z tohoto důvodu probíhá řada studií, ve kterých jsou ke standardní dávce AZA přidávány další preparáty s cílem potencovat léčebný efekt. Přidání některých preparátů, jako je lenalidomid, vorinostat, eltrombopag, nepřineslo očekávaný benefit, neboť léčebná odpověď byla srovnatelná s léčbou AZA a významně narostl počet nežádoucích projevů léčby (22, 23).
Slibnějším preparátem kombinované léčby se jeví pevonedistat (inhibitor nedylace – tedy inhibice aktivační schopnosti nádorového supresoru p53, ale bez ovlivnění Mdm2-závislé degradace), kde celková léčebná odpověď ve studii fáze II byla v kombinované větvi 79,3 % vs. 56,7 % u větve s AZA a medián trvání léčebné odpovědi byl 34,6 M vs. 13,1M. Na léčbu odpovídali i pacienti s nepříznivou mutací TP53. Více informací nám přinesou výsledky studie fáze III, která probíhala i na některých českých centrech (24).
Velmi silný potenciál v léčbě MDS bude mít zřejmě venetoclax (inhibitor BCL-2), což dokládají výsledky studií použití preparátu pro léčbu AML starších nemocných, kteří nejsou již kandidáty intenzivní chemoterapie. V současné době probíhají dvě studie u MDS pacientů a první výsledky u MDS refrakterních/relabovaných dokumentují 50% celkovou léčebnou odpověď (ORR) a 38 % pacientů dosáhlo kompletní remisi ve dřeni (25).
Pro pacienty se selháním léčby AZA byly určeny studie fáze II a III s guadecitabinem (druhá generace hypometylační látky) a rigosertibem (multikinázový inhibitor). Výsledky léčby guadecitabinem jsou zatím rozporuplné, protože u pacientů po selhání AZA bylo dosaženo prodloužení přežití, ale celkovou léčebnou odpověď mělo pouze 14,3 %. Preparát je rovněž neefektivní u pacientů s nepříznivou TP53 mutací (26, 27).
Výsledky studií s rigosertibem jsou naopak povzbudivější. V prvních studiích byl tento preparát podáván ve formě 3denní kontinuální infuze, v současné době je již dostupná perorální forma. Ve studii fáze II v kombinaci s AZA byla zjištěna celková léčebná odpověď až u 90 % MDS pacientů bez předchozí léčby a u 54 % pacientů s předchozím selháním léčby.
Další možnost v léčbě MDS představuje cílená léčba inhibitory. Nejdále ve vývoji jsou inhibitory mutací IDH1 a IDH2, které jsou přítomny asi u 5 % MDS a 20 % AML pacientů (ivosidenib, enasidinib). V současné době máme k dispozici nadějné výsledky těchto preparátů u AML pacientů, a proto již byly zahájeny podobné studie na poli MDS (monoterapie nebo kombinace s AZA) (28).
Mutaci TP53 prokazujeme asi u 10 % MDS/AML pacientů a u 50 % pacientů s komplexním karyotypem. Vzhledem k tomu, že tito nemocní mají velmi nepříznivou prognózu, cílená léčba inhibitory TP53 představuje další oblast výzkumu. Povzbudivé výsledky přinesla studie fáze II, která prokázala synergický efekt kombinace AZA a inhibitoru TP53 (APR-246) s dosažením 87 % celkového léčebného efektu (29).
Závěr
Posledních dvacet let přineslo nepochybné pokroky v léčbě MDS a nadále probíhá velké množství studií, avšak schválených preparátů pro léčbu MDS je stále omezený počet (Obr. 2). Výsledky léčby MDS nejsou příliš uspokojivé, kdy příčinou je zřejmě složitá patogeneze choroby a významná klinická variabilita onemocnění u jednotlivých pacientů. Pro pacienty nízkého rizika je nově schváleným preparátem luspatercet a výsledky studií s imetelstatem a roxadustatem vypadají také pozitivně.
U nepříznivé skupiny pacientů MDS vysokého rizika se ve studiích jeví velmi nadějně preparáty venetoclax a inhibitor TP53 (APR-246), jejichž přidání ke standardní léčbě AZA potencuje léčebný efekt. Vzhledem k probíhajícím studiím lze očekávat, že během dalších let budou léčebné možnosti rozšířeny o další preparáty.
KORESPONDENČNÍ ADRESA AUTORA:
MUDr. Petra Bělohlávková, Ph.D.
IV. interní hematologická klinika, FN Hradec Králové
Sokolská 581, 500 05 Hradec Králové
Článek přijat redakcí: 12. 9. 2020
Článek přijat po recenzích: 31. 3. 2021
Sources
1. Malcovati L, Hellström-Lindberg E, Bowen D et al. Diagnosis and treatment of primary myelodysplastic syndromes in adults: recommendations from the European Leukemia - Net, Blood. 2013; 122 : 2943–2964.
2. Arber DA, Orazi A, Hasserjian R et al. The 2016 revision to the World Health Organization classification of myeloid neoplasms and acute leukemia. Blood. 2016; 127 : 2391–2405.
3. Greenberg PL, Tuechler H, Schanz J et al. Revised international prognostic scoring system for myelodysplastic syndromes. Blood. 2012; 120 : 2454–2465.
4. Platzbecker U. Treatment of MDS. Blood. 2019; 7 : 133(10): 1096–1107.
5. Fenaux P, Platzbecker U, Ades L. How we manage adults with myelodysplastic syndrome. Br J Haematol. 2019. doi: 10.1111/bjh.16206.
6. Gascón P, Krendyukov A, Mathieson N, Aapro M. Epoetin Alfa for the Treatment of Myelodysplastic Syndrome-Related Anemia: A Review of Clinical Data, Clinical Guidelines, and Treatment Protocols. Leuk Res. 2019; 81 : 35–42.
7. Komrokji RS, List AF. Short - and long-term benefits of lenalidomide treatment in patients with lower-risk del(5q) myelodysplastic syndromes. Ann Oncol. 2016; 27 : 62–68.
8. Jonášová A, Červinek L, Bělohlávková P et al. První české zkušenosti s lenalidomidem v terapii anemických nemocných s myelodysplastickým syndromem s delecí dlouhého ramene 5. chromozomu, Vnitr Lek. 2015; 61(12): 1028–1033.
9. Santini V, Almeida A, Giagounidis A et al. Randomized Phase III Study of Lenalidomide Versus Placebo in RBC Transfusion-Dependent Patients With Lower-Risk Non-del(5q) Myelodysplastic Syndromes and Ineligible for or Refractory to Erythropoiesis-Stimulating Agents. J. Clin. Oncol. 2016; 34 : 2988–2996.
10. Kantarjian HM, Fenaux P, Sekeres MA et al. Long-term follow-up for up to 5 years on the risk of leukaemic progression in thrombocytopenic patients with lower-risk myelodysplastic syndromes treated with romiplostim or placebo in a randomised double-blind trial. Lancet Haematol. 2018; 5: e117–26.10.
11. Langemeijer S, De Swart L, Yu G, Smith A, Crouch S, Johnston T et al. Impact of treatment with iron chelators in lower-risk MDS patients participating in the European leukemianet MDS (EUMDS) registry. Blood. 2016; 128(22): 3186.
12. Gattermann N. Do Recent Randomized Trial Results Influence which Patients with Myelodysplastic Syndromes Receive Iron Chelation? Hematol Oncol Clin North Am. 2020; 34(2): 465–473.
13. Stahl M, Bewersdorf JP, Giri S et al. Use of immunosuppressive therapy for management of myelodysplastic syndromes: a systematic review and meta-analysis Haematologica 2020; 105(1): 102–111.
14. de Witte T, Bowen D, Robin M et al. Allogeneic hematopoietic stem cell transplantation for MDS and CMML: recommendations from an international expert panel. 2017; 129(13): 1753–1762.
15. Zeidan AM, Stahl M, DeVeaux M, Giri S, Huntington S, Podoltsev N et al. Counseling patients with higher-risk MDS regarding survival with azacitidine therapy: are we using realistic estimates? Blood Cancer J; 2018; 8 : 55.
16. Fenaux P. The Medalist Trial: results of a phase 3, randomized, double-blind, placebocontrolled study of luspatercept to treat anemia in patients with very low-, low-, or intermediate - risk myelodysplastic syndromes (MDS) with ring sideroblasts (RS) who require red blood cell (RBC) transfusions. Blood. 2018; 132(Suppl 1): 1.
17. Platzbecker U, Germing U, Götze KS et al. Luspatercept for the treatment of anaemia in patients with lower-risk myelodysplastic syndromes (PACE-MDS): a multicentre, open - -label phase 2 dose-finding study with long-term extension study. Lancet Oncol. 2017; 18 : 1338–1347.
18. Steensma DP, Platzbecker U, Van Eygen K et al. Imetelstat Treatment Leads to Durable Transfusion Independence (TI) in RBC Transfusion-Dependent (TD), Non-Del(5q) Lower Risk MDS Relapsed/Refractory to Erythropoiesis-Stimulating Agent (ESA) Who Are Lenalidomide (LEN) and HMA Naive. Blood. 2018; 132 : 463.
19. Fenaux P, Raza A, Vellenga E, Platzbecker U, Santini V, Samarina I. Efficacy and Safety of Imetelstat in RBC Transfusion-Dependent (TD) IPSS Low/Int-1 MDS Relapsed/Refractory to Erythropoiesis-Stimulating Agents (ESA) (IMerge). Blood. 2017; 130 : 4256.
20. Yang Y, Yu X, Zhang Y et al. Hypoxia-inducible factor prolyl hydroxylase inhibitor roxadustat (FG-4592) protects against cisplatin-induced acute kidney injury. Clin. Sci. 2018; 132 : 825–838.
21. Henry JG, Glaspy J, Harrup RA et al. Roxadustat (FG4592; ASP1517; AZD9941) in the Treatment of Anemia in Patients with Lower Risk Myelodysplastic Syndrome (LR-MDS) and Low Red Blood Cell (RBC) Transfusion Burden (LTB). Blood. 2019; 134. (Supplement 1)
22. Sekeres MA, Othus M, List AF et al. Randomized phase II study of azacitidine alone or in combination with lenalidomide or with vorinostat in higher-risk myelodysplastic syndromes and chronic myelomonocytic leukemia: North American Intergroup Study SWOG s1117. J Clin Oncol. 2017; 35(24): 2745–2753.
23. Dickinson M, Honar Cherif H, Fenaux P et al. Azacitidine with or without eltrombopag for first-line treatment of intermediate - or high-risk MDS with thrombocytopenia. Blood. 2018; 132 : 2629–2638.
24. Sekeres MA, Watts J, Radinof A et al. Randomized phase 2 trial of pevonedistat plus azacitidine versus azacitidine for higher-risk MDS/CMML or low-blast AML. Leukemia. 2021 Jan 22. doi: 10.1038/s41375-021-01125-4. Online ahead of print.
25. Wei AH, Strickland SA Jr, Hou JZ et al. Venetoclax combined with low-dose cytarabine for previously untreated patients with acute myeloid leukemia: results from a phase Ib/II study. J Clin Oncol 2019; 37 : 1277–1284.
26. Garcia-Manero G, Roboz G, Walsh K et al. Guadecitabine (SGI-110) in patients with intermediate or high-risk myelodysplastic syndromes: phase 2 results from a multicentre, open-label, randomised, phase 1/2 trial. Lancet Hematol. 2019; 6 : 317–327.
27. Navada SC, Garcia-Manero G, Atallah EL et al. Phase II study of oral rigosertib combined with azacitidine (AZA) as first line therapy in patients (Pts) with higher-risk myelodysplastic syndromes (HR-MDSt]. American Society of Hematology. 2019. http:// dx.doi. org/10.1182/blood-2019-131676.
28. DiNardo CD, Watts JM, Stein EM, de Botton S, Fathi AT, Prince GT et al. Ivosidenib (AG - 120) induced durable remissions and transfusion independence in patients with IDH - 1-mutant relapsed or refractory myelodysplastic syndrome: results from a phase 1 dose escalation and expansion study. Blood. 2018; 132 : 1812.
29. Sallman DA, DeZern AE, Garcia-Manero G et al. Phase 2 Results of APR-246 and Azacitidine (AZA) in Patients with TP53 mutant Myelodysplastic Syndromes (MDS) and Oligoblastic Acute Myeloid Leukemia (AML). Blood. 2019; 134(Supplement 1): 676–676.
Labels
Diabetology Endocrinology Internal medicine Haematology General practitioner for adultsArticle was published in
Internal Medicine

2021 Issue 3
- Memantine Eases Daily Life for Patients and Caregivers
- Possibilities of Using Metamizole in the Treatment of Acute Primary Headaches
- Metamizole at a Glance and in Practice – Effective Non-Opioid Analgesic for All Ages
- Memantine in Dementia Therapy – Current Findings and Possible Future Applications
- Monitoring of Joint Health is an Important Part of Hemophilia Care
-
All articles in this issue
- Nezapomínáme na možnost biologické terapie hypercholesterolemie pomocí PCSK9-inhibitorů?
- Co nového přináší aktualizace CEAP klasifikace chronického žilního onemocnění z roku 2020?
- Možnosti léčby myelodysplastického syndromu v roce 2021
- Léčba tří pacientů s Erdheimovou-Chesterovou chorobou kladribinem, případně kombinací kladribinu a cyklofosfamidu a přehled léčby této nemoci
- Rivaroxaban v léčbě a prevenci recidivy žilního tromboembolismu u dětí
- Postavení moxonidinu v léčbě hypertenze
- Podkožní krvácení při hypotyreóze indukované pembrolizumabem
- Vericiguat u nemocných se srdečním selháním a sníženou ejekčí frakcí – studie VICTORIA
- Komentáře k analýze složení směsi flavonoidů v tabletách Diozen 500 mg metodou UHPLC
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue
- Co nového přináší aktualizace CEAP klasifikace chronického žilního onemocnění z roku 2020?
- Vericiguat u nemocných se srdečním selháním a sníženou ejekčí frakcí – studie VICTORIA
- Postavení moxonidinu v léčbě hypertenze
- Možnosti léčby myelodysplastického syndromu v roce 2021
