Antikoagulace u onkologických pacientů, nová doporučení na základě randomizovaných klinických studií
Anticoagulation in cancer patients; new recommendations based on randomized clinical trials
Venous thromboembolic disease (VTD) is currently the second leading cause of death in cancer patients with a prevalence of approximately 20% compared with that of 5% in the entire adult population. Cancer patients are a heterogeneous group with significant differences in the risk of VTD which is, in particular, determined by the type of tumour, its extent, location, and the presence of metastases. Some tumours represent a mean 3 - to 5-fold increase in risk, while in others the risk of developing VTD is even several times higher. In comparison with non-cancer patients, those with a tumour are not only at an increased risk of an initial thromboembolic event, but also of its recurrence, regardless of ongoing anticoagulation which is associated with a higher risk of bleeding, particularly in mucosal involvement. Venous thrombosis and its treatment may interfere with the ongoing diagnosis and treatment. In cancer patients, VTD is a frequent incidental finding on imaging studies. Primary thromboprophylaxis (apixaban, rivaroxaban, LMWH) is currently recommended in selected groups of cancer patients who are either hospitalized for acute internal disease or immobilized and have an active malignancy, undergo outpatient systemic chemotherapy for a tumour with a high risk of VTD (a Khorana score of ≥ 2) or surgery and are not at high risk of bleeding. DOACs should be administered six months after the initiation of chemotherapy. If there is a risk of drug interactions or mucosal bleeding, LMWHs are recommended. At present, DOACs (apixaban, edoxaban, rivaroxaban) and LMWHs are the first-choice drugs in treating VTD. LMWHs are preferred in mucosal tumours, when there is a high risk of bleeding, in progressive malignancy, concomitant emetogenic therapy, and dyspeptic difficulties. In severe renal insufficiency (CrCl < 15 ml/min), vitamin K antagonists may be of value. Individualized treatment should take into consideration the patient’s general condition, prognosis, and personal preferences.
Keywords:
Chemotherapy – treatment – primary prevention – DOAC – Trousseau syndrome – paraneoplastic thromboembolic disease – low-molecular-weight heparins
Authors:
Dalibor Musil
Authors‘ workplace:
Interní a kardiologická klinika Fakultní nemocnice Ostrava a LF Ostravské univerzity
Published in:
Vnitř Lék 2022; 68(2): 111-115
Category:
Review Articles
Overview
Žilní tromboembolická nemoc (TEN) je dnes druhou nejčastější příčinou smrti u pacientů s nádorem s prevalencí asi 20 % ve srovnání s 5 % v celé dospělé populaci. Onkologičtí pacienti jsou heterogenní skupinou s velkými rozdíly v riziku TEN, které je určováno zejména typem nádoru, jeho rozsahem, lokalizací a přítomností metastáz. Některé nádory představují průměrný 3 až 5násobný nárůst rizika, u jiných je nebezpečí vzniku TEN ještě několikanásobně vyšší. Ve srovnání s neonkologickými pacienty jsou pacienti s nádorem vystaveni nejenom zvýšenému riziku první tromboembolické příhody, ale rovněž její recidivy, bez ohledu na pokračující antikoagulaci, která je spojena s vyšším rizikem krvácení, zejména u slizničního postižení. Žilní trombóza a její léčba mohou interferovat s probíhající diagnostikou a léčbou. U onkologických pacientů je TEN častým náhodným nálezem při zobrazovacích vyšetřeních. Primární tromboprofylaxe (apixaban, rivaroxaban, LMWH) je v současné době doporučena u vybraných skupin onkologických pacientů, kteří jsou buď hospitalizovaní pro akutní interní onemocnění, nebo imobilizováni a mají aktivní malignitu, podstupují ambulantní systémovou chemoterapii pro nádor s vysokým rizikem TEN (Khoranovo skóre ≥ 2) nebo operační výkon a současně nemají vysoké riziko krvácení. DOAC by měly být podávány 6 měsíců od zahájení chemoterapie. Pokud je riziko lékových interakcí nebo slizničního krvácení, jsou doporučeny LMWH. V léčbě TEN jsou dnes první volbou DOAC (apixaban, edoxaban, rivaroxaban) a LMWH. LMWH jsou preferovány u slizničních tumorů, při vysokém riziku krvácení, u progredující malignity, při současné emetogenní terapii a dyspeptických potížích. U závažné renální insuficience (CrCl < 15 ml/min) mohou mít své místo antagonisté vitaminu K. Individualizovaná léčba by měla zohledňovat celkový stav pacienta, jeho prognózu a osobní preference.
Klíčová slova:
léčba – DOAC – chemoterapie – primární prevence – Trousseaův syndrom – paraneoplastická tromboembolická nemoc – nízkomolekulární hepariny
Úvod
Žilní trombóza byla poprvé identifikována jako komplikace nádorového onemocnění Armandem Trousseauem v roce 1865 (1). Je ironií, že u něho samotného se objevila hluboká žilní trombóza levé paže jako paraneoplastický projev karcinomu žaludku. Diagnózu svého vlastního Trousseauova syndromu přežil pouhých šest měsíců, když v roce 1867 zemřel.
Trousseaův syndrom (CAT – cancer‑associated thrombosis, paraneoplastická tromboembolická nemoc) je dnes druhou nejčastější příčinou smrti u pacientů s nádorem. Hlavní příčinou je onkologické onemocnění samotné. Průměrné riziko žilní tromboembolické nemoci (TEN) je u pacientů s nádorem ve srovnání se zdravými lidmi stejného věku a pohlaví 4–7krát vyšší s prevalencí asi 20 % ve srovnání s 5 % v celé dospělé populaci (2). Onkologičtí pacienti jsou poměrně heterogenní skupinou s velkými rozdíly v riziku TEN, které je určováno věkem, přidruženými chorobami, typem onkologické léčby (cisplatina, bevacizumab, erytropoetin), zejména pak druhem nádoru, jeho rozsahem, lokalizací a přítomností metastáz (3, 4) (Tab. 1). Z tabulky je patrné, že zatímco některé nádory jsou spojené s průměrným 3 až 5násobným nárůstem rizika, u jiných je nebezpečí vzniku TEN ještě několikanásobně vyšší. Častější výskyt TEN zvyšuje morbiditu, mortalitu a léčebné náklady. Účinná profylaxe a léčba TEN je proto jednou z důležitých cest, jak se vyhnout řadě komplikací a zlepšit kvalitu života.
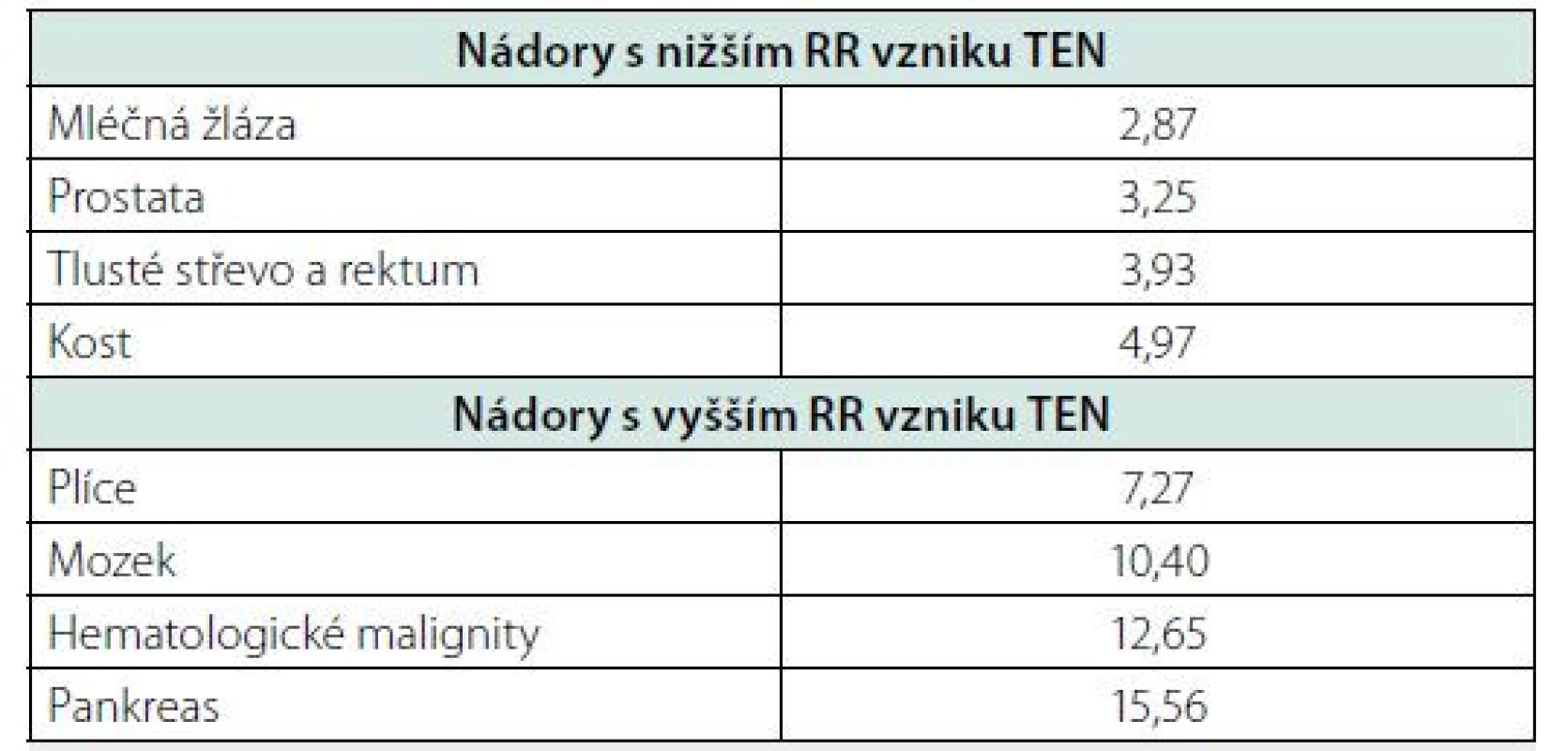
Riziko TEN v neposlední řadě zvyšuje také ambulantní systémová onkologická léčba. V roce 2013 retrospektivní analýza reálných dat 27 479 pacientů ukázala, že skutečná míra výskytu paraneoplastické TEN je v těchto případech vyšší, než se do té doby předpokládalo. Celková incidence TEN 3,5 měsíce od začátku chemoterapie byla 7,3 % (v rozmezí 4,6–11,6 % podle lokalizace nádoru), po 12 měsících stoupla na 13,5 % (v rozmezí 9,8–21,3 %) s nejvyšším rizikem u pacientů s karcinomem pankreatu, žaludku a plic (5).
Příčinami porušené koagulace u paraneoplastické TEN jsou v první řadě nádor (typ, lokalizace, metastázy) a jeho léčba (chemoterapie, radioterapie, operace, adjuvantní léčba, hospitalizace, krevní převody). Změny v krevním obraze představují důležité ukazatele rizika zahrnuté v Khoranově skóre (viz dále). Nesmíme také zapomínat na ostatní rizikové faktory spojené s TEN také u neonkologických pacientů (věk, pohlaví, etnikum, nadváha a obezita, komorbidity, imobilizace, rodinná a osobní anamnéza stran TEN, hormonální léčba, inhibitory angiogeneze, vrozená trombofilie) (6).
Přes zlepšující se medicínskou péči koincidence nádorů a TEN v průběhu posledních desetiletí neustále narůstá. Důvodem je delší přežívání onkologických pacientů při účinnější léčbě, která je však často trombogenní, stárnoucí populace a díky novým zobrazovacím technologiím stále se zdokonalující diagnostika TEN, kdy lze zjistit i malé bércové trombózy nebo subsegmentální plicní embolizace nevelkého rozsahu, které by dříve unikly pozornosti (6).
Nádorové onemocnění zvyšuje nejenom riziko první trombotické příhody, také recidivy jsou zde ve srovnání s neonkologickými pacienty častější, bez ohledu na pokračující antikoagulaci, zejména u vysoce aktivního onemocnění. Nebezpečí krvácení při antikoagulaci je asi 6krát vyšší. Žilní trombóza a její léčba mohou interferovat s probíhající diagnostikou a léčbou základního onemocnění. U onkologických pacientů je při různých zobrazovacích vyšetřeních žilní trombóza častým náhodným nálezem. Takovéto náhodné asymptomatické nálezy jsou spojené se zvýšeným rizikem nádorové rekurence a mortality stejně jako symptomatická TEN (7).
Antikoagulační léčba je u onkologických pacientů indikována v primární prevenci, v léčbě TEN a také v sekundární tromboprofylaxi.
Primární prevence TEN
Riziko vzniku TEN u onkologických pacientů léčených systémovou chemoterapií lze odhadnout na základě Khoranova skóre (Tab. 2). Khorana et al. vypracovali prediktivní model skóre od 0 do 6, kde vyšší skóre ukazuje vyšší riziko TEN. Podle tohoto modelu je incidence TEN během 2,5 měsíce u pacientů s nízkým rizikem TEN (skóre = 0) 0,3 %, u pacientů se středním rizikem (skóre = 1–2) 2,0 % a u pacientů s vysokým rizikem TEN (skóre ≥ 3) 6,7 % (8).
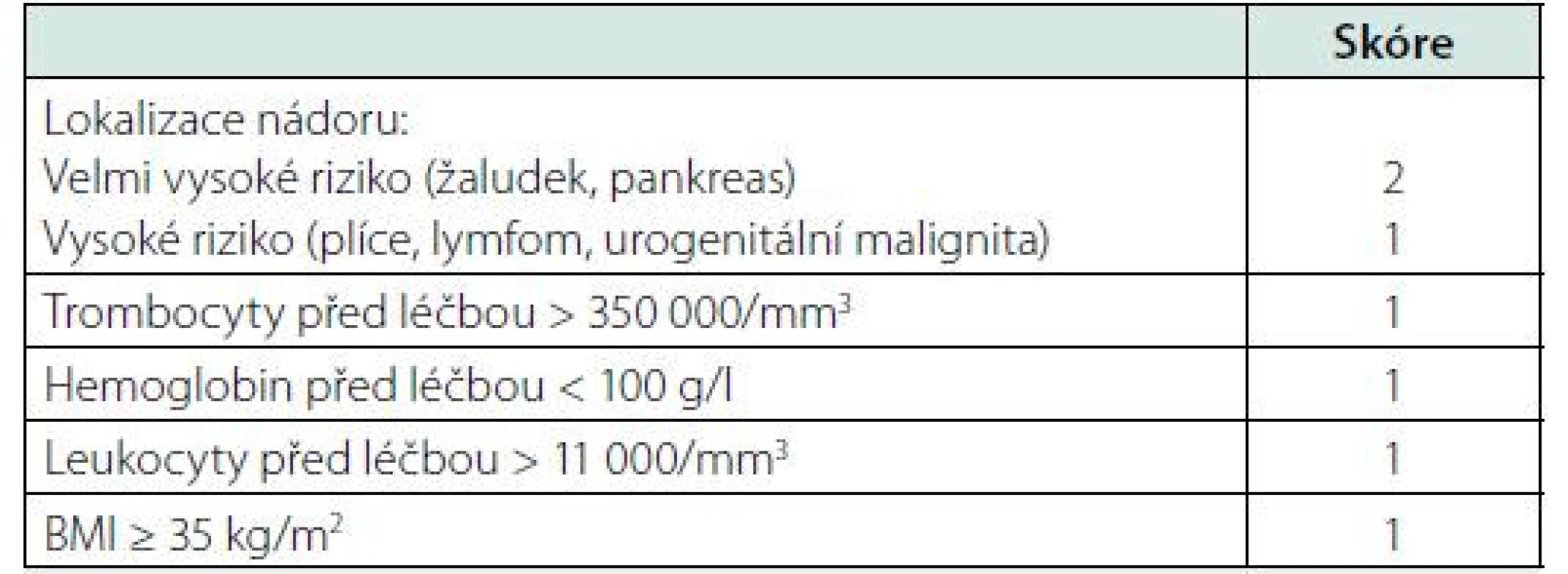
Skóre = 1–2, střední riziko TEN
Skóre ≥ 3, vysoké riziko TEN
Účinnost nízkomolekulárních heparinů (LMWH) v prevenci TEN u ambulantních onkologických pacientů byla poprvé zjišťována dvěma prospektivními, randomizovanými, placebem kontrolovanými, dvojitě slepými studiemi PROTECHT a SAVE‑ONCO. Smíšená populace onkologických pacientů v nich ještě nebyla tříděna podle Khoranova skóre predikce rizika TEN.
Studie PROTECHT zařadila 1 150 ambulantních pacientů s lokálně pokročilými nebo metastazujícími solidními nádory léčenými chemoterapií do skupiny s nadroparinem (n = 769) nebo s placebem (n = 381). Během 180 dnů snížil nadroparin ve srovnání s placebem relativní riziko TEN o 50 % (2 % vs. 3,9 %, RR 0,50; p = 0,02), absolutní riziko TEN o 1,9 % bez signifikantního nárůstu velkého krvácení (9).
Ve studii SAVE‑ONCO bylo 3 212 pacientů na ambulantní chemoterapii pro pokročilé solidní tumory nebo metastázy randomizováno mezi semuloparin (n = 1 608) a placebo (n = 1 604). Léčba s mediánem trvání 3,5 měsíce byla aplikována, dokud nedošlo ke změně v režimu podávání chemoterapie. Ve skupině léčené semuloparinem kleslo relativní riziko TEN ve srovnání s placebem o 64 % (1,2 % vs. 3,4 %, RR 0,36; p < 0,001), absolutní riziko TEN o 2,2 % (10). V obou těchto studiích byl celkový výskyt TEN v placebové skupině poměrně nízký (3–4 %), a přestože relativní riziko TEN pokleslo během 6měsíčního podávání LMWH významně až velmi významně, kleslo absolutní riziko pouze o 2 %.
Přínos primární tromboprofylaxe proto zůstával stále poněkud pochybný a neobjasněný. S příchodem přímých orálních antikoagulancií (DOAC) se v roce 2019 objevily dvě nové primárně preventivní studie. Důležitou změnu přineslo použití Khoranova skóre, validované pro identifikaci onkologických pacientů se zvýšeným rizikem TEN, kteří by mohli z tromboprofylaxe profitovat více než ti ostatní s nižším skóre (Tab. 2).
Randomizovaná, placebem kontrolovaná, dvojitě slepá studie AVERT hodnotila účinnost a bezpečnost apixabanu (2,5 mg 2× denně) v průběhu 180 dnů trvající tromboprofylaxe a 30 dnů navazujícího sledování u onkologických pacientů se středním (63 % pacientů s Khoranovým skóre 2) a vysokým rizikem TEN (22 % pacientů s karcinomem žaludku a pankreatu, Khoranovo skóre ≥ 3) ambulantně léčených systémovou chemoterapií. Apixaban prokázal významný tromboprofylaktický efekt. Relativní riziko TEN ve srovnání s placebem pokleslo v průběhu celého sledování o 59 % (95 % CI = 35–74 %; p < 0,001) a během aktivní léčby o 86 %. Absolutní rozdíl ve výskytu TEN (6 %) byl dán zejména nižším výskytem plicní embolie v apixabanové skupině. Výsledek byl mnohem lepší, než dosáhly hepariny ve studiích PROTECHT a SAVE‑ONCO. Při léčbě došlo k velkému krvácení u 6 pacientů (2,1 %) s apixabanem a u 3 pacientů (1,1 %) v placebové skupině (RR = 1,89; CI = 0,39–9,24) (11).
Ve dvojitě slepé, randomizované studii CASSINI byli systémovou ambulantní chemoterapií léčeni pacienti se středním rizikem (32 % pacientů s Khoranovým skóre 2) a vysokým rizikem TEN (53 % pacientů s karcinomem žaludku a pankreatu, Khoranovo skóre ≥ 3), bez hluboké žilní trombózy (HŽT) vyloučené ultrazvukovým vyšetřením. Nemocní byli náhodně rozděleni do skupiny léčené rivaroxabanem 10 mg/den nebo placebem po dobu 180 dní s klinickými a ultrazvukovými kontrolami každých 8 týdnů. Po léčebné periodě následovalo ještě 30denní sledování. Šestiměsíční podávání rivaroxabanu nesnížilo ve srovnání s placebem signifikantně incidenci TEN ani smrti v důsledku TEN (RR = 0,66; 95 % CI = 0,40–1,09; p = 0,10). Výsledek byl ovšem velmi těsný v neprospěch rivaroxabanu. Příčinou bylo z různých důvodů předčasné ukončení sledování u 47 % pacientů, převážně v placebové větvi. To představovalo významné omezení. Na druhé straně není tento fakt nijak překvapující, pokud si uvědomíme, že se jednalo o nemocné s velmi pokročilým nádorovým onemocněním. V průběhu samotné aktivní léčby (intervenční perioda), kdy byl rivaroxaban skutečně aplikován, bez jakýchkoliv pochybností významně potlačil výskyt TEN (RR = 0,40; 95 % CI = 0,20–0,80; absolutní riziko se snížilo o 3,8 %), i když za cenu nevýznamného zvýšení rizika velkého krvácení (7).
Výsledky studií AVERT a CASSINI odpovídají závěrům dvou předchozích tromboprofylaktických studií PROTECHT a SAVE‑ONCO s nadroparinem a semuloparinem, ale zatímco zde pokleslo absolutní riziko TEN v průběhu aktivní léčby ve srovnání s placebem o 1,9 %, respektive o 2,2 %, ve studii AVERT byl tento rozdíl trojnásobný (6 %) a u CASSINI téměř dvakrát větší (3,8 %). Vysvětlením může být skutečnost, že obě studie s DOAC zahrnuly velký počet pacientů s vysokým rizikem TEN (Khoranovo skóre ≥ 3). Kvalita důkazů ze studií PROTECHT a SAVE‑ONCO pro LMWH je proto hodnocena jako střední (B), zatímco kvalita důkazů ze studií AVERT a CASSINI pro DOAC jako střední až vysoká (B/A) (12). Velké krvácení se objevilo u DOAC signifikantně častěji a šlo na vrub gastrointestinálního a gynekologického krvácení a hematurie. Trápilo proto hlavně pacienty s nádory těchto orgánů.
Délka přežívání byla v léčené i placebové skupině stejná. Odráží to skutečnost, že mnoho pacientů mělo pokročilé onkologické onemocnění, které bylo hlavní příčinou úmrtí, i když prevence TEN by ideálně měla mortalitu snižovat. Rozdíly ve výsledcích mezi studiemi jsou do značné míry podmíněné zastoupením různých typů nádorů, srovnání je proto vždy velmi obtížné. Pokud bychom například z tohoto pohledu porovnali studii CASSINI s rivaroxabanem a studii AVERT s apixabanem, tak v první bylo 53 % pacientů řazeno podle Khoranova skóre do skupiny s vysokým rizikem TEN (karcinom pankreatu a žaludku), ve středním riziku bylo 32 % pacientů. Ve studii AVERT tomu bylo naopak, 22 % pacientů patřilo do skupiny s vysokým rizikem, zatímco 63 % do skupiny se středním rizikem.
Na základě těchto validních dat vydala v srpnu 2019 International Society on Thrombosis and Haemostasis (ISTH) doporučení, podle kterého jsou DOAC (apixaban a rivaroxaban) indikovány v primární tromboprofylaxi u pacientů s rizikovým skóre dle Khorany ≥ 2, ambulantně léčených systémovou chemoterapií, pokud nehrozí lékové interakce a není vysoké riziko krvácení. DOAC by měly být podávány po dobu 6 měsíců od zahájení chemoterapie. Při hrozbě lékových interakcí nebo slizničního krvácení jsou doporučeny LMWH (13).
V dalších klinických situacích doporučuje ASCO (American Society of Clinical Oncology 2019) primární tromboprofylaxi pouze u vybraných skupin onkologických pacientů, kteří jsou buď hospitalizovaní pro akutní interní onemocnění, nebo podstupují jakýkoliv větší operační výkon (14) (Tab. 3).
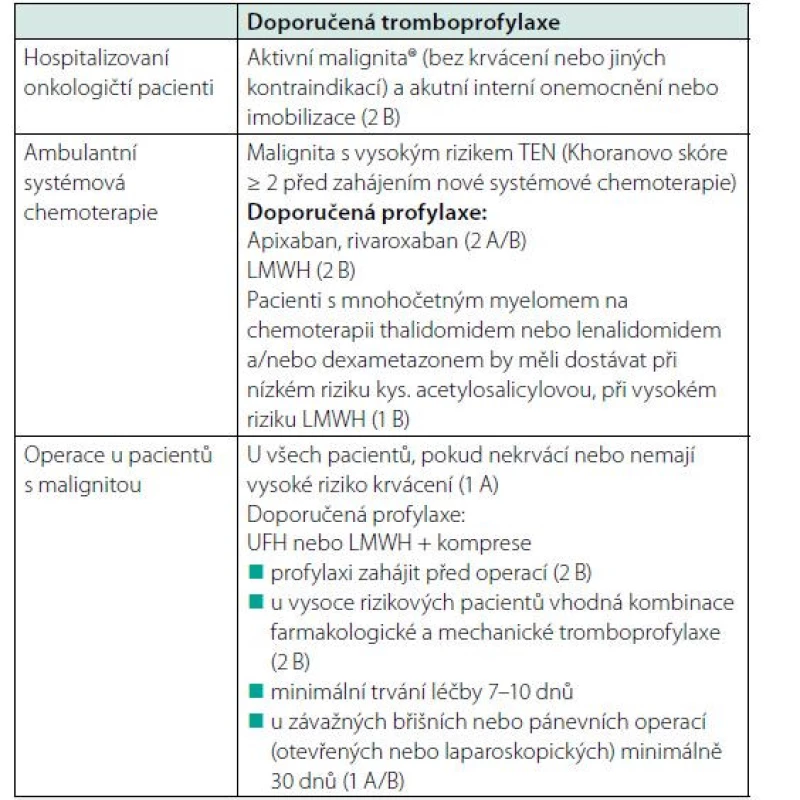
Léčba TEN
TEN může výrazně zkomplikovat onkologickou léčbu, navíc pacienti s nádorem mají významné riziko recidivy TEN bez ohledu na pokračující antikoagulaci. Ještě začátkem 21. století nebyl v léčbě TEN žádný rozdíl mezi neonkologickými a onkologickými pacienty. Po úvodním několikadenním souběžném podávání heparinu (UFH – nefrakcionovaný heparin nebo LMWH) a warfarinu byli pacienti po dosažení terapeutického INR 2–3 ponecháni na monoterapii warfarinem.
Tento přístup se změnil poté, co byla v roce 2003 publikována studie CLOT srovnávající v prevenci recidivy TEN u onkologických pacientů účinnost LMWH dalteparinu s warfarinem. Pacienti byli randomizováni buď k šestiměsíčnímu podávání dalteparinu (200 IU/kg/den 1 měsíc a dále 150 IU/kg/den 5 měsíců), nebo dalteparinu (200 IU/kg/den) po dobu 5–7 dnů a následné šestiměsíční léčbě warfarinem s cílovým INR 2,5. Mezi oběma skupinami nebyl rozdíl v mortalitě, krvácení ani ve výskytu trombocytopenie, ale onkologičtí pacienti měli s dalteparinem asi poloviční pravděpodobnost recidivy TEN (RR = 0,48; 95 % CI = 0,32–0,71, p = 0,002) (15). Metaanalýza několika studií (CATHANOX, CLOT, MAN ‑ LITE, OCENOX, CATCH) tento závěr potvrdila. LMWH ve srovnání s warfarinem snižují riziko recidivy TEN o 40 % (RR = 0,60; 95 % CI = 0,45–0,80) bez rozdílu ve výskytu krvácení (RR = 1,07; 95 % CI = 0,65–1,75, NS) (16).
Na základě těchto výsledků se stala šestiměsíční monoterapie LMWH na několik let první volbou v léčbě paraneoplastické TEN. Léčba se prodlužovala při trvající aktivitě nádoru nebo při jiných dlouhodobých rizikových faktorech. Z praktického hlediska jsou LMWH výhodné, většinou nevyžadují laboratorní kontroly a nemají závažnější interakce s jinými léky a s potravou. Na druhé straně však každodenní aplikace jedné nebo dvou podkožních injekcí po dobu šesti měsíců může být obtěžující a negativně ovlivnit dlouhodobé setrvání na této léčbě. Hledala se proto další alternativa.
Po zavedení DOAC do klinické praxe u neonkologických pacientů se začaly tyto léky, přestože neměly oporu v odborných doporučeních, používat také u nemocných s malignitou. Podle dat z registrů, retrospektivních či observačních studií byla léčba DOAC u paraneoplastické TEN spojená se srovnatelným či nižším výskytem recidivy TEN oproti LMWH, přičemž se výskyt závažného krvácení významně nelišil (17).
Randomizované klinické studie zaměřené na DOAC u onkologických pacientů na sebe nedaly dlouho čekat. Všechna DOAC v nich byla v průběhu šesti až dvanáctiměsíční léčby srovnávána s dalteparinem (200 IU/ kg/den 1. měsíc a dále 150 IU/kg/den 5 měsíců). Studie Hokusai‑VTE Cancer prokázala u akutní symptomatické a asymptomatické (incidentální) TEN nižší tendenci k recidivě v edoxabanové skupině (RR = 0,71; 95 % CI = 0,48–1,06; p = 0,09; absolutní riziko o 3,4 % nižší), ale významně častěji se zde vyskytlo závažné krvácení (RR = 1,77; 95 % CI = 1,03–3,04; p = 0,04; absolutní riziko o 2,9 % vyšší). Subanalýza prokázala, že za nárůstem stojí krvácení z horní části GIT u pacientů s nádory v této oblasti (18). Rivaroxaban ve studii Select‑D byl spojen s významně nižším kumulativním výskytem recidivy TEN (RR = 0,43; 95 % CI = 0,19–0,99; p = 0,09) a s nevýznamným zvýšením velkého (RR = 1,83; 95 % CI = 0,68–4,96) a významným zvýšením malého krvácení (RR = 3,76; 95 % CI = 1,63–8,69) (19). Studie CARAVAGGIO hodnotící apixaban, potvrdila noninferioritu ve srovnání s dalteparinem co do rizika recidivy TEN (RR = 0,63; 95 % CI = 0,37–1,07; p < 0,001) a rovněž bezpečnostní výsledek byl příznivý, bez signifikantního rozdílu v riziku závažného krvácení (RR = 0,82; 95 % CI = 0,40–1,69; p = 0,60) (20).
Podle dnes platných doporučení ASCO z roku 2019 jsou první volbou u paraneoplastické TEN DOAC (apixaban, edoxaban, rivaroxaban) a LMWH. LMWH jsou léky první volby u luminálních nádorů GIT, urogenitálních nádorů (zejména se zvýšeným rizikem krvácení u cystostomie nebo nefrostomie), při aktivní slizniční patologii (ezofagitida, gastroduodenální vřed, gastritida, kolitida), při progresi malignity, pokud pacient trpí nauzeou, zvracením, poruchami střevní absorpce nebo při riziku lékových interakcí. DOAC jsou první volbou u malignit mimo trávicí a urogenitální trakt, pokud nehrozí lékové interakce, není krvácení z GIT nebo závažné renální selhání (14). Všechna odborná doporučení pro léčbu onkologických pacientů s TEN shrnuje tabulka 4 (17).
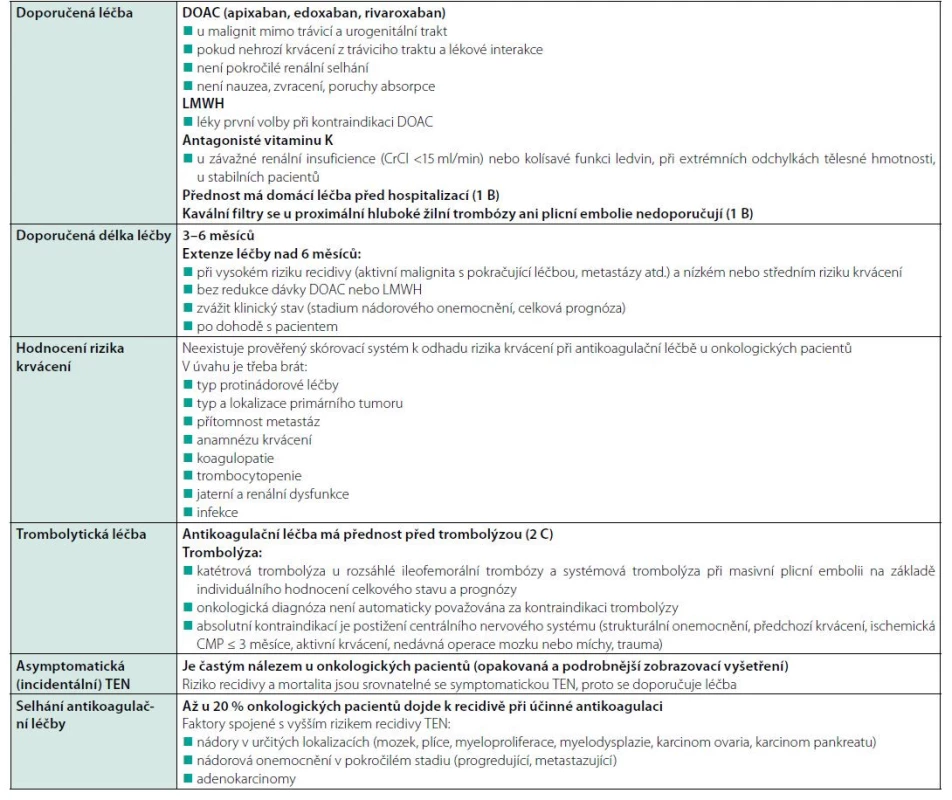
Závěr
U onkologických pacientů je TEN často závažnou komplikací zvyšující morbiditu, mortalitu a léčebné náklady. Paraneoplastická tromboembolická nemoc je dnes druhou nejčastější příčinou smrti u pacientů s nádorem. Proč jsou nádory tak často provázené žilní trombózou, zatím nebylo beze zbytku objasněné. Hlavními rizikovými faktory jsou vlastní nádor, jeho typ, lokalizace, progrese a onkologická léčba.
Ve srovnání s neonkologickými pacienty jsou pacienti s nádorem vystaveni nejenom zvýšenému riziku první tromboembolické příhody, ale také u nich mnohem častěji dochází k recidivě, někdy přes účinnou léčbu. Antikoagulace je spojená s vyšším rizikem krvácení, zejména u nádorů v určitých lokalizacích. U onkologických pacientů je TEN častým náhodným nálezem při zobrazovacích vyšetřeních. Účinná profylaxe a léčba TEN je proto jednou z důležitých cest, jak se vyhnout řadě komplikací a zlepšit nemocným kvalitu života.
Na základě randomizovaných klinických studií s LMWH a DOAC, které proběhly v posledních dvaceti letech, doznala prevence a léčba paraneoplastické TEN významných změn. Primární tromboprofylaxe je v současné době doporučena pouze u vybraných skupin onkologických pacientů, kteří jsou buď hospitalizovaní pro akutní interní onemocnění, nebo imobilizovaní a mají aktivní malignitu, podstupují ambulantní systémovou chemoterapii pro malignitu s vysokým rizikem TEN (Khoranovo skóre ≥ 2) nebo operační výkon a současně nemají vysoké riziko krvácení.
V léčbě jsou dnes první volbou DOAC (apixaban, edoxaban, rivaroxaban) a LMWH. U LMWH máme nejvíc důkazů a zkušeností. Jsou preferovány u slizničních tumorů, při vysokém riziku krvácení, u progredující malignity, při současné emetogenní terapii a dyspeptických potížích. U závažné renální insuficience (CrCl < 15 ml/min) mají stále své místo antagonisté vitaminu K (warfarin).
Při výběru pacientů pro léčbu DOAC je třeba pečlivě dbát o to, aby nehrozilo slizniční krvácení z nádorových i nenádorových příčin, nedocházelo k lékovým interakcím a nešlo o pokročilé selhání ledvin. Léčba by měla být individualizována, zohledňovat celkový stav pacienta, jeho prognózu, osobní preference a přání.
KORESPONDENČNÍ ADRESA AUTORA:
doc. MUDr. Dalibor Musil, Ph.D.
Interní a kardiologická klinika Fakultní nemocnice Ostrava a LF Ostravské univerzity
17. listopadu 1790/5, 708 00 Ostrava-Poruba
Cit. zkr: Vnitř Lék. 2022;68(2):111-115
Článek přijat redakcí: 20. 12. 2021
Článek přijat po recenzích: 23. 2. 2022
Sources
1. Trousseau A. Phlegmasia alba dolens. Clinique Medicale de L’Hotel‑Dieu de Paris 1865;3 : 490-515.
2. Ikushima S, Ono R, Fukuda K et al. Trousseau’s syndrome: cancer‑associated thrombosis. Jpn J Clin Oncol. 2016;46 : 204-208.
3. Khorana AA, Dalal M, Lin J, Connolly GC. Incidence and predictors of venous thromboembolism (VTE) among ambulatory high‑risk cancer patients undergoing chemotherapy in the United States. Cancer 2013;119 : 648-655.
4. Horsted F, West J, Grainge MJ. Risk of venous thromboembolism in patients with cancer: a systematic review and meta‑analysis. PLoS Med. 2012;9(7):e1001275.
5. Lyman GH, Eckert L, Wang Y et al. Venous thromboembolism risk in patients with cancer receiving chemotherapy: a real‑world analysis. Oncologist. 2013;18 : 1321-1329.
6. Connors JM. Prophylaxis against venous thromboembolism in ambulatory patients with cancer. N Engl J Med. 2014;370 : 2515-2519.
7. Khorana AA, Soff GA, Kakkar AK et al. Rivaroxaban for thromboprophylaxis in high‑risk ambulantory patients with cancer. N Engl J Med. 2019;380 : 720-728.
8. Khorana AA, Kuderer NM, Culakova E et al. Development and validation of a predictive model for chemotherapy‑associated thrombosis. Blood. 2008;111 : 4902-4907.
9. Agnelli G, Gussoni G, Bianchini C et al. Nadroparin for the prevention of thromboembolic events in ambulatory patients with metastatic or locally advanced solid cancer receiveng chemotherapy: a randomised, placebo‑controlled, double‑blind study. Lancet Oncol. 2009;10 : 943-349.
Další literatura u autora a na www.casopisvnitrnilekarstvi.cz
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Internal Medicine

2022 Issue 2
-
All articles in this issue
- Editorial
- Prediabetes
- Co nového přinášejí ADA standardy péče o pacienty s diabetem z roku 2022?
- Orální semaglutid – Rybelsus®, první agonista GLP-1 receptoru pro perorální použití v klinické praxi
- SGLT-2 inhibitory a jejich uplatnění v praxi – update 2022
- Co internistům přinášejí nová doporučení ESC pro léčbu srdečního selhání 2021?
- Antikoagulace u onkologických pacientů, nová doporučení na základě randomizovaných klinických studií
- Kolorektální karcinom u pacientů s diabetes mellitus – epidemiologie, patofyziologie a implikace pro praxi
- Co čekat od silnějšího dulaglutidu?
- Incidentalomy hypofýzy
- Možnosti farmakologického využití vitaminu C v onkologii
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue
- Orální semaglutid – Rybelsus®, první agonista GLP-1 receptoru pro perorální použití v klinické praxi
- SGLT-2 inhibitory a jejich uplatnění v praxi – update 2022
- Antikoagulace u onkologických pacientů, nová doporučení na základě randomizovaných klinických studií
- Prediabetes
