Časná diagnostika systémové sklerodermie
Early diagnosis of systemic scleroderma
Systemic scleroderma (SSc) is a systemic immune-mediated connective tissue disease characterized by fibroproductive changes in connective tissue and microvascular disorders. The disease affects the skin, musculoskeletal system and internal organs. It is a disease with a significant rate of morbidity and mortality, significantly worsening the quality of life of patients. Early initiation of therapy is necessary to prevent disease progression. This review article discusses the current possibilities of early diagnosis of systemic scleroderma.
Keywords:
diagnostics – early forms of scleroderma – systemic scleroderma
Authors:
Adéla Skoumalová 1; Pavel Horák 1; Zuzana Heřmanová 2; Jakub Videman 1; Andrea Smržová 1; Viktor Palla 3
Authors‘ workplace:
III. interní klinika – nefrologická, revmatologická a endokrinologická, FN a LF UP Olomouc
1; Ústav imunologie, FN a LF UP Olomouc
2; Klinika chorob kožních a pohlavních, FN a LF UP Olomouc
3
Published in:
Vnitř Lék 2022; 68(5): 285-289
Category:
Main Topic
doi:
https://doi.org/10.36290/vnl.2022.061
Overview
Systémová sklerodermie (SSc) je systémové imunitně mediované onemocnění pojiva charakterizované fibroproduktivními změnami v pojivové tkáni a mikrovaskulárními poruchami. Onemocnění postihuje kůži, pohybový aparát a vnitřní orgány. Jedná se o onemocnění s vysokou mírou morbidity a mortality, výrazně zhoršující kvalitu života pacientů. Pro zabránění progrese choroby je nutné včasné zahájení terapie. Tento přehledový článek se věnuje současným možnostem časné diagnostiky systémové sklerodermie.
Klíčová slova:
diagnostika – systémová sklerodermie – časné formy sklerodermie
Úvod
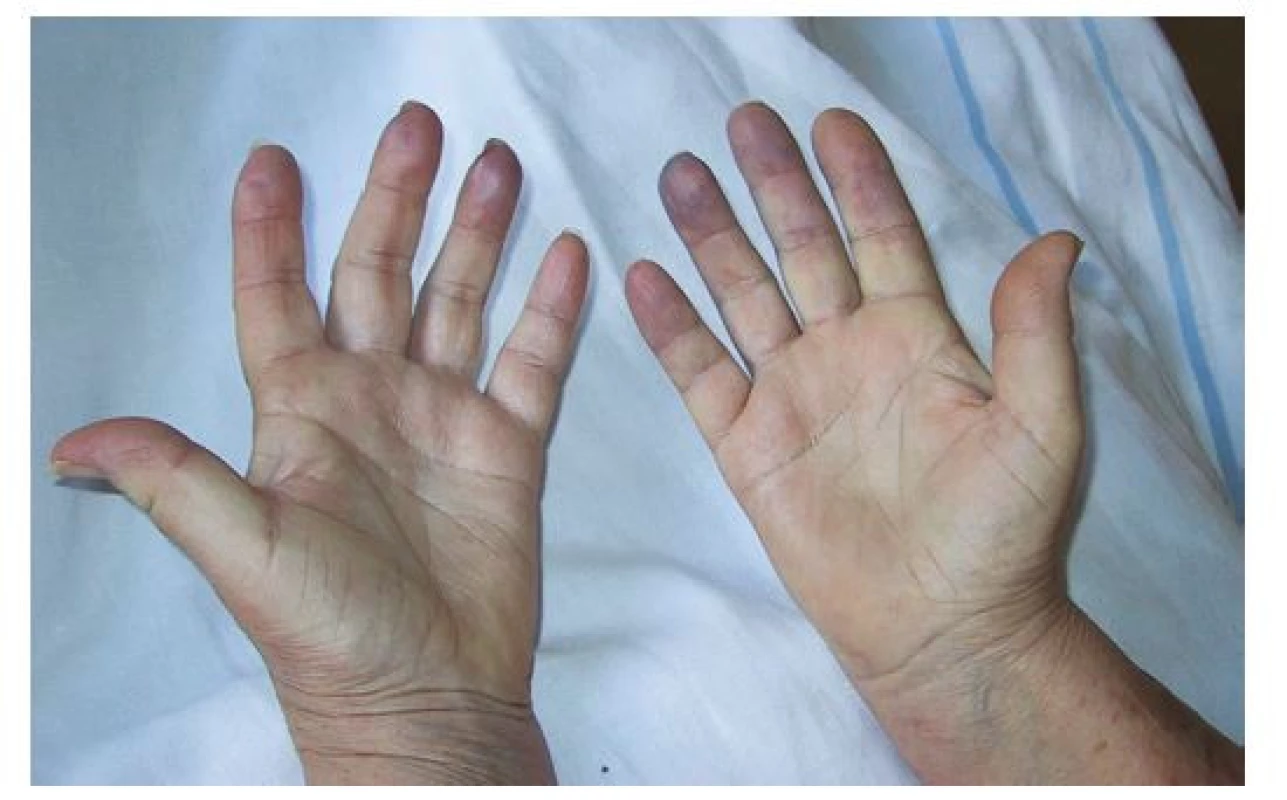
Systémová sklerodermie (SSc) je systémové imunitně mediované onemocnění pojiva charakterizované fibroproduktivními změnami v pojivové tkáni a vaskulárními poruchami. Onemocnění postihuje kůži, pohybový aparát a vnitřní orgány. Jedná se o onemocnění se značnou mírou morbidity a mortality, výrazně zhoršující kvalitu života pacientů (1). Postihuje 3–8× častěji ženy než muže, manifestuje se obvykle v mladším a středním věku. Udávaná prevalence činí 4–253 případů na milion a roční incidence 3–19 případů na milion. (2). Klinický obraz může být značně heterogenní, avšak nejčastěji se onemocnění projevuje Raynaudovým fenoménem (RF, Obr. 1), který bývá jednou z prvních manifestací choroby, následovaný kožními změnami, ke kterým se později přidává orgánové postižení (plíce, gastrointestinální trakt, kardiovaskulární systém).
Klinické manifestace
Kůže
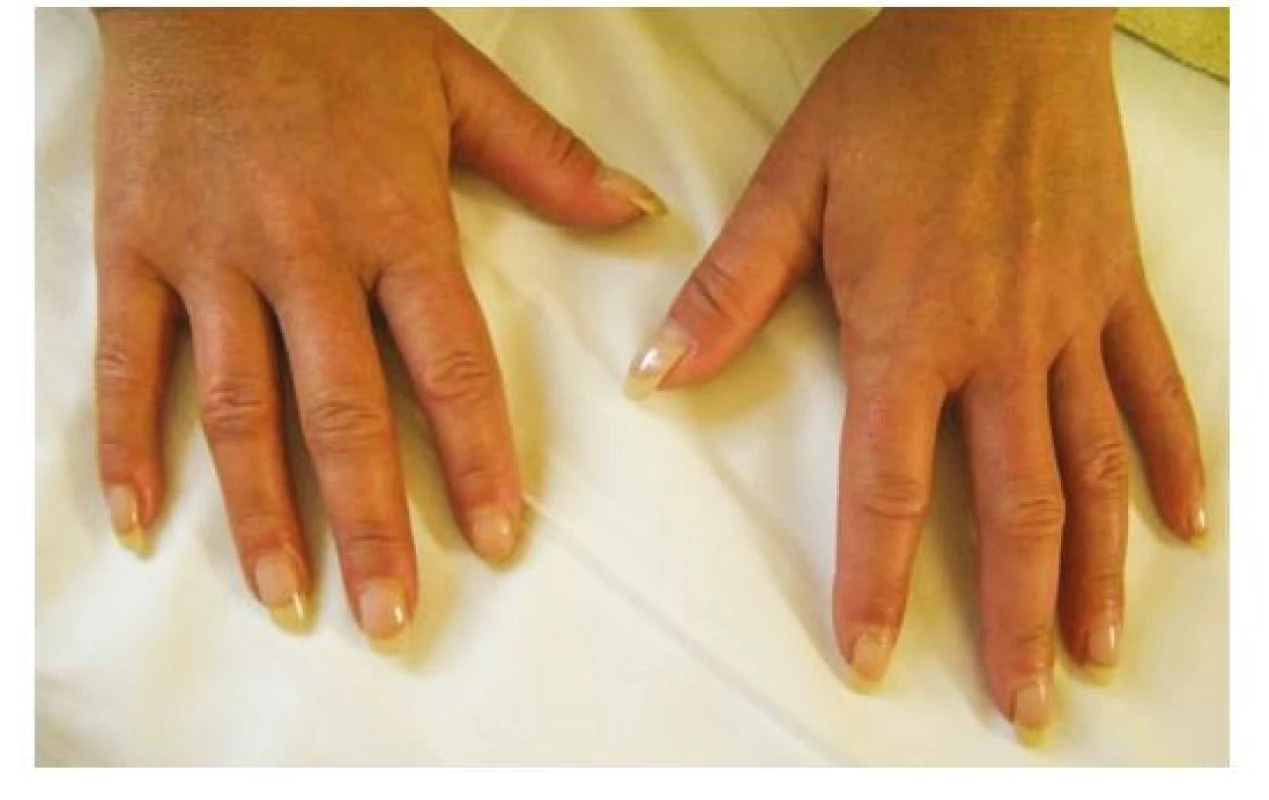
Sklerodermie je stav tuhnutí kůže způsobené fibrotizací podkoží. Obecně jsou rozlišovány dvě formy postižení: lokalizovaná a systémová forma. Lokalizovaná forma má širokou diferenciální diagnostiku, tento článek se jí dále nevěnuje. Systémová forma predilekčně postihuje kůži rukou, předloktí a obličeje. Podle rozsahu postižení se dále systémová sklerodermie dělí na několik podtypů (viz níže) (2). V časné fázi onemocnění může docházet k rozvoji otoku v oblasti prstů, které jsou podkladem vzniku tzv. „puffy fingers“ (Obr. 2). Následně dochází k fibrotizaci podkoží a vzniku sklerodaktylií.
Formy systémové sklerodermie
• limitovaná forma (lcSSc) – s postižením kůže distálně od loktů a kolen, případně i s postižením tváře a krku
• difúzní forma (dcSSc) – s celotělovým postižením kůže, obvykle rychleji progredující forma onemocnění, častěji asociovaná s intersticiálním plicním postižením a s horší prognózou
• SSc sine scleroderma (ssSSc) – forma onemocnění bez typického postižení kůže
• SSc v rámci překryvných syndromů – současně diagnostikovaná SSc a jiné revmatické onemocnění (SLE, revmatoidní artritida, myositida)
• nediferencované onemocnění pojiva
Cévní
Časným projevem onemocnění bývá záchvatovitá porucha prokrvení aker (nejčastěji prstů rukou, nohou) označovaná jako Raynaudův fenomén (RF) – jako první příznak SSc se projevuje u 95 % pacientů. (3). Vzniká na podkladě vazokonstrikce vyvolané chladem či stresovým podnětem, kdy v postižené oblasti dochází k barevným změnám, kůže mění barvu na bledou bílou či žlutavou, po odeznění konstrikce dochází k překrvení a zčervenání. RF může postihovat až 5 % populace (4), je proto nutné rozlišovat jeho primární a sekundární formu. Primární onemocnění vzniká pouze na podkladě zvýšené tendence k vazospasmům. Sekundární forma se rozvíjí na podkladě systémového onemocnění pojiva (nejčastěji SSc). Vzhledem k možnosti rozvoje RF jako prvního projevu SSc jsou v algoritmu časné diagnostiky osoby s výskytem RF indikovány k dalšímu došetření.
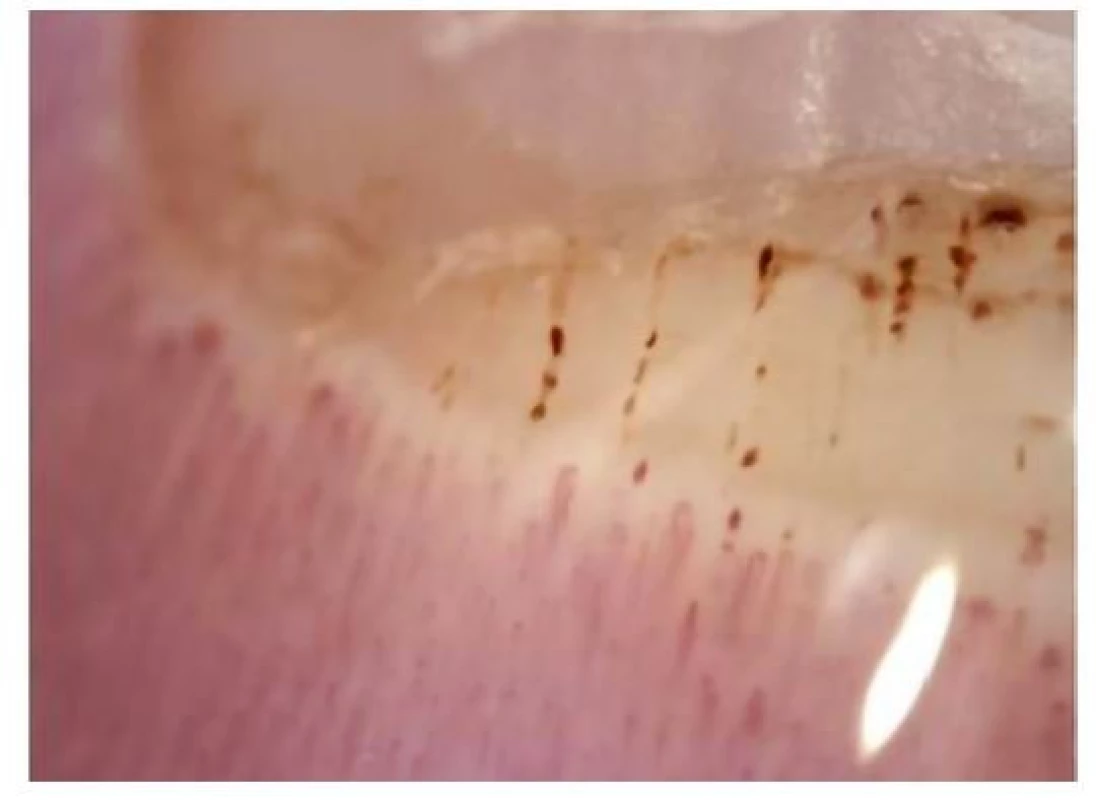
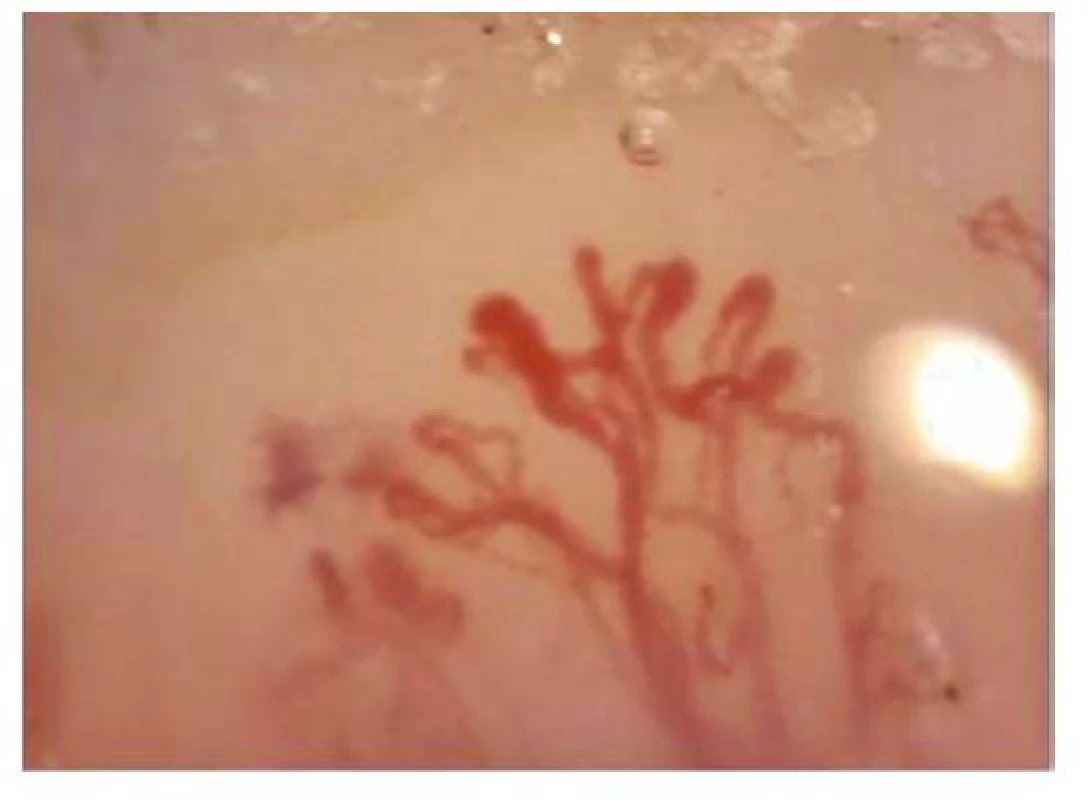
Na podkladě poruchy cévního zásobení se mohou tvořit digitální ulcerace, typické jsou ragády na koncích prstů označované jako defekty charakteru krysího kousnutí. K objektivizaci postižení malých cév se využívá kapilaroskopické vyšetření nehtových valů. Při vyšetření nacházíme typické změny: snížený počet kapilár na 1 mm pole, poruchu uspořádání a dilataci kapilár (Obr. 4), mikrohemoragie z kapilár (Obr. 5), následné avaskulární zóny a novotvorba kapilár (Obr. 6) (5). V rámci mikrovaskulárního postižení dochází také k dilataci kapilár v obličeji a vzniku teleangiektázií.
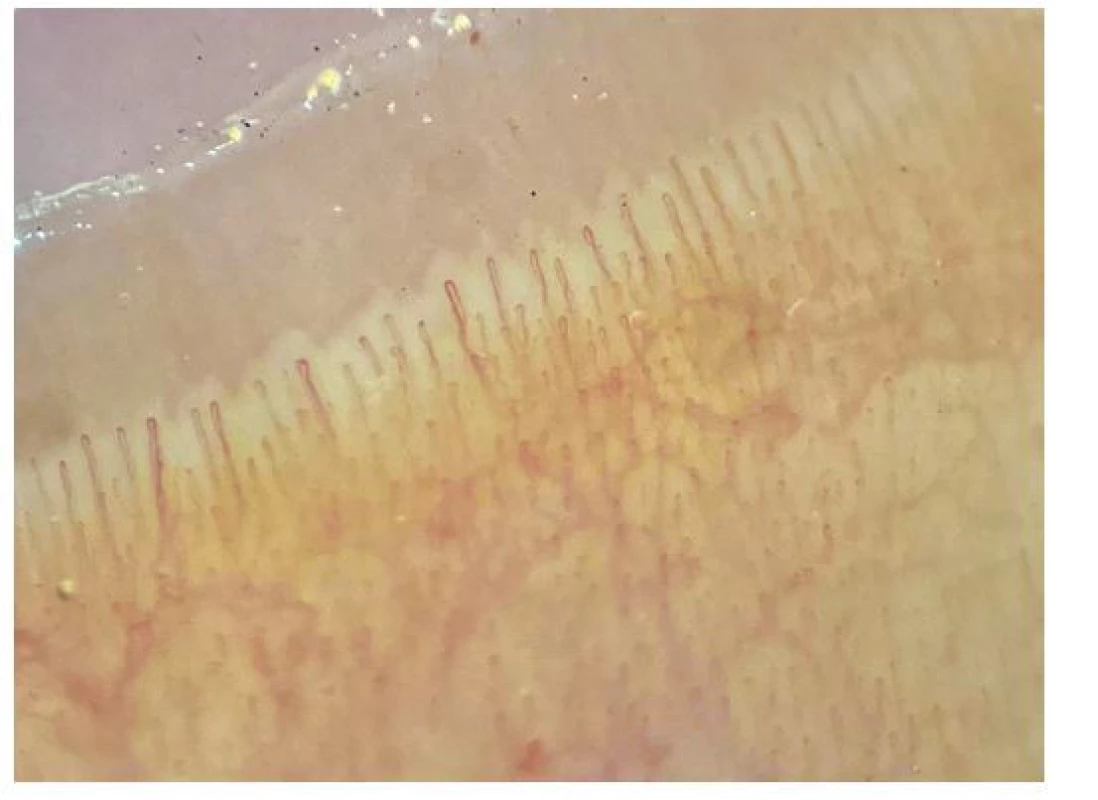
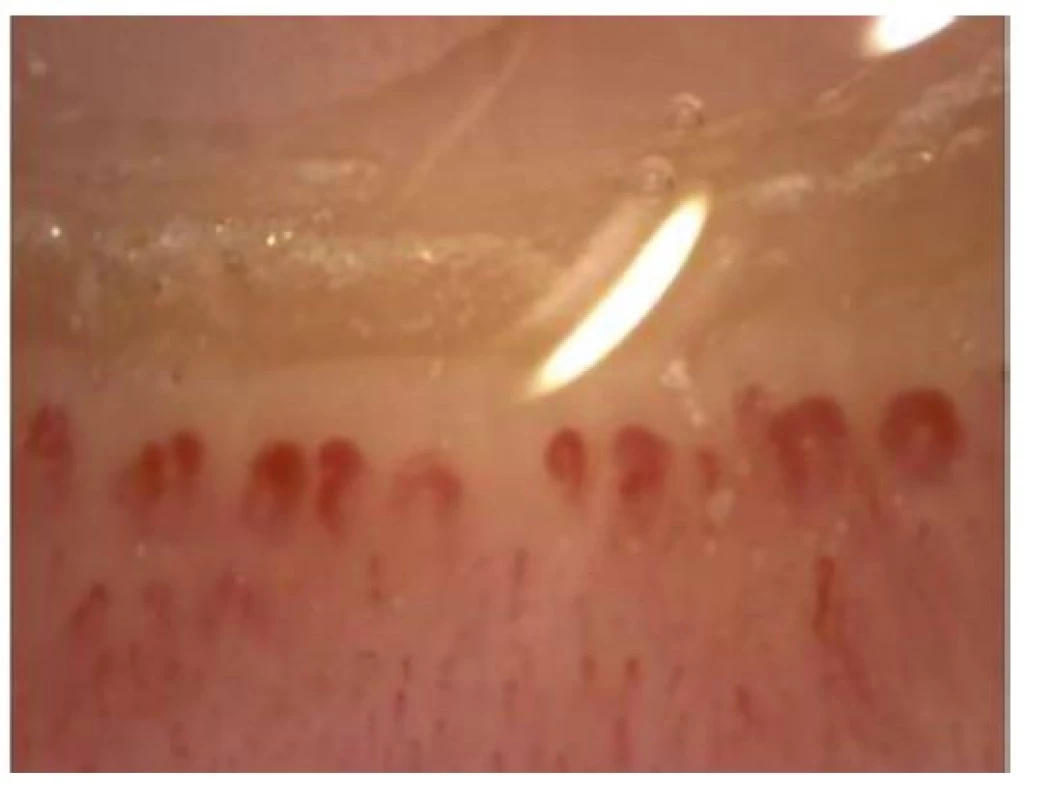
Srdce
Plicní arteriální hypertenze (PAH) při SSc významně ovlivňuje mortalitu pacientů. Vyskytuje se ve formě primární při postižení plicních cév i ve formě sekundární v rámci postižení plicního intersticia. Udávaná prevalence PAH je 10–15 %. Medián dožití pacientů se SSc a PAH je 1–3 roky, pokud se současně vyskytne i intersticiální plicní postižení, pak je prognóza ještě 5× horší (6).
K dalším možným kardiálním postižením v rámci SSc patří fibrotizace myokardu, při které může docházet k poruchám systolické i diastolické funkce srdce a k poruchám rytmu. Vyskytuje se i postižení perikardu ve formě perikarditidy a také patologie srdečních chlopní.
Plíce
Plicní postižení se vyskytuje až u 80 % nemocných se SSc. Pro onemocnění je typické intersticiální plicní postižení. Spolu s plicní arteriální hypertenzí vede až k 60 % úmrtí spojených se SSc. K intersticiálnímu postižení se v poslední době obrací velká pozornost vzhledem k novým terapeutickým možnostem – použití biologické (rituximab, tocilizumab) či antifibrotické terapie (nintedanib, pirfenidone) (7, 8). Mimo postižení intersticiálním procesem jsou nemocní se SSc ohrožení aspirační pneumonií (při postižení GIT), dále pak tromboembolickou chorobou, spontánními pneumothoraxy či malignitami (9).
Ledviny
V minulosti obávaná a relativně častá sklerodermická renální krize je v současné době vzácná díky terapii ACE inhibitory. Prevalence je 5 % u dcSSc a 2 % u lcSSc (10). Dříve příčina až 42 % úmrtí spojených se SSc, nyní se podílí přibližně na 6 % úmrtí (6). Nicméně ve vzácných případech může být stále první manifestací choroby.
Sklerodermická renální krize je charakterizována nově vzniklou hypertenzí s hodnotami krevního tlaku nad 140/90 mm Hg či zvýšením výchozího systolického tlaku o více než 30 mm Hg (nebo více než 20 mm Hg diastolického), doprovázenou akutním renálním poškozením s elevací sérového kreatininu anebo oligoanurií. Současně se může vyskytnout hemolytická anemie. Méně často dochází pouze k izolovanému renálnímu poškození bez rozvoje hypertenze, tzv. normotenzní renální krizi. Ve zvýšeném riziku vzniku sklerodermické renální krize jsou pacienti s difuzní či rychle progredují formou onemocnění a v časné fázi onemocnění. Dalším rizikovým faktorem je užívání kortikosteroidů ve středních a vyšších dávkách (>15 mg Prednisonu či ekvivalent), proto se tyto dávky obvykle v terapii SSc nepodávají. (11). Ačkoli se ACE inhibitory u sklerodermické renální krize používají s dobrým efektem terapeuticky pro zvládnutí samotného stavu i asociované hypertenze, jejich profylaktické podávání se nedoporučuje vzhledem k popisovanému možnému zvýšenému riziku rozvoje renální krize (12).
Gastrointestinální trakt (GIT)
Postižení gastrointestinálního traktu je velmi časté, vyskytuje se až u 95 % nemocných a podílí se až na 12 % úmrtí při SSc. U 10 % postižených je přítomno již při stanovení diagnózy a výrazně zhoršuje kvalitu života pacientů. Může docházet k postižení všech etáží zažívacího traktu. Dochází k poruše motility GIT, poruchám polykání, poruše evakuace žaludku, syndromu bakteriálního přerůstání v tenkém střevě, anorektálním poruchám. Mezi klinické projevy postižení GIT patří malabsorpce, gastroesofageální reflux, nauzea, zvracení, průjem či zácpa (13).
Pohybový aparát
SSc je v 46 až 95 % doprovázena postižením muskuloskeletálního systému, což je pro nemocné se SSc výrazně omezující a invalidizující. Častěji se vyskytuje u difuzní formy SSc (14). Onemocnění bývá doprovázeno artralgiemi, méně často i artritidami, tuhostí rukou a nohou, případně i flekčními kontrakturami, a také svalovou slabostí, zejména proximálních svalových skupin (15). Můžeme se setkat i s překryvnými syndromy systémové sklerodermie a revmatoidní artritidy či myositidy (2, 14).
Problematika časné diagnózy
Vzhledem k faktu, že rychlé zahájení terapie je důležité k zabránění progrese choroby, je nutné SSc diagnostikovat již v časné fázi onemocnění. Rozvinuté onemocnění má obvykle již typický klinický obraz, často jsou přítomné i orgánové změny. Přestože se onemocnění může zpočátku projevit širokou škálou příznaků, mezi nejčastější patří RF a GE reflux (16). Právě časná přítomnost RF vedla k vypracování doporučení pro diagnostiku časné formy systémové sklerodermie.
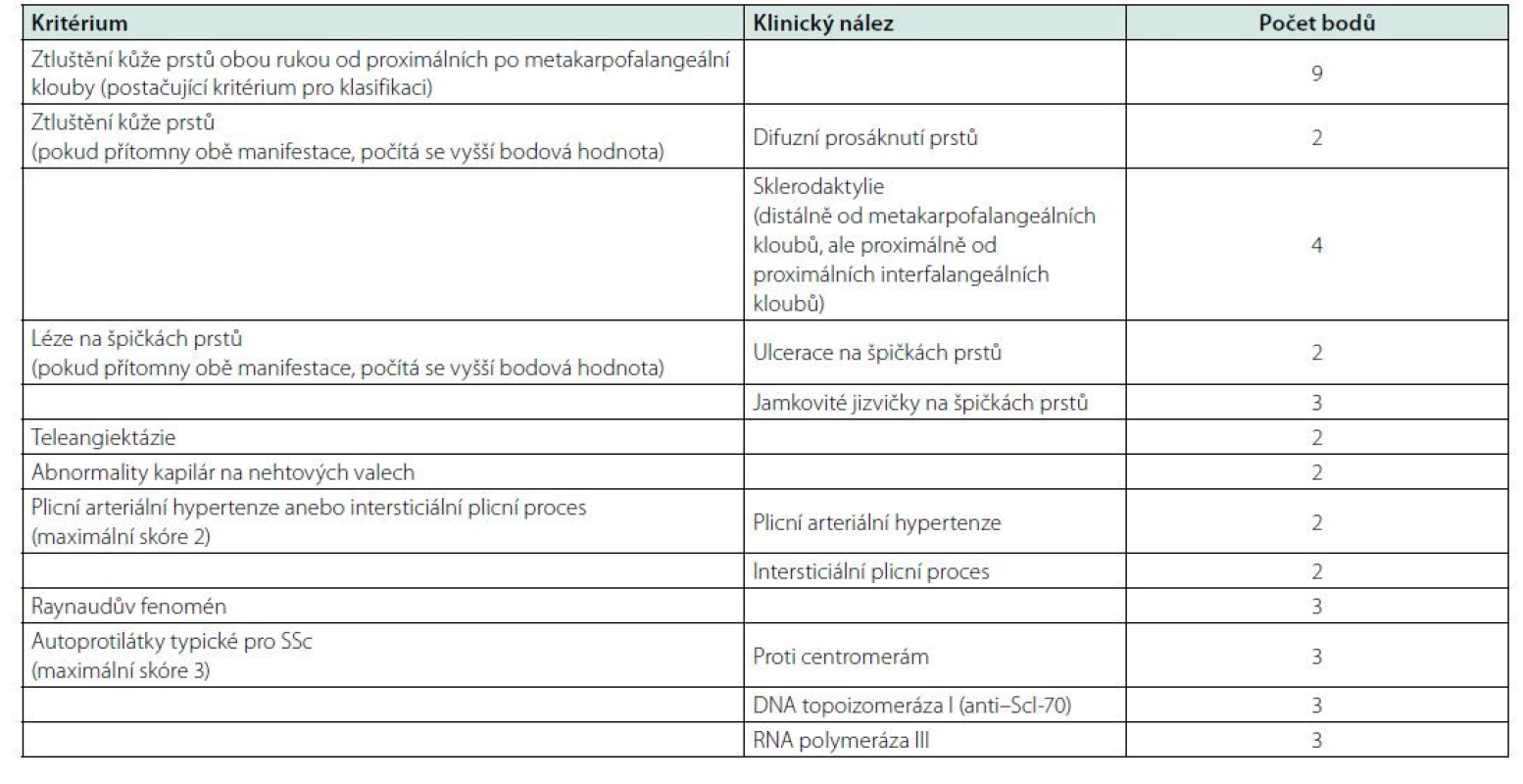
Pro systémovou sklerodermii doposud neexistují diagnostická kritéria, nicméně se pro tento účel využívají klasifikační kritéria Americké revmatologické společnosti a Evropské ligy proti revmatismu (American College for Rheumatolgy and The European League Against Rheumatism, ACR a EULAR) z roku 2013 (17). Skládají se z několika bodově ohodnocených kritérií, pro klasifikaci choroby jako SSc je třeba získání alespoň 9 bodů (Tab. 1).
Pro možnost časné diagnostiky choroby, kdy pacient nesplňuje klasifikační kritéria, byl vypracován algoritmus v rámci projektu VEDOSS (Very Early Diagnosis of Systemic Sclerosis) EUSTAR multicentre study (18). Tento algoritmus zdůrazňuje potřebu sledování pacientů s RF, s difúzním prosáknutím prstů (tzv. „puffy fingers“) a pozitivními antinukleárními (ANA) protilátkami. Na základě jejich přítomnosti je doporučen další postup a došetření (schéma 1, upraveno dle (18)).

Výchozím bodem algoritmu je klinické podezření na možnou diagnózu systémové sklerodermie. K tomuto podezření by měla vést přítomnost tří varovných signálů („red flags“): Raynaudůva fenoménu, „puffy fingers“, pozitivity ANA protilátek. V případě přítomnosti těchto varovných signálů je doporučeno doplnění kapilaroskopického vyšetření a vyšetření specifických protilátek (anticentromerové, anti‑Scl70/ topoizomeráza I, anti‑RNA polymeráza III) (Obr. 7). Pokud je pozitivní alespoň jedno z uvedených vyšetření, stav je uzavřen jako velmi časná SSc a jsou indikována další vyšetření ke zhodnocení případného orgánového postižení. V rámci tohoto došetření je doporučeno funkční vyšetření plic, HRCT plic a jícnová manometrie. Dle výsledku provedených vyšetření zahajujeme adekvátní terapii. Pokud není zjištěno orgánové postižení, pak je pacient indikován k pravidelnému sledování. Přesná frekvence kontrol u časné sklerodermie není stanovena, nicméně při terapii sklerodermie je doporučováno opakování plicních funkčních testů (spirometrie, DLCO) každých 6 měsíců v prvních 6 letech nemoci, dle výsledku opakování HRCT plic. Provedení jícnové manometrie je indikováno na podkladě klinických příznaků postižení horního GIT a dále je doporučeno každoroční echokardiografické vyšetření. Při suspekci na PAH je doplňováno vyšetření natriuretických peptidů (BNP), ventilačně perfúzní scintigrafie plic a případně pravostranná srdeční katetrizace. K posouzení postižení plic se výběrově doplňuje i bronchoalveolární laváž (BAL). Jícnovou manometrii lze nahradit scintigrafickým vyšetřením jícnu, další vyšetření pak zahrnují pH‑metrii a endoskopické vyšetření horního GIT (2).
Krok 1: Klinické podezření – „red flags“
• Raynaudův fenomén
• Difuzní prosáknutí prstů
• Pozitivita antinukleárních protilátek
Krok 2: Diagnostika
• Kapilaroskopické vyšetření
• Vyšetření specifických protilátek: anticentromerové, anti‑Scl70/ topoizomeráza I, anti‑RNA polymeráza III
Krok 3: Zhodnocení orgánového postižení
• Funkční vyšetření plic (spirometrie, DLCO)
• HRCT
• Jícnová manometrie
Závěr
Systémová sklerodermie je onemocnění se závažnou prognózou. K zabránění progrese onemocnění je důležitá včasná diagnostika a zahájení terapie. Zvláštní pozornost bychom proto měli věnovat osobám, u kterých se vyskytne Raynaudův fenomén, otoky prstů charakteru „puffy fingers“ a u kterých byla zjištěna pozitivita antinukleárních protilátek. U těchto pacientů je indikováno další došetření a pravidelné sledování.
Podpořeno MZ ČR RVO FNOL-0098892 a grantem IGA_LF_2022_03
KORESPONDENČNÍ ADRESA AUTORKY:
MUDr. Adéla Skoumalová
III. interní klinika – nefrologická, revmatologická a endokrinologická, FN a LF UP Olomouc
I. P. Pavlova 6, 725 00 Olomouc
Cit. zkr: Vnitř Lék. 2022;68(5):285-289
Článek přijat redakcí: 31. 5. 2022
Článek přijat po recenzích: 1. 7. 2022
Sources
1. Assassi S, Del Junco D, Sutter K et al. Clinical and genetic factors predictive of mortality in early systemic sclerosis. Arthritis Rheumatism. 2009;61 : 1403-1411.
2. Bečvář R, Soukup T, Štork J et al. Doporučení České revmatologické společnosti pro diagnostiku systémové sklerodermie. Česká Revmatologie. 2014;22, č. 2.
3. Gemma Lepri, Silvia Bellando Randone, Marco Matucci Cerinic et al. Early diagnosis of systemic sclerosis, where do we stand today?, Expert Review of Clinical Immunology. 2022, 18 : 1,1-3. Available from DOI: < https://doi.org/10.1080/1744666X.2022.2015327>
4. Ariane L. Herrick, Fredrick M. Wigley. Raynaud’s phenomenon, Best Practice & Research Clinical Rheumatology. 2020, Volume 34, Issue 1, 1521-6942.
5. Soukup T et al. Systémová sklerodermie v roce 2017. Vnitř Lék 2018; 64(2):146-154.
6. Poudel DR, Jayakumar D, Danve A et al. Determinants of mortality in systemic sclerosis: a focused review. Rheumatology International, 2017;38(10),1847-1858.
7. Horák P, Žurková M, Skoumalová A et al. Rozšiřující se možnosti léčby intersticiálního plicního postižení u systémových onemocnění pojiva. Remedia 2022;32 : 12-20.
8. Roofeh D, Lescoat A, Khanna D. Treatment for systemic sclerosis‑associated interstitial lung disease. Current Opinion in Rheumatology, 2021; 33(3),240–248. Available from DOI: https:// doi.org/10.1097/bor.0000000000000795
9. Perelas A, Silver RM, Arrossi AV et al. Systemic sclerosis‑associated interstitial lung disease. Lancet Respir Med. 2020; 8(3):304-320. Available from DOI: <https://doi.org/10.1016/S2213-2600(19)30480-1>
10. Shanmugam VK, Steen VD. Renal disease in scleroderma: an update on evaluation, risk stratification, pathogenesis and management. Curr Opin Rheumatol. 2012;24(6):669-676. Available from DOI: <https://doi.org/10.1097/BOR.0b013e3283588dcf>
11. Woodworth TG, Suliman YA., LW, Furst DE, Clements P. Scleroderma renal crisis and renal involvement in systemic sclerosis. Nature Reviews Nephrology. 2016;12(11),678-691. Available from DOI: https://doi.org/10.1038/nrneph.2016.124
12. Adler S, Varisco P, Distler O et al. SAT0508 Ace‑inhibitors in arterial hypertension in ssc patients display a risk factor for scleroderma renal crisis – a eustar analysis. Ann Rheum Dis 2018; 77 : 1110.
13. Frech TM, Mar D. Gastrointestinal and Hepatic Disease in Systemic Sclerosis. Rheum Dis Clin North Am. 2018;44(1):15-28. Available from DOI: <https://doi.org/10.1016/j.rdc.2017. 09. 002>
14. Morrisroe KB, Nikpour M, Proudman SM. Musculoskeletal Manifestations of Systemic Sclerosis. Rheumatic Disease Clinics of North America, 2015; 41(3),507-518. Available from DOI: <https://doi.org/10.1016/j.rdc.2015. 04. 011>
15. Randone SB, Guiducci S, Cerinic MM. Musculoskeletal involvement in systemic sclerosis. Best Practice & Research Clinical Rheumatology, 2008;22(2), 339-350. Available from DOI: <https://doi.org/10.1016/j.berh.2008. 01. 008 >
16. Denton CP, Khanna D. Systemic sclerosis. Lancet. 2017;390(10103):1685-1699. Available from DOI: < https://doi.org/10.1016/S0140-6736(17)30933-9>
17. van Den Hoogen F, Khanna D, Fransen J et al. 2013 classification criteria for systemic sclerosis: an American College of Rheumatology/European league against rheumatism collaborative initiative. Ann Rheum, DiS. 2013;72(11):1747-1755.
18. Avouac J, Fransen J, Walker U et al. Preliminary criteria for the very early diagnosis of systemic sclerosis: results of a Delphi Consensus Study from EULAR Scleroderma Trials and Research Group. Annals of the Rheumatic Diseases. 2010;70(3),476-481. Available from DOI: <https://doi.org/10.1136/ard.2010.136929>
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Internal Medicine

2022 Issue 5
-
All articles in this issue
- Hlavní téma – Aktuality v revmatologii
- Treatment of giant cell arteritis – current approach and new possibilities
- What is new in the treatment of Systemic Lupus Erythematosus?
- News in the treatment of axial spondyloarthritis
- Early diagnosis of systemic scleroderma
- Diffuse alveolar hemorrhage as a life‑ threatening manifestation of newly diagnosed granulomatosis with polyangiitis following COVID-19 infection – a case report
- What’s new in 2021 ESC Guidelines on cardiovascular disease prevention in clinical practice?
- Why take organ damage in hypertension seriously?
- Inflammation and vascular diseases
- Time in range: new parameter to evaluate blood glucose control
- What’s new in 2020 ESC Guidelines for the management of acute coronary syndromes in patients presenting without persistent ST‑ segment elevation?
- Differential diagnosis of back pain
- Entresto (sakubitril-valsartan) získalo prestižní mezinárodní Galénovu cenu za nejlepší farmaceutický produkt pro rok 2022
- XXXIX. dny mladých internistů v Martině
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue
- Differential diagnosis of back pain
- Early diagnosis of systemic scleroderma
- What’s new in 2021 ESC Guidelines on cardiovascular disease prevention in clinical practice?
- What is new in the treatment of Systemic Lupus Erythematosus?
