Prvé použitie podkožného C1 inhibítora v profylaxii atakov hereditárneho angioedému u tehotných pacientok na Slovensku
Initial use of subcutaneous plasma-derived C1 inhibitor in prophylaxis of acute attacks of hereditary angioedema in pregnant patients in Slovakia
Hereditary angioedema (HAE) is a rare, inborn disease manifested with recurrent attacks of angioedema. They can affect the skin and subcutaneous tissue, mucous membranes (gastrointestinal, respiratory, and uropoietic tracts), and submucous tissue. Women in reproductive age require specific management of the disease regarding both the course of the disease and treatment options. It is not only the treatment in female patients that is specific, but also the situations (pregnancy, breastfeeding). We present a case report of the initial use of a subcutaneous C1 inhibitor in the long-term prophylaxis of HAE attacks in two pregnant patients.
Keywords:
hereditary angioedema – Prophylaxis – pregnancy
Authors:
Katarína Hrubišková 1; Miloš Jeseňák 2,3; Juraj Payer 1
Authors‘ workplace:
Centrum pre hereditárny angioedém – Expertízne pracovisko MZ SR pre zriedkavé choroby, V. interná klinika Lekárskej fakulty Univerzity Komenského a Univerzitnej nemocnice Bratislava
1; Centrum pre hereditárny angioedém – Expertízne pracovisko MZ SR pre zriedkavé choroby, Klinika detí a dorastu, Klinika pneumológie a ftizeológie, Jesseniova lekárska fakulta v Martine, Univerzita Komenského v Bratislave, Univerzitná nemocnica Martin
2; Oddelenie klinickej imunológie a alergológie, Univerzitná nemocnica Martin
3
Published in:
Vnitř Lék 2023; 69(4): 265-268
Category:
Case reports
doi:
https://doi.org/10.36290/vnl.2023.050
Overview
Hereditárny angioedém (HAE) je vrodené zriedkavé ochorenie prejavujúce sa rekurentnými atakmi angioedému. Postihnutá môže byť koža a podkožie, sliznice (tráviaci, respiračný, uropoetický trakt) a podslizničné tkanivo. U žien vo fertilnom veku má manažment ochorenia špecifiká, ktoré sa týkajú ako priebehu ochorenia, tak možností liečby. Tieto špecifiká sa týkajú jednak liečby samotných žien, ako aj špecifických situácií (tehotenstvo, dojčenie). Prinášame informáciu o prvom použití podkožného C1 inhibítora v rámci dlhodobej profylaxie atakov HAE u dvoch tehotných pacientok.
Klíčová slova:
profylaxia – tehotenstvo – hereditárny angioedém
Úvod
Hereditárny angioedém patrí medzi bradykinínom mediované angioedémy (nejde o alergický typ angioedému, kde sú kľúčovými mediátormi pôsobky uvoľňované z mastocytov a bazofilov). Podstatou ochorenia je vrodená porucha serínovej proteázy − C1 inhibítora (C1–INH), ktorý kontroluje komplementový, kalikreín‑kinínový (kontaktný) a plazmínový systém plazmy (1). Porucha sa môže týkať nedostatočnej koncentrácie C1 inhibítora v plazme alebo jeho nedostatočnej funkčnej aktivity a vzniká na podklade patogénnych variantov génu SERPING1 kódujúcom samotný C1-INH.
Okrem HAE s poruchou funkcie C1 inhibítora existuje niekoľko ďalších typov ochorenia, ktoré sa spájajú s inými genetickými zmenami (koagulačný faktor XII, angiopoetín 1, plazminogén, kininogén 1, myoferlín a heparansulfát‑glukozamín 3-O‑sulfotransferáza 6) (2).
Dominujúcim klinickým príznakom ochorenia je rekurentný angioedém, ktorý postihuje kožu a podkožie, sliznice a podslizničné tkanivo. Najčastejšie býva postihnutá oblasť hlavy, tváre a krku, končatín a genitálií. Slizničné angioedémy postihujú sliznice tráviaceho traktu, kde opuch vedie k brušnej bolesti, vracaniu, hnačke a nezriedka k obrazu náhlej brušnej príhody s nálezom voľnej tekutiny v dutine brušnej či malej panve. Opuch v oblasti dýchacích ciest môže spôsobiť dysfóniu, stridor, sťažené dýchanie až asfyxiu. V minulosti bola mortalita na laryngeálny edém okolo 30 % (3, 4).
Ataky angioedému sú neprediktabilné, a to tak z hľadiska času vzniku, lokality, či závažnosti. Zvýšená frekvencia atakov sa môže objaviť v súvislosti s infekciou, fyzickou alebo psychickou záťažou a hormonálnymi zmenami (typicky po nástupe puberty, počas gravidity, ale aj pri liečbe hormonálnymi prípravkami). Atak angioedému väčšinou trvá 24 − 72 hodín. Pred vznikom ataku sa môžu objaviť niektoré prodromálne príznaky ako je erythema marginatum, nervozita, zmeny nálad.
Diagnostika a liečba
Pri klinickom podozrení na HAE je diagnóza potvrdená laboratórnym vyšetrením koncentrácie a funkčnej aktivity C1 inhibítora. Ako dobre dostupnú skríningovú metódu možno využiť stanovenie koncentrácie C4 zložky komplementu, ktorá je u väčšiny pacientov s HAE znížená. Diagnostiku možno doplniť genetickou analýzou variantov génu SERPING1. Genetická analýza je kľúčová pri stanovení diagnózy HAE s normálnym C1 inhibítorom, avšak pri HAE spojenom s deficitom C1-INH nie je podmienkou stanovenia diagnózy (2).
Liečebná stratégia sa zameriava na zvládnutie akútnych atakov, na krátkodobú profylaxiu pred rizikovými situáciami a na dlhodobú profylaxiu u vysoko symptomatických pacientov. Liečebné možnosti sa v ostatných rokoch výrazne rozšírili, čím sa ochorenie stáva dobre zvládnuteľným a pacienti môžu viesť plnohodnotný život.
Na liečbu akútnych atakov HAE máme na Slovensku k dispozícii 3 liečebné modality − ikatibant (antagonista bradykinínových B2 receptorov), ktorý sa podáva subkutánne (použiteľný od 2 rokov života s korekciou dávky u detí podľa telesnej hmotnosti), C1 inhibítor vyrobený z plazmy darcov a rekombinantný C1 inhibítor. Oba C1 inhibítory sa podávajú formou intravenóznej injekcie. Prehľad liečebných možností je v Tab. 1.
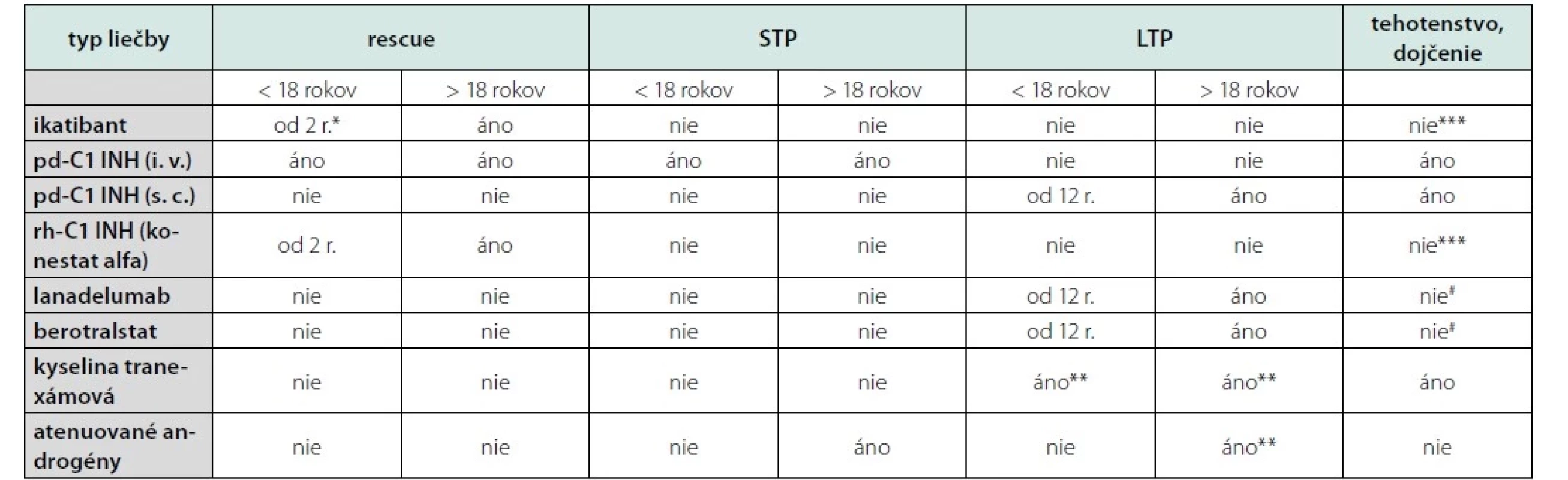
Profylaktická liečba akútnych atakov je rezervovaná pre pacientov, ktorí majú frekventné ataky, závažne prebiehajúce ataky alebo ataky, ktoré ich výrazne limitujú. Cieľom dlhodobej profylaxie je zabezpečiť pacientovi život bez akútnych atakov. Ako prvolíniová liečba sú odporúčané podkožný C1 inhibítor vyrobený z plazmy darcov, lanadelumab (plne humánna monoklonálna protilátka proti plazmatickému kalikreínu) a berotralstat (nízkomolekulový perorálny inhibítor plazmatického kalikreínu). Druholíniovú liečbu predstavujú atenuované androgény (2).
Okrem dlhodobej profylaxie využívame aj krátkodobé režimy, ktoré chránia pacienta počas zákrokov alebo výkonov, ktoré sa spájajú so zvýšeným rizikom vzniku akútneho ataku. Ide o všetky výkony, pri ktorých dochádza k manipulácii na slizniciach dýchacieho alebo tráviaceho traktu, stomatologické ošetrenie a operačné výkony. Liekom prvej voľby je C1 inhibítor vyrobený z plazmy darcov. Dobré skúsenosti máme aj s použitím rekombinantného C1 inhibítora (5).
Špecifiká ochorenia u žien vo fertilnom veku
Estrogény potenciujú aktiváciu komplexu prekalikreín − kininogén s vysokou molekulovou hmotnosťou (high molecular weight kininogen, HMWK) a stimulujú endotelové bunky, z ktorých lokálne uvoľňujú heat shock proteín 90. To vedie k produkcii kalikreínu, ktorý potom z HMWK uvoľňuje bradykinín. Ten je potentným vazodilatátorom (6).
Obdobie nástupu puberty a menštruačného cyklu môže byť spúšťačom akútnych atakov hereditárneho angioedému, ktorý sa dovtedy nemanifestoval. Ak ide o pacientku, u ktorej vznikla mutácia de novo (teda má negatívnu rodinnú anamnézu ochorenia) a na diagnózu sa nemyslí, často bývajú brušné ataky HAE považované za bolesti sprevádzajúce menštruáciu alebo za dysmenoreu (7).
Liečebné možnosti sú u žien vo fertilnom veku rovnaké ako u iných pacientov, s tou výnimkou, že v rámci dlhodobej profylaxie nepoužívame atenuované androgény. Ak nie je k dispozícii iná možnosť liečby, žena užívajúca atenuované androgény má mať zabezpečenú účinnú antikoncepciu. Vzhľadom na negatívny vplyv estrogénov na vznik, priebeh a závažnosť atakov, sa treba vyvarovať použitia antikoncepcie obsahujúcej estrogény. 60 – 80 % žien, ktoré užívali kombinované orálne kontraceptíva, referovalo častejšie a závažnejšie ataky (8). Bariérové metódy antikoncepcie, intrauterinné telieska a progesterónová antikoncepcia sú považované za bezpečné (9).
Tehotenstvo ovplyvňuje priebeh ochorenia rôznym spôsobom (tretina pacientok má rovnaký priebeh ochorenia, tretina má zhoršenie symptómov a tretina redukciu príznakov) a na základe priebehu jedného tehotenstva sa nedá predpovedať priebeh ďalšieho u tej istej pacientky (8). V dôsledku zväčšovania maternice a pohybov plodu bývajú brušné ataky najčastejšou manifestáciou v priebehu tehotenstva. Prítomnosť brušných atakov môže byť jedným z dôvodov pre uvažovanie nad dlhodobou profylaxiou u tehotnej pacientky, keďže brušné bolesti v rámci ataku, vracanie a hnačka sa niekedy nedajú odlíšiť od iných komplikácií tehotenstva.
Liekom prvej voľby na zvládnutie akútneho ataku v priebehu tehotenstva je C1 inhibítor vyrobený z plazmy a liekom prvej voľby na dlhodobú profylaxiu je podkožný C1 inhibítor vyrobený z plazmy. O použití ikatibantu u šiestich tehotných pacientok, ktoré porodili zdravé deti, referovali českí kolegovia (10). Lanadelumab a berotralstat neboli u tehotných žien skúmané, hoci v súčasnosti je v prípade prevýšenia benefitov nad rizikom betrotralstat možné použiť aj počas gravidity.
Vaginálny pôrod zriedkavo provokuje atak angioedému, ale napriek tomu má mať každá pacientka zabezpečenú on demand liečbu priamo na pôrodnej sále. Preprocedurálna profylaxia sa odporúča u pacientok, ktoré mali frekventné ataky v treťom trimestri, alebo ktoré majú anamnézu opuchov genitálií po mechanickej traume. V prípade sekcie, vákuum extrakcie alebo pôrodu s kliešťami sa taktiež odporúča použitie profylaktickej liečby (8, 11). Pre obdobie laktácie platia rovnaké zásady týkajúce sa liečby, ako v priebehu tehotenstva.
Pacientka 1
Podozrenie na hereditárny angioedém bolo u pacientky vyslovené vo veku 24 rokov na základe typických opuchov postihujúcich rôzne časti tela vrátane laryngu a dutiny brušnej a typického laboratórneho nálezu zníženej funkčnej aktivity C1 inhibítora. Symptómy sa u pacientky začali objavovať vo veku cca 17 rokov. Pre nedostupnosť iných možností liečby bola pacientka nastavená na profylaktickú liečbu danazolom s titráciou najnižšej dávky s dostatočným klinickým efektom.
Pri vyšetrení na našej ambulancii v roku 2015 sme diagnózu potvrdili opakovaným laboratórnym vyšetrením funkčnej aktivity C1 inhibítora. Genetickou analýzou SERPING1 verifikovaná mutácia c.1191_1192insACA (p. Thr397_leu398insThr), pri ktorej inzercia aminokyseliny threonín ovplyvňuje reaktívne centrum C1 inhibítora a tým pádom jeho funkčnú aktivitu. Do roku 2015, keď sme realizovali diagnostiku, tento variant v literatúre nebol opísaný.
Pacientka pokračovala v užívaní danazolu do roku 2017, keď sme liečbu pre nežiaduce účinky (vzostup pečeňových transamináz) ukončili a prešli sme na dlhodobú profylaxiu kyselinou tranexámovou (podľa vtedy platných odporúčaní išlo o alternatívu liečby androgénmi). Pacientka mala zabezpečenú on demand liečbu rekombinantným C1 inhibítorom a ikatibantom. Profylaxia kyselinou tranexámovou pokračovala do roku 2019, keď pacientka otehotnela a liečbu vysadila. Počas tehotenstva mala pacientka frekventné ataky, ktoré dominantne postihovali dutinu brušnú, končatiny a genitálie. V tehotenstve sme ako záchrannú medikáciu podávali C1 inhibítor vyrobený z plazmy.
Z vekovej indikácie bola pacientke odporučená amniocentéza, ktorú absolvovala po príprave intravenóznym C1 inhibítorom bez komplikácií. Pôrod prebehol v 41. týždni za použitia vákuum extrakcie (pre nepokračujúci pôrod). Pacientke bol pred pôrodom podaný C1 inhibítor vyrobený z plazmy v dávke 500 I.U. Narodil sa zdravý chlapec (pôrodná hmotnosť 3 890 g/pôrodná dĺžka 52 cm).
Po pôrode sme sa vrátili k dlhodobej profylaktickej liečbe kyselinou tranexámovou, avšak pôvodne uspokojivý efekt tejto liečby sme už nezaznamenali. Pacientka mala napriek liečbe frekventné ataky vyžadujúce si podávanie on demand liečby. 1. 6. 2021 sme začali dlhodobú profylaxiu lanadelumabom, ktorá bola mimoriadne účinná a pacientka mala za prvé 4 mesiace liečby len jeden atak (pred liečbou lanadelumabom sme u pacientky evidovali 21 závažných, on demand liečbu vyžadujúcich atakov v priebehu roka).
V septembri 2021 druhýkrát otehotnela a v liečbe lanadelumabom sme nepokračovali. Opätovne absolvovala amniocentézu po príprave C1 inhibítorom. Vzhľadom na priebeh predošlého tehotenstva s frekventnými atakmi sme u pacientky po schválení zdravotnou poisťovňou iniciovali profylaktickú liečbu podkožným C1 inhibítorom. Dávka podkožného C1 inhibítora odporúčaná na profylaxiu je 60 I.U. na kilogram hmotnosti podávaná každé 3 − 4 dni. Pacientke sme po dohode so zdravotnou poisťovňou, ktorá liečbu hradila, podávali dávku cca 45 I.U./kg každé 4 dni (4 000 I.U. každé 4 dni pri hmotnosti 86 kg) zohľadňujúc aj snahu zjednodušiť pacientke aplikáciu (nekombinovať jednu ampulku 3 000 I.U. a jednu ampulku 2 000 I.U. v rámci jedného podania). Táto dávka zostala nezmenená počas celého tehotenstva a bola mimoriadne efektívna, pacientka mala iba jeden mierny atak, ktorý si nevyžadoval podanie záchrannej medikácie. V 41. týždni pacientka po indukcii a príprave intravenóznym C1 inhibítorom porodila zdravé dievčatko (3 400 g/50 cm). Ani u jedného dieťaťa sa na základe vyšetrenia buniek z plodovej vody nepotvrdil prenos matkinho patogénneho variantu v géne SERPING1. Po druhom pôrode sme sa vrátili k profylaktickej liečbe lanadelumabom.
Pacientka 2
Pacientka bola vyšetrená na našej ambulancii v rámci skríningu prvostupňových príbuzných − prejavy hereditárneho angioedému mala matka i brat pacientky. Vo veku 22 rokov bola pacientka asymptomatická, i keď laboratórny nález bol pre diagnózu typický. U pacientky sme potvrdili rovnaký variant v géne SERPING1 ako u symptomatického brata − c.1220delA (p. Gln407Argfs*24). Tento variant spôsobuje predčasné zaradenie stop kodónu pri syntéze proteínu.
V januári 2020 bola pacientka v 10. týždni prvého tehotenstva. Pre bolesti brucha po pohlavnom styku a nález voľnej tekutiny v dutine brušnej bola pacientka hospitalizovaná s podozrením na hemoperitoneum. Krvácanie do dutiny brušnej sa nepotvrdilo, vysoko pravdepodobne išlo o jeden z prvých prejavov hereditárneho angioedému. Ďalší priebeh tehotenstva bol bez komplikácií, pacientka nemala žiadne iné akútne ataky angioedému. Pôrod prebehol v 36. týždni tehotenstva po príprave intravenóznym C1 inhibítorom. Narodilo sa zdravé dievčatko (pôrodná hmotnosť 2 600 g/pôrodná dĺžka 46 cm).
Nasledujúce dva roky bola pacientka po stránke HAE naďalej oligosymptomatická a nepotrebovala ani záchrannú medikáciu, ani dlhodobú profylaxiu.
V marci 2022 bola vyšetrená na našej ambulancii v 14. týždni druhého tehotenstva. Referovala vysoký výskyt akútnych atakov − dominantne sa vyskytovali brušné ataky, opuchy končatín a migrenózne bolesti hlavy, ktoré ustupovali po aplikácii C1 inhibítora. Pacientku sme nastavili na profylaktickú liečbu podkožným C1 inhibítorom v dávke 3 000 I.U. každé 4 dni (hmotnosť 75 kg). Pri tejto liečbe pacientka nemala po zvyšok tehotenstva ani jeden akútny atak a v 39. týždni fyziologicky porodila dievčatko (pôrodná hmotnosť 3 380 g/pôrodná dĺžka 51 cm). Po pôrode je pacientka opäť oligosymptomatická, má predpísanú on demand medikáciu, ale zatiaľ nebolo potrebné ju použiť. Nepotrebuje ani dlhodobý profylaktický liečebný režim.
Záver
V našom centre pre hereditárny angioedém sme prvýkrát na Slovensku liečili dve tehotné pacientky podkožným C1 inhibítorom určeným na dlhodobú profylaxiu akútnych atakov angioedému. Každá pacientka mala iný priebeh ochorenia pred otehotnením (jedna bola vysoko symptomatická a vyžadovala dlhodobú profylaxiu, druhá bola prakticky asymptomatická), obe pacientky však mali počas tehotenstva významné zhoršenie priebehu ochorenia s frekventnými brušnými atakmi. Liečbu obe pacientky tolerovali bez nežiaducich účinkov, bez problémov zvládli autoaplikáciu a liečba bola u oboch veľmi účinná. Počet akútnych atakov sa zredukoval na úplné minimum i napriek tomu, že sme zvolili nižšiu profylaktickú dávku, ako je odporúčané.
Hereditárny angioedém je v súčasnosti dobre liečiteľné ochorenie a stále sa objavujú nové liečebné modality. Je to ochorenie, ktorého priebeh je veľmi rozdielny medzi jednotlivými chorými, ale mení sa aj u konkrétneho chorého v závislosti od životnej situácie. Tehotenstvo a pôrod u pacientky s HAE jednoznačne vyžadujú sledovanie v centre, ktoré má s touto diagnózou dostatočné skúsenosti a má možnosť interdisciplinárnej spolupráce.
Poďakovanie: Autori ďakujú za konzultácie primárovi MUDr. Romanovi Haklovi, Ph.D., z Centra pre hereditárny angioedém v Brne.
Táto publikácia vznikla vďaka podpore v rámci Operačného programu Integrovaná infraštruktúra pre projekt: Systémová verejná výskumná infraštruktúra − biobanka pre nádorové a zriedkavé ochorenia, kód ITMS:313011AFG5, spolufinancovaný zo zdrojov Európskeho fondu regionálneho rozvoja.
Článek přijat redakcí: 2. 2. 2023
Článek přijat po recenzích: 11. 4. 2023
MUDr. Katarína Hrubišková
Imunologicko-alergologická ambulancia V. internej kliniky LF UK a UN Bratislava katarina.
Sources
1. Davis AE 3rd, Mejia P, Lu F. Biological activities of C1 inhibitor. Mol Immunol. 2008 Oct;45(16):4057-63. doi: 10.1016/j.molimm.2008. 06. 028. Epub 2008 Jul 31. PMID: 18674818; PMCID: PMC2626406.
2. Maurer M, et al. The international WAO/EAACI guideline for the management of hereditary angioedema—The 2021 revision and update. Allergy, 2022;77(7): 1961-1990. https://doi.org/10.1111/all.15214.
3. Frank MM, Gelfand JA, Atkinson JP. Hereditary angioedema: the clinical syndrome and its management. AnnIntern Med. 1976;84:580–593.
4. Agostoni A, Aygören‑Pürsün E, Binkley KE, et al. Hereditary and acquired angioedema: problems and progress: proceedings of the third C1 esterase inhibitor deficiency workshop and beyond. J AllergyClinImmunol. 2004;114(suppl 3):S51-S131. doi: 10.1016/j.jaci.2004. 06. 047.
5. Valerieva A, Staevska MT, Grivcheva‑Panovska V, et al. Recombinant human C1 esterase inhibitor for hereditary angioedema attacks: A European registry. WorldAllergy Organ J. 2021 Apr 22;14(4):100535. doi: 10.1016/j.waojou.2021.100535. PMID: 33995818; PMCID: PMC8093463
6. Joseph K, Tholanikunnel BG, Kaplan AP. Cytokine and estrogen stimulation of endothelial cells augments activation of the prekalikrein‑high molecular weight kininogen complex. Implications for hereditary angioedema. J AllergyClinImmunol. 2017;140(1):170-6.
7. Bork K, Men G, StaubachP, Hardt. Hereditary angioedema: new findings concerning symptomas, affected organs, and course. Am J Med.2006;119:267-74.
8. Banerji A, Riedl M. Managing the female patient with hereditary angiedema, WomensHealth (lond). 2016;12:351-61.
9. Caballero T, Farkas H, Bouillet L, et al. International consensus and practical guidelines on the gynecologic and obstetric management of female patients with hereditary angioedema caused by C1 inhibitor deficiency. J AllergyclinImmunol. 2012;129(2):308-20.
10. Hakl R, Kuklínek P, Krčmová I, et al. Treatment of hereditary angioedema attacks with icatibant and recombinant C1 inhibitor during pregnancy. J ClinImmunol. 2018;38(7):810-5.
11. Busse PJ, Christiansen SC, Riedl MA, et al. US HAEA MedicalAdvisoryBoard 2020 Guidelines for the Management of Hereditary Angioedema. J AllergyClinImmunolPract. 2021;9(1):132-150e3.
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Internal Medicine

2023 Issue 4
Most read in this issue
- Osteomalacie
- Point-of-Care ultrasonografie ve vnitřním lékařství
- Hluboká žilní trombóza – postavení ultrazvuku v diagnostice a dalším sledování pacientů
- V prevenci demence je třeba se zaměřit na časnou a důslednou léčbu hypertenze
