Nízko-molekulárne heparíny a ich neantitrombotické účinky na hojenie rán
Low molecular weight heparins and their non-antithrombotic effects on wound healing
Heparin and low molecular weight heparins (LMWHs) are commonly indicated drugs for surgery and non-surgery patients because of their effectiveness and safety in prevention and therapy of deep vein thrombosis. While the effect of LMWHs on coagulation cascade is commonly known, some other effects of these drugs are unknown.
Many papers present anti-inflammatory effects of LMWHs. Affecting of inflammation takes place on more levels. LMWHs block penetration of neutrophils into the tissue by inhibiting their adhesion to endothelial cells, by blocking of chemoatractants and by decreasing of elastases production. LMWHs affect production and activity of tumour necrosis factor α, interleukins 6 and 8 and interferon γ. LMWHs also decrease vascular permeability and stable structure of capillary basal membrane.
The effect of LMWHs on angiogenesis is not fully understood. While positive effect on fibroblast growth factor is frequently presented, the effect on vascular endothelial growth factor is controversial at least. Opinions concerning the effect on fibroblast growth and collagen production are also ambiguous. However, most of papers indicate positive effect of LMWH on this part of wound healing. Number of studies that point to the divergences of the effects of individual LMWHs is growing, thus explaining the differences between individual studies.
Small uncontrolled clinical studies show the possible utilization of LMWH in chronic wound treatment, especially in inflammatory bowel diseases treatment. However, for their practical application, more studies are needed.
Key words:
low molecular weight heparins, anti-inflammatory effects, angiogenesis, wound healing. To.
Authors:
T. Toporcer; L. Lakyová; J. Radoňak
Authors‘ workplace:
Univerzita Pavla Jozefa Šafárika v Košiciach, Lekárska fakulta, I. chirurgická klinika
Published in:
Čas. Lék. čes. 2009; 148: 481-488
Category:
Review Article
Overview
Heparín a nízko-molekulárne heparíny (LMWH) sú vzhľadom na ich účinnosť a bezpečnosť v predchádzaní a liečbe hlbokej žilovej trombózy v súčasnosti veľmi často indikovanými liekmi nielen u chirurgických pacientov. Zatiaľ čo vplyv LMWH na koagulačnú kaskádu je zväčša známy, objavuje sa množstvo iných interakcií týchto látok, ktoré sú doposiaľ neobjasnené.
Neustále pribúdajú práce poukazujúce na protizápalové účinky LMWH. Ovplyvnenie zápalu sa odohráva na viacerých úrovniach. LMWH blokujú prenikanie neutrofilov do tkaniva inhibíciou ich adhézie na endotelové bunky, blokovaním chemoatraktantov i znížením produkcie elastáz neutrofilmi. Ovplyvnená je tvorba i účinnosť tumorózneho nekrotického faktora α, interleukínov 6 a 8 a interferónu γ. LMWH taktiež znižujú cievnu permeabilitu a stabilizujú bazálne membrány kapilár.
Vplyv LMWH na angiogenézu nie je jednoznačný. Zatiaľ čo pozitívny účinok na fibroblastový rastový faktor je opakovane prezentovaný, vplyv na vaskulárny endotelový rastový faktor je prinajmenšom kontroverzný. Názory na ovplyvnenie rastu fibroblastov a produkciu kolagénu tiež nie sú uzavreté, väčšina štúdii poukazuje na pozitívny vplyv. Stále pribúda prác poukazujúcich na rozdielnosť vplyvu jednotlivých LMWH, čo vysvetľuje rozdiely medzi jednotlivými štúdiami.
Sporadické malé klinické práce poukazujú na možné využitie LMWH tak pri liečbe chronických rán, najmä však zápalových ochorení čreva. Pre ich aplikovanie v praxi sú však nevyhnutné ďalšie štúdie.
Kľúčové slová:
nízko-molekulárne heparíny, protizápalové účinky, angiogenéza, hojenie rán.
Heparín a nízko-molekulárne heparíny
Heparín bol ako antitrombotická látka prvý krát použitý v 30. rokoch 20. storočia. Vzhľadom na jeho fyzikálnu i chemickú heterogenicitu boli jeho parametre štandardizované až v roku 1942. Heparín patrí do skupiny polyaniónových polysacharidov nazývaných glykosaminoglykány (GAG). Štruktúra GAG je typická opakovaním disacharidových sekvencií, ktoré pozostávajú z urónovej kyseliny a amino-sacharidových zvyškov. Heparín je vysoko sulfatovaný polysacharid pozostávajúci z hexourónovej kyseliny a D-glukosaminového zvyšku spojeného glykozidovou väzbou (1–3).
Chemicky je heparín heterogénnou skupinou molekúl s hmotnosťou od 3 do 30 kDa (stredná molekulárna hmotnosť je 15 kDa). Komerčný heparín alebo nefrakcionovaný heparín (UFH) je izolovaný z tkaniva bohatého na mastocyty. Pôsobí antitromboticky aktivovaním antitrombínu a spúšťaním reakcií, ktoré inaktivujú koagulačné enzýmy, faktor IIa a faktor Xa. UFH taktiež podporuje inhibíciu faktora IXa, faktora XIa a faktora VIIa. Heparín sa viaže na antitrombín pomocou pentasacharidu, ktorý je prítomný iba na asi jednej tretine molekúl. Väzba na antitrombín pomocou špecifického pentasacharidu spôsobí konformačné zmeny v centre antitrombínu, čo akceleruje interakciu s faktorom Xa, ale nie s trombínom. Pre inhibíciu trombínu sa musí heparín viazať ako na antitrombín, tak aj na koagulačné enzýmy. Tento premosťovací účinok vyžaduje reťazce s dĺžkou aspoň 18 sacharidov (5,4 kDa). Inaktiváciou trombínu heparín nezabraňuje iba tvorbe fibrínu, ale taktiež inhibuje trombínom indukovanú aktiváciu krvných doštičiek, faktorov V a VIII (2).
Okrem reakcie s antitrombínom interaguje heparín aj so širokou skupinou molekúl pomocou elektrostatických väzieb. Táto skupina zahŕňa heparín-kofaktor II, rôzne receptory a rastové faktory. Sila väzby závisí od širokého spektra špecifík molekuly heparínu (2).
Nízko-molekulárne heparíny (LMWH) boli ako antitrombotické lieky uvedené na trh v polovici 80. rokov. LMWH sú vyrábané depolymerizáciou molekuly UFH. Len približne 15 až 20 % molekúl LMWH obsahuje antitrombín-viažúci pentasacharid. Najmenej polovica reťazcov, ktoré obsahujú tento pentasacharid, je príliš krátka na vytvorenie premostenia trombín-antitrombín. Z tohto dôvodu majú LMWH redukovanú schopnosť inaktivácie faktora IIa. Na druhej strane, kratšie reťazce molekúl dovoľujú zvýšenú interakciu s faktorom Xa. Interakcia s faktorom Xa je v menšej miere možná aj bez nutnosti interakcie s antitrombínom III (4, 5).
V porovnání s heparínom, LMWH majú menšiu afinitu k väzbe na plazmatické proteíny, endotelové bunky a makrofágy. Tieto špecifiká vysvetľujú farmakokinetické rozdiely medzi LMWH a UFH. Väzba UFH na plazmatické proteíny redukuje antitrombotické účinky, pričom variabilita zastúpenia heparín-viažucich proteínov v plazme má za následok variabilitu antitrombotického účinku podanej dávky. Pri LMWH sú tieto rozdiely redukované. Biologická dostupnosť LMWH po intravenóznom a subkutánnom podaní je vyššia ako pri UFH a varíruje medzi 87 a 98 %. Biologický polčas enoxaparínu, dalteparínu, tinzaparínu a iných LMWH je udávaný v rozmedzí 100 až 360 minút, závisí od spôsobu podania. Aktivita anti-Xa pretrváva dlhšie ako aktivita anti-IIa, čo je dôsledok kratšieho polčasu dlhších reťazcov (1, 4). V súčasnosti sú LMWH indikované pri liečbe širokej skupiny ochorení, medzi prvými trombembolická choroba, nestabilná angina pectoris a non-Q infarkt myokardu. Ďalšou indikáciou je prevencia hlbokej žilovej trombózy u chirurgických i onkologických pacientov (5–7). V posledných rokoch prichádza na trh 2. generácia LMWH, ktorá je špecifická ešte nižšou molekulárnou hmotnosťou a vyšším pomerom účinnosti anti Xa/anti IIa. Zástupcom tejto skupiny liečiv je Bemiparin (tab. 1).
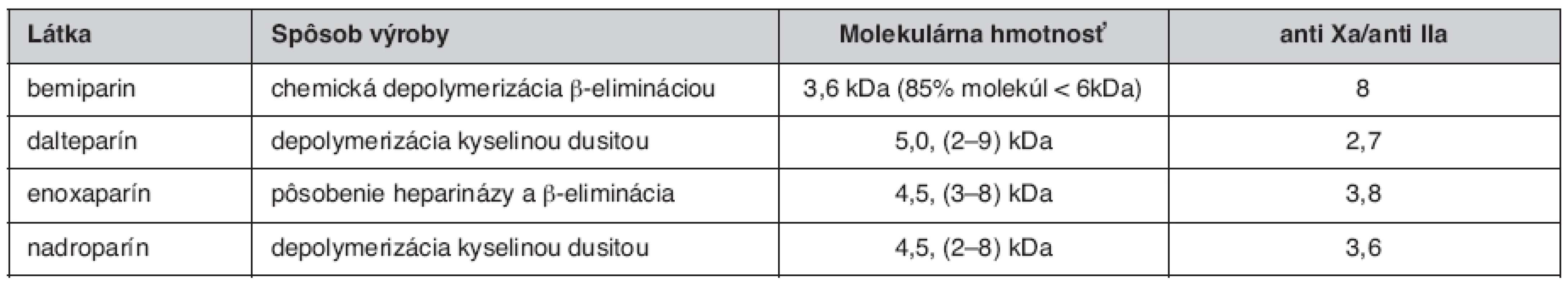
LMWH nie je jeden liek
LMWH predstavujú depolymerizovaný produkt pripravený z mukozálneho heparínu pôsobením chemických, enzymatických a fyzikálnych metód. Tieto látky sú vo svojej molekulárnej a štrukturálnej charakteristike veľmi zložité a široko heterogénne. Rôzne LMWH sú produktom špecifických, rôznorodých patentovaných postupov, ktoré vedú ku kompozične rôznorodým produktom, čo veľmi významne ovplyvňuje ich biologické vlastnosti (obr. 1) (1, 3).
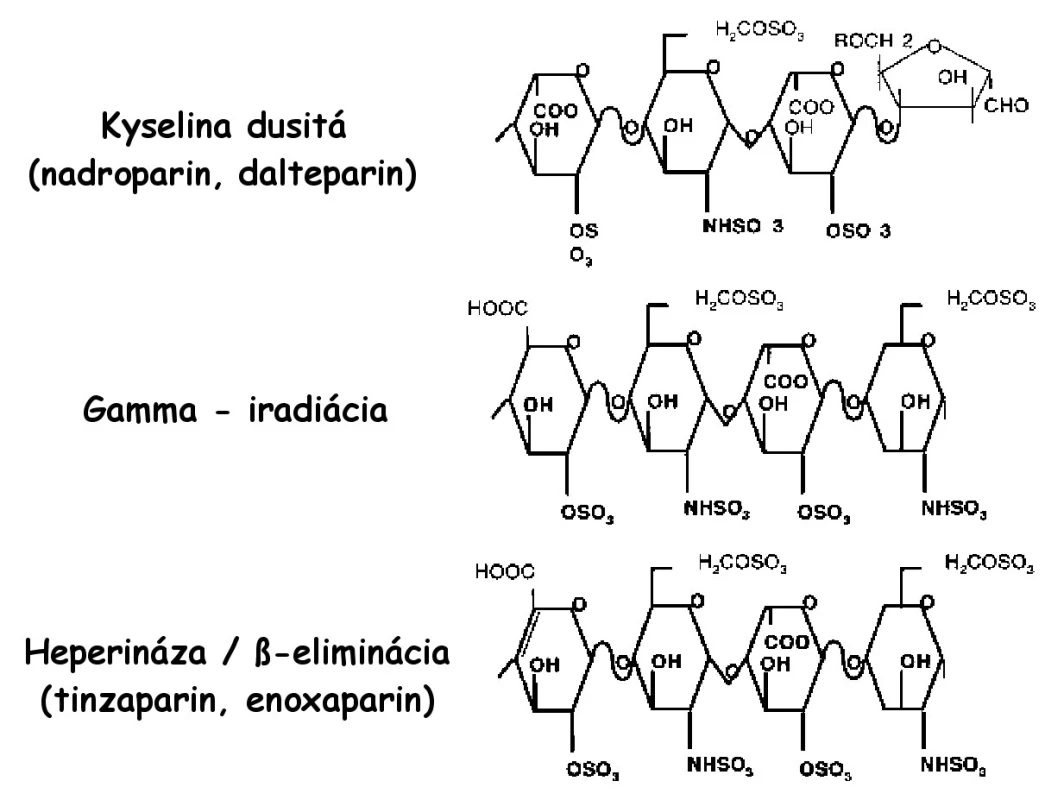
Každý LMWH je svojim oligosacharidovým komponentom, molekulárnou hmotnosťou, účinkom anti Xa aj anti IIa a pomerom anti Xa/anti IIa špecifický (tab. 2). Nadroparín a dalteparín sú produktom pôsobenia kyseliny dusitej a je pre nich charakteristická prítomnosť sulfatovaných pentasacharidov na redukovanom konci. Pôsobenie heparinázy a β-eliminácia vedie k tvorbe dvojitých väzieb, ktoré sú charakteristické pre tinzaparín a enoxaparín. Enoxaparín obsahuje navyše špecifickú 1,6-anhydroamino - a anhydrogluko - skupinu, ktoré sú špecifické len pre tento druh LMWH. Podľa tohto tvrdenia by sa mal enoxaparín líšiť od tinzaparínu práve touto skupinou. Je teda zrejmé, že rôzny depolymerizačný proces a následná modifikácia vedie k špecifickej štrukturálnej individualite jednotlivých LMWH (3).
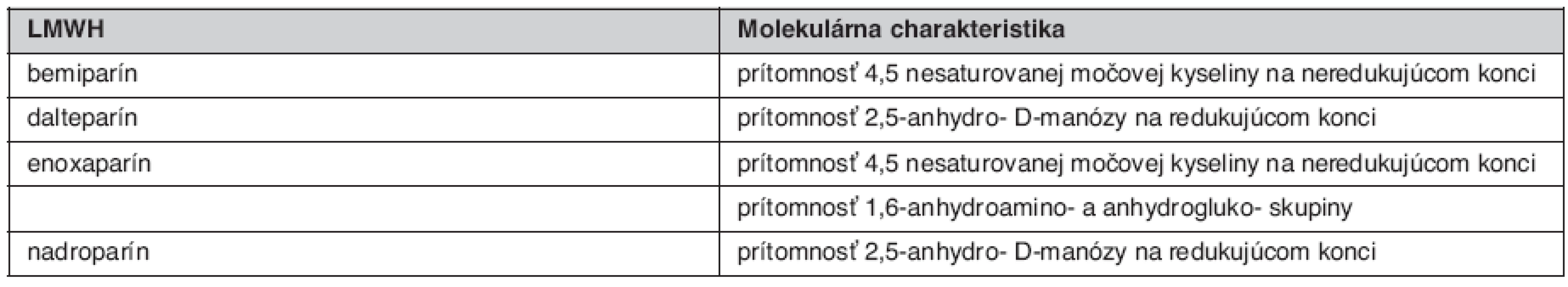
Napriek výrazným interindividuálnym rozdielom medzi jednotlivými LMWH v zmysle ich priemyselnej výroby i vzhľadu samotnej molekuly je ich vplyv na koagulačnú kaskádu natoľko podobný, že sú často v praxi chápané ako jediný LMWH vyrábaný rôznymi farmaceutickými firmami (1). V roku 1993 Svetová zdravotnícka organizácia (WHO) prehlásila, že každý LMWH je samostatným liekom navzájom nenahraditeľným. Individualitu jednotlivých LMWH potvrdili aj Správa jedla a liekov Spojených štátov (U.S. FDA), Americká akadémia hrudníkových chirurgov a Americká akadémia kardiológov (2, 3).
UFH, LMWH a ich vplyv na hojenie rán
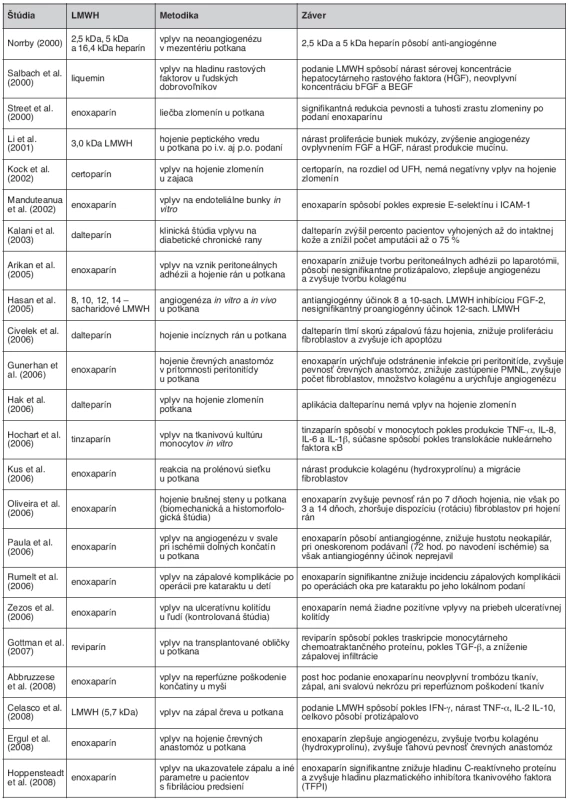
Hojenie rán je definované ako nahradenie mŕtveho tkaniva živým, a väčšina autorov ho rozdeľuje do troch základných fáz: zápalová, proliferačná a maturačná. Práce zaoberajúce sa vplyvom UFH a LMWH na hojenie rán sa zameriavajú najmä vplyvom na zápal, angiogenézu, proliferáciu fibroblastov a tvorbu kolagénu, s objasňovaním jednotlivých mechanizmov účinku (tab. 3).
UFH, LMWH a ich protizápalové účinky
Protizápalový účinok heparínu a LMWH je v súčasnosti potvrdený množstvom experimentálnych i klinických štúdii. Samotné ovplyvnenie zápalu sa odohráva na viacerých úrovniach riadiacich mechanizmov zápalu.
V priebehu zápalovej reakcie dochádza k nadprodukcii heparináz aktivovanými leukocytmi, ktoré štiepia GAG súčasti bazálnej membrány kapilár. Porušenie bazálnej membrány zvyšuje kapilárnu permeabilitu, čo vedie ku zvýšenej extravazácii zápalových buniek a ďalšiemu rozvoju zápalu. Heparín svojim účinkom inhibuje heparinázy, čím znižuje odbúravanie GAG bazálnych membrán, navyše je dokázaná jeho implementácia do týchto štruktúr a ich následná stabilizácia (8).
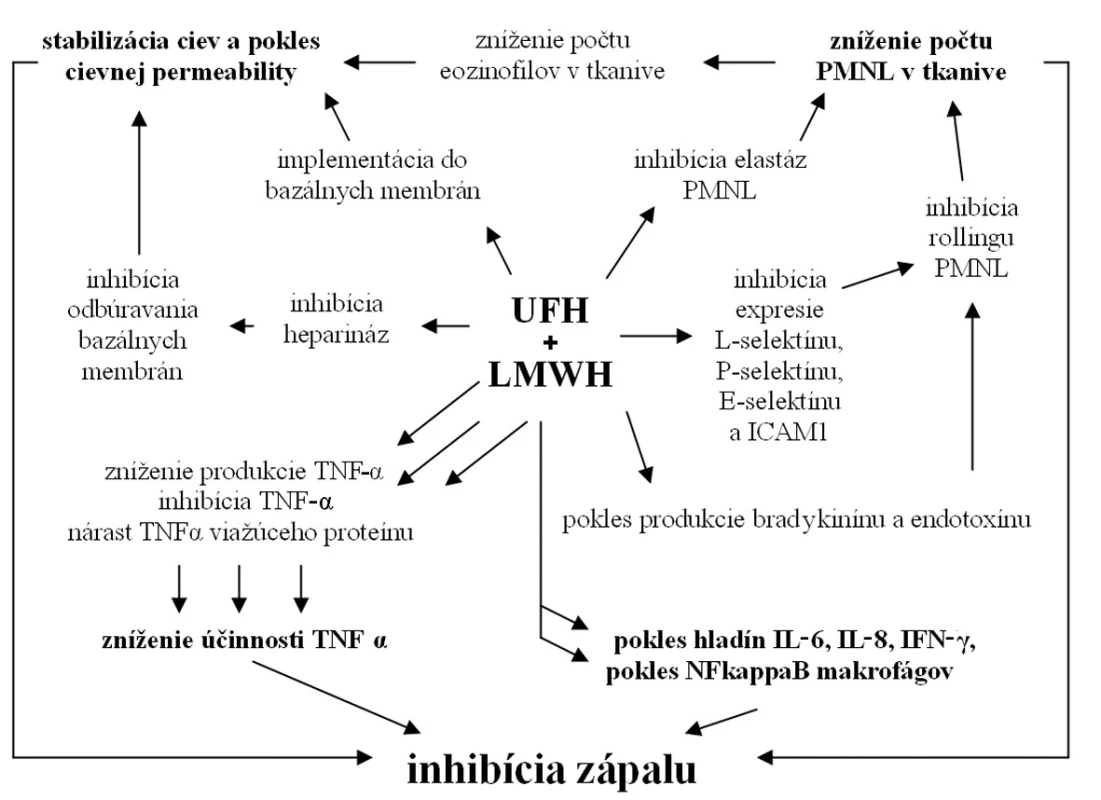
Iniciálne štádium zápalu je podmienené interakciou neutrofilov (PMNL) a endotelových buniek. Interakciou L-selektínu leukocytov, P-selektínu trombocytov a intercelulárnej adhezívnej molekuly 1 (ICAM1) endoteliálnych buniek dochádza k iniciálnej slabej väzbe (rolovanie) a následnej pevnej interakcii, ktorá je podmienkou diapedézy. Viaceré experimentálne práce dokazujú inhibíciu expresie L-selektínu, P-selektínu, E-selektínu a ICAM1 po aplikácii tak heparínu, ako aj LMWH (8–10). LMWH ďalej inhibuje produkciu bradikinínu a endotoxínu (atraktanty PMNL) (11). Dokázaná je aj inhibícia elastáz PMNL, čo sťažuje ich prenikanie do tkaniva (8). Inhibíciou aktivity PMNL dochádza k redukcii migrácie eozinofilov a zabráneniu sekundárneho nárastu permeability ciev. Znížená interakcia leukocytov a endotelových buniek vedie k poklesu infiltrácie okolitého tkaniva zápalovými bunkami, najmä PMNL a makrofágmi, a to tak pri hojení kožných rán, ako aj črevných anastomóz (9, 12, 13).
V riadení zápalovej reakcie hrajú kľúčovú úlohu viaceré cytokíny a rastové faktory, medzi prvými aj tumorózny nekrotický faktor α (TNF-α) svojím účinkom chemoatraktancie a aktivácie najmä PMNL a monocytov. Nadprodukcia TNF-α je aj jedným zo základných patologických mechanizmov pri zápalových ochoreniach čreva (IBD) (14). Viacerí autori poukazujú na zníženie produkcie TNF-α po lokálnom i celkovom podaní ako heparínu, tak aj LMWH (15–17). Disacharidy, vznikajúce pôsobením heparinázy I na heparín a LMWH, majú ďalej schopnosť inhibovať TNF-α (8). Poklesom TNF-α pôsobením LMWH dochádza k inhibícii apoptotických dejov a následne k zníženiu oxidačného poškodenia buniek tkaniva (9). UFH taktiež stimuluje produkciu TNF-α – viažúceho proteínu, čím znižuje jeho biologickú účinnosť (8). Iní autori dokumentujú, že heparín a LMWH znižujú produkciu interleukínu 8 (IL8), inhibujú jeho interakciu s PMNL a tlmia IL8 indukovanú chemotaktickú odpoveď PMNL (8, 15). Ďalšie práce poukazujú na pokles interleukínu 6 (IL6), interleukínu-1β (IL 1β), interferónu-γ (IFN-γ), ako aj jadrového faktora κB (NFκB) monocytov a makrofágov po podaní UFH a LMWH (15–17). Viaceré práce zdôrazňujú pokles tvorby reaktívnych kyslíkových radikálov a následný pokles hladiny oxidačného stresu po aplikácii UFH alebo LMWH (8). Protizápalové účinky niektorí autori transformujú na pozitívny vplyv UFH a LMWH na IBD, čo potvrdzujú v experimente (17). Civelek et al. pripisujú dalteparínu také intenzívne protizápalové účinky, že jeho aplikácia podľa autorov zvyšuje riziko infekcie rán (9). Na druhej strane raritne sa vyskytujú aj práce popierajúce protizápalové účinky LMWH (18).
Okrem množstva experimentálnych štúdií boli v poslednom období publikované aj viaceré menšie klinické štúdie prezentujúce protizápalové vlastnosti LMWH. Hoopendsteadt et al. prezentujú štatisticky signifikantný pokles C-reaktívneho proteínu (CRP) po podaní enoxaparínu (19). Je prezentovaný aj pokles incidencie zápalových komplikácii po operáciách oka pre kataraktu po lokálnom podaní enoxaparínu (20). Niektorí autori pripisujú pozitívny vplyv LMWH na IBD len ich antitrombotickým účinkom, inhibíciou mikrotrombotizácii v stene čreva a mikroinfarktov (21). Michel et al. však takýto mechanizmus popierajú, čo podkladajú faktom, že pri terapii warfarínom sa podobné účinky nevyskytujú (22). Iní autori však nepopisujú žiaden účinok enoxaparínu na ulceróznu kolitídu (23).
Z publikovaných štúdii je zrejmé, že UFH a LMWH ovplyvňujú zápalovú reakciu na viacerých úrovniach (obr. 2). Účinok je potvrdený mnohými experimentálnymi modelmi, ako aj sporadickými menšími klinickými štúdiami. Na potvrdenie týchto účinkov v klinickej praxi a určenie presných indikácii a interakcií sú však potrebné väčšie klinické štúdie.
UFH, LMWH a ich vplyv na angiogenézu a reepitelizáciu
Medzi najdôležitejšie deje participujúce na hojení rán patrí angiogenéza a reepitelizácia defektu. Tieto procesy sú dynamicky koordinované viacerými rastovými faktormi, pričom veľká časť z nich je ovplyvniteľná heparínom (tab. 4). Medzi prvé patrí skupina faktorov: fibroblastový rastový faktor (FGF), vaskulárny endoteliálny rastový faktor (VEGF) a hepatocelulárny rastový faktor (HGF) (24).
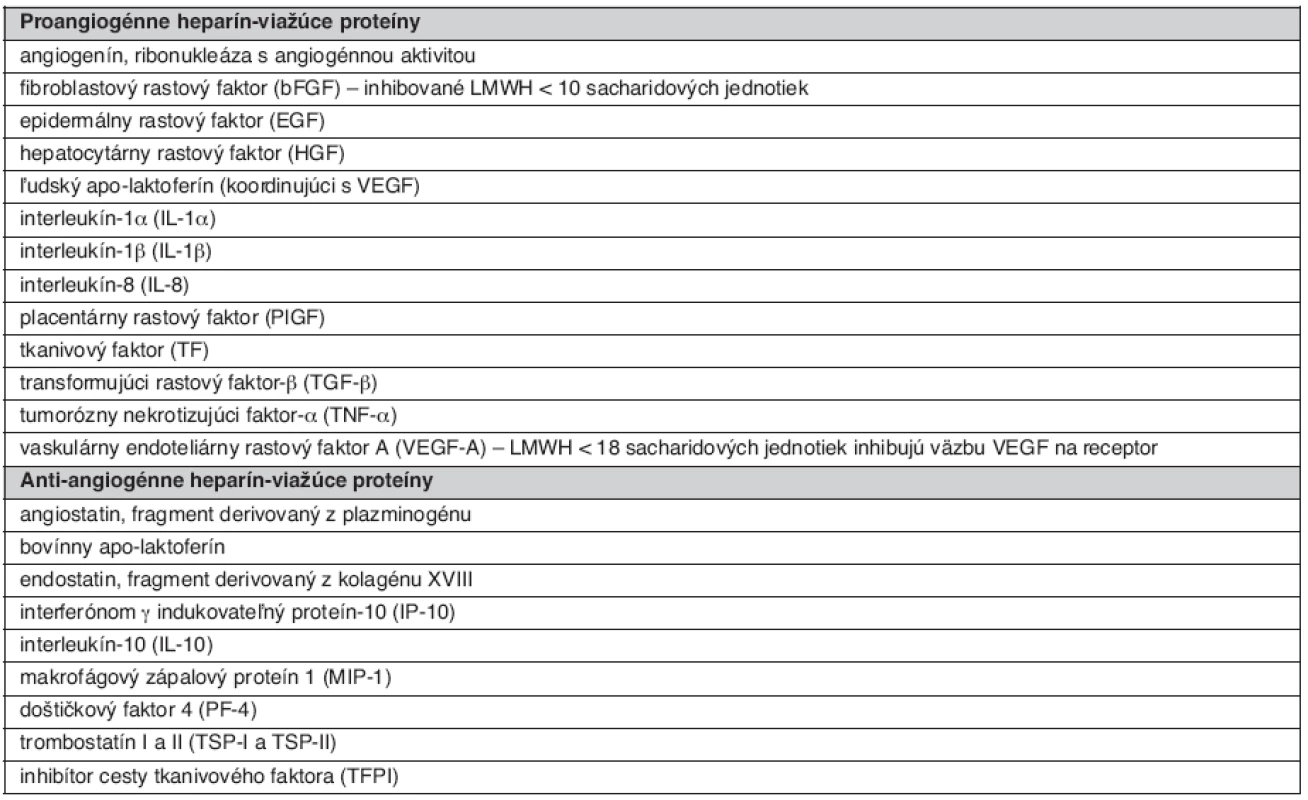
Väčšina prác prezentuje pozitívny vplyv UFH a LMWH na deje stimulované skupinou faktorov FGF, buď up-reguláciou syntézy, alebo potenciovaním biologického účinku (21, 25–27). Základný FGF (bFGF) pôsobí na epitelové bunky prostredníctvom FGF receptora (FGFr) a syndekanu 1 (transmembránového heparansulfátu), čím stimuluje ich proliferáciu. Pri BID dochádza k redukcii syndekanu 1 a spomaleniu regenerácie epitelu. UFH dokáže parciálne suplementovať syndekan 1, čím zvyšuje účinnosť bFGF, proliferáciu endotelu a regeneráciu čreva (8). Niektorí autori špecifikujú zložky molekuly pričom uvádzajú, že stimulačne na FGF pôsobia len heparíny so 6-O-sulfatovaným glykosamínom (25). Ostrowsky et al. priamo špecifikujú interakciu jednotlivých FGF a FGFr a ich ovplyvnenie LMWH s rôzne dlhým reťazcom. LMWH s reťazcom kratším ako 8 sacharidov potenciujú interakciu FGF1 a FGFr 2IIIb a 4, zatiaľ čo LMWH s reťazcom dlhším ako 8 sacharidov potenciujú interakciu FGF1 a FGFr 1 a FGF7 a FGFr 2IIIb (28). Na druhej strane sú publikované práce prezentujúce negatívny vplyv LMWH a UFH na účinky FGF (25).
Kľúčovým rastovým faktorom angiogenézy je VEGF (24). Niektorí autori popisujú, že aplikácia LMWH stimuluje produkciu aj účinnosť VEGF (25, 26). Iné práce priamo dokumentujú pozitívny vplyv na neoangiogenézu, pričom len nepriamo predpokladajú interakciu ovplyvnenia VEGF (12, 26, 27). Na druhej strane existuje množstvo prác prezentujúcich negatívny účinok LMWH na angiogenézu (25, 29, 30). Street et al. dokumentujú inhibíciu angiogenézy pri hojení fraktúr u potkana po podaní enoxaparínu, pričom ako jednu z možných interakcii uvádzajú inhibíciu VEGF (31). Pisano et al. popisujú inhibíciu interakcie VEGF a VEGF receptora po aplikácii LMWH (30). Norby poukazuje na inhibíciu VEGF indukovanej angiogenézy po podaní heparínu s molekulárnou hmotnosťou 5kDa (1). Zaujímavá je práca Hasana et al., kde autori prezentujú, že heparín s 10 a menej sacharidovými podjednotkami (≤ 3 kDa) inhibuje angiogenézu a heparín s 12 a viac sacharidmi (≥ 3,6 kDa) pôsobí na angiogenézu stimulačne (25). Závislosť vplyvu heparínu na angiogenézu od molekulárnej hmotnosti aplikovanej molekuly cestou viacerých rastových faktorov je teda opakovane zdôrazňovaná viacerými prácami (1, 21, 28, 32). Popísané je ovplyvnenie aj iných rastových faktorov angiogenézy, pozitívny vplyv na epiteliálny rastový faktor (EGF) a následné urýchlenie angiogenézy (26). Salbach et al. v klinickej štúdii dokumentujú progresiu angiogenézy pri tkanivovej ischémii po podaní LMWH. Autori nezaznamenali nárast VEGF ani FGF, dokumentujú eleváciu HGF (33).
Ďalšie dve teórie vysvetľujú ovplyvnenie angiogenézy LMWH ich antitrombotickými vlastnosťami. Trombín je koncový produkt koagulačnej kaskády, ktorý urýchľuje degranuláciu mastocytov. Degranuláciou mastocytov dochádza k uvoľneniu množstva rastových faktorov, medzi inými VEGF a bFGF a aktivácii HGF. LMWH svojim účinkom proti koagulačným faktorom IIa a Xa inhibujú tvorbu trombínu, aktiváciu mastocytov, uvoľnenie rastových faktorov, a v konečnom dôsledku pôsobia antiangiogénne (1). Ďalším dôležitým mechanizmom v koagulačnej kaskáde je úloha tkanivového faktora (TF). Heparín a LMWH zasahujú do koagulačnej kaskády nielen znížením produkcie TF endotelovými bunkami, ale aj zvýšením produkcie inhibítora systému tkanivového faktora (TFPI) (1, 3). Podanie enoxaparínu a tinzaparínu spôsobil v klinických štúdiách signifikantný nárast sérovej hladiny TFPI (1, 19). TFPI má značné priame antiangiogénne účinky, čo dokazuje potlačenie inhibície angiogenézy vyvolanej LMWH monoklonálnymi anti-TFPI protilátkami. Uvoľnenie TFPI je však závislé ako na dĺžke reťazca heparínu, tak aj jeho sulfatácii. Najväčší účinok na uvoľnenie TFPI má heparín s hmotnosťou 8 až 12,6 kDa, takmer žiadny nárast hladiny TFPI nespôsobí pentasacharid LMWH (1,5 kDa) (1).
Z prezentovaného je zrejmé, že LMWH a heparín sú schopné značne ovplyvniť angiogenézu. Ich vplyv však významne záleží od presnej špecifikácie molekuly a interakcie so značným množstvom rastových faktorov.
UFH, LMWH a ich vplyv na fibroblasty, tvorbu ECM a hojenie
Maturačná fáza hojenia rán je špecifikovaná tvorbou granulačného tkaniva, ktoré je charakterizované ako tkanivo bohaté na neokapiláry, fibroblasty a exracelulárnu matrix (ECM).
Zvýšená produkcia FGF vplyvom LMWH by sa mala okrem angiogenézy pozitívne prejaviť aj urýchlením migrácie a proliferácie fibroblastov počas hojenia. Viacerí autori prezentujú zvýšenú infiltráciu rany a granulačného tkaniva fibroblastami po aplikovaní LMWH (12, 34). Ďalšie práce dokazujú pozitívny vplyv priamo na ich proliferáciu (21). Iné štúdie sa zameriavajú na produkciu kolagénu, kvantifikáciou hydroxyprolínu počas hojenia, pričom konštatujú pozitívny vplyv LMWH aj na tento parameter priebehu proliferačnej fázy (12, 27, 34, 35). Dokázaný je aj pozitívny vplyv heparínu na ústup senilného fenotypu fibroblastov nastupujúci pri diabetických ranách (36). Niektorí autori sa zameriavajú na hojenie črevných anastomóz v experimente a vplyv na ich možnú dehiscenciu kvantifikovaním pevnosti v ťahu. Dokázaný je vzrast pevnosti črevných anastomóz pri aplikovaní LMWH (35, 37). Na druhej strane ďalšie práce prezentujú, že LMWH neovplyvňujú hojenie rán, pevnosť kožných incízií alebo hojenie zlomenín (26, 37–39). Ba čo viac, niektorí autori uzatvárajú vplyv LMWH na hojenie ako negatívny a prezentujú nárast apoptózy fibroblastov a pokles ich mitóz (9). Krzesniak-Wszola et al. zdôrazňujú zvýšenie produkcie tkanivových kolagenáz a metaloproteináz 1, 8 a 13 po aplikácii LMWH, čo vedie k enzymatickej deštrukcii ECM pri hojení črevných anastomóz a zvýšenému riziku vzniku dehiscencie (40).
Jednu z mála klinických štúdií zameraných na vplyv LMWH na hojenie chronických rán prezentuje Kalani et al. Autori uvádzajú, že aplikovaním dalteparínu dochádza k poklesu počtu amputácií, vzostupu rán zahojených sa až do intaktnej kože i rán zmenšených na menej ako 50 % defektu. Autori pripisujú pozitívny vplyv najmä zlepšením prekrvenia okolia rany (36).
Záver
Skupina LMWH predstavuje súbor špecifických liekov s podobnými, ale určite nie totožnými farmakokinetickými a farmakodynamickými vlastnosťami. Okrem základného účinku ovplyvnenia koagulačnej kaskády sa v súčasnosti upozorňuje na mnohé ďalšie interakcie LMWH. Inhibícia tvorby trombínu sa môže odzrkadliť ako v protizápalových, tak aj antiangiogénnych účinkoch. Množstvo prác zdôrazňuje jednoznačne protizápalový účinok LMWH cestou viacerých patologických mechanizmov. Názory na ovplyvnenie angiogenézy sú v súčasnosti dosť kontroverzné. Stále sa však objavuje viacej štúdií zdôrazňujúcich špecificitu jednotlivých LMWH najmä v tejto oblasti. Najčastejšie je uvádzaná závislosť od dĺžky a sulfatácie molekuly LMWH. Pohľady na ovplyvnenie reepitelizácie a proliferácie fibroblastov tiež nie sú jednoznačné, väčšina autorov ale uvádza stimulačný účinok LMWH. Sporadické malé klinické štúdie poukazujú na možné využitie LMWH tak pri liečbe chronických rán, najmä však zápalových ochorení čreva. Otvára sa teda nová kapitola pre aplikáciu skupiny liečiv LMWH.
Skratky
bFGF – základný fibroblastový rastový faktor
CRP – C-reaktívny proteín
ECM – extracelulárna matrix
FGF – fibroblastový rastový faktor
FGFr – receptor fibroblastového rastového faktora
GAG – glykosaminoglykány
HGF – hepatocetulárny rastový faktor
IBD – zápalové ochorenia čreva (Crohnova choroba, ulcerózna kolitída)
ICAM1 – intercelulárna adhezívna molekula 1
IFN-γ – interferón-γ
IL-8 – interleukín-8
IL-6 – interleukín-6
IL-1β – interleukín-1β
LMWH – nízko-molekulárne heparíny
NFκB – jadrový faktor κB
PMNL – neutrofily (polymorfonukleáry)
TF – tkanivový faktor
TFPI – inhibítor systému tkanivového faktora
TNFα – tumorózny nekrotický faktor α
U.S.FDA – Správa jedla a liekov Spojených štátov amerických
UFH – nefrakcionovaný heparín
WHO – Svetová zdravotnícka organizácia
Adresa pro korespondenci:
MUDr. Tomáš Toporcer
1. chirurgická klinika LF UPJŠ
Tr. SNP 1, 040 01 Košice, Slovenská republika
fax: +421 907 976 185, e-mail: topyto@gmail.com
Sources
1. Norrby, K. Low-molecular-weight heparins and angiogenesis. APMIS 2006; 114 : 79–102.
2. Hirsh J, Levine M. N. Low molecular weight heparin. Blood 1992; 79 : 1–17.
3. Fareed J, Leong WL, Hoppensteadt DA, et al. Generic low-molecular-weight heparins: some practical considerations. Semin Thromb Hemost 2004; 30 : 703–713.
4. Boneu B. Low molecular weight heparins: are they superior to unfractionated heparins to prevent and to treat deep vein thrombosis? Thromb Res 2000; 100: V113–V120.
5. Karetova D, Chochola M, Linhart A. Prevention of thrombembolic disease in internal medicine. Čas Lék čes 2006; 145 : 353–357.
6. Zemkova M, Meyboom RH, Blazek M, et al. Deep vein thromboembolism in malignant diseases. Ces a slov Farm 2007; 56 : 5–10.
7. Mazuch J, Mištuna D, Golian D. Chirurgické aspekty tromboembolickej choroby a venóznych trombóz. Praktická flebologie 2004; 13 : 18–24.
8. Papa A, Danese S, Gasbarrini A, et al. Review article: potential therapeutic applications and mechanisms of action of heparin in inflammatory bowel disease. Aliment Pharmacol Ther 2000; 14 : 1403–1409.
9. Civelek A, Ak K, Kurtkaya O, Tekeli A, et al. Effect of a low molecular weight heparin molecule, dalteparin, on cellular apoptosis and inflammatory process in an incisional wound-healing model. Surg Today 2007; 37 : 406–411.
10. Manduteanu I, Voinea M, Capraru M, et al. A novel attribute of enoxaparin: inhibition of monocyte adhesion to endothelial cells by a mechanism involving cell adhesion molecules. Pharmacology 2002; 65 : 32–37.
11. Downing LJ, Strieter RM, Kadell AM, et al. Low-dose low-molecular-weight heparin is anti-inflammatory during venous thrombosis. J Vasc Surg 1998; 28 : 848–854.
12. Gunerhan Y, Koksal N, Gul O, et al. Effects of unfractionated heparin and low-molecular-weight heparin on colonic anastomoses in the presence of experimental peritonitis. Eur Surg Res 2006; 38 : 353–357.
13. Gottmann U, Mueller-Falcke A, Schnuelle P, et al. Influence of hypersulfated and low molecular weight heparins on ischemia/reperfusion: injury and allograft rejection in rat kidneys. Transpl Int 2007; 20 : 542–549.
14. Zakuciova M, Janicko M, Gombosova L, et al. Infliximab for treatment of fistuling Crohn’s disease – Analysis of 50 patient. Lekársky obzo, 2008; 57 : 106–110.
15. Hochart H, Jenkins PV, Smith OP, et al. Low-molecular weight and unfractionated heparins induce a downregulation of inflammation: decreased levels of proinflammatory cytokines and nuclear factor-kappaB in LPS-stimulated human monocytes. Br J Haematol 2006; 133 : 62–67.
16. Gori AM, Attanasio M, Gazzini A, et al. Cytokine gene expression and production by human LPS-stimulated mononuclear cells are inhibited by sulfated heparin-like semi-synthetic derivatives. J. Thromb Haemost 2004; 2 : 1657–1662.
17. Celasco G, Moro L, Bozzella R, et al. Efficacy of intracolonic administration of low-molecular-weight heparin CB-01-05, compared to other low-molecular-weight heparins and unfractionated heparin, in experimentally induced colitis in rat. Dig Dis Sci 2008; 53 : 3170–3175.
18. Abbruzzese TA, Albadawi H, Kang J, et al. Enoxaparin does not ameliorate limb ischemia-reperfusion injury. J Surg Res 2008; 147 : 260–266.
19. Hoppensteadt D, Fareed J, Klein AL, et al. Comparison of anticoagulant and anti-inflammatory responses using enoxaparin versus unfractionated heparin for transesophageal echocardiography-guided cardioversion of atrial fibrillation. Am J Cardiol 2008; 102 : 842–846.
20. Rumelt S, Stolovich C, Segal Z. I, et al. Intraoperative enoxaparin minimizes inflammatory reaction after pediatric cataract surgery. Am J Ophthalmol 2006; 141 : 433–437.
21. Li Y, Shin VY, Cheuk CY, et al. A 3.0-kDa low molecular weight heparin promotes gastric ulcer healing in rats. Aliment Pharmacol Ther 2001; 15 : 2009–2017.
22. Michell NP, Lalor P, Langman MJ. Heparin therapy for ulcerative colitis? Effects and mechanisms. Eur J Gastroenterol Hepatol 2001; 13 : 449–456.
23. Zezos P, Papaioannou G, Nikolaidis N, et al. Low-molecular-weight heparin (enoxaparin. as adjuvant therapy in the treatment of active ulcerative colitis: a randomized, controlled, comparative study). Aliment Pharmacol Ther 2006; 23 : 1443–1453.
24. Bao P, Kodra A, Tomic-Canic M, et al. The Role of Vascular Endothelial Growth Factor in Wound Healing. J Surg Res 2009; 153 : 317–358.
25. Hasan J, Shnyder SD, Clamp AR, et al. Heparin octasaccharides inhibit angiogenesis in vivo. Clin Cancer Res 2005; 11 : 8172–8179.
26. Oliveira PG, Sousa JB, Reys LG, et al. Effects of enoxaparin on the healing of abdominal wall in rats: study on breaking strength and histopathology. Acta Cir Bras 2006; 21 : 247–251.
27. Arikan S, Adas G, Barut G, et al. An evaluation of low molecular weight heparin and hyperbaric oxygen treatment in the prevention of intra-abdominal adhesions and wound healing. Am J Surg 2005; 189 : 155–160.
28. Ostrovsky O, Berman B, Gallagher J, et al. Differential effects of heparin saccharides on the formation of specific fibroblast growth factor (FGF) and FGF receptor complexes. J Biol Chem 2002; 277 : 2444–2453.
29. De Paula EV, Nascimento MC, Ramos CD, et al. Early in vivo anticoagulation inhibits the angiogenic response following hindlimb ischemia in a rodent model. Thromb Haemost 2006; 96 : 68–72.
30. Pisano C, Aulicino C, Vesci L, et al. Undersulfated, low-molecular-weight glycol-split heparin as an antiangiogenic VEGF antagonist. Glycobiology 2005; 15 : 1C–6C.
31. Street JT, McGrath M, O’Regan K, et al. Thromboprophylaxis using a low molecular weight heparin delays fracture repair. Clin Orthop Relat Res 2000; 381 : 278–289.
32. Mojzis J, Sarissky M, Pilatova M, et al. In vitro Antiproliferative and Antiangiogenic Effects of Flavin7. Physiol Res 2008; 57 : 413–420.
33. Salbach PB, Bruckmann M, Turovets O, et al. Heparin-mediated selective release of hepatocyte growth factor in humans. Br J Clin Pharmacol 2000; 50 : 221–226.
34. Kus E, Bienkiewicz A. Subcutaneous low molecular weight heparin administration promotes wound healing in rats. Pathophysiology 2006; 13 : 81–84.
35. Ergul E, Ozgun YM, Kiyak G, et al. Does Low Molecular Weight Heparin Impair Anastomotic Wound Healing? J Gastrointest Surg 2009; 13 : 798–803.
36. Kalani M, Apelqvist J, Blomback M, et al. Effect of dalteparin on healing of chronic foot ulcers in diabetic patients with peripheral arterial occlusive disease: a prospective, randomized, double-blind, placebo-controlled study. Diabetes Care 2003; 26 : 2575–2580.
37. Matzsch T, Bergqvist D, Blomquist P, et al. Influence of standard heparin or low molecular weight heparin on healing of abdominal wounds and colonic anastomoses in rats. Acta Chir Scand 1987; 153 : 593–598.
38. Kock HJ, Werther S, Uhlenkott H, et al. Influence of unfractionated and low-molecular-weight heparin on bone healing: an animal model. Unfallchirurg 2002; 105 : 791–796.
39. Hak DJ, Stewart RL, Hazelwood SJ. Effect of low molecular weight heparin on fracture healing in a stabilized rat femur fracture model. J Orthop Res 2006; 24 : 645–652.
40. Krzesniak-Wszola N, Bielecki K, Ostrowski J. Do low-molecular-weight heparins influence the healing process in colon anastomosis? Colorectal Dis 2007; 9 : 489–493.
Labels
Addictology Allergology and clinical immunology Angiology Audiology Clinical biochemistry Dermatology & STDs Paediatric gastroenterology Paediatric surgery Paediatric cardiology Paediatric neurology Paediatric ENT Paediatric psychiatry Paediatric rheumatology Diabetology Pharmacy Vascular surgery Pain management Dental HygienistArticle was published in
Journal of Czech Physicians

- Advances in the Treatment of Myasthenia Gravis on the Horizon
- Possibilities of Using Metamizole in the Treatment of Acute Primary Headaches
- Metamizole at a Glance and in Practice – Effective Non-Opioid Analgesic for All Ages
- Metamizole vs. Tramadol in Postoperative Analgesia
- Spasmolytic Effect of Metamizole
-
All articles in this issue
- Specializační vzdělávání lékařů v České republice
- Personalizovaná medicína – genomická fáze Proč a zač
- Nízko-molekulárne heparíny a ich neantitrombotické účinky na hojenie rán
- Kompliance v psychiatrii
- Podávání intravenózního železa v bezkrevní medicíně
- Pomoc manželkám mužů závislých na alkoholu
- Historie a současnost registrace vrozených vad v České republice
- Možnosti léčby plazmou u pacientů s hereditární formou trombotické trombocytopenické purpury
- Journal of Czech Physicians
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Podávání intravenózního železa v bezkrevní medicíně
- Nízko-molekulárne heparíny a ich neantitrombotické účinky na hojenie rán
- Kompliance v psychiatrii
- Možnosti léčby plazmou u pacientů s hereditární formou trombotické trombocytopenické purpury
