Karcinom pankreatu – naše zkušenosti se vztahem k diabetes mellitus
Our experience with pancreatic cancer and its relation to diabetes mellitus
Background.
Despite the introduction of new imaging methods, the prognosis of pancreatic carcinoma (PC) remains hopeless. Therefore, there has been exerted much effort to elucidate the risk factor enabling the diagnosis of PC in the „preclinical state“. At the time of PC diagnosis, more than 30 % of patients suffer from diabetes mellitus, much more often than in the rest of the population. It is not clear whether DM is a risk factor for PC onset or DM appears secondary to the destruction of the gland by the tumor progression or by the effect of unknown factors produced by the cancer cells.
Methods and Results.
We enrolled 204 individuals into the study, 69 of them were controls, 70 patients had type 2 diabetes mellitus and 65 cases had newly diagnosed PC. The patients with PC had in 68% of cases disturbed glucose homeostasis and significantly higher values of insulin resistance index (HOMA-IR) in comparison with the control group. The presence of glucose homeostasis disturbances does not influence tumor staging and localization.
Conclusions.
Results of our pilot study confirmed the so far unsatisfactory state of PC diagnostics (majority of cases fall to stages III and IV) and corroborated the close relation to DM. The early markers for the risk of pancreatic carcinoma development should be searched among the factors participating in the regulation of the glucose homeostasis and insulin sensitivity.
Key words:
pancreatic cancer, insulin resistance, diabetes mellitus.
Authors:
Tomáš Krechler 1; Miroslav Zeman 1; Marek Vecka 2; Marie Jáchymová 2; Josef Hořejš 3; Zdeněk Krška 4; Jan Ulrych 4; Jana Dušková 5; Aleš Žák 1
Authors‘ workplace:
Univerzita Karlova v Praze, 1. lékařská fakulta, IV. interní klinika VFN
1; Univerzita Karlova v Praze, 1. lékařská fakulta, Ústav klinické biochemie a laboratorní diagnostiky
2; Univerzita Karlova v Praze, 1. lékařská fakulta, Radiodiagnostická klinika VFN
3; Univerzita Karlova v Praze, 1. lékařská fakulta, 1. chirurgická klinika VFN
4; Univerzita Karlova v Praze, 1. lékařská fakulta, Ústav patologie
5
Published in:
Čas. Lék. čes. 2010; 149: 291-296
Category:
Original Article
Overview
Východisko.
Prognóza karcinomu pankreatu v době diagnózy je přes všechny dosud zavedené diagnostické metody obvykle infaustní. Proto se hledají takové markery, jejichž stanovení by umožňovalo diagnostikovat karcinom pankreatu v „preklinickém stadiu“. Diabetes mellitus je mezi pacienty s karcinomem pankreatu mnohem častěji přítomen než v ostatní populaci. Není jasné, zda je diabetes rizikovým faktorem pro vznik karcinomu pankreatu, nebo zda diabetes vzniká sekundárně jako následek destrukce žlázy růstem nádoru či působením dosud neznámých faktorů, produkovaných nádorovými buňkami.
Metody a výsledky.
Vyšetřili jsme celkem 204 probandů, z toho 69 kontrolních osob, 70 pacientů s diabetes mellitus 2. typu a 65 pacientů s nově diagnostikovaným karcinomem pankreatu. Mezi našimi pacienty s karcinomem pankreatu mělo 68 % poruchu homeostázy glukózy a významně vyšší hodnoty ukazatele inzulínové rezistence HOMA-IR oproti kontrolní skupině. Přítomnost poruch glukózové homeostázy ve skupině karcinomu pankreatu nemá vliv na zastoupení jednotlivých stadií karcinomu ani na jeho lokalizaci.
Závěry.
Výsledky naší pilotní studie potvrzují dosud nevyhovující stav diagnostiky karcinomu pankreatu (většina nádorů ve stadiu III a IV) a těsný vztah karcinomu pankreatu k diabetes mellitus. Mezi faktory účastnící se regulace homeostázy glukózy a inzulínové senzitivity bude vhodné hledat biologické časné markery rizika rozvoje karcinomu pankreatu.
Klíčová slova:
karcinom pankreatu, diabetes mellitus, inzulínová rezistence.
Úvod
Karcinom pankreatu (KP) je čtvrtou nejčastější příčinou smrti na nádorová onemocnění v USA (1) a pátou v Evropě (2). Incidence i prevalence KP neustále vzrůstá. Prevalence KP byla v České republice v roce 1989 u mužů 8,6/100 000 a vzrostla do roku 2005 o 45,9 % na 12,6/100 000. Ještě výraznější vzestupný trend je možné zaznamenat v prevalenci KP u žen: v roce 1989 6,7/100 000 a v roce 2005 vzestup na 12,2/100 000, tedy vzestup o 79,4 %. Absolutní incidence u obou pohlaví roste s věkem: Případy nově diagnostikovaných KP jedinců mladších 35 let jsou ojedinělé, od 45 let věku pak incidence prudce vzrůstá a nejvyšší je mezi 65–75 lety.
Zhoubné nádory pankreatu jsou čtvrtou nejčastější příčinou úmrtí na zhoubné nádory v České republice u obou pohlaví (3). Histologicky lze zhoubné nádory pankreatu klasifikovat v 95 % jako duktální adenokarcinom (PDAC – pankreatický duktální adenokarcinom) a pouze v 5 % karcinom postihuje acinární buňky (4). Drtivá většina případů karcinomu pankreatu je diagnostikována již v pokročilém stadiu III a IV s postižením lymfatických uzlin a přítomností metastáz. Proto se stále objevují snahy o rozpoznání takového rizikového faktoru, který by umožňoval diagnostikovat karcinom pankreatu v „preklinickém stadiu“. Z hlediska rozměrů nádoru by se mělo jednat o nádory menší než 2 cm, s omezeným šířením do okolních struktur. U takových nádorů pak stoupá 5leté přežití na 14–37 % (5–7).
Etiopatogeneze KP je multifaktoriální. Uplatňují se vlivy zevního prostředí, získané genetické poruchy i vliv genetické dědičné zátěže. Riziko vzniku karcinomu pankreatu zvyšuje kouření cigaret, nadváha a obezita (8, 9). Naproti tomu se zdá, že fyzická aktivita a příjem ovoce a zeleniny ve stravě mají ochranný vliv (10). Interakce genetických činitelů a faktorů zevního prostředí pak iniciují kancerogenezi. Buňky KP vznikají postupnou přeměnou prekurzorových lézí: 1. buď přes pankreatické intraepiteliální neoplazie (PanIN-1 až PanIN-3), které mohou být ve zvýšené míře přítomny i v terénu chronické pankreatitidy (11), anebo 2. přes mucinózní cystické novotvary, či intraduktální mucinózní neoplazie (s postupně vzrůstající pokročilostí) na karcinom in situ (12, 13), které korelují se zvyšující se frekvencí mutací onkogenů (K-ras, HER 2/neu), ztrátou exprese tumor supresorových genů (p16, p53, DPC4/SMAD4, BRCA2), mutací udržujícími stabilitu genů (hMLH1, hMSH2, BRCA2, BRCA1), abnormalitami epigenetickými a vývojových signálních drah, zkracováním telomer a ztrátou 18q chromozomu (DCC), prokazovaných v těchto novotvarech (12, 14, 15).
Jediným potenciálně kurativním způsobem léčby KP je chirurgická resekce tumoru. Udává se, že v době stanovení diagnózy je méně než 15 % tumorů resekabilních. Naše zkušenosti jsou obdobné jako pozorování jiných autorů, u kterých bylo procento kurativních resekcí 2,6 % z celkového počtu diagnostikovaných KP (7).
Pětileté přežití u chirurgicky resekabilních nádorů velmi závisí na tom, jak veliký je nádor v době diagnózy: u velkých nádorů (cca 30 mm je asi 10–20 %, u nádorů menších 20 mm se udává asi 14–37 % (6, 16), zatímco u nádorů resekovaných při velikosti pod 10 mm je to již asi 75 % (5, 17–19). Včasná detekce pokročilých stadií neinvazivní nebo časné invazivní fáze KP by vyžadovala screening asymptomatických osob. Avšak KP není příliš častý a screening celé populace by bylo velmi nákladný. Byla provedena analýza, ve které bylo zjištěno, že pro dosažení ekonomické efektivity screeningu je třeba zajistit, aby pravděpodobnost nálezu dysplazie nebo nádoru před provedením specifických vyšetření byla alespoň 16 % (20). Proto se doporučuje použití dvoustupňové strategie. V prvním stupni screeningu by měla být identifikována část populace s významně vyšším než průměrným rizikem vzniku onemocnění a ve druhém stupni se hledá další fenotypická charakteristika mezi osobami s vysokým rizikem (nějaký biochemický či sérologický marker či jiný faktor, zjistitelný neinvazivním způsobem), která by byla známkou časného stadia rakoviny pankreatu (21, 22).
Současná diagnostika KP spočívá ve využití rychle se rozvíjejících zobrazovacích metod (EUS – endosonografická ultrasonografie, CT – počítačová tomografie, MR – magnetická rezonance). V současné době je možné díky těmto metodám diagnostikovat i malé léze pankreatu (do 1 cm), a tím významně prodloužit přežívání pacientů. Hlavní problém však spočívá v tom, že právě tyto léze jsou asymptomatické a jejich občasná většinou náhodná diagnóza nemění nic na špatné prognóze většiny nemocných s KP.
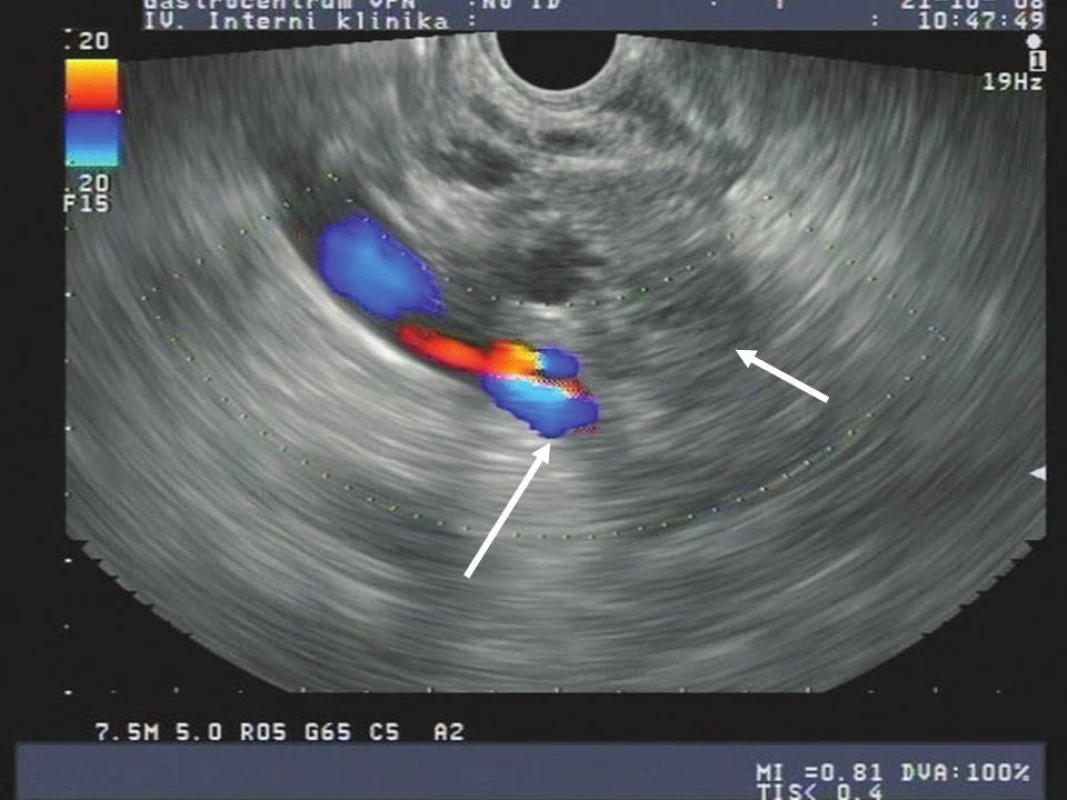
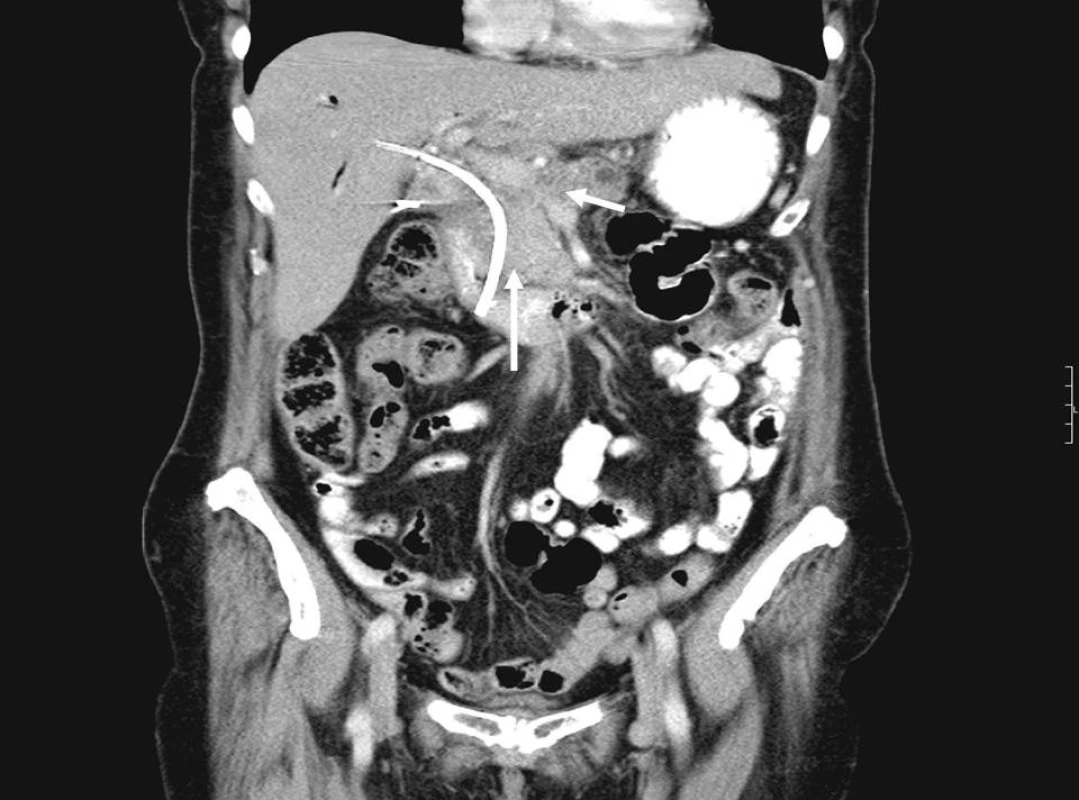
Na obrázcích 1 a 2 jsou zobrazeny endosonografické a CT snímky karcinomu hlavy pankreatu.
Prevalence diabetes mellitus (DM) 2. typu je vyšší (35%) u pacientů s KP než v běžné populaci (23). V současné době se ukazuje, že nově diagnostikovaný DM by mohl sloužit jako vhodný první stupeň ve screeningu KP. Nemocní s nově zjištěným DM mají vyšší pravděpodobnost vzniku KP než ostatní populace. V rozsáhlé populační studii v USA byl u 0,8 % nemocných s nově zjištěným DM starších 50 let do tří let po diagnóze DM diagnostikován KP a poměr skutečně vzniklých případů k očekávaným byl 7,9 (24).
Vztahy mezi DM a KP jsou zřejmě obousměrné. Nemocní s dlouhotrvajícím DM 2. typu mají mírně zvýšené riziko KP (25). Nedávné metaanalýzy ukázaly, že u nově manifestovaného DM 2. typu je riziko vzniku KP výrazně vyšší (26). Karcinom pankreatu je na druhé straně spojen s vysokou prevalencí DM 2. typu. Diabetes mellitus je častý již u časných stadií KP; u karcinomů menších než 10 mm byl v jedné studii nalezen DM ve třetině případů (5). Pannala et al. (27) našli ve dvou studiích u celkem 642 nově zjištěných nemocných s karcinomem pankreatu 47 % diabetiků. V jiné studii mělo více než 80 % pacientů v době stanovení diagnózy KP hraniční poruchu glukózové homeostázy či již DM (28).
Vzhledem k uvedeným souvislostem manifestace KP s poruchami glukózového metabolismu jsme se v této práci zaměřili na sledování parametrů glukózové homeostázy u nemocných s diagnostikovaným KP.
SOUBOR NEMOCNÝCH A POUŽITÉ METODY
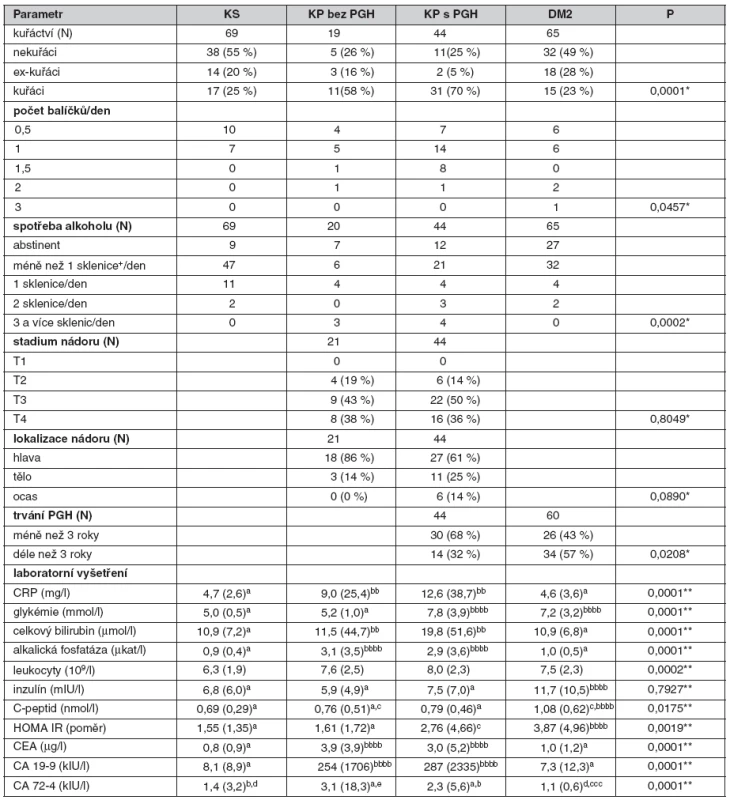
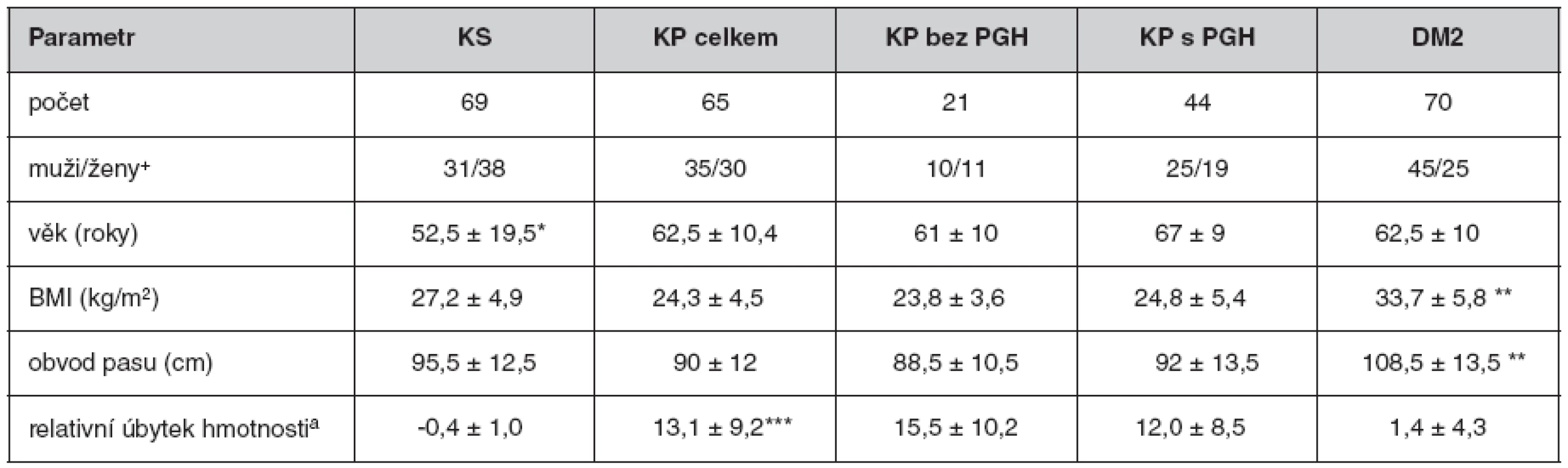
V této studii bylo vyšetřeno celkem 204 pacientů, z toho 69 kontrolních osob, 70 pacientů s DM 2. typu a 65 pacientů s nově diagnostikovaným KP. Pacienti s KP byli diagnostikováni na IV. interní klinice 1. LF UK a VFN v Praze v období 1/2006–8/2009. Karcinom pankreatu byl u pacientů verifikován histologicky (z aspirační biopsie nebo chirurgického resekátu). Nemocní byli kompletně vyšetřeni klinicky a byla provedena základní biochemická vyšetření včetně ukazatelů homeostázy glukózy (glykémie, C-peptid, inzulín) a byl vypočten ukazatel inzulínové rezistence HOMA-IR (výpočet viz tab. 1).
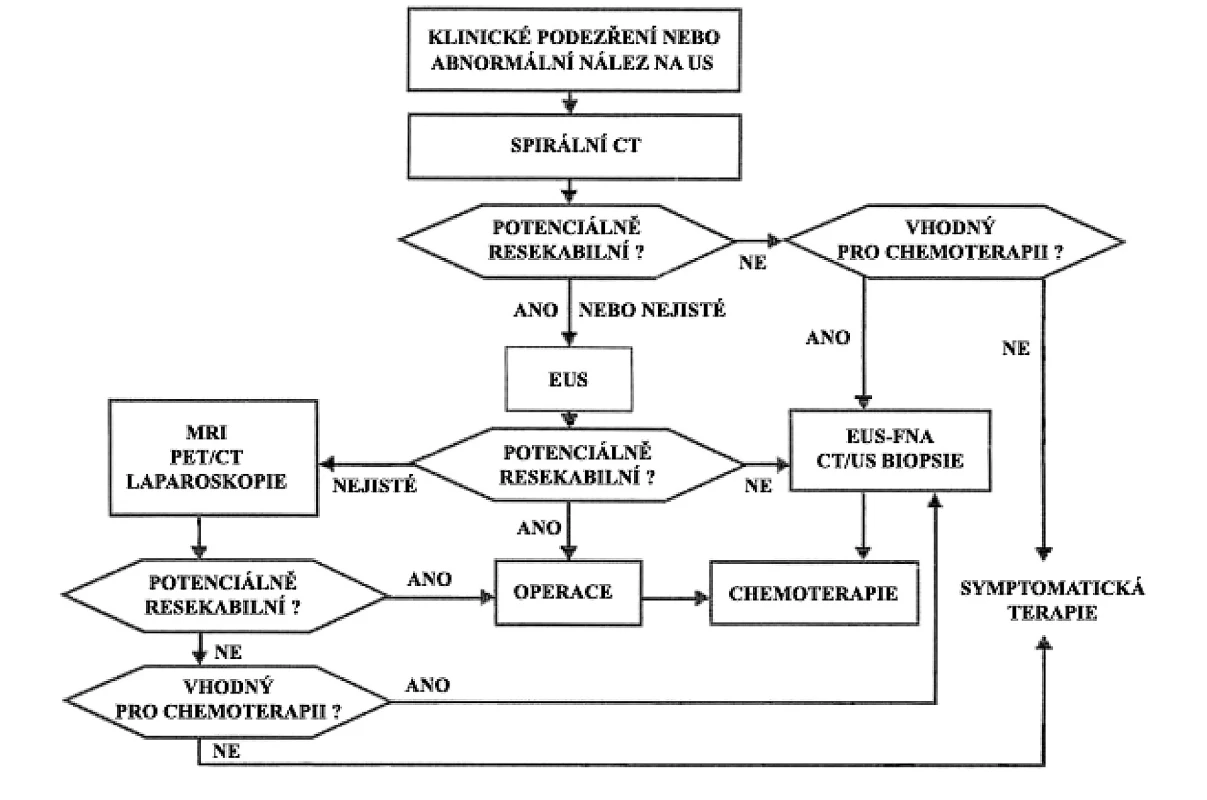
Studie byla schválena Etickou komisí 1. LF UK a VFN. Ke stanovení stupně pokročilosti (staging) jsme použili kombinaci doporučených postupů vypracovaných mezinárodní Union Internationale Contre le Cancer (UICC) a americkou American Joint Committee on Cancer (29). V diagnostice KP jsme postupovali dle doporučovaných postupů. Diagnostický algoritmus je shrnut na obrázku 3 (30).
Kontrolní skupina sestává ze zdravých osob (zdravotnický personál, studenti 1. LF UK), z nemocných s chorobami muskuloskeletálního aparátu degenerativního původu a z osob s funkčními poruchami zažívacího ústrojí. Poruchy glukózové homeostázy byly diagnostikovány podle publikovaných kritérií (31). Byli sem zařazeni nemocní s DM 2. typu nebo s porušenou lačnou glykémií (> 6,1 mmol/l). U všech probandů byla provedena klinická, antropometrická a biochemická vyšetření.
Do našeho souboru pacientů s KP a DM 2. typu nebyli zařazeni pacienti se současně se vyskytující chronickou pankreatitidou. Základní charakteristiky vyšetřovaných souborů jsou shrnuty v tabulce 2.
Výsledky
V našem souboru s nově diagnostikovaným KP dominují pacienti v pokročilém stadiu T3 a T4 (85 %). Lokalizace i stupeň pokročilosti nádoru se ve skupinách s poruchou glukózové homeostázy (PGH) i bez PGH nelišily. Ve skupině KP mělo 28 pacientů DM a 16 pacientů porušenou glykémii nalačno. Délka trvání PGH u pacientů s KP se pohybovala v rozmezí 0–23 let. U většiny pacientů v našem souboru s KP a PGH (68 %) byla přítomna PGH trvající kratší dobu než 3 roky. U 18 pacientů (41 %) byla PGH zjištěna v době stanovení diagnózy KP. Ve skupině s KP byli významně častěji zastoupeni kuřáci (65 %, P(χ2) < 0,001) a byla také zaznamenána významně vyšší spotřeba alkoholu (P(χ2) < 0,001).
Nemocní s KP (obě podskupiny) měli statisticky významně vyšší hodnoty ALP a bilirubinu, významně vyšší hladiny sledovaných onkomarkerů (CA 19-9, CEA (P < 0,001) i CA 72-4 (P < 0,02)).
U nemocných KP (ať už se současným PGH, nebo bez ní) jsme ve srovnání s kontrolní skupinou našli vyšší hladiny inzulínu, rozdíl však při daném rozptylu a velikosti souboru nedosáhl statistické významnosti.
Statisticky významný byl pouze rozdíl mezi skupinou DM2 a ostatními skupinami (P < 0,0001). Lačná glykémie byla významně vyšší u skupiny DM a KP-PGH ve srovnání se skupinou kontrolní (KS) i KP bez PGH (P < 0,0001), skupiny KS a KP bez PGH a KP s PGH se mezi sebou nelišily. Při sledování ukazatele inzulínové rezistence (HOMA-IR) jsme zjistili, že skupina DM se významně liší vyššími hodnotami od všech ostatních skupin, nemocní skupiny KP s PGH měli index HOMA-IR významně vyšší ve srovnání se skupinou KS (P < 0,006) i KP bez PGH (P < 0,023) (viz tab. 2).
Diskuze
Hlavní nález této pilotní studie bylo zjištění, že 68 % nemocných s nově diagnostikovaným KP našeho souboru mělo poruchu homeostázy glukózy (buď DM2, nebo porušenou glykémii nalačno). Pacienti s KP se současně přítomnou PGH měli vyšší stupeň inzulínové rezistence ve srovnání s KS. Z uspořádání studie vyplývá, že nebylo u našich nemocných možno stanovit, zda diabetes mellitus diagnóze KP předcházel, nebo zda manifestace DM byla důsledkem diabetogenního působení KP. Z výsledků publikovaných klinických studií vyplývá, že vznik hyperglykémie nebo DM u štíhlých osob starších 45–50 let bez rodinné anamnézy diabetu by měl být indikací ke screeningovému vyšetření na KP (24, 27). Zdá se, že vznik diabetické poruchy u KP není působen destrukcí endokrinní pankreatické tkáně, ale spíše je důsledkem působení dosud neurčených faktorů produkovaných nádorem (32). Vyšší hodnoty zánětlivých parametrů (CRP a leukocytů) ve skupině KP v naší práci zřejmě souvisejí s pokročilým stadiem nádorů a častými zánětlivými komplikacemi.
Významně vyšší hodnoty ALP a bilirubinu u nemocných s KP (obě podskupiny) lze částečně vysvětlit určitým stupněm cholestázy u většiny nově diagnostikovaných KP, jednak faktem, že v buňkách duktálního adenokarcinomu pankreatu je zvýšená exprese alkalické fosfatázy (ALP) (33).
Diabetes mellitus 2. typu, zejména v prvních letech, dokud nedochází k vyčerpání inzulární rezervy, je obvykle provázen hyperinzulinémií se současnou rezistencí na působení inzulínu v periferních tkáních. Chronicky působící zvýšená hladina inzulínu může svým mitogenním vlivem u diabetiků podporovat iniciaci a progresi nádorů. Hyperinzulinémie může být spojena se zvýšenou aktivací receptorů pro inzulínu podobný růstový faktor (insulin-like growth factor-1 – IGF-1), který je z 80 % homologní s inzulínovým receptorem, ale jeho mitogenní potenciál je vyšší. Inzulín také snižuje hladinu IGF‑vázajících proteinů (IGF-BP1 a IGF BP2) s následným zvýšením biologicky aktivní volné frakce IGF (34, 35).
Relativně nižší hodnoty HOMA-IR u pacientů s PGH oproti skupině DM 2. typu mohou být částečně vysvětleny zastoupením nemocných s různou závažností poruchy glukózové homeostázy v obou skupinách. Ve skupině pacientů s PGH jsou zahrnuti i pacienti s IFG a ve skupině DM 2. typu mohou být rozdíly v trvání diabetu i léčbě.
U části pacientů s DM bude zřejmě v důsledku hyperglykémie a hyperinzulinémie, případně dalších, dosud neznámých faktorů, vytvořeno prokancerogenní prostředí a u jiných naopak rozvíjející karcinom pankreatu může produkovat diabetogenní faktory. Není také vyloučené, že existuje podskupina pacientů, u které se neprojevuje diabetogenní potenciál karcinomu. U naší skupiny pacientů bez PGH jsou tedy hodnoty glukózy a inzulínu (tedy i HOMA-IR) srovnatelné s hodnotami kontrolní skupiny. Hodnocení výsledků dále komplikuje vliv hubnutí, který je vyjádřen výrazně nižším body mass indexem (BMI) u KP bez PGH ve srovnání s DM.
V nádorových buňkách je často pozorována zvýšená exprese inzulínových receptorů (36), u kterých byla v experimentálních studiích zjištěna vyšší senzitivita (37). Vyšší exprese izoformy A inzulínového receptoru v těchto buňkách může vést k jejich vyššímu mitogennímu potenciálu (38). Vliv inzulínové rezistence na kancerogenezi pravděpodobně také souvisí s úzkým vztahem inzulínové rezistence k chronickému zánětlivému stavu a oxidačnímu stresu, které se v kancerogenezi významně uplatňují, např. prostřednictvím aktivace jaderného transkripčního faktoru NFκB (39).
ZÁVĚR
Závěrem lze konstatovat, že jsme v této pilotní studii potvrdili významnou asociaci nově diagnostikovaného KP s poruchami glukózové homeostázy (v našem souboru 68 % nemocných s KP mělo PGH). Tito nemocní měli ve srovnání s osobami kontrolní skupiny rovněž rezistenci na působení inzulínu. Zdá se, že při hledání „druhého filtru“, umožňujícího mezi diabetiky najít osoby se zvýšeným rizikem KP, bude vhodné pátrat po biochemickém nebo sérologickém markeru souvisejícím s inzulínovou rezistencí.
Zkratky
- ALP – alkalická fosfatáza
- BMI – body mass index
- CEA – karcinoembryonální antigen
- CRP – C-reaktivní protein
- CT – počítačová tomografie
- DM – diabetes mellitus
- ERCP – endoskopická retrográdní cholangiopankreatografie
- EUS – endoskopická ultrasonografie
- HOMA-IR – index inzulínové rezistence
- IGF-1 – insulin-like growth factor-1
- KP – karcinom pankreatu
- KS – kontrolní skupina
- MR – magnetická rezonance
- MRCP – cholangiopankreatografie při zobrazení magnetickou rezonancí
- PanIN – pankreatická intraepiteliální neoplazie
- PGH – porucha glukózové homeostázy (DM nebo porušená glykémie nalačno)
- PDAC – pankreatický duktální adenokarcinom
Studie byla podpořena grantem č. 9528-3 IGA MZ ČR.
Adresa pro korespondenci:
MUDr. Tomáš Krechler, CSc.
IV. interní klinika 1. LF UK a VFN
U Nemocnice 2, 128 08 Praha 2
fax: +420 224 923 524, e-mail: krechler@vfn.cz
Sources
1. Jemal A, Seigel R, Ward E, et al. Cancer statistics, 2007. CA Cancer J Clin 2007; 57 : 43–66.
2. Ferlay J, Autier P, Boniol M, et al. Estimates of the cancer incidence and mortality in Europe in 2006. Ann Oncol 2007; 18 : 581–592.
3. Novotvary 2006. Praha, ÚZIS a NOR, 2009.
4. Castillo FC, Jimenez RE. Pancreatic cancer, cystic pancreatic neoplasms, and other nonendocrine pancreatic tumors. In: Feldman M, Friedman LS, Sleisinger MH. Eds, Sleisinger & Fordtrans’s Gastrointestinal and Liver Dissease. Pathophysiology/Diagnosis/Management. 7th ed. Philadelphia; WB. Saunders Company: 2002, 970-987.
5. Tsuchia R, Noda T, Harada N, et al. Colective review of small carcinoma of the pancreas. Ann Surg 1986; 203 : 77.
6. Niederhuber JE, Brennan MF, Menck HR. The national cancer data base report on pancreatic cancer. Cancer 1995; 76 : 1671–1677.
7. DiMagno EP, Reber HA, Tempero MA. AGA technical rewiew on the epidemiology, diagnosis and treatment of pancreatic ductal adenocarcinoma Gastroenteroloy 1999; 177 : 1464–1484.
8. Michaud DS, Giovannucci E, Willett WC, et al. Physical activity, obesity, height, and the risk of pancreatic cancer. JAMA 2001; 286 : 921–929.
9. Van den Brandt PA, Goldbohm RA. Nutrition in the prevention of gastrointestinal cancer. Best Pract Res Clin Gastroenterol 2006; 20 : 589–603.
10. Anand P, Kunnumakkara AB, Sundaram C, et al. Cancer is a preventable disease that requires major lifestyle changes. Pharm Res 2008; 25 : 2097–2116.
11. Hermanová M, Nenutil R, Křen L, et al. Proliferative activity in pancreatic intraepithelial neoplasias of chronic pancreatitis resection specimen: Detection of high-risk lesions. Neoplasma 2004; 51 : 400–404.
12. Maitra A, Hruban RH. Pancreatic cancer. Annu Rev Pathol 2008; 3 : 157–188.
13. Hruban RH, Maitra A, Kern SE, Goggins M. Precursors to pancreatic cancer. Gastroenterol Clin North Am 2007; 36 : 831–849.
14. Zavoral M, et al: Karcinom pankreatu. Praha: Galén 2005.
15. Koorstra JB, Hustinx SR, Offerhaus GJ, Maitra A. Pancreatic carcinogenesis. Pancreatology 2008; 8 : 110–1125.
16. Bramhall SR, Allum WH, Jones AG, et al. Treatment and survival in 13560 patients with pancreatic cancer and incidence of the diseases in the West Midlands: an epidemiological study. Br J Surg 1995; 82 : 111–115.
17. Conlon KC, Klimstra DS, Brennan MF. Long-term survival after curative resection for pancreatic ductal adenocarcinoma. Clinicopathologic analysis of 5-year survivors. Ann Surg 1996; 223 : 273–279.
18. Sohn TA, Yeo CJ, Cameron JL, et al. Resected adenocarcinoma of the pancreas-616 patients: results, outcomes, and prognostic indicators. J Gastrointest Surg 2000; 4 : 567–579.
19. Ishikawa O, Ohigashi H, Imaoka S, et al. Minute carcinoma of the pancreas measuring 1 cm or less in diameter — collective review of Japanese case reports. Hepatogastroenterology 1999; 46 : 8–15.
20. Rulyak SJ, Kimmey MB, Veenstra DL, Brentnall TA. Cost-effectiveness of pancreatic cancer screening in familial pancreatic cancer kindreds. Gastrointest Endosc. 2003; 57 : 23–29.
21. Chari ST, Leibson CL, Rabe KG, et al. Probality of pancreatic cancer following diabetes: a population based study. Gastroenterology 2005; 129 : 504–511.
22. Pannala R, Leirness JB, Bamlet WR, et al. Prevalence and clinical profile of pancreatic cancer-associated diabetes mellitus. Gastroenterology 2008; 134 : 981–987.
23. Trna J, Dítě P, Hermanová M, et al. Diabetes mellitus in patients suffering from pancreatic cancer. Čes a slov gastroenter a hepatol 2008; 62 : 69–73.
24. Chari ST. Detecting Pancreatic Cancer Early: Problems and Prospects. Semin Oncol 2007; 34 : 284–294.
25. Everhart J, Wright D. Diabetes mellitus as a risk factor for pancreatic cancer. JAMA 1995; 273 : 1605–1609.
26. Huxley R, Ansary-Moghaddam A, Berrington DF, et al. Type-II – Diabetes and pancreatic cancer: a meta-analysis of 36 studies. Br J Cancer 2005; 92 : 2076–2083.
27. Pannala R, Leirness JB, Bamlet WR, et al. Prevalence and clinical profile of pancreatic cancer-associated diabetes mellitus. Gastroenterology 2008; 134 : 981–987.
28. Noy A, Bilezikian P. Diabetes and pancreatic cancer: clues to early diagnosis of a. pancreatis malignancy. J Clin Endocrinol Metab 1994; 79 : 1223–1231.
29. AJCC Cancer staging Handbook. The 6th edition. New York: Springer Verlag 2002.
30. Michl P, Oauls S, Gross TM. Evidence-based diagnosis and staging of pancreatic cancer. Best Pract Res Clin Gastroenterol 2006; 120 : 227–251.
31. The Expert Committee on the Diagnosis and Classification of Diabetes Mellitus: Report of the on the Diagnosis and Classification of Diabetes Mellitus. Diabetes Care 1997; 20, 1183–1189.
32. Basso D, Valerio A, Seraglia R, et al. Putative pancreatic cancer – associated diabetogenit factor 2030 MW peptide. Pancreas 2002; 24 : 8–14.
33. Benham F J, Fögh J, Harris H. Alkaline phosphatase expression in human cell lines derived from various malignancies. Int J Cancer 1981; 27 : 637–644.
34. Kaaks R, Lukanova A. Energy balance and cancer: the role of insulin and insulin-like growth factor-I. Proc Nutr Soc 2001; 60 : 91–106.
35. Sandhu MS, Dunger DB, Giovannucci EL. Insulin, insulin-like growth factor-I(IGF-I), IGF bindings proteins, their biologic interactions, and colorectal cancer. J Natl Cancer Inst 2002; 94 : 972–980.
36. Milazzo G, Giorgino F, Damante G, et al. Insulin receptor expression and function in human breast cancer cell lines. Cancer Res 1992; 52 : 3924–3930.
37. Frittitta L, Vigneri R, Papa V, et al. Structural and functional studies of insulin receptors in human breast cancer. Breast Cancer Res Treat 1993; 25 : 73–82.
38. Godsland IF. Insulin resistance and hyperinsulinaemia in the development and progression of cancer Clinical Science 2010; 118 : 315–332.
39. Federico A, Morgillo F, Tuccillo C, et al. Chronic inflammation and oxidative stress in human carcinogenesis. Int J Cancer 2007; 121 : 2381–2386.
Labels
Addictology Allergology and clinical immunology Angiology Audiology Clinical biochemistry Dermatology & STDs Paediatric gastroenterology Paediatric surgery Paediatric cardiology Paediatric neurology Paediatric ENT Paediatric psychiatry Paediatric rheumatology Diabetology Pharmacy Vascular surgery Pain management Dental HygienistArticle was published in
Journal of Czech Physicians

- Advances in the Treatment of Myasthenia Gravis on the Horizon
- Possibilities of Using Metamizole in the Treatment of Acute Primary Headaches
- Metamizole vs. Tramadol in Postoperative Analgesia
- Metamizole at a Glance and in Practice – Effective Non-Opioid Analgesic for All Ages
- Spasmolytic Effect of Metamizole
-
All articles in this issue
- Neurinom akustiku – vestibulární schwannom – osobní pohled na nejmodernější postupy v jeho léčbě
- Diabetes mellitus 2. typu jako subklinický zánět
- Diabetes mellitus, antidiabetika a kost
- Kalcitonin a jeho úloha v regulaci kalciofosfátového metabolismu
- Karcinom pankreatu – naše zkušenosti se vztahem k diabetes mellitus
- Katétrová infekce vyvolaná Mycobacterium bovis
- Journal of Czech Physicians
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Neurinom akustiku – vestibulární schwannom – osobní pohled na nejmodernější postupy v jeho léčbě
- Kalcitonin a jeho úloha v regulaci kalciofosfátového metabolismu
- Diabetes mellitus 2. typu jako subklinický zánět
- Karcinom pankreatu – naše zkušenosti se vztahem k diabetes mellitus
