Chronické srdeční selhání
Chronic heart failure
Incidence of chronic heart failure (HF) is increasing steadily in all developed countries, predominantly due to population ageing. The prevalence of HF in population is 1–2%, reaching up to 10% in higher age categories. At present HF is classified according to left ventricular ejection fraction (EF) value to HF with reduced EF (formerly systolic HF) and HF with preserved EF (formerly diastolic HF). Coronary artery disease dominates in the aetiology of HF with reduced EF (about 70%), especially status post myocardial infarction. Pathophysiology of HF with preserved EF is very complex and still not fully understood. Multiple comorbidities play an important role, especially hypertension and diabetes mellitus. HF with preserved EF represents about half of all HF cases and its rate is slowly increasing. Morbidity expressed as hospitalization rate is comparable in patients with both types of HF, whereas mortality is a little bit lower in patients with HF with preserved EF. But in patients with HF and preserved EF the prevailing causes of both, the hospitalizations and the deaths are non-cardiovascular.
Diagnosis of HF is relatively simple in fully manifested cases, but it could be a problem in milder forms especially of the HF with preserved EF in elderly patients with multiple comorbidities. For the definite diagnosis of HF the patient has to have typical symptoms and clinical signs as well as objectively documented left ventricular dysfunction, usually by echocardiography. According to the EF value the type of HF is determined. In HF with preserved EF an evidence of a structural heart impairment and/or left ventricular diastolic dysfunction is also necessary. Plasma levels of natriuretic peptides could be helpful for determination of correct diagnosis, particularly in untreated patients. Basic examination of patients with suspected HF is completed by ECG and some laboratory parameters (e.g. renal function, ions, red blood count).
Treatment of HF with reduced EF is based on evidence from many clinical trials. It is complex and consists on non-pharmacological interventions, pharmacotherapy (ACE inhibitors, sartans, betablockers, mineralocortikoid receptor blockers, in specific situations also ivabradine and digoxin), surgery and devices. There is no evidence-based treatment for HF with preserved EF, therefore it still remains empiric.
Keywords:
chronic heart failure – heart failure with reduced ejection fraction – heart failure with preserved ejection fraction – natriuretic peptides
:
Jaromír Hradec
:
III. interní klinika 1. LF UK a VFN, Praha
:
Čas. Lék. čes. 2015; 154: 260-268
:
Review Article
Výskyt chronického srdečního selhání (CHSS) se ve všech rozvinutých zemích neustále zvyšuje. Souvisí to především se stárnutím populace. Prevalence CHSS v populaci je 1–2 %, ale dosahuje až 10 % ve vyšších věkových kategoriích. V současnosti dělíme CHSS podle hodnoty ejekční frakce (EF) levé komory na CHSS se sníženou EF (dříve systolické) a CHSS se zachovalou EF (dříve diastolické). V etiologii CHSS se sníženou EF převládá ischemická choroba srdeční (přibližně 70 %), zejména stavy po infarktu myokardu. Patofyziologie CHSS se zachovanou EF je velmi komplexní a zatím ji ne zcela rozumíme. Velkou roli nepochybně hrají mnohočetné komorbidity, především hypertenze a diabetes mellitus. Srdeční selhání se zachovalou EF tvoří přibližně polovinu případů a jeho podíl zvolna narůstá. Morbidita nemocných vyjádřená počtem hospitalizací je u nemocných s oběma typy CHSS srovnatelná, mortalita je u CHSS se zachovalou EF o něco nižší než u CHSS se sníženou EF. U CHSS se zachovalou EF však u hospitalizací i úmrtí převažují nekardiovaskulární příčiny.
Diagnostika CHSS je u rozvinutých případů poměrně jednoduchá, ale u lehčích forem zejména CHSS se zachovalou EF u starších nemocných s mnohočetnými komorbiditami může dělat problémy. Pro stanovení diagnózy CHSS musí mít nemocný typické potíže a klinické známky. Musí mít také objektivně dokumentovanou dysfunkci levé komory, v praxi nejčastěji echokardiograficky. Podle hodnoty EF se určí typ SS, při CHSS se zachovalou EF je pak ještě nutný průkaz strukturálního poškození srdce a/nebo diastolické dysfunkce levé komory. Stanovení správné diagnózy, zejména u dosud neléčených nemocných, mohou významně pomoci plazmatické koncentrace natriuretických peptidů. K základnímu vyšetření nemocných s podezřením na CHSS patří také EKG a některé laboratorní ukazatele (funkce ledvin, iontogram, krevní obraz).
Léčba CHSS se sníženou EF je podložena důkazy z mnoha klinických studií. Je komplexní a její součástí jsou opatření nefarmakologická, farmakologická léčba (inhibitory ACE nebo sartany, betablokátory, diuretika, blokátory mineralokortikoidních receptorů, v indikovaných případech ivabradin a digoxin), chirurgická a přístrojová léčba. Pro léčbu CHSS se zachovanou EF zatím důkazy nemáme, a proto zůstává empirická.
Klíčová slova:
chronické srdeční selhání – srdeční selhání se sníženou ejekční frakcí – srdeční selhání se zachovalou ejekční frakcí – natriuretické peptidy
ÚVOD
Chronické srdeční selhání (CHSS) je klinický syndrom, který představuje komplikaci a často i konečné stadium přirozeného vývoje celé řady kardiovaskulárních chorob, jako jsou např. ischemická choroba srdeční, neléčená nebo špatně kontrolovaná hypertenze, nekorigované chlopenní srdeční vady, kardiomyopatie a další. Prevalence i incidence CHSS se ve všech rozvinutých zemí v posledních letech zvyšuje. Je to způsobeno především dvěma faktory. Výskyt CHSS výrazně narůstá s věkem. Tak, jak populace rozvinutých zemí včetně České republiky stárne, narůstá také počet nemocných s CHSS. Druhým faktorem je fakt, že díky zlepšující se léčbě se snižuje úmrtnost na akutní kardiovaskulární příhody, především na akutní infarkt myokardu. Přežívající nemocní ale mají poškozený myokard, a jsou tak kandidáty pozdějšího rozvoje CHSS. Pokročilejší CHSS je spojeno s nutností opakovaných hospitalizací. Představuje proto významnou ekonomickou zátěž zdravotního systému.
V léčbě CHSS došlo v posledních letech k významným pokrokům. Moderní léčebné postupy nejenom zmírňují potíže nemocných a zlepšují kvalitu života, ale také příznivě ovlivňují prognózu a prodlužují nemocným život. Prospěšnost většiny léčebných postupů u CHSS se sníženou ejekční frakcí je podložena výsledky velkých randomizovaných klinických studií, a splňuje tak požadavky medicíny založené na důkazech. U CHSS se zachovanou ejekční frakcí se zatím nepodařilo v provedených klinických studiích důkazy o prospěšnosti nějaké léčby získat, a ta proto zůstává empirická. Přes významné pokroky v léčbě má CHSS stále špatnou prognózu. Proto je důležité jeho vzniku předcházet, tzn. důsledně léčit choroby, které k němu vedou (např. dbát na dobrou kontrolu hypertenze, včasnou chirurgickou léčbu chlopenních vad apod.).
U naprosté většiny nemocných s CHSS je nezbytně nutná úzká spolupráce mezi praktickým lékařem a kardiologem nebo internistou. Většina nemocných přijde se svými potížemi k praktickému lékaři. On by měl potíže a příznaky nemocného vyhodnotit a získá-li podezření, že by mohly být způsobeny CHSS, měl by nemocného poslat ke kardiologickému vyšetření. Kardiolog má k dispozici vyšetřovací metody, které jsou nezbytné ke stanovení nebo definitivnímu potvrzení diagnózy. Měl by indikovat a zařídit potřebná specializovaná vyšetření (např. koronární angiografii), navrhnout optimální léčbu včetně eventuální přístrojové a měl by nemocného kontrolovat pokaždé, když dojde k destabilizaci jeho klinického stavu. Nemocný s akutním srdečním selháním nebo s akutně zhoršeným CHSS musí být hospitalizován, obvykle na oddělení intenzivní péče nebo na koronární jednotce.
DEFINICE, KLINICKÁ KLASIFIKACE A TERMINOLOGIE
Srdeční selhání může být obecně definováno jako abnormality srdeční struktury nebo funkce, které vedou k neschopnosti srdce dodávat metabolizujícím tkáním kyslík v množství odpovídajícím jejich potřebám i přes normální plnicí tlak nebo pouze za cenu zvýšení plnicího tlaku. Pro praktické účely je srdeční selhání definováno klinicky jako syndrom, při kterém mají nemocní typické příznaky (např. dušnost nebo únavu) a známky (např. zvýšenou náplň krčních žil, venostatické chrůpky na plicích, tachykardii nebo periferní otoky), které jsou důsledkem abnormalit srdeční struktury nebo funkce (1, 2). Průkaz vyvolávající srdeční příčiny je pro diagnózu CHSS klíčový. Obvykle to je myokardiální onemocnění, které vede k systolické dysfunkci levé komory. Nicméně CHSS může být způsobeno také diastolickou dysfunkcí levé komory, poruchami chlopní, perikardu, endokardu, arytmiemi či poruchami vedení.
Srdeční selhání se klinicky klasifikuje podle různých hledisek:
- Podle časového faktoru se srdeční selhání klasifikuje jako akutní a chronické.
- Podle selhávající srdeční komory a z toho vyplývající klinické symptomatologie se srdeční selhání klasifikuje jako levostranné (s dominujícími příznaky plicní venostázy), pravostranné (s dominujícími příznaky systémové venostázy) a oboustranné (s kombinací příznaků plicní a systémové venostázy). Pojem městnavé srdeční selhání označuje stav srdečního selhání s příznaky žilní kongesce, ať již v plicním nebo systémovém řečišti.
- Podle charakteru srdeční dysfunkce se srdeční selhání klasifikuje jako systolické, kdy klesá staživost myokardu, srdeční výdej a ejekční frakce, a diastolické, kdy je ztíženo plnění srdečních komor, např. při poklesu poddajnosti (zvýšení tuhosti) myokardu. Z praktických důvodů se však v poslední době dává přednost širším termínům srdeční selhání se sníženou ejekční frakcí (HFREF – heart failure with reduced ejection fraction) místo systolického srdečního selhání a srdeční selhání se zachovanou ejekční frakcí (HFPEF – heart failure with preserved ejection fraction) místo diastolického srdečního selhání. Hranice mezi zachovanou a sníženou ejekční frakcí bývá udávána různě, obvykle mezi hodnotami 0,40–0,50).
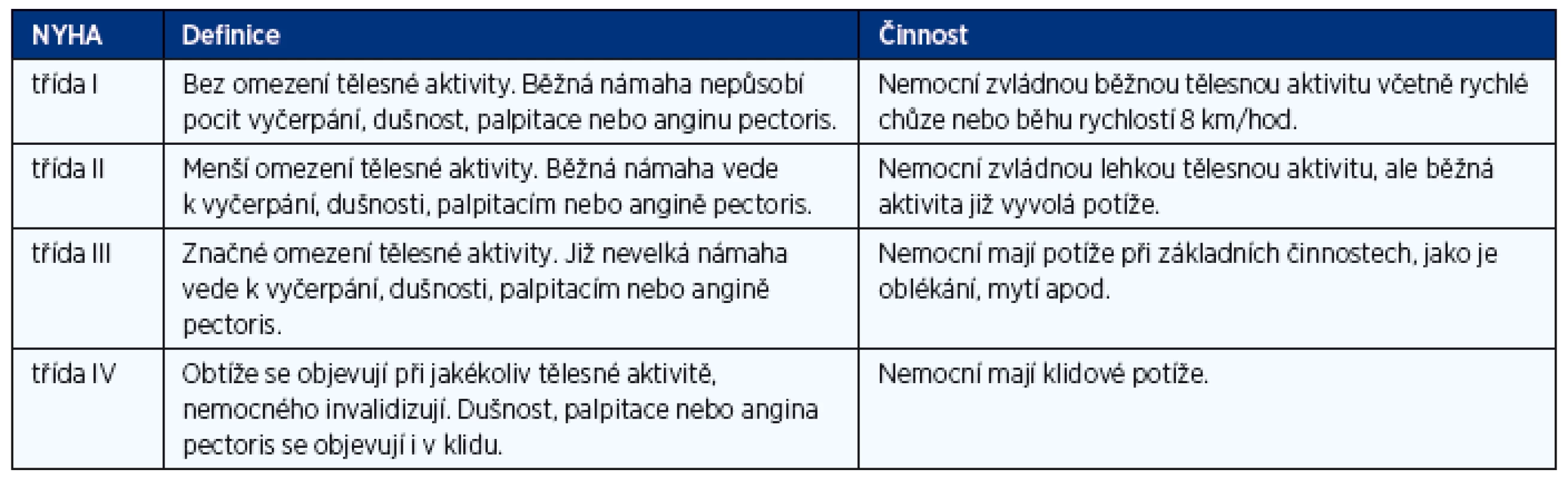
Klinická závažnost (tíže) srdečního selhání se vyjadřuje stupni funkční klasifikace NYHA (tab. 1). Srdeční selhání ve funkční třídě NYHA I znamená stav, kdy vlivem kompenzačních mechanismů nebo léčby došlo k vymizení symptomů a klinických příznaků a nemocný je asymptomatický. Tento stav nebo stav, kdy symptomy nemocného jsou mírné a stabilní, se nazývá kompenzované srdeční selhání. Jako dekompenzované srdeční selhání se označuje stav, kdy dochází k progresivnímu zhoršování symptomů a známek onemocnění. Jako asymptomatická dysfunkce levé komory (systolická nebo diastolická) se označuje stav, kdy je objektivně prokázaná porušená funkce levé komory, ale nemocný je asymptomatický i bez adekvátní léčby.
EPIDEMIOLOGIE, PROGNÓZA
Přibližně 1–2 % dospělé populace ve vyspělých zemích trpí CHSS, prevalence je výrazně závislá u obou pohlaví na věku. U lidí ve věku 70 let a více stoupá až k ≥ 10 %. Roční incidence nově vzniklého srdečního selhání je kolem 0,4 %. V České republice tedy máme 100 000–200 000 nemocných s CHSS a zhruba stejný počet nemocných s asymptomatickou systolickou dysfunkcí levé komory, kteří ve valné většině časem dospějí do fáze manifestního srdečního selhání. O výskytu asymptomatické diastolické dysfunkce levé komory v populaci nemáme spolehlivé údaje. Každý rok se srdeční selhání u nás nově manifestuje přibližně u dalších 40 000 nemocných. Celoživotní riziko vzniku srdečního selhání je pro obě pohlaví bez ohledu na věk kolem 20 %, tzn., že jím onemocní během života jeden člověk z pěti! Průměrný věk nemocných s CHSS se pohybuje mezi 74–76 lety.
V etiologii srdečního selhání jsou velké geografické rozdíly a navíc se v čase etiologie významně mění. Kdysi byla nejčastější příčinou srdečního selhání neléčená nebo špatně korigovaná hypertenze, častou příčinou byly také nekorigované chlopenní vady, zejména porevmatické. Dnes to je v rozvinutých zemích včetně České republiky asi u 70 % nemocných ICHS, zejména stavy po IM, následují kardiomyopatie. Hypertenze a chlopenní vady jako příčiny CHSS ustoupily do pozadí.
Přibližně polovina nemocných s CHSS má nízkou ejekční frakci levé komory (HFREF). Toto srdeční selhání je nejlépe prostudovaným typem, jak co do patofyziologie, tak i léčby. Druhou přibližně polovinu nemocných se srdečním selháním tvoří nemocní se zachovanou ejekční frakcí (HFPEF). Prevalence tohoto typu CHSS stále stoupá díky stárnutí populace. O možných patofyziologických mechanismech HFPEF je diskutováno dále.
Léčení srdečního selhání je velmi nákladná záležitost, ekonomicky značně zatěžující zdravotní systém. Spotřebovává 1–2 % celkového rozpočtu na zdravotnictví. Přibližně 60 % nákladů vytvářejí opakované hospitalizace. Srdeční selhání je příčinou 5 % všech hospitalizací, u nemocných starších 65 let dokonce 20 % všech hospitalizací.
Prognóza CHSS je nepříznivá. Příliš ji nezlepšily ani nesporné pokroky v léčbě, kterých bylo v uplynulých 30 letech dosaženo. I když se prognóza nemocných se systolickým CHSS pozvolna zlepšuje, stále umírá přibližně polovina nemocných do 5 let od stanovení diagnózy. Prognóza je závislá na klinické závažnosti CHSS vyjádřeného třídou klasifikace NYHA. Jednoroční mortalita kolísá od 5 % u asymptomatických nemocných (NYHA I) až k 40 % u nemocných s klidovou dušností (NYHA IV). Nemocní s HFPEF mají prognózu o něco lepší.
KLINICKÉ DILEMA – SRDEČNÍ SELHÁNÍ SE ZACHOVANOU EJEKČNÍ FRAKCÍ
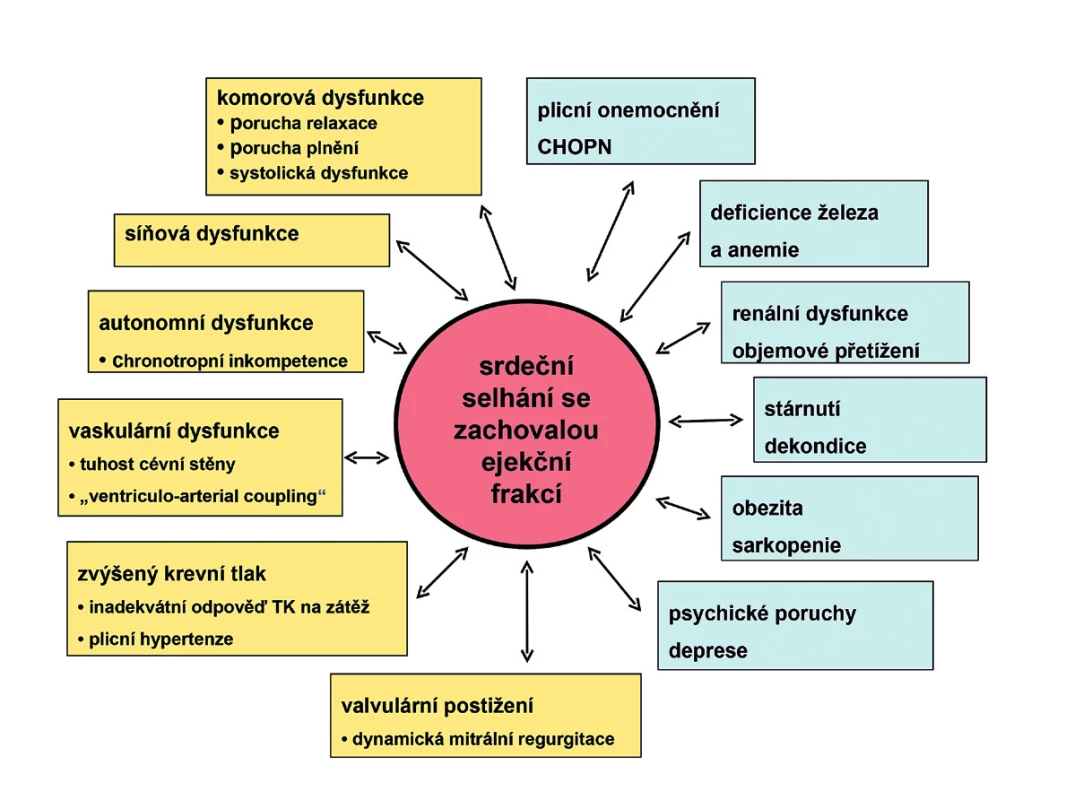
O syndromu srdečního selhání se zachovalou ejekční frakcí (HFPEF) se jako o zvláštní jednotce mluví, píše a diskutuje již minimálně 20 let, ovšem pod různými a měnícími se názvy (3, 4). Vlastně již staré termíny dopředné (forward heart failure) a zpětné (backward heart failure) srdeční selhání, o kterých jsem se učil jako student, jsou více méně synonymem stavů, pro které později byly používány termíny systolické a diastolické srdeční selhání a nejnověji pak HFREF a HFPEF. Oba dva stavy mají společné to, že se jedná o srdeční selhání s typickými symptomy (dušností, únavou a intolerancí zátěže), fyzikálními známkami (zvýšenou náplní krčních žil, venostatickými plicními chrůpky, periferními otoky) a radiologickými známkami (plicní cévní redistribucí, intersticiálním edémem, pleurálním výpotkem). Tím ale jejich podobnost končí, ve všem ostatním jsou naprosto odlišné. Oba stavy se liší fenotypickými projevy – nemocní s HFPEF jsou starší, častěji ženy, mají v průměru vyšší BMI, jsou častěji obézní, mají častěji hypertenzi a diabetes mellitus, naproti tomu mají méně často ICHS, zejména méně často jsou po prodělaném infarktu myokardu. Oba dva stavy mají naprosto odlišnou patofyziologii. Zatímco u HFREF je celkem srozumitelně popsaná a dominuje jí systolická dysfunkce levé komory, kvantifikovatelná jednoduchým ukazatelem – ejekční frakcí (EF), tak u HFPEF je patofyziologie velmi komplexní, není ji možné kvantifikovat jednoduchým ukazatelem a byť se za posledních několik let významně zvýšilo množství informací, stále jí rozumíme jen velmi neúplně (obr. 1). Velkou roli hrají nepochybně četné komorbidity, jako je hypertenze, diabetes mellitus, chronická obstrukční plicní nemoc, anemie a deficience železa, renální dysfunkce, deprese a další.
Významné rozdíly existují také v léčbě. Pro HFREF existuje celá řada léků, jejichž prospěšné účinky na snížení morbidity a mortality byly dokumentovány v mnoha velkých klinických studiích, takže právem můžeme mluvit o léčbě založené na důkazech, pro nemocné s HFPEF žádnou na důkazech založenou léčbu k dispozici nemáme a uchylujeme se proto k léčbě čistě empirické. Díky účinné léčbě se prognóza nemocných s HFREF v posledních 20 letech zvolna zlepšuje a jejich mortalita klesá, u nemocných s HFPEF se prognóza v čase nemění (5).
Proč se vůbec opustila starší terminologie systolické a diastolické srdeční selhání, která zdůrazňovala hlavní patofyziologický rozdíl mezi oběma stavy, tj. systolickou nebo diastolickou dysfunkci levé komory jako příčinu vzniku symptomatického srdečního selhání? Důvodů je hned několik. Tím hlavním je fakt, že každý nemocný se systolickým srdečním selháním má zvýšený plnicí tlak levé komory, má tedy současně také diastolickou dysfunkci levé komory. A opačně, pomocí studií používajících tkáňově-dopplerovskou analýzu bylo prokázáno, že většina nemocných s diastolickým srdečním selháním má i přes normální hodnotu EF sníženou longitudinální a radiální systolickou funkci levé komory. Jedná se tedy nikoliv o čistě systolické nebo čistě diastolické srdeční selhání, ale o srdeční selhání s dominující systolickou dysfunkcí levé komory nebo o srdeční selhání s dominující diastolickou dysfunkcí levé komory (6). Dalším argumentem bylo, že EF měřená s časovým odstupem od epizody akutního srdečního selhání nemusí odpovídat hodnotě EF v akutní fázi. Původně snížená EF se mohla buď spontánně, nebo vlivem léčby normalizovat.
Diastolická dysfunkce je způsobena prodlouženou izovolumickou relaxací, zpomaleným plněním a zvýšenou diastolickou tuhostí levé komory. K tomu, aby bylo možné přesně a plně diastolickou funkci charakterizovat, musí být změřen tlak, objem a tloušťka stěny levé komory a spočítány ukazatelé, které charakterizují aktivní relaxaci a pasivní tuhost komory. To vyžaduje invazivní vyšetření a detailní analýzu, což je nemožné provádět při rutinním vyšetření, screeningu nemocných nebo ve velkých klinických studiích. Neinvazivní hodnocení diastolické funkce má nízkou senzitivitu, specificitu i přesnost. Je to způsobeno tím, že neinvazivní ukazatelé diastolické funkce jsou ovlivněny také objemem, průtokem, heterogenitou, remodelací a jinými faktory, což velmi ztěžuje jejich interpretaci (4, 6). Situaci sice poněkud zlepšily nové metody, jako je tkáňový Doppler, a nové způsoby hodnocení, ale postup je pořád složitý a ne vždy spolehlivý.
Problém také představuje hodnota EF, která diskriminuje mezi HFREF a HFPEF. V různých studiích se tato hodnota pohybuje v poměrně širokém rozmezí od 0,40 do 0,50, resp. od 40 do 50 %. Hodnota EF závisí na metodě, která se použije k jejímu stanovení. Rentgenová ventrikulografie kontrastní látkou hodnotu EF nadhodnocuje. Nejpřesnější je stanovená EF metodou MR, která je ale málo dostupná. V praxi se EF nejčastěji stanovuje echokardiograficky. Snížení spodní hranice normálních hodnot EF pod 50 % měla na svědomí populační echokardiografická studie McDonaghové z Glasgowa, která publikovala průměrné hodnoty echokardiograficky stanovené EF vypočtené Simpsonovou metodou ve dvou projekcích 47 ± 7 % (7).
Již výše bylo zmíněno, že zatímco pro léčbu HFREF máme celou širokou paletu „evidence-based“ léků a léčebných postupů, pro léčení HFPEF se zatím nepodařilo získat v klinických studiích důkazy o účinnosti a prospěšnosti žádného ze zkoušených léků. Je to s podivem a těžko pochopitelné. Pro nemocné s HFPEF je charakteristické, že mají celou řadu komorbidit, mezi nimiž dominuje hypertenze, která se vyskytuje až u 90 % nemocných. Hypertenze nepochybně hraje v patofyziologii vzniku diastolické dysfunkce, eventuálně s manifestním srdečním selháním, významnou roli. Zvyšuje tuhost myokardu, vede k hypertrofii levé komory, k dilataci levé síně, je takřka pravidelně doprovázená časnými echo/dopplerovskými známkami diastolické dysfunkce. Máme k dispozici účinná antihypertenziva, z nichž mnohá navozují významnou regresi hypertrofie levé komory a cévní stěny, zejména ta ze skupin inhibitorů RAAS. Teoreticky lze tedy velmi důvodně očekávat, že tyto léky povedou také ke zlepšení diastolického srdečního selhání. A přesto všechny studie, ve kterých byly tyto léky klinicky zkoušeny – PEP-CHF s perindoprilem (8), CHARM-preserved s candesartanem (9), I-PRESERVE s irbesartanem (10) a nedávno i Aldo-DHF a TOPCAT se spironolactonem (11, 12) – přinesly naprosto negativní výsledky. Současné oficiální doporučené postupy se proto léčbě HFPEF buď úplně vyhýbají, nebo jen stručně doporučují kontrolovat léčbou fyziologické faktory, jako jsou krevní tlak, srdeční frekvence, cirkulující objem a ischemii myokardu, o kterých je známé, že ovlivňují komorovou relaxaci (1, 2). Rezultují z toho jen obecná empirická doporučení, jako např. následující doporučení třídy I:
- Kontroluj systolický i diastolický krevní tlak podle stávajících doporučení.
- Při fibrilaci síní kontroluj komorovou frekvenci.
- Použij diuretika ke zmírnění plicní kongesce a periferních otoků, ale opatrně, protože hypovolemie by zhoršila diastolickou funkci levé komory a z ní rezultující srdeční selhávání (1).
DIAGNOSTIKA
Stanovení správné diagnózy CHSS může být na jedné straně u plně rozvinutých pokročilých stavů poměrně jednoduché, ale na druhé straně u lehčích forem velmi obtížné. Platí to zejména pro nemocné s HFPEF. Nízká specificita symptomů (dušnosti, únavy a periferních otoků) a nedostatečné využívání diagnostických testů činí spolehlivou diagnostiku CHSS problematickou zejména u žen, starších a obézních nemocných. Mnoho nemocných se srdečním selháním trpí komorbiditami, které mohou činit interpretaci symptomů a klinických známek ještě obtížnější. Zejména starší nemocní často představují v primární péči problém, protože mají častěji a více komorbidit, pro kognitivní poruchy se od nich hůře získává spolehlivá anamnéza a méně často jsou indikováni ke specializovaným diagnostickým testům nebo odesláni ke konziliárnímu kardio-logickému vyšetření. Příznaky a známky jsou také důležité při monitorování odpovědi nemocného na léčbu a ke zhodnocení stability klinického stavu v čase. Přetrvávání příznaků i přes adekvátní léčbu obvykle signalizuje nutnost zvýšení dávek léků. Zhoršování příznaků je závažnou událostí, která nemocnému přináší riziko urgentní hospitalizace nebo úmrtí a vyžaduje vždy okamžitou lékařskou pozornost.
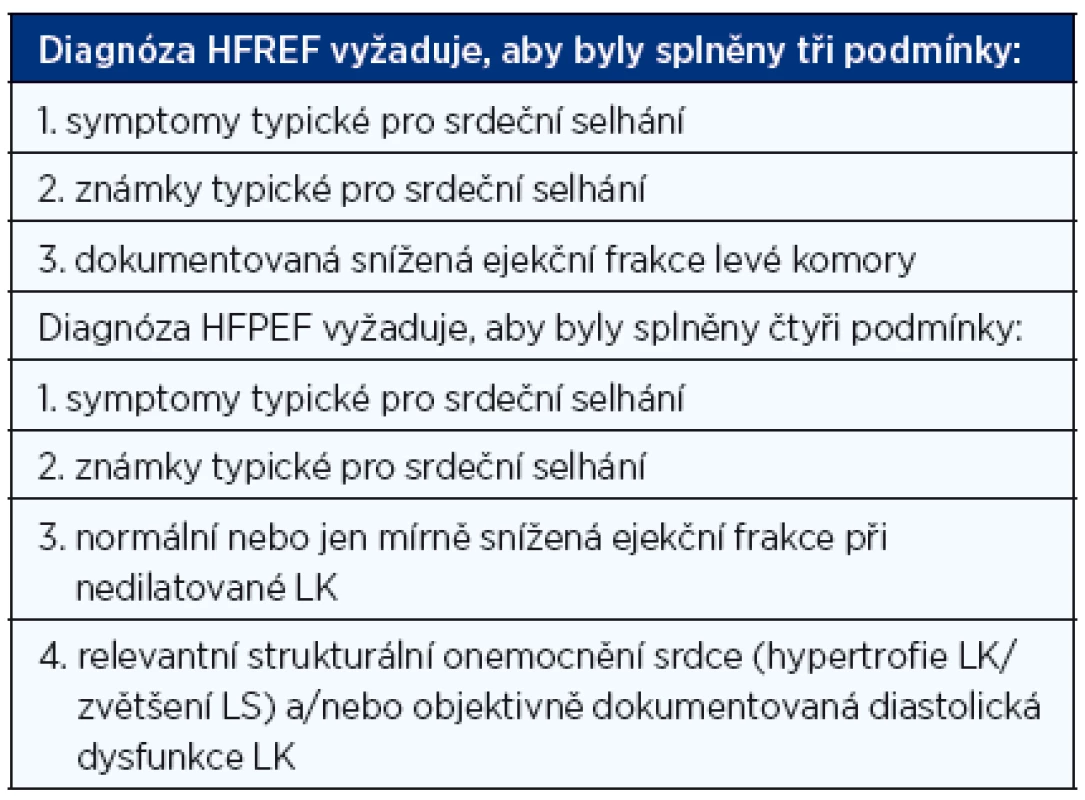
Jak v diagnostice CHSS správně postupovat? Ke stanovení správné diagnózy CHSS je nutné splnit několik podmínek:
- Nemocný musí mít typické symptomy a klinické známky srdečního selhání.
- Musí být stanovena hodnota ejekční frakce levé komory (nejčastěji echokardiograficky), abychom mohli rozhodnout, zda se jedná o HFREF nebo HEPEF.
- Jedná-li se o HFPEF, musí být objektivně dokumentováno strukturální postižení srdce a/nebo diastolická dysfunkce (opět nejčastěji echokardiograficky) (tab. 2).
Pomocným diagnostickým kritériem může být příznivá odpověď na léčbu (např. ústup dušnosti nebo otoků DK po diuretikách). Užitečná je také znalost plazmatických koncentrací natriuretických peptidů (BNP nebo NT-proBNP), zejména u dosud neléčeného nemocného.
Typickými symptomy srdečního selhání jsou dušnost a únavnost v klidu nebo při námaze, typickými klinickými známkami tachykardie, 3. srdeční ozva, cvalový rytmus, venostatické chrůpky na plicích a při pravostranném srdečním selháním také zvýšená náplň krčních žil, eventuálně jejich systolická pulzace, městnavá hepatomegalie a otoky dolních končetin. Symptomy a klinické známky srdečního selhání jsou důležité, protože vzbudí podezření lékaře, že by se mohlo jednat o srdeční selhání. K diagnóze však nestačí, protože jejich specificita je nízká, mohou být způsobeny jinými nekardiálními onemocněními (např. chronickou obstrukční plicní nemocí, obezitou, syndromem chronické žilní insuficience a dalšími). Tachykardie může chybět při užívání bradykardizujících léků (např. betablokátorů, verapamilu, diltiazemu).
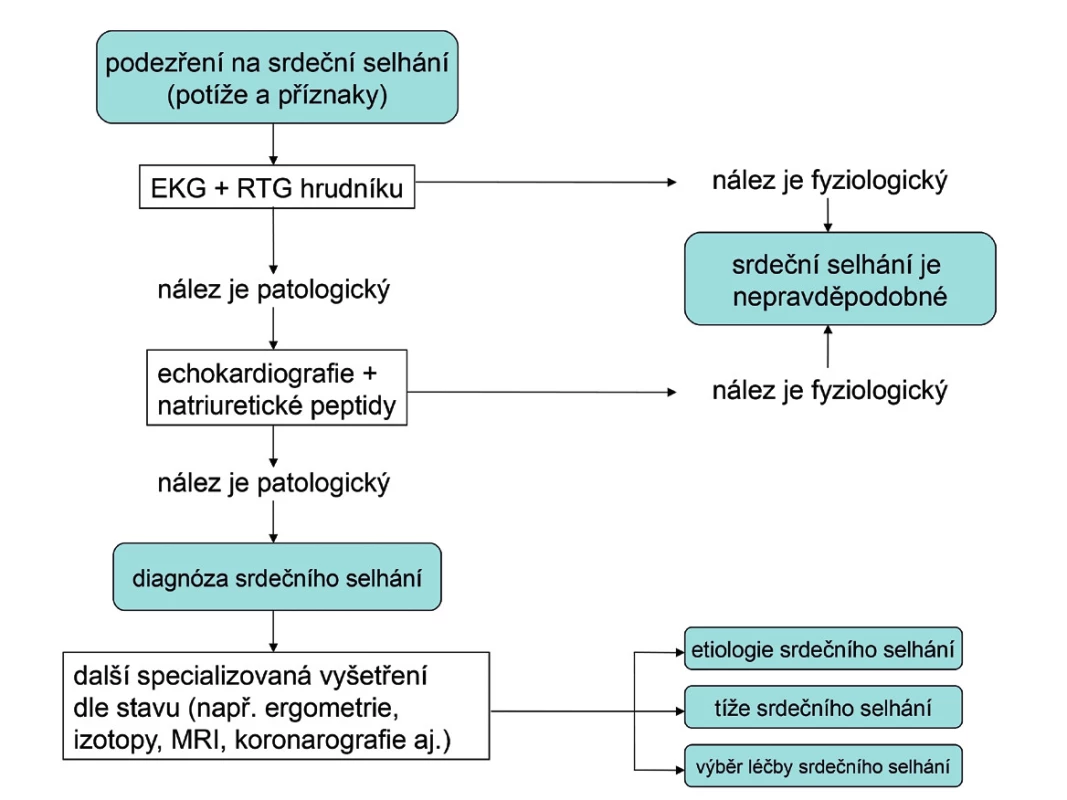
Každý nemocný s podezřením na srdeční selhání by měl mít udělána následující vyšetření: EKG, skiagram hrudníku a echokardiografii.
EKG křivka je u nemocného s CHSS obvykle patologická. K diagnóze srdečního selhání jako takového však nepřispěje. Při nálezu fyziologické křivky je ale CHSS velmi nepravděpodobné. Význam EKG je hlavně v tom, že pomáhá určit etiologii srdečního selhání (např. patologické kmity Q jako obraz prodělaného IM, hypertrofie levé komory, blokády Tawarových ramének apod.). Je také důležité pro rozhodování o správné léčbě (např. kontrola srdeční frekvence, antikoagulace při fibrilaci síní, kardiostimulace při bradyarytmiích nebo srdeční resynchronizační léčba při blokádě levého Tawarova raménka).
Skiagram hrudníku má při vyšetření nemocných s podezřením na CHSS jen omezené využití. Nejdůležitější je asi pro rozpoznání jiných, zejména plicních příčin potíží a známek nemocného. U nemocných s pokročilým CHSS může ukázat dilataci srdečního stínu nebo známky plicní venostázy až plicního edému. Relativní velikost srdečního stínu k laterálnímu průměru hrudníku vyjadřuje tzv. kardiotorakální index (KTI). Jeho normální hodnota je KTI < 0,5. Bohužel, většina RTG pracovišť u nás tento jednoduchý ukazatel zvětšení srdečního stínu rutinně neměří a v popisech skiagramu hrudníku neuvádí. Normální skiagram hrudníku v žádném případě CHSS nevylučuje. Zejména při HFPEF může mít stín srdeční normální velikost.
Naprosto nutný je objektivní průkaz dysfunkce levé srdeční komory. Nejdostupnější a nejlevnější diagnostickou metodou, kterou lze zhodnotit funkci levé komory, je echokardiografie. Umožňuje stanovit hodnotu ejekční frakce levé komory a rozhodnout, zda se jedná o dysfunkci systolickou či diastolickou, stanovit její tíži a ve většině případů i určit etiologii srdečního selhání. Každý nemocný, u kterého se objeví důvodné podezření na srdeční selhání, by proto měl mít provedené echokardiografické vyšetření.
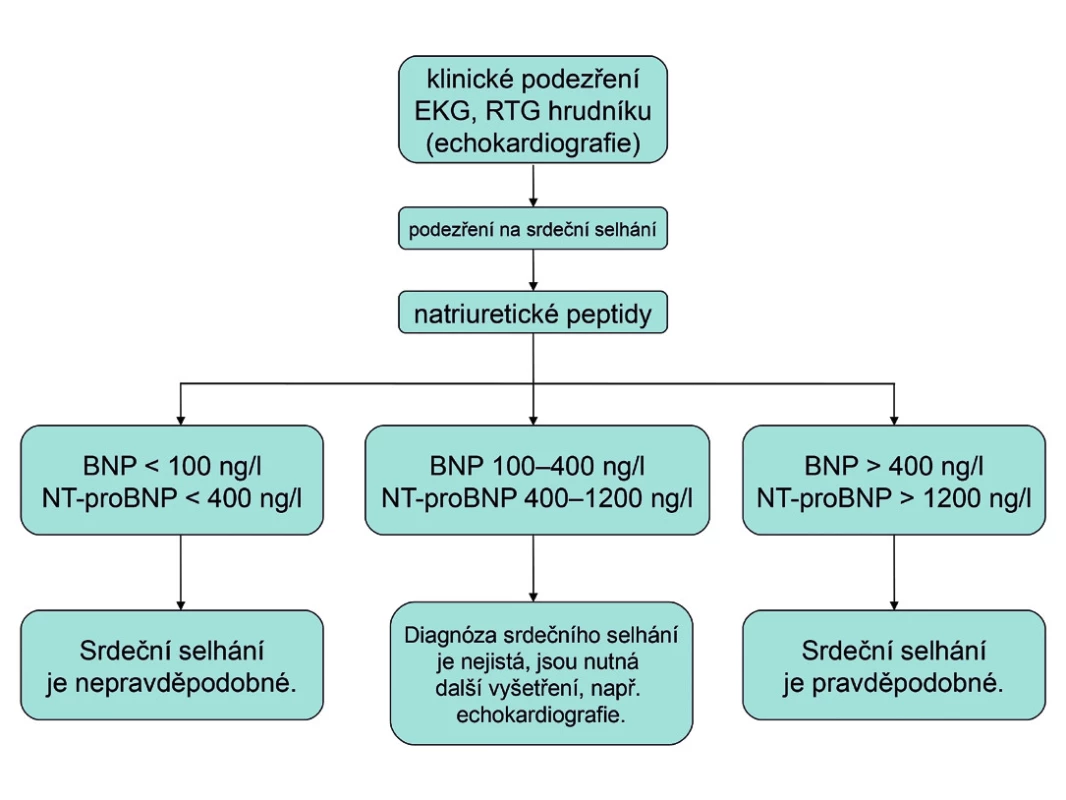
Užitečným pomocníkem v diagnostice srdečního selhání je stanovení plazmatické koncentrace natriuretického peptidu typu B (BNP) nebo N-terminálního konce molekuly jeho prekurzoru (NT-proBNP). Natriuretické peptidy BNPa NT-proBNP se uvolňují z kardiomyocytů srdečních komor při jejich zvýšeném napětí. Jsou tedy biochemickým markerem dysfunkce komorového myokardu. Bohužel, naděje, že se stanovení natriuretických peptidů stane jednoduchým krevním testem na přítomnost CHSS, se ukázala být příliš optimistická. Stanovení plazmatické koncentrace BNP a NT-proBNP má především velmi silnou negativní prediktivní hodnotu. Normální hodnoty (tj. BNP < 100 ng/l a NT-proBNP < 400 ng/l) vylučují srdeční selhání s 90% pravděpodobností. To ovšem platí pouze pro dosud neléčeného nemocného. Dobře léčený nemocný se srdečním selháním může mít plazmatické koncentrace natriuretických peptidů v normě, přesto má stále CHSS. Zjednodušený algoritmus použití hodnot natriuretických peptidů v diagnostice dosud neléčeného srdečního selhání, který sice plně neodpovídá současným doporučeným postupům, ale je velmi jednoduchý a pro praxi výhodný, je uveden na obrázku 2 (13). Natriuretické peptidy mají také významnou prognostickou hodnotu.
Z ostatních laboratorních vyšetření je třeba kontrolovat renální funkce (kreatinin, urea), iontogram (Na, K, Cl) a urikemii. Biochemické monitorování je nezbytné při intenzivnější diuretické léčbě a po nasazení léků, které mohou vést ke zhoršení renálních funkcí (inhibitory ACE a sartany) a k hyperkalemii (inhibitory ACE, sartany, antagonisté aldosteronu, kalium šetřící diuretika) nebo k hyperurikemii (thiazidová diuretika). Pokročilé CHSS může být doprovázeno anemií, jejíž etiologie je komplexní. Kombinuje se normocytární normochromní anemie při chronických chorobách se sideropenií, deficitem vitaminů (B1, B6 a B12), snížená produkce erytropoetinu při časté doprovodné renální insuficienci a snížená periferní citlivost na něj. Každý nemocný s CHSS, ale i s dušností nejasné etiologie v rámci diferenciální diagnostiky její příčiny by proto měl mít vyšetřen také krevní obraz.
Kardiolog může podle potřeby indikovat další specializovaná vyšetření. Například většina nemocných by měla mít provedenou koronární arteriografii.
Algoritmus diagnostiky srdečního selhání je uveden na obrázku 3.
LÉČBA
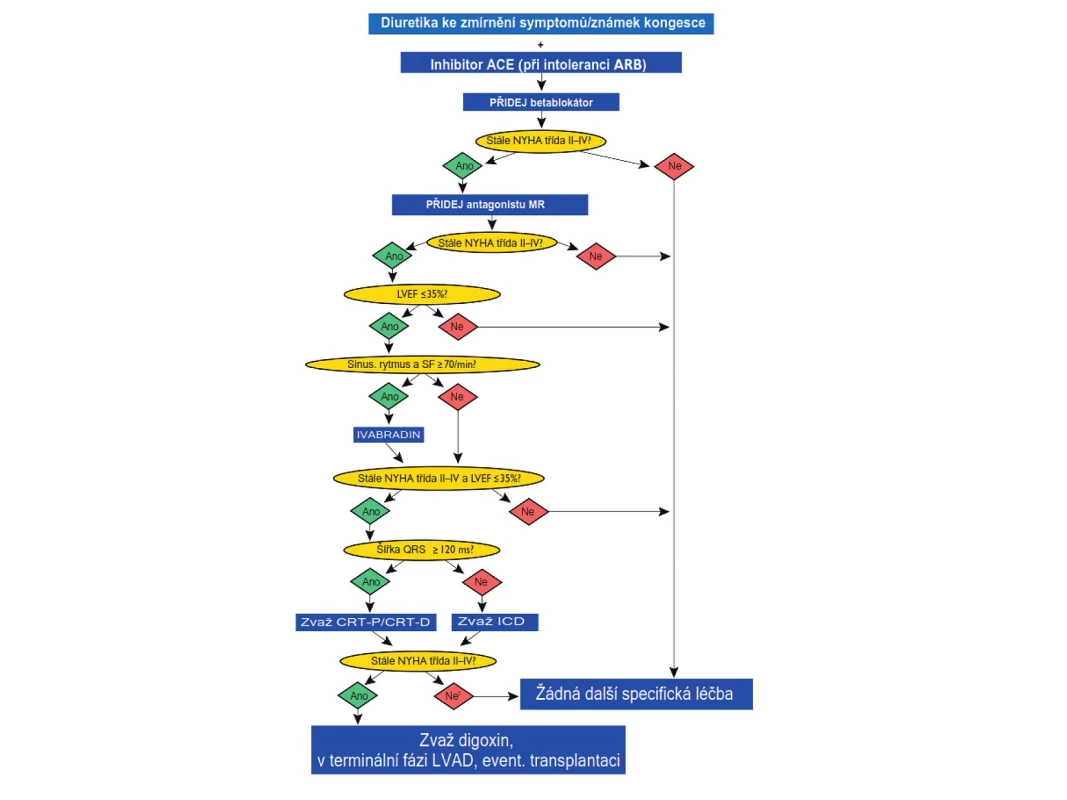
Léčba CHSS musí být komplexní. Zahrnuje řadu režimových nefarmakologických opatření, farmakoterapii a v indikovaných případech nejrůznější chirurgické léčebné výkony (od revaskularizačních výkonů až po transplantaci srdce) a sofistikované přístrojové léčebné postupy (např. biventrikulární kardiostimulaci – srdeční resynchronizační léčbu, implantabilní kardiostimulátory/kardiovertery a podpůrné levokomorové pumpy). Léčba musí být primárně zaměřena na prevenci kardiovaskulárních chorob, které vedou k dysfunkci levé komory a vzniku srdečního selhání a na prevenci progrese srdečního selhání u nemocných, u kterých se již srdeční selhání rozvinulo. Dalšími cíli léčby je zlepšení kvality života a zlepšení prognózy. Léčebný algoritmus při srdečním selhání se sníženou ejekční frakcí (HFREF, systolické CHSS) je uveden na obrázku 4.
Nefarmakologická opatření
Nesmírně důležitá je informovanost a edukace nemocného a jeho rodinných příslušníků, které zlepší spolupráci a zvýší adherenci k léčbě. Nemocný musí být instruován, že by si měl pravidelně monitorovat svoji tělesnou hmotnost a při jejím náhlém vzestupu (o > 2 kg za 3 dny) vyhledat neprodleně svého ošetřujícího lékaře. Je-li svým lékařem informovaný a dobře spolupracující, může si v takovém případě sám zvýšit dávku diuretika. Z dietních opatření je třeba při pokročilém CHSS omezit příjem sodíkových iontů na < 2 g/den, to znamená omezit příjem kuchyňské soli a pití minerálních vod. Při pokročilém CHSS je základním opatřením omezení příjmu tekutin na 1,5–2,0 l/den. U nemocných léčených saluretiky je třeba dbát na dostatečný přívod draslíku v potravě, v případě hypokalemie pak substituovat perorálními přípravky, jako je např. KCl, nebo diuretika kombinovat s kalium šetřícími léky. Umírněné požívání alkoholu (jedno pivo nebo 2 dl vína denně) je povolené vyjma nemocných s etylickou dilatační kardiomyopatií. Obézní nemocní by měli být všemožně motivováni k redukci tělesné hmotnosti, zákaz kouření u kuřáků je samozřejmostí. Při cestování by měli preferovat krátké lety před dlouhými cestami autem nebo autobusem a měli by se vyhýbat pobytům v horkých krajinách s vysokou vlhkostí vzduchu. Vakcinace proti chřipce se obecně považuje za prospěšnou. Častou je otázka na možné sexuální aktivity. Obavy mají spíše partneři nemocných než nemocní sami. Pokud nemocný není příliš symptomatický (funkční třída NYHA I–II), měl by být on i jeho partner ujištěni, že umírněná sexuální aktivita neškodí. CHSS představuje jeden z rizikových faktorů pro vznik hluboké žilní trombózy. V kombinaci s dalšími rizikovými faktory (např. imobilizace při hospitalizaci, delší let apod.) je proto vhodná prevence vzniku žilní trombózy nízkými (preventivními) dávkami nízkomolekulárního heparinu.
Farmakologická léčba
K farmakologické léčbě CHSS se sníženou ejekční frakcí se používají léky, jejichž účinnost a bezpečnost byla přesvědčivě prokázána v mnoha klinických studiích. Jsou to blokátory systému renin-angiotenzin-aldosteron na jeho různých úrovních: inhibitory angiotenzin-konvertujícího enzymu (ACE), blokátory receptorů AT1 pro angiotenzin II – tzv. sartany, blokátory mineralokortikoidních receptorů, dále pak betablokátory a diuretika. Ve specifických situacích se k těmto základním lékům přidává nově ivabradin a své místo v léčbě má stále i digoxin. Taktika farmakologické léčby CHSS je shrnuta na obrázku 4 (1, 2).
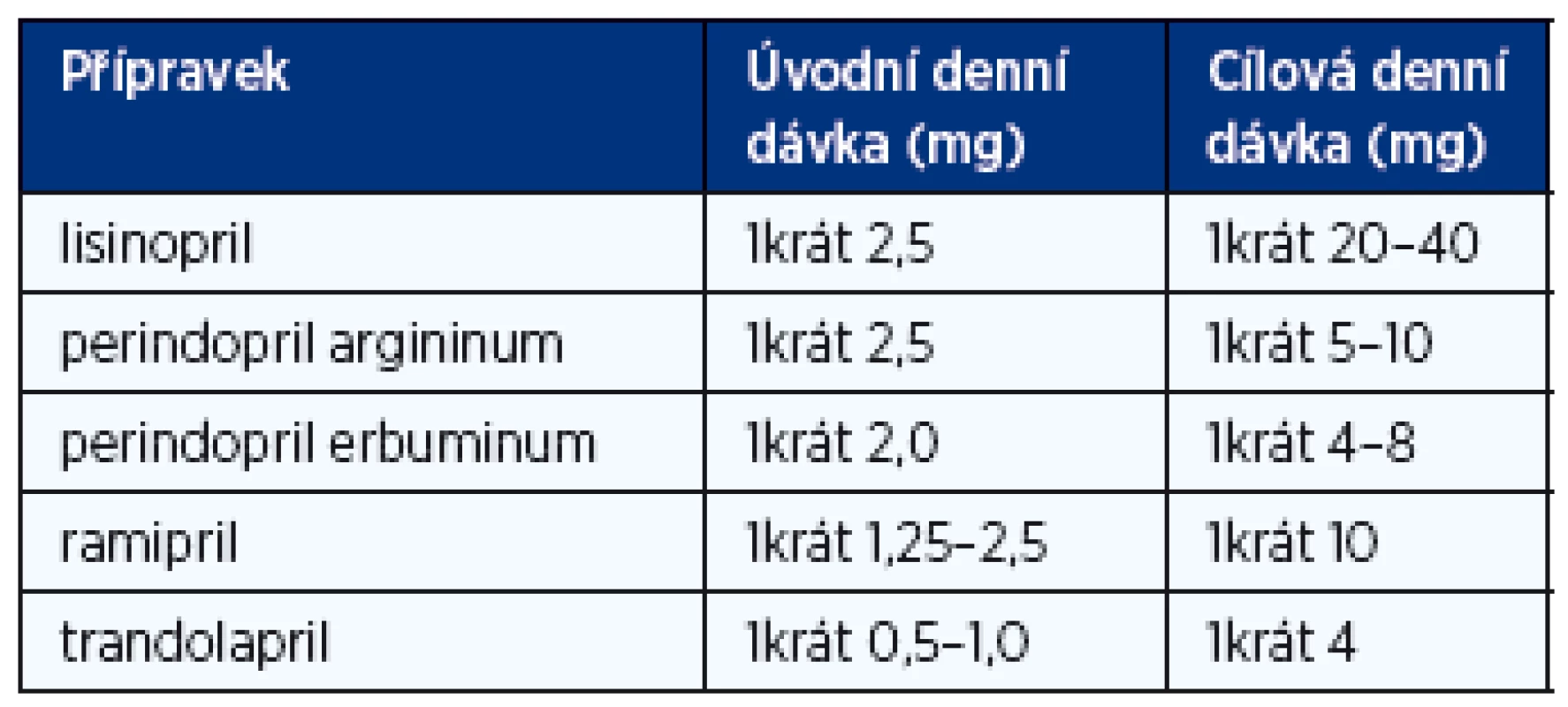
Inhibitory ACE jsou u nemocných s CHSS na podkladě systolické dysfunkce a u nemocných s asymptomatickou systolickou dysfunkcí levé komory léky první volby. Měly by být podávány v denních dávkách vyzkoušených v klinických studiích (tab. 3), resp. v maximální dávce, kterou nemocný toleruje. Léčba se zahajuje nízkou dávkou a titruje se po 3–5 dnech za kontrol iontogramu a renální funkce. Inhibitory ACE u symptomatických nemocných prodlužují přežívání, snižují počet nutných hospitalizací, zlepšují kvalitu života a zlepšují toleranci zátěže. U nemocných s asymptomatickou systolickou dysfunkcí zabraňují nebo oddalují vznik srdečního selhání, snižují riziko infarktu myokardu a náhlé srdeční smrti. Relativně častým nežádoucím účinkem je suchý dráždivý kašel, který se objevuje u přibližně 5 % nemocných. Inhibitory ACE jsou absolutně kontraindikovány pouze při bilaterální stenóze renálních tepen a anamnéze angioedému při předchozí léčbě.
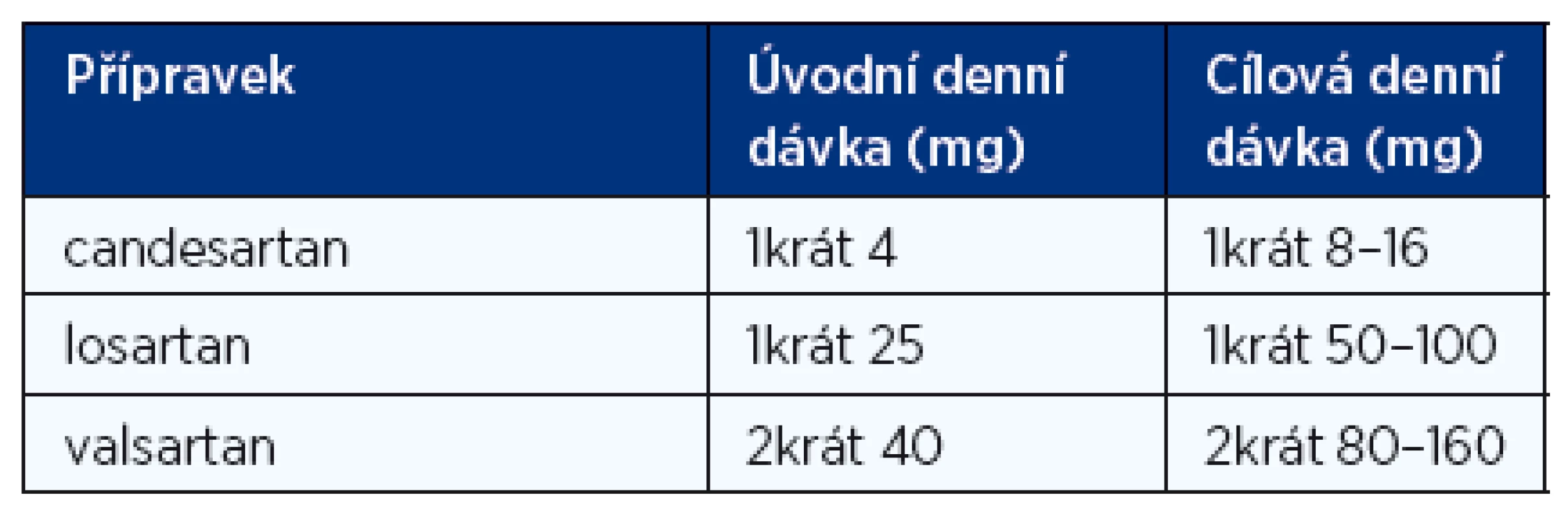
Blokátory receptorů AT1 pro angiotenzin II (tzv. sartany) mají u nemocných s CHSS na podkladě systolické dysfunkce levé komory podobný účinek na mortalitu a morbiditu jako inhibitory ACE. Indikace pro antagonisty receptorů pro angiotenzin II jsou shodné s indikacemi pro inhibitory ACE. Kombinace obou léků blokujících systém renin-angiotenzin-aldosteron proti monoterapii inhibitorem ACE snižuje počet hospitalizací pro srdeční selhání, ale neovlivňuje ani mortalitu ani výskyt infarktů myokardu a cévních mozkových příhod. Sartany proto zůstávají hlavně alternativou pro nemocné, kteří mají kontraindikace nebo netolerují inhibitory ACE, nejčastěji pro suchý dráždivý kašel. Jejich obvyklé dávkování je uvedeno v tabulce 4.
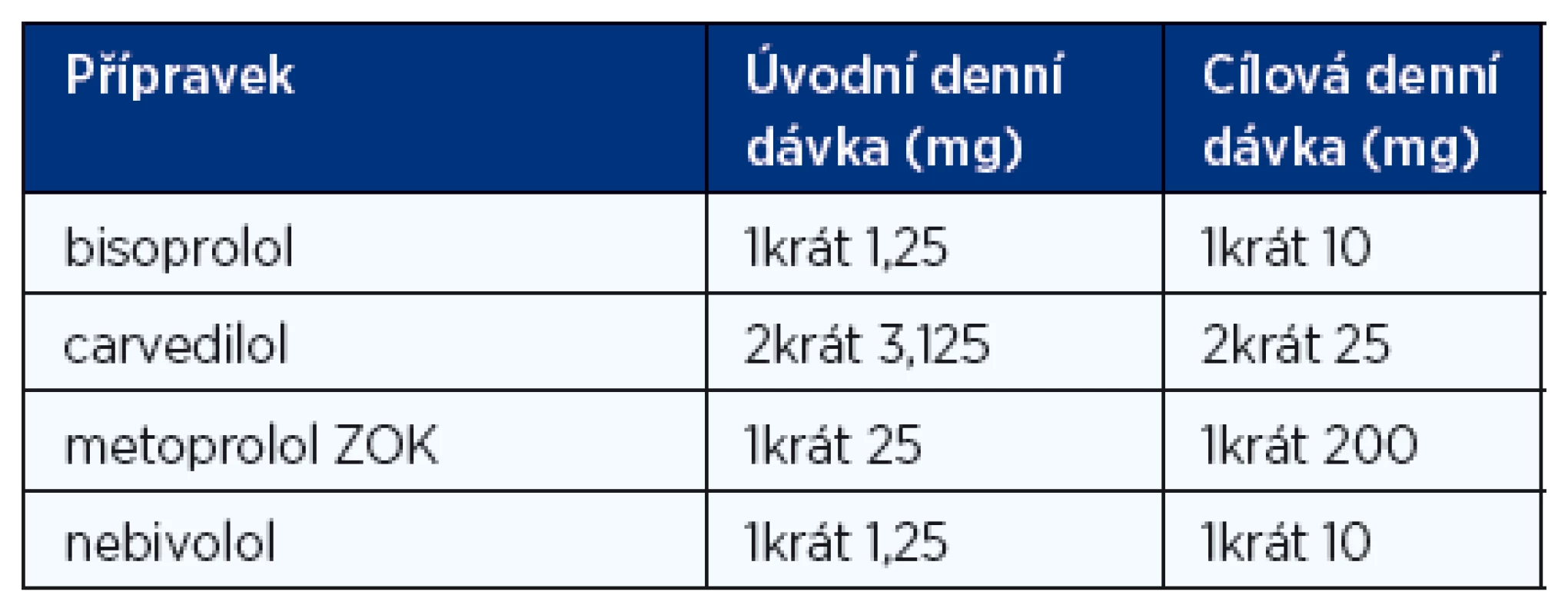
Betablokátory jsou podobně jako inhibitory ACE léky první volby u nemocných s CHSS na podkladě systolické dysfunkce a u nemocných s asymptomatickou systolickou dysfunkcí levé komory po prodělaném infarktu myokardu. Stávající praxe, kdy se betablokátor začíná titrovat u nemocného, který již užívá inhibitor ACE, vznikla historicky. Klinické studie, které prokázaly prospěšnost inhibitorů ACE, totiž byly provedeny o 10 let dříve než klinické studie s betablokátory. Proto byly betablokátory zkoušeny až na pozadí léčby inhibitory ACE. Betablokátory snižují mortalitu, zejména riziko náhlé smrti, prodlužují přežívání nemocných, snižují nutnost hospitalizací, zlepšují funkční třídu NYHA. To vše bez ohledu na věk, rasu, pohlaví nebo hodnotu ejekční frakce. Většina klinických studií s betablokátory v léčbě systolického CHSS byla ukončena předčasně pro jejich přesvědčivý a výrazný účinek na mortalitu, kterou snižují přibližně o jednu třetinu. Zdá se však, že účinek betablokátorů u CHSS není skupinový, proto jsou doporučeny pouze ty přípravky, u kterých byl jejich prospěšný účinek prokázán v klinických studiích. Jsou to bisoprolol, metoprolol sukcinát v úpravě ZOK, karvedilol a nebivolol. Léčba musí být zahájena velmi nízkou denní dávkou, která je pak opatrně titrována až do dávky cílové (tab. 5) nebo alespoň nejvyšší tolerované. Jinak hrozí hemodynamické zhoršení nemocného. Titrace obvykle probíhá tak, že se dávka betablokátoru zdvojnásobuje po 2 týdnech. Toto schéma ale musí být individuálně modifikováno podle klinické reakce nemocného.
Blokátory mineralokortikoidních receptorů (MR) jsou indikovány u všech nemocných se srdečním selháním s nízkou ejekční frakcí, kteří zůstávají symptomatičtí (funkční třída NYHA II–IV) i při léčbě diuretiky, inhibitory ACE/sartany a betablokátory. Do této skupiny v současnosti patří dva přípravky: starší a neselektivní spironolakton a novější a selektivní eplerenon. Oba se podávají jednou denně v dávce 25–50 mg. Spironolakton u přibližně 10 % mužů vede k nežádoucím účinkům, jako jsou gynekomastie, mastodynie a impotence, které jsou způsobeny neselektivní blokádou receptorů pro steroidní pohlavní hormony. Specifický blokátor eplerenon tyto nežádoucí účinky nemá. Je však v současnosti preskripčně omezen pouze na specialisty a zůstává indikačně omezen pouze pro nemocné, kteří spironolakton netolerují. Podávání blokátorů MR snižuje u nemocných s CHSS významně mortalitu. Obvyklými nežádoucími účinky jsou u obou přípravků hyperkalemie a zhoršení renálních funkcí, proto je potřeba obojí monitorovat a při zhoršení snížit denní dávku, případně lék úplně vysadit. Kalemie > 5,0 mmol/l je kontraindikací jejich nasazení. Obvyklé dávkování je uvedeno v tabulce 6.

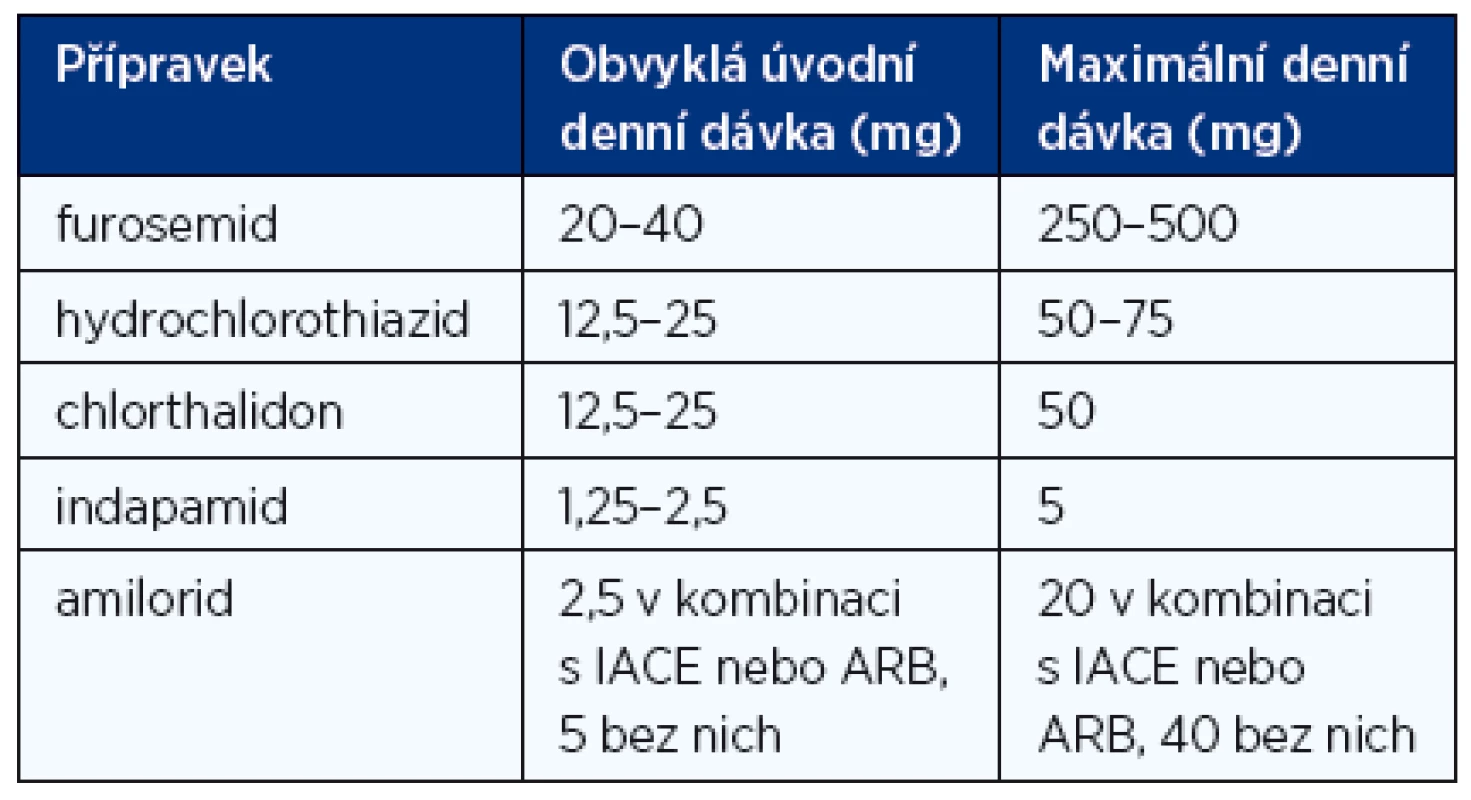
Diuretika jsou nezbytná u nemocných se známkami retence tekutin, ať již se manifestuje jako plicní venostáza nebo periferní otoky. Měla by být používána vždy v kombinaci s inhibitory ACE/sartany a betablokátory, pokud jsou tyto léky tolerovány. Podání diuretik má obvykle za následek rychlou a výraznou úlevu od dušnosti, zlepšení tolerance zátěže a ústup periferních otoků. Diuretika sice účinně snižují nebo odstraňují symptomy, zlepšují kvalitu života a snižují četnost hospitalizací, ale neovlivňují příznivě mortalitu. Při mírnějším CHSS stačí thiazidová diuretika, při těžším CHSS se používají diuretika kličková (u nás prakticky jenom furosemid) nebo kombinace kličkového a thiazidového diuretika. U nemocných s těžším renálním selháním (clearance kreatininu < 30 ml/min) ztrácejí thiazidová diuretika účinnost, proto u těchto nemocných musí být podáván furosemid. Kalium šetřící diuretika (s výjimkou spironolaktonu) jsou indikována jen u nemocných, kteří i při léčbě inhibitorem ACE nebo sartanem mají dokumentovanou tendenci k hypokalemii. Obvyklé dávkování diuretik při CHSS je uvedeno v tabulce 7.
Ivabradin je prvním klinicky využívaným zástupcem nové třídy bradykardizujících léků, tzv. bradinů. Tyto léky blokují kanály If v pacemakerových buňkách sinusového uzlu, čímž vedou k bradykardii, aniž mají jiné hemodynamické nebo elektrofyziologické účinky. Klinickými studiemi je přesvědčivě doloženo, že zpomalení zvýšené srdeční frekvence je u nemocných s CHSS prognosticky výhodné, především snižuje počet rehospitalizací. Ivabradin je indikován u nemocných, kteří jsou adekvátně léčeni léky popsanými výše, zůstávají však i nadále symptomatičtí, přitom mají sinusový rytmus a klidovou srdeční frekvenci ≥ 70/min. U nás je v současnosti ivabradin preskripčně omezen na odborné lékaře (internisty a kardiology) a v indikačním omezení je kvalifikující srdeční frekvence zvýšena na ≥ 75/min.
Digoxin je indikovaný u nemocných s CHSS a fibrilaci síní s rychlou komorovou odpovědí. Zpomaluje komorovou frekvenci, což vede ke zlepšení systolické i diastolické funkce komory a zmírnění symptomů. Kombinace digoxinu a betablokátoru je u nemocných s CHSS a fibrilací síní s rychlou odpovědí komor účinnější než monoterapie kterýmkoliv z těchto dvou léků. U nemocných se sinusovým rytmem je role digoxinu rozporuplná. Může být vyzkoušen u nemocných, kteří mají systolickou dysfunkci levé komory a jsou symptomatičtí i při výše popsané standardní léčbě. Digoxin neovlivňuje mortalitu nemocných s CHSS, ale může snížit potřebu hospitalizací, zejména pro zhoršení srdečního selhání. Kontraindikacemi digoxinu jsou bradykardie, síňokomorové blokády 2. až 3. stupně, syndrom nemocného sinusového uzlu, Wolffův-Parkinsonův-Whiteův syndrom, hypertrofická obstrukční kardiomyopatie, hypokalemie a hyperkalemie. Doporučená perorální denní dávka se pohybuje v rozmezí 0,125–0,25 mg denně, U starších nemocných volíme dávku ještě nižší, obvykle 0,0625–0,125 mg denně. Digoxin se vylučuje téměř úplně ledvinami, při renální insuficienci je proto nutné denní dávku příslušně redukovat.
Antiagregační léčba kyselinou acetylsalicylovou je u CHSS sporná pro možnou interakci s inhibitory ACE. V klinické praxi se obvykle podává u nemocných s CHSS ischemické etiologie, stejně jako v sekundární prevenci u nemocných s jinými klinickými manifestacemi ICHS.
Antikoagulační léčba warfarinem je indikována u nemocných s CHSS a fibrilací síní, anamnézou systémové nebo plicní embolizace, prokázaným intrakardiálním trombem, po rozsáhlém Q-IM přední stěny s poinfarktovou výdutí, výraznou dilatací levé komory neischemické etiologie při současném výskytu dalších rizikových faktorů trombózy (např. trombogenní mutace, spontánní echokontrast a další).
Farmakologická léčba CHSS se zachovanou ejekční frakcí (diastolického srdečního selhání) je více méně empirická. Prozatím nebylo přesvědčivě prokázáno, že by nějaká léčba snižovala u HFPEF morbiditu nebo mortalitu. Diuretika se používají ke kontrole retence sodíku a vody, úlevě od dušnosti a vyplavení otoků stejně jako u HFREF. Adekvátní léčba hypertenze a ischemie myokardu jsou považovány za důležitá léčebná opatření, stejně jako kontrola komorové frekvence při fibrilaci síní. V těch několika mortalitně-morbiditních klinických studií, které byly doposud provedeny, nebyl prokázán žádný prospěch z testované léčby (candesartan, perindopril, irbesartan, spironolacton).
Chirurgická léčba
Chirurgická léčba je indikována tehdy, je-li CHSS důsledkem korigovatelné poruchy srdečních struktur. O indikaci chirurgických léčebných postupů obvykle rozhoduje kardiolog a předchází jí řada specializovaných vyšetření. Proto zde jenom stručně vyjmenujeme nejčastější léčebné postupy, které přicházejí v úvahu. Zájemce o podrobnější informace odkazujeme na podrobnější Doporučený postup Evropské i České kardiologické společnosti (1, 2).
Nejčastějším chirurgickým léčebným postupem je revaskularizace myokardu (implantace aortokoronárních bypasů). Aby byla revaskularizace úspěšná, musí být předem prokázáno, že bude revaskularizován viabilní myokard. Dále přicházejí v úvahu aneuryzmektomie symptomatické poinfarktové výdutě, plastika mitrální chlopně při významné mitrální insuficienci způsobené dilatací levé komory a náhrada aortální chlopně u aortální stenózy.
Ortotopická transplantace srdce (OTS) je dnes zavedenou klinickou metodou pro léčení nemocných v terminálním stadiu srdečního selhání, u nichž již byly vyčerpány všechny ostatní léčebné možnosti. V České republice se transplantace provádějí na dvou pracovištích – v IKEM Praha a CKTCH v Brně. Provedená OTS výrazně zlepšuje kvalitu života nemocných i jejich prognózu. Operační úmrtnost je kolem 10 %, 1 rok přežívá 80 % a 5 let 70 % nemocných. Transplantační program je omezen především nabídkou dárců, a proto je tato metoda řešením pouze pro malou část nemocných s velmi pokročilým CHSS. V posledních letech se počet srdečních transplantací v České republice ustálil kolem 60 nemocných/rok. Jako „most k transplantaci“ lze u jednotlivých nemocných použít na specializovaných pracovištích různé mechanické srdeční podpory.
Přístrojová léčba
Přístrojová léčba CHSS je vysoce specializovaná, dokonce i uvnitř oboru kardiologie, na specialisty v elektrofyziologii a na vysoce specializované elektrofyziologické laboratoře. Proto zde opět pouze stručná informace a případné zájemce odkazujeme na Doporučení Evropské i České kardiologické společnosti (1, 2).
Srdeční resynchronizační léčba (biventrikulární stimulace) se provádí u nemocných s CHSS a nízkou ejekční frakcí (EF < 0,35), kteří mají široký komplex QRS na EKG křivce (QRS ≥ 150 ms) s morfologií BLRT, eventuálně echokardiograficky prokázanou dyssynchronií kontrakce myokardu obou srdečních komor, a kteří jsou adekvátně léčeni farmakologicky. Správně indikovaným nemocným přináší tato léčba výraznou symptomatickou úlevu a také jim významně prodlužuje život.
Implantace kardioverteru/defibrilátoru (ICD) se provádí u nemocných s vysokým rizikem náhlé srdeční smrti, např. u těch, kteří již byli úspěšné recuscitováni z oběhové zástavy způsobené fibrilací komor nebo setrvalou komorovou tachykardií (tzv. sekundární prevence). O implantaci ICD jako primární prevenci náhlé arytmické srdeční smrti rozhoduje kardiolog na základě odhadu rizika. U některých nemocných se biventrikulární stimulace a ICD kombinuje.
Seznam použitých zkratek
ACE angiotenzin-konvertující enzym
ARB blokátor receptorů AT1 pro angiotenzin II
BNP natriuretický peptid typu B
EF ejekční frakce
EKG elektrokardiogram
HFPEF srdeční selhání se zachovanou ejekční frakcí
(heart failure with preserved ejection fraction)
HFREF srdeční selhání se sníženou ejekční frakcí
(heart failure with reduced ejection fraction)
CHSS chronické srdeční selhání
ICD implantace kardioverteru/defibrilátoru
ICHS ischemická choroba srdeční
IM infarkt myokardu
KTI kardiotorakální index
MR mineralokortikoidní receptor
NT-proBNP aminoterminální konec prohormonu BNP
OTS ortotopická transplantace srdce
RTG rentgenogram
ADRESA PRO KORESPONDENCI:
prof. MUDr. Jaromír Hradec, CSc., FESC
III. interní klinika 1. LF UK a VFN
U Nemocnice 1, 128 08 Praha 2
e-mail: jhradec@vfn.cz
Sources
1. McMurray JV, Adamopoulos S, Anker S, et al. ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure 2012. The Task Force for the Diagnosis and Treatment of Acute and Chronic Heart Failure 2012 of the European Society of Cardiology. Developed in collaboration with the Heart Failure Association (HFA) of the ESC. Eur Heart J 2012; 33 : 1787–1847.
2. Hradec J, Vítovec J, Špinar J. Souhrn Doporučených postupů ESC pro diagnostiku a léčbu akutního a chronického srdečního selhání – 2012. Připraven Českou kardiologickou společností. Cor Vasa 2013; 55 : 33–48; event. Cor et Vasa 2013; 55: e25–e40.
3. Gregorová Z, Meluzín J, Špinarová L. Co je nového v srdečním selhání se zachovalou ejekční frakcí levé komory za posledních 5 let? Vnitř Lék 2014; 60 : 586–594.
4. Hradec J. Diagnóza psaná klínovým písmem – editorial. Vnitř Lék 2014; 60 : 553–554.
5. Owan TE, Hodge DO, Herges RM, et al. Trends in prevalence and outcomes of heart failure with preserved ejection fraction. N Engl J Med 2006; 355 : 251–259.
6. Komajda M, Lam CSP. Heart failure with preserved ejection fraction: a Clinical dilemma. Eur Heart J 2014; 35 : 1022–1032.
7. McDonagh TA, Morrison CE, Lawrence A, et al. Symptomatic and asymptomatic left-ventricular systolic dysfunction in an urban population. Lancet 1997; 350 : 829–833.
8. Cleland CHF, Tendera M, Adamus J, et al. The perindopril in elderly people with chronic heart failure (PEP-CHF) study. Eur Heart J 2006; 27 : 2338–2345.
9. Yusuf S, Pfeffer MA, Svedberg K, et al. Effects of candesartan in patients with chronic heart failure and preserved left/ventricular ejection fraction: the CHARM – Preserved trial. Lancet 2003; 362 : 777–781.
10. Massie BM, Carson PE, McMurray JJ, et al. Irbesartan in patients with heart failure and preserved ejection fraction. N Engl J Med 2008; 359 : 2456–2467.
11. Edelmann F, Wachter R, Schmidt AG, et al. Effect of spironolactone on diastolic function and exercise capacity in patients with heart failure with preserved ejection fraction: the Aldo-DHF randomized controlled trial. JAMA 2013; 309 : 781–791.
12. Pitt B, Pfeffer MA, Assmann SF, et al. Spironolactone for heart failure with preserved ejection fraction. N Engl J Med 2014; 370 : 1383–1392.
13. Krupička J, Janota T, Hradec J. Natriuretické peptidy u srdečního selhání. Cor Vasa 2013; 55 : 470–476.
Labels
Addictology Allergology and clinical immunology Angiology Audiology Clinical biochemistry Dermatology & STDs Paediatric gastroenterology Paediatric surgery Paediatric cardiology Paediatric neurology Paediatric ENT Paediatric psychiatry Paediatric rheumatology Diabetology Pharmacy Vascular surgery Pain management Dental HygienistArticle was published in
Journal of Czech Physicians

- Advances in the Treatment of Myasthenia Gravis on the Horizon
- Possibilities of Using Metamizole in the Treatment of Acute Primary Headaches
- Metamizole vs. Tramadol in Postoperative Analgesia
- Spasmolytic Effect of Metamizole
- Metamizole at a Glance and in Practice – Effective Non-Opioid Analgesic for All Ages
-
All articles in this issue
- Chronic heart failure
- GEORGE DAVIS SNELL
- Study PARADIGM-HF – a paradigm shift in the treatment of chronic heart failure
- Non-cardiogenic pulmonary edema, acute respiratory distress syndrome
- Mountain sickness
- Analysis of the relationship of heavy/light chain pairs of immunoglobulin (Hevylite™) to the results of gel electrophoresis and nefelometric examination of serum proteins at the time of multiple myeloma diagnosis
- Medical Consequences of Chernobyl with Focus on the Endocrine System – Part 2
- Journal of Czech Physicians
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Mountain sickness
- Non-cardiogenic pulmonary edema, acute respiratory distress syndrome
- Chronic heart failure
- Analysis of the relationship of heavy/light chain pairs of immunoglobulin (Hevylite™) to the results of gel electrophoresis and nefelometric examination of serum proteins at the time of multiple myeloma diagnosis
